SCOPODERM depotplåster 1 mg/72 h
Kvalitativ och kvantitativ sammansättning
Ett Scopoderm 1 mg/72 tim depotplåster innehåller 1,3 mg skopolamin i ett plåster med storleken 2,5 cm2. Ett plåster frisätter cirka 1 mg skopolamin under 72 timmar.
Hyoscin är namnet på den aktiva substansen i Europafarmakopén (Ph.Eur.).
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Depotplåster.
Kliniska uppgifter
Terapeutiska indikationer
Profylaktisk behandling av symtom på åksjuka och sjösjuka, såsom rotatorisk yrsel, illamående och kräkningar.
Dosering och administreringssätt
Dosering
För att få en optimal preventiv effekt ska ett Scopoderm depotplåster appliceras ca 5–6 timmar före resans början (eller kvällen före resan) på en ren, torr, hårfri hudyta bakom örat (se ”Bruksanvisning”). Ett Scopoderm depotplåster räcker för att ge profylax mot åksjuka i 72 timmar. Om plåstret behövs under en kortare tidsperiod så ska det avlägsnas vid slutet av resan. Om profylaktisk behandling behövs under en längre tid ska depotplåstret avlägsnas 72 timmar efter appliceringen och ett nytt plåster appliceras bakom det andra örat.
Pediatrisk population
Scopoderm depotplåster kan användas av barn i åldern 10 år eller äldre. Säkerhet och effekt för preparatet hos barn yngre än 10 år har inte fastställts.
Äldre
Scopoderm depotplåster kan användas av äldre (se rekommendationer för vuxna), men de kan dock ha en större risk för biverkningar av skopolamin än övriga åldersgrupper (se avsnitt Varningar och försiktighet).
Patienter med nedsatt lever- eller njurfunktion
Scopoderm depotplåster ska användas med försiktighet hos patienter med nedsatt lever- eller njurfunktion (se avsnitt Varningar och försiktighet)
Administreringssätt
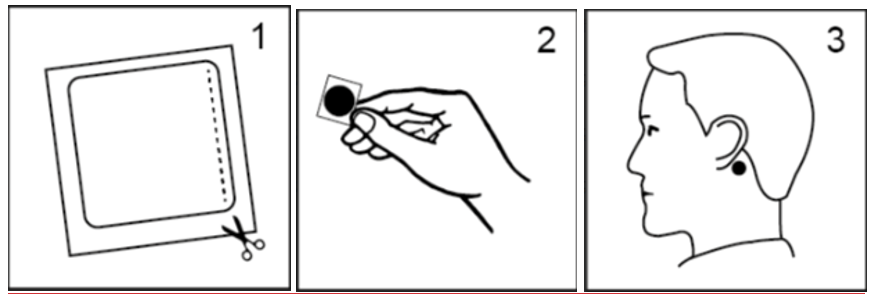
Bruksanvisning
- Klipp längs den prickade linjen och ta ut det gulbruna plåstret som är täckt av en transparent, fyrkantig skyddsfilm (figur 1).
- Håll i kanten av plåstret och ta bort den fyrkantiga skyddsfilmen. Försök låta bli att röra den silverfärgade självhäftande ytan (figur 2).
- Tryck fast plåstret (den silverfärgade självhäftande sidan nedåt) på en ren, torr och hårfri hudyta bakom örat (figur 3).
Undvik att röra vid plåstret efter att det har applicerats på huden, eftersom den aktiva substansen kan sippra ut vid kanten om plåstret utsätts för tryck.
För att förhindra att spår av aktiv substans kommer in i ögonen – vilket kan leda till tillfällig, lindrig dimsyn och dilatation av pupillerna (ibland bara i ena ögat) – ska händerna alltid tvättas efter kontakt med plåstret.
Även appliceringsstället ska tvättas efter att plåstret har avlägsnats.
Scopoderm depotplåster fäster normalt bra på huden. Om plåstret ändå lossnar ska det ersättas med ett nytt. Scopoderm depotplåster kan behållas på under bad och dusch.
Använda plåster ska vikas ihop och kasseras så att barn inte kommer åt dem.
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen. Glaukom.
Varningar och försiktighet
Scopoderm depotplåster ska användas med särskild försiktighet av patienter med pylorusstenos eller med ett hämmat urinflöde, t.ex. vid prostatasjukdomar, liksom av patienter med tarmobstruktion.
Försiktighet ska iakttas även när behandling ges till äldre patienter samt till patienter med metaboliska rubbningar eller nedsatt lever- eller njurfunktion.
Patienter som tidigare uppvisat ett förhöjt intraokulärt tryck (trycksmärta, dimsyn, halo glaucomatosus) ska inte använda Scopoderm depotplåster förrän de genomgått en oftalmologisk undersökning.
I sällsynta fall kan förvirringstillstånd och/eller synhallucinationer förekomma. I sådana fall ska Scopoderm depotplåster genast avlägsnas. Om symtomen trots detta kvarstår i en svår form ska nödvändiga behandlingsåtgärder vidtas, t.ex. långsam intravenös administrering av 1–4 mg (barn 0,5 mg) fysostigmin. Detta kan upprepas vid behov.
I enstaka fall har en ökning i anfallsfrekvensen hos patienter med epilepsi rapporterats.
Idiosynkratiska reaktioner kan förekomma vid vanliga terapeutiska doser av skopolamin.
Försiktighet ska iakttas efter att plåstret avlägsnats, eftersom biverkningar kan kvarstå i över 24 timmar efter att det avlägsnats.
Eftersom plåstret innehåller aluminium ska det avlägsnas innan medicinska bilddiagnostiska undersökningar genomförs.
Händerna ska tvättas noga efter kontakt med Scopoderm depotplåster. Även hudområdet där plåstret har suttit ska tvättas noga efter att plåstret avlägsnats.
Använd aldrig mer än ett depotplåster i taget.
Interaktioner
Skopolamin ska ges med försiktighet till patienter som använder läkemedel som påverkar det centrala nervsystemet. Detta gäller särskilt patienter som får behandling med antikolinerga läkemedel, t.ex. andra belladonnaalkaloider, antihistaminer, tricykliska antidepressiva (såsom amitriptylin eller imipramin), amantadin eller kinidin.
Det rekommenderas att intag av alkohol undviks under användningen av Scopoderm depotplåster.
Fertilitet, graviditet och amning
Graviditet
Det finns inga kontrollerade studier om eventuella effekter av skopolamin under graviditet eller amning. Prekliniska studier på möss och råttor har inte visat på reproduktions- eller utvecklingsstörningar vid doser som är jämförbara med rekommenderad klinisk dos (se avsnitt Prekliniska säkerhetsuppgifter). Den aktiva substansen, skopolamin, passerar enkelt placenta. Gravida kvinnor ska kontakta läkare innan de använder detta läkemedel.
Amning
Eftersom skopolamin utsöndras i bröstmjölk, om än bara i mycket små mängder, ska försiktighet iakttas när Scopoderm depotplåster ges till ammande kvinnor. Ammande kvinnor ska kontakta läkare innan de använder detta läkemedel.
Fertilitet
I fertilitetsstudier där honråttor gavs dagliga, subkutana injektioner med skopolaminhydrobromid uppkom ingen försämring av fertiliteten eller några fosterskador. Honornas kroppsvikt minskade i gruppen som fått den högsta dosen (plasmakoncentrationen var cirka 500 gånger högre än den koncentration som uppnås hos människa vid användning av skopolamindepotplåster).
Effekter på förmågan att framföra fordon och använda maskiner
Scopoderm depotplåster kan orsaka somnolens eller synrubbningar och i sällsynta fall också andra biverkningar med ursprung i centrala nervsystemet (se avsnitt Biverkningar), vilket kan inverka negativt på patientens reaktionsförmåga. Patienterna ska därför varnas för denna risk och uppmanas att iaktta försiktighet i samband med aktiviteter som kräver skärpt uppmärksamhet, såsom att köra bil eller använda maskiner.
Biverkningar
Biverkningarna av Scopoderm beror i huvudsak på de antikolinerga effekterna av skopolamin.
Biverkningarna har grupperats efter organklass och frekvens enligt följande konvention:
mycket vanliga (≥ 1/10), vanliga (≥ 1/100, < 1/10), mindre vanliga (≥ 1/1 000, < 1/100), sällsynta (≥ 1/10 000, < 1/1 000), mycket sällsynta (< 1/10 000), ingen känd frekvens (kan inte beräknas från tillgängliga data). Inom respektive frekvensgrupp presenteras biverkningarna efter fallande allvarlighetsgrad.
Tabell 1 Förteckning över biverkningar
| Organsystem | Biverkning | Frekvens |
| Psykiska störningar | Desorientering, förvirring och hallucinationer | Sällsynta |
| Centrala och perifera nervsystemet | Somnolens, yrsel | Mycket vanliga |
| Minnesstörningar, försämrad koncentrationsförmåga, rastlöshet | Sällsynta | |
| Agitation, koordinationsavvikelser, huvudvärk | Ingen känd frekvens | |
| Ögon | Ackommodationsstörningar (cykloplegi), däribland dimsyn, myopi och mydriasis (ibland ensidiga) | Mycket vanliga |
| Irritation i ögonlocken | Vanliga | |
| Trångvinkelglaukom | Mycket sällsynta | |
| Magtarmkanalen | Muntorrhet | Mycket vanliga |
| Hud och subkutan vävnad | Hudirritation | Vanliga |
| Generaliserade utslag | Mycket sällsynta | |
| Reaktioner vid appliceringsstället, däribland utslag, pruritus, erytem och brännande känsla | Ingen känd frekvens | |
| Njurar och urinvägar | Urinretention | Sällsynta |
Biverkningar relaterade till utsättning av behandling med Scopoderm depotplåster
Efter utsättning av behandlingen – oftast efter flera dagars användning – har bl.a. yrsel, illamående, kräkningar, huvudvärk och balansrubbningar rapporterats i sällsynta fall.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till:
webbsida: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
De centrala effekterna av skopolamin i höga doser liknar effekterna av atropin. De börjar med rastlöshet, excitationstillstånd och förvirring. Vid högre doser uppkommer plötsliga förvirringstillstånd (delirium), hallucinationer och kramper. Mycket höga doser orsakar koma och andningsförlamning.
Behandling
Ta bort alla plåster omedelbart, eftersom vissa överdoseringssymtom kan kvarstå i upp till 24 timmar eller längre även efter att plåstret har avlägsnats.
Det mest effektiva antidotet är fysostigmin som, beroende på symtomens svårighetsgrad, injiceras långsamt intravenöst i doser om 1–4 mg för vuxna (0,5 mg för barn). Eftersom fysostigmin metaboliseras snabbt kan patienten falla in i koma igen inom 1–2 timmar, vilket kräver en ny injektion av fysostigmin. Diazepam i ganska små doser kan vara till nytta vid excitationstillstånd och kramper. Högre doser ska undvikas, eftersom andningsdepressionen kan förstärkas. I svåra fall kan konstgjord andning behövas. I händelse av hypertermi ska omedelbara åtgärder vidtas för att avleda värme (kalla bad).
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: antiemetika, ATC‑kod: A04AD01
Verkningsmekanism
Skopolamins förmåga att förebygga illamående och kräkningar på grund av åksjuka och sjösjuka kan vara relaterad till hämningen av den kolinerga impulsöverledningen från den vestibulära kärnan till högre centra i centrala nervsystemet, samt från den retikulära formationen till kräkcentrum.
Farmakodynamisk effekt
Den aktiva substansen i Scopoderm depotplåster är en naturligt förekommande belladonnaalkaloid, skopolamin, vars farmakologiska effekter är väl kända. Som ett parasympatolytikum hämmar skopolamin kompetitivt aktiviteten av acetylkolin (och andra direktverkande parasympatomimetika) vid de muskarina receptorerna. Dess effekt kan avbrytas med höga doser av parasympatomimetika. Effekten av skopolamin beror på målorganens känslighet och dosens storlek. Vid terapeutiska doser försvagar skopolamin den motoriska funktionen, orsakar somnolens, hämmar salivering och svettning samt vidgar pupillerna.
Farmakokinetiska egenskaper
Absorption
Jämvikt mellan mängden absorberad och eliminerad aktiv substans uppnås cirka 6 timmar efter applicering av Scopoderm depotplåster. Plasmakoncentrationen av skopolamin vid steady state efter absorption genom huden från depotplåstret är 0,17–0,33 nmol/liter. Jämvikten kvarstår i 72 timmar, förutsatt att depotplåstret inte avlägsnas.
Distribution
Det finns begränsad mängd data om distributionen av skopolamin, men läkemedlet distribueras väl och når centrala nervsystemet. Skopolamin verkar vara reversibelt bundet till plasmaproteiner.
Metabolism
Metabolismen av skopolamin är inte fullständigt klarlagd. Läkemedlet verkar metaboliseras i levern (genom glukuronid- eller sulfatkonjugering).
Eliminering
Efter att depotplåstret har avlägsnats minskar mängden aktiv substans i kroppen långsamt till ungefär 1/3 under de följande 24 timmarna, eftersom det skopolamin som fortfarande finns kvar i huden fortsätter att tas upp i blodomloppet. Skopolamin utsöndras i urinen. Efter användning av ett skopolamindepotplåster är mängden fritt skopolamin som utsöndras med urinen cirka 0,7 mikrog/timme, och den totala mängden skopolamin (i fri respektive konjugerad form) som utsöndras är cirka 3,8 mikrog/timme. Mindre än 10 % av den totala mängden utsöndras i urinen som oförändrat läkemedel och som metaboliter under 108 timmar. Efter en engångsapplicering av två plåster var halveringstiden för läkemedlet (fritt skopolamin) 9,5 timmar.
Prekliniska säkerhetsuppgifter
Gängse studier avseende allmäntoxicitet, hudirritation, gentoxicitet, karcinogenicitet och reproduktionseffekter visade inte några särskilda risker för människa. En marginell embryotoxisk effekt observerades hos kaniner efter daglig intravenös administrering av skopolaminhydrobromid, när dosen var cirka hundra gånger högre än de dosnivåer som uppnåtts med depotplåster. Inga biverkningar noterades hos råttor efter intravenös administrering i studier av reproduktionstoxikologiska effekter.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Plåstrets utsida
Aluminiserad polyesterfilm
Läkemedelsreservoar och självhäftande yta
Krospovidon
Isopropylpalmitat
Lättflytande paraffin
Polyisobuten
Membran som reglerar absorptionshastigheten
Etylenvinylacetatsampolymer
Skyddsfilm på den självhäftande ytan
Polyester
Inkompatibiliteter
Ej relevant.
Hållbarhet
3 år.
Särskilda förvaringsanvisningar
Förvaras vid högst 25 °C.
Plåstrets skyddsfilm ska inte tas bort förrän plåstret ska appliceras.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
SCOPODERM depotlaastari
1 mg/72 h (L:ei) 5 kpl (48,59 €)
PF-selosteen tieto
Plåstren är förpackade i en platt, förseglad foliefodrad påse. Ytterförpackningen består av en kartong och innehåller instruktioner.
Påsmaterialet är laminat av PET, lågdensitetspolyetylen, belagd aluminiumfolie och torkmedelsfilm.
Läkemedlets utseende:
Platt, runt reservoarplåster med en diameter på 1,8 cm. Ena sidan av plåstret är gulbrunt; den andra sidan är silverfärgad och täckt av en större, fyrkantig, transparent skyddsfilm.
Särskilda anvisningar för destruktion och övrig hantering
Depotplåstren ska vikas på mitten (klibbiga sidan inåt) innan de kasseras. Använda plåster ska vikas ihop och kasseras så att barn inte kommer åt dem. Plåstret får inte klippas.
Händerna ska tvättas noga efter kontakt med depotplåstren. Även hudområdet där plåstret har suttit ska tvättas efter att plåstret avlägsnats. Dessa försiktighetsåtgärder är nödvändiga för att minimera risken för att skopolamin kommer in i ögonen (se avsnitt Biverkningar).
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Ersättning
SCOPODERM depotlaastari
1 mg/72 h 5 kpl
- Ei korvausta.
Atc-kod
A04AD01
Datum för översyn av produktresumén
07.04.2025
Yhteystiedot
Karhumäentie 3
01530 Vantaa
09 862 1111
