MIDIANA tabletti, kalvopäällysteinen 0,03/3 mg
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Potilas
Kysymyksiä ja vastauksia yhdistelmäehkäisyvalmisteista: Viimeisintä tietoa naisille
Terveydenhuollon ammattilainen
Tarkistuslista yhdistelmäehkäisyvalmisteiden määrääjille
Yhdistelmäehkäisyvalmisteet: Materiaalia naisen yksilöllisten veritulppariskitekijöiden arviointiin, keskustelun tueksi ja sopivimman valmisteen valitsemiseksi
Vaikuttavat aineet ja niiden määrät
Yksi tabletti sisältää 0,03 mg etinyyliestradiolia ja 3 mg drospirenonia.
Apuaineet, joiden vaikutus tunnetaan:
Yksi kalvopäällysteinen tabletti sisältää 48,17 mg laktoosimonohydraattia ja 0,070 mg soijalesitiiniä.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Tabletti, kalvopäällysteinen.
Kliiniset tiedot
Käyttöaiheet
Raskauden ehkäisy.
Midiana-valmisteen määräämistä koskevassa päätöksessä on otettava huomioon valmisteen käyttäjän nykyiset riskitekijät, erityisesti laskimotromboembolian (VTE) riskitekijät, ja millainen Midiana-valmisteen käytön VTE:n riski on verrattuna muiden yhdistelmäehkäisyvalmisteiden riskeihin (ks. kohdat Vasta-aiheet ja Varoitukset ja käyttöön liittyvät varotoimet).
Annostus ja antotapa
Antotapa: suun kautta
Annostus
Miten Midiana-tabletteja otetaan
Tabletit pitää ottaa joka päivä suunnilleen samaan aikaan, tarvittaessa pienen nestemäärän kera, läpipainopakkaukseen merkityssä järjestyksessä. Tabletteja otetaan yksi päivässä 21 peräkkäisen päivän ajan. Ennen uuden pakkauksen aloittamista pidetään 7 päivän tauko, jonka aikana tulee yleensä tyhjennysvuoto. Vuoto alkaa yleensä 2–3 päivän kuluttua viimeisen tabletin ottamisesta eikä välttämättä ole päättynyt ennen seuraavan pakkauksen aloittamista.
Midiana-tablettien käytön aloittaminen
- Ei edeltävää hormonaalista ehkäisyä (edeltäneen kuukauden aikana)
Tablettien ottaminen pitää aloittaa luonnollisen kuukautiskierron ensimmäisenä päivänä (eli ensimmäisenä vuotopäivänä).
- Vaihto toisesta hormonaalisesta yhdistelmäehkäisyvalmisteesta (ehkäisytabletit, -rengas tai ‑laastari)
Midiana-tablettien käyttö tulee aloittaa mieluiten seuraavana päivänä aiemman yhdistelmäehkäisytablettipakkauksen viimeisen vaikuttavia aineita sisältävän tabletin otosta, mutta viimeistään aiempien yhdistelmäehkäisytablettien tavanomaista tablettitaukoa tai lumetablettijaksoa seuraavana päivänä. Ehkäisyrenkaan tai -laastarin käytön jälkeen Midiana-tablettien käyttö tulee aloittaa mieluiten ehkäisyrenkaan tai -laastarin poistopäivänä, mutta viimeistään sinä päivänä, kun seuraava ehkäisyrengas tai -laastari pitäisi asettaa.
- Vaihto pelkkää progestiinia sisältävästä ehkäisyvalmisteesta (minipilleri, ehkäisyinjektio, ehkäisyimplantaatti) tai progestiinia vapauttavasta hormonikierukasta
Pelkkää progestiinia sisältävästä ehkäisytabletista voidaan siirtyä milloin tahansa (ehkäisyimplantaatista tai hormonikierukasta sen poistopäivänä, ehkäisyinjektiosta seuraavana injektiopäivänä), mutta kaikissa tapauksissa käyttäjää on neuvottava käyttämään lisäksi estemenetelmää ensimmäisten 7 tablettipäivän ajan.
- Ensimmäisellä raskauskolmanneksella tapahtuneen raskauden keskeytymisen jälkeen
Tablettien käyttö voidaan aloittaa heti, eikä lisäehkäisyä tarvita.
- Synnytyksen tai toisella raskauskolmanneksella tapahtuneen raskauden keskeytymisen jälkeen
Käyttäjää on kehotettava aloittamaan Midiana-tablettien käyttö 21–28 vuorokautta synnytyksen tai toisella raskauskolmanneksella tapahtuneen raskauden keskeytymisen jälkeen. Jos tablettien käyttö aloitetaan myöhemmin, käyttäjää tulee kehottaa käyttämään lisäksi jotain estemenetelmää ensimmäisten 7 päivän ajan. Jos nainen on jo ollut yhdynnässä, raskaus on suljettava pois ennen yhdistelmäehkäisytablettien käytön aloittamista, tai hänen on odotettava ensimmäisten kuukautisten alkamista.
Käyttö imetyksen aikana, ks. kohta Raskaus ja imetys.
Tablettien unohtaminen
Jos tabletin unohtamisesta on alle 12 tuntia, ehkäisyteho ei ole heikentynyt. Tabletti otetaan heti muistettaessa, ja muut tabletit otetaan tavanomaiseen aikaan.
Jos tabletin unohtamisesta on yli 12 tuntia, ehkäisyteho voi olla heikentynyt. Seuraavat kaksi perussääntöä pätevät tapauksissa, joissa tablettien ottaminen on unohtunut:
- Tablettien ottamista ei pidä koskaan keskeyttää yli 7 päivän ajaksi.
- Hypotalamus-aivolisäke-munasarja-akselin riittävä suppressio edellyttää tablettien ottamista yhtäjaksoisesti 7 päivän ajan.
Tämän perusteella voidaan antaa seuraavat käytännön ohjeet:
- Viikko 1
Viimeinen unohtunut tabletti pitää ottaa heti muistettaessa, vaikka tällöin olisikin otettava kaksi tablettia samalla kertaa. Seuraavat tabletit otetaan tavanomaiseen aikaan. Seuraavien 7 päivän ajan pitää lisäksi käyttää estemenetelmää (kuten kondomia). Jos nainen on ollut yhdynnässä edeltävien 7 päivän aikana, raskauden mahdollisuus on otettava huomioon. Raskauden mahdollisuus on sitä suurempi, mitä useampi tabletti on unohtunut ja mitä lähempänä tavanomaista tablettitaukoa tabletit ovat unohtuneet.
- Viikko 2
Viimeinen unohtunut tabletti pitää ottaa heti muistettaessa, vaikka tällöin olisikin otettava kaksi tablettia samalla kertaa. Seuraavat tabletit otetaan tavanomaiseen aikaan. Jos tabletteja on otettu ohjeen mukaan 7 päivän ajan ennen ensimmäistä unohtunutta tablettia, lisäehkäisyä ei tarvita. Jos käyttäjä on unohtanut useamman kuin yhden tabletin, häntä on kehotettava käyttämään lisäehkäisyä 7 päivän ajan.
- Viikko 3
Valmisteen ehkäisyteho saattaa olla heikentynyt, koska 7 päivän tablettitauko on lähellä. Ehkäisytehon heikkeneminen voidaan kuitenkin vielä estää mukauttamalla tablettien käyttöä.
Noudattamalla jompaakumpaa seuraavista vaihtoehdoista lisäehkäisyä ei tarvita, jos tabletteja on otettu ohjeen mukaan 7 päivän ajan ennen ensimmäistä unohtunutta tablettia. Jos näin ei ole, käyttäjän pitää noudattaa ensimmäistä näistä kahdesta vaihtoehdosta ja käyttää myös lisäehkäisyä seuraavien 7 päivän ajan.
- Viimeinen unohtunut tabletti pitää ottaa heti muistettaessa, vaikka tällöin olisikin otettava kaksi tablettia samalla kertaa. Seuraavat tabletit otetaan tavanomaiseen aikaan. Seuraava läpipainopakkaus pitää aloittaa heti, kun käytössä olevan läpipainopakkauksen tabletit loppuvat niin, ettei pakkausten väliin jää taukoa. Tyhjennysvuoto jää todennäköisesti tulematta ennen uuden pakkauksen loppumista, mutta tablettien käytön aikana voi ilmetä tiputtelu- tai läpäisyvuotoa.
- Tablettien ottaminen käytössä olevasta läpipainopakkauksesta voidaan lopettaa. Tällöin tulee pitää 7 päivän tablettitauko, mukaan lukien ne päivät, jolloin tabletit on unohdettu ottaa. Tämän jälkeen aloitetaan tablettien ottaminen uudesta läpipainopakkauksesta.
Jos käyttäjä on unohtanut ottaa tabletteja eikä tyhjennysvuotoa tule ensimmäisen normaalin tablettitauon aikana, raskauden mahdollisuus on otettava huomioon.
Ohjeet ruoansulatuskanavan häiriöiden yhteydessä
Vaikeiden ruoansulatuskanavan häiriöiden (esim. oksentelu tai ripuli) yhteydessä vaikuttavien aineiden imeytyminen saattaa olla epätäydellistä, ja tällöin tulee käyttää lisäehkäisyä.
Jos oksentelua esiintyy 3–4 tunnin sisällä tabletin ottamisesta, uusi korvaava tabletti pitää ottaa mahdollisimman pian. Jos mahdollista, uusi tabletti otetaan 12 tunnin sisällä tavallisesta tabletin ottamisajasta. Jos tabletin ottamisajasta on kulunut yli 12 tuntia, sovelletaan tablettien unohtamista koskevia ohjeita (kohta Annostus ja antotapa ”Tablettien unohtaminen”). Jos nainen ei halua muuttaa tablettien normaalia käyttöaikataulua, hänen on otettava ylimääräinen tabletti (tabletit) toisesta läpipainopakkauksesta.
Kuukautisten siirtäminen
Kuukautisia voidaan siirtää aloittamalla uusi Midiana-läpipainopakkaus heti edellisen loputtua ilman taukoa. Kuukautisia voidaan siirtää niin pitkälle kuin halutaan, kuitenkin enintään toisen pakkauksen loppumiseen saakka. Kuukautisten siirron aikana voi esiintyä läpäisy- tai tiputteluvuotoa. Midiana-tablettien säännöllinen käyttö voidaan aloittaa tavanomaisen 7 päivän tablettitauon jälkeen.
Jos nainen haluaa muuttaa kuukautisten alkamispäivää joksikin toiseksi viikonpäiväksi, häntä voidaan neuvoa lyhentämään seuraavaa tablettitaukoa niin monella päivällä kuin hän haluaa. Mitä lyhyempi tauko on, sitä suurempi on riski, että tyhjennysvuotoa ei tule ja että seuraavan pakkauksen käytön aikana esiintyy läpäisy- ja tiputteluvuotoa (kuten kuukautisia siirrettäessä).
Pediatriset potilaat
Midiana on tarkoitettu käytettäväksi ainoastaan kuukautisten alkamisen jälkeen. Yli 2 000:lta alle 18-vuotiaalta nuorelta naiselta kerätyt epidemiologiset tiedot eivät viittaa siihen, että turvallisuus ja teho tässä nuoressa ikäryhmässä eroaisivat turvallisuudesta ja tehosta yli 18-vuotiailla naisilla.
Vasta-aiheet
Hormonaalisia yhdistelmäehkäisyvalmisteita ei pidä käyttää alla lueteltujen tilojen yhteydessä. Jos jokin näistä tiloista ilmenee ensimmäistä kertaa hormonaalisen yhdistelmäehkäisyvalmisteen käytön aikana, valmisteen käyttö on lopetettava heti.
-
Laskimotromboembolia (VTE) tai sen riski
- laskimotromboembolia – tällä hetkellä esiintyvä VTE (potilaalla antikoagulanttilääkitys) tai anamneesissa VTE (esim. syvä laskimotromboosi [SLT] tai keuhkoembolia)
- tiedossa oleva perinnöllinen tai hankinnainen laskimotromboembolia-alttius, kuten APC-resistenssi, (mukaan lukien Faktori V Leiden), antitrombiini III:n puutos, C‑proteiinin puutos, S‑proteiinin puutos
- suuri leikkaus ja siihen liittyvä pitkittynyt immobilisaatio (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
- useiden riskitekijöiden aiheuttama suuri laskimotromboembolian riski (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
-
Valtimotromboembolia tai sen riski
- valtimotromboembolia – tällä hetkellä esiintyvä tai aiemmin esiintynyt valtimotromboembolia (esim. sydäninfarkti) tai sitä ennakoiva tila (esim. angina pectoris)
- aivoverisuonisairaus – tällä hetkellä esiintyvä tai aiemmin esiintynyt aivohalvaus tai sitä ennakoiva tila (esim. ohimenevä aivoverenkiertohäiriö, TIA)
- tiedossa oleva perinnöllinen tai hankinnainen valtimotromboembolia-alttius, kuten hyperhomokysteinemia ja fosfolipidivasta-aineet (kardiolipiinivasta-aineet, lupusantikoagulantti)
- anamneesissa migreeni, johon liittyy fokaalisia neurologisia oireita
- monista riskitekijöistä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) tai yhden vakavan riskitekijän esiintymisestä johtuva suuri valtimotromboemboliariski. Näitä riskitekijöitä voivat olla:
- diabetes, jossa esiintyy verisuonioireita
- vaikea hypertensio
- vaikea dyslipoproteinemia
- Nykyinen tai aiemmin ilmennyt vaikea maksasairaus, mikäli maksan toimintakoearvot eivät ole normalisoituneet
- Vaikea tai akuutti munuaisten vajaatoiminta
- Nykyiset tai aiemmat maksakasvaimet (hyvän- tai pahanlaatuiset)
- Todetut tai epäillyt maligniteetit, joihin sukupuolihormonit vaikuttavat (esim. sukupuolielimissä tai rinnoissa)
- Diagnosoimaton emätinverenvuoto
- Yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille
-
Yliherkkyys maapähkinälle tai soijalle
Midiana on vasta-aiheinen, jos samanaikaisesti käytetään ombitasviiria/paritapreviiria/ritonaviiria ja dasabuviiria, glekapreviiria/pibrentasviiria taisofosbuviiria/velpatasviiria/voksilapreviiria sisältäviä lääkevalmisteita (ks. kohta Yhteisvaikutukset).
Varoitukset ja käyttöön liittyvät varotoimet
Varoitukset
- Midiana-valmisteen soveltuvuudesta on keskusteltava naisen kanssa, jos hänellä esiintyy mikä tahansa alla mainituista tiloista tai riskitekijöistä.
- Jos jokin näistä tiloista tai riskitekijöistä pahenee tai ilmenee ensimmäisen kerran, käyttäjää on kehotettava ottamaan yhteys lääkäriin, joka päättää, pitääkö Midiana-valmisteen käyttö keskeyttää.
- Jos epäillään laskimo- tai valtimotromboemboliaa tai se on todettu, yhdistelmäehkäisyvalmisteen käyttö on lopetettava. Jos aloitetaan antikoagulanttihoito, on aloitettava riittävä vaihtoehtoinen ehkäisy, sillä antikoagulanttihoito (kumariinit) on teratogeeninen.
- Verenkiertohäiriöt
Laskimotromboembolian (VTE) riski
Minkä tahansa yhdistelmäehkäisyvalmisteen käyttö lisää laskimotromboembolian (VTE) riskiä verrattuna siihen, että tällaista valmistetta ei käytetä lainkaan. Levonorgestreelia, norgestimaattia tai noretisteronia sisältäviin valmisteisiin liittyy pienin VTE:n riski. Tämä riski voi olla jopa kaksinkertainen muilla valmisteilla, kuten esimerkiksi Midiana-valmisteella. Päätöksen muun kuin VTE:n riskiltään pienimmän valmisteen käyttämisestä saa tehdä vain sen jälkeen, kun ehkäisyä harkitsevan naisen kanssa on keskusteltu. Keskustelussa on varmistettava, että hän ymmärtää Midiana-valmisteen käyttöön liittyvän VTE:n riskin, miten hänen nykyiset riskitekijänsä vaikuttavat tähän riskiin ja että hänen VTE:n riskinsä on suurimmillaan ensimmäisen vuoden aikana, jona hän käyttää yhdistelmäehkäisyvalmistetta ensimmäistä kertaa elämässään. On myös jonkin verran näyttöä siitä, että riski suurenee, kun yhdistelmäehkäisyvalmisteen käyttö aloitetaan uudelleen vähintään 4 viikon tauon jälkeen.
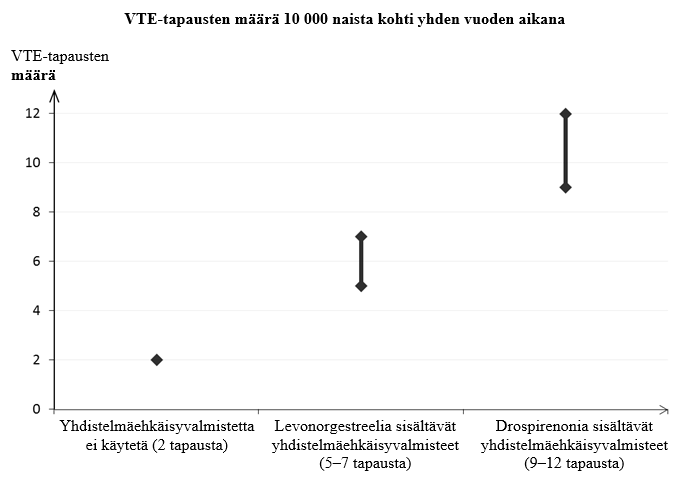
Noin kahdelle naiselle 10 000:sta, jotka eivät käytä yhdistelmäehkäisyvalmistetta eivätkä ole raskaana, kehittyy VTE yhden vuoden aikana. Yksittäisellä naisella tämä riski voi kuitenkin olla suurempi riippuen hänen omista, taustalla vaikuttavista riskitekijöistä (ks. jäljempänä).
Arviolta1 noin 9–12 naiselle 10 000:sta, jotka käyttävät drospirenonia sisältävää yhdistelmäehkäisyvalmistetta, kehittyy VTE yhden vuoden aikana. Levonorgestreelia sisältävää yhdistelmäehkäisyvalmistetta käyttävillä naisilla vastaava luku on noin 62.
1 Ilmaantuvuus arvioitiin kaikista epidemiologisista tutkimustuloksista vertaamalla eri valmisteiden suhteellisia riskejä levonorgestreelia sisältäviin yhdistelmäehkäisyvalmisteisiin.
2 Vaihteluvälin 5–7 keskipiste 10 000 naisvuotta kohden, mikä perustuu levonorgestreelia sisältävien yhdistelmäehkäisyvalmisteiden käytön suhteelliseen riskiin verrattuna käyttämättömyyteen, jolloin riski on noin 2,3–3,6.
Molemmissa tapauksissa VTE-tapausten määrä vuotta kohti on pienempi kuin määrä, joka on odotettavissa raskauden aikana tai synnytyksen jälkeisenä aikana.
VTE saattaa aiheuttaa kuoleman 1–2 %:ssa tapauksista.
Yhdistelmäehkäisyvalmisteiden käyttäjillä tromboosia on erittäin harvoin raportoitu esiintyneen muissa verisuonissa (esim. maksan, suoliliepeen, munuaisten tai verkkokalvon laskimoissa ja valtimoissa).
Laskimotromboembolian riskitekijät
Yhdistelmäehkäisyvalmisteiden käyttäjillä esiintyvien laskimotromboembolisten komplikaatioiden riski voi suurentua huomattavasti, jos naisella on muita riskitekijöitä, erityisesti jos riskitekijöitä on useita (ks. taulukko).
Midiana-valmiste on vasta-aiheinen naisella, jolla on useita riskitekijöitä, jotka aiheuttavat suuren VTE:n riskin (ks. kohta Vasta-aiheet). Jos naisella on useampia kuin yksi riskitekijä, nämä yhdessä voivat muodostaa yksittäisten tekijöiden summaa suuremman riskin – tässä tapauksessa VTE:n kokonaisriski on otettava huomioon. Jos hyöty-riski-suhteen katsotaan olevan negatiivinen, yhdistelmäehkäisyvalmistetta ei pidä määrätä (ks. kohta Vasta-aiheet).
Taulukko: Laskimotromboembolian (VTE) riskitekijät
Riskitekijä | Kommentti |
Ylipaino (painoindeksi yli 30 kg/m2)
| Riski suurenee huomattavasti painoindeksin noustessa. |
Pitkittynyt immobilisaatio, suuri leikkaus, kaikki jalkojen tai lantion alueen leikkaukset, neurokirurgia tai merkittävä trauma
Huomioitavaa: väliaikainen immobilisaatio, mukaan lukien > 4 tunnin lentomatka, voi myös olla VTE:n riskitekijä, erityisesti naisilla, joilla on myös muita riskitekijöitä | Näissä tilanteissa on suositeltavaa lopettaa tablettien käyttö (elektiivisen leikkauksen kohdalla vähintään neljä viikkoa etukäteen), eikä sitä pidä jatkaa ennen kuin käyttäjä on ollut kaksi viikkoa täysin liikuntakykyinen. Jotain muuta raskaudenehkäisymenetelmää on käytettävä ei-toivotun raskauden ehkäisemiseksi.
|
Positiivinen sukuanamneesi (tämänhetkinen tai aikaisempi VTE sisaruksella tai vanhemmalla, etenkin suhteellisen nuorella iällä, esim. alle 50‑vuotiaana) | Jos perinnöllistä alttiutta epäillään, potilas on syytä ohjata erikoislääkärin tutkimuksiin ennen kuin minkään yhdistelmäehkäisyvalmisteen käytöstä päätetään. |
Muut laskimotromboemboliaan liittyvät sairaudet | Syöpä, systeeminen lupus erythematosus, hemolyyttis-ureeminen oireyhtymä, krooninen tulehduksellinen suolistosairaus (Crohnin tauti tai haavainen koliitti) ja sirppisoluanemia |
Ikääntyminen | Erityisesti yli 35 vuoden ikä |
Suonikohjujen ja pinnallisen laskimontukkotulehduksen mahdollisesta yhteydestä laskimotromboosin alkamiseen tai etenemiseen ei ole yksimielisyyttä.
Laskimotromboembolian suurempi riski raskauden ja erityisesti synnytyksen jälkeisten noin 6 viikon aikana on otettava huomioon (ks. lisätiedot kohdasta Raskaus ja imetys ”Raskaus ja imetys”)
Laskimotromboembolian oireet (syvä laskimotromboosi ja keuhkoembolia)
Jos oireita ilmaantuu, naisia on neuvottava hakeutumaan välittömästi lääkärin hoitoon ja kertomaan yhdistelmäehkäisyvalmisteen käytöstä.
Syvän laskimotromboosin (SLT) oireita voivat olla:
- toisen jalan ja/tai jalkaterän turvotus tai turvotus jalan laskimon kohdalla
- jalan kipu tai arkuus, joka saattaa tuntua vain seistessä tai kävellessä
- jalan lisääntynyt lämmöntunne, jalan ihon värin muutos tai punoitus.
Keuhkoembolian oireita voivat olla:
- äkillisesti alkanut, selittämätön hengenahdistus tai nopeutunut hengitys
- äkillinen yskä, johon saattaa liittyä veriysköksiä
- pistävä rintakipu
- vaikea pyörrytys tai huimaus
- nopea tai epäsäännöllinen sydämen syke.
Jotkin näistä oireista (esim. hengenahdistus, yskä) ovat epäspesifisiä, ja ne voidaan tulkita virheellisesti yleisluontoisemmiksi tai vähemmän vaikeiksi tapahtumiksi (esim. hengitystieinfektioksi).
Muita verisuonitukoksen merkkejä voivat olla mm.: äkillinen kipu, turvotus ja sinertävä värimuutos raajassa.
Jos tukos tulee silmään, oireena voi olla esim. kivuton näön hämärtyminen, joka voi edetä näön menetykseen. Joskus näön menetys voi tapahtua lähes välittömästi.
Valtimotromboembolian (ATE) riski
Epidemiologisissa tutkimuksissa on osoitettu, että yhdistelmäehkäisyvalmisteiden käyttöön liittyy suurentunut valtimotromboembolian (sydäninfarkti) tai aivoverisuonitapahtuman (esim. aivojen ohimenevä verenkiertohäiriö [TIA], aivohalvaus) riski. Valtimotromboemboliset tapahtumat voivat johtaa kuolemaan.
Valtimotromboembolian (ATE) riskitekijät
Valtimotromboembolisten komplikaatioiden tai aivoverisuonitapahtuman riski yhdistelmäehkäisyvalmisteen käyttäjillä on korkeampi niillä naisilla, joilla on riskitekijöitä (ks. taulukko). Midiana-valmiste on vasta-aiheinen, jos naisella on joko yksi vakava tai useampia ATE:n riskitekijöitä, mikä aiheuttaa suuren valtimotromboemboliariskin (ks. kohta Vasta-aiheet). Jos naisella on useampi kuin yksi riskitekijä, nämä yhdessä voivat muodostaa yksittäisten tekijöiden summaa suuremman riskin – tässä tapauksessa kokonaisriski on otettava huomioon. Jos hyöty-riski-suhteen katsotaan olevan negatiivinen, yhdistelmäehkäisyvalmistetta ei pidä määrätä (ks. kohta Vasta-aiheet).
Taulukko: Valtimotromboembolian (ATE) riskitekijät
Riskitekijä | Kommentti |
Ikääntyminen | Erityisesti yli 35 vuoden ikä |
Tupakointi | Yhdistelmäehkäisyvalmistetta käyttäviä naisia on neuvottava olemaan tupakoimatta. Yli 35‑vuotiaita, tupakoimista jatkavia naisia on vakavasti kehotettava käyttämään jotakin muuta ehkäisymenetelmää. |
Kohonnut verenpaine | |
Ylipaino (painoindeksi yli 30 kg/m2) | Riski kasvaa huomattavasti painoindeksin noustessa. Erityisen tärkeää naisilla, joilla on muitakin riskitekijöitä. |
Positiivinen sukuanamneesi (tämänhetkinen tai aikaisempi valtimotromboembolia sisaruksella tai vanhemmalla, etenkin suhteellisen nuorella iällä, alle 50‑vuotiaana). | Jos perinnöllistä alttiutta epäillään, potilas on syytä ohjata erikoislääkärin tutkimuksiin ennen kuin minkään yhdistelmäehkäisyvalmisteen käytöstä päätetään. |
Migreeni | Migreenin esiintymistiheyden kasvu tai vaikeusasteen lisääntyminen (mikä saattaa olla aivoverisuonitapahtumaa ennakoiva oire) yhdistelmäehkäisyvalmisteen käytön aikana voi olla syy yhdistelmäehkäisyvalmisteen käytön välittömään keskeyttämiseen. |
Muut verisuoniston haittatapahtumiin liittyvät sairaudet | Diabetes, hyperhomokysteinemia, sydämen läppävika ja eteisvärinä, dyslipoproteinemia ja systeeminen lupus erythematosus (SLE). |
Valtimotromboembolian (ATE) oireet
Jos oireita ilmaantuu, naisia on neuvottava hakeutumaan välittömästi lääkärin hoitoon ja kertomaan yhdistelmäehkäisyvalmisteen käytöstä.
Aivoverisuonitapahtuman oireita voivat olla:
- kasvojen, käsivarren tai jalan äkillinen tunnottomuus tai heikkous (varsinkin vain yhdellä puolella vartaloa esiintyvä)
- äkillinen kävelyn vaikeutuminen, huimaus, tasapainon tai koordinaation menetys
- äkillinen sekavuus, puhe- tai ymmärtämisvaikeudet
- äkillinen näön heikentyminen toisessa silmässä tai molemmissa silmissä
- äkillinen, vaikea tai pitkittynyt päänsärky, jonka syytä ei tiedetä
- tajunnan menetys tai pyörtyminen, johon saattaa liittyä kouristuskohtaus.
Ohimenevät oireet viittaavat siihen, että tapahtuma on ohimenevä aivoverenkiertohäiriö (TIA).
Sydäninfarktin oireita voivat olla:
- kipu, epämiellyttävä tunne, paineen tunne, painon tunne, puristuksen tai täysinäisyyden tunne rinnassa, käsivarressa tai rintalastan takana
- selkään, leukaan, nieluun, käsivarteen ja/tai vatsaan säteilevä epämiellyttävä tunne
- täyteläisyyden, ruoansulatushäiriöiden tai tukehtumisen tunne
- hikoilu, pahoinvointi, oksentelu tai huimaus
- erittäin voimakas heikkouden tunne, ahdistuneisuus tai hengenahdistus
-
nopea tai epäsäännöllinen sydämen syke.
- Kasvaimet
Joissakin epidemiologisissa tutkimuksissa on raportoitu kohdunkaulan syövän riskin suurentuneen yhdistelmäehkäisytablettien pitkäaikaiskäytön (> 5 vuotta) yhteydessä, mutta vieläkään ei ole yksimielisyyttä siitä, missä määrin tähän havaintoon vaikuttavat sukupuolikäyttäytymisen sekoittavat vaikutukset ja muut tekijät, kuten ihmisen papilloomavirus (HPV).
Meta-analyysi 54 epidemiologisesta tutkimuksesta osoitti, että yhdistelmäehkäisytablettien käyttäjien suhteellinen rintasyöpäriski on hieman suurentunut (suhteellinen riski 1,24). Suurentunut riski häviää vähitellen 10 vuoden kuluessa yhdistelmäehkäisytablettien käytön lopettamisesta. Rintasyöpä on harvinainen alle 40-vuotiailla naisilla, joten yhdistelmäehkäisytabletteja käyttävillä tai hiljattain niitä käyttäneillä havaittu rintasyöpädiagnoosien ylimäärä on pieni verrattuna rintasyövän kokonaisriskiin. Nämä tutkimukset eivät anna näyttöä kausaliteetista. Havaittu riskin suureneminen saattaa johtua rintasyövän varhaisemmasta diagnoosista yhdistelmäehkäisytablettien käyttäjillä, yhdistelmäehkäisytablettien biologisista vaikutuksista tai kummastakin tekijästä yhdessä. Ehkäisytablettien käyttäjillä diagnosoidut rintasyövät eivät ole yleensä edenneet kliinisesti niin pitkälle kuin ehkäisytabletteja käyttämättömillä diagnosoidut rintasyövät.
Harvoissa tapauksissa yhdistelmäehkäisytablettien käyttäjillä on raportoitu hyvänlaatuisia maksakasvaimia ja vieläkin harvemmin pahanlaatuisia maksakasvaimia. Kasvaimet ovat yksittäistapauksissa johtaneet hengenvaaralliseen vatsansisäiseen verenvuotoon. Maksakasvain tulee ottaa huomioon erotusdiagnoosina, kun yhdistelmäehkäisytabletteja käyttävällä naisella on vaikea ylävatsakipu, suurentunut maksa tai merkkejä vatsansisäisestä verenvuodosta.
Käytettäessä suuriannoksisia yhdistelmäehkäisytabletteja (0,05 mg etinyyliestradiolia) kohdun limakalvon ja munasarjasyövän riski pienenee. Ei ole vielä vahvistettu, päteekö tämä myös pieniannoksisiin yhdistelmäehkäisytabletteihin.
- Muut tilat
Masentunut mieliala ja masennus ovat tunnettuja hormonaalisten ehkäisyvalmisteiden käyttöön liittyviä haittavaikutuksia (ks. kohta Haittavaikutukset). Masennus voi olla vakavaa, ja se on itsetuhoisen käyttäytymisen ja itsemurhan tunnettu riskitekijä. Naisia on kehotettava ottamaan yhteyttä lääkäriinsä, jos heillä esiintyy mielialan muutoksia ja masennuksen oireita, myös pian hoidon aloittamisen jälkeen.
Valmisteen sisältämä progestiini on aldosteroniantagonisti, jolla on kaliumia säästäviä ominaisuuksia. Valtaosalla käyttäjistä kaliumpitoisuuden nousua ei kuitenkaan ole odotettavissa. Joillakin lievää tai keskivaikeaa munuaisten vajaatoimintaa sairastavilla potilailla on kliinisessä tutkimuksessa havaittu vähäistä, mutta ei merkitsevää, seerumin kaliumpitoisuuden suurenemista kaliumia säästävien lääkkeiden ja drospirenonin samanaikaisen käytön yhteydessä. Sen vuoksi on suositeltavaa tarkistaa seerumin kaliumpitoisuus ensimmäisen hoitosyklin aikana, jos potilaalla on munuaisten vajaatoiminta ja jos seerumin kaliumpitoisuus on ennen hoitoa viitealueen ylärajalla, varsinkin, jos potilas käyttää kaliumia säästäviä lääkkeitä. Ks. myös kohta Yhteisvaikutukset.
Naisilla, joilla on hypertriglyseridemia tai joilla sitä esiintyy suvussa, voi olla suurentunut haimatulehduksen riski yhdistelmäehkäisytablettien käytön aikana.
Vaikka lievää verenpaineen kohoamista on raportoitu monilla yhdistelmäehkäisytabletteja käyttävillä naisilla, kliinisesti merkityksellinen kohoaminen on harvinaista. Vain harvoissa tapauksissa yhdistelmäehkäisytablettien käyttö on aiheellista lopettaa välittömästi. Jos hypertensiopotilaalla verenpainearvot pysyvät jatkuvasti koholla yhdistelmäehkäisytablettien käytön aikana tai jos merkitsevästi kohonnut verenpaine ei reagoi riittävästi verenpainelääkitykseen, yhdistelmäehkäisytablettien käyttö on keskeytettävä. Yhdistelmäehkäisytablettien käyttöä voidaan jatkaa, jos verenpainelääkityksellä saadaan aikaan normotensio.
Seuraavia sairauksia tai niiden pahenemista on raportoitu ilmenneen sekä raskauden että yhdistelmäehkäisytablettien käytön yhteydessä, mutta niiden yhteydestä yhdistelmäehkäisytablettien käyttöön ei ole pitävää näyttöä: kolestaattinen ikterus ja/tai kutina, sappikivet, porfyria, systeeminen lupus erythematosus, hemolyyttis-ureeminen oireyhtymä, Sydenhamin korea, herpes gestationis, otoskleroosiin liittyvä kuulon heikentyminen.
Eksogeeniset estrogeenit voivat indusoida tai pahentaa perinnöllisen ja hankinnaisen angioedeeman oireita.
Yhdistelmäehkäisytablettien käytön keskeyttäminen saattaa olla tarpeen akuuteissa tai kroonisissa maksan toimintahäiriöissä, kunnes maksa-arvot ovat normalisoituneet. Yhdistelmäehkäisytablettien käyttö on lopetettava, jos raskausaikana aiemmin ilmennyt tai aiempaan sukupuolihormonien käyttöön liittynyt kolestaattinen ikterus ja/tai kolestaasiin liittyvä kutina uusiutuu.
Vaikka yhdistelmäehkäisytabletit saattavat vaikuttaa perifeeriseen insuliiniresistenssiin ja glukoosinsietoon, pieniannoksista estrogeenia sisältäviä yhdistelmäehkäisytabletteja (alle 0,05 mg etinyyliestradiolia) käyttävien diabetespotilaiden hoidon muuttamistarpeesta ei ole näyttöä. Diabetespotilaita tulee kuitenkin seurata huolellisesti, erityisesti ehkäisytablettien käytön alkuvaiheessa.
Yhdistelmäehkäisytablettien käytön aikana on raportoitu endogeenisen masennuksen, epilepsian, Crohnin taudin ja haavaisen paksusuolitulehduksen pahenemista.
Maksaläiskiä voi joskus esiintyä, varsinkin jos niitä on esiintynyt raskausaikana. Jos naisella on taipumusta saada maksaläiskiä, hänen tulee välttää altistumista auringolle ja ultraviolettisäteilylle yhdistelmäehkäisytablettien käytön aikana.
Lääkärintarkastus/neuvonta
Ennen Midiana-valmisteen käytön aloittamista tai uudelleen aloittamista potilaan sairaushistoria on selvitettävä täydellisesti (mukaan lukien sukuanamneesi), ja raskaus on suljettava pois. Naisen verenpaine on mitattava, ja hänelle on tehtävä lääkärintarkastus ottaen huomioon vasta-aiheet (ks. kohta Vasta-aiheet) ja varoitukset (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). On tärkeää kiinnittää naisen huomiota laskimo- ja valtimoveritulppia koskeviin tietoihin, kuten Midiana-valmisteen käyttöön liittyvään riskiin verrattuna muihin yhdistelmäehkäisyvalmisteisiin, laskimo- ja valtimoveritulppien oireisiin, tiedossa oleviin riskitekijöihin sekä siihen, mitä tehdä, jos epäilee veritulppaa.
Naista on myös neuvottava lukemaan pakkausseloste huolellisesti ja noudattamaan siinä annettuja ohjeita. Tarkastuskäyntien tiheyden ja luonteen pitää perustua vakiintuneisiin hoitosuosituksiin, ja ne on toteutettava kunkin naisen kliinisten tarpeiden mukaisesti.
Naisia on varoitettava siitä, että hormonaaliset ehkäisyvalmisteet eivät suojaa HIV-infektiolta (AIDS) eivätkä muilta sukupuoliteitse tarttuvilta taudeilta.
Tehon heikkeneminen
Tablettien unohtaminen (ks. kohta Annostus ja antotapa), ruoansulatuskanavan häiriöt (ks. kohta Annostus ja antotapa) tai muu samanaikainen lääkitys (ks. kohta Yhteisvaikutukset) voivat heikentää yhdistelmäehkäisytablettien tehoa.
Syklikontrollin heikentyminen
Kaikki yhdistelmäehkäisytabletit voivat aiheuttaa epäsäännöllistä vuotoa (tiputtelu- ja läpäisyvuotoa), etenkin ensimmäisten käyttökuukausien aikana. Siksi epäsäännöllistä vuotoa kannattaa alkaa tutkia vasta noin kolme kiertoa kestävän sopeutumisvaiheen jälkeen.
Jos vuotohäiriöt jatkuvat tai niitä ilmaantuu kiertojen oltua aiemmin säännölliset, ei-hormonaaliset syyt on syytä ottaa huomioon ja suorittaa asianmukaiset diagnostiset toimenpiteet maligniteetin tai raskauden poissulkemiseksi. Nämä voivat käsittää kaavinnan.
Joillakin naisilla ei tule tyhjennysvuotoa tablettitauon aikana. Jos yhdistelmäehkäisytabletteja on otettu kohdan Annostus ja antotapa ohjeiden mukaan, nainen ei todennäköisesti ole raskaana. Jos yhdistelmäehkäisytabletteja ei kuitenkaan ole käytetty ohjeiden mukaan ennen tyhjennysvuodon ensimmäistä poisjääntiä tai jos kaksi tyhjennysvuotoa on jäänyt tulematta, raskauden mahdollisuus on suljettava pois ennen yhdistelmäehkäisytablettien käytön jatkamista.
Apuaineet
Tämä lääkevalmiste sisältää 48,17 mg laktoosimonohydraattia per annos. Potilaiden, joilla on harvinainen perinnöllinen galaktoosi-intoleranssi, täydellinen laktaasinpuutos tai glukoosi-galaktoosi imeytymishäiriö, ei tule käyttää tätä lääkevalmistetta.
Tämä lääkevalmiste sisältää 0,070 mg soijalesitiiniä per annos. Tätä lääkevalmistetta ei tule käyttää maapähkinälle tai soijalle allergisille potilaille.
Yhteisvaikutukset
Huomautus: Mahdollisten yhteisvaikutusten selvittämiseksi on tutustuttava samanaikaisesti käytettävien lääkevalmisteiden valmisteyhteenvetoihin.
Farmakodynaamiset yhteisvaikutukset
Kun kliinisissä tutkimuksissa hoidettiin hepatiitti C virusinfektiota (HCV) ombitasviirin, paritapreviirin ja ritonaviirin yhdistelmällä ja dasabuviirilla ribaviriinin kanssa tai ilman, transaminaasiarvon (ALAT) kohoamista yli 5 x ULN (viitealueen yläraja) esiintyi merkitsevästi useammin naisilla, jotka käyttivät etinyyliestradiolia sisältävää valmistetta, kuten yhdistelmäehkäisyvalmistetta. Myös glekapreviirin ja pibrentasviirin yhdistelmää tai sofosbuviirin, velpatasviirin ja voksilapreviirin yhdistelmää käyttävillä potilailla ALAT-arvon kohoamista havaittiin etinyyliestradiolia sisältävää valmistetta (kuten yhdistelmäehkäisyvalmistetta) käyttävillä naisilla (ks. kohta Vasta-aiheet). Tästä syystä Midiana-valmistetta käyttävien on vaihdettava toiseen ehkäisymenetelmään (esim. pelkkää progestiinia sisältävään tai hormonittomaan ehkäisymenetelmään) ennen kyseisten yhdistelmähoitojen aloittamista. Midiana-valmisteen käyttö voidaan aloittaa uudelleen 2 viikon kuluttua näiden yhdistelmähoitojen päättymisestä.
Farmakokineettiset yhteisvaikutukset
- Muiden lääkevalmisteiden vaikutus Midiana-valmisteeseen
Yhteisvaikutuksia voi esiintyä sellaisten lääkkeiden kanssa, jotka indusoivat mikrosomaalisia entsyymejä. Tämä voi johtaa sukupuolihormonien lisääntyneeseen puhdistumaan ja saattaa heikentää ehkäisytehoa ja/tai aiheuttaa läpäisyvuotoja.
Hoito
Entsyymi-induktio on havaittavissa jo parin hoitopäivän jälkeen. Maksimaalinen entsyymi-induktio havaitaan yleensä muutaman viikon sisällä. Induktio voi jatkua vielä neljän viikon ajan lääkehoidon päätyttyä.
Lyhytaikainen hoito
Naisten, jotka käyttävät entsyymejä indusoivia lääkeaineita, on yhdistelmäehkäisyvalmisteen lisäksi käytettävä tilapäisenä lisäehkäisynä jotain estemenetelmää tai jotain muuta ehkäisymenetelmää. Estemenetelmää on käytettävä koko samanaikaisesti jatkuvan lääkehoidon ajan ja vielä 28 vuorokauden ajan sen loppumisen jälkeen. Jos lääkehoito kestää kauemmin kuin yhdistelmäehkäisytablettipakkaus, seuraava yhdistelmäehkäisytablettipakkaus on aloitettava heti edellisen loputtua ilman tavanomaista tablettitaukoa.
Pitkäaikainen hoito
Naisille, jotka käyttävät pitkäaikaisesti maksaentsyymejä indusoivia lääkeaineita, suositellaan jonkin muun luotettavan, ei-hormonaalisen ehkäisymenetelmän käyttöä.
Kirjallisuudessa on raportoitu alla mainittuja yhteisvaikutuksia.
Lääkeaineet, jotka lisäävät sukupuolihormonien puhdistumaa (entsyymi-induktion aiheuttama yhdistelmäehkäisyvalmisteen tehon heikkeneminen):
Barbituraatit, bosentaani, karbamatsepiini, fenytoiini, primidoni, rifampisiini ja HIV-lääkkeet ritonaviiri, nevirapiini ja efavirentsi sekä mahdollisesti myös felbamaatti, griseofulviini, okskarbatsepiini, topiramaatti ja mäkikuismaa (Hypericum perforatum) sisältävät rohdosvalmisteet.
Lääkeaineet, joilla on vaihteleva vaikutus sukupuolihormonien puhdistumaan:
Useat HIV-proteaasin estäjien ja ei-nukleosidisten käänteiskopioijaentsyymin estäjien yhdistelmät (mukaan lukien HCV-proteaasin estäjien yhdistelmät) saattavat suurentaa tai pienentää estrogeenin tai progestiinien plasmapitoisuutta käytettäessä samanaikaisesti yhdistelmäehkäisyvalmisteita. Näiden muutosten kokonaisvaikutus voi tietyissä tapauksissa olla kliinisesti merkittävä.
Tämän vuoksi mahdolliset yhteisvaikutukset ja niihin liittyvät lisäohjeet on tarkastettava samanaikaisen HIV/HCV-lääkityksen valmisteyhteenvedosta. Jos yhteisvaikutuksen mahdollisuutta epäillään, proteaasin estäjää tai ei-nukleosidista käänteiskopioijaentsyymin estäjää käyttävän naisen on käytettävä lisäehkäisynä jotain estemenetelmää.
Lääkeaineet, jotka vähentävät sukupuolihormonien puhdistumaa (entsyyminestäjät):
Entsyyminestäjien ja yhdistelmäehkäisytablettien välisten mahdollisten yhteisvaikutusten kliininen merkitys on tuntematon.
Jos voimakkaita CYP3A4:n estäjiä ja yhdistelmäehkäisytabletteja käytetään samanaikaisesti, estrogeenin ja/tai progestiinin pitoisuus plasmassa voi suurentua.
Kun moniannostutkimuksessa drospirenonin (3 mg/vrk) ja etinyyliestradiolin (0,02 mg/vrk) yhdistelmän kanssa käytettiin 10 päivän ajan samanaikaisesti voimakasta CYP3A4:n estäjää, ketokonatsolia, drospirenonin AUC(0–24h)-arvo suureni 2,7-kertaiseksi ja etinyyliestradiolin 1,4-kertaiseksi.
Etorikoksibin 60–120 mg vuorokausiannosten on osoitettu suurentavan plasman etinyyliestradiolipitoisuuksia vastaavasti 1,4–1,6-kertaisiksi, kun 0,035 mg etinyyliestradiolia sisältävää yhdistelmäehkäisyvalmistetta on käytetty samanaikaisesti.
- Midiana-valmisteen vaikutus muihin lääkevalmisteisiin
Ehkäisytabletit saattavat vaikuttaa tiettyjen muiden lääkeaineiden metaboliaan. Sen mukaisesti pitoisuudet plasmassa ja kudoksissa saattavat joko suurentua (esim. siklosporiini) tai pienentyä (esim. lamotrigiini).
Vapaaehtoisilla naisilla tehtyjen in vivo -interaktiotutkimusten (merkkiaineina omepratsoli, simvastatiini tai midatsolaami) perusteella on epätodennäköistä, että 3 mg drospirenoniannoksella olisi kliinisesti merkittävä vaikutus muiden lääkeaineiden CYP450-välitteiseen metaboliaan.
Kliiniset tutkimustiedot viittaavat siihen, että etinyyliestradioli estää CYP1A2:n substraattien puhdistumaa, mikä johtaa niiden pitoisuuksien vähäiseen (esim. teofylliini) tai kohtalaiseen (esim. titsanidiini) suurenemiseen plasmassa.
Farmakodynaamiset yhteisvaikutukset
Samanaikainen käyttö ombitasviirin, paritapreviirin ja ritonaviirin yhdistelmää ja dasabuviiria sisältävien lääkevalmisteiden kanssa ribaviriinin kanssa tai ilman saattaa suurentaa ALAT-arvon kohoamisen riskiä (ks. kohdat Vasta-aiheet ja Varoitukset ja käyttöön liittyvät varotoimet). Tästä syystä Midiana-valmistetta käyttävien on vaihdettava toiseen ehkäisymenetelmään (esim. pelkkää progestiinia sisältävään tai hormonittomaan ehkäisymenetelmään) ennen kyseisen yhdistelmähoidon aloittamista. Midiana-valmisteen käyttö voidaan aloittaa uudelleen 2 viikon kuluttua yhdistelmähoidon päättymisestä.
- Muut yhteisvaikutukset
Drospirenonin ja ACE:n estäjien tai tulehduskipulääkkeiden samanaikaisen käytön ei havaittu vaikuttavan merkitsevästi seerumin kaliumpitoisuuteen potilailla, jotka eivät sairasta munuaisten vajaatoimintaa. Drospirenonin/etinyyliestradiolin samanaikaista käyttöä aldosteroniantagonistien tai kaliumia säästävien diureettien kanssa ei ole kuitenkaan tutkittu. Tällaisissa tilanteissa seerumin kaliumpitoisuutta on syytä seurata ensimmäisen hoitosyklin aikana. Ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet.
- Laboratoriokokeet
Steroidiehkäisyn käyttö voi vaikuttaa eräisiin laboratoriokoetuloksiin, kuten maksan, kilpirauhasen, lisämunuaisten ja munuaisten biokemiallisiin parametreihin, (kantaja)proteiinien (esim. kortikosteroideja sitova globuliini ja lipidi/lipoproteiinifraktiot) pitoisuuksiin plasmassa, hiilihydraattiaineenvaihdunnan parametreihin ja veren hyytymis- ja fibrinolyysiparametreihin. Muutokset pysyvät yleensä viitealueella. Drospirenoni aiheuttaa plasman reniiniaktiivisuuden ja aldosteronin lisääntymistä lievän antimineralokortikoidiaktiivisuutensa seurauksena.
Raskaus ja imetys
Raskaus
Midiana-valmistetta ei saa käyttää raskauden aikana.
Jos nainen tulee raskaaksi drospirenonin/etinyyliestradiolin käytön aikana, valmisteen käyttö pitää lopettaa heti. Laajojen epidemiologisten tutkimusten mukaan synnynnäisten kehityshäiriöiden riski ei ole kuitenkaan suurentunut ennen raskautta yhdistelmäehkäisytabletteja käyttäneiden naisten lapsilla, kuten ei myöskään teratogeenisten vaikutusten riski silloin, kun yhdistelmäehkäisytabletteja on käytetty tahattomasti raskauden aikana.
Eläinkokeissa on havaittu tiineys- ja imetysaikana esiintyviä haittavaikutuksia (ks. kohta Prekliiniset tiedot turvallisuudesta). Eläinkokeiden perusteella vaikuttavien aineiden hormonivaikutusten aiheuttamia haittavaikutuksia ei voida sulkea pois. Yhdistelmäehkäisytablettien raskaudenaikaisesta käytöstä saadun kokemuksen mukaan ei kuitenkaan ole todettu, että niillä olisi varsinaisia ihmiseen kohdistuvia haittavaikutuksia.
Tähän mennessä drospirenonin/etinyyliestradiolin raskauden aikaisesta käytöstä kertyneen tiedon perusteella ei voida tehdä päätelmiä drospirenonin/etinyyliestradiolin raskauteen tai sikiön tai vastasyntyneen terveyteen kohdistuvista haitallisista vaikutuksista. Relevantteja epidemiologisia tietoja ei vielä ole.
Kun Midiana-valmisteen käyttö aloitetaan uudelleen, on huomioitava, että laskimotromboembolian riski on suurentunut synnytyksen jälkeisenä aikana (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Imetys
Yhdistelmäehkäisytabletit saattavat vaikuttaa imetykseen, sillä ne voivat vähentää rintamaidon määrää ja muuttaa sen koostumusta. Siksi yhdistelmäehkäisytablettien käyttöä ei suositella ennen kuin lapsen imetys on lopetettu kokonaan. Pieniä määriä kontraseptiivisia steroideja ja/tai niiden metaboliitteja voi erittyä rintamaitoon yhdistelmäehkäisytablettien käytön aikana. Näillä määrillä voi olla vaikutus lapseen.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Tutkimuksia valmisteen vaikutuksesta ajokykyyn ja koneiden käyttökykyyn ei ole tehty. Vaikutuksia ajokykyyn ja koneiden käyttökykyyn ei ole havaittu yhdistelmäehkäisytablettien käyttäjillä.
Haittavaikutukset
Vakavat haittavaikutukset yhdistelmäehkäisytablettien käyttäjillä, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Seuraavia haittavaikutuksia on raportoitu drospirenonin/etinyyliestradiolin (kuten esimerkiksi Midiana-valmisteen) käytön aikana:
Elinjärjestelmä | Haittavaikutusten yleisyys | |||
Yleinen | Melko harvinainen | Harvinainen | Tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin) | |
Immuunijärjestelmä | yliherkkyys, astma | perinnöllisen ja hankinnaisen angioedeeman oireiden paheneminen | ||
Psyykkiset häiriöt | masentuneisuus | libidon heikkeneminen, | ||
Hermosto | päänsärky |
| ||
Kuulo ja tasapainoelin | huonokuuloisuus | |||
Verisuonisto | migreeni | hypertensio, hypotensio | laskimotromboembolia, | |
Ruoansulatuselimistö | pahoinvointi | oksentelu, | ||
Iho ja ihonalainen kudos |
| akne, | erythema nodosum, | |
Sukupuolielimet ja rinnat | kuukautiskierron häiriöt, | rintojen suurentuminen, | eritevuoto rinnoista | |
Yleisoireet ja antopaikassa todettavat haitat |
| nesteen kertyminen, |
| |
Tiettyjen haittavaikutusten kuvaus
Yhdistelmäehkäisyvalmisteita käyttävillä naisilla on havaittu valtimoiden ja laskimoiden tromboottisten ja tromboembolisten tapahtumien lisääntynyt riski. Näitä tapahtumia ovat mm. sydäninfarkti, aivohalvaus, ohimenevät aivoverenkiertohäiriöt (TIA), laskimoveritulppa ja keuhkoembolia. Tapahtumia kuvataan tarkemmin kohdassa Varoitukset ja käyttöön liittyvät varotoimet.
Seuraavia vakavia haittatapahtumia on havaittu yhdistelmäehkäisytabletteja käyttävillä naisilla, ja niistä on kerrottu kohdassa Varoitukset ja käyttöön liittyvät varotoimet:
- Laskimotromboemboliset tapahtumat
- Valtimotromboemboliset tapahtumat
- Hypertensio
- Maksakasvaimet
- Seuraavien tilojen ilmenemisen tai pahenemisen yhteyttä yhdistelmäehkäisytablettien käyttöön ei ole osoitettu varmasti: Crohnin tauti, haavainen paksusuolitulehdus, epilepsia, kohdun myooma, porfyria, systeeminen lupus erythematosus, herpes gestationis, Sydenhamin korea, hemolyyttis-ureeminen oireyhtymä, kolestaattinen ikterus
- Maksaläiskät
- Yhdistelmäehkäisytablettien käytön keskeyttäminen saattaa olla tarpeen akuuteissa tai kroonisissa maksan toimintahäiriöissä, kunnes maksa-arvot ovat normalisoituneet.
- Eksogeeniset estrogeenit voivat indusoida tai pahentaa perinnöllisen ja hankinnaisen angioedeeman oireita.
Yhdistelmäehkäisytablettien käyttäjillä rintasyöpädiagnoosien esiintyvyys on hieman suurentunut. Rintasyöpä on harvinainen alle 40-vuotiailla naisilla, joten rintasyöpädiagnoosien ylimäärä on pieni verrattuna rintasyövän kokonaisriskiin. Sen syy-yhteyttä yhdistelmäehkäisytablettien käyttöön ei tunneta. Lisätietoja, ks. kohta Vasta-aiheet ja Varoitukset ja käyttöön liittyvät varotoimet.
Yhteisvaikutukset
Muiden lääkkeiden (entsyymi-indusorien) ja yhdistelmäehkäisytablettien yhteisvaikutukset voivat aiheuttaa läpäisyvuotoja ja/tai ehkäisyn pettämisen (ks. kohta Yhteisvaikutukset).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 Fimea
Yliannostus
Midiana-valmisteen yliannostuksesta ei ole toistaiseksi kokemusta. Muiden yhdistelmäehkäisytablettien käyttöön liittyvän kokemuksen perusteella mahdollisia oireita tässä tapauksessa ovat pahoinvointi, oksentelu ja tyhjennysvuoto. Tyhjennysvuotoa voi myös esiintyä tytöillä ennen menarkea, jos he ovat vahingossa ottaneet lääkevalmistetta. Antidoottia ei ole, ja lisähoidon tulee olla oireenmukaista.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: progestageenit ja estrogeenit, kiinteät yhdistelmävalmisteet
ATC-koodi: G03AA12
Pearlin luku menetelmän epäonnistumisen suhteen: 0,09 (kaksitahoisen 95 % luottamusvälin yläraja: 0,32).
Pearlin kokonaisluku (menetelmän virhearvo + potilaan virhearvo): 0,57 (kaksitahoisen 95 % luottamusvälin yläraja: 0,90).
Vaikutusmekanismi
Midiana-tablettien ehkäisyteho perustuu monen eri tekijän yhteisvaikutukseen. Näistä tärkeimpiä ovat ovulaation estyminen ja kohdun limakalvon muutokset.
Midiana on yhdistelmäehkäisytabletti, joka sisältää etinyyliestradiolia ja drospirenonia (progestageeni). Terapeuttisella drospirenoniannoksella on myös antiandrogeenisia ja lievästi antimineralokortikoidisia ominaisuuksia. Sillä ei ole estrogeenista, glukokortikoidista eikä antiglukokortikoidista vaikutusta. Drospirenonin farmakologinen profiili muistuttaa hyvin paljon luonnollista progesteronia.
Kliinisten tutkimusten perusteella on viitteitä siitä, että drospirenonin lievästi antimineralokortikoidisten ominaisuuksien seurauksena valmisteella on lievä antimineralokortikoidinen vaikutus.
Farmakokinetiikka
- Drospirenoni
Imeytyminen
Suun kautta otettu drospirenoni imeytyy nopeasti ja lähes täydellisesti. Huippupitoisuus seerumissa (noin 38 ng/ml) saavutetaan 1–2 tunnissa kerta-annoksen ottamisen jälkeen. Drospirenonin biologinen hyötyosuus on 76–85 %. Samanaikaisella aterioinnilla ei ole vaikutusta drospirenonin hyötyosuuteen.
Jakautuminen
Suun kautta otetun drospirenonin pitoisuus seerumissa laskee kahdessa vaiheessa terminaalisen puoliintumisajan ollessa 31 tuntia. Drospirenoni sitoutuu seerumin albumiiniin. Se ei sitoudu sukupuolihormonia sitovaan globuliiniin (SHBG) eikä kortikoidia sitovaan globuliiniin (CBG). Vain 3–5 % drospirenonin kokonaismäärästä seerumissa esiintyy vapaana steroidina. Etinyyliestradiolin indusoima SHBG-pitoisuuden nousu ei vaikuta drospirenonin sitoutumiseen seerumin proteiineihin. Drospirenonin jakautumistilavuus on keskimäärin 3,7 ± 1,2 l/kg.
Biotransformaatio
Suun kautta otettu drospirenoni metaboloituu hyvin suuressa määrin. Sen päämetaboliitit plasmassa ovat drospirenonihappo, joka muodostuu laktonirenkaan avautumisen jälkeen, ja 4,5-dihydro-drospirenoni-3-sulfaatti, joka muodostuu pelkistymisen ja sitä seuraavan sulfaation seurauksena. Lisäksi CYP3A4 katalysoi drospirenonin oksidatiivista metaboliaa.
Drospirenoni voi estää heikosti tai kohtalaisesti CYP450-entsyymejä CYP1A1, CYP2C9, CYP2C19 ja CYP3A4 in vitro.
Eliminaatio
Drospirenonin metabolinen puhdistuma seerumissa on 1,5 ± 0,2 ml/min/kg. Muuttumatonta lääkeainetta ei juuri erity. Drospirenonin metaboliitit erittyvät ulosteeseen ja virtsaan suhteessa 1,2:1,4. Metaboliittien virtsaan ja ulosteeseen erittymisen puoliintumisaika on noin 40 tuntia.
Vakaa tila
Hoitosyklin aikana drospirenonin vakaan tilan huippupitoisuus seerumissa (noin 70 ng/ml) saavutetaan noin 8 päivän hoidon jälkeen. Drospirenonin terminaalisen puoliintumisajan ja valmisteen antovälin suhteen takia drospirenonin pitoisuus seerumissa kumuloituu noin 3-kertaiseksi.
Erityisryhmät
Munuaisten vajaatoiminta
Vakaan tilan drospirenonipitoisuus seerumissa lievää munuaisten vajaatoimintaa sairastavilla (kreatiniinipuhdistuma 50–80 ml/min) oli verrattavissa tilanteeseen naisilla, joilla munuaistoiminta oli normaalia. Drospirenonipitoisuus seerumissa oli noin 37 % korkeampi keskivaikeaa munuaisten vajaatoimintaa sairastavilla (kreatiniinipuhdistuma 30–50 ml/min) naisilla verrattuna naisiin, joilla munuaistoiminta oli normaalia. Myös lievää tai keskivaikeaa munuaisten vajaatoimintaa sairastavat naiset sietivät drospirenonihoitoa hyvin. Drospirenonihoidolla ei ollut kliinisesti merkitseviä vaikutuksia seerumin kaliumpitoisuuteen.
Maksan vajaatoiminta
Kerta-annostutkimuksessa keskivaikeaa maksan vajaatoimintaa sairastavilla vapaaehtoisilla havaittiin noin 50 % lasku oraalisessa puhdistumassa verrattuna vapaaehtoisiin, joilla maksatoiminta oli normaalia. Havaitun drospirenonipuhdistuman pienenemisen keskivaikeaa maksan vajaatoimintaa sairastavilla vapaaehtoisilla ei todettu johtavan mihinkään olennaiseen eroon seerumin kaliumpitoisuuksissa. Kaliumpitoisuuden suurenemista seerumissa yli viitealueen ylärajan ei myöskään havaittu diabeteksen ja samanaikaisen spironolaktonihoidon yhteydessä (kaksi tekijää, jotka voivat altistaa hyperkalemialle). Voidaan todeta, että drospirenoni on hyvin siedetty potilailla, joilla on lievä tai keskivaikea maksan vajaatoiminta (Child–Pugh B).
Etniset ryhmät
Drospirenonin tai etinyyliestradiolin farmakokinetiikassa ei ole havaittu kliinisesti merkittäviä eroja japanilaisten ja valkoihoisten naisten välillä.
- Etinyyliestradioli
Imeytyminen
Suun kautta otettu etinyyliestradioli imeytyy nopeasti ja täydellisesti. 30 µg annoksen ottamisen jälkeen huippupitoisuus plasmassa (100 pg/ml) saavutetaan 1–2 tunnissa. Etinyyliestradioli käy läpi laajan ensikierron maksametabolian. Metabolia vaihtelee suuresti yksilöstä toiseen. Absoluuttinen biologinen hyötyosuus on noin 45 %.
Jakautuminen
Etinyyliestradiolin näennäinen jakautumistilavuus on 5 l/kg ja sitoutuminen plasman proteiineihin noin 98 %. Etinyyliestradioli indusoi SHBG:n ja CBG:n maksasynteesiä. Etinyyliestradiolin (30 µg/vrk) käytön aikana SHBG:n pitoisuus plasmassa nousee arvosta 70 nmol/l noin arvoon 350 nmol/l.
Pieniä määriä etinyyliestradiolia erittyy rintamaitoon (0,02 % annoksesta).
Biotransformaatio
Etinyyliestradiolin ensikierron metabolia suolessa ja maksassa on merkittävää. Etinyyliestradioli metaboloituu pääasiassa aromaattisen hydroksylaation kautta, mutta siitä muodostuu monia erilaisia hydroksyloituneita ja metyloituneita metaboliitteja, jotka esiintyvät vapaina metaboliitteina ja konjugoituneina glukuronidien ja sulfaattien kanssa. Etinyyliestradiolin metaboliateitse tapahtuvan puhdistuman nopeus on noin 5 ml/min/kg.
In vitro etinyyliestradioli on CYP2C19-, CYP1A1- ja CYP1A2-entsyymien reversiibeli estäjä sekä CYP3A4/5-, CYP2C8- ja CYP2J2-entsyymien mekanismiin perustuva estäjä.
Eliminaatio
Etinyyliestradioli ei erity merkitsevässä määrin muuttumattomassa muodossa. Etinyyliestradiolin metaboliitit erittyvät virtsaan ja sappeen suhteessa 4:6, ja niiden eliminaation puoliintumisaika on noin 1 vuorokausi. Eliminaation puoliintumisaika on 20 tuntia.
Vakaa tila
Vakaa tila saavutetaan hoitosyklin jälkipuoliskolla, ja etinyyliestradiolipitoisuus seerumissa kumuloituu 1,4–2,1-kertaiseksi.
Prekliiniset tiedot turvallisuudesta
Koe-eläimillä drospirenonin ja etinyyliestradiolin vaikutukset rajoittuivat niihin, jotka liittyvät tunnettuun farmakologiseen vaikutukseen. Erityisesti lisääntymistoksikologisissa tutkimuksissa eläimillä havaittiin lajispesifisiä alkio- ja sikiötoksisia vaikutuksia. Drospirenonin ja etinyyliestradiolin käyttäjien altistusta suurempien drospirenonialtistusten havaittiin vaikuttavan sukupuolen eriytymiseen rottien sikiöillä, mutta ei apinoilla.
Farmaseuttiset tiedot
Apuaineet
Tabletin ydin: laktoosimonohydraatti, esigelatinoitu maissitärkkelys, maissitärkkelys, povidoni K-25, magnesiumstearaatti
Kalvopäällyste: polyvinyylialkoholi, titaanidioksidi (E171), talkki (E553b), makrogoli 3 350, lesitiini (soija)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
2 vuotta
Säilytys
Säilytä alle 30 °C. Säilytä alkuperäispakkauksessa. Herkkä valolle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
MIDIANA tabletti, kalvopäällysteinen
0,03/3 mg (L:kyllä) 3 x 21 fol (24,74 €)
PF-selosteen tieto
Midiana 0,03 mg / 3 mg kalvopäällysteiset tabletit on pakattu PVC/PVDC/alumiini-läpipainopakkaukseen.
Läpipainopakkaukset on pakattu pahvikoteloon. Jokaisessa kotelossa on säilytyspussi.
Pakkauskoot:
21 kalvopäällysteistä tablettia
3 × 21 kalvopäällysteistä tablettia
6 × 21 kalvopäällysteistä tablettia
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Valkoinen tai luonnonvalkoinen, pyöreä, kaksoiskupera kalvopäällysteinen tabletti. Toisella puolella merkintä ”G63”, toisella puolella ei mitään merkintää.
Käyttö- ja käsittelyohjeet
Ei erityisvaatimuksia.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
MIDIANA tabletti, kalvopäällysteinen
0,03/3 mg 3 x 21 fol
- Ei korvausta.
ATC-koodi
G03AA12
Valmisteyhteenvedon muuttamispäivämäärä
30.01.2023
Yhteystiedot
Barnhusgatan 22, 5tr
111 23 Stockholm
Sweden
+358105793700
medinfo.fi@gedeonrichter.eu
