BUCCOLAM munhålelösning 2,5 mg, 5 mg, 7,5 mg, 10 mg
Kvalitativ och kvantitativ sammansättning
BUCCOLAM 2,5 mg munhålelösning
Varje förfylld spruta för oral användning innehåller 2,5 mg midazolam (som hydroklorid) i 0,5 ml lösning
BUCCOLAM 5 mg munhålelösning
Varje förfylld spruta för oral användning innehåller 5 mg midazolam (som hydroklorid) i 1 ml lösning
BUCCOLAM 7,5 mg munhålelösning
Varje förfylld spruta för oral användning innehåller 7,5 mg midazolam (som hydroklorid) i 1,5 ml lösning
BUCCOLAM 10 mg munhålelösning
Varje förfylld spruta för oral användning innehåller 10 mg midazolam (som hydroklorid) i 2 ml lösning
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Munhålelösning.
Kliniska uppgifter
Terapeutiska indikationer
Behandling av långvariga, akuta krampanfall hos spädbarn, småbarn från 3 månader till vuxna.
BUCCOLAM får endast användas av föräldrar/vårdare till patient som har fått diagnosen epilepsi.
För spädbarn i åldern 3–6 månader ska behandling ske i sjukhusmiljö där övervakning är möjlig och återupplivningsutrustning finns tillgänglig. Se avsnitt Dosering och administreringssätt.
Villkor
BUCCOLAM liuos suuonteloon
2,5 mg 4 x 0,5 ml
- Hoito 3-6 kuukauden ikäisille imeväisikäisille tulee antaa sairaalaoloissa, joissa tarkkailu on mahdollista ja elvytysvälineistö saatavilla.
Dosering och administreringssätt
Dosering
Standarddoser anges nedan:
| Åldersintervall | Dos | Etikettfärg |
| 3 till 6 månader (sjukhusmiljö) | 2,5 mg | Gul |
| > 6 månader till < 1 år | 2,5 mg | Gul |
| 1 år till < 5 år | 5 mg | Blå |
| 5 år till < 10 år | 7,5 mg | Lila |
| 10 år till vuxna | 10 mg | Orange |
Vårdaren ska endast administrera en enda dos av midazolam. Om anfallet inte upphör inom tio minuter efter administreringen av midazolam måste vårdaren söka akut medicinsk hjälp och visa upp den tomma sprutan för hälso- och sjukvårdspersonalen som information om vilken dos patienten har fått.
Vid förnyade anfall efter en första behandling skall en andra eller upprepad dos endast ges efter kontakt med medicinsk rådgivning (se avsnitt Farmakokinetiska egenskaper).
För patienter med ökad risk för andningsdepression från bensodiazepiner, bör man överväga att administrera BUCCOLAM under övervakning av hälso- och sjukvårdspersonal innan behandling med BUCCOLAM påbörjas. Administreringen kan ske i frånvaro av ett anfall.
Specialpopulationer
Nedsatt njurfunktion
Någon dosjustering behövs inte, men BUCCOLAM ska användas med försiktighet till patienter med kronisk njursvikt eftersom elimineringen av midazolam kan fördröjas och effekterna av läkemedlet förlängas (se avsnitt Varningar och försiktighet).
Nedsatt leverfunktion
Nedsatt leverfunktion minskar clearance för midazolam, vilket leder till en ökning i den terminala halveringstiden. Av denna anledning kan de kliniska effekterna bli starkare och mer långvariga. Följaktligen rekommenderas en omsorgsfull övervakning av kliniska effekt och vitala tecken efter administrering av midazolam till patienter med nedsatt leverfunktion (se avsnitt Varningar och försiktighet).
BUCCOLAM är kontraindicerat för patienter med svårt nedsatt leverfunktion (se avsnitt Kontraindikationer).
Pediatrisk population
Säkerhet och effekt för midazolam för barn i åldern 0 till 3 månader har inte fastställts. Inga data finns tillgängliga.
Äldre
Äldre är känsligare för effekten av bensodiazepiner. Hos äldre patienter (≥ 60 år) ska BUCCOLAM användas med försiktighet.
Administreringssätt
BUCCOLAM är avsett för användning i munhålan. Hela mängden lösning sprutas in långsamt i mellanrummet mellan tandköttet och kindens insida. Laryngo-trakeal insprutning ska undvikas för att förhindra oavsiktlig aspiration av lösningen. Om det behövs (för större volymer och/eller yngre patienter) ska cirka hälften av dosen först ges långsamt i ena sidan av munhålan och sedan resterande dos i andra sidan.
Ingående anvisningar om administrering av läkemedlet finns i avsnitt Särskilda anvisningar för destruktion och övrig hantering.
Försiktighetsåtgärder före hantering eller administrering av läkemedlet
Anslut inte någon kanyl, intravenösa slangar eller annan utrustning för parenteral administrering till sprutan för oral användning.
BUCCOLAM är ej avsett för intravenös användning.
Ta av hatten på sprutan för oral användning före användning för att undvika kvävningsrisk.
Kontraindikationer
Överkänslighet mot den aktiva substansen, bensodiazepiner eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen.
Myasthenia gravis
Svår andningsinsufficiens
Sömnapnésyndrom
Svårt nedsatt leverfunktion
Varningar och försiktighet
Särskild försiktighet ska iakttas vid administrering av midazolam till högriskpatienter:
• vuxna patienter över 60 år
• kroniskt sjuka eller försvagade patienter, t.ex.:
• patienter med kronisk andningssvikt
• patienter med kronisk njursvikt, nedsatt leverfunktion eller nedsatt hjärtfunktion
• pediatriska patienter med kardiovaskulär instabilitet.
Dessa högriskpatienter kan behöva lägre doser.
Andningsinsufficiens
Midazolam ska användas med försiktighet till patienter med kronisk andningsinsufficiens eftersom midazolam kan dämpa andningen ytterligare.
Pediatriska patienter i åldern 3 till 6 månader
Med tanke på de högre halterna av metaboliter i förhållande till moderläkemedlet hos yngre barn kan en fördröjd andningsdepression som ett resultat av högre aktiva metabolitkoncentrationer hos patienter i åldersgruppen 3–6 månader inte uteslutas. Därför ska användningen av BUCCOLAM på patienter i åldersgruppen 3–6 månader begränsas till att endast ske under övervakning av vårdpersonal med tillgång till återupplivningsutrustning, möjlighet att övervaka andningsfunktionen och, om nödvändigt, med tillgång till andningsstöd.
Förändrad elimination av midazolam
Midazolam ska användas med försiktighet på patienter med kronisk njursvikt, nedsatt leverfunktion eller nedsatt hjärtfunktion. Midazolam kan ansamlas hos patienter med kronisk njursvikt eller nedsatt leverfunktion medan det kan orsaka försämrad midazolamclearance hos patienter med nedsatt hjärtfunktion.
Samtidig användning med andra bensodiazepiner
Försvagade patienter är mer utsatta för effekterna av bensodiazepiner på det centrala nervsystemet (CNS) och kan därför behöva lägre doser.
Alkohol- eller drogmissbruk i anamnes
Midazolam ska undvikas till patienter med alkohol- eller drogmissbruk i anamnesen.
Amnesi
Midazolam kan framkalla anterograd amnesi.
Hjälpämnen
Natrium
Detta läkemedel innehåller mindre än 1 mmol (23 mg) natrium per oral doseringsspruta, d.v.s. är näst intill “natriumfritt”.
Interaktioner
Midazolam metaboliseras av CYP3A4. Hämmare och inducerare av CYP3A4 har potentialen att öka respektive minska plasmakoncentrationerna och därmed effekterna av midazolam, vilket kräver motsvarande dosjusteringar. Farmakokinetiska interaktioner med CYP3A4-hämmare eller -inducerare är mer uttalade för oralt midazolam jämfört med midazolam som ges som munhålelösning eller parenteralt eftersom CYP3A4-enzymer även förkommer i den övre magtarmkanalen. Vid administrering via munhålan påverkas endast systemisk clearance. Efter en enstaka dos av midazolam som munhålelösning är följden för den maximala kliniska effekten på grund av CYP3A4-hämning liten men effekten kan sitta i längre. Följaktligen rekommenderas en omsorgsfull övervakning av de kliniska effekterna på och de vitala tecknen för patienten i samband med användning av midazolam med en a CYP3A4-hämmare, även efter en enstaka dos.
Anestetika och narkotiska analgetika
Fentanyl kan reducera clearance av midazolam.
Antiepileptika
Samadministrering med midazolam kan orsaka ökad sedering eller respiratorisk eller kardiovaskulär depression. Midazolam kan interagera med andra läkemedel som metaboliseras i levern, t.ex. fenytoin, vilket förstärker effekten.
Kalciumkanalblockerare
Diltiazem och verapamil har visat sig reducera clearance av midazolam och andra bensodiazepiner och kan förstärka deras verkan.
Magsårsläkande läkemedel
Cimetidin, ranitidin och omeprazol har visat sig reducera clearance av midazolam och andra bensodiazepiner och kan förstärka deras verkan.
Xantiner
Metabolismen av midazolam och andra bensodiazepiner accelereras av xantiner.
Dopaminerga läkemedel
Midazolam kan hämma levodopa.
Muskelavslappnande medel
T.ex. baklofen. Midazolam kan förstärka effekterna av muskelavslappnande medel, med ökade CNS-depressiva effekter.
Nabilon
Samadministrering med midazolam kan orsaka ökad sedering eller respiratorisk och kardiovaskulär depression.
Läkemedel som hämmar CYP3A4
Läkemedelsinteraktioner efter administrering av midazolam som munhålelösning är sannolikt likartade med de som ses efter intravenöst midazolam snarare än efter oral administrering.
Mat
Grapefruktjuice minskar clearance av midazolam och förstärker dess verkan.
Azoler mot svamp
Ketokonazol ökade plasmakoncentrationerna av intravenöst midazolam femfaldigt medan den terminala halveringstiden ökade ungefär trefaldigt.
Vorikonazol ökade exponeringen av intravenöst midazolam trefaldigt medan dess elimineringshalveringstid ökade ungefär trefaldigt.
Flukonazol och itrakonazol ökade båda plasmakoncentrationerna av intravenöst midazolam två‑ till trefaldigt i samband med en 2,4‑faldig ökning av den terminala halveringstiden för itrakonazol och en 1,5‑faldig ökning för flukonazol.
Posakonazol ökade plasmakoncentrationerna av intravenöst midazolam ungefär tvåfaldigt.
Makrolidantibiotika
Erytromycin resulterade i en ungefär 1,6‑ till 2‑faldig ökning av plasmakoncentrationerna av intravenöst midazolam i samband med en 1,5‑ till 1,8‑faldig ökning av den terminala halveringstiden av midazolam.
Claritromycin ökade plasmakoncentrationerna av intravenöst midazolam upp till 2,5‑faldigt i samband med en 1,5‑ till tvåfaldig ökning av den terminala halveringstiden.
HIV-proteashämmare
Samadministrering med proteashämmare (t.ex. saquinavir och andra HIV-proteashämmare) kan ge upphov till en stor koncentrationsökning av midazolam. Vid samadministrering med ritonavirförstärkt lopinavir ökade plasmakoncentrationerna av intravenöst midazolam 5,4‑faldigt, i samband med en likartad ökning av den terminala halveringstiden.
Kalciumkanalblockerare
En enstaka dos av diltiazem ökade plasmakoncentrationerna av intravenöst midazolam med cirka 25 % och den terminala halveringstiden förlängdes med 43 %.
Olika läkemedel
Atorvastatin visade en 1,4‑faldig ökning av plasmakoncentrationerna av intravenöst midazolam jämfört med kontrollgruppen.
Läkemedel som inducerar CYP3A4
Rifampicin
7 dagar med 600 mg en gång dagligen minskade plasmakoncentrationerna av intravenöst midazolam med cirka 60 %. Den terminala halveringstiden minskade med cirka 50–60 %.
Örter
Johannesört minskade plasmakoncentrationerna av midazolam med cirka 20‑40 %, vilket förknippades med en minskning av den terminala halveringstiden på cirka 15‑17 %. Den CYP3A4-inducerande effekten kan variera beroende på det specifika johannesörtextraktet.
Farmakodynamiska interaktioner mellan läkemedel (Drug-Drug Interactions, DDI)
Samadministreringen av midazolam med andra sedativa/hypnotiska läkemedel och CNS-depressorsubstanser, inklusive alkohol, leder sannolikt till ökad sedering och andningsdepression.
I exemplen ingår opiatderivat (som används som smärtstillande, hostdämpande eller substitutionsbehandlingar), antipsykotiska medel, andra bensodiazepiner som används som ångestdämpande medel eller sömnmedel, barbiturater, propofol, ketamin, etomidat; sederande antidepressiva medel, ej aktuella H1-antihistaminer och centralt verkande blodtryckssänkande läkemedel.
Alkohol (inklusive läkemedel som innehåller alkohol) kan markant öka den sedativa effekten av midazolam. Alkoholintag ska undvikas helt vid midazolamadministrering (se avsnitt Varningar och försiktighet).
Midazolam minskar den minsta alveolära koncentrationen (MAC) av inhalationsanestetika.
Effekten av CYP3A4-hämmare kan vara större hos spädbarn eftersom en del av munhåledosen sannolikt sväljs och absorberas i magtarmkanalen.
Fertilitet, graviditet och amning
Graviditet
Det finns inga eller begränsad mängd data från användningen av midazolam i gravida kvinnor.
Djurstudier visar inte någon teratogen effekt avseende reproduktionstoxicitet, men fostertoxicitet har observerats hos människa liksom för andra bensodiazepiner. Det finns inga data om exponerade graviditeter tillgängliga för graviditetens första två trimestrar.
Administreringen av höga doser midazolam under graviditetens sista trimester eller under förlossningen har rapporterats framkalla biverkningar hos modern eller fostret/barnet (risk för inhalation av vätska och maginnehåll under moderns förlossningsarbete, oregelbunden hjärtfrekvens hos fostret, minskad tonus, dålig sugförmåga, hypotermi och andningsdepression hos det nyfödda barnet).
Midazolam kan användas under graviditet om det är kliniskt nödvändigt. Risken för nyfödda barn ska tas med i beräkningen om midazolam administreras under graviditetens tredje trimester.
Amning
Midazolam utsöndras i låga kvantiteter (0,6 %) i bröstmjölk. Därför är det eventuellt inte nödvändigt att avbryta amningen efter en enstaka dos av midazolam.
Fertilitet
Djurstudier påvisade ingen nedsatt fertilitet (se avsnitt Prekliniska säkerhetsuppgifter).
Effekter på förmågan att framföra fordon och använda maskiner
Midazolam har påtaglig effekt på förmågan att framföra fordon och använda maskiner.
Sedering, amnesi, nedsatt uppmärksamhet och nedsatt muskelfunktion kan ha en negativ inverkan på förmågan att framföra fordon, cykla eller använda maskiner. Efter att ha fått midazolam ska patienten varnas för att framföra fordon eller använda maskiner tills han/hon har återhämtat sig helt.
Biverkningar
Summering av säkerhetsprofilen
Publicerade kliniska studier visar att midazolam administrerades som munhålelösning till cirka 443 barn med kramper. Andningsdepression inträffar med en frekvens på upp till 5 %. Detta är dock en känd komplikation i samband med krampanfall och även förknippad med midazolamanvändning. En episod av klåda sattes möjligen i samband med buckal användning av midazolam.
Tabell över biverkningar
I nedanstående tabell förtecknas de biverkningar som i kliniska studier och efter marknadsintroduktion har rapporterats förekomma vid administrering av midazolam som munhålelösning till barn.
Biverkningarnas frekvens klassificeras enligt nedan:
Vanliga: ≥ 1/100, < 1/10
Mindre vanliga ≥ 1/1 000, < 1/100
Mycket sällsynta < 1/10 000
Ingen känd frekvens: kan inte beräknas från tillgängliga data
Inom respektive frekvensområde presenteras biverkningarna efter fallande allvarlighetsgrad:
Klassificering av organsystem | Frekvens: Läkemedelsbiverkning |
Psykiska störningar | Mycket sällsynta: Aggression**, agitation**, ilska**, förvirringstillstånd**, euforisk sinnesstämning**, hallucinationer**, fientlighet**, rörelsestörningar**, våldsamhet**. |
Centrala och perifera nervsystemet | Vanliga: Sedering, sömnighet, nedsatt medvetandenivå, andningsdepression Mycket sällsynta: Anterograd amnesi**, ataxi**, yrsel**, huvudvärk**, kramper**, paradoxala reaktioner**. |
Hjärtat | Mycket sällsynta: Bradykardi**, hjärtstillestånd**, hypotension**, vasodilatation**. |
Andningsvägar, bröstkorg och mediastinum | Mycket sällsynta: Apné**, dyspné**, laryngospasm**, andningsstillestånd**. |
Magtarmkanalen | Vanliga: Illamående och kräkningar Mycket sällsynta: Förstoppning**, muntorrhet**. |
Hud och subkutan vävnad | Mindre vanliga: Klåda, utslag och urtikaria Ingen känd frekvens: Angioödem* |
Allmänna symtom och/eller symtom vid administreringsstället | Mycket sällsynta: Trötthet**, hicka**. |
**Dessa biverkningar har rapporterats förekomma när midazolam injiceras på barn och/eller vuxna, vilket kan vara relevant för administrering som munhålelösning.
*Läkemedelsbiverkningen identifierades efter marknadsintroduktion.
Beskrivning av utvalda biverkningar
En ökad risk för fall och frakturer har noterats bland äldre bensodiazepinanvändare.
Risken för livshotande incidenter är större hos patienter med befintlig andningsinsufficiens eller nedsatt hjärtfunktion, i synnerhet vid administrering av höga doser (se avsnitt Varningar och försiktighet).
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till.
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Symtom
En midazolamöverdos kan vara livshotande, om patienten har en befintlig andnings- eller hjärtinsufficiens eller om läkemedlet kombineras med andra CNS-depressorsubstanser (inklusive alkohol).
Överdosering av bensodiazepiner tar sig vanligen uttryck i olika grader av depression i centrala nervsystemet, från dåsighet till koma. I lindriga fall omfattar symtomen dåsighet, förvirring och letargi. I mer allvarliga fall kan symtomen omfatta ataxi, minskad tonus, hypotension, andningsdepression, i sällsynta fall koma och i mycket sällsynta fall dödsfall.
Hantering
Vid hantering av överdosering av läkemedel ska det bäras i åtanke att flera medel kan ha tagits.
Efter en överdos av oral midazolam ska kräkning framkallas (inom en timme) om patienten är vid medvetande eller magsköljning utföras med luftvägarna skyddade om patienten är medvetslös. Om en magtömning inte bedöms vara till nytta ska aktivt kol ges för att hämma absorption. Vid intensivvård ska särskild uppmärksamhet fästas vid de respiratoriska och kardiovaskulära funktionerna.
Flumazenil kan vara användbart som antidot.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Sömnmedel och lugnande medel, bensodiazepinderivat ATC-kod: N05CD08.
Verkningsmekanism
Midazolam är ett derivat av gruppen imidazobensodiazepiner. Den fria basen är en lipofil substans med låg löslighet i vatten. Det basiska kvävet i position 2 i ringsystemet för imidazobensodiazepin gör det möjligt för midazolam att bilda hydrokloridsalter med syror. Dessa producerar en stabil lösning som lämpar sig för administrering i munhålan.
Farmakodynamiska effekter
Den farmakologiska verkan av midazolam kännetecknas av kort varaktighet på grund av snabb metabol omvandling. Midazolam har en kramplösande effekt. Det har dessutom en sederande och sömngivande effekt med uttalad intensitet, samt en ångestdämpande och muskelavslappnande effekt.
Klinisk effekt och säkerhet
I fyra studier med kontroller i form av rektalt diazepam och en studie med jämförelse med intravenöst diazepam, med totalt 688 barn, observerades att synliga tecken på kramper avtog inom tio minuter hos 65 % till 78 % av barnen som fick midazolam som munhålelösning. I två av studierna observerades dessutom att synliga tecken på kramper avtog inom tio minuter utan att återkomma inom en timme efter administrering hos 56 % till 70 % av barnen. Frekvensen och allvarlighetsgraden i de läkemedelsbiverkningar som har rapporterats för midazolam som munhålelösning i publicerade kliniska tester är likartade de läkemedelsbiverkningar som har rapporterats i jämförelsegruppen som använde rektalt diazepam.
Europeiska läkemedelsmyndigheten har beviljat undantag från kravet att skicka in studieresultat för BUCCOLAM för gruppen av den pediatriska populationen < 3 månader på grundvalen att det specifika läkemedlet inte ger signifikanta behandlingsfördelar jämfört med befintliga behandlingar för dessa pediatriska patienter.
Farmakokinetiska egenskaper
Simulerade farmakokinetiska parametrar för rekommenderad dos för barn i åldrarna 3 månader till under 18 år, baserat på en farmakokinetisk populationsstudie, samt farmakokinetiska parametrar för rekommenderad dos för vuxna, baserat på en biotillgänglighetsstudie hos friska vuxna, redovisas i tabellform nedan:
| Dos | Ålder | Parameter | Genomsnitt | Standardavvikelse |
| 2,5 mg | 3 mån. till< 1 år | AUC0–inf (ng.h/ml) | 168 | 98 |
| Cmax (ng/ml) | 104 | 46 | ||
| 5 mg | 1 år till < 5 år | AUC0–inf (ng.h/ml) | 242 | 116 |
| Cmax (ng/ml) | 148 | 62 | ||
| 7,5 mg | 5 år till < 10 år | AUC0–inf (ng.h/ml) | 254 | 136 |
| Cmax (ng/ml) | 140 | 60 | ||
| 10 mg | 10 år till < 18 år | AUC0–inf (ng.h/ml) | 189 | 96 |
| Cmax (ng/ml) | 87 | 44 | ||
| 10 mg | > 18 år | AUC0–inf (ng.h/ml) (n=22) | 259 | 62 |
| Cmax (ng/ml) (n=22) | 71 | 29 |
Simulerade farmakokinetiska parametrar för rekommenderad dos hos vuxna (ej äldre, ej överviktiga), baserat på en farmakokinetisk studie, föreslår att en dos på 10 mg hos alla vuxna leder till en liknande exponering som för alla pediatriska åldersgrupper vid deras motsvarande terapeutiska doser.
Absorption
Efter administrering som munhålelösning absorberas midazolam snabbt. Maximal plasmakoncentration uppnås inom 30 minuter. Den absoluta biotillgängligheten för midazolam som munhålelösning är cirka 75 % hos vuxna. Biotillgängligheten för midazolam som munhålelösning har uppskattats till 87 % hos barn med svår malaria och konvulsioner.
Distribution
Midazolam är höggradigt lipofilt och har en omfattande distribution. Steady state-volymen för distribution efter administrering som munhålelösning beräknas till 5,3 l/kg.
Cirka 96–98 % av midazolam binds till plasmaproteiner. Den största delen av plasmaproteinbindningen beror på albumin. Det sker en långsam och obetydlig passage av midazolam in i cerebrospinalvätskan. Hos människa har det visat sig att midazolam långsamt passerar placentan och går in i fostercirkulationen. Små mängder midazolam återfinns i bröstmjölk.
Metabolism
Midazolam elimineras nästan helt genom biotransformation. Andelen av dosen som extraheras av levern har beräknats till 30–60 %. Midazolam hydroxyleras av cytokrom P4503A4-isozymet och den primära urin- och plasmametaboliten är alfa-hydroxy-midazolam. Efter administrering som munhålelösning är AUC-kvoten för alfa-hydroxy-midazolam i förhållande till midazolam 0,46 hos barn och 0,28 hos vuxna.
En farmakokinetisk populationsstudie visar att metabolitnivåerna är högre hos yngre än äldre pediatriska patienter och är således av större betydelse hos barn än hos vuxna.
Eliminering
Plasmaclearance av midazolam hos barn efter administrering som munhålelösning är 30 ml/kg/min. De initiala och terminala elimineringshalveringstiderna är 27 respektive 204 minuter. Midazolam utsöndras främst via njurarna (60–80 % av den injicerade dosen) och återvinns som glukurokonjugerat alfa-hydroxy-midazolam. Mindre än 1 % av dosen återfinns i urinen som oförändrat läkemedel.
Farmakokinetik i särskilda populationer
Äldre
Exponeringen för midazolam efter administrering som munhålelösning hos vuxna mellan 60 och 70 år liknar den hos unga vuxna. Exponeringen hos äldre vuxna efter administrering som munhålelösning är okänd men kan vara ökad eftersom halveringstiden för eliminering kan vara upp till fyra gånger längre efter intravenös administrering.
Överviktiga
Den genomsnittliga halveringstiden för midazolam efter administrering som munhålelösning hos vuxna med ett BMI mellan 30 och 34 liknar den hos vuxna med ett BMI mellan 25 och 30 (8,4 respektive 5,5 timmar). Halveringstiden för vuxna med ett BMI över 34 är okänd men kan öka eftersom den genomsnittliga halveringstiden efter intravenös administrering är längre hos överviktiga än hos icke-överviktiga patienter (5,9 mot 2,3 timmar). Detta beror på en ökning på cirka 50 % i distributionsvolymen korrigerad för total kroppsvikt. Clearance är inte signifikant annorlunda hos överviktiga än hos icke-överviktiga patienter.
Nedsatt leverfunktion
Elimineringshalveringstiden hos cirrospatienter kan vara längre och clearance lägre jämfört med tiderna hos friska frivilliga försökspersoner (se avsnitt Varningar och försiktighet).
Nedsatt njurfunktion
Elimineringshalveringstiden hos patienter med kronisk njursvikt är likartad med tiden hos friska frivilliga försökspersoner.
Elimineringshalveringstiden för midazolam är förlängd upp till sex gånger hos kritiskt sjuka.
Hjärtinsufficiens
Elimineringshalveringstiden är längre hos patienter med kronisk hjärtsvikt jämfört med tiden hos friska frivilliga försökspersoner (se avsnitt Varningar och försiktighet).
Exponering efter en andra dos under samma krampanfall
Simulerade exponeringsdata visar att den total AUC-arean ungefär fördubblas när ytterligare en dos administreras 10, 30 eller 60 minuter efter den första dosen. En andra dos efter 10 minuter ger en signifikant ökning av genomsnittligt Cmax på mellan 1,7 och 1,9 gånger. Efter 30 respektive 60 minuter har det redan skett en signifikant eliminering av midazolam och därför är ökningen av genomsnittligt Cmax mindre uttalad: 1,3 till 1,6 respektive 1,2 till 1,5 gånger (se avsnitt Dosering och administreringssätt).
Etniskt ursprung
Kliniska prövningar har inkluderat patienter från japanska och icke-japanska grupper, och inga skillnader har identifierats i den farmakokinetiska profilen gällande exponering för BUCCOLAM.
Dosjusteringar är inte motiverade.
Prekliniska säkerhetsuppgifter
I en fertilitetsstudie på råttor där djuren fick upp till tio gånger den kliniska dosen iakttogs inga negativa effekter på fertiliteten.
Det finns inga andra prekliniska data som är relevanta för den förskrivande läkaren utöver de som redan ingår i andra avsnitt i produktresumén.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Natriumklorid
Vatten för injektioner
Saltsyra (för pH-reglering och omvandling av midazolam till hydrokloridsalt)
Natriumhydroxid (för pH-reglering)
Inkompatibiliteter
Ej relevant.
Hållbarhet
BUCCOLAM 2,5 mg munhålelösning
18 månader.
BUCCOLAM 5 mg, 7,5 mg, 10 mg munhålelösning
2 år
Särskilda förvaringsanvisningar
Förvara sprutan för oral användning i det skyddande plastfodralet.
Förvaras i skydd mot kyla. Får ej frysas.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
BUCCOLAM liuos suuonteloon
2,5 mg (L:ei) 4 x 0,5 ml (112,73 €)
5 mg (L:ei) 4 x 1 ml (112,73 €)
7,5 mg (L:ei) 4 x 1,5 ml (112,73 €)
10 mg (L:ei) 4 x 2 ml (112,73 €)
PF-selosteen tieto
Gul, förfylld nålfri spruta för oral användning (polypropylen) med kolv (polypropylen) och ändhatt (polyeten med hög densitet) förpackad i ett skyddande kapselfodral av plast.
| Styrka | Lösningsvolym | Sprutvolym | Åldersintervall | Etikettfärg |
| 2,5 mg | 0,5 ml | 1 ml | 3 mån. till < 1 år | Gul |
| 5 mg | 1 ml | 3 ml | 1 år till < 5 år | Blå |
| 7,5 mg | 1,5 ml | 3 ml | 5 år till < 10 år | Lila |
| 10 mg | 2 ml | 3 ml | 10 år till vuxna | Orange |
BUCCOLAM finns i två förpackningsstorlekar:
- Förpackningar med 2 förfyllda sprutor
- Förpackningar med 4 förfyllda sprutor.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Läkemedlets utseende:
Klar, färglös till gulaktig lösning.
pH 2,9 till 3,7.
Särskilda anvisningar för destruktion och övrig hantering
Administrering av BUCCOLAM
BUCCOLAM är ej avsett för intravenös användning.
Steg 1
 | Håll i plastfodralet och ta av hatten. Ta ut sprutan ur plastfodralet. |
Steg 2
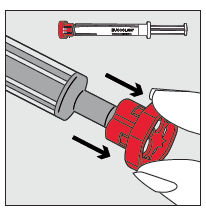 | Ta av den röda hatten från sprutspetsen och kassera den på ett säkert sätt. |
Steg 3
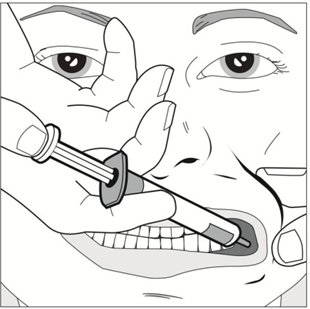 | Ta ett försiktigt grepp med tummen och pekfingret och dra tillbaka patientens kind. Sätt sprutspetsen i den bakre delen av mellanrummet mellan kindens insida och tandköttet i underkäken. |
Steg 4
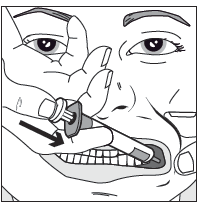 | Tryck sakta in sprutkolven tills det tar stopp. Hela mängden läkemedel ska långsamt sprutas in i mellanrummet mellan tandköttet och kindens insida (munhålan). Om det behövs (för större volymer och/eller yngre patienter) ska cirka hälften av dosen först ges långsamt i ena sidan av munhålan och sedan resterande dos i andra sidan. |
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Ersättning
BUCCOLAM liuos suuonteloon
2,5 mg 4 x 0,5 ml
5 mg 4 x 1 ml
7,5 mg 4 x 1,5 ml
10 mg 4 x 2 ml
- Ei korvausta.
Atc-kod
N05CD08
Datum för översyn av produktresumén
21.10.2024
Yhteystiedot
Box 98
182 11 Danderyd
Sweden
www.neuraxpharm.com/se
medinfo-nordics@neuraxpharm.com
