ENANTON DEPOT DUAL pulver och vätska till injektionsvätska, suspension i förfylld spruta 30 mg
Kvalitativ och kvantitativ sammansättning
En förfylld spruta innehåller 30,0 mg leuprorelinacetat motsvarande 28,58 mg leuprorelinbas.
Hjälpämne med känd effekt
Enanton Depot Dual 30 mg innehåller polysorbat 1,0 mg/injektionsspruta.
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Pulver och vätska till injektionsvätska, suspension i förfylld spruta.
Kliniska uppgifter
Terapeutiska indikationer
Behandling av avancerad prostatacancer.
Dosering och administreringssätt
Dosering
30 mg leuprorelinacetat administreras subkutant som en engångsdos med 6 månaders mellanrum.
Preparatet ska ges med försiktighet till patienter med urinvägsobstruktion eller ryggmärgsskador, samt till patienter med risk för utveckling av dessa tillstånd (se även avsnitt Varningar och försiktighet).
Farmakokinetiken av leuprorelinacetat har inte undersökts hos patienter med lever- eller njursvikt. Enstaka observationer har gjorts avseende skillnader i serumnivåerna av leuprorelin (för tilläggsinformation se avsnitt Farmakokinetiska egenskaper).
Läkemedelsbehandlingen av prostatacancer är ofta långvarig.
Administreringssätt
Enanton Depot Dual-injektionen ska endast beredas, färdigställas och administreras av sjukvårdspersonal som är förtrogna med dessa rutiner.
Enanton Depot Dual 30 mg ges som en subkutan injektion. Anvisningar om beredning av läkemedlet före administrering finns i avsnitt Särskilda anvisningar för destruktion och övrig hantering.
Obs
Dosintervallet ska vara 168–180 dagar (24–26 veckor) för att undvika symptomförsämring.
Intravenöst eller intraarteriellt administrerad spruta kan orsaka en trombos. Därför ska administrering av sprutan enligt anvisningarna försäkras.
Kontraindikationer
Överkänslighet mot den aktiva substansen, något hjälpämne som anges i avsnitt Förteckning över hjälpämnen, syntetiskt GnRH eller GnRH-derivat.
Varningar och försiktighet
Leverfunktionen ska övervakas under behandling med leuprorelinacetat, eftersom förhöjt transaminas, AFOS, GT, LDH och bilirubin i serum kan uppkomma (se även avsnitt Biverkningar).
Leuprorelinacetat, som är ett potent GnRH-derivat som påverkar funktionen av hypofysen och könskörtlarna, kan i början av behandlingen öka testosteronkoncentrationen i serum övergående. Detta kan direkt efter den första injektionen orsaka förvärrad skelettsmärta, obstruktion av urinvägar, hematuri, svaghet i de nedre extremiteterna, parestesi och tillfällig försämring av patientens kliniska tillstånd (s.k. ”flare”-fenomen, se även avsnitt Biverkningar). Symptomen ska vanligtvis avta vid fortsatt behandling. För att minska risken för ”flare”-fenomenet kan patienten ges antiandrogen. Behandlingen i fråga inleds tre dagar innan behandling med Enanton Depot Dual och fortsätts i 2–3 veckor.
Patienter med urinvägsobstruktion eller ryggmärgsskada som orsakats av prostatacancer eller en metastas, ska övervakas noggrant under de första behandlingsveckorna, eftersom symptomen kan förvärras (se även avsnitt Biverkningar).
Serumkoncentrationerna av testosteron och PSA (prostate specific antigen) kan monitoreras för att fastställa behandlingssvaret av Enanton Depot Dual. Testosteronkoncentrationen stiger under den första veckan och sjunker efter detta. Kastrationsnivån uppnås inom 2–4 veckor och bibehålls under hela behandlingsperioden. Vid slutskedet av en 6 månaders behandlingsperiod skulle det vara bra att mäta testosteronnivån hos de patienter som inte tidigare behandlats med LHRH-analoger.
Långvarig estrogen- eller androgenbrist (orsakad av bilateral orkidektomi eller GnRH-agonistbehandling) är associerad med en ökad risk för minskad mineralkoncentration i benen vilket kan orsaka osteoporos och en ökad risk för benfrakturer hos patienter med ytterligare riskfaktorer.
Det finns en ökad risk för depression (som kan vara allvarlig) hos patienter som behandlas med GnRH-agonister, såsom leuprorelinacetat. Patienterna ska informeras om risken och behandlas på lämpligt sätt om symptom uppkommer.
Androgendeprivationsbehandling kan förlänga QT-intervallet. För patienter med QT-förlängning i anamnesen eller med riskfaktorer för QT-förlängning samt för patienter som samtidigt behandlas med andra läkemedel som kan förlänga QT-intervallet (se avsnitt Interaktioner), bör läkare bedöma nytta/risk-förhållandet inklusive risken för torsades de pointes, innan behandling med leuprorelinacetat påbörjas.
Hämning av endogen könshormonproduktion, under androgenbehandling eller på grund av estrogenbrist (hos menopausala kvinnor), är associerad med en ökad risk för metabola förändringar (såsom glukosintolerans och förvärring av diabetes och fettlever) samt för kardiovaskulära sjukdomar. Forskningsdata om ökad kardiovaskulär dödlighet är motstridiga. Patienter med en förhöjd risk för metabola förändringar, metabolt syndrom eller kardiovaskulära sjukdomar ska utvärderas noggrant innan behandlingen inleds och de ska övervakas noggrant under GnRH-behandlingen.
Efter marknadsintroduktion har epileptiska anfall upptäckts hos patienter som behandlats med leuprorelinacetat. Epileptiska anfall har förekommit både hos barn och vuxna, oberoende om patienten tidigare haft epilepsi, krampanfall eller utsättande riskfaktorer.
Idiopatisk intrakraniell hypertension
Idiopatisk intrakraniell hypertension (pseudotumor cerebri) har rapporterats hos patienter som fått leuprorelin. Patienterna ska varnas om tecken och symtom på idiopatisk intrakraniell hypertension, däribland svår eller återkommande huvudvärk, synstörningar och tinnitus. Om idiopatisk intrakraniell hypertension uppstår ska utsättning av leuprorelin övervägas.
Mycket allvarliga hudbiverkningar
Mycket allvarliga hudbiverkningar (SCARs), inklusive Stevens–Johnsons syndrom (SJS) och toxisk epidermal nekrolys (TEN) som kan vara livshotande eller dödliga, har rapporterats i samband med behandling med leuprorelin. Vid förskrivningstillfället ska patienten informeras om tecken och symtom och ska övervakas noga för allvarliga hudreaktioner. Om tecken och symtom som tyder på dessa reaktioner uppstår ska leuprorelin omedelbart sättas ut och en alternativ behandling ska övervägas (enligt vad som är lämpligt).
Detta läkemedel innehåller mindre än 1 mmol (23 mg) natrium per dos, d.v.s. är näst intill ”natriumfritt”.
Enanton Depot Dual innehåller polysorbat. Polysorbater kan orsaka allergiska reaktioner.
Interaktioner
Eftersom androgendeprivationsbehandling kan förlänga QT-intervallet, ska en noggrann övervägning göras av samtidig användning av leuprorelinacetat med läkemedel som förlänger QT-intervallet eller som kan framkalla torsades de pointes, såsom klass IA antiarytmika (t.ex. kinidin, disopyramid) eller klass III antiarytmika (t.ex. amiodaron, sotalol, dofetilid, ibutilid), metadon, moxifloxacin, antipsykotika, o.s.v. (se avsnitt Varningar och försiktighet).
Fertilitet, graviditet och amning
Enanton Depot Dual 30 mg är enbart indicerat för män för behandling av prostatacancer.
Effekter på förmågan att framföra fordon och använda maskiner
Enanton Depot Dual kan ha en effekt på förmågan att framföra fordon och använda maskiner, eftersom trötthet, synstörningar och yrsel ha rapporterats under behandling med leuprorelinacetat. Detta ska beaktas vid bilkörning eller användning av maskiner.
Biverkningar
”Flare”-fenomen: Skelettsmärta, urinvägsobstruktion och svaghet i nedre extremiteter, parestesier (se även avsnitt Varningar och försiktighet) (hos ≥ 5 % av patienterna).
Såsom med andra preparat som tillhör denna grupp, har hypofysär apoplexi rapporterats som en mycket sällsynt biverkning hos patienter med hypofystumör, till följd av den första leuprorelinacetatdosen.
Biverkningarnas frekvensklasser är definierade enligt följande: Vanliga (≥ 1/100 och < 1/10), mindre vanliga (≥ 1/1 000 och < 1/100), sällsynta (≥ 1/10 000 och < 1/1 000), mycket sällsynta (< 1/10 000) inklusive enstaka rapporter och ingen känd frekvens (kan inte beräknas från tillgängliga data).
Organsystem | Vanliga | Mindre vanliga | Sällsynta | Mycket sällsynta | Ingen känd frekvens |
Blodet och lymfsystemet | Anemi, trombocytopeni | ||||
Immunsystemet | Överkänslighet, utslag, klåda, urtikaria, vinande andning, feber, frossa och anafylaktisk reaktion | ||||
Metabolism och nutrition | Viktförändringar, anorexi, förhöjda totalkolesterol-, triglycerid- eller glukos-koncentrationer i serum, hyperkalemi, förhöjda koncentrationer av urinsyra | Metabolt syndrom (hypertension, dyslipidemi, insulin-resistens, försvagad insulintolerans), fettlever | |||
Psykiatriska tillstånd | Humör-svängningar, depression, sömnlöshet | ||||
Centrala och perifera nervsystemet | Huvudvärk, yrsel, parestesi | Hypofysär apoplexi | Epileptiskt anfall, idiopatisk intrakraniell hypertension (pseudotumor cerebri) (se avsnitt Varningar och försiktighet) | ||
Ögon | Synstörningar | ||||
Öron och balansorgan | Dövhet, tinnitus | ||||
Hjärtat | Onormala EKG-fynd, ökad kardiothorakal kvot | Palpitationer, QT-förlängning (se avsnitt Varningar och försiktighet och Interaktioner) | |||
Blodkärl | Värme-vallningar | Värmekänsla i ansiktet | Trombos | ||
Andningsvägar, bröstkorg och mediastinum | Lungemboli | Interstitiell lungsjukdom | |||
Magtarm-kanalen | Illamående, kräkningar | Diarré | |||
Lever och gallvägar | Förhöjda LDH-koncentrationer, funktions-störning i levern (ikterus) | Förhöjda serumkoncentrationer av transaminaser, GT-AFOS och bilirubin | |||
Hud och subkutan vävnad | Svettning | Dermatit, hårväxt på huvudet, utslag, klåda | Steven–Johnsons syndrom/toxisk epidermal nekrolys (SJS/TEN) (se avsnitt Varningar och försiktighet), toxiskt hudutslag, erythema multiforme, utslag med blåsor, exfoliativ dermatit, akut generaliserad exantematös pustulos (AGEP) | ||
Muskulo-skeletala systemet och bindväv | Muskelsvaghet | Artralgi eller skelettsmärta, smärta i axlarna, nedre ryggen eller extremiteterna | Myalgi | Osteoporos (inklusive ryggrads-fraktur), minskad mineralkoncentration i benen | |
Njurar och urinvägar | Pollakisuri, hematuri, förhöjda ureakoncentrationer i serum | ||||
Reproduktions-organ och bröstkörtel | Minskad libido, impotens, testikelatrofi | Gynekomasti, obehag i perinealregionen | |||
Allmänna symptom och/eller symptom vid administrerings-stället | Reaktion vid injektions-stället*, värmekänsla | Svårigheter att gå, ödem, tryckkänsla i bröstet, stelhet, sjukdomskänsla, trötthet, feber. Smärta, induration eller rodnad vid injektionsstället. | Abscess vid injektionsstället |
*) Säkerhetsprofilen för Enanton Depot Dual 30 mg överensstämmer med profilen för 11,25 mg-preparatet, men reaktioner vid injektionsstället har rapporterats oftare vid användning av 30 mg.
Dessutom kan metabola förändringar (t.ex. glukosintolerans eller förvärring av diabetes) eller en ökad risk för kardiovaskulära händelser förekomma vid användning av GnRH-analoger.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Patienten ska övervakas noggrant vid överdoseringsfall och behandlas symptomatiskt.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Endokrinterapi, Gonadotropinfrisättande hormonanaloger, ATC-kod: L02AE02.
Den aktiva substansen i Enanton Depot Dual-preparaten är leuprorelinacetat, en långverkande GnRH (LHRH)-analog som vid långvarig användning med terapeutiska doser fungerar som en potent hämmare av gonadotropinfrisättningen. Leuprorelinacetat är ca 100 gånger mer potent än naturligt GnRH-hormon.
I studier på människor och djur har steroidogen suppression av ovarier och testiklar observerats efter den stimulering som sker i början av långvarig behandling med leuprorelinacetat. Funktionen av äggcellerna och testiklarna är reversibel efter utsättning av behandlingen.
Hos människor orsakar leuprorelinacetat i början en ökning av koncentrationen av luteiniserande hormon (LH) och follikelstimulerande hormon (FSH), vilket leder till en övergående ökning av gonadsteroidnivåer både hos män och kvinnor. Kontinuerlig administrering av leuprorelin minskar dock gonadotropin- och könssteroidkoncentrationerna. Denna effekt kan observeras inom 2–4 veckor efter behandlingsstart.
Farmakokinetiska egenskaper
Leuprorelinacetat frisätts kontinuerligt från mjölksyrapolymeren under en period på 6 månader efter injektion av Enanton Depot Dual 30 mg. Bärarpolymeren löses upp i vävnaden på ett liknande sätt som kirurgiskt suturmaterial.
Efter en engångsdos av Enanton Depot Dual 30 mg, steg koncentrationen av leuprorelin snabbt, med en efterföljande minskning till samma nivå inom några dagar. Inom två timmar efter administrering uppnåddes leuprorelinnivån 100 ng/ml. En jämn, mätbar serumkoncentration observerades i upp till 180 dagar efter senaste administrering av dosen. Distributionsvolymen av leuprorelin är 36 liter hos män. Total clearance är 139,6 ml/min efter en injektion av Enanton Depot Dual 30 mg.
Med upprepade doser uppnås en kvarstående kastrationsnivå av testosteron, utan den övergående höjning av testosteronnivåer som ses efter den första injektionen.
Farmakokinetiken av leuprorelinacetat har inte studerats hos patienter med lever- eller njursvikt. Vid kronisk njursvikt har höga leuprorelinkoncentrationer uppmätts i vissa fall, medan man hos patienter med leversvikt såg lägre leuprorelinkoncentrationer. Denna observation saknar dock klinisk betydelse.
Metabolismen, distributionen och utsöndringen av leuprorelinacetat har inte bestämts fullständigt hos människa.
Prekliniska säkerhetsuppgifter
Akut toxicitet (LD50)
Akut toxicitet av leuprorelinets depot-formulering har studerats hos han- och honmöss och -råttor med fyra administreringssätt (i.p., i.m., s.c. och p.o.). Inga dödsfall hos försöksdjuren har observerats med doserna 2 000 mg och 5 000 mg.
Toxicitet vid upprepad dos
Kroniska toxicitetsstudier som varade 13 veckor har utförts hos råttor och hundar med 8 mg leuprorelinacetat per kg kroppsvikt per vecka. I 12 månaders toxicitetsstudier användes leuproreliacetat med doser på 32 mg/kg/månad.
Lokala hudskador på injektionsstället förekom med alla dosnivåer (den lägsta testade dosen var 0,8 mg leuprorelinacetat/kg/månad), och dessutom upptäcktes atrofiska förändringar i reproduktionsorganen. Hos råttor utvecklades blåsor på både levern och njurtubulus epitelceller med alla doser. Förändringar i könsorganen orsakas av läkemedlets endokrina effekter.
Karcinogenicitet, mutagenicitet, effekter på fertiliteten
Karcinogenicitet
Karcinogenicitetsstudier på två år har utförts hos råtta och mus. En dosberoende ökning av hypofysadenom upptäcktes hos råtta då 0,6–4 mg leuprorelin gavs dagligen. Hos möss utvecklades inga hypofysadenom trots att doser på 60 mg/kg användes under två års tid.
Mutagenicitet
In vitro- och in vivo-studier med leuprorelinacetat har inte visat någon potentiell mutagenicitet då genetiska mutationer och kromosommutationer har undersökts.
Fertilitet
Då administreringen av leuprorelin avslutades ökade livmoderns och ovariernas vikt, hormonkoncentrationerna steg och en färsk gulkropp konstaterades hos könsmogna honråttor. I denna studie användes 10 µg subkutant två gånger per dag i 14 dagar eller 40 µg subkutant i 13 dagar
Då han- och honråttor gavs leuprorelin kontinuerligt i 3 månader (200 µg/kg/dag) eller intermittent (0,8 eller 2,4 mg/kg/månad), utvecklades genitalierna normalt. Inga avvikelser observerades i F1-generationen. F1-generationens beteende studerades inte.
Kliniska och farmakologiska studier har visat att fertiliteten var reversibel senast 24 veckor efter avslutad administrering av läkemedlet.
Reproduktionstoxicitet
Studier med råtta och kanin visade ingen teratogenicitet. Fostertoxicitet eller -dödlighet har noterats hos kaniner med dosen > 0,24 µg/kg.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Pulver till injektionsvätska:
Poly(mjölksyra)
Mannitol
Vätska:
Mannitol
Karmellosnatrium
Polysorbat 80
Ättiksyra, koncentrerad (för pH-justering)
Vatten för injektionsvätskor
Inkompatibiliteter
Då blandbarhetsstudier saknas får detta läkemedel inte blandas med andra läkemedel.
Hållbarhet
3 år.
Efter beredning ska suspensionen användas omedelbart.
Särskilda förvaringsanvisningar
Förvaras i skydd mot kyla. Får ej frysas.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
ENANTON DEPOT DUAL injektiokuiva-aine ja liuotin suspensiota varten, esitäytetty ruisku
30 mg (L:ei) 30 mg (635,50 €)
PF-selosteen tieto
1 x förfylld tvåkammarspruta (glas Ph. Eur. typ I, gummiproppar av silikoniserat klorobutylgummi), med injektionsnål (23 G) med säkerhetsskydd.
Läkemedlets utseende:
Den förfyllda sprutan är en tvåkammarspruta som innehåller vitt pulver och en klar, färglös lösning.
Särskilda anvisningar för destruktion och övrig hantering
Beredning och administrering av injektionsvätskan
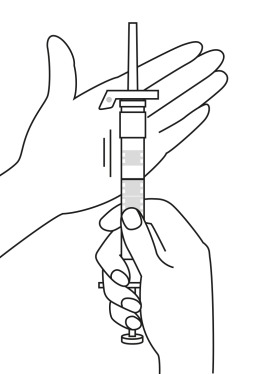
Pulvret och vätskan till injektionsvätskan ska blandas ihop före användningen. OBS! Dra aldrig tillbaka kolven under beredning, detta kan orsaka separation mellan propparna vilket kan medföra läckage mellan propparna eller vid kolven.
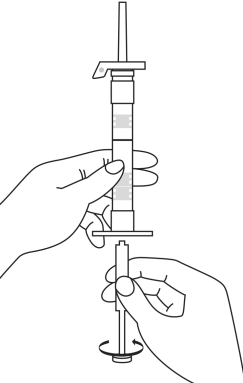
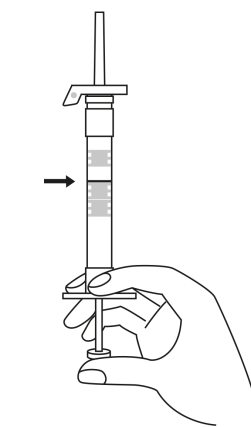
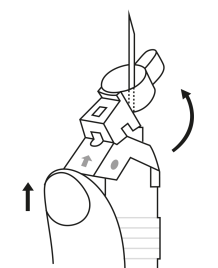
| 1. Håll sprutan upprätt (nålen uppåt). Skruva fast kolvens skaft på sprutans botten tills den bakre gummiproppen börjar snurra. |
| 5. Håll sprutan med nålen uppåt så att du ser om det finns luftbubblor i sprutan. Om luftbubblor syns, tryck försiktigt på kolven tills all luft (men ingen vätska) har avlägsnats från sprutan. |
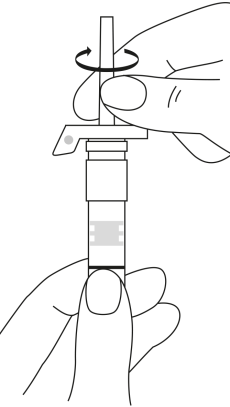
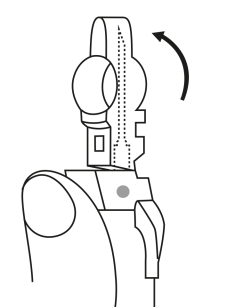
| 2. Håll sprutan upprätt (nålen uppåt). Kontrollera att nålen är ordentligt fastskruvad på sprutan genom att skruva nålskyddet medsols. Skruva inte åt det för hårt. Knacka försiktigt på sprutan med ett finger så att pulvret lossnar från kammarens vägg. |
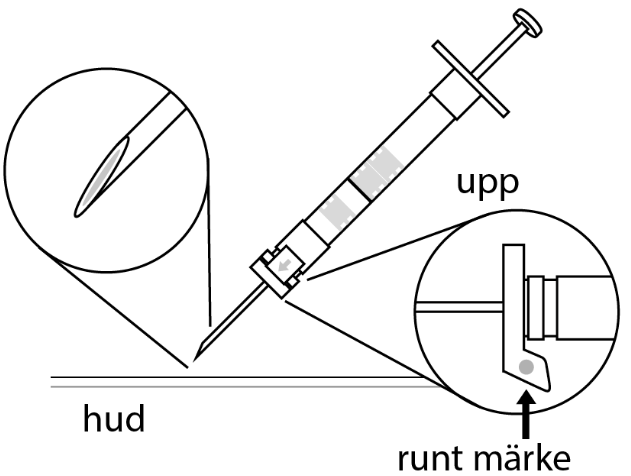
6. Rengör hudområdet med antiseptiskt medel före injektionen. När injektionen ges ska pricken på säkerhetsskyddet peka uppåt. Kontrollera att nålen inte punkterar ett blodkärl och injicera hela innehållet i sprutan på en gång under huden som vid en normal injektion. | |
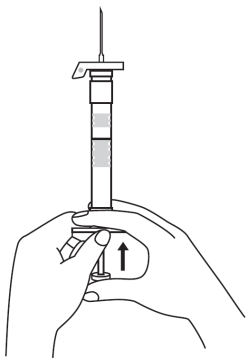
| 3. Håll sprutan upprätt (nålen uppåt). Tryck in kolven långsamt (6‑8 sekunder) tills den mellersta gummiproppens övre del når den blå linjen. | ||
EFTER INJEKTION 7. En pil är tryckt på säkerhetsskyddets klaff. Tryck på säkerhetsskyddets klaff i pilens riktning genast efter injektionen. Då glider skyddet mot nålspetsen och låses som skydd för nålen. Kontrollera låsningen genom att lyssna eller känna (när skyddet låses hör du ett ”klick” eller känner en knäpp). | |||
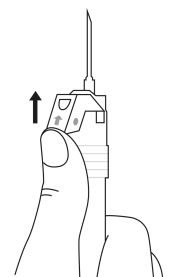
| 4. Håll sprutan upprätt (nålen uppåt). Skaka sprutan försiktigt tills suspensionen är jämn. Färdig injektion är en vit, mjölkaktig suspension. Dra försiktigt av nålskyddet. | ||
Allmänna råd
- Se till att suspensionen har en jämn konsistens före dosering.
- Den färdiga suspensionen ska användas omedelbart.
- Vid behov kan plåster läggas på injektionsstället.
- Läkemedlet får inte injiceras på samma plats två gånger i följd, utan injektionsstället bör varieras.
- Den färdiga suspensionen får inte förvaras, eftersom produkten inte innehåller något konserveringsmedel.
- Injektionsstället får inte masseras.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Ersättning
ENANTON DEPOT DUAL injektiokuiva-aine ja liuotin suspensiota varten, esitäytetty ruisku
30 mg 30 mg
- Ylempi erityiskorvaus (100 %). Eturauhassyöpä (116).
- Peruskorvaus (40 %).
Atc-kod
L02AE02
Datum för översyn av produktresumén
28.10.2024
Yhteystiedot
 ORION OYJ ORION PHARMA
ORION OYJ ORION PHARMA Orionintie 1, PL 65
02101 Espoo
010 4261
www.orion.fi
etunimi.sukunimi@orionpharma.com