MERCILON tablett 150/20 mikrog
Kvalitativ och kvantitativ sammansättning
Varje tablett innehåller 150 mikrogram desogestrel och 20 mikrogram etinylestradiol.
Hjälpämne med känd effekt: laktos < 80 mg
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Tablett
Kliniska uppgifter
Terapeutiska indikationer
Antikonception.
Vid beslut att förskriva Mercilon ska den enskilda användarens nuvarande riskfaktorer beaktas, framför allt de för venös tromboembolism (VTE), samt risken för VTE med Mercilon jämfört med andra kombinerade hormonella preventivmedel (se avsnitt Kontraindikationer och Varningar och försiktighet).
Dosering och administreringssätt
Dosering
En tablett ska tas dagligen 21 dagar i följd. Innan en ny karta påbörjas görs ett 7 dagars uppehåll i intaget av tabletter. Bortfallsblödningen börjar under uppehållet. Den startar vanligtvis 2–3 dagar efter intaget av den sista tabletten och kan fortsätta in på nästa karta.
Pediatrisk population
Säkerhet och effekt av Mercilon hos ungdomar under 18 har inte studerats.
Administreringssätt
Oral användning.
Hur man tar Mercilon
Tabletterna måste tas i rätt ordning enligt förpackningen varje dag, vid ungefär samma tidpunkt, och vid behov tillsammans med en liten mängd vätska.
Hur man börjar med Mercilon
Ingen hormonell metod har använts [under föregående månad]
Mercilon bör påbörjas den första dagen av kvinnans naturliga menstruationscykel (alltså på den första blödningsdagen). Det går även att börja dag 2–5, men man rekommenderar att använda ett kompletterande skydd med en barriärmetod de första 7 tablettdagarna under den första cykeln.
Byte till Mercilon från en annan kombinerad hormonell preventivmetod (kombinerade p-piller, vaginalring eller p-plåster)
Kvinnan bör starta med Mercilon dagen efter den sista aktiva tabletten av tidigare använt kombinerat p‑piller, dock aldrig senare än dagen efter det normala tablettfria intervallet eller dagen efter den sista placebotabletten. Om en vaginalring eller ett p-plåster har använts tidigare, bör kvinnan helst starta med Mercilon samma dag som uttag/borttag sker, dock aldrig senare än den dag då användningen av en ny ring eller ett nytt plåster skulle ha påbörjats.
Om kvinnan har använt sin tidigare metod korrekt och utan avbrott samt är relativt säker på att hon inte är gravid, kan hon byta från sitt tidigare preventivmedel till Mercilon vilken dag som helst i cykeln.
Den hormonfria perioden för den tidigare använda metoden får aldrig vara längre än den rekommenderade tiden.
Alla preventivmedel (p-plåster, vaginalring) kanske inte finns på marknaden i alla EU-länder.
Byte till Mercilon från ett preventivmedel innehållande enbart gestagen (minipiller, injektion, implantat) eller ett intrauterint preventivmedel (IUD) som frisätter gestagen
Kvinnan kan byta från minipiller till Mercilon vilken dag som helst. (Vid byte från ett implantat eller hormonspiral (IUD) ska Mercilon påbörjas samma dag som implantatet/hormonspiralen tas ut. Vid byte från ett injektionspreparat ska Mercilon påbörjas samma dag som nästa injektion skulle ha getts.) I alla dessa fall ska kvinnan rekommenderas att använda kompletterande barriärmetod de första 7 tablettdagarna under den första cykeln.
Efter abort i första trimestern
Kvinnan kan börja med Mercilon omedelbart. Om hon gör det behövs inget kompletterande skydd.
Efter förlossning eller abort i andra trimestern
För ammande kvinnor se avsnitt Fertilitet, graviditet och amning.
Kvinnan rekommenderas att börja med Mercilon på dag 21 till 28 efter förlossning eller efter abort i andra trimestern. Vid senare start rekommenderas kvinnan att använda kompletterande barriärmetod de första 7 tablettdagarna under den första cykeln. Om kvinnan redan har haft samlag måste man utesluta graviditet innan hon startar med ett kombinerat hormonellt preventivmedel, eller invänta att den följande menstruationen börjar.
Hantering av tablettglömska
Om det har gått mindre än 12 timmar sedan tabletten skulle ha tagits är skyddet mot graviditet inte nedsatt. Den glömda tabletten bör tas så snart som möjligt och nästa tablett tas sedan vid ordinarie tidpunkt.
Om det har gått mer än 12 timmar sedan tabletten skulle ha tagits, kan graviditetsskyddet vara nedsatt. Följande två grundregler gäller vid glömd tablett:
- Tablettuppehåll med aktiva tabletter får aldrig överskrida 7 dagar.
- 7 dagars oavbrutet tablettintag krävs för att uppnå tillräcklig hämning av hypotalamus-hypofys-ovarieaxeln.
I enlighet med detta kan följande råd användas i allmän praxis:
Vecka 1
Den senast glömda tabletten ska tas så snart som kvinnan kommer ihåg, även om detta innebär att hon tar två tabletter vid samma tillfälle. Därefter fortsätter hon att ta tabletterna på ordinarie tidpunkt. En barriärmetod som kondom bör användas de närmaste sju dagarna. Har kvinnan haft samlag under de föregående sju dagarna, bör möjligheten av en graviditet övervägas. Ju fler glömda tabletter och ju närmare de är den regelbundna tablettfria perioden, desto större är risken för graviditet.
Vecka 2
Den senast glömda tabletten ska tas så snart som möjligt, även om detta innebär att två tabletter tas vid samma tillfälle. Därefter tas tabletterna på ordinarie tidpunkt. Under förutsättning att tabletterna tagits vid rätt tidpunkt de föregående sju dagarna, behövs inget ytterligare skydd. Om det inte är fallet eller om hon har glömt mer än 1 tablett bör kompletterande skydd användas under sju dagar.
Vecka 3
Risken för minskat graviditetsskydd är överhängande med tanke på den kommande tablettfria perioden. Genom att justera schemat för tablettintaget, går det emellertid att förhindra att skyddseffekten minskar. Följer man något av följande två alternativ behövs därför inget extra skydd, under förutsättning att alla tabletterna togs på rätt tid under de sju dagarna precis innan den första glömda tabletten. Om så inte är fallet, bör det första alternativet följas och extra skydd bör användas även under de kommande sju dagarna.
- Kvinnan ska ta den senast glömda tabletten så snart som möjligt, även om det innebär att hon tar två tabletter vid samma tidpunkt. Därefter tas tabletterna på ordinarie tidpunkt. Nästa tablettkarta måste påbörjas med en gång då tabletterna i den tablettkarta som används har tagit slut, utan något uppehåll i tablettintaget. Kvinnan kommer troligtvis inte få någon bortfallsblödning förrän alla tabletter på den andra tablettkartan har tagits, men oregelbundna blödningar i form av stänkblödning eller genombrottsblödning kan uppträda under dagar då hon tar tabletter.
- Kvinnan kan också rådas att avbryta intaget av tabletter från den aktuella tablettkartan. Därefter ska hon ha 7 dagars uppehåll i intaget av tabletter, inklusive de dagar hon glömt tabletter, och därefter fortsätta med nästa tablettkarta.
Om kvinnan har glömt att ta tabletter och inte fått någon bortfallsblödning under det första vanliga tablettuppehållet, bör möjligheten för graviditet beaktas.
Råd vid gastrointestinala störningar
Vid kraftiga gastrointestinala störningar kan absorptionen vara ofullständig och kompletterande skydd bör användas.
Vid kräkningar inom 3–4 timmar efter tablettintag bör man följa de råd som ges i avsnitt Hantering av tablettglömska (se avsnitt Dosering och administreringssätt). Om kvinnan inte vill ändra sitt tablettschema så måste hon ta extra tabletter från en annan karta.
Hur man ändrar eller skjuter upp bortfallsblödningen (menstruationen)
Att förskjuta menstruationen är ingen indikation för preparatet, men i speciella fall kan kvinnan fortsätta med en ny tablettkarta Mercilon utan uppehåll, genast efter att den tidigare kartan har tagit slut. Denna förskjutning kan göras så länge kvinnan önskar fram till slutet av den andra tablettkartan. Kvinnan kan få stänkblödning eller genombrottsblödning under denna tid. Regelbundet intag av Mercilon ska sedan återupptas efter det vanliga tablettuppehållet på 7 dagar.
För att byta startdag för menstruationen kan kvinnan ges rådet att förkorta nästkommande tablettuppehåll med så många dagar som hon önskar. Ju kortare uppehåll desto större är risken att kvinnan inte får någon bortfallsblödning och att hon får stänkblödning eller genombrottsblödning under nästa tablettkarta (som vid uppskjutning av bortfallsblödningen).
Kontraindikationer
Kombinerade hormonella preventivmedel ska inte användas vid följande tillstånd. Om något av dessa tillstånd skulle uppträda för första gången vid användning av kombinerat hormonellt preventivmedel ska behandlingen avbrytas omedelbart.
-
Förekomst av eller risk för venös tromboembolism (VTE)
- venös tromboembolism – pågående VTE (patient på antikoagulantia) eller anamnes på VTE (t ex djup ventrombos [DVT] eller lungemboli [PE]).
- känd ärftlig eller förvärvad predisposition för venös tromboembolism, t ex APC‑resistens (inklusive Faktor V Leiden), antitrombin‑III‑brist, protein C‑brist, protein S‑brist.
- större kirurgiskt ingrepp med långvarig immobilisering (se avsnitt Varningar och försiktighet).
- hög risk för venös tromboembolism på grund av förekomst av flera riskfaktorer (se avsnitt Varningar och försiktighet).
-
Förekomst av eller risk för arteriell tromboembolism (ATE)
- arteriell tromboembolism – pågående arteriell tromboembolism, anamnes på arteriell tromboembolism (t ex myokardiell infarkt) eller prodromalsymtom (t ex angina pectoris).
- cerebrovaskulär sjukdom – pågående stroke, anamnes på stroke eller prodromalsymtom (t ex transitorisk ischemisk attack, TIA).
- känd ärftlig eller förvärvad predisposition för arteriell tromboembolism, t ex hyperhomocysteinemi och antifosfolipidantikroppar (antikardiolipinantikroppar, lupus antikoagulant).
- migrän med fokala neurologiska symtom i anamnesen.
- hög risk för arteriell tromboembolism på grund av flera riskfaktorer (se avsnitt Varningar och försiktighet) eller på grund av förekomst av en allvarlig riskfaktor som:
- diabetes med vaskulära symtom
- allvarlig hypertoni
- allvarlig dyslipoproteinemi.
- Förekomst av pankreatit eller anamnes på pankreatit om den varit associerad med allvarlig hypertriglyceridemi.
- Förekomst av eller anamnes på allvarlig leversjukdom så länge levervärdena inte har normaliserats.
- Förekomst av eller anamnes på levertumör (benign eller malign).
- Känd eller misstänkt könshormonberoende malignitet (t ex i genitalorganen eller brösten).
- Endometriehyperplasi.
- Odiagnostiserad vaginalblödning.
- Konstaterad eller misstänkt graviditet.
- Överkänslighet mot de aktiva substanserna eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen. Mercilon är kontraindicerat vid samtidig användning med läkemedel innehållande ombitasvir/paritaprevir/ritonavir samt dasabuvir eller läkemedel som innehåller glekaprevir/pibrentasvir (se avsnitt Varningar och försiktighet och Interaktioner).
Varningar och försiktighet
Varningar
Vid förekomst av någon av de tillstånd eller riskfaktorer som anges nedan, bör lämpligheten av Mercilon diskuteras med kvinnan.
Om något av dessa tillstånd eller riskfaktorer förvärras eller uppträder för första gången ska kvinnan ta kontakt med sin läkare. Läkare ska då besluta om användningen ska avbrytas.
1. Cirkulatoriska rubbningar
Risk för venös tromboembolism (VTE)
Användning av ett kombinerat hormonellt preventivmedel ökar risken för venös tromboembolism (VTE) jämfört med icke-användning. Produkter som innehåller levonorgestrel, norgestimat eller noretisteron förknippas med den lägsta risken för VTE. Andra produkter som t ex Mercilon kan ha en risk som är dubbelt så stor. Beslutet att använda en annan produkt än den med den lägsta risken för VTE ska tas först efter en diskussion med kvinnan för att säkerställa att hon känner till risken för VTE med Mercilon, hur hennes riskfaktorer påverkar den här risken, och att hennes VTE‑risk är störst under det första året hon använder ett kombinerat hormonellt preventivmedel för första gången i sitt liv. Det finns också vissa belägg för att risken är större när ett kombinerat hormonellt preventivmedel används igen efter ett uppehåll på 4 veckor eller längre.
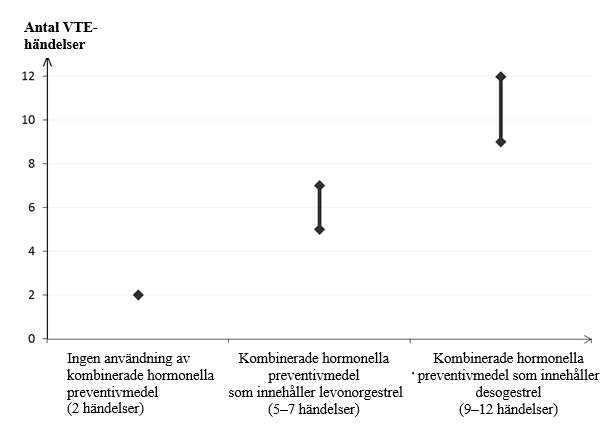
Hos kvinnor, som inte använder ett kombinerat hormonellt preventivmedel och som inte är gravida kommer cirka 2 av 10 000 att utveckla en VTE under en period om ett år. Hos en enskild kvinna kan dock risken vara betydligt högre, beroende på hennes underliggande riskfaktorer (se nedan).
Man uppskattar1 att av 10 000 kvinnor som använder kombinerade hormonella preventivmedel innehållande desogestrel kommer mellan 9 och 12 kvinnor att utveckla en VTE under ett år; detta kan jämföras med cirka 62 kvinnor som använder kombinerade hormonella preventivmedel som innehåller levonorgestrel.
1Dessa förekomster uppskattades från samtliga epidemiologiska studiedata med hjälp av relativa risker för de olika produkterna jämfört med kombinerade hormonella preventivmedel som innehåller levonorgestrel.
2Genomsnittsintervallet är på 5–7 per 10 000 kvinnoår, baserat på en relativ risk för kombinerade hormonella preventivmedel som innehåller levonorgestrel jämfört med en ickeanvändning på cirka 2,3 till 3,6.
I båda fallen är antalet VTE-händelser per år färre än det antal händelser som förväntas hos kvinnor under graviditet eller under postpartumperioden.
VTE kan vara dödlig i 1–2 % av fallen.
Antal VTE-händelser per 10 000 kvinnor under ett år
I extremt sällsynta fall har trombos rapporterats hos användare av kombinerade hormonella preventivmedel i andra blodkärl, t ex i hepatiska, mesenteriska, renala eller retinala vener och artärer.
Riskfaktorer för VTE
Risken för venösa tromboemboliska komplikationer hos användare av kombinerade hormonella preventivmedel kan öka betydligt hos kvinnor med ytterligare riskfaktorer, framför allt om flera riskfaktorer föreligger (se tabell).
Mercilon är kontraindicerat om en kvinna har flera riskfaktorer som innebär att hon löper hög risk för VTE (se avsnitt Kontraindikationer). Om en kvinna har mer än en riskfaktor är det möjligt att risken är större än summan av de enskilda faktorerna – i detta fall bör hennes totala risk för VTE beaktas. Om förhållandet nytta-risk anses vara negativt ska ett kombinerat hormonellt preventivmedel inte förskrivas (se avsnitt Kontraindikationer).
Tabell: Riskfaktorer för VTE
Riskfaktor | Kommentar |
Fetma (BMI över 30 kg/m2). | Risken ökar betydligt när BMI ökar. Detta är särskilt viktigt att beakta om det också finns andra riskfaktorer. |
Långvarig immobilisering, större kirurgiskt ingrepp, alla operationer i ben eller bäcken, neurokirurgi eller omfattande skada. Anm: tillfällig immobilisering inklusive flygresor > 4 timmar kan också vara en riskfaktor för VTE, särskilt hos kvinnor med andra riskfaktorer. | I dessa situationer är det lämpligt att göra ett uppehåll i användningen av plåstret/p pillret/ringen (vid elektiv kirurgi minst fyra veckor i förväg) och inte återuppta användningen förrän två veckor efter fullständig remobilisering. En annan preventivmetod bör användas för att undvika oavsiktlig graviditet. Antitrombotisk behandling bör övervägas om Mercilon inte har satts ut i förväg. |
| Positiv familjeanamnes (nuvarande eller tidigare VTE hos syskon eller förälder speciellt i relativt unga år, t ex före 50 års ålder). | Om man misstänker en hereditär predisposition, ska kvinnan remitteras till en specialist för rådgivning innan hon beslutar sig för att använda någon form av kombinerade hormonella preventivmedel. |
Andra medicinska tillstånd som förknippas med VTE. | Cancer, systemisk lupus erythematosus, hemolytiskt uremiskt syndrom, kronisk inflammatorisk tarmsjukdom (Crohns sjukdom eller ulcerös kolit) och sicklecell-anemi. |
Stigande ålder. | Framför allt hos kvinnor över 35 år. |
Det råder inte enighet om den eventuella betydelsen av varicer eller ytlig tromboflebit för uppkomst eller progression av venös trombos.
Den ökade risken för venös tromboembolism vid graviditet och framför allt under cirka 6 veckor i puerperiet måste beaktas (för information om ”Graviditet och amning” se avsnitt Fertilitet, graviditet och amning).
Symtom på VTE (djup ventrombos och lungemboli)
Vid symtom ska kvinnan rådas att omedelbart söka läkare och informera vårdpersonalen om att hon tar kombinerade hormonella preventivmedel.
Symtom på djup ventrombos (DVT) kan omfatta:
- ensidig svullnad av ben och/eller fot eller längs en ven i benet
- smärta eller ömhet i benet som kanske bara känns vid stående eller gående
- ökad värme i det drabbade benet med rödfärgning eller missfärgning av benet.
Symtom på lungemboli (PE) kan omfatta:
- plötslig debut av oförklarlig andfåddhet eller snabb andning
- plötslig hosta som kan förknippas med hemoptys
- kraftig bröstsmärta
- kraftig ostadighetskänsla eller yrsel
- snabba eller oregelbundna hjärtslag.
En del av dessa symtom (t ex andfåddhet och hosta) är icke-specifika och kan feltolkas som mer vanliga eller mindre allvarliga händelser (t ex luftvägsinfektioner).
Andra tecken på vaskulär ocklusion kan omfatta plötslig smärta, svullnad och blåmissfärgning av en extremitet.
Om ocklusion uppkommer i ögonen kan symtomen variera från smärtfri dimsyn som kan utvecklas till synförlust. Ibland kan synförlust uppkomma nästan omedelbart.
Risk för arteriell tromboembolism (ATE)
Epidemiologiska studier har också visat ett samband mellan användning av kombinerade hormonella preventivmedel och en ökad risk för arteriell tromboembolism (myokardinfarkt) eller cerebrovaskulär händelse (t ex transitorisk ischemisk attack [TIA], stroke). Arteriella tromboemboliska händelser kan vara dödliga.
Riskfaktorer för ATE
Risken för arteriella tromboemboliska komplikationer eller för en cerebrovaskulär händelse hos användare av kombinerade hormonella preventivmedel ökar hos kvinnor med riskfaktorer (se tabell). Mercilon är kontraindicerat om kvinnan har en allvarlig eller flera riskfaktorer som innebär att hon löper hög risk för ATE (se avsnitt Kontraindikationer). Om kvinnan har mer än en riskfaktor är det möjligt att riskökningen är större än summan av de enskilda faktorerna – i detta fall bör hennes totala risk beaktas. Om förhållandet nytta-risk anses vara negativt ska ett kombinerat hormonellt preventivmedel inte förskrivas (se avsnitt Kontraindikationer).
Tabell: Riskfaktorer för ATE
Riskfaktor | Kommentar |
Stigande ålder. | Framför allt hos kvinnor över 35 år. |
Rökning. | Kvinnor bör rekommenderas att sluta röka om de använder ett kombinerat hormonellt preventivmedel. Kvinnor över 35 år som fortsätter att röka bör starkt rekommenderas att använda en annan preventivmetod. |
Hypertoni. | |
Fetma (BMI över 30 kg/m2). | Risken ökar avsevärt när BMI ökar. Detta är särskilt viktigt för kvinnor med ytterligare riskfaktorer. |
Positiv familjeanamnes (nuvarande eller tidigare arteriell tromboembolism hos ett syskon eller förälder i relativt unga år, före 50 års ålder). | Om man misstänker en hereditär predisposition, ska kvinnan remitteras till en specialist för rådgivning innan hon beslutar sig för att använda någon form av kombinerade hormonella preventivmedel. |
Migrän. | En ökning av frekvens eller svårighetsgrad av migrän vid användning av kombinerade hormonella preventivmedel (som kan vara prodromalsymtom på en cerebrovaskulär händelse) kan vara ett skäl för omedelbart utsättande. |
Andra medicinska tillstånd som förknippas med negativa vaskulära händelser. | Diabetes mellitus, hyperhomocysteinemi, hjärtklaffssjukdom och förmaksflimmer, dyslipoproteinemi och systemisk lupus erythematosus. |
Symtom på ATE
Vid symtom ska kvinnan rådas att omedelbart söka läkare och informera hälso- och sjukvårdspersonalen om att hon tar kombinerade hormonella preventivmedel.
Symtom på en cerebrovaskulär händelse kan omfatta:
- plötslig domning eller svaghet i ansikte, armar eller ben, speciellt på en sida av kroppen
- plötsliga problem med att gå, yrsel, förlorad balans eller koordination
- plötslig förvirring, svårigheter att tala eller förstå
- plötsliga synproblem i ett eller båda ögonen
- plötslig, svår eller långvarig huvudvärk utan känd orsak
- medvetslöshet eller svimning med eller utan krampanfall.
- Tillfälliga symtom som tyder på att händelsen är en transitorisk ischemisk attack (TIA).
Symtom på en hjärtinfarkt kan vara:
- smärta, obehag, tryck, tyngdkänsla, tryck eller fyllnadskänsla i bröstet, armen eller bakom bröstbenet
- obehag som strålar mot ryggen, käken, halsen, armen och/eller magen
- mättnadskänsla, matsmältningsbesvär eller kvävningskänsla
- svettning, illamående, kräkningar eller yrsel
- extrem svaghet, ångest, eller andfåddhet
- snabba eller oregelbundna hjärtslag.
2. Tumörer
- Vissa epidemiologiska studier tyder på att långtidsanvändning av kombinerade p‑piller utgör en riskfaktor för att utveckla cervixcancer hos kvinnor som har en infektion med humant papillomvirus (HPV). Det råder emellertid fortfarande oenighet om i vilken utsträckning dessa fynd beror på andra faktorer, t ex skillnader i antalet sexuella partners eller skillnader i användning av barriärmetoder.
- En meta-analys från 54 epidemiologiska studier rapporterade en något ökad relativ risk (RR=1,24) för att få bröstcancer diagnostiserad hos kvinnor som för tillfället använder kombinerade p‑piller. Den ökade risken försvinner gradvis under 10 år efter avslutad behandling. Eftersom bröstcancer är ovanligt hos kvinnor under 40 år, är det ökade antalet fall av diagnostiserad bröstcancer hos dem som använder eller nyligen har använt p‑piller litet jämfört med den totala risken för att få bröstcancer. Dessa studier ger inget bevis om orsakerna. Det observerade mönstret av ökad risk kan bero på en tidigare diagnos hos användare av kombinerade p-piller, en biologisk effekt av de kombinerade p-pillren eller en kombination av båda. Bröstcancer som diagnostiserats hos användarna tenderar att vara mindre avancerade än hos dem som aldrig använt p‑piller.
- I sällsynta fall har benigna levertumörer, och i ännu mer sällsynta fall maligna levertumörer, rapporterats hos kvinnor som använder kombinerade p‑piller. I enstaka fall har dessa tumörer lett till livshotande blödningar i bukhålan. Därför ska levertumör övervägas som differentialdiagnos vid kraftig smärta i övre delen av buken, leverförstoring eller tecken på intraabdominell blödning hos kvinnor som använder kombinerade hormonella preventivmedel.
3. ALAT förhöjningar
- Under kliniska prövningar med patienter som behandlades för hepatit C-virusinfektioner (HCV) med en läkemedelskombination innehållande ombitasvir/paritaprevir/ritonavir och dasabuvir, med eller utan ribavirin, var förhöjt transaminas (ALAT) 5 gånger övre normalgräns (ÖNG), signifikant mer förekommande hos kvinnor som använde läkemedel innehållande etinylestradiol såsom kombinerade hormonella preventivmedel. Dessutom observerades, för patienter behandlade med glekaprevir/pibrentasvir, förhöjt transaminas (ALAT) hos kvinnor som använt läkemedel innehållande etinylestradiol såsom kombinerade hormonella preventivmedel (se avsnitt Kontraindikationer och Interaktioner).
4. Övriga tillstånd
- Kvinnor med hypertriglyceridemi, eller hereditet för det, kan löpa en ökad risk att få pankreatit vid användning av kombinerade hormonella preventivmedel.
- Exogena östrogener kan inducera eller förvärra symtomen på ärftligt eller förvärvat angioödem.
- Även om små höjningar av blodtrycket har rapporterats hos många kvinnor som använder kombinerade hormonella preventivmedel, är kliniskt relevant höjning ovanligt. Något samband mellan användning av kombinerade hormonella preventivmedel och klinisk hypertoni har inte kunnat fastställas. Om en kliniskt manifest blodtryckshöjning uppstår vid användning av kombinerade hormonella preventivmedel är det lämpligt att läkaren avbryter behandlingen och behandlar blodtrycket. När det bedöms lämpligt kan behandlingen med läkemedlet återupptas om blodtrycket normaliserats med blodtrycksmedicinering.
- Följande tillstånd har rapporterats förekomma eller förvärras både under graviditet och vid kombinerade hormonella preventivmedel men bevisen för ett samband är ofullständiga: ikterus och/eller pruritus i samband med cholestas, bildning av gallsten, porfyri, systemisk lupus erythematosus, hemolytiskt uremiskt syndrom, chorea minor, herpes gestationis, otosklerosrelaterad hörselnedsättning.
- Akuta eller kroniska rubbningar i leverfunktionen kan göra det nödvändigt att avbryta behandlingen med det kombinerade hormonella preventivmedlet tills levervärdena har normaliserats. Recidiv av cholestatisk ikterus som först uppträtt under graviditet eller tidigare användning av könshormoner innebär att behandlingen med kombinerade hormonella preventivmedel ska avbrytas.
- Även om kombinerade hormonella preventivmedel har en effekt på den perifera insulinresistensen och glukostoleransen, finns inga bevis för att man behöver ändra den terapeutiska regimen hos diabetiker som använder kombinerade p‑piller. Kvinnor med diabetes ska emellertid observeras noggrant när de använder kombinerade hormonella preventivmedel.
- Crohns sjukdom och ulcerös kolit har associerats med användning av kombinerade hormonella preventivmedel
- Kloasma kan ibland uppträda, framför allt hos kvinnor som har haft kloasma under tidigare graviditet. Kvinnor med en tendens till kloasma ska undvika solbestrålning och ultraviolett strålning när de använder kombinerade hormonella preventivmedel.
- En Mercilon-tablett innehåller < 80 mg laktos. Denna mängd ska beaktas av patienter med sällsynta ärftliga tillstånd såsom galaktosintolerans, total laktasbrist eller glukos-galaktosmalabsorption samt patienter som följer en laktosfri kost.
- Nedstämdhet och depression är välkända biverkningar vid användning av hormonella preventivmedel (se avsnitt Biverkningar). Depressioner kan vara allvarliga och är en välkänd riskfaktor för självmordsbeteende och självmord. Kvinnor ska rådas att kontakta läkare vid humörförändringar och depressiva symtom, också direkt efter inledd behandling.
När man bedömer vilken preventivmetod man ska välja måste man ta hänsyn till all information som anges ovan.
Läkarundersökning
Innan användning av Mercilon påbörjas eller används igen ska en fullständig anamnes (inklusive hereditet) tas och graviditet uteslutas. Blodtrycket ska tas och en läkarundersökning ska utföras baserad på kontraindikationerna (se avsnitt Kontraindikationer) och varningar (se avsnitt Varningar och försiktighet). Det är viktigt att informera kvinnan om venösa och arteriella tromboser, inklusive risken med Mercilon jämfört med andra kombinerade hormonella preventivmedel, symtomen på VTE och ATE, de kända riskfaktorerna och vad hon ska göra i händelse av en misstänkt trombos.
Kvinnan ska också informeras om att noggrant läsa igenom bipacksedeln och följa anvisningarna. Frekvensen och typen av undersökningar ska baseras på fastställda riktlinjer och anpassas enligt varje kvinnas kliniska behov.
Kvinnan ska informeras om att hormonella preventivmedel inte skyddar mot hiv‑infektioner (AIDS) och andra sexuellt överförbara sjukdomar.
Minskad effekt
Effekten av Mercilon kan minska i samband med t ex glömda tabletter (se avsnitt Dosering och administreringssätt), vid gastrointestinala besvär (se avsnitt Dosering och administreringssätt) eller när andra läkemedel som minskar plasmakoncentrationen av etinylestradiol och/eller etonogestrel, desogestrels aktiva metabolit, används samtidigt (se avsnitt Interaktioner).
Naturläkemedel som innehåller johannesört (Hypericum perforatum) bör inte tas samtidigt med Mercilon p.g.a. att det finns en risk att plasmakoncentrationen av de aktiva substanserna minskar och därmed minskad effekt av Mercilon (se avsnitt Interaktioner).
Försämrad cykelkontroll
Alla kombinerade hormonella preventivmedel kan ge oregelbundna blödningar (stänkblödning eller genombrottsblödning), speciellt i början av behandlingen. Därför är en utvärdering av oregelbundna blödningar meningsfull först efter en anpassningsperiod på cirka tre cykler.
Om de oregelbundna blödningarna kvarstår eller om de debuterar efter tidigare regelbundna cykler, bör man överväga icke-hormonella orsaker och vidta lämpliga diagnostiska åtgärder för att utesluta malignitet eller graviditet. Det kan innebära livmoderkyrettage.
Hos en del kvinnor kan bortfallsblödningen utebli under tablettuppehållet. Om kvinnan använt ett kombinerat hormonellt preventivmedel enligt instruktionerna i avsnitt Dosering och administreringssätt, är det inte troligt att hon är gravid. Om kvinnan inte använt läkemedlet enligt instruktionerna innan den första uteblivna bortfallsblödningen eller om två bortfallsblödningar uteblir efter varandra, måste man utesluta graviditet innan behandlingen kan fortsätta.
Interaktioner
Observera: produktresuméerna för andra läkemedel som används ska kontrolleras för att identifiera potentiella interaktioner.
Effekter av andra läkemedel på Mercilon
Interaktioner kan inträffa med läkemedel och (traditionella) växtbaserade läkemedel som inducerar mikrosomala enzymer, speciellt cytokrom P450-enzymer (CYP), vilket kan resultera i ökad clearance av könshormoner, som kan leda till genombrottsblödningar och/eller utebliven antikonception.
Handhavande
Enzyminduktion kan observeras redan efter några dagars behandling. Maximal enzyminduktion ses generellt inom några veckor. Efter avslutad behandling kan enzyminduktion kvarstå under ca 4 veckor.
Korttidsbehandling
Kvinnor som behandlas med enzyminducerande läkemedel eller (traditionella) växtbaserade läkemedel ska använda sig av en barriärmetod som komplement till Mercilon eller välja en annan preventivmetod. Barriärmetod måste användas under hela den tid då läkemedlet intas samt under 28 dagar efter avslutad behandling.
Långtidsbehandling
Hos kvinnor på långtidsbehandling med enzyminducerande aktiva substanser, rekommenderas en annan pålitlig icke-hormonell preventivmetod som inte påverkas av enzyminducerande läkemedel.
Följande interaktioner har rapporterats i litteraturen.
Substanser som ökar clearance av Mercilon (enzyminduktion) t ex
Fenytoin, fenobarbital, primidon, bosentan, karbamazepin, rifampicin, vissa HIV-proteashämmare (t ex ritonavir) och icke-nukleosida omvänt transkriptashämmare (t ex efavirenz, nevirapin) och möjligen också oxkarbazepin, topiramat, rifabutin, felbamat, griseofulvin samt (traditionella) växtbaserade läkemedel som innehåller johannesört.
Substanser med varierande effekter på clearance av Mercilon
Vid samtidig administrering med hormonella preventivmedel, kan många kombinationer av HIV-proteashämmare (t ex nelfinavir) och icke-nukleosida omvänt transkriptashämmare (t ex nevirapin), och/eller kombinationer med hepatit C-virus (HCV) läkemedel (t ex boceprevir, telaprevir) öka eller minska plasmakoncentrationerna av gestagener, inklusive etonogestrel eller östrogen. Nettoeffekten av dessa förändringar kan vara kliniskt relevant i vissa fall.
Därför ska produktresuméerna för samtidigt administrerade HIV/HCV-läkemedel konsulteras för att identifiera potentiella interaktioner och eventuella tillhörande rekommendationer. I tveksamma fall ska tillägg av barriärmetod användas av kvinnor som behandlas med proteashämmare eller icke-nukleosida omvänt transkriptashämmare.
Substanser som minskar clearance av Mercilon (enzymhämmare)
Den kliniska relevansen av potentiella interaktioner med enzymhämmare är fortfarande okänd.
Samtidig administrering av starka (t ex ketokonazol, itrakonazol, klaritromycin) eller måttliga (t ex flukonazol, diltiazem, erytromycin) CYP3A4-hämmare kan öka plasmakoncentrationer av östrogener eller gestagener, inklusive etonogestrel.
Etoricoxib-doser på 60 till 120 mg/dag har visat sig öka plasmakoncentrationerna av etinylestradiol 1,4 respektive 1,6 gånger, när de tas samtidigt med ett kombinerat hormonellt preventivmedel innehållande 0,035 mg etinylestradiol.
Effekter av Mercilon på andra läkemedel
Kombinerade p-piller kan interagera med metabolismen av andra läkemedel. Således kan plasma- och vävnadskoncentrationen av andra aktiva substanser antingen öka (t ex ciklosporin) eller minska (t ex lamotrigin).
Kliniska data tyder på att etinylestradiol hämmar clearance av CYP1A2-substrat, vilket leder till en svag (t ex teofyllin) eller måttlig (t ex tizanidin) ökning av deras plasmakoncentration.
Farmakodynamiska interaktioner
Samtidig användning av läkemedelskombinationer innehållande ombitasvir/paritaprevir/ritonavir och dasabuvir, med eller utan ribavirin, eller kombinationen glekaprevir/pibrentasvir kan öka risken för ALAT-förhöjningar (se avsnitt Kontraindikationer och Varningar och försiktighet). Därför måste Mercilon-användare byta till en alternativ preventivmetod (t ex preventivmedel som bara innehåller gestagen eller icke-hormonella metoder) innan de påbörjar behandlingen med detta kombinationspreparat. Mercilon kan återupptas 2 veckor efter att behandlingen med detta kombinationspreparat har avslutats.
Laboratorietester
Användning av steroidhormoner som ingår i preventivmedel kan påverka vissa laboratorieparametrar, inklusive biokemiska parametrar för lever-, tyreoidea-, binjure- och njurfunktion, plasmanivåer av bärarproteiner, t ex kortikosteroidbindande globulin och lipid/lipoproteinfraktioner, parametrar för kolhydratmetabolismen och parametrar för koagulation och fibrinolys. Dessa förändringar ligger vanligtvis inom normalområdet.
Fertilitet, graviditet och amning
Graviditet
Mercilon är inte avsett att användas under graviditet. Om kvinnan blir gravid under användning av Mercilon ska behandlingen snarast avbrytas. De flesta epidemiologiska studierna har inte visat någon ökad risk för medfödda missbildningar hos barn till kvinnor som använt kombinerade hormonella preventivmedel innan de blivit gravida, inte heller har man sett några teratogena effekter när kvinnor av misstag behandlats med kombinerade hormonella preventivmedel i tidig graviditet.
Den ökade risken för VTE under postpartumperioden ska beaktas vid återinsättning av Mercilon (se avsnitt Dosering och administreringssätt och Varningar och försiktighet).
Amning
Amningen kan påverkas av kombinerade hormonella preventivmedel eftersom de kan reducera mängden bröstmjölk och även påverka dess sammansättning. Därför ska kombinerade hormonella preventivmedel i allmänhet inte användas förrän den ammande kvinnan helt har avvant barnet. Små mängder av kontraceptiva steroider och/eller metaboliter kan utsöndras i bröstmjölken men det finns inga bevis för att det påverkar barnets hälsa negativt.
Effekter på förmågan att framföra fordon och använda maskiner
Mercilon har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner.
Biverkningar
Beskrivning av utvalda biverkningar
En ökad risk för arteriella och venösa trombotiska och tromboemboliska händelser, t ex myokardiell infarkt, stroke, transitoriska ischemiska attacker, venös trombos och lungemboli har observerats hos kvinnor som använder kombinerade hormonella preventivmedel, vilket diskuteras mer i detalj i avsnitt Varningar och försiktighet.
Även andra biverkningar har rapporterats hos kvinnor som använder kombinerade hormonella preventivmedel. Dessa inkluderar till exempel hypertoni, hormonberoende tumörer (t.ex. levertumörer, bröstcancer), kloasma. Dessa biverkningar beskrivs närmare i avsnitt Varningar och försiktighet.
Som med alla kombinerade hormonella preventivmedel kan förändringar i blödningsmönstret förekomma, särskilt under de första månadernas användning. Dessa kan omfatta förändringar av blödningsfrekvens (utebliven, mer sällan, mer frekvent eller kontinuerlig), intensitet (minskad eller ökad) eller varaktighet.
Möjliga relaterade biverkningar som har rapporterats hos användare av Mercilon eller kombinerade hormonella preventivmedel i allmänhet, anges i tabellen nedan1. Alla biverkningar är listade enligt organklass och frekvens: vanliga (≥1/100), mindre vanliga (≥1/1 000 ‑ <1/100), sällsynta (<1/1 000) och ingen känd frekvens (kan inte beräknas från tillgängliga data).
Organsystem | Vanliga | Mindre vanliga | Sällsynta | Ingen känd frekvens |
Immunsystemet | Överkänslighetsreaktioner | Förvärrade symtom på ärftligt eller förvärvat angioödem | ||
Metabolism och nutrition | Vätskeretention | |||
Psykiska störningar | Nedstämdhet, humörförändring | Minskad libido | Ökad libido | |
Centrala och perifera nervsystemet | Huvudvärk | Migrän | ||
Ögon | Svårighet att använda kontaktlinser | |||
Blodkärl | Venös tromboembolism, arteriell tromboembolism | |||
Magtarmkanalen | Illamående, buksmärta | Kräkningar, diarré | ||
Hud och subkutan vävnad | Utslag, urtikaria | Erythema nodosum, erythema multiforme | ||
Reproduktionsorgan och bröstkörtel | Smärta i brösten, bröstspänning | Bröstförstoring | Vaginal flytning, sekretion från brösten | |
Undersökningar | Viktökning | Viktnedgång | ||
| 1I tabellen har den lämpligaste MedDRA-term som beskriver biverkningen använts. Synonymer samt tillstånd relaterade till symtomet är inte uppräknade men bör också beaktas. | ||||
Interaktioner
Genombrottsblödningar och/eller utebliven antikonception kan bero på interaktioner av andra läkemedel (enzyminducerare) med hormonella preventivmedel (se avsnitt Interaktioner).
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till.
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Det finns inga rapporter om allvarliga, skadliga effekter vid överdos. Symtomen som kan uppträda är: illamående, kräkningar samt lätt vaginalblödning hos unga flickor. Det finns ingen antidot och behandlingen är symtomatisk.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Gestagener och estrogener, fasta kombinationspreparat: ATC-kod: G03AA09
Verkningsmekanism
Den preventiva effekten av kombinerade hormonella preventivmedel baseras på samverkan av många olika faktorer varav den viktigaste är ovulationshämning. Dessutom sker förändring av cervixsekretet. Vid sidan av skydd mot graviditet, har kombinerade hormonella preventivmedel flera andra positiva egenskaper, vilka tillsammans med de negativa egenskaperna (se avsnitt Varningar och försiktighet och Biverkningar) ska beaktas vid val av preventivmetod. Menstruationscyklerna blir mer regelbundna och menstruationerna blir mindre smärtsamma och blödningsmängden minskar. Det senare kan resultera i minskad förekomst av järnbrist. Dessutom har studier av kombinerade högdospreventivmedel (50 µg etinylestradiol) visat att risken för fibrocystiska brösttumörer, ovariecystor, bäckeninflammation, ektopisk graviditet, endometriecancer och ovarialcancer minskar. Om detta även gäller för kombinerade lågdospreventivmedel är ännu inte bekräftat.
Pediatrisk population
Kliniska data om effekt och säkerhet hos ungdomar under 18 år finns inte tillgängliga.
Farmakokinetiska egenskaper
Desogestrel
Absorption
Oralt administrerat desogestrel absorberas snabbt och fullständigt och omvandlas till etonogestrel. Maximal serumkoncentration, cirka 2 ng/ml, uppnås efter cirka 1,5 timme. Biotillgängligheten är 62–81 %.
Distribution
Etonogestrel binds till serumalbumin och sexualhormonbindande globulin (SHBG). Endast 2–4 % av den totala läkemedelskoncentrationen i serum finns närvarande som fri steroid. 40–70 % är bundet till SHBG. Ökningen av SHBG som induceras av etinylestradiol påverkar distributionen mellan bärarproteiner och ger en ökning av den SHBG-bundna fraktionen och en minskning av den albuminbundna. Den skenbara distributionsvolymen för desogestrel är 1,5 l/kg.
Metabolism
Etonogestrel metaboliseras via de kända vägarna för steroidmetabolism. Metabolismen är fullständig. Clearance från serum är cirka 2 ml/minut/kg. Ingen interaktion upptäcktes med samtidigt givet etinylestradiol.
Eliminering
Serumnivåerna av etonogestrel minskar i två faser. Den slutliga eliminationsfasen karakteriseras av en halveringstid på cirka 30 timmar. Av desogestrel och dess metaboliter utsöndras 60 % via urin och 40 % via galla.
Steady-state förhållanden
Farmakokinetiken för etonogestrel påverkas av SHBG-nivåerna, vilka ökar trefaldigt av etinylestradiol. Efter dagligt intag ökar serumnivåerna två- till trefaldigt och steady-state nivåer uppnås under den andra hälften av behandlingscykeln.
Etinylestradiol
Absorption
Oralt administrerat etinylestradiol absorberas snabbt och fullständigt. Maximal serumkoncentration, cirka 45 pg/ml, uppnås inom 1–2 timmar. Den absoluta biotillgängligheten är cirka 60 % och är ett resultat av presystemisk konjugering och första passage-metabolism.
Distribution
Etinylestradiol är i hög grad, men icke-specifikt, bundet till serumalbumin (cirka 98,5 %) och inducerar en ökning av serumkoncentrationen av SHBG. Den skenbara distributionsvolymen har fastställts till cirka 5 l/kg.
Metabolism
För etinylestradiol sker presystemisk konjugering i såväl slemhinnan i tunntarmen som i levern. Etinylestradiol metaboliseras primärt genom aromatisk hydroxylering, men ett stort antal olika hydroxylerade och metylerade metaboliter bildas. Dessa finns i blodcirkulationen som fria metaboliter och som sulfat- och glukuronidkonjugat. Clearance är cirka 5 ml/min/kg.
Etinylestradiol är in vitro en reversibel hämmare av CYP2C19, CYP1A1 och CYP1A2, samt även en mekanismbaserad hämmare av CYP3A4/5, CYP2C8 och CYP2J2.
Eliminering
Serumnivåerna av etinylestradiol minskar i två faser. Den slutliga eliminationsfasen karakteriseras av en halveringstid på cirka 24 timmar. Inget oförändrat etinylestradiol utsöndras. Av metaboliterna utsöndras 40 % via urin och 60 % via galla. Halveringstiden för utsöndringen av metaboliterna är cirka 1 dag.
Steady-state förhållanden
Steady-state nivå uppnås efter 3–4 dagar, då serumnivåerna är 30–40 % högre än vid singeldos.
Prekliniska säkerhetsuppgifter
I prekliniska studier har ingen risk för människor framkommit när kombinerade hormonella preventivmedel används enligt rekommendationerna. Detta baseras på gängse studier avseende allmäntoxicitet, gentoxicitet, karcinogenicitet och kombinerade hormonella preventivmedels reproduktionstoxikologiska effekter.
Man ska dock ha i åtanke att könshormoner kan påverka tillväxt av vissa hormonberoende vävnader och tumörer.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
kiseldioxid, kolloidal, vattenfri
laktosmonohydrat
potatisstärkelse
povidon
stearinsyra
all-rac-alfa-tokoferol
Inkompatibiliteter
Ej relevant.
Hållbarhet
3 år.
Särskilda förvaringsanvisningar
Förvaras vid högst 25 °C.
Ljuskänsligt.
Fuktkänsligt.
Förvaras i originalförpackningen.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
MERCILON tabletti
150/20 mikrog (L:kyllä) 3 x 21 fol (18,61 €), 6 x 21 fol (36,82 €)
PF-selosteen tieto
PVC/aluminiumblister förpackad i en aluminiumlaminerad påse. Varje blisterförpackning innehåller 21 tabletter. Påsarna är förpackade i en tryckt kartong tillsammans med bipacksedeln. Förpackningsstorlekarna är 1 x 21, 3 x 21, 6 x 21 tabletter.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Läkemedlets utseende:
Tabletterna är runda, bikonvexa och 6 mm i diameter. På ena sidan märkta med TR med 4 nedanför och på den andra sidan Organon*.
Särskilda anvisningar för destruktion och övrig hantering
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Ersättning
MERCILON tabletti
150/20 mikrog 3 x 21 fol, 6 x 21 fol
- Ei korvausta.
Atc-kod
G03AA09
Datum för översyn av produktresumén
30.05.2022
Yhteystiedot
 Organon Finland Oy
Organon Finland Oy Puolikkotie 8, 5. krs
02230 Espoo
Suomi
029 170 3520
dpoc.finland@organon.com
