INNOVAIR NEXTHALER inhalaatiojauhe 200/6 mikrog/annos
Vaikuttavat aineet ja niiden määrät
Yksi mitattu 10 mg:n annos inhalaatiojauhetta sisältää: 200 mikrogrammaa vedetöntä beklometasonidipropionaattia ja 6 mikrogrammaa formoterolifumaraattidihydraattia. Tämä vastaa potilaan saamaa annosta (suukappaleesta lähtevä annos) 158,8 mikrogrammaa beklometasonidipropionaattia ja 4,9 mikrogrammaa formoterolifumaraattidihydraattia.
Apuaine, jonka vaikutus tunnetaan: yksi inhalaatio sisältää 9,8 mg laktoosimonohydraattia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Inhalaatiojauhe.
Kliiniset tiedot
Käyttöaiheet
Innovair nexthaler on tarkoitettu astman säännölliseen hoitoon silloin, kun lääkitys yhdistelmävalmisteella (inhaloitava kortikosteroidi ja pitkävaikutteinen beeta2-agonisti) on tarkoituksenmukaista:
- jos potilaan tilaa ei saada riittävään hoitotasapainoon inhaloitavilla kortikosteroideilla ja tarvittaessa käytettävillä inhaloitavilla nopeavaikutteisilla beeta2-agonisteilla
- jos potilaan tila on jo riittävästi hallinnassa käytettäessä sekä inhaloitavaa kortikosteroidivalmistetta että pitkävaikutteisia beeta2-agonisteja.
Innovair nexthaler on tarkoitettu aikuisille.
Huomautus: Innovair nexthalerin käytöstä akuuttien astmakohtausten hoidossa ei ole kliinisesti merkityksellistä tietoa.
Annostus ja antotapa
Annostus
Innovair nexthaler ei ole tarkoitettu astman hoidon aloittamiseen. Annostus on yksilöllinen, ja se on sovitettava sairauden vaikeusasteen mukaan. Tämä on otettava huomioon sekä yhdistelmävalmistehoitoa aloitettaessa että annosta muutettaessa. Jos yksittäinen potilas tarvitsee hoitoa muunlaisella annosyhdistelmällä kuin yhdistelmävalmisteen sisältämät annokset, hänelle on määrättävä sopivat annokset beeta2-agonisteja ja/tai kortikosteroideja erillisistä inhalaattoreista.
Koska Innovair nexthaler ‑valmisteen hiukkaskoko on erittäin hienojakoinen, annosta on muutettava, jos potilas siirtyy Innovair nexthaler ‑valmisteen käyttöön sellaisesta valmisteesta, jonka koostumus ei ole yhtä hienojakoinen. Tällöin on otettava huomioon, että Innovair nexthaler ‑valmistetta käytettäessä beklometasonidipropionaatin suositeltava vuorokausiannos on pienempi kuin käytettäessä sellaista beklometasonidipropionaattia sisältävää valmistetta, jonka koostumus ei ole yhtä hienojakoinen, ja annos on sovitettava potilaskohtaisesti.
Annossuositus vähintään 18-vuotiaille aikuisille:
Kaksi inhalaatiota kaksi kertaa vuorokaudessa.
Enimmäisvuorokausiannos on 4 inhalaatiota.
Lääkärin on arvioitava potilaan tilaa säännöllisesti, jotta Innovair nexthalerin annostus pysyy optimaalisena, ja annosta saa muuttaa vain lääkärin suosituksesta. Annos on titrattava pienimpään mahdolliseen annokseen, jolla oireet saadaan pysymään tehokkaasti hallinnassa. Kun oireet on saatu hallintaan pienimmällä suositellulla annoksella, seuraavaksi voidaan kokeilla hoitoa yksinään käytettävällä inhaloitavalla kortikosteroidilla. Tätä tarkoitusta varten on saatavana nexthaler-inhalaattori, joka sisältää pienemmän määrän beklometasonidipropionaattia annosta kohden (Innovair nexthaler 100 mikrog/6 mikrog/annos).
Potilasta on neuvottava käyttämään Innovair nexthaler ‑valmistetta päivittäin, vaikka hänellä ei esiintyisikään oireita.
Erityiset potilasryhmät:
Annostusta ei tarvitse muuttaa iäkkäille potilaille.
Innovair nexthaler ‑valmisteen käytöstä maksan tai munuaisten vajaatoimintaa sairastaville ei ole tietoa (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Innovair nexthaler 200 mikrog/6 mikrog/annos ‑valmistetta ei pidä käyttää alle 18-vuotiaiden lasten ja nuorten hoitoon.
Antotapa
Innovair nexthaler on tarkoitettu inhalaatioon.
Nexthaler toimii sisäänhengityksen voimalla. Keskivaikeaa ja vaikeaa astmaa sairastavien potilaiden on osoitettu kykenevän tuottamaan sisäänhengitysvirtauksen, joka riittää laukaisemaan annoksen nexthaler‑inhalaattorista (ks. kohta Farmakodynamiikka). Innovair nexthaler ‑valmisteen kulkeutuminen elimistöön ei riipu virtauksen voimakkuudesta sillä sisäänhengityksen voimakkuuden alueella, jonka tämä potilasryhmä kykenee tuottamaan inhalaattorin läpi.
Nexthaler‑inhalaattorin oikea käyttötapa on ehdottoman tärkeä hoidon onnistumisen kannalta. Potilasta on neuvottava lukemaan pakkausseloste huolellisesti ja noudattamaan siinä annettuja ohjeita. Katso käyttöohjeet alta.
Jos potilas ei ole ottanut inhalaatiota inhalaattorin läpi, annoslaskurin ikkunassa näkyvä annosten lukumäärä ei pienene, kun suojus suljetaan.
Potilasta on neuvottava avaamaa inhalaattorin suojus vasta ennen käyttöä. Jos potilas on avannut suojuksen, mutta ei inhaloi annosta, ja sulkee suojuksen, mitattu annos palautuu takaisin inhalaattorin sisällä olevan jauheen joukkoon. Potilas voi ottaa seuraavan mitatun annoksen turvallisesti.
Potilaan on huuhdeltava suu tai kurlattava kurkku vedellä tai harjattava hampaat inhalaation ottamisen jälkeen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
INNOVAIR NEXTHALER ‑INHALAATTORIN KÄYTTÖOHJEET
A. Pakkauksen sisältö
Lisätietoa tämän pakkauksen sisällöstä, katso kappale Pakkaukset ja valmisteen kuvaus
Jos pakkauksen sisältö ei ole sama kuin kappaleessa 6.5, palauta inhalaattorisi paikkaan, josta sen sait ja hanki uusi.
B. Yleiset varoitukset ja varotoimet
- Älä ota inhalaattoria pussista, jollet aio käyttää sitä heti.
- Käytä inhalaattoria vain tämän ohjeen mukaisesti.
- Pidä suojus suljettuna, kunnes otat annoksen.
- Säilytä inhalaattori käyttökertojen välillä puhtaassa ja kuivassa paikassa.
- Älä irrota nexthaler ‑inhalaattorin osia toisistaan mistään syystä.
C. Nexthaler ‑inhalaattorin tärkeimmät osat
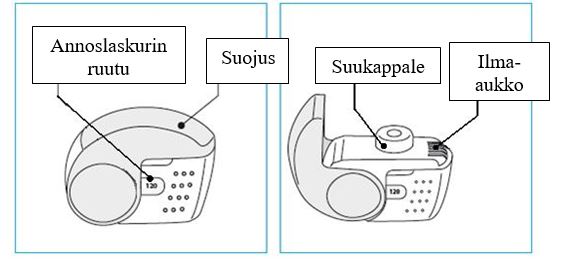
Nexthaler ‑inhalaattorin käytössä on kolme helppoa vaihetta: avaa, inhaloi, sulje.
D. Ennen uuden nexthaler ‑inhalaattorin käyttöä
1. Avaa pussi ja ota inhalaattori pussista.
- Älä käytä inhalaattoria, jos pussin sinetöinti on auki tai pussi on rikki. Palauta inhalaattori paikkaan, josta sait sen, ja hanki uusi.
- Kirjoita ulkopakkaukseen päivämäärä, jolloin avasit pussin
2. Tarkista inhalaattori.
- Jos inhalaattori näyttää rikkoutuneelta tai vaurioituneelta, palauta se paikkaan, josta sait sen, ja hanki uusi.
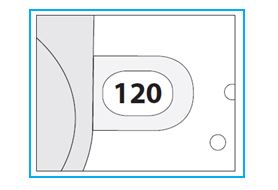
3. Tarkista annoslaskurin ruutu. Jos inhalaattori on vielä käyttämätön, ruudussa näkyvä lukema on 120.
- Älä käytä uutta inhalaattoria, jos lukema on pienempi kuin 120. Palauta inhalaattori paikkaan, josta sait sen, ja hanki uusi.
E. Näin käytät nexthaler ‑inhalaattoria
- Jos et ole varma oletko saanut oikean annoksen, ota yhteys apteekkihenkilökuntaan tai lääkäriin
- Jos et ole varma onko annoslaskuri liikkunut yhden inhalaation jälkeen, odota kunnes on seuraavan annoksesi aika ja ota se normaalisti. Älä ota ylimääräistä annosta
E.1. Avaaminen
1. Pidä inhalaattoria pystyasennossa.
2. Tarkista jäljellä olevien annosten lukumäärä: jos lukema on 1–120, annoksia on jäljellä.
- Jos annoslaskurin ruudussa näkyvä lukema on 0, annoksia ei ole jäljellä. Hävitä inhalaattori ja hanki uusi.
3. Avaa suojus kokonaan.
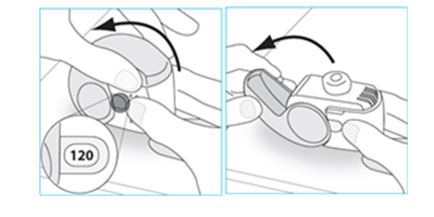
4. Ennen inhalaatiota hengitä ulos niin kauan kuin tuntuu hyvältä.
- Älä hengitä ulos inhalaattorin kautta
E.2. Inhalointi
Jos mahdollista, seiso tai istu pystyasennossa, kun otat inhalaation
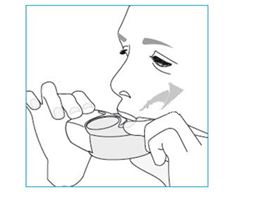
1. Nosta inhalaattori huulillesi ja sulje huulet suukappaleen ympärille.
- Älä tuki ilma-aukkoa, kun pitelet inhalaattoria.
- Älä hengitä sisään ilma-aukon kautta.
2. Hengitä sisään voimakkaasti ja syvään suun kautta.
- Saatat tuntea suussasi aineen maun, kun otat annoksen.
- Saatat kuulla tai tuntea naksahduksen, kun otat annoksen.
- Älä hengitä sisään nenän kautta.
- Älä ota inhalaattoria suustasi inhalaation aikana.
3. Ota inhalaattori pois suusta.
4. Pidätä hengitystäsi 5–10 sekunnin ajan tai niin pitkään kuin tuntuu hyvältä.
5. Hengitä hitaasti ulos.
- Älä hengitä ulos inhalaattorin kautta.
E.3. Sulkeminen
1. Laita inhalaattori taas pystyasentoon ja sulje suojus kokonaan.
2. Tarkista, että annoslaskurin lukema on vähentynyt yhdellä.
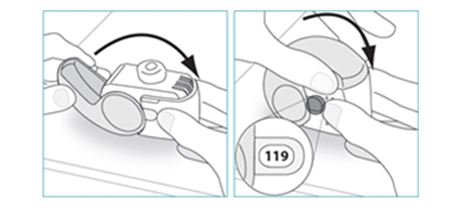
3. Jos tarvitset toisen annoksen, toista vaiheet E.1–E.3.
F. Puhdistus
- Inhalaattoria ei yleensä tarvitse puhdistaa.
-
Tarvittaessa voit puhdistaa inhalaattorin kuivalla liinalla tai paperipyyhkeellä käytön jälkeen.
- Älä käytä puhdistukseen vettä tai muuta nestettä. Älä kastele inhalaattoria.
G. Säilytys ja hävitys
Lisätietoa säilytysolosuhteista ja hävittämisestä, katso kappaleet 6.4 ja 6.6
Vasta-aiheet
Yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille
Varoitukset ja käyttöön liittyvät varotoimet
On suositeltavaa, että annosta pienennetään asteittain ennen valmisteen käytön lopettamista. Hoitoa ei saa keskeyttää äkillisesti.
Astman hoidossa on yleensä noudatettava asteittaista hoito-ohjelmaa. Potilaan vastetta on tarkkailtava kliinisesti ja keuhkojen toimintaa mittaavilla kokeilla.
Jos hoito ei potilaan mielestä tehoa, hänen on käännyttävä lääkärin puoleen. Keuhkoputkia laajentavien lääkkeiden käytön lisääntyminen on merkki taudin vaikeutumista, ja astman hoito on syytä arvioida uudelleen. Äkillinen ja etenevä astman hallinnan huononeminen saattaa johtaa hengenvaaralliseen tilanteeseen, ja potilaan hoito on arvioitava kiireellisesti uudelleen. Jos epäillään infektiota, on harkittava inhaloitavien tai suun kautta otettavien kortikosteroidien annoksen suurentamista tai antibioottihoitoa.
Potilaalle ei saa aloittaa Innovair nexthaler ‑hoitoa taudin pahenemisvaiheen aikana eikä silloin, jos astma pahenee huomattavasti tai äkillisesti. Innovair nexthaler ‑hoidon aikana voi esiintyä vakavia astmaan liittyviä haittavaikutuksia ja pahenemisvaiheita. Potilasta on kehotettava jatkamaan hoitoa, mutta hakeutumaan lääkärin vastaanotolle, jos astman oireita ei saada hallintaan tai jos ne pahenevat Innovair nexthaler ‑hoidon aloittamisen jälkeen.
Kuten muunkin inhalaatiohoidon yhteydessä, paradoksista bronkospasmia voi ilmetä, jolloin hengityksen vinkuminen, yskä tai hengenahdistus lisääntyy pian lääkkeen ottamisen jälkeen. Tällaiset oireet on hoidettava heti nopeavaikutteisella inhaloitavalla keuhkoputkia laajentavalla lääkkeellä. Innovair nexthaler ‑valmisteen käyttö on lopetettava heti, potilaan tila arvioitava ja tarvittaessa aloitettava vaihtoehtoinen hoito.
Innovair nexthaleria ei ole tarkoitettu astman hoidon aloittamiseen.
Potilaan on syytä pitää nopeavaikutteinen keuhkoputkia laajentava lääke aina mukana akuuttien astmakohtausten varalta.
Potilasta on muistutettava käyttämään Innovair nexthaler ‑hoitoa päivittäin, vaikka oireita ei esiintyisikään. Kun astman oireet on saatu hallintaan, Innovair nexthaler ‑annoksen pienentämistä vähitellen voidaan harkita. Potilaan tilan säännöllinen seuranta on tärkeää, kun annostusta pienennetään. Potilaalle on käytettävä pienintä tehokasta Innovair nexthaler ‑annosta (ks. kohta Annostus ja antotapa).
Inhaloitavat kortikosteroidit voivat aiheuttaa systeemisiä vaikutuksia etenkin, jos niitä käytetään suurina annoksina pitkän aikaa. Systeemisten vaikutusten esiintyminen on kuitenkin vähemmän todennäköistä kuin käytettäessä suun kautta otettavia kortikosteroideja. Mahdollisia systeemisiä vaikutuksia ovat Cushingin oireyhtymä, Cushingin oireyhtymään liittyvät oireet, lisämunuaisen toiminnan estyminen, lasten ja nuorten kasvun hidastuminen, luuntiheyden pieneneminen, kaihi ja glaukooma sekä harvemmin psykologiset ja käyttäytymiseen liittyvät vaikutukset, kuten psykomotorinen hyperaktiivisuus, unihäiriöt, ahdistuneisuus, masentuneisuus tai aggressiivinen käyttäytyminen (erityisesti lapsilla). Siksi on tärkeää, että inhaloitavaa kortikosteroidia käytettäessä haetaan pienin annos, jolla astma pysyy tehokkaasti hallinnassa.
Pitkäaikainen hoito suurilla inhaloitavilla kortikosteroidiannoksilla voi johtaa lisämunuaisen toiminnan estymiseen ja akuuttiin lisämunuaiskriisiin. Jos alle 16-vuotias lapsi tai nuori inhaloi suurempia annoksia kuin beklometasonidipropionaatin suositusannokset, hänellä tällainen riski saattaa olla erityisen suuri. Trauma, leikkaus, infektio tai annoksen nopea pienentäminen voi aiheuttaa akuutin Addisonin kriisin. Oireet ovat tavallisesti epämääräisiä. Niitä voivat olla ruokahaluttomuus, vatsakipu, painon lasku, väsymys, päänsärky, pahoinvointi, oksentelu, hypotensio, tajunnantason aleneminen, hypoglykemia ja kouristukset. Lisähoitoa systeemisillä kortikosteroideilla on harkittava stressitilanteiden tai suunniteltujen leikkausten yhteydessä.
Potilaan siirtyessä oraalisista kortikosteroideista inhaloitavien kortikosteroidien käyttöön voi lisämunuaisreservin heikentymisen riski säilyä melko pitkään. Potilailla, jotka ovat aiemmin tarvinneet suuria kortikosteroidiannoksia kohtaushoitona tai saaneet pitkään hoitoa suurilla inhaloitavilla kortikosteroidiannoksilla, voi olla vastaava riski. Tällaiset reservien heikkenemisen jäännösvaikutukset on huomioitava aina stressiä aiheuttavissa hätätilanteissa ja suunniteltujen toimenpiteiden yhteydessä, ja asianmukaisen kortikosteroidihoidon aloittamista on harkittava. Lisämunuaisten toiminnan heikkenemisen vaikeusaste saattaa vaatia erikoislääkärin konsultaatiota ennen suunniteltuja toimenpiteitä.
Innovair nexthaler ‑valmistetta on annettava varoen potilaille, joilla on aktiivinen tai rauhallisessa vaiheessa oleva keuhkotuberkuloosi tai hengitysteiden sieni- tai virusinfektio.
Innovair nexthaler ‑valmistetta on käytettävä varoen (mihin voi kuulua seuranta), jos potilaalla on sydämen rytmihäiriöitä, etenkin kolmannen asteen eteis-kammiokatkos ja takyarytmiaa, idiopaattinen subvalvulaarinen aortan ahtauma, hypertrofinen obstruktiivinen kardiomyopatia, iskeeminen sydänsairaus, vaikea sydämen vajaatoiminta, vaikea verenpainetauti tai aneurysma.
Potilaan hoidossa on oltava varovainen myös, jos hänellä tiedetään tai epäillään olevan joko synnynnäistä tai lääkehoidosta johtuvaa QTc-ajan pitenemistä (QTc > 0,44 sekuntia). Myös formoteroli saattaa pidentää QTc-aikaa.
Innovair nexthaler ‑hoidossa on oltava varovainen myös, jos potilaalla on tyreotoksikoosi, diabetes mellitus, feokromosytooma tai hoitamaton hypokalemia.
Beeta2-agonistihoito voi aiheuttaa mahdollisesti vakavaa hypokalemiaa. Vaikeaa astmaa sairastavien hoidossa on oltava erityisen varovainen, koska hypoksia saattaa voimistaa tätä vaikutusta. Myös muu samanaikainen hypokalemiaa mahdollisesti aiheuttava lääkehoito (esim. ksantiinijohdannaiset, steroidit ja diureetit) voi voimistaa hypokalemiaa (ks. kohta Yhteisvaikutukset). Varovaisuutta suositellaan myös, jos astman hoitotasapaino on huono, jolloin potilaalla voi olla käytössä useita keuhkoputkia laajentavia lääkkeitä kohtauslääkkeinä. Seerumin kaliumarvojen seurantaa suositellaan tällaisissa tilanteissa.
Formoterolin käyttö inhalaationa saattaa suurentaa veren glukoosipitoisuutta. Tästä syystä diabeetikkojen verensokeriarvoja on seurattava tarkoin.
Jos potilaalle suunnitellaan anestesiaa halogenoiduilla anesteeteilla, on varmistettava, ettei Innovair nexthaler ‑valmistetta anneta vähintään 12 tuntiin ennen anestesian aloittamista, koska siitä aiheutuu sydämen rytmihäiriöiden riski.
Potilasta on neuvottava huuhtelemaan suu tai kurlaamaan kurkku vedellä tai harjaamaan hampaat hänelle määrätyn inhalaatioannoksen ottamisen jälkeen, mikä pienentää suun ja nielun sieni-infektion riskiä.
Tämä lääkevalmiste sisältää laktoosia. Laktoosi sisältää pieniä määriä maitoproteiineja, jotka voivat aiheuttaa allergisen reaktion. Potilaiden, joilla on harvinainen perinnöllinen galaktoosi-intoleranssi, täydellinen laktaasinpuutos tai glukoosi-galaktoosi-imeytymishäiriö, ei pidä käyttää tätä lääkettä.
Näköhäiriö
Systeemisesti tai topikaalisesti käytettävien kortikosteroidien käytön yhteydessä saatetaan ilmoittaa näköhäiriöistä. Jos potilaalla esiintyy oireita, kuten näön hämärtymistä tai muita näköhäiriöitä, potilas on ohjattava silmälääkärille, joka arvioi oireiden mahdolliset syyt. Niitä voivat olla kaihi, glaukooma tai harvinaiset sairaudet, kuten sentraalinen seroosi korioretinopatia, joista on ilmoitettu systeemisten tai topikaalisten kortikosteroidien käytön jälkeen.
Yhteisvaikutukset
Farmakokineettiset yhteisvaikutukset
Beklometasonidipropionaatti metaboloituu esteraasientsyymien välityksellä.
Beklometasoni on vähemmän riippuvainen CYP3A-välitteisestä metaboliasta kuin jotkin muut kortikosteroidit, ja yleensä ottaen yhteisvaikutukset ovat epätodennäköisiä; systeemisten vaikutusten mahdollisuutta ei voida kuitenkaan poissulkea samanaikaisessa käytössä voimakkaiden CYP3A:n estäjien (kuten ritonaviirin tai kobisistaatin) kanssa, ja siksi varovaisuus ja asianmukainen seuranta on suositeltavaa tällaisten aineiden käytössä.
Farmakodynaamiset yhteisvaikutukset
Beetasalpaajat voivat heikentää tai estää formoterolin vaikutusta. Innovair nexthaler ‑valmistetta ei siksi saa käyttää samanaikaisesti beetasalpaajien (myös silmätippojen) kanssa, jollei käyttöön ole pakottavaa syytä.
Muiden beeta-adrenergisten lääkeaineiden samanaikaisella käytöllä saattaa olla additiivisia vaikutuksia. Hoidossa on siksi oltava varovainen, jos samanaikaisesti formoterolin kanssa määrätään teofylliiniä tai muita beeta-adrenergisia lääkkeitä.
Samanaikainen hoito kinidiinillä, disopyramidilla, prokaiiniamidilla, fentiatsiineilla, tietyillä antihistamiineilla (esimerkiksi terfenadiinilla), MAO:n estäjillä tai trisyklisillä masennuslääkkeillä saattaa pidentää QTc-aikaa ja lisätä kammioarytmian riskiä.
Lisäksi levodopa, levotyroksiini, oksitosiini ja alkoholi voivat heikentää sydämen beeta-2-sympatomimeettien sietokykyä.
Samanaikainen hoito MAO:n estäjillä tai lääkeaineilla, joilla on samankaltaisia ominaisuuksia (kuten furatsolidoni ja prokarbatsiini), voi edistää hypertensiivisten reaktioiden ilmaantumista.
Arytmian riski suurenee, jos potilaalle annetaan hoidon aikana anestesia halogenoiduilla hiilivety-yhdisteillä.
Samanaikainen hoito ksantiinijohdannaisilla, steroideilla tai diureeteilla saattaa voimistaa beeta-2-agonistien mahdollisia hypokaleemisia vaikutuksia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Hypokalemia voi lisätä alttiutta sydämen rytmihäiriöille, jos potilas saa hoitoa digitalisglykosideilla.
Raskaus ja imetys
Raskaus
Ei ole oleellisia kliinisiä tietoja Innovair nexthaler ‑valmisteen käytöstä raskaana oleville naisille. Beklometasonidipropionaatin ja formoterolin yhdistelmällä tehdyissä eläinkokeissa havaittiin lisääntymiseen ja sikiöön kohdistuvaa toksisuutta suuren systeemisen altistuksen jälkeen (ks. kohta Prekliiniset tiedot turvallisuudesta). Tiineille eläimille annettujen suurten kortikosteroidiannosten tiedetään aiheuttavan poikkeavuuksia sikiön kehitykseen, kuten suulakihalkiota ja kohdunsisäisen kehityksen hidastumista. Koska beeta2-sympatomimeettisillä lääkeaineilla on tokolyyttisiä vaikutuksia, valmisteen käytössä on oltava varovainen synnytyksen lähestyessä. Formoterolin käyttöä ei suositella raskauden aikana, etenkään raskauden loppuvaiheissa tai synnytyksen aikana, jos saatavilla on toinen (turvallisempi) hoitovaihtoehto.
Innovair nexthaler ‑valmisteen käyttöä raskauden aikana tulisi harkita vain, jos hoidosta odotettavat hyödyt ovat mahdollisia riskejä suuremmat.
Imetys
Ei ole oleellisia kliinisiä tietoja Innovair nexthaler ‑valmisteen käytöstä ihmiselle imetyksen aikana.
Vaikka eläinkokeista saatuja tietoja ei ole, beklometasonidipropionaatin voidaan olettaa erittyvän maitoon muiden kortikosteroidien tavoin.
Vaikka formoterolin erittymisestä ihmisen rintamaitoon ei ole tietoa, sitä on havaittu imettävien eläinten maidossa.
Innovair nexthaler ‑valmisteen antamista imettäville äideille tulisi harkita, jos hoidosta odotettavat hyödyt ovat sen mahdollisia haittoja suuremmat. On päätettävä lopetetaanko rintaruokinta vai lopetetaanko Innovair nexthaler ‑hoito ottaen huomioon rintaruokinnasta aiheutuvat hyödyt lapselle ja hoidosta koituvat hyödyt äidille.
Hedelmällisyys
Tutkimustietoa Innovair nexthaler -valmisteen vaikutuksesta ihmisen hedelmällisyyteen ei ole. Rotilla tehdyissä tutkimuksissa beklometasonidipropionaattiin liittyi naaraan hedelmällisyyden heikkenemistä ja alkioon kohdistuvaa toksisuutta, kun sitä annettiin suuria annoksia osana yhdistelmähoitoa (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Innovair nexthaler ‑valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneiden käyttökykyyn.
Haittavaikutukset
Yleisin haittavaikutus on vapina. Innovair nexthaler 100 mikrog/6 mikrog/annos ‑valmisteella tehdyssä 12 viikkoa kestäneessä kliinisessä tutkimuksessa vapinaa ilmeni vain käytettäessä suurimpia annoksia (400/24 mikrogrammaa vuorokaudessa), tavallisimmin hoidon alussa, ja se oli voimakkuudeltaan lievää. Yksikään potilas ei keskeyttänyt tutkimusta vapinan takia.
Astmaatikoille tehtyjen kliinisten tutkimusten tulokset
Innovair nexthaler 100 mikrog/6 mikrog/annos -valmisteen turvallisuutta arvioitiin vaikuttavalla aineella kontrolloiduissa ja lumekontrolloiduissa kliinisissä tutkimuksissa, joissa valmistetta annettiin 719:lle vähintään 12-vuotiaalle eri vaikeusasteista astmaa sairastavalle potilaalle. Seuraavassa taulukossa mainitut esiintymistiheydet koskevat vähintään 12-vuotiaita astmaatikkoja, ja ne perustuvat kahdesta keskeisestä kliinisestä tutkimuksesta saatuihin turvallisuustietoihin. Näissä tutkimuksissa Innovair nexthaler 100 mikrog/6 mikrog/annos ‑valmistetta annettiin tässä valmisteyhteenvedossa suositelluilla annoksilla 8–12 viikon ajan. Innovair nexthaler 100 mikrog/6 mikrog/annos ‑valmisteella tehdyissä kliinisissä tutkimuksissa ei havaittu psyykkisiä häiriöitä, mutta ne on sisällytetty taulukkoon inhaloitavien kortikosteroidien mahdollisina luokkavaikutuksina.
Beklometasonidipropionaatin ja formoterolin kiinteän yhdistelmän (Innovair nexthaler) käyttöön liittyvät haittavaikutukset esitetään seuraavassa elinjärjestelmittäin. Yleisyysluokat on määritelty seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000) ja hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
Elinjärjestelmä | Haittavaikutus | Yleisyysluokka |
Infektiot | Nenänielun tulehdus | Melko harvinainen |
Suun kandidiaasi | Melko harvinainen | |
Aineenvaihdunta ja ravitsemus | Hypertriglyseridemia | Melko harvinainen |
Psyykkiset häiriöt | Psykomotorinen hyperaktiivisuus, unihäiriöt, ahdistuneisuus, masennus, aggressiivisuus, käytöshäiriöt (erityisesti lapsilla) | Tuntematon |
Silmät | Näön hämärtyminen (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet) | Tuntematon |
Hermosto | Vapina | Yleinen |
Päänsärky | Melko harvinainen | |
Sydän | Takykardia | Melko harvinainen |
Sinusbradykardia | Melko harvinainen | |
Rasitusrintakipu (angina pectoris) | Melko harvinainen | |
Sydänlihaksen iskemia | Melko harvinainen | |
Hengityselimet, rintakehä ja välikarsina | Kurkun ärsytys, astman paheneminen | Melko harvinainen |
Hengenahdistus | Melko harvinainen | |
Suunielun kipu | Melko harvinainen | |
Dysfonia | Melko harvinainen | |
Yskä | Melko harvinainen | |
Ruoansulatuselimistö | Pahoinvointi | Melko harvinainen |
Yleisoireet ja antopaikassa todettavat haitat | Uupumus | Melko harvinainen |
Ärtyneisyys | Melko harvinainen | |
Tutkimukset | QT-ajan piteneminen EKG:ssä | Melko harvinainen |
Virtsan vapaan kortisolin pitoisuuden pieneneminen | Melko harvinainen | |
Veren kortisolipitoisuuden pieneneminen | Melko harvinainen | |
Veren kaliumpitoisuuden suureneminen | Melko harvinainen | |
Veren glukoosipitoisuuden suureneminen | Melko harvinainen | |
Huono R-aallon progressio EKG:ssä | Melko harvinainen |
Formoterolin käytön yhteydessä tyypillisesti havaittavia haittavaikutuksia ovat: vapina, päänsärky, takykardia, sinusbradykardia, rasitusrintakipu, sydänlihaksen iskemia, QT-ajan piteneminen.
Beklometasonidipropionaatin käyttöön tyypillisesti liittyviä haittavaikutuksia ovat: nenänielun tulehdus, suun kandidiaasi, dysfonia, kurkun ärsytys, ärtyneisyys, virtsan vapaan kortisolin pitoisuuden pieneneminen, veren kortisolipitoisuuden pieneneminen, veren glukoosipitoisuuden suureneminen.
Muita haittavaikutuksia, joita ei ole havaittu Innovair nexthalerin kliinisessä käytössä, mutta joita havaitaan tyypillisesti inhaloitavan beklometasonidipropionaatin käytön yhteydessä, ovat muut suun sieni-infektiot. Makuhäiriöitä on toisinaan raportoitu inhaloitavan kortikosteroidihoidon yhteydessä.
Kohdassa Varoitukset ja käyttöön liittyvät varotoimet on esitetty toimenpiteitä, joilla voi vähentää suun sieni-infektioiden, suun kandidiaasin ja dysfonian ilmenemistä.
Inhaloitavat kortikosteroidit (kuten beklometasonidipropionaatti) voivat aiheuttaa esiintyä systeemisiä vaikutuksia etenkin, jos niitä käytetään suurina annoksina pitkän aikaa. Mahdollisia systeemisiä vaikutuksia voivat olla Cushingin oireyhtymä, Cushingin oireyhtymään liittyvät oireet, lisämunuaisen toiminnan estyminen, luuntiheyden pieneneminen, lasten ja nuorten kasvun hidastuminen, kaihi ja glaukooma (ks. myös 4.4).
Muita haittavaikutuksia, joita ei ole havaittu kliinisessä käytössä, kun Innovair nexthaler 100 mikrog/6 mikrog/annos ‑valmistetta on käytetty terapeuttisilla annoksilla, mutta joita havaitaan tyypillisesti beeta2-agonistien (kuten formoterolin) käytön yhteydessä, ovat sydämentykytys, eteisvärinä, kammiolisälyönnit, takyarytmia, mahdollisesti vakava hypokalemia ja verenpaineen nousu tai lasku. Inhaloitavan formoterolin käytön yhteydessä on toisinaan raportoitu unettomuutta, heitehuimausta, levottomuutta ja ahdistuneisuutta. Formoteroli voi myös aiheuttaa lihaskramppeja ja myalgiaa.
Yliherkkyysreaktioita, kuten ihottumaa, nokkosihottumaa, kutinaa, ihon punoitusta sekä silmien, kasvojen, huulten ja kurkun turvotusta, on ilmoitettu.
Kuten muunkin inhalaatiohoidon yhteydessä, paradoksista bronkospasmia voi ilmetä, jolloin hengityksen vinkuminen, yskä tai hengenahdistus lisääntyy lääkkeen ottamisen jälkeen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista kansallisen ilmoitusjärjestelmän kautta: www.fimea.fi
Yliannostus
Innovair nexthalerin suurin suositeltu kerta-annos on 2 inhalaatiota. Astmaatikoille tehdyissä tutkimuksissa on käytetty neljää kumulatiivista Innovair nexthaler ‑inhalaatiota (beklometasonidipropionaattiannos yhteensä 800 mikrogrammaa, formoteroliannos 24 mikrogrammaa yhtenä annoksena). Kumulatiivinen hoito ei aiheuttanut epänormaaleja kliinisesti merkityksellisiä vaikutuksia peruselintoimintoihin, eikä vakavia tai vaikeita haittavaikutuksia havaittu (ks. myös kohta Haittavaikutukset).
Astmapotilaille on annettu tutkimuksissa inhalaatiosumutetta 100/6 mikrogramman annoksina enintään kaksitoista kumulatiivista sumutuskertaa (beklometasonidipropionaatin kokonaisannos 1200 mikrogrammaa, formoterolin kokonaisannos 72 mikrogrammaa). Kumulatiivinen hoito ei aiheuttanut poikkeavuuksia peruselintoimintoihin, eikä vakavia tai vaikeita haittavaikutuksia havaittu.
Liialliset formoteroliannokset voivat aiheuttaa beeta2-adrenergisille agonisteille tyypillisiä vaikutuksia, kuten pahoinvointia, oksentelua, päänsärkyä, vapinaa, uneliaisuutta, sydämentykytystä, takykardiaa, kammioarytmiaa, QTc-ajan pitenemistä, metabolista asidoosia, hypokalemiaa ja hyperglykemiaa.
Formoteroliyliannostuksen yhteydessä on annettava oireenmukaista elintoimintoja tukevaa hoitoa. Vakavat tapaukset edellyttävät sairaalahoitoa. Kardioselektiivisten beeta-adrenergisten salpaajien käyttöä voidaan myös harkita, mutta vain erityistä varovaisuutta noudattaen, koska beeta-adrenergisten salpaajien käyttö voi aiheuttaa bronkospasmia. Seerumin kaliumarvoja on seurattava.
Suositusannoksia suurempien beklometasonidipropionaattiannosten akuutti inhaloiminen voi johtaa lisämunuaisen toiminnan ohimenevään estymiseen. Tämä ei vaadi hätätoimenpiteitä, koska lisämunuaisen toiminta korjaantuu muutamassa päivässä, mikä voidaan todeta plasman kortisolipitoisuuden määrityksillä. Näiden potilaiden hoitoa jatketaan annoksilla, jotka riittävät pitämään astman riittävästi hoitotasapainossa.
Inhaloitavan beklometasonidipropionaatin krooninen yliannostus: lisämunuaisen toiminnan estymisen riski (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Lisämunuaisreservien seuraaminen on tarpeen. Hoitoa jatketaan annoksilla, jotka riittävät pitämään astman riittävästi hoitotasapainossa.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Obstruktiivisten hengitystiesairauksien lääkkeet, adrenergiset lääkeaineet yhd.valmisteina kortikosteroidien tai muiden lääkeaineiden kanssa. ATC-koodi: R03AK08.
Vaikutusmekanismi ja farmakodynaamiset vaikutukset
Innovair nexthaler sisältää beklometasonidipropionaattia ja formoterolia jauheena. Se tuottaa erittäin hienojakoisen aerosolin, jonka aerodynaamisen läpimitan mediaani (MMAD) on 1,4–1,7 mikrometriä ja johon kaksi komponenttia ovat jakautuneet. Innovair nexthalerin aerosolipartikkelit ovat keskimäärin paljon pienempiä kuin koostumukseltaan vähemmän hienojakoisissa valmisteissa.
Radioaktiivisesti merkityn lääkeaineen jakautumista elimistöön on tutkittu Innovair nexthaler 100 mikrog/6 mikrog/annos ‑valmisteella aikuisille astmaatikoille tehdyssä tutkimuksessa. Tutkimus osoitti, että suuri osa lääkkeestä (arviolta 42 % nimellisannoksesta) jakautuu keuhkoihin ja että jakautuminen hengitysteihin on tasaista. Lääkeaineen kulkeutumista koskevien ominaisuuksien perusteella on suositeltavaa käyttää pientä annosta sellaista kortikosteroidia, jonka farmakodynaamiset vaikutukset ovat tehostuneet paikallisesti ja jonka on osoitettu olevan näiden vaikutusten osalta samanveroinen vastaavan inhalaatiosumutteen kanssa.
Innovair nexthaler sisältää beklometasonidipropionaattia ja formoterolia. Näiden vaikuttavien aineiden vaikutusmekanismi on erilainen. Muiden inhaloitavien kortikosteroidien ja beeta2-agonistien yhdistelmien tavoin astman pahenemisvaiheiden vähenemisessä havaitaan additiivinen vaikutus.
Beklometasonidipropionaatti
Suositeltuina annoksina inhalaationa annetulla beklometasonidipropionaatilla on anti-inflammatorinen glukokortikoidivaikutus keuhkoihin, minkä seurauksena astman oireet lievittyvät ja pahenemisvaiheet vähenevät. Inhalaationa annetulla beklometasonidipropionaatilla on vähemmän haittavaikutuksia kuin systeemisesti annetuilla kortikosteroideilla.
Formoteroli
Formoteroli on selektiivinen beeta2-adrenerginen agonisti, joka relaksoi keuhkoputkien sileää lihasta potilailla, joilla on korjaantuvaa hengitysteiden ahtautumista aiheuttava sairaus. Keuhkoputkia laajentava vaikutus alkaa nopeasti, 1–3 minuutin kuluessa inhalaation ottamisesta, ja vaikutus kestää 12 tuntia annoksen ottamisen jälkeen.
Kliiniset kokemukset
Innovair nexthaler ‑inhalaatiojauheen pienemmän vahvuuden (100 mikrogrammaa/6 mikrogrammaa) kahden komponentin tehoa verrattiin inhalaatiosumutteeseen (100 mikrogrammaa/6 mikrogrammaa) kolmessa erillisessä keskivaikeaa tai vaikeaa jatkuvaa astmaa sairastaville potilaille tehdyssä tutkimuksessa. Yleisesti ottaen näiden kahden inhalaattorin odotetaan olevan kliinisessä käytössä teholtaan samanarvoisia, kun annos on 1 tai 2 inhalaatiota kahdesti vuorokaudessa.
Yhden tutkimuksen ensisijaisena tavoitteena oli arvioida inhaloidun kortikosteroidikomponentin tehoa mitattuna bronkodilataatiolla annosta edeltävään FEV1-arvoon verrattuna. 696:lla keskivaikeaa tai vaikeaa astmaa sairastavalla potilaalla annosta edeltävä FEV1 parani kolmen kuukauden hoitojakson jälkeen kliinisesti merkityksellisesti lähtötilanteeseen verrattuna, kun annostus oli molempien lääkemuotojen osalta joko 1 inhalaatio kahdesti vuorokaudessa tai 2 inhalaatiota kaksi kertaa vuorokaudessa. Keskimäärin FEV1 parani vähintään 250 ml. Annosta edeltävän FEV1-arvon osalta Innovair nexthaler ‑inhalaatiojauheen ja inhalaatiosumutteen välillä ei ollut kliinisesti merkityksellistä eroa kummallakaan annostuksella. Aamu-PEF-arvon osalta havaittiin merkitsevä riippuvuus annoksen suuruudesta. Annosvasteen tilastollista merkitsevyyttä ei saavutettu annosta edeltävän FEV1-arvon suhteen. Oireiston hallintaa mittaavat arvot, kuten aamuin ja illoin arvioitavat oirepisteet ja oireettomien päivien prosentuaalinen osuus, paranivat hoitojakson aikana merkitsevästi lähtötilanteeseen verrattuna molempien lääkemuotojen osalta, erityisesti kahdella suurella annoksella.
Toisen tutkimuksen ensisijaisena tavoitteena oli arvioida Innovair nexthalerin pitkävaikutteisen beeta2-agonistikomponentin tehoa. Bronkodilataatio mitattiin hoidon alussa ja enintään 12 tunnin kuluttua kerta-annoksesta keuhkojen toimintakokeilla, joissa arvioitiin FEV1-arvoa (FEV1:n AUC-arvo yli 80 % formoterolin vaikutusajasta). Lumeeseen verrattuna sekä yksi Innovair nexthaler ‑inhalaatio että neljä inhalaatiota molempia vaikuttavia aineita paransivat merkitsevästi FEV1:n AUC0-12-arvoa. Kumpikin Innovair nexthaler ‑inhalaatiojauheannos oli vertailukelpoinen (non-inferior) vastaavan inhalaatiosumuteannoksen kanssa. Tilastollisesti merkitsevä riippuvuus annoksen ja vasteen suuruuden välillä havaittiin molemmilla lääkemuodoilla pienen ja suuren annoksen välillä.
Kolmannessa tutkimuksessa 755 hoitotasapainossa olevaa astmapotilasta sai 4 viikkoa kestävän sisäänajovaiheen ajan inhalaatiosumutetta, joka sisälsi beklometasonidipropionaattia ja formoterolia kiinteänä yhdistelmänä, yhden inhalaation kahdesti vuorokaudessa. Tämän jälkeen potilaat satunnaistettiin saamaan 8 viikon ajan joko sisäänajovaiheessa käytettyä valmistetta, Innovair nexthaler ‑inhalaatiojauhetta tai inhalaatiojauhetta, joka sisälsi beklometasonidipropionaattia 100 mikrogrammaa/annos; kaikkia otettiin yksi inhalaatio kaksi kertaa vuorokaudessa. Ensisijainen muuttuja oli aamulla mitatun uloshengityksen huippuvirtauksen (PEF-arvon) keskiarvon muutos hoitojakson jälkeen lähtötilanteeseen verrattuna. Kahdeksan viikkoa kestäneen hoidon jälkeen kahden yhdistelmävalmisteen välillä ei ollut eroa ensisijaisen päätetapahtuman osalta. Molemmat olivat merkitsevästi parempia kuin beklometasonidipropionaatti ainoana hoitona. Kahden yhdistelmäinhalaattorin välillä ei havaittu eroja oireita koskevissa mittauksissa, kuten astman hallintaa koskevan kyselylomakkeen pistemäärässä ja niiden päivien lukumäärässä, jolloin kohtauslääkettä ei tarvittu.
Avoimen lumevalmisteella tehdyn tutkimuksen tavoitteena oli varmistaa, että potilaan ikä, tauti ja sairauden vaikeusaste eivät vaikuta potilaan nexthaler‑inhalaattorin läpi tuottaman sisäänhengityksen virtauksen voimakkuuteen ja että näin ollen kaikki potilaan kykenevät aktivoimaan laitteen ja saamaan siitä lääkeannoksen. Ensisijainen päätetapahtuma oli kaikissa ikä- ja tautiryhmissä niiden potilaiden prosentuaalinen osuus, jotka pystyivät aktivoimaan inhalaattorin. Tutkimukseen osallistui kahdeksankymmentäyhdeksän iältään 5–84-vuotiasta potilasta, joihin kuului keskivaikeaa (FEV1 > 60 % odotetusta) ja vaikeaa (FEV1 ≤ 60 % odotetusta) astmaa sairastavia potilaita sekä keskivaikeaa (FEV1 ≥ 50 % odotetusta) tai vaikeaa (FEV1 < 50 % odotetusta) keuhkoahtaumaa sairastavaa potilasta. Kaikki potilaat kykenivät tuottamaan riittävän nexthalerin käyttöön riittävän sisäänhengityksen virtauksen iästä, sairaudesta ja sairauden vaikeusasteesta riippumatta.
Satunnaistetussa lumekontrolloidussa kaksoissokkoutetussa 5 hoitojakson vaihtovuoroisessa tutkimuksessa 60 aikuispotilasta, joiden astma oli osittain tai ei lainkaan hoitotasapainossa, sai kaksi erilaista kerta-annosta (1 tai 4 inhalaatiota) sekä Innovair nexthaler 100 mikrog/6 mikrog/annos -valmistetta että Innovair nexthaler 200 mikrog/6 mikrog/annos -valmistetta ja lisäksi lumetta. Tutkimuksessa selvitettiin bronkodilataatiovaikutusta (FEV1-arvon ajan suhteen normalisoitu AUC0−12h). Innovair nexthaler 200 mikrog/6 mikrog/annos- ja Innovair nexthaler 100 mikrog/6 mikrog/annos ‑valmisteiden mukautettu keskimääräinen ero (95 %:n luottamusväli) oli pienemmällä formoteroliannoksella (1 inhalaatio – 6 mikrogrammaa) 0,029 l (−0,018; 0,076) ja suuremmalla formoteroliannoksella (4 inhalaatiota – 24 mikrogrammaa) 0,027 l (−0,020; 0,073)l. Tulokset osoittivat, että hoitojen välisen eron mukautetun keskiarvon kaksitahoisen 95 %:n luottamusvälin alarajat olivat selvästi ennalta määritetyn vertailukelpoisuusrajan (−0,12 l) yläpuolella, mikä osoitti Innovair nexthaler 200 mikrog/6 mikrog/annos ‑valmisteen kummankin formoteroliannoksen (6 ja 24 mikrogrammaa) ennalta määritetyn vertailukelpoisuuden (0,12 l) pienempään vahvuuteen verrattuna FEV1-arvon ajan suhteen normalisoidun AUC0-12h-arvo osalta.
Farmakokinetiikka
Beklometasonidipropionaatti
Beklometasonidipropionaatti on aihiolääke, jonka affiniteetti glukokortikoideja sitoviin reseptoreihin on heikko. Se hydrolysoituu esteraasientsyymien välityksellä aktiiviseksi metaboliitiksi, beklometasoni-17-monopropionaatiksi, jolla on voimakkaampi paikallinen anti-inflammatorinen vaikutus kuin aihiolääke beklometasonidipropionaatilla.
Imeytyminen, jakautuminen ja biotransformaatio
Inhaloitu beklometasonidipropionaatti imeytyy nopeasti keuhkoista. Ennen imeytymistä se muuntuu useimmissa kudoksissa esiintyvän esteraasientsyymin välityksellä laajasti aktiiviseksi metaboliitiksi, beklometasoni-17-monopropionaatiksi. Aktiivisen metaboliitin systeeminen hyötyosuus on seurausta imeytymisestä keuhkoista ja niellyn annoksen jälkeen imeytymisestä ruoansulatuselimistöstä. Niellyn beklometasonidipropionaatin hyötyosuus on kuitenkin merkityksettömän pieni. Presysteemisen beklometasoni-17-monopropionaatiksi muuntumisen seurauksena osa annoksesta imeytyy aktiivisena metaboliittina.
Systeeminen altistus suurenee inhaloidun annoksen suurenemisen myötä lähes lineaarisesti.
Annossumuttimesta otetun inhalaation jälkeinen absoluuttinen hyötyosuus on noin 2 % (nimellinen annos muuttumatonta beklometasonidipropionaattia) ja 62 % (nimellinen annos beklometasoni-17-monopropionaattia).
Kun valmistetta annetaan laskimoon, beklometasonidipropionaatille ja sen aktiiviselle metaboliitille on luonteenomaista suuri puhdistuma plasmasta (beklometasonidipropionaatin puhdistuma 150 l/h ja aktiivisen metaboliitin puhdistuma 120 l/h), beklometasonidipropionaatin pieni jakaantumistilavuus (20 l) vakaassa tilassa ja aktiivisen metaboliitin suurempi jakaantumistilavuus (424 l) kudoksiin. Beklometasonidipropionaatin metabolian tuloksena syntyy pääasiassa (82 %) aktiivista metaboliittia, beklometasoni-17-monopropionaattia.
Sitoutuminen plasman proteiineihin on kohtalaisen voimakasta (87 %).
Eliminaatio
Beklometasonidipropionaatin pääasiallinen eliminaatioreitti on erittyminen polaarisina metaboliitteina ulosteisiin. Beklometasonidipropionaatin ja sen metaboliittien eliminoituminen munuaisten kautta on hyvin vähäistä. Beklometasonidipropionaatin terminaalinen eliminaation puoliintumisaika on 0,5 tuntia ja beklometasoni-17-monopropionaatin 2,7 tuntia.
Erityispotilasryhmät
Beklometasonidipropionaatin farmakokinetiikkaa munuaisten tai maksan vajaatoimintaa sairastavissa potilaissa ei ole tutkittu. Koska beklometasonidipropionaatti kuitenkin metaboloituu suolistonesteissä, seerumissa, keuhkoissa ja maksassa esiintyvien esteraasientsyymien välityksellä hyvin nopeasti polaarisemmiksi aineenvaihduntatuotteiksi, beklometasoni-21-monopropionaatiksi, beklometasoni-17-monopropionaatiksi ja beklometasoniksi, maksan vajaatoiminnalla ei odoteta olevan beklometasonidipropionaatin farmakokinetiikkaa ja turvallisuusprofiilia muuttavia vaikutuksia.
Koska beklometasonidipropionaattia tai sen metaboliitteja ei havaittu virtsassa, munuaisten vajaatoimintaa sairastavien systeemisen altistuksen ei odoteta suurentuvan.
Lineaarisuus/ei-lineaarisuus
Kliinisfarmakologisessa tutkimuksessa arvioitiin kahtena eri vahvuutena (Innovair nexthaler 100 mikrog/6 mikrog/annos ja Innovair nexthaler 200 mikrog/6 mikrog/annos) keuhkoihin annetun inhalaatiojauheen kahden komponentin hyötyosuutta ja systeemistä kokonaisaltistusta. Näitä muuttujia arvioitiin kummankin annosvahvuuden kerta-annoksen (4 inhalaatiota) jälkeen sekä aktiivihiilen kanssa että ilman aktiivihiiltä. Tutkimus oli avoin, kerta-annoksilla toteutettu 6 hoitojakson vaihtovuoroinen tutkimus. Tutkimukseen otettiin yhteensä 30 astmaa sairastavaa aikuispotilasta, joiden FEV1 oli ≥ 70 % ennakoidusta arvosta. Tutkittavat saivat päivittäin pienen annoksen inhaloitavaa kortikosteroidia (esim. budesonidia tai vastaavaa ≤ 400 mikrog/vrk) tai pienen annoksen inhaloitavan kortikosteroidin ja pitkävaikutteisen beeta2-agonistin yhdistelmävalmistetta. Keuhkojen kautta imeytyvän B17MP:n (beklometasonidipropionaatin aktiivinen metaboliitti) hyötyosuus ja systeeminen kokonaisaltistus B17MP:lle olivat suhteessa annokseen vahvuudella 200 mikrog/6 mikrog/annos ja hyväksytyllä vahvuudella 100 mikrog/6 mikrog/annos molemmissa tutkituissa olosuhteissa (aktiivihiilen kanssa ja ilman aktiivihiiltä). Tutkimus ei täysin osoittanut formoterolin biologista samanarvoisuutta keuhkojen kautta imeytyvän lääkeaineen hyötyosuutena ja systeemisenä kokonaisaltistuksena mitattuna, sillä Cmax:n ja AUCt:n alemman 90 %:n luottamusvälin arvot olivat biologisen samanarvoisuuden alarajan (80 %) alapuolella, kun kahta vahvuutta verrattiin keskenään. Pienentyneeseen systeemiseen altistukseen (joka vastaa Cmax- ja AUCt-arvojen 20–14 %:n laskua) ei liity turvallisuutta koskevia huolenaiheita, koska systeemisissä vaikutuksissa (mukaan lukien glukoosi- kalium- ja sydän- ja verisuonimuuttujat) ei havaittu eroja. Tämä osoittaa, että Innovair nexthaler 200 mikrog/6 mikrog/annos ‑valmiste on vähintään yhtä turvallinen kuin Innovair nexthaler 100 mikrog/6 mikrog/annos ‑valmiste. Keuhkoihin jakautuneen lääkeaineen Cmax-arvojen välinen ero oli 20 % ja AUCt-arvojen ero 22 %. Kahden annosvahvuuden (100/6 mikrogrammmaa ja 200/6 mikrogrammaa) bronkodilataatiolla mitatun tehon vastaavuus on osoitettu spesifisessä farmakodynaamisessa tutkimuksessa (ks. kohta Farmakodynamiikka).
Formoteroli
Imeytyminen ja jakautuminen
Inhalaationa otettu formoteroli imeytyy sekä keuhkoista että ruoansulatuselimistöstä. Inhalaationa otetun annoksen jälkeen niellyn lääkkeen osuus on 60–90 %, kun käytetään annosinhalaattoria. Vähintään 65 % niellystä osuudesta imeytyy ruoansulatuselimistöstä. Muuttumattoman lääkkeen huippupitoisuus plasmassa saavutetaan 0,5–1 tunnin kuluessa suun kautta tapahtuvan annon jälkeen. Formoterolista sitoutuu plasman proteiineihin 61–64 %, josta 34 % albumiiniin. Terapeuttisia annoksia käytettäessä sitoutumiskohdat eivät saturoidu. Suun kautta annettuna eliminaation puoliintumisajaksi on määritetty 2–3 tuntia. Formoterolin imeytyminen on lineaarista, kun inhaloitu formoterolifumaraattiannos on 12–96 mikrogrammaa.
Biotransformaatio
Formoteroli metaboloituu laajasti, ja tärkein metaboliareitti on suora konjugoituminen fenolihydroksyyliryhmän avulla. Glukuronidihappokonjugaatti on inaktiivinen. Toinen tärkeä metaboliareitti on O-demetylaatio, jonka jälkeen tapahtuu konjugoituminen fenoli-2’-hydroksyyliryhmän avulla. Sytokromi P450 isoentsyymit CYP2D6, CYP2C19 ja CYP2C9 osallistuvat formoterolin O-demetylaatioon. Maksa vaikuttaa olevan pääasiallinen metaboliareitti. Formoteroli ei estä CYP450-entsyymejä hoidon kannalta merkityksellisillä pitoisuuksilla.
Eliminaatio
Jauheinhalaattorista saatavan formoterolikerta-annoksen inhaloinnin jälkeen kumulatiivinen erittyminen virtsan kautta suureni lineaarisesti annoksilla 12–96 mikrogrammaa. Annoksesta erittyi muuttumattomana keskimäärin 8 % ja kokonaisformoteroliannoksesta 25 %. Plasmassa esiintyvien pitoisuuksien mittaukset osoittivat, että 12 terveen vapaaehtoisen otettua inhalaationa kerta-annoksen 120 mikrogrammaa keskimääräinen eliminaation puoliintumisaika oli 10 tuntia. Virtsaan erittyneestä muuttumattomasta lääkeaineesta 40 % oli (R,R)-enantiomeeria ja 60 % (S,S)-enantiomeeria. Näiden kahden enantiomeerin suhteellinen osuus pysyi muuttumattomana tutkittujen annosten yhteydessä eikä näyttöä ollut siitä, että toinen enantiomeeri kumuloituisi suhteellisesti enemmän kuin toinen toistuvan annon jälkeen.
Kun valmistetta annettiin terveille vapaaehtoisille suun kautta (40–80 mikrogrammaa), annoksesta 6−10 % havaittiin virtsassa muuttumattomana aineena, ja enintään 8 % annoksesta havaittiin glukuronidimuodossa.
Yhteensä 67 % suun kautta annetusta formoteroliannoksesta erittyy virtsaan (pääasiassa metaboliitteina) ja loput ulosteisiin. Formoterolin munuaispuhdistuma on 150 ml/min.
Erityispotilasryhmät
Maksan/munuaisten vajaatoiminta: formoterolin farmakokinetiikkaa maksan tai munuaisten vajaatoimintaa sairastavien potilaiden elimistössä ei ole tutkittu. Altistuksen voidaan kuitenkin odottaa suurenevan, jos potilaalla on vaikea maksakirroosi, koska formoteroli eliminoituu pääasiassa maksametabolian kautta.
Kliiniset kokemukset
Beklometasonidipropionaatin ja formoterolin yhdistelmän aiheuttamaa systeemistä altistusta on verrattu näiden komponentteihin erikseen käytettynä aiheuttamaan altistukseen. Beklometasonidipropionaatin ja formoterolin välillä ei havaittu merkkejä farmakokineettisistä tai farmakodynaamisista (systeemisistä) yhteisvaikutuksista.
Prekliiniset tiedot turvallisuudesta
Innovair nexthalerin vaikuttavilla aineilla erikseen tehtyjen farmakologista turvallisuutta ja toistuvan altistuksen aiheuttamaa toksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille Yhdistelmän toksisuusprofiili on vaikuttavien aineiden erillisten profiilien mukainen, eikä siihen liity lisääntynyttä toksisuutta tai odottamattomia löydöksiä.
Rotilla tehdyt lisääntymistoksisuutta koskevat tutkimukset viittasivat valmisteen annosriippuvaisiin vaikutuksiin. Suuriin beklometasonidipropionaattiannoksiin liittyi naaraan hedelmällisyyden heikkenemistä, alkion kiinnittymisen vähenemistä sekä alkioon ja sikiöön kohdistuvaa toksisuutta. Tiineille eläimille annettujen suurten kortikosteroidiannosten tiedetään aiheuttavan poikkeavuuksia sikiön kehitykseen, kuten suulakihalkiota ja kohdunsisäisen kehityksen hidastumista. Beklometasonidipropionaatin ja formoterolin yhdistelmän käytön yhteydessä havaitut vaikutukset aiheutuivat todennäköisesti beklometasonidipropionaatista. Tällaisia vaikutuksia havaittiin vain suurella systeemisellä altistuksella aktiiviselle metaboliitille beklometasoni-17-monopropionaatille (200-kertainen altistus verrattuna potilaiden plasman altistukseen). Lisäksi tiineyden ja synnytyksen pitkittymistä esiintyi enemmän. Tämä vaikutus liittyi eläinkokeiden perusteella todettuihin beeta2-sympatomimeettien tokolyyttisiin vaikutuksiin. Tällaisia vaikutuksia havaittiin, kun emon plasman formoterolipitoisuus oli pienempi kuin Innovair nexthaler ‑hoitoa saavien odotetut pitoisuudet.
Beklometasonidipropionaatin ja formoterolin yhdistelmällä tehdyt geenitoksisuutta koskevat tutkimukset eivät viitanneet siihen, että valmisteella olisi mutageenisia vaikutuksia. Tällä yhdistelmällä ei ole tehty karsinogeenisuustutkimuksia. Vaikuttavilla aineilla erikseen tehdyt eläinkokeet eivät viittaa karsinogeenisuuden riskiin ihmisille.
Farmaseuttiset tiedot
Apuaineet
Laktoosimonohydraatti (voi sisältää pieniä määriä maitoproteiinia), magnesiumstearaatti
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta.
Lääkevalmiste on käytettävä kuuden kuukauden kuluessa pussin avaamisesta.
Säilytys
Säilytä alkuperäispakkauksessa. Herkkä kosteudelle.
Ota inhalaattori foliopussista vasta juuri ennen ensimmäistä käyttökertaa.
Ennen pussin avaamista: Tämä lääkevalmiste ei vaadi lämpötilan suhteen erityisiä säilytysolosuhteita.
Pussin avaamisen jälkeen: Säilytä alle 25 °C.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
INNOVAIR NEXTHALER inhalaatiojauhe
200/6 mikrog/annos (L:kyllä) 120 annosta (50,19 €), 3 x 120 annosta (140,77 €)
PF-selosteen tieto
Yhdessä kotelossa on 1, 2 tai 3 nexthaler‑inhalaattoria, joista kustakin saa 120 inhalaatiota. Kukin inhalaattori on pakattu kuumasaumattuun PET/Al/PE- tai PA/Al/PE-suojapussiin (folio).
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Innovair nexthaler on moniannosinhalaattori. Se koostuu kotelosta, jonka alaosassa on ikkuna, josta näkee jäljellä olevien inhalaatioiden määrän, ja siihen kiinteästi liitetystä suojuksesta. Annoslaskurin toiminta perustuu suojuksen avaamiseen ja sulkemiseen. Kun suojus avataan, näkyviin tulee suukappale, jonka läpi jauhe inhaloidaan. Kotelon alaosa ja suukappale on valmistettu akryylinitriilibutadieenistyreenistä. Suojus on polypropeenia.
Valmisteen kuvaus:
Moniannosinhalaattori sisältää valkoista tai melkein valkoista jauhetta.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
INNOVAIR NEXTHALER inhalaatiojauhe
200/6 mikrog/annos 120 annosta, 3 x 120 annosta
- Alempi erityiskorvaus (65 %). Krooninen keuhkoastma ja sitä läheisesti muistuttavat krooniset obstruktiiviset keuhkosairaudet (203).
- Peruskorvaus (40 %).
ATC-koodi
R03AK08
Valmisteyhteenvedon muuttamispäivämäärä
25.01.2022
Yhteystiedot
Klara Norra Kyrkogata 34
111 22 Stockholm
Sverige
(+46) 8 753 35 20
www.chiesi.fi
infonordic@chiesi.com
