HAVRIX injektionsvätska, suspension i förfylld spruta 1440 ELISA U/ml
Kvalitativ och kvantitativ sammansättning
Havrix 720
1 dos (0,5 ml) innehåller:
Inaktiverat hepatit A-virus1, 2 720 ELISA-enheter
1 producerat i humana diploidceller (MRC-5)
2adsorberat på aluminiumhydroxid, hydratiserad 0,25 mg Al3+
Havrix 1440
1 dos (1 ml) innehåller:
Inaktiverat hepatit A-virus1, 2 1440 ELISA-enheter
1 producerat i humana diploidceller (MRC-5)
2adsorberat på aluminiumhydroxid, hydratiserad 0,5 mg Al3+
Detta vaccin kan innehålla spår av neomycin och formaldehyd som används vid tillverkningen, se avsnitt Kontraindikationer.
Hjälpämnen med känd effekt:
Havrix 720 innehåller 83 mikrogram fenylalanin och 25 mikrogram polysorbat 20 per dos (se avsnitt Varningar och försiktighet).
Havrix 1440 innehåller 166 mikrogram fenylalanin och 50 mikrogram polysorbat 20 per dos (se avsnitt Varningar och försiktighet).
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Injektionsvätska, suspension i förfylld spruta.
Kliniska uppgifter
Terapeutiska indikationer
Havrix är avsett för aktiv immunisering mot hepatit A-virusinfektion (HAV) hos barn, ungdomar och vuxna:
- Havrix 720: individer i åldern 1 till och med 15 år. Det kan även användas till ungdomar upp till och med 18 års ålder.
- Havrix 1440: individer i åldern 16 år och äldre.
Vaccinet ska användas i enlighet med gällande rekommendationer.
Dosering och administreringssätt
Dosering
Primärvaccination
Havrix 720 (0,5 ml suspension)
En engångsdos Havrix 720 till barn används för immunisering av barn och ungdomar i åldern 1 år t.o.m. 15 år.
Vid behov kan det vara acceptabelt att använda en engångsdos Havrix 720 till barn för immunisering av ungdomar i åldern 16 år upp till och med 18 år (se avsnitt Farmakodynamiska egenskaper).
Havrix 1440 (1,0 ml suspension)
En engångsdos Havrix 1440 till vuxna används för immunisering av vuxna och ungdomar från 16 år.
För optimalt antikroppssvar ska primär immunisering ges minst 2 och helst 4 veckor före förväntad exponering för hepatit A-virus (se avsnitt Farmakodynamiska egenskaper).
Boostervaccination
Efter primärvaccination med antingen Havrix 720 till barn eller Havrix 1440 till vuxna rekommenderas en boosterdos för att säkerställa långtidsskydd. Boosterdosen ska helst ges inom 6 till 12 månader efter primärvaccinationen, men kan ges upp till 5 år efter primärvaccination (se avsnitt Farmakodynamiska egenskaper).
Utbytbarhet
Havrix är utbytbart mot ett annat inaktiverat hepatit A-vaccin.
Äldre population
Det finns begränsad data från användning av inaktiverade hepatit A-vacciner hos äldre individer.
Tillgänglig information finns i avsnitt Farmakodynamiska egenskaper men ingen doseringsrekommendation kan fastställas.
Pediatrisk population
Säkerhet och effect för Havrix 720 för barn under 1 år har inte fastställts.
Tillgänglig information finns i avsnitt Farmakodynamiska egenskaper men ingen doseringsrekommendation kan fastställas.
Administreringssätt
Havrix 720 till barn (0,5 ml suspension) ska ges intramuskulärt i deltoideusregionen hos barn och ungdomar och anterolateralt i låret hos små barn om deltoideusmuskeln ännu inte är tillräckligt utvecklad (se avsnitt Särskilda anvisningar för destruktion och övrig hantering).
Havrix 1440 till vuxna (1,0 ml suspension) ska ges intramuskulärt i deltoideusregionen hos ungdomar och vuxna (se avsnitt Särskilda anvisningar för destruktion och övrig hantering).
Oavsett var administrering sker så ska ett fast tryck appliceras på injektionsstället (utan att gnugga) i minst två minuter efter injektionen.
Havrix ska inte ges i glutealregionen.
Havrix ska inte under några omständigheter ges intravenöst.
Havrix ska inte ges subkutant eller intradermalt (se avsnitt Varningar och försiktighet).
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen eller mot neomycin eller formaldehyd.
Överkänslighetsreaktion efter tidigare administrering av något hepatit A-vaccin.
Varningar och försiktighet
Spårbarhet
För att underlätta spårbarhet av biologiska läkemedel ska läkemedlets namn och tillverkningssatsnummer dokumenteras.
Allmänna rekommendationer
Liksom med andra vacciner ska vaccination med Havrix skjutas upp hos personer med akut, svår sjukdom med feber. En lindrig infektion, t.ex. förkylning, bör inte vara skäl att skjuta upp vaccinationen.
Liksom för alla injektionsvacciner ska lämplig medicinsk behandling och övervakning alltid finnas tillgänglig i händelse av en sällsynt anafylaktisk reaktion efter administrering av vaccinet.
Noggrann övervakning under minst 15 minuter efter vaccinationen rekommenderas.
Synkope (svimning) kan inträffa efter, eller till och med före, en vaccination, framför allt hos ungdomar som en psykogen reaktion på nålstick. Detta kan åtföljas av flera neurologiska symtom såsom övergående synrubbning, parestesi och tonisk-kloniska rörelser i extremiteterna under återhämtningen. Det är viktigt att rutiner finns på plats för att undvika skador vid svimning.
Havrix förhindrar inte hepatitinfektion orsakad av andra smittämnen såsom hepatit B-virus, hepatit C-virus, hepatit E-virus eller andra patogener som kan orsaka leverinfektion.
Individer kan befinna sig i inkubationstiden för hepatit A vid tidpunkten för vaccinationen. Det är okänt om Havrix kan förhindra hepatit A i sådana fall.
Som med alla vacciner är det inte säkert att ett skyddande immunsvar induceras hos alla som vaccineras.
Immunsvaret på Havrix kan vara svagare hos personer med ett nedsatt immunförsvar. Dessa personer behöver alltid vaccineras med 2 doser enligt schema.
Havrix ska administreras med försiktighet till personer med trombocytopeni eller blödningsrubbning eftersom blödning kan inträffa hos dessa personer efter en intramuskulär injektion. I undantagsfall och om det följer gällande rekommendationer kan vaccinet i dessa fall ges subkutant. Detta kan dock leda till ett suboptimalt antikroppssvar mot HAV. Oavsett administreringsväg ska ett fast tryck appliceras på injektionsstället (utan att gnugga) i minst två minuter efter injektionen.
Hjälpämnen
Havrix 720 innehåller 83 mikrogram fenylalanin per dos.
Havrix 1440 innehåller 166 mikrogram fenylalanin per dos.
Fenylalanin kan vara skadligt för personer med fenylketonuri (PKU).
Havrix 720 ELISA U innehåller 25 mikrogram polysorbat 20 per dos.
Havrix 1440 ELISA U innehåller 50 mikrogram of polysorbat 20 per dos.
Polysorbater kan orska allergiska reaktioner.
Detta vaccin innehåller mindre än 1 mmol (23 mg) natrium per dos, d.v.s. är näst intill ”natriumfritt”.
Detta vaccin innehåller mindre än 1 mmol (39 mg) kalium per dos, d.v.s. är näst intill ”kaliumfritt”.
Interaktioner
Eftersom Havrix är ett inaktiverat vaccin leder samtidig användning av andra inaktiverade vacciner sannolikt inte till någon interferens med immunsvaret.
Havrix kan ges samtidigt med vaccin mot tyfoidfeber, gula febern, kolera (injicerat), tetanus, eller samtidigt med monovalenta och kombinationsvacciner mot mässling, påssjuka, röda hund och vattkoppor.
Havrix kan ges samtidigt med immunglobuliner. Serokonversionsfrekvensen förblir oförändrad men antikroppstitrarna kan bli lägre än vid vaccination med enbart Havrix.
Om Havrix måste ges samtidigt med andra injektionsvacciner eller med immunglobuliner ska läkemedlen ges med olika sprutor och nålar och på skilda injektionsställen.
Fertilitet, graviditet och amning
Graviditet
En måttlig mängd data från gravida kvinnor (mellan 300 och 1 000 graviditeter) tyder inte på någon missbildande- eller foster-/neonatal toxicitet.
Djurstudier tyder inte på reproduktionstoxikologiska effekter (se avsnitt Prekliniska säkerhetsuppgifter).
Användning av Havrix kan övervägas under graviditet om det är nödvändigt.
Amning
Det är okänt om Havrix utsöndras i bröstmjölk. Även om risken kan bedömas som försumbar ska Havrix endast användas under amning om det är absolut nödvändigt.
Fertilitet
Det finns inga data om effekten av Havrix på fertiliteten hos människa. Effekter på fertiliteten hos människa har inte undersökts i djurstudier.
Effekter på förmågan att framföra fordon och använda maskiner
Havrix har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
De vanligaste lokala biverkningarna, hos både barn och vuxna, är smärta och rodnad vid injektionsstället.
De vanligaste allmänna biverkningarna är hos barn irritabilitet och hos vuxna trötthet samt huvudvärk.
Biverkningstabell
Data från kliniska prövningar
Säkerhetsprofilen som presenteras i tabellen nedan baseras på data från 5 331 forskningspersoner, varav 1 664 var barn (upp till 18 års ålder) som vaccinerats med Havrix 720 och 3 667 vuxna (från 16 år) som vaccinerats med Havrix 1440 i kliniska prövningar (total vaccinerad kohort). Totalt har 3 193 doser Havrix 720 och 7 131 doser Havrix 1440 getts i kliniska prövningar. Totalt gavs 3 971 doser Havrix 1440 samtidigt med Engerix-B till 2 064 vuxna forskningspersoner.
Biverkningarna presenteras indelade efter följande frekvenser:
Mycket vanliga (≥1/10)
Vanliga (≥1/100, <1/10)
Mindre vanliga (≥1/1 000, <1/100)
Sällsynta (≥1/10 000, <1/1 000)
Mycket sällsynta (<1/10 000)
Inom varje frekvensgrupp presenteras biverkningarna efter fallande allvarlighetsgrad.
Organsystem | Frekvens | Biverkning |
Infektioner och infestationer | Mindre vanliga | Övre luftvägsinfektion (2), rinit |
Metabolism och nutrition | Vanliga | Aptitlöshet |
Psykiatriska tillstånd | Mycket vanliga | Irritabilitet (1) |
Centrala och perifera nervsystemet | Mycket vanliga | Huvudvärk (3) |
Vanliga | Dåsighet (1) | |
Mindre vanliga | Yrsel (2) | |
Sällsynta | Hypestesi (2), parestesi (2) | |
Magtarmkanalen | Vanliga | Gastrointestinala tecken och symtom (2) (5), diarré (4), illamående |
Mindre vanliga | Kräkningar | |
Hud och subkutan vävnad | Mindre vanliga | Hudutslag (1) |
Sällsynta | Klåda (2) | |
Muskuloskeletala systemet och bindväv | Mindre vanliga | Myalgi (2), stelhet i muskler och skelett (2) |
Allmänna symtom och/eller symtom vid administreringsstället | Mycket vanliga | Smärta och rodnad vid injektionsstället, trötthet (2) |
Vanliga | Sjukdomskänsla, feber (≥37,5 °C), reaktion vid injektionsstället (t.ex. induration(4) och svullnad) | |
Mindre vanliga | Influensaliknande sjukdom (2) | |
Sällsynta | Frossa (2) |
(1) Enbart Havrix 720
(2) Enbart Havrix 1440
(3) Rapporterat med frekvensen vanliga för Havrix 720
(4) Rapporterat med frekvensen mindre vanliga för Havrix 720
(5) Gastrointestinala symtom: omfattar illamående, kräkningar, diarré (symtomen har ej registrerats separat)
Data efter marknadsintroduktion
Följande biverkningar har dessutom observerats efter marknadsintroduktion med både Havrix 720 och Havrix 1440
Organsystem | Frekvens | Biverkning |
Immunsystemsjukdomar | Sällsynta | Anafylaxi, allergiska reaktioner inkluderande anafylaktoida reaktioner och symtom liknande serumsjuka |
Centrala och perifera nervsystemet | Sällsynta | Konvulsioner |
Vaskulära sjukdomar | Sällsynta | Vaskulit |
Sjukdomar i hud och subkutan vävnad | Sällsynta | Angioödem, erythema multiforme, urtikaria |
Muskuloskeletala systemet och bindväv | Sällsynta | Artralgi |
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nyttariskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till.
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Fall av överdosering har rapporterats under övervakningen efter godkännande för försäljning. De biverkningar som rapporterats efter överdosering stämde överens med dem som rapporterats efter korrekt administrering av vaccinet.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Vaccin mot hepatit A, inaktiverat, ATC-kod: J07BC02
Verkningsmekanism
Havrix skyddar mot HAV genom inducering av specifika HAV-antikroppar.
Farmakodynamisk effekt
Havrix immunogenicitet har undersökts i 39 studier hos över 6 000 forskningspersoner som inkluderat vuxna, ungdomar och barn.
Immunsvar
I kliniska studier uppnåddes serokonversion hos 99 % av de vaccinerade inom 30 dagar efter primärdosen.
I kliniska delstudier på vuxna där man studerade immunsvarets kinetik, påvisades en tidig och snabb serokonversion efter primärdosen Havrix 1440 Adult hos 79 % av de vaccinerade personerna dag 13, hos 86,3 % dag 15, 95,2 % dag 17 och 100 % dag 19.
Begränsade data finns tillgängliga från kliniska studier som inkluderar spädbarn under 1 år. I dessa studier gavs Havrix 720 vid 2, 4 och 6 månaders ålder eller som 2 doser med 6 månaders mellanrum från 4 till 6 månaders ålder. Humorala antikroppar mot HAV detekterades hos de flesta av de vaccinerade spädbarnen en månad efter att den sista vaccin dosen. Spädbarn med maternella antikroppar hade ett markant minskat immunsvar jämfört med spädbarn som initialt var seronegativa (se avsnitt Dosering och administreringssätt).
I kliniska studier på barn i åldern 1‑18 år kunde specifika humorala antikroppar mot HAV detekteras hos över 93 % av de vaccinerade personerna dag 15 och hos 99 % en månad efter primärdosen Havrix 720.
I kliniska studier där ungdomar i åldern 16‑18 år fick Havrix 720 detekterades humorala antikroppar mot HAV hos över 94 % av de vaccinerade personerna dag 15 och hos 100 % en månad efter primärdosen Havrix 720.
Immunsvar hos patienter med kronisk leversjukdom
I två kliniska prövningar vaccinerades 300 forskningspersoner med kronisk leversjukdom (kronisk hepatit B, kronisk hepatit C eller annan sjukdom) med 2 doser Havrix 1440 som gavs med 6 månaders mellanrum. Vaccinet inducerade detekterbara antikroppstitrar hos minst 95 % av de vaccinerade en månad efter den andra vaccinationen.
Immunsvarets varaktighet
För att säkerställa långtidsskydd ska en boosterdos ges 6 till 12 månader efter primärdosen Havrix 720 eller Havrix 1440. I kliniska prövningar var samtliga vaccinerade personer seropositiva en månad efter boosterdosen.
Om boosterdosen inte ges 6 till 12 månader efter primärdosen kan den emellertid ges i upp till 5 år efter primärdosen. I en jämförande prövning på vuxna visade sig en boosterdos som gavs i upp till 5 år efter primärdosen inducera samma mängd antikroppar som en boosterdos som gavs 6 till 12 månader efter primärdosen.
Den långsiktiga varaktigheten av antikroppar mot hepatit A efter två doser Havrix 1440 som gavs med 6 till 12 månaders mellanrum har studerats. I två kliniska prövningar med vuxna personer var 96,7 % respektive 100 % av de vaccinerade fortfarande seropositiva vid uppföljning efter 17,5 år (studie HAV-112) respektive efter 17 år (studie HAV-123).
Grundat på data insamlade upp till år 17 och 17,5 kan man prediktera att minst 95 % respektive 90 % av personerna fortfarande kommer att vara seropositiva (≥ 15 mIE/ml) 30 respektive 40 år efter vaccinationen.
Aktuella data ger inte stöd för ytterligare en boostervaccination till immunkompetenta personer när de har erhållit två doser.
Man kan förvänta sig att skyddet hos barn efter två doser Havrix 720 är jämförbart med ovan angivna predikterade varaktighet hos vuxna.
Farmakokinetiska egenskaper
Ingen utvärdering av farmakokinetiska egenskaper krävs för vacciner.
Prekliniska säkerhetsuppgifter
I skyddsstudier på schimpans observerades inte några särskilda risker för människa.
En studie av reproduktionstoxicitet hos råtta har utförts med ett annat kombinationsvaccin mot hepatit A och hepatit B (HAB). Detta kombinationsvaccin har samma aktiva innehållsämne som Havrix. Råttor administrerades en femtedel av HAB-dosen till människa intramuskulärt (200 µl, intramuskulär injektion innehållande 144 ELISA-enheter av hepatit A-virus (inaktiverat), 4 mikrogram hepatit B-ytantigen och 0,09 mg aluminium som aluminiumsalter). Det varit inte kopplat till maternell toxicitet och inga biverkningar eller negativa vaccinrelaterade effekter på den pre- och postnatala utvecklingen av foster/avkomma kunde observeras.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Aminosyror för injektion (innehåller fenylalanin)
Dinatriumfosfat
Kaliumdivätefosfat
Polysorbat 20 (E432)
Kaliumklorid
Natriumklorid
Vatten för injektionsvätskor
Inkompatibiliteter
Då det saknas data från kompabilititets studier ska detta vaccin ska inte blandas med andra vacciner eller andra läkemedel.
Hållbarhet
3 år.
Särskilda förvaringsanvisningar
Förvaras i kylskåp (2 °C – 8 °C).
Får ej frysas. Vaccinet ska kasseras om det har varit fryst.
Förvaras i originalförpackningen. Ljuskänsligt.
Stabilitetsdata tyder på att Havrix är stabilt i 3 dagar vid temperaturer i upp till 25 ºC. Dessa data är endast avsedda som vägledning för hälso- och sjukvårdspersonal i fall då vaccinet tillfälliga temperaturavvikelser har skett.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
HAVRIX injektioneste, suspensio, esitäytetty ruisku
1440 ELISA U/ml (L:ei) 0,5 ml (46,76 €), 1 ml (71,98 €)
PF-selosteen tieto
Havrix 720 ELISA U
-
0,5 ml suspension i förfylld spruta (typ I glas) med kolvring (butylgummi) och med ett skyddslock.
Förpackningar om 1, 5, 10 eller 25, med eller utan nålar.
Havrix 1440 ELISA U
-
1 ml suspension i en förfylld spruta (typ I glas) med kolvring (butylgummi) och med ett skyddslock.
Förpackningar om 1, 5, 10, eller 25, med eller utan nålar. -
1 ml i en injektionsflaska (typ I glas) med en propp (butylgummi).
Förpackningar om 1, 5, 10, 25 eller 100.
Skyddslocket och gummikolvringen på den förfyllda sprutan och proppen på injektionsflaskan är av syntetiskt gummi.
Injektionsflaska 1 ml.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Läkemedlets utseende:
Grumlig vätska, suspension. Under förvaring kan innehållet uppvisa en tunn vit bottensats med klar, färglös supernatant.
Särskilda anvisningar för destruktion och övrig hantering
Havrix är en grumlig vätska, suspension.
Under förvaring kan innehållet uppvisa en tunn vit bottensats med klar, färglös supernatant.
Före användning ska vaccinet kontrolleras visuellt med avseende på främmande partiklar och/eller fysikaliska förändringar. Före användning av Havrix, ska sprutan omskakas väl, så att en nästan ogenomskinlig vit suspension erhålls. Använd inte vaccinet om det ser ut på annat vis.
Instruktioner för den förfyllda sprutan
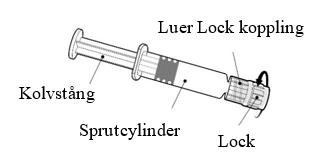 | Håll alltid i sprutcylindern, inte i kolvstången. Skruva av locket på sprutan genom att vrida den motsols. |
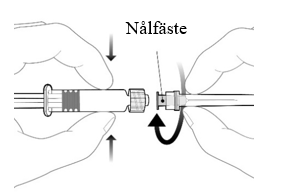 | Fäst nålen på sprutan genom att ansluta den till Luer Lock kopplingen och rotera ett kvarts varv medsols tills du känner att den låser sig. Dra inte ut kolvstången ur sprutcylindern, om detta sker ska vaccinet inte administreras. |
Destruktion
Ej använt vaccin och avfall ska kasseras enligt gällande anvisningar.
Ersättning
HAVRIX injektioneste, suspensio, esitäytetty ruisku
1440 ELISA U/ml 0,5 ml, 1 ml
- Ei korvausta.
Atc-kod
J07BC02
Datum för översyn av produktresumén
08.04.2025
Yhteystiedot
 GLAXOSMITHKLINE OY
GLAXOSMITHKLINE OY Porkkalankatu 20 A
00180 Helsinki
010 303 030
www.glaxosmithkline.fi
