NOCDURNA frystorkad tablett 25 mikrog, 50 mikrog
Kvalitativ och kvantitativ sammansättning
Varje frystorkad tablett innehåller desmopressinacetat motsvarande 25 mikrogram respektive 50 mikrogram desmopressin.
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Frystorkad tablett
Kliniska uppgifter
Terapeutiska indikationer
Nocdurna är indicerat för symtomatisk behandling av nokturi vid idiopatisk nattlig polyuri hos vuxna (se avsnitt Farmakodynamiska egenskaper).
Dosering och administreringssätt
Dosering
- Kvinnor: 25 mikrogram dagligen en timme före sänggåendet. Tabletten läggs under tungan där den löses upp utan vatten.
- Män: 50 mikrogram dagligen en timme före sänggåendet. Tabletten läggs under tungan där den löses upp utan vatten.
Dosökning rekommenderas inte hos äldre patienter ≥ 65 år.
Om högre doser övervägs för patienter under 65 år vid otillräckligt svar på Nocdurna, bör andra orala preparat innehållande desmopressin användas (se avsnitt Varningar och försiktighet, Biverkningar och Farmakodynamiska egenskaper).
Om tecken eller symtom på vätskeretention och/eller hyponatremi (huvudvärk, illamående/kräkningar, viktökning och i allvarliga fall kramper) uppkommer, bör behandlingen avbrytas och omvärderas. När behandlingen sedan återupptas, ska strikta vätskerestriktioner följas mycket noggrant och natriumnivåerna i serum kontrolleras (se avsnitt Varningar och försiktighet).
Behandling med Nocdurna bör sättas ut om natriumnivån i serum sjunker under den nedre gränsen för det normala intervallet (d v s 135 mmol/l).
Särskilda populationer
Äldre patienter (65 år och äldre)
Äldre patienter har en ökad risk för att utveckla hyponatremi vid desmopressinbehandling och kan också ha nedsatt njurfunktion. Försiktighet bör därför iakttas för denna åldersgrupp och dagliga doser över 25 mikrogram för kvinnor och 50 mikrogram för män bör inte användas. Hos äldre patienter ska serumnatrium ligga inom det normala intervallet innan behandling inleds, den första veckan (4–8 dagar efter påbörjad behandling) och återigen efter en månad. Nocdurna bör sättas ut om natriumnivån i serum sjunker under den nedre gränsen för det normala intervallet (se avsnitt Varningar och försiktighet). Fortsatt terapi ska noga övervägas hos äldre patienter där terapeutisk nytta inte visats efter 3 månader.
Nedsatt njurfunktion
Nocdurna är kontraindicerat hos patienter med måttligt till svårt nedsatt njurfunktion (se avsnitt Kontraindikationer).
Nedsatt leverfunktion
Dosjustering är inte nödvändig för patienter med nedsatt leverfunktion (se avsnitt Farmakokinetiska egenskaper).
Pediatrisk population
Det finns ingen relevant användning av Nocdurna hos den pediatriska populationen för indikationen symtomatisk behandling av nokturi förenad med idiopatisk nattlig polyuri.
Administreringssätt
Nocdurna placeras under tungan. Tabletten behövs inte ta med vatten utan den löses upp sig själv under tungan.
Födointag kan minska intensiteten och varaktigheten av den antidiuretiska effekten vid låga doser av desmopressin (se avsnitt Farmakokinetiska egenskaper).
Kontraindikationer
- Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen
- Habituell eller psykogent betingad polydipsi (dygnsurinvolym över 40 ml/kg)
- Känd eller misstänkt nedsatt hjärtfunktion eller andra tillstånd förknippade med vätskeretention som kräver behandling med diuretika, inklusive sådana tillstånd i anamnesen
- Måttlig till svår njurinsufficiens (kreatininclearance mindre än 50 ml/min)
- Känd hyponatremi
- Syndrom med störd antidiuretiskt hormon sekretion (SIADH)
Varningar och försiktighet
I synnerhet äldre patienter bör genomgå klinisk undersökning och utfrågning före behandling med Nocdurna eftersom nattlig polyuri kan vara ett symtom på hjärt-kärlsjukdom eller andra medicinska tillstånd förknippade med vätskeretention. Vid misstanke om sådana tillstånd rekommenderas inte behandling med desmopressin (se också avsnitt Kontraindikationer).
Vätskeintaget ska begränsas minst 1 timme före till 8 timmar efter administrering. Utan samtidig minskning av vätskeintaget kan behandlingen leda till långdragen vätskeretention och/eller hyponatremi med eller utan varnande tecken och symtom (huvudvärk, illamående/kräkningar, viktökning och i allvarliga fall kramper).
En ökad risk för hyponatremi föreligger hos äldre med natriumnivåer i den lägre delen av det normala intervallet. Hos patienter över 65 år bör natriumnivån i serum kontrolleras innan behandling inleds, den första veckan (4–8 dagar efter påbörjad behandling) och återigen efter en månad (se avsnitt Dosering och administreringssätt).
Vid en dosnivå på 50 mikrogram kan kvinnor ha en ökad risk för hyponatremi jämfört med män (se avsnitt Farmakodynamiska egenskaper). Det är därför viktigt att de könsspecifika dosrekommendationerna följs.
Nocdurna bör sättas ut om natriumnivån i serum sjunker under den nedre gränsen för det normala intervallet.
Desmopressin ska användas med försiktighet hos patienter vid tillstånd med rubbad vätske- och/eller elektrolytbalans.
Behandling med desmopressin bör avbrytas och omvärderas vid akuta sjukdomar med rubbad vätske- och/eller elektrolytbalans (såsom systeminfektioner, feber och gastroenterit).
För att undvika hyponatremi måste försiktighet iakttas med särskild uppmärksamhet på vätskeretention och en frekvent kontroll av natrium i serum vid samtidig behandling med läkemedel som är kända för att inducera SIADH (hyperutsöndring av antidiuretiskt hormon), t ex tricykliska antidepressiva, selektiva serotoninåterupptagshämmare, klorpromazin, diuretika och karbamazepin samt vissa antidiabetika i sulfonureidgruppen särskilt klorpropamid och vid samtidig behandling med antiinflammatoriska läkemedel (NSAID-preparat).
Särskild försiktighet bör iakktas hos patienter som får tiazider eller loopdiuretika för hypertoni eller andra medicinska tillstånd som inte förknippas med vätskeretention. Natriumkontroller krävs hos dessa patienter.
Svår blåsdysfunktion och urivägsobstruktion bör övervägas innan behandling påbörjas.
Försiktighet krävs vid cystisk fibros, hjärt-kärlsjukdom, hypertoni, kronisk njursjukdom och preeklampsi.
Diagnosen nefrogen diabetes indipidus ska övervägas om minskning av natturinproduktion inte sker efter initiering av desmopressinbehandling.
Särskild försiktighet ska iakttas hos patienter som får litium om maskering av tidig litium-inducerad nefrogen diabetes insipidus skulle inträffa vid administrering av desmopressin för en nokturi-indikation. Desmopressin rekommenderas inte till patienter som misstänks ha litium-inducerad nefrogen diabetes insipidus.
Interaktioner
Farmakodynamiska interaktioner
Substanser som är kända för att inducera SIADH kan orsaka en ökad risk för vätskeretention/hyponatremi (t ex tricykliska antidepressiva, selektiva serotoninåterupptagshämmare, klorpromazin, diuretika och karbamazepin, liksom antidiabetika av sulfonureidgruppen, särskilt klorpropamid) (se avsnitt Varningar och försiktighet)).
Icke-steroida antiinflammatoriska läkemedel (NSAID-preparat) och oxytocin kan potentiera den antidiuretiska effekten av desmopressin och kan inducera vätskeretention/hyponatremi (se avsnitt Varningar och försiktighet).
Litium kan minska den antidiuretiska effekten av desmopressin.
Farmakokinetiska interaktioner
Samtidig behandling med loperamid kan resultera i en trefaldig ökning av desmopressins plasmakoncentrationer efter oral administrering, vilket kan leda till en ökad risk för vätskeretention/hyponatremi. Ytterligare kan andra läkemedel som orsakar en långsammare tarmpassage ha samma effekt, detta har dock inte undersökts.
En standardiserad måltid med 27 % fett minskade signifikant absorption av desmopressin tabletter (absorptionshastighet och -grad). Ingen signifikant effekt observerades med avseende på farmakodynamik (urinproduktion eller osmolalitet).
Födointag kan minska intensiteten och varaktigheten av den antidiuretiska effekten vid låga orala doser av desmopressin tabletter.
Fertilitet, graviditet och amning
Graviditet
Försiktighet bör iakttas vid förskrivning till gravida kvinnor.
Data från ett begränsat antal (n = 53) gravida kvinnor som behandlats för diabetes insipidus, samt data från ett begränsat antal gravida kvinnor med blödningskomplikationer (n = 216), visar inga skadliga effekter av desmopressin på graviditeten eller fostrets/den nyföddes hälsa. Inga andra relevanta epidemiologiska data är tillgängliga. Djurstudier påvisar varken direkta eller indirekta skadliga effekter avseende graviditet, embryonal/fosterutveckling, förlossning eller postnatal utveckling.
Djurstudier avseende produktionstoxikologiska effekter har inte visat några kliniskt relevanta effekter på föräldradjur eller avkomma. In vitro -analyser i humana kotyledonmodeller visade att transplacental transport av desmopressin saknas när det administreras i terapeutiska koncentrationer motsvarande rekommenderade doser.
Amning
Resultat från analyser av modersmjölk från mödrar som fått höga doser desmopressin (300 μg intranasalt) visar att mängden desmopressin som kan överföras till barnet är avsevärt lägre än de mängder som krävs för att påverka diuresen. Det anses därför inte nödvändigt att avsluta amning.
Fertilitet
Djurstudier med desmopressin har inte visat någon försämring av fertiliteten hos han- eller honråttor.
Effekter på förmågan att framföra fordon och använda maskiner
Nocdurna har ingen eller försumbar effekt på förmågan att framföra fordon eller använda maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
Baserat på frekvensen rapporterade biverkningar i kliniska studier med Nocdurna på indikationen nokturi hos män (50 mikrogram; N = 222) och kvinnor (25 mikrogram; N = 219) var de vanligaste biverkningarna under behandlingen muntorrhet (13 %), huvudvärk (3 %), hyponatremi (3 %) och yrsel (2 %).
Beskrivning av utvalda biverkningar
Den allvarligaste biverkningen med desmopressin är hyponatremi förknippad med huvudvärk, illamående, kräkningar, minskat natrium i serum, viktökning, sjukdomskänsla, buksmärta, muskelkramper, yrsel, förvirring, nedsatt medvetandegrad och i allvarliga fall kramper och koma. Hyponatremi är en antidiuretisk effekt som uppstår av ökad reabsorption av vätska i renala tubuli och osmotisk plasmautspädning. Majoriteten av vuxna som behandlats för nokturi utvecklade låga natriumnivåer i serum inom de första behandlingsdagarna eller efter dosökning. Särskild uppmärksamhet bör ägnas åt de försiktighetsåtgärder som anges i avsnitt Varningar och försiktighet.
Kvinnor har en ökad risk för hyponatremi jämfört med män vilket kan bero på en ökad känslighet för vasopressin och dess analoger i renala tubuli. Denna risk minimeras genom lägre dosrekommendation till kvinnor. Risken för hyponatremi hos åldersgruppen över 65 år reduceras ytterligare genom övervakning natriumnivån i serum (se avsnitt Dosering och administreringssätt och Varningar och försiktighet).
Lista över biverkningar
Nedanstående tabell 1 visar frekvensen av rapporterade biverkningar. Frekvensen definieras enligt följande: Mycket vanliga (≥ 1/10), vanliga (≥ 1/100, < 1/10) och mindre vanliga (≥ 1/1000, < 1/100).
Tabell 1: Frekvens av rapporterade biverkningar (fas III-studier och rapporter efter marknadsföringen)
MedDRA | Mycket vanliga (≥ 1/10) | Vanliga | Mindre vanliga (≥ 1/1000, < 1/100) |
Metabolism och nutrition | Hyponatremi | ||
Centrala och perifera nervsystemet | Huvudvärk | ||
Magtarmkanalen | Muntorrhet* | Illamående | Förstoppning |
Allmänna symtom och/eller symtom vid administreringsstället | Trötthet |
* Notera att i en del av de kliniska studierna tillfrågades patienterna särskilt om muntorrhet.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande.
Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Symtom
Överdosering av Nocdurna tabletter leder till en förlängd verkningsduration med ökad risk för vätskeretention och hyponatremi.
Behandling
Trots att behandlingen av hyponatremi ska vara individuell, kan följande generella rekommendationer ges: hyponatremi behandlas med avbrytande av desmopressinbehandlingen och vid behov ska vätskerestriktion samt symtomatisk behandling påbörjas.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Vasopressin och analoger
ATC-kod: H01BA02
Verkningsmekanism
Nocdurna innehåller desmopressin som är en syntetisk analog till det naturliga antidiuretiska hormonet argininvasopressin (AVP). Desmopressin härmar vasopressins antidiuretiska effekt genom att binda sig till V2-receptorer i renala tubuli, vilket orsakar reabsorption av vatten in i kroppen. Ytterligare minskar den nattliga urinproduktionen till följd av denna reabsorption. På grund av de föreslagna låga könsspecifika doserna (25 mikrogram för kvinnor och 50 mikrogram för män) och den begränsade verkningsdurationen av Nocdurna, är den antidiuretiska verksamheten begränsad till den nattliga sömnperioden.
Farmakodynamisk effekt
I studien CS29 skilde den vikt-korrigerade dosen av Nocdurna som inducerade 50 % maximalt uppnåelig läkemedelseffekt på nattlig urinvolym avsevärt mellan kvinnor och män. Det uppskattade exponeringsvärdet för män var 2,7 gånger (95 % CI: 1,3–8,1) högre än värdet för kvinnor för att få en identisk dynamisk effekt, motsvarande högre desmopressinkänslighet hos kvinnor. Utvecklingen av hyponatremi är dosberoende. Kvinnor löper större risk än män för att utveckla hyponatremi. Incidensen av hyponatremi stiger med ökande ålder (se avsnitt Dosering och administreringssätt och Varningar och försiktighet).
Klinisk effekt
Effekten av Nocdurna har visats i två randomiserade placebo-kontrollerade dubbelblinda studier hos 268 kvinnor (studie CS40, desmopressin frystorkade tabletter 25 mikrogram mot placebo) respektive 395 män (studie CS41, desmopressin frystorkade tabletter 50 mikrogram och 75 mikrogram mot placebo) med nokturi definierad som ett genomsnitt av ≥ 2 nattliga miktioner per natt och polyuri hos 90 % av kvinnorna och 87 % av männen.
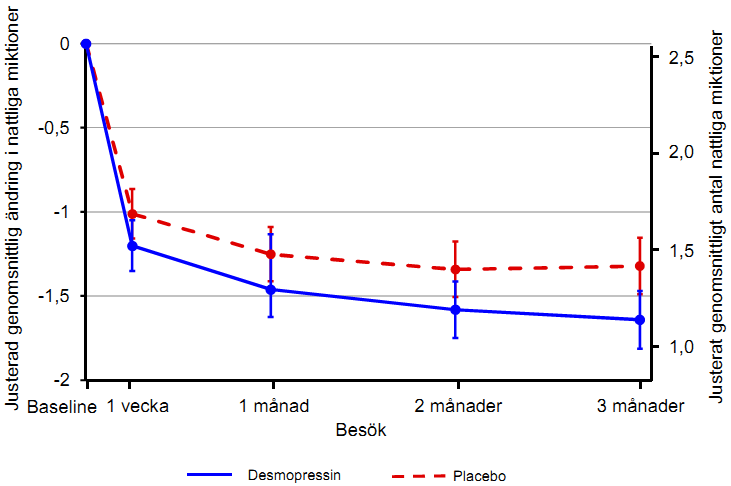
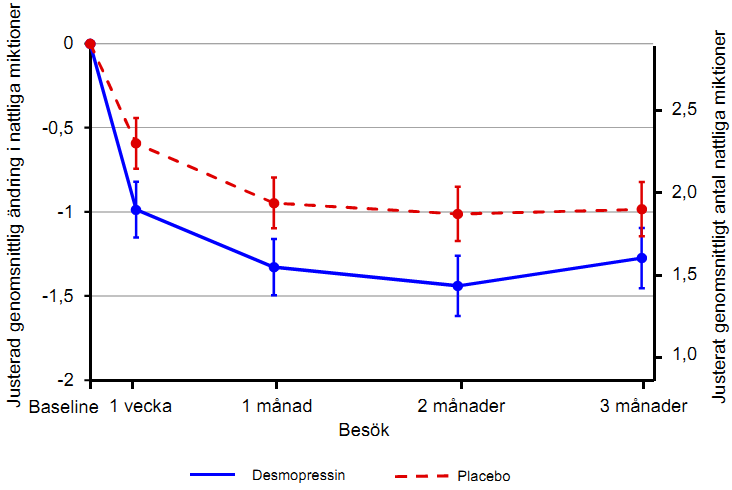
Båda studierna uppfyllde de 2 co-primära endpoints med statistiskt signifikant skillnad i desmopressins favör under 3-månadersperioden. Statistisk signifikant minskning visades av det justerade genomsnittliga antalet nattliga miktioner från utgångsvärdet med 25 mikrogram desmopressin frystorkade tabletter (-1,46) jämfört med placebo (-1,24) i studien med kvinnor (p = 0,028) (figur 1) och med 50 mikrogram desmopressin frystorkade tabletter (-1,25) jämfört med placebo (-0,88) i studien med män (p = 0,0003) (figur 2). Proportionen försökspersoner med > 33 % minskning av det genomsnittliga antalet nattliga miktioner (respondenter) ökade signifikant, nästan en dubblering. Oddskvoten för > 33 % minskning med 25 mikrogram desmopressin frystorkade tabletter jämfört med placebo var 1,85 (p = 0,006) i studien med kvinnor och oddskvoten för > 33 % minskning med 50 mikrogram desmopressin frystorkade tabletter jämfört med placebo var 1,98 (p = 0,0009) i studien med män.
För sekundära endpoints visades en ökning från utgångsvärdet till 3 månader i den första ostörda sömnperioden (FUSP)/tid till första miktionen med en behandlingskontrast på 49 minuter i studien med kvinnor och 39 minuter i studien med män. Statistiskt signifikant förbättring i livskvalitet visades med 25 mikrogram desmopressin frystorkade tabletter (NQoL totalpoäng 27,24) jämfört med placebo (21,90) (p = 0,0226) hos kvinnor och en förbättring med 50 mikrogram desmopressin frystorkade tabletter (NQoL totalpoäng 18,37) jämfört med placebo (13,88) (p = 0,0385) hos män. Det fanns ett starkt samband (p < 0,0001) i båda studierna mellan behandlingssvar (minskning av antalet nattliga miktioner och ökning av FUSP) och förbättringar i patienternas livskvalitet.
Figur 1.Co-primär endpoint:Justerad genomsnittlig skillnad från utgångsvärdet för nattliga miktioner under 3 månaders behandling – (kvinnor, CS40 fullständigt analysset)
Figur 2.Co-primär endpoint:Justerad genomsnittlig skillnad från utgångsvärdet för nattliga miktioner under 3 månaders behandling – (män, CS41 fullständigt analysset)
I en dubbelblind randomiserad klinisk studie undersöktes effekt och säkerhet av en kombinationsbehandling med desmopressin frystorkade tabletter och tolterodin depotkapslar för behandling av överaktiv blåsa med nokturi hos kvinnor, under en period på 3 månader. Fyrtionio försökspersoner exponerades för en kombination av 25 mikrogram Nocdurna (desmopressin frystorkade tabletter) och 4 mg tolterodin. Inga allvarliga biverkningar observerades i denna studie och säkerhetsprofilen för kombinationsbehandlingen liknade säkerhetsprofilen för 25 mikrogram Nocdurna. Effekten i form av minskning från utgångsvärdet i genomsnittligt antal nattliga miktioner under 3 månaders behandling var numerärt större i kombinationsbehandlingen jämfört med tolterodin monoterapigrupp (behandlingskontrast, -0,34 miktioner) i fullständigt analysset, och skillnaden uppnådde statistisk signifikans (p = 0,049) med en behandlingskontrast av -0,41 miktioner i per protokoll analysset.
Könsskillnader avseende effekt och säkerhet
I den kliniska studien [FE992026 CS029] analyserades dos-respons för Nocdurna hos kvinnor och män i doser från 10 till 100 mikrogram: Hos kvinnor fanns det ingen ytterligare vinst i farmakodynamisk effekt med doser högre än 25 mikrogram, vilket tyder på att dos-respons-platån var nådd med 25 mikrogram hos kvinnor. Hos män var minskningen av urinvolym större med 50 mikrogram men inte väsentligt större med 100 mikrogram. Doser upp till 50 mikrogram hos kvinnor gav inte ytterligare effekt men var förknippad med en 5-faldig ökning av risken för hyponatremi jämfört med män i åldersgruppen över 50 år (p = 0,015).
Farmakokinetiska egenskaper
Absorption
Genomsnittlig absolut biotillgänglighet för desmopressin efter sublingual administrering från tidigare dosfinnande studier av doser på 200, 400 och 800 mikrogram är 0,25 % (CI 95 %; 0,21–0,31 %). Desmopressin uppvisar en måttlig till hög variation i biotillgänglighet, både inom och mellan individer. Desmopressin visar doslinjäritet avseende AUC och Cmax i intervallet 60–240 mikrogram. Biotillgängligheten har dock inte utvärderats av doser under 60 mikrogram.
Distribution
Distributionen av desmopressin beskrivs bäst som en två-compartments distributionsmodell med en distributionsvolym under elimineringsfasen på 0,3–0,5 l/kg.
Metabolism
Metabolismen av desmopressin har inte studerats in vivo. In vitro -studier med levermikrosomer från människa har visat att ingen signifikant mängd av desmopressin metaboliseras i levern av cytokrom P450 -systemet. Det är därför inte troligt att desmopressin metaboliseras i levern av cytokrom P450 -systemet hos människa. Effekten av desmopressin på farmakokinetiken av andra läkemedel är sannolikt minimal på grund av dess brist på inhibering av cytokrom P450 läkemedelsmetaboliska system.
Eliminering
Totalt clearance av desmopressin har beräknats till 7,6 l/h. Terminal halveringstid av desmopressin beräknas till 2,8 timmar. Hos friska försökspersoner var fraktionen som utsöndras oförändrad 52 % (44–60 %).
Linjäritet/icke-linjäritet
Det finns inget som tyder på icke-linjäritet i någon av de farmakokinetiska parametrarna för desmopressin.
Karaktäristik i särskilda patientgrupper
Nedsatt njurfunktion
Beroende av stadiet av nedsatt njurfunktion ökar AUC och halveringstid med svårighetsgraden av nedsatt njurfunktion. Desmopressin är kontraindicerat hos patienter med måttligt till svårt nedsatt njurfunktion (kreatininclearance mindre än 50 ml/min).
Tabell 2: Farmakokinetiska parametrar för olika grader av nedsatt njurfunktion. Data från studien CS001.
Kreatininclearance | Njurfunktion | AUC (h* pg/ml) | T½ (h) | |
Friska | > 80 ml/min | Normal | 186 | 2,8 |
Mild | 50–80 ml/min | Lätt nedsatt | 281 | 4,0 |
Måttlig | 30–49 ml/min | Måttligt nedsatt | 453 | 6,7 |
Svår | 5–29 ml/min | Svårt nedsatt | 682 | 8,7 |
Nedsatt leverfunktion
Inga studier avseende farmakokinetiken av desmopressin har utförts i denna population.
Det är osannolikt att desmopressin skulle interagera med läkemedel som påverkar metabolismen i levern, eftersom desmopressin inte uppvisar signifikant levermetabolism i in vitro -studier med mikrosomer från människa.
Prekliniska säkerhetsuppgifter
Gängse studier avseende säkerhetsfarmakologi, allmäntoxicitet, gentoxicitet och reproduktionstoxicitet visade inte några särskilda risker för människa.
Carcinogenicitetsstudier har inte utförts på grund av att desmopressin är nära besläktat med det naturligt förekommande peptidhormonet.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Gelatin
Mannitol (E 421)
Citronsyra, vattenfri
Inkompatibiliteter
Ej relevant.
Hållbarhet
4 år
Särskilda förvaringsanvisningar
Detta läkemedel kräver inga särskilda förvaringsanvisningar.
Förvaras i originalförpackningen. Fuktkänsligt. Ljuskänsligt.
Enstaka tablett används omedelbart efter öppnandet av respektive blister.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
NOCDURNA tabletti, kylmäkuivattu
25 mikrog (L:ei) 30 x 1 fol (25,79 €)
50 mikrog (L:ei) 30 x 1 fol (25,79 €)
PF-selosteen tieto
Perforerad blisterförpackning i en pappkartong.
Blistrets underfolie och ovanfolie: flera lager laminat av PVC/OPA/aluminium/OPA/PVC, värmeförseglingen: lack/aluminium/PET/papper.
Förpackningsstorlek
30x1 frystorkade tabletter.
Läkemedlets utseende:
Nocdurna 25 mikrogram:
Vit, rund frystorkad tablett som är ca 12 mm i diameter och präglad med 25 på ena sidan.
Nocdurna 50 mikrogram:
Vit, rund frystorkad tablett som är ca 12 mm i diameter och präglad med 50 på ena sidan.
Särskilda anvisningar för destruktion och övrig hantering
Inga särskilda anvisningar.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Ersättning
NOCDURNA tabletti, kylmäkuivattu
25 mikrog 30 x 1 fol
50 mikrog 30 x 1 fol
- Peruskorvaus (40 %).
Atc-kod
H01BA02
Datum för översyn av produktresumén
05.05.2021
Yhteystiedot
Bertel Jungin aukio 5
02600 Espoo
020 740 1440
info@ferring.fi
etunimi.sukunimi@ferring.com
