VITAROS kräm 3 mg/g
Kvalitativ och kvantitativ sammansättning
Varje endosbehållare innehåller 200 mikrogram alprostadil i 100 mg kräm (2 mg/g).
Varje endosbehållare innehåller 300 mikrogram alprostadil i 100 mg kräm (3 mg/g).
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Kräm
Kliniska uppgifter
Terapeutiska indikationer
Behandling av män ≥18 års ålder med erektil dysfunktion, vilket är oförmåga att uppnå eller bibehålla en erektion som är tillräcklig för en tillfredsställande sexuell funktion.
Dosering och administreringssätt
Dosering
Vitaros finns tillgängligt i två dosstyrkor, 200 och 300 mikrog alprostadil i 100 mg kräm. Vitaros ska vid behov användas för att uppnå erektion. Varje endosbehållare med Vitaros är endast avsedd för engångsbruk och ska på lämpligt sätt kasseras efter användning. Effekten sätter in inom 5 till 30 minuter efter administrering. Effektdurationen är cirka 1 till 2 timmar. Emellertid kan den verkliga varaktigheten variera från patient till patient. Varje patient ska före självadministrering instrueras av vårdpersonal om korrekt teknik för tillförsel av Vitaros. Medlet får användas maximalt 2–3 gånger per vecka och högst en gång per 24‑timmarsperiod.
Initialdosen ska rekommenderas av läkare. En startdos på 300 mikrog kan övervägas, speciellt hos patienter med allvarlig erektil dysfunktion, komorbiditet eller misslyckad behandling med PDE5‑inhibitorer. Patienter som på grund av lokala biverkningar inte tolererar en dos på 300 mikrog kan titreras till den lägre dosen på 200 mikrog.
Patienter ska instrueras om lämplig administreringsteknik.
Administreringssätt
Det rekommenderas att man urinerar innan läkemedlet appliceras. Efter det att locket tagits av, applicera hela innehållet av Vitaros in i penisöppningen (meatus) inom 5 till 30 minuter före samlagsförsök i enlighet med instruktionerna nedan:
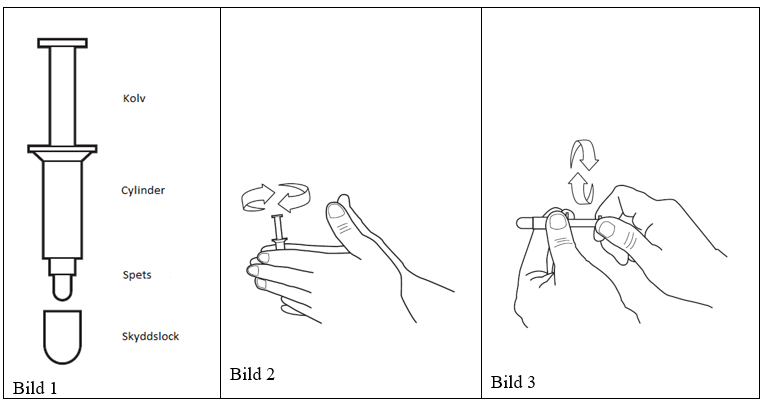
1) Tvätta händerna före applicering av Vitaros. Ta ut en endosbehållare ur foliepåsen genom att riva ner folien helt från mitten av den övre kanten. Ta ut endosbehållaren ur påsen (se bild 1). Spara påsen och använd den då den använda endosbehållaren ska slängas.
2) Få innehållet i endosbehållaren att anta rumstemperatur genom att rulla behållaren mellan dina händer (se bild 2). Detta steg kan hoppas över om foliepåsen tidigare tagits fram ur kylskåpet (inom de tidsgränser som nämns i avsnitt Särskilda förvaringsanvisningar Särskilda förvaringsanvisningar) och innehållet redan har antagit rumstemperatur.
3) Vrid kolven fram och tillbaka flera gånger så att du försäkrar dig om att den kommer glida lätt (se bild 3). Ta sedan av locket från endosbehållarens spets.
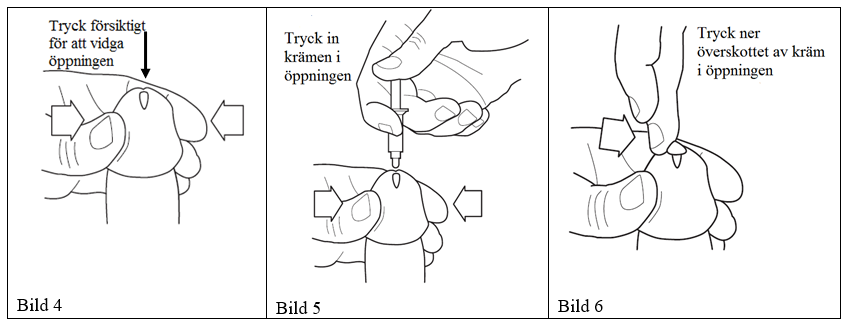
4) Ta tag om spetsen av penis med en hand och tryck försiktigt för att vidga penisöppningen medan penis hålls i upprätt läge (se bild 4). (Observera! Den som inte är omskuren, drar tillbaka och håller fast förhuden, innan penisöppningen vidgas.)
5) Håll endosbehållarens cylinder mellan fingrarna och placera behållarens spets så nära penisöppningen som möjligt, utan att sticka in den i penis (se bild 5) så att krämen kan tryckas ner i urinröret. Kom ihåg att trycka ut all kräm från endosbehållaren. Tryck försiktigt och långsamt men bestämt ned kolven med tummen eller fingret, tills all kräm tryckts in i penisöppningen och ner i urinröret. Observera: Även om det är viktigt att all kräm kommer ner i urinröret ska inte endosbehållarens spets föras in i penisöppningen.
6) Håll penis i upprätt läge i ungefär 30 sekunder för att låta krämen penetrera. Det kommer sannolikt att bli en del kräm som inte initialt ryms i penisöppningen. Överskottet av kräm som täcker penisöppningen bör tryckas ner i öppningen med hjälp av ett finger. Använd inte en andra endosbehållare för att kompensera för kräm som inte kommit in i öppningen (se bild 6). Urinera inte omedelbart efter det att krämen applicerats, det finns då en risk att läkemedlet åker ut före det att effekten äger rum.
7) Kom ihåg att varje dos Vitaros endast räcker till en enstaka applicering. Sätt tillbaka locket på endosbehållarens spets och lägg den i den öppnade påsen. Vik sedan ihop denna och kassera i enlighet med lokala föreskrifter.
8) Vitaros kan verka irriterande på ögonen. Tvätta händerna efter applicering av Vitaros.
Kontraindikationer
Vitaros ska inte användas till patienter med något av följande:
- Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen.
- Underliggande sjukdomar och tillstånd såsom ortostatisk hypotension, myokardinfarkt och svimning.
- Tillstånd som kan predisponera för priapism, till exempel sickle cell‑anemi eller anlag härför, trombocytemi, polycytemi, multipelt myelom eller leukemi.
- Avvikande penisanatomi, till exempel uttalad hypospadi, anatomiska deformiteter i penis, såsom ökad krökning av denna, samt uretrit och balanit (inflammation/infektion i glans penis).
- Benägenhet för ventrombos eller hyperviskositetssyndrom och därför ökad risk för priapism (uttalad erektion som varar 4 timmar eller mer).
- Vitaros bör inte användas till patienter som avråds från deltagande i sexuella aktiviteter, t ex män med instabila kardiovaskulära eller cerebrovaskulära förhållanden.
- Vitaros bör vid samlag med fertil kvinna användas endast om kondom samtidigt används.
Varningar och försiktighet
Lokala effekter
Även om det är mindre vanligt, har förlängda erektioner som varade >4 timmar (priapism) observerats vid användning av Vitaros (se avsnitt Biverkningar Biverkningar). Om priapism uppträder, ska patienten omedelbart söka läkare. Om priapism inte omedelbart behandlas, kan resultatet bli skada på penisvävnaden och permanent förlust av potensen.
Symtomatisk hypotension (yrsel) och synkope förekom under fas 3‑studierna hos en liten andel av patienterna (se avsnitt Biverkningar). Patienter bör uppmanas att undvika framförande av fordon eller riskabla aktiviteter, vid vilka skador kan orsakas om hypotension eller synkope skulle uppträda efter administrering av Vitaros.
Före inledande av behandling med Vitaros bör behandlingsbara orsaker till den erektila dysfunktionen uteslutas med hjälp av lämpliga diagnostiska metoder.
Härtill kommer att patienter med underliggande sjukdomar, såsom ortostatisk hypotension, myokardinfarkt och synkope, ej bör använda Vitaros (se avsnitt Kontraindikationer Kontraindikationer).
Kliniska studier har ej genomförts med patienter med anamnes på neurologisk sjukdom eller ryggmärgsskador.
Farmakokinetiken för Vitaros har inte formellt studerats hos patienter med lever- och/eller njursvikt. Dosen kan på grund av försämrad metabolism behöva minskas i dessa populationer.
Allmänna försiktighetsåtgärder
Vitaros bör appliceras enligt instruktionerna ovan. Felaktig intrauretral applicering kan medföra en brännande eller svidande känsla och smärta i penis. Upprepad, långtida intrauretral exponering för Vitaros är okänd.
Patienterna bör informeras om att Vitaros inte ger något skydd mot smitta med sexuellt överförbara sjukdomar. Patienter som använder Vitaros och deras partners kan behöva upplysas om de åtgärder som är nödvändiga för att skydda mot spridning av sexuellt överförd smitta, inklusive humant immunbristvirus (hiv).
Sjukvårdspersonal bör uppmuntra sina patienter att informera sina sexualpartners om att de använder Vitaros. Partners till användare av Vitaros kan uppleva biverkningar, vanligast är vaginal irritation. På så sätt rekommenderas användning av kondom.
Effekterna av Vitaros på slemhinnan i munhåla och analregion har inte studerats. Kondom bör därför användas vid orala (fellatio) och anala samlag.
Vitaros har inga kontraceptiva egenskaper. Par som använder Vitaros rekommenderas adekvat kontraception, om kvinnan är fertil.
Det finns ingen information om effekterna under tidig graviditet av alprostadil i de mängder som överförs till kvinnliga partners. Kondom bör användas under samlag med kvinnor som är fertila, gravida eller ammande.
Endast kondomer tillverkade av latexmaterial har undersökts i kombination med medlet, och andra material kanske inte utesluter tänkbara risker för skador på kondomen.
Interaktioner
Farmakokinetiska och farmakodynamiska interaktionsstudier av Vitaros har ej genomförts. Utifrån metabolismens egenskaper (se avsnitt Farmakokinetiska egenskaper Farmakokinetiska egenskaper) ter sig läkemedelsinteraktioner osannolika.
Effekt av interaktion
Säkerheten för och effekten av Vitaros i kombination med andra behandlingar av erektil dysfunktion, särskilt behandling med fosfodiesteras‑5‑inhibitorer (PDE5) såsom sildenafil, tadalafil och vardenafil, har ej studerats. Därför bör Vitaros ej användas i kombination med PDE5‑inhibitorer. Eftersom både Vitaros och PDE5‑inhibitorer har kardiovaskulära effekter, kan en ytterligare ökad kardiovaskulär risk ej uteslutas.
Inga interaktionsstudier har gjorts för Vitaros i kombination med penisimplantat eller glattmuskelrelaxantia, såsom papaverin, eller läkemedel använda för att inducera erektion, såsom alfablockerande medel (t ex intrakavernöst fentolamin eller tymoxamin). Det finns en risk för priapism (smärtsam, utdragen, abnorm erektion), när de används i kombination.
Inga interaktionsstudier har gjorts för Vitaros i kombination med sympatomimetika, avsvällande medel och aptithämmare. Kombinationer med dessa kan resultera i minskad effekt av alprostadil (inhibition genom läkemedelsinteraktion).
Inga interaktionsstudier har gjorts för Vitaros i kombination med antikoagulantia och inhibitorer av trombocytaggregation. Kombinationer med dessa kan resultera i ökad risk för uretrablödningar eller hematuri.
Patienter som samtidigt behandlas med antihypertensiva och vasoaktiva medel kan uppvisa en ökad risk för hypotension; särskilt gäller detta äldre patienter.
Fertilitet, graviditet och amning
Graviditet
Det finns inga data från användningen av Vitaros till gravida kvinnor. Den indirekta exponeringen av kvinnor för alprostadil är sannolikt låg.
Djurstudier av större doser av alprostadil har visat reproduktionstoxikologiska effekter (se avsnitt Prekliniska säkerhetsuppgifter).
Gravida kvinnor bör ej exponeras för Vitaros.
Amning
Det är okänt om indirekt exponering för alprostadil via Vitaros leder till signifikant utsöndring i bröstmjölk. Användning av Vitaros under amning rekommenderas ej.
Fertilitet
Hos kaninhannar observerades atrofi av tubuli seminiferi i testiklarna efter upprepade doser. Det är inte känt om Vitaros har någon effekt på den manliga fertiliteten.
Effekter på förmågan att framföra fordon och använda maskiner
Inga studier har gjorts av effekterna på förmågan att framföra fordon och använda maskiner.
Eftersom yrsel och synkope (svimning) i sällsynta fall har rapporterats från kliniska prövningar med Vitaros, bör patienter undvika bilkörning och andra riskfyllda aktiviteter där yrsel eller svimning kan leda till skada inom 1 till 2 timmar efter administrering av Vitaros.
Biverkningar
De vanligaste läkemedelsrelaterade biverkningar som rapporterats av patienter under kliniska studier var övergående lokala urogenitala reaktioner vid eller nära appliceringsstället, t ex sveda, smärta, klåda, stickningar och erytem på penis efter applicering, vilka var lätta till måttliga i svårighetsgrad och övergående, varade 1 till 2 timmar. Dessa lokala biverkningar tolererades väl av de flesta patienter och var jämförbara mellan olika doser av alprostadil.
Mindre vanliga men eventuellt allvarliga biverkningar i kliniska fas 3‑studier var yrsel, svimning (synkope) och hypotension (2/459 (0,4 %), 6/1591 (0,4 %) och 6/1280 (0,5 %) vid doserna 100, 200 respektive 300 mikrog). Priapism observerades bara hos 1 patient (0,06 %) i de två 3‑månadersstudierna och bara hos 5 (0,4 %) patienter i >6‑månadersstudien, inklusive 4 (0,3 %) i gruppen som fick 200 mikrog och 1 (0,1 %) i gruppen som fick 300 mikrog alprostadil.
De vanligaste läkemedelsrelaterade biverkningar som rapporterades av kvinnliga partner under placebokontrollerade, dubbelblinda, kliniska studier av användning flera gånger (3 månader och >6 månader) var lätt till måttlig övergående vaginal sveda eller klåda som försvann 1 till 2 timmar efter uppkomst. Det är okänt om dessa biverkningar har samband med Vitaros eller till att samlag återupptagits, vilket skedde oftare hos partners som fick aktiv medicinering.
Lista över biverkningar
De oftast rapporterade biverkningarna under behandling med Vitaros presenteras i tabellen härnedan. (Mycket vanliga ≥1/10; Vanliga ≥1/100, <1/10; Mindre vanliga ≥1/1 000, <1/100; Sällsynta ≥1/10 000, <1/1 000; Mycket sällsynta <1/10 000)
Priapism (erektion som varar längre än 4 timmar) är ett allvarligt tillstånd, som kräver snabb läkarbehandling.
Tabell 1 Biverkningar
Klassificering av organsystem (MedDRA) | Frekvens | Biverkning |
Centrala och perifera nervsystemet | Mindre vanliga | Hyperestesi |
Blodkärl* | Mindre vanliga | Yrsel Synkope Hypotension |
Hud och subkutan vävnad | Vanliga | Utslag |
Muskuloskeletala systemet och bindväv | Mindre vanliga | Extremitetssmärta |
Njurar och urinvägar | Vanliga | Uretrasmärta |
Mindre vanliga | Uretrastenos Urinvägsinflammation | |
Reproduktionsorgan och bröstkörtel | Vanliga | Brännande känsla i penis Smärta i penis Peniserytem Genital smärta Genitalt obehag Genitalt erytem Ökad erektion Genital klåda Penisödem Balanit Sveda i penis Dunkande känsla i penis Domningskänsla i penis Hos kvinnliga partners: Brännande känsla vulvovaginalt Vaginit |
Mindre vanliga | Klåda i penis Genitalt utslag Smärta i skrotum Genital fyllnadskänsla Extrem stelhet Känslolöshet i penis Förlängd erektion/priapism Hos kvinnliga partners: Vulvovaginal klåda | |
Allmänna symtom och/eller symtom vid administreringsstället | Mindre vanliga | Smärta vid administreringsstället |
Speciella populationer
*Det finns inga tydliga tecken på att alprostadil ökar risken för kardiovaskulära händelser andra än de vasodilaterande effekterna, men det kan inte uteslutas att patienter med underliggande sjukdom/riskfaktorer löper ökad risk i kombination med ökad sexuell/fysisk aktivitet som är förknippad med alprostadilanvändning (se avsnitt Kontraindikationer och Varningar och försiktighet).
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande.
Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Behandlingskrävande överdosering har inte rapporterats för Vitaros. Överdosering av Vitaros kan medföra hypotension, synkope, yrsel, penissmärta och möjligen priapism (stel erektion som varar >4 timmar). Priapism kan leda till en permanent försämring av den erektila funktionen. Patienter som misstänks ha tagit en överdos och utvecklar dessa symtom ska övervakas medicinskt, tills systemiska eller lokala symtom försvunnit.
Vid en förlängd erektion som varar 4 timmar eller mer ska patienten uppmanas att söka läkare. Följande åtgärder kan vidtas:
- Patienten ska ligga på rygg eller på sidan. Lägg under två minuter en ispåse omväxlande på höger respektive vänster sida på övre delen av lårets insida (detta kan framkalla en reflexöppning av venklaffarna). Om ingen reaktion uppnås efter 10 minuter, avbryts behandlingen.
- Om denna behandling är verkningslös, och en stel erektion har varat mer än 6 timmar, ska aspiration från penis genomföras. Med aseptisk teknik införs en 19–21 gauge ”butterfly”-nål i corpus cavernosum, och 20–50 ml blod aspireras. Detta kan få penis att svälla av. Vid behov kan proceduren upprepas på penis motsatta sida.
- Om ingen effekt uppnås med ovanstående metoder, rekommenderas intrakavernös injektion av α-adrenergikum. Även om inte den sedvanliga kontraindikationen mot intrapenil tillförsel av vasokonstriktor gäller vid behandling av priapism, uppmanas till försiktighet vid denna åtgärd. Blodtryck och puls ska kontinuerligt övervakas under åtgärden. Extrem försiktighet krävs hos patienter med kranskärlssjukdom, okontrollerad hypertension, cerebral ischemi och hos patienter som tar monoaminoxidashämmare. I det senare fallet ska beredskap för hantering av en hypertensiv kris finnas.
- En 200 mikrog/ml lösning av fenylefrin bereds, och 0,5 till 1,0 ml av denna injiceras med 5–10 minuters intervall. Alternativt används en 20 mikrog/ml lösning av adrenalin. Vid behov kan detta följas av ytterligare aspiration av blod genom samma ”butterfly”‑nål. Den maximala dosen av fenylefrin är 1 mg, och av adrenalin 100 mikrog (5 ml av endera lösningen).
- Som ett alternativ kan metaraminol användas, men det bör noteras att hypertensiva kriser med dödlig utgång har rapporterats. Om de vidtagna åtgärderna fortfarande inte häver priapismen, ska patienten omedelbart remitteras till operation.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Medel vid erektil dysfunktion
ATC-kod: G04BE01
Verkningsmekanism
Alprostadil är kemiskt identiskt med prostaglandin E1, vars effekter innefattar bland annat vasodilatation av blodkärl i den erektila vävnaden i corpora cavernosa och en ökning av det arteriella blodflödet i dessa, vilket sammantaget framkallar styvhet i penis.
Efter applicering av Vitaros framkallas erektion inom 5 till 30 minuter. Alprostadil har kort halveringstid hos människa, och en förbättring av erektionerna kan förväntas vara från 1 till 2 timmar efter administrering.
Klinisk effekt och säkerhet
I två pivotala fas 3‑studier utvärderades effekten av Vitaros (100, 200 and 300 mikrog) hos män (n=1651) med erektil dysfunktion under en 12‑veckorsperiod. Statistiskt signifikanta (p<0,001) förändringar i förhållande till placebo observerades vid medelförändring för co‑primära resultatmått, d v s poäng för domänen erektil funktion i IIEF (IIEF‑EF), genomsnittlig procent för lyckad vaginal penetration (SEP‑3) och genomsnittlig procent för lyckad ejakulation (SEP‑4). Den genomsnittliga förändringen av IIEF‑EF‑poäng var 1,6; 2,5 respektive 2,4 för dosnivåerna 100, 200 och 300 mikrog. Förbättringar av co‑primärt resultatmåtten fler lyckade vaginala penetrationer (100 mikrog [2,9 %], 200 mikrog [5,1 %], 300 mikrog [7,2 %]) och lyckade ejakulationer (100 mikrog [7,0 %], 200 mikrog [13,8 %], 300 mikrog [9,1 %]) observerades också. Liknande resultat observerades hos den subpopulation av män som tidigare behandlats med en fosfodiesteras typ V‑hämmare (PDE‑5i) och de med diabetes, kardiell anomali, hypertension eller post‑prostatektomi. Jämförbara resultat observerades hos män ≤65 och >65 år. Post‑hoc responderanalys visade att procentandelen män som rapporterade statistiskt signifikant (p<0,001) förbättring av IIEF‑EF‑poängen (≥4) var 35 %, 39 % och 38 % i förhållande till placebo (21 %) i grupperna som fick 100, 200 respektive 300 mikrog. I en öppen klinisk studie av längre varaktighet gav dosen 300 mikrog fortsatt förbättring med en genomsnittlig förändring på 6,67 av IIEF‑EF‑poäng i förhållande till baseline.
Farmakokinetiska egenskaper
Absorption
Absolut biotillgänglighet efter lokal administrering bestämdes ej. I en farmakokinetisk studie behandlades patienter med erektil dysfunktion med 100 mg Vitaroskräm med doser om 100, 200 och 300 mikrog alprostadil. Plasmanivåerna av PGE1 och dess metabolit PGE0 var hos de flesta patienter låga eller ej påvisbara i de flesta blodprover som togs vid olika tidpunkter efter administreringen, och farmakokinetiska parametrar kunde ej bestämmas. Värdena på Cmax och AUC för 15‑keto‑PGE0 var låga och uppvisade en subproportionell ökning i dosintervallet 100–300 mikrog. Maximala plasmakoncentrationer av 15‑keto-PGE0 uppnåddes inom en timma efter administrering.
Tabell 2
Genomsnittliga (SD) farmakokinetiska parametrar för 15‑keto‑PGE0
Parameter | Placebo (N=5) | Vitaros 100 mikrog (N=5) | Vitaros 200 mikrog (N=5) | Vitaros 300 mikrog (N=5) |
AUCa (pg*h/ml) | 388 (256) | 439 (107) | 504 (247) | 960 (544) |
Cmax (pg/ml) | 23 (19) | 202 (229) | 120 (103) | 332 (224) |
Tmax (h) | 6 (8) | 0,6 (0,4) | 1 (0,7) | 0,7 (0,3) |
T1/2 (h) | 4 (--)b | 5 (3) | 3 (1)c | 6 (6) |
a AUC är ytan under plasmakoncentrationskurvan från tiden noll till 24 h. b Endast 1 patient hade tillräckliga data för uppskattning av halveringstiden. c Endast 3 patienter hade tillräckliga data för uppskattning av halveringstiden. SD = standardavvikelse | ||||
Distribution
Efter applicering av alprostadil vid meatus och glans penis, absorberas substansen snabbt i corpus spongiosum och corpora cavernosa via kollateralkärl. Överskottet passerar in i bäckenets venösa cirkulation genom vener som dränerar corpus spongiosum.
Metabolism
Efter lokal administrering metaboliseras PGE1 snabbt och lokalt genom enzymatisk oxidation av 15-hydroxylgruppen under bildning av 15‑keto‑PGE1. 15‑keto‑PGE1 bibehåller endast 1–2 % av den biologiska aktiviteten hos PGE1 och reduceras snabbt under bildning av den i störst mängd förekommande inaktiva metaboliten, 13,14‑dihydro,15‑keto‑PGE, som elimineras av framför allt njurar och lever.
Eliminering
Efter intravenös administrering av tritiummärkt alprostadil till människa, försvinner det märkta läkemedlet under de första 10 minuterna snabbt från blodet, och endast låga nivåer av radioaktivitet kvarstår i blodet efter 1 timme. Metaboliterna av alprostadil elimineras framför allt via njurarna, så att cirka 90 % av den tillförda intravenösa dosen avges med urinen inom 24 timmar efter administreringen. Återstoden utsöndras med avföringen. Det finns inga tecken på att vävnaderna kvarhåller alprostadil eller dess metaboliter efter intravenös administrering.
Farmakokinetik i speciella populationer
Lungsjukdom
Patienter med lungsjukdom kan ha nedsatt förmåga att eliminera läkemedlet. Hos patienter med akut andningssviktsyndrom hos vuxen minskade lungornas extraktion av intravenöst tillfört PGE1 med cirka 15 % jämfört med en kontrollgrupp av patienter med normal andningsfunktion.
Kön
Effekten av kön på farmakokinetiken för Vitaros har inte studerats, och farmakokinetiska studier har inte gjorts på kvinnliga partners.
Geriatrik, pediatrik
Effekterna av ålder på farmakokinetiken för lokalt applicerat alprostadil har inte studerats. Vitaros är inte indicerat för användning till barn eller ungdomar under 18 år.
Prekliniska säkerhetsuppgifter
Alprostadil, DDAIP och Vitaros (inklusive DDAIP) har inte uppvisat någon gentoxisk potential.
Studier av eventuell karcinogenicitet hos alprostadil och Vitaros har ej genomförts. Karcinogenicitetsbedömningar av hjälpämnet DDAIP uppvisade ingen tumörbildning efter lokal applicering på möss och subkutan tillförsel till råttor. I den transgena musmodellen Tg.AC inducerade administrering av DDAIP i en koncentration av 1,0 % och 2,5 % papillom hos honor respektive hannar. Denna effekt är troligen inte relevant för människa, eftersom den sannolikt orsakades av irritation.
Alprostadil har ingen inverkan på spermiernas antal eller morfologi. Hjälpämnet DDAIP orsakade emellertid atrofi av tubuli seminiferi i kanintestiklar efter lokal administrering med en koncentration av 5 %. En direkt spermatotoxisk effekt av DDAIP kunde inte testas, och relevansen för en eventuellt minskad manlig fertilitet hos människa är därför okänd. DDAIP som gavs subkutant till råttor påverkade ej fertiliteten.
Alprostadil har visats vara embryotoxiskt (minskad fostervikt), när det i låga doser getts som subkutan bolus till dräktiga råttor. Högre doser resulterade i ökad frekvens av resorptioner, minskat antal levande foster, ökad incidens av viscerala och skelettala variationer och missbildningar samt förgiftningstillstånd hos mamman. Intravaginal administrering av PGE1 till dräktiga kaniner medförde inga skador på fostret.
Reproduktionstoxikologiska studier av DDAIP gjordes efter subkutan tillförsel till råttor och kaniner. Inga effekter noterades hos råttor, men hos kaniner förekom vid höga doser fetotoxicitet med bland annat ökad frekvens missbildningar. Detta var sannolikt en följd av ett förgiftningstillstånd hos mamman. Inga effekter på den postnatala utvecklingen upptäcktes hos råttor.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Renat vatten
Etanol, vattenfri
Etyllaurat
Hydroxypropylguargummi
Dodecyl‑2‑N,N‑dimetylaminopropionathydroklorid
Kaliumdivätefosfat
Natriumhydroxid, för pH‑justering
Fosforsyra, för pH‑justering
Inkompatibiliteter
Ej relevant.
Hållbarhet
Vitaros 2 mg/g kräm: 9 månader
Vitaros 3 mg/g kräm: 12 månader
Används omedelbart efter öppnandet. Ej använd produkt kasseras.
Särskilda förvaringsanvisningar
Förvaras i kylskåp (2 oC–8 oC). Får ej frysas.
Patienten kan förvara oöppnade påsar utanför kylskåp vid en temperatur under 25 °C i upp till 3 dagar före användning.
Vid slutet av denna period ska ej använd produkt kasseras.
Förvaras i originalförpackningen. Ljuskänsligt.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
VITAROS emulsiovoide
3 mg/g (L:ei) 4 x 1 annos (58,74 €)
PF-selosteen tieto
Vitaros tillhandahålls i individuella påsar innehållande en (1) endosbehållare. Endosbehållaren består av en kolv, en cylinder och ett skyddslock som levereras i en skyddande påse. En endosbehållare innehåller 100 mg kräm och fungerar även som applikator. Vitaros finns i kartonger med fyra (4) endosbehållare. Påsarna är tillverkade av aluminiumfolie/laminat. Endosbehållare består av polypropen och polyeten.
Läkemedlets utseende:
Vitaros är en vit till benvit kräm.
Särskilda anvisningar för destruktion och övrig hantering
Varje endosbehållare är endast avsedd för engångsbruk.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Ersättning
VITAROS emulsiovoide
3 mg/g 4 x 1 annos
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Alprostadiili, aviptadiilin ja fentolamiinin yhdistelmävalmiste ja sildenafiili: Vaikeasta perustaudista johtuva vaikea erektiöhäiriö erityisin edellytyksin (308).
- Korvataan enintään 6 hoitoannosta kuukaudessa.
Atc-kod
G04BE01
Datum för översyn av produktresumén
25.03.2021
Yhteystiedot
Ground Floor, 71 Lower Baggot Street
D02 P593 Dublin
Ireland
regulatory@simplepharma.company
