ACARIZAX frystorkad sublingual tablett 12 SQ-HDM
Kvalitativ och kvantitativ sammansättning
Standardiserat allergenextrakt från husdammskvalster Dermatophagoides pteronyssinus och Dermatophagoides farinae 12 SQ-HDM* per frystorkad sublingual tablett.
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
* [SQ-HDM är dosenheten för Acarizax. SQ är en metod för standardisering av biologisk styrka, allergeninnehåll och allergenextraktets komplexitet. HDM är en förkortning för house dust mite (husdammskvalster).]
Läkemedelsform
Frystorkad sublingual tablett
Kliniska uppgifter
Terapeutiska indikationer
Acarizax är avsett för vuxna i åldern 18-65 år baserat på anamnes och ett positivt sensibiliseringstest för husdammskvalster (hudpricktest och/eller specifikt IgE-test) med minst ett av följande villkor:
- ihållande måttlig till svår rinit vid allergi mot husdammskvalster, trots användning av symtomlindrande läkemedel
- astma vid allergi mot husdammskvalster, som inte är välkontrollerad med inhalationssteroider och samtidig mild till svår rinit vid allergi mot husdammskvalster. Patientens astmastatus ska noga utvärderas innan behandlingen påbörjas (se avsnitt Kontraindikationer).
Acarizax är avsett för barn i åldern 5-17 år baserat på anamnes och ett positivt sensibiliseringstest för husdammskvalster (hudpricktest och/eller specifikt IgE-test) med ihållande måttlig till svår rinit vid allergi mot husdammskvalster, trots användning av symtomlindrande läkemedel.
Villkor
Hoito tulee aloittaa allergioiden hoitoon perehtyneen erikoislääkärin toimesta.
Dosering och administreringssätt
Dosering
Rekommenderad dos för barn och vuxna (5-65 år) är en frystorkad sublingual tablett (12 SQ-HDM) dagligen.
Klinisk effekt kan förväntas efter 8-14 veckor från påbörjad behandling. Internationella behandlingsriktlinjer hänvisar till en behandlingstid på 3 år för allergenspecifik immunterapi för att uppnå sjukdomsmodifierande effekt. Effektdata finns för 18 månaders behandling med Acarizax hos vuxna; data för 3 års behandling saknas (se avsnitt Farmakodynamiska egenskaper). Om ingen förbättring observeras under det första behandlingsåret med Acarizax finns ingen indikation att fortsätta behandlingen.
Pediatrisk population
Allergisk rinit: Doseringen för barn (5-17 år) är densamma som för vuxna. Klinisk erfarenhet av behandling av allergisk rinit med Acarizax hos barn < 5 år har inte fastställts. Acarizax är inte avsett för behandling av allergisk rinit hos barn < 5 år. Tillgängliga data finns i avsnitt Biverkningar och Farmakodynamiska egenskaper.
Allergisk astma: Effekten av behandling av allergisk astma med Acarizax hos barn < 18 år har inte fastställts. Acarizax är inte avsett för behandling av allergisk astma hos barn < 18 år. Tillgängliga data finns i avsnitt Biverkningar och Farmakodynamiska egenskaper.
Äldre population
Klinisk erfarenhet av immunterapi med Acarizax för vuxna > 65 år har inte fastställts. Acarizax är inte avsett för vuxna > 65 år (se avsnitt Farmakodynamiska egenskaper).
Administreringssätt
Behandling med Acarizax bör initieras av läkare med erfarenhet av behandling av allergiska sjukdomar.
Den första frystorkade sublinguala tabletten ska tas under medicinsk övervakning och patienten ska övervakas under minst en halvtimme, för att möjliggöra diskussion och eventuell behandling av omedelbara biverkningar.
Acarizax är en frystorkad sublingual tablett. Tabletten ska tas med torra fingrar från blisterförpackningen direkt efter öppnandet och placeras under tungan där den löses upp. Undvik att svälja under 1 minut. Mat och dryck ska inte intas under minst 5 minuter.
Om behandlingen med Acarizax avbryts i upp till 7 dagar, kan behandlingen återupptas av patienten. Vid behandlingsuppehåll mer än 7 dagar, rekommenderas kontakt med läkare innan behandlingen återupptas.
Kontraindikationer
Överkänslighet mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen.
Patienter med FEV1 < 70 % av det förväntade värdet (efter adekvat farmakologisk behandling) vid initiering av behandlingen.
Patienter som haft en svår astmaexacerbation under de senaste 3 månaderna.
Hos patienter med astma och pågående akut luftvägsinfektion, bör initiering av behandling med Acarizax skjutas upp tills infektionen avklingat.
Patienter med aktiva eller dåligt kontrollerade autoimmuna sjukdomar, immundefekter, immunbrist, immunsuppression eller malignt neoplastiska sjukdomar med aktuell sjukdomsrelevans.
Patienter med akut, svår oral inflammation eller sår i munhålan (se avsnitt Varningar och försiktighet).
Varningar och försiktighet
Astma
Astma är en känd riskfaktor för svåra systemiska allergiska reaktioner.
Patienter bör informeras om att Acarizax inte är avsett för behandling av akuta astmaexacerbationer. Vid akuta astmaexacerbationer ska ett kortverkande luftrörsvidgande läkemedel användas. Om patienten upplever att behandling med kortverkande luftrörsvidgande läkemedel inte ger effekt eller har behov av fler inhalationer än normalt, måste läkarvård sökas.
Patienter ska informeras om att omedelbart söka läkarvård om deras astma plötsligt försämras.
Acarizax bör initialt ges som tilläggsbehandling och inte som ersättning för befintliga astmaläkemedel. Snabb utsättning av astmaläkemedel efter påbörjad behandling med Acarizax rekommenderas inte. Nedtrappning av astmaläkemedel bör ske gradvis och under överinseende av läkare i enlighet med riktlinjer för astmabehandling.
Svåra systemiska allergiska reaktioner
Behandlingen ska avbrytas och läkare kontaktas omedelbart vid svåra systemiska allergiska reaktioner, svår astmaexacerbation, angioödem, sväljsvårigheter, andningssvårigheter, röstförändringar, hypotension eller fyllnadskänsla i halsen. Debut av systemiska symtom kan inkludera rodnad, klåda, värmekänsla, allmänt obehag och agitation/ångest.
Ett behandlingsalternativ av svåra systemiska allergiska reaktioner är adrenalin. Adrenalinets effekt kan förstärkas hos patienter som behandlas med tricykliska antidepressiva, monoaminoxidashämmare (MAO-hämmare) och/eller COMT-hämmare vilket kan få fatala konsekvenser. Effekterna av adrenalinet kan minska hos patienter som behandlas med betablockare.
Patienter med hjärtsjukdom kan ha en ökad risk vid systemiska allergiska reaktioner. Klinisk erfarenhet av Acarizax till patienter med hjärtsjukdom är begränsad.
Detta bör beaktas innan allergenspecifik immunterapi påbörjas.
Initiering av Acarizax hos patienter som tidigare haft en systemisk allergisk reaktion vid subkutan immunterapi med allergenextrakt från husdammskvalster bör noga övervägas och åtgärder för att behandla eventuella reaktioner ska finnas tillgängliga. Detta grundar sig på erfarenhet från klinisk användning av en motsvarande sublingual tablett vid immunterapi med gräspollen, som tyder på ökad risk för en svår allergisk reaktion hos patienter som tidigare upplevt en systemisk allergisk reaktion vid subkutan immunterapi med gräspollen.
Oral inflammation
Hos patienter med svår oral inflammation (t.ex. lichen planus, sår eller svamp i munnen), sår i munhålan eller efter oral kirurgi, inklusive tandutdragning, eller efter tandlossning, bör initiering av behandling med Acarizax skjutas upp och pågående behandling tillfälligt avbrytas för att tillåta läkning av munhålan.
Lokala allergiska reaktioner
Vid behandling med Acarizax utsätts patienten för det allergen som orsakar de allergiska symtomen. Man kan därför förvänta sig lokala allergiska reaktioner under behandlingsperioden. Reaktionerna är vanligen milda till måttliga, men allvarligare orofaryngala reaktioner kan förekomma. Om patienten upplever svåra lokala biverkningar vid behandlingen bör symtomlindrande läkemedel (t.ex. antihistamin) beaktas.
Eosinofil esofagit
Fall av eosinofil esofagit har rapporterats i samband med behandling med Acarizax. Patienter med svåra eller ihållande gastroesofagala symtom, såsom dysfagi eller dyspepsi, bör avbryta behandling med Acarizax och söka vård.
Autoimmuna sjukdomar i remission
Det finns endast begränsade data på behandling med allergenspecifik immunterapi hos patienter med autoimmuna sjukdomar i remission. Acarizax bör därför förskrivas med försiktighet till dessa patienter.
Födoämnesallergi
Acarizax kan innehålla spår av fiskprotein. Tillgängliga data visar inte på en ökad risk för allergiska reaktioner hos patienter med fiskallergi.
Detta läkemedel innehåller mindre än 1 mmol (23 mg) natrium per dos, d.v.s. är näst intill "natriumfritt".
Interaktioner
Inga interaktionsstudier på människa har utförts och inga potentiella läkemedelsinteraktioner har identifierats från någon källa. Samtidig behandling med symtomlindrande antiallergiska läkemedel kan öka patientens toleranströskel vid immunterapi. Detta bör beaktas vid utsättning av sådana läkemedel.
Fertilitet, graviditet och amning
Graviditet
Klinisk erfarenhet från gravida kvinnor saknas. Djurexperimentella data talar inte för ökad risk för fosterskada. Behandling med Acarizax bör inte inledas under graviditet. Om patienten blir gravid under pågående behandling kan behandlingen fortsätta efter noggrann bedömning av patientens allmäntillstånd (inklusive lungfunktion) och reaktioner på tidigare intag av Acarizax. Patienter med samtidig astma bör kontrolleras noggrant under graviditeten.
Amning
Inga kliniska data finns tillgängliga för användning av Acarizax under amning. Inga effekter på det ammade barnet kan förväntas.
Fertilitet
Det finns inga kliniska data beträffande fertilitet vid användning av Acarizax. I en repetitiv dos- toxicitetsstudie på möss observerades inga effekter i reproduktionsorganen för båda könen.
Effekter på förmågan att framföra fordon och använda maskiner
Acarizax har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
Patienter som tar Acarizax bör i första hand förvänta sig att milda till måttliga lokala allergiska reaktioner kan inträffa inom de första dagarna för att sedan avta under fortsatt behandling (1-3 månader) (se avsnitt Varningar och försiktighet). För majoriteten av händelser förväntas reaktionen starta inom 5 minuter efter intag av Acarizax varje dag den förekommer och sedan avta efter några minuter till timmar. Mer allvarliga orofaryngala allergiska reaktioner kan förekomma (se avsnitt Varningar och försiktighet).
Isolerade fall av allvarlig akut försämring av astmasymtom har rapporterats. Patienter med kända riskfaktorer bör inte påbörja behandling med Acarizax (se avsnitt Kontraindikationer).
Tabellerad sammanställning av biverkningar
Följande biverkningstabell baseras på data från placebokontrollerade kliniska studier på Acarizax till vuxna och ungdomar (mer än 2100 patienter behandlade med Acarizax) med husdammskvalsterallergisk rinit och/eller husdammskvalsterallergisk astma och från spontanrapportering.
Biverkningarna är indelade enligt MedDRA-konventionen om frekvens i mycket vanliga (≥ 1/10), vanliga (≥ 1/100, < 1/10), mindre vanliga (≥ 1/1 000, < 1/100), sällsynta (≥ 1/10 000, < 1/1 000), mycket sällsynta (< 1/10 000).
| Organsystem | Frekvens | Biverkning |
| Infektioner och infestationer | Mycket vanliga | Nasofaryngit |
| Vanliga | Bronkit, faryngit, rinit, sinuit | |
| Mindre vanliga | Laryngit | |
| Immunsystemet | Mindre vanliga | Anafylaktisk reaktion |
| Centrala och perifera nervsystemet | Vanliga | Dysgeusi |
| Mindre vanliga | Yrsel, parestesi | |
| Ögon | Vanliga | Ögonklåda |
| Mindre vanliga | Allergisk konjunktivit | |
| Öron och balansorgan | Mycket vanliga | Öronklåda |
| Mindre vanliga | Obehag i öronen | |
| Hjärtat | Mindre vanliga | Palpitationer |
| Andningsvägar, bröstkorg och mediastinum | Mycket vanliga | Halsirritation |
| Vanliga | Astma, hosta*, dysfoni, dyspné, orofaryngal smärta, faryngalt ödem | |
| Mindre vanliga | Nästäppa, obehag i näsan, nasalt ödem, faryngalt erytem, rinorré, nysningar, trånghet i halsen, tonsillär hypertrofi | |
| Sällsynta | Laryngalt ödem, nasal obstruktion, trakealt ödem | |
| Magtarmkanalen | Mycket vanliga | Läppödem, ödem i munnen, oral klåda |
| Vanliga | Magsmärta, diarré, dysfagi, dyspepsi, gastroesofagal refluxsjukdom, glossodyni, glossit, läppklåda, sår i munnen, oral smärta, tungklåda, illamående, oralt obehag, erytem i munslemhinnan, oral parestesi, stomatit, tungödem, kräkningar | |
| Mindre vanliga | Muntorrhet, smärta i läpparna, sår på läpparna, esofagusirritation, blåsor i munslemhinnan, förstorade spottkörtlar, hypersalivation | |
| Sällsynta | Eosinofil esofagit | |
| Hud och subkutan vävnad | Vanliga | Klåda, urtikaria |
| Mindre vanliga | Erytem | |
| Sällsynta | Angioödem | |
| Allmänna symtom och/eller symtom vid administreringsstället | Vanliga | Obehag från bröstet, trötthet |
| Mindre vanliga | Sjukdomskänsla, känsla av främmande kropp |
Beskrivning av utvalda biverkningar
Om patienten upplever betydande biverkningar vid behandlingen bör symtomlindrande läkemedel beaktas.
Fall av allvarliga systemiska allergiska reaktioner, inklusive anafylaxi har rapporterats efter marknadsföring. Medicinsk övervakning vid första tabletten är därför en viktig säkerhetsåtgärd (se avsnitt Dosering och administreringssätt). Det har dock även förekommit fall av allvarlig systemisk allergisk reaktion vid doser som följer efter den initiala dosen.
I fall av akut försämring av astmasymtom eller svåra systemiska allergiska reaktioner, angioödem, sväljsvårigheter, andningssvårigheter, röstförändringar, hypotension eller trånghetskänsla i halsen ska läkare omedelbart kontaktas. Hypertensiv kris har rapporterats på grund av respiratorisk distress kort efter intag av Acarizax. I dessa fall ska behandlingen avbrytas permanent eller tills läkaren råder annorlunda.
* I kliniska studier observerades hosta med samma frekvens för Acarizax och placebo.
Pediatrisk population
Ungdomar 12-17 år
Rapporterade biverkningar hos ungdomar har varit liknande i frekvens, typ och svårighetsgrad som hos vuxna.
Barn 5-11 år
Den generella säkerhetsprofilen hos barn som behandlades med Acarizax liknade den som observerats hos vuxna och ungdomar. De flesta biverkningarna var milda till måttliga och förekom med en liknande frekvenskategori hos barn och vuxna/ungdomar. Den generella säkerhetsprofilen hos barn med astma liknade den hos barn utan astma. Säkerhetsprofilen för Acarizax hos barn baseras främst på data från dubbelblinda, placebokontrollerade, multinationella kliniska studier (cirka 900 barn behandlade med Acarizax) med aktiv efterfrågan av fördefinierade lokala biverkningar under de första 28 behandlingsdagarna.
Följande biverkningar observerades med en högre frekvens i barnstudierna jämfört med studierna för vuxna och ungdomar:
Magsmärta, diarré, dysgeusi, glossodyni, sår i munnen, illamående, faryngalt ödem och tungödem tillhörde frekvenskategorin mycket vanliga biverkningar (≥ 1/10). Samtliga av dessa var bland de fördefinierade efterfrågade biverkningarna.
Symtom på allergisk konjunktivit rapporterades i frekvenskategorin vanliga biverkningar (≥ 1/100 till < 1/10).
Angioödem och eosinofil esofagit rapporterades i frekvenskategorin mindre vanliga biverkningar (≥ 1/1 000 till < 1/100).
Barn under 5 år
Det finns inga data vid behandling med Acarizax hos barn under 5 år.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till:
webbplats: www.fimea.fi
Säkerhets‐ och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
I fas I studier har vuxna patienter med allergi orsakad av husdammskvalster exponerats för doser upp till 32 SQ-HDM. Det finns inga data hos barn (5-17 år) för exponering av doser över den rekommenderade dagliga dosen 12 SQ-HDM.
Om doser högre än den rekommenderade dagliga dosen intas, ökar risken för biverkningar, inklusive risken för systemiska allergiska reaktioner eller svåra lokala allergiska reaktioner. Vid svåra reaktioner såsom angioödem, sväljsvårigheter, andningssvårigheter, röstförändringar eller trånghetskänsla i halsen ska en omedelbar medicinsk bedömning göras. Dessa reaktioner bör behandlas med relevanta symtomlindrande läkemedel.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Allergenextrakt, husdammskvalster
ATC-kod: V01AA03
Verkningsmekanism
Acarizax är allergenspecifik immunterapi. Specifik immunterapi med allergenprodukter innebär upprepad administrering av allergener till allergiska individer med syfte att modifiera det immunologiska svaret på allergenet.
Immunsystemet är målorgan för den farmakologiska effekten av allergenspecifik immunterapi, men den kompletta och exakta verkningsmekanismen avseende den kliniska effekten är inte helt klarlagd. Behandling med Acarizax har visats framkalla en ökning av husdammskvalsterspecifikt IgG4 och inducerar ett systemiskt antikroppssvar som kan konkurrera med IgE i bindningen av husdammskvalsterallergen. Denna effekt ses redan efter 4 veckors behandling.
Acarizax påverkar orsaken till respiratorisk husdammskvalsterallergisk sjukdom, och den kliniska effekten under behandling har visats för både övre och nedre luftvägarna. Det underliggande skydd som erhålls av Acarizax leder till förbättring av sjukdomskontrollen och ökad livskvalitet visad genom minskade symtom, minskat behov av andra läkemedel och en minskad risk för exacerbation.
Klinisk effekt hos vuxna
Effekten av behandling med Acarizax 12 SQ-HDM vid respiratorisk husdammskvalsterallergisk sjukdom undersöktes i två dubbelblinda, randomiserade, placebokontrollerade studier med olika effektmått och olika patientpopulationer. Två tredjedelar av patienterna var sensibiliserade för fler allergen än just husdammskvalster. Sensibilisering för enbart husdammskvalster eller husdammskvalster och ett eller flera andra allergen påverkade inte resultatet i studierna. Stödjande belägg från en studie i allergenexponeringskammare och en studie med lägre doser presenteras också.
Allergisk rinit
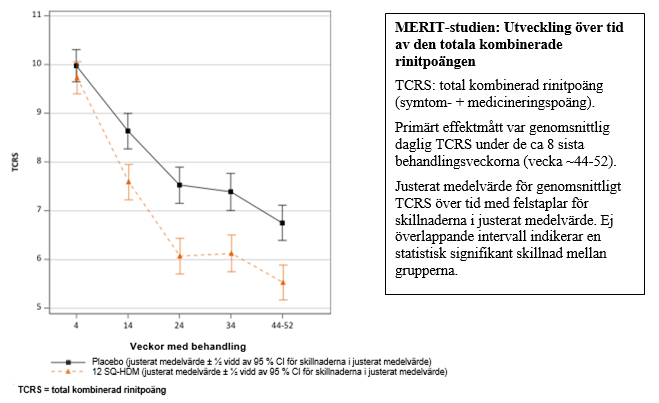
MERIT-studien (MT-06)
- MERIT-studien inkluderade 992 vuxna med måttlig till svår husdammskvalsterallergisk rinit trots användning av rinitläkemedel. Patienterna randomiserades till ca 1 års daglig behandling med 12 SQ-HDM, 6 SQ-HDM eller placebo och fick fri tillgång till standardiserad behandling med rinitläkemedel. Patienterna träffade en specialist ungefär varannan månad under hela studien.
-
Primärt effektmått var den genomsnittliga dagliga totala kombinerade rinitpoängen (TCRS) utvärderad under de 8 sista behandlingsveckorna.
- TCRS var summan av rinitsymtompoängen och rinitmedicineringspoängen.
Rinitsymtompoängen utvärderade 4 nässymtom (rinnande näsa, nästäppa, kliande näsa, nysningar) dagligen på en skala mellan 0-3 (inga, milda, måttliga, svåra symtom) dvs. poängintervall: 0-12. Rinitmedicineringspoängen var summan av poängen för intag av nasala steroider (2 poäng per puff, max 4 puffar/dag) och orala antihistaminer (4 poäng/tablett, max 1 tablett/dag) dvs. poängintervall: 0-12. Därmed är poängintervall för TCRS: 0-24.
- TCRS var summan av rinitsymtompoängen och rinitmedicineringspoängen.
- Ytterligare fördefinierade viktiga sekundära effektmått var den totala kombinerade rinokonjunktivitpoängen och rinokonjunktivitlivskvaliteten (RQLQ).
-
Post-hoc analys av dagarna med rinitexacerbation genomfördes också för att ytterligare illustrera den kliniska relevansen av resultaten.
- En rinitexacerbation definierades som en dag när patienten åter hade den höga grad av symtom som krävdes för att inkluderas i studien: en rinitsymtompoäng på minst 6 eller minst 5 med ett symtom klassat som svårt.
- En rinitexacerbation definierades som en dag när patienten åter hade den höga grad av symtom som krävdes för att inkluderas i studien: en rinitsymtompoäng på minst 6 eller minst 5 med ett symtom klassat som svårt.
| MERIT-resultat | 12 SQ-HDM | Placebo | Behandlingseffekt | ||||
| Primärt effektmått | N | Poäng | N | Poäng | Absolut skillnadc | Relativ skillnadd | p-värde |
| Total kombinerad rinitpoäng | |||||||
| FAS-MIa (justerat medelvärde) | 318 | 5,71 | 338 | 6,81 | 1,09 [0,35; 1,84] | - | 0,004 |
| FASb (justerat medelvärde) | 284 | 5,53 | 298 | 6,76 | 1,22 [0,49; 1,96] | 18 % | 0,001 |
| FASb (median) | 284 | 5,88 | 298 | 7,54 | 1,66 | 22 % | - |
| Fördefinierade viktiga sekundära effektmått | N | Poäng | N | Poäng | Absolut skillnadc | Relativ skillnadd | p-värde |
| Rinitsymtompoäng | |||||||
| FASb (justerat medelvärde) | 284 | 2,76 | 298 | 3,30 | 0,54 [0,18; 0,89] | 16 % | 0,003 |
| FASb (median) | 284 | 2,98 | 298 | 3,98 | 1,00 | 25 % | - |
| Rinitmedicineringspoäng | |||||||
| FASb (justerat medelvärde) | 284 | 2,22 | 298 | 2,83 | 0,60 [0,08; 1,13] | 21 % | 0,024 |
| FASb (median) | 284 | 2,83 | 298 | 4,00 | 1,17 | 29 % | - |
| Total kombinerad rinokonjunktivitpoäng | |||||||
| FASb (justerat medelvärde) | 241 | 7,91 | 257 | 9,12 | 1,21 [0,13; 2,28] | 13 % | 0,029 |
| FASb (median) | 241 | 8,38 | 257 | 10,05 | 1,67 | 17 % | - |
| Rinokonjunktivitlivskvalitet frågeformulär (RQLQ(S)) poäng | |||||||
| FASb (justerat medelvärde) | 229 | 1,38 | 240 | 1,58 | 0,19e [0,02; 0,37] | 12 % | 0,031 |
| FASb (median) | 229 | 1,25 | 240 | 1,46 | 0,21 | 14 % | - |
| Post-hoc effektmått | N | Proportion | N | Proportion | Odds ratiof[95 % CL] | p-värde | |
| Sannolikheten för en dag med rinitexacerbation | |||||||
| FAS (uppskattning)b | 284 | 5,33 % | 298 | 11,14 % | 0,45 [0,28; 0,72] | 0,001 | |
| Sannolikheten för en dag med rinitexacerbation trots användning av rinitläkemedel | |||||||
| FAS (uppskattning)b | 284 | 3,43 % | 298 | 6,50 % | 0,51 [0,32; 0,81] | 0,005 | |
N: antal patienter i behandlingsgruppen med data tillgänglig för analys. CL: konfidensgränser a FAS-MI: fullständigt analysset med multipla imputeringar. I analysen hanteras patienter som avbröt studien före effektbedömningsperioden som placebo patienter. För den primära analysen (FAS-MI) var endast den absoluta skillnaden i förväg specificerad. b FAS: fullständigt analysset. Alla tillgängliga data använda fullt ut, dvs. patienter som lämnade data under effektbedömningsperioden. c Absolut skillnad: placebo minus 12 SQ-HDM, 95 % konfidensgränser. d Relativ skillnad mot placebo: placebo minus 12 SQ-HDM dividerat med placebo. e Skillnaden mellan 12 SQ-HDM och placebo var primärt driven av skillnader på tre områden: sömnproblem, praktiska problem och nässymtom. f Odds ratio för att få en rinitexacerbation: 12 SQ-HDM jämfört med placebo. | |||||||
Stödjande belägg - allergisk rinit
En randomiserad, dubbelblind, placebokontrollerad fas II-studie i allergenexponeringskammare genomfördes hos 124 vuxna med husdammskvalsterallergisk rinit. Före varje allergenprovokation utsattes all allergimedicinering. Vid den sista allergenprovokationen efter 24 veckors behandling med 12 SQ-HDM, 6 SQ-HDM eller placebo, var medelvärdet för rinitsymtompoängen 7,45 [6,57; 8,33] i placebogruppen och 3,83 [2,94; 4,72] i 12 SQ-HDM gruppen, vilket motsvarar en absolut skillnad på 3,62 och en relativ skillnad på 49 % (95 % konfidensintervall [35 %, 60 %], p < 0,001). Skillnaden mellan 12 SQ-HDM och placebo var också statistiskt signifikant vid 16 veckor (medelvärden på 4,82 och 6,90, skillnad på 2,08 vilket motsvarar 30 %, 95 % CI [17 %, 42 %], p < 0,001) och vid 8 veckor (medelvärden på 5,34 och 6,71, skillnad på 1,37 vilket motsvarar 20 %, 95 % CI [7 %, 33 %], p = 0,007).
Allergisk astma
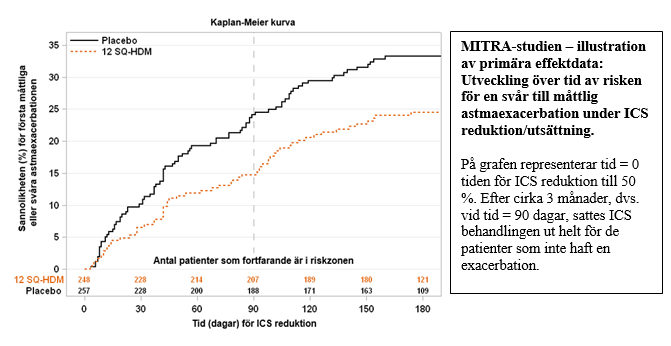
MITRA-studien (MT-04)
MITRA-studien inkluderade 834 vuxna med husdammskvalsterallergisk astma som inte var välkontrollerad med daglig dos inhalationssteroid (ICS) motsvarande 400-1200 µg budesonid. Alla patienter fick 7-12 månaders behandling med 12 SQ-HDM, 6 SQ-HDM eller placebo utöver ICS och kortverkande beta-agonist innan reducering av ICS. Ingen titreringsfas för att fastställa lägsta underhållsdos av ICS genomfördes innan randomisering. Effekten bedömdes efter tid till första måttliga eller allvarliga astmaexacerbationen under ICS reduktion de sista 6 månaderna av 13-18 månaders behandling.
-
Definitionen av en måttlig astmaexacerbation var uppfylld om patienten uppfyllde en eller flera av nedanstående 4 kriterier och det samtidigt medförde en ändrad behandling:
- Nattligt uppvaknande eller ökade symtom: nattliga uppvaknanden på grund av astma som kräver kortverkande β2 agonist (SABA) i två på varandra följande nätter eller en ökning på ≥ 0,75 från baslinjen i daglig symtompoäng i två på varandra följande dagar.
- Ökad SABA användning: ökning från baslinjen i tillfällen av SABA användning i två på varandra följande dagar (minsta ökning: 4 puffar/dag).
- Försämring av lungfunktion: ≥ 20 % minskning av PEF-värdet från baslinjen i minst två på varandra följande morgnar/kvällar eller ≥ 20 % minskning i FEV1 från baslinjen.
- Sjukvårdsbesök: besök på akutmottagning/prövningsställe för astmabehandling som inte krävde systemiska kortikosteroider.
-
En svår astmaexacerbation definierades som upplevelse av minst ett av följande:
- Behov av systemiska kortikosteroider i ≥ 3 dagar
- Besök på akutmottagning som krävde systemiska kortikosteroider eller sjukhusvistelse ≥ 12 h.
| MITRA-resultat | 12 SQ-HDM | Placebo | Effekt 12 SQ-HDM mot placebo | p-värde | |||
| N | n (%) | N | n (%) | Riskkvot [95 % CL] | Risk-reduktiona | ||
| Primärt effektmått | |||||||
| Exacerbation, måttlig till svår (FAS-MI) b | 282 | 59 (21 %) | 277 | 83 (30 %) | 0,69 [0,50;0,96] | 31 % | 0,027 |
Exacerbation, måttlig till svår (FAS) c | 248 | 59 (24 %) | 257 | 83 (32 %) | 0,66 [0,47;0,93] | 34 % | 0,017 |
| Predefinierade analyser av komponenter av primärt effektmått | |||||||
| Nattligt uppvaknande eller ökade symtom c | 248 | 39 (16 %) | 257 | 57 (22 %) | 0,64 [0,42;0,96] | 36 % | 0,031 |
| Ökad SABA användning c | 248 | 18 (7 %) | 257 | 32 (12 %) | 0,52 [0,29;0,94] | 48 % | 0,029 |
| Försämring av lungfunktion c | 248 | 30 (12 %) | 257 | 45 (18 %) | 0,58 [0,36;0,93] | 42 % | 0,022 |
| Svår exacerbation c | 248 | 10 (4 %) | 257 | 18 (7 %) | 0,49 [0,23;1,08] | 51 % | 0,076 |
N: antal patienter i behandlingsgruppen med data tillgänglig för analys. n (%): antal och procent av patienterna i behandlingsgruppen som mötte kriterierna. CL: konfidensgränser a Skattat av riskkvot b FAS-MI: fullständigt analysset med multipla imputeringar. I analysen hanteras patienter som avbröt studien före effektbedömningsperioden som placebo patienter. c FAS: fullständigt analysset. Alla tillgängliga data använda fullt ut, dvs. patienter som lämnade data under effektbedömningsperioden. | |||||||
Post-hoc analyser av astmasymtom och symtomatisk läkemedelsanvändning under de 4 sista behandlingsveckorna innan reduktion av inhalationssteroider genomfördes också för att undersöka effekten av Acarizax som tillägg till inhalationssteroider. Analysen tittade på poängen för dagliga och nattliga astmasymtom, nattliga uppvaknanden och SABA intag. Post-hoc analysen visade konsekventa numeriska skillnader till fördel för 12 SQ-HDM jämfört med placebo för alla undersökta parametrar under de sista 4 veckorna innan reduktion av inhalationssteroider. Skillnaderna var bara statistiskt signifikanta för poängen för dagliga astmasymtom (p = 0,0450) och oddsen för inga nattliga uppvaknanden (p = 0,0409).
Stödjande belägg - allergisk astma
I en randomiserad, dubbelblind, placebokontrollerad fas II-studie, randomiserades 604 patienter ≥ 14 år med husdammskvalsterallergisk astma kontrollerad av inhalationsteroider (100-800 µg budesonid) och en klinisk historia av husdammskvalsterallergisk rinit till cirka 1 års behandling med 1, 3 eller 6 SQ-HDM eller placebo. Vid den 4 veckor långa effektutvärderingsperioden i slutet på studien, var medelförändringen från baslinjen i daglig ICS dos 207,6 µg budesonid i 6 SQ-HDM gruppen och 126,3 µg i placebogruppen vilket motsvarar en absolut skillnad på 81 µg budesonid per dag (95 % konfidensintervall [27;136], p = 0,004. Relativt medelvärde och median ICS reduktion från baslinjen var 42 % och 50 % för 6 SQ-HDM och 15 % och 25 % för placebo. I en post-hoc analys av en subgrupp (N = 108) av individer med sämre astmakontroll och ICS ≥ 400 µg budesonid, var medelförändringen från baslinjen i daglig ICS dos 384,4 µg budesonid i 6 SQ-HDM gruppen och 57,8 µg i placebogruppen vilken motsvarar en absolut skillnad mellan 6 SQ-HDM och placebo på 327 µg budesonid per dag (95 % CI [182;471], p < 0,0001, post-hoc analys).
Pediatrisk population
Klinisk effekt hos barn
Effekten av behandling med Acarizax 12 SQ-HDM vid respiratorisk husdammskvalsterallergisk sjukdom hos barn undersöktes i två dubbelblinda, randomiserade, placebokontrollerade studier. Det primära målet med studierna var att undersöka effekt vid allergisk rinit i MT-12-studien och att undersöka effekt vid allergisk astma i MT-11-studien.
Allergisk rinit
Barn 5-11 år
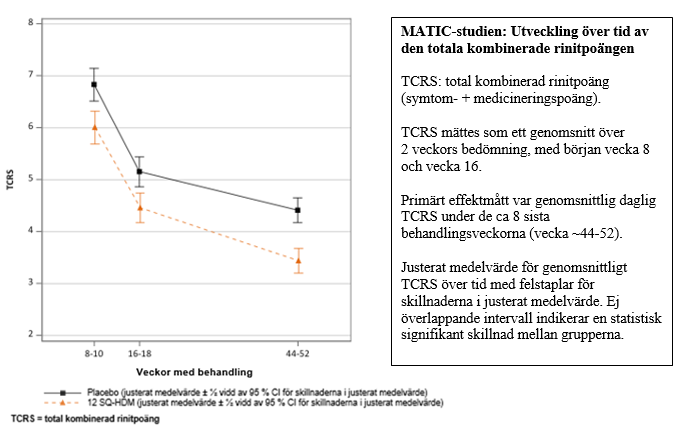
MATIC-studien (MT-12)
Effekten av behandling med Acarizax 12 SQ-HDM vid husdammskvalsterallergisk rinit hos barn 5-11 år undersöktes i en dubbelblind, randomiserad, placebokontrollerad studie (MATIC-studien (MT-12)).
- MATIC-studien (MT-12) inkluderade 1 458 barn (5-11 år) med måttlig till svår husdammskvalsterallergisk rinit/rinokonjunktivit (medelvärde för total kombinerad rinitpoäng (TCRS) vid baslinjen var 18,3). Cirka 40 % av studiepopulationen rapporterade samtidig astma vid baslinjen. Patienterna randomiserades till cirka 1 års daglig behandling med 12 SQ-HDM eller placebo och hade fri tillgång till standardiserad behandling med rinit- och konjunktivitläkemedel.
-
Primärt effektmått var den genomsnittliga dagliga totala kombinerade rinitpoängen (TCRS) utvärderad under de 8 sista behandlingsveckorna.
- Daglig TCRS är summan av dagliga rinitsymtompoäng (DSS) och dagliga rinitmedicineringspoäng (DMS). Rinitsymtompoängen utvärderade 4 nässymtom (rinnande näsa, nästäppa, nysningar, kliande näsa) dagligen på en skala mellan 0-3 (inga, milda, måttliga, svåra symtom) dvs. poängintervall: 0-12. Rinitmedicineringspoängen var summan av poängen för intag av nasala steroider (max 8 poäng/dag) och orala antihistaminer (max 4 poäng/dag), dvs. poängintervall: 0-12. Därmed är poängintervall för TCRS: 0-24.
- Efter 1 års behandling med 12 SQ-HDM var den absoluta skillnaden i justerat medelvärde 0,97 (95 % konfidensintervall [0,50; 1,44]) och den relativa skillnaden 22 % (p < 0,0001) jämfört med placebo. Behandlingseffekten kan variera mellan patienter beroende på status på deras allergiska sjukdom.
- Klinisk effekt observerades efter 8 veckors behandling (p = 0,01).
| MATIC-resultat | 12 SQ-HDM | Placebo | Behandlingseffekt | ||||
|---|---|---|---|---|---|---|---|
| Primärt effektmått | N | Poäng | N | Poäng | Absolut skillnadb | Relativ skillnadc | p-värde |
| Total kombinerad rinitpoäng | |||||||
| FASa (justerat medelvärde) | 693 | 3,44 | 706 | 4,41 | 0,97 [0,50; 1,44] | 22,0 % | < 0,0001 |
| Känslighetsuppskattning 1e | 727f | 3,45 | 731f | 4,42 | 0,97 [0,49; 1,44] | 21,9 % | < 0,0001 |
| Fördefinierade viktiga sekundära effektmått | N | Poäng | N | Poäng | Absolut skillnadb | Relativ skillnadc | p-värde |
| Rinitsymtompoäng | |||||||
| FAS (justerat medelvärde) | 693 | 1,50 | 706 | 1,92 | 0,43 [0,23; 0,62] | 22,2 % | < 0,0001 |
| Rinitmedicineringspoäng | |||||||
| FAS (justerat medelvärde) | 693 | 1,44 | 706 | 1,94 | 0,49 [0,18; 0,80] | 25,3 % | 0,0016 |
| Total kombinerad rinokonjunktivitpoäng | |||||||
| FAS (justerat medelvärde) | 693 | 4,01 | 706 | 5,16 | 1,15 [0,58; 1,71] | 22,2 % | < 0,0001 |
| Fördefinierade sekundära effektmått | N | Poäng | N | Poäng | Absolut skillnadb | Relativ skillnadc | p-värde |
| Pediatriskt rinokonjunktivitlivskvalitet frågeformulär (PRQLQ) | |||||||
| FAS (justerat medelvärde) | 695 | 0,84 | 690 | 1,01 | 0,17 [0,08; 0,25] | 16,6 % | < 0,0001 |
| Fördefinierade sekundära effektmått | N | Proportion | N | Proportion | Odds ratiod [95 % CL] | p-värde | |
| Dagar med rinitexacerbation | |||||||
| FAS (uppskattning) | 693 | 0,025 | 706 | 0,044 | 0,56 [0,42; 0,74] | < 0,0001 | |
| Dagar med mild rinit | |||||||
| FAS (uppskattning) | 693 | 0,318 | 706 | 0,209 | 1,77 [1,27; 2,47] | 0,0008 | |
| Fördefinierade explorativa effektmått | N | Proportion | N | Proportion | Odds ratiod [95 % CL] | p-värde | |
| Rinitsymtomfria dagar | |||||||
| FAS (uppskattning) | 693 | 0,200 | 706 | 0,116 | 1,90 [1,37; 2,66] | 0,0002 | |
N: antal patienter med observationer som bidrar till analysen. CL: konfidensgränser
a FAS: fullständigt analysset. Alla tillgängliga data används fullt ut, dvs. patienter som lämnade data under effektbedömningsperioden.
b Absolut skillnad: placebo minus 12 SQ-HDM, 95 % konfidensintervall.
c Relativ skillnad mot placebo: placebo minus 12 SQ-HDM dividerat med placebo.
d Odds ratio för att få en rinitexacerbation, dagar med mild rinit och rinitsymtomfria dagar: 12 SQ-HDM jämfört med placebo. Dagar med rinitexacerbation (dagar med rinit-DSS på 6 eller 5 med ett enskilt symtom som får poängen 3 (symtom som är svårt att tolerera; påverkar aktiviteter i det dagliga livet och/eller sömnen)).
e Studieläkemedel-estimand: För patienter som avbröt behandling på grund av bristande effekt eller behandlingsrelaterade biverkningar, imputerades saknade effektmått från placebogruppen. För behandlingsavbrott på grund av andra skäl, imputerades saknade effektmått från den egna behandlingsgruppen.
f För känslighetsuppskattning 1, N inkluderar patienter med imputerade observationer.
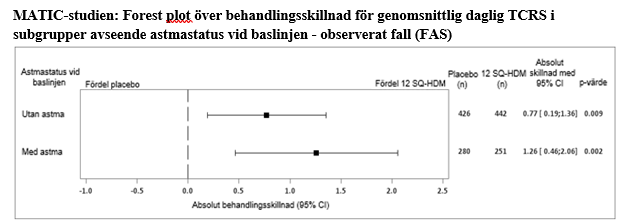
Subgruppsanalys av det primära effektmåttet (TCRS) enligt astmastatus vid baslinjen visade en absolut skillnad i justerat medelvärde på 1,26 (95 % konfidensintervall [0,46; 2,06]) hos barn med samtidig astma och 0,77 (95 % konfidensintervall [0,19; 1,36]) hos barn utan samtidig astma. En poolad analys av TCRS för 5 fas III-studier hos patienter med husdammskvalsterallergisk rinit som behandlats med 12 SQ-HDM eller placebo visade en absolut skillnad i justerat medelvärde på 1,27 (95 % konfidensintervall [0,82; 1,72]) hos patienter med samtidig astma (N = 1 450) och 0,81 (95 % konfidensintervall [0,49; 1,13]) hos patienter utan samtidig astma (N = 2 595).
CI = konfidensintervall, FAS = fullständigt analysset, n = antal patienter med observationer som bidrar till analysen, TCRS = total kombinerad rinitpoäng
Fördefinierade analyser av astmarelaterade effektmått utvärderade dagliga astmasymtompoäng, SABA-användning, SABA-fria dagar och nattliga uppvaknanden som krävde SABA-användning. Resultaten visade konsekventa numeriska skillnader till fördel för 12 SQ-HDM jämfört med placebo för alla 4 parametrar. Skillnaderna var statistiskt signifikanta för dagliga astmasymtompoäng (p = 0,0259) och nattliga uppvaknanden som krävde SABA-användning (p = 0,0279).
Barn 5-17 år
MAPIT-studien (MT-11)
Det primära målet var att visa effekt av Acarizax 12 SQ-HDM jämfört med placebo hos barn och ungdomar (5-17 år) med husdammskvalsterallergisk astma baserat på kliniskt relevanta astmaexacerbationer efter minst 4 månaders behandling. Acarizax 12 SQ-HDM gavs som tilläggsbehandling till grundbehandling av astma (låg dos ICS plus långverkande β2-agonister (LABA) eller hög/medel dos ICS med eller utan LABA). Studiepopulationen hade också en klinisk historia av husdammskvalsterallergisk rinit av någon svårighetsgrad (total kombinerad rinitpoäng (TCRS) > 0 vid baslinjen; medelvärde för TCRS vid baslinjen var 9,0). MT-11 var inte utformad för att bedöma klinisk effekt vid allergisk rinit. Resultaten av riniteffektmåtten TCRS, rinit-DSS och rinit-DMS presenteras i tabellen nedan.
| MAPIT resultat | 12 SQ‑HDM | Placebo | Behandlingseffekt | ||||
|---|---|---|---|---|---|---|---|
| Fördefinierade ytterligare sekundära effektmåtta | N | Poäng | N | Poäng | Absolut skillnadb | Relativ skillnadc | p-värded |
| Total kombinerad rinitpoäng | |||||||
| FASe (justerat medelvärde) | 253 | 2,16 | 259 | 2,46 | 0,30 [-0,22; 0,81] | 12,1 % | 0,2597 |
| Rinitsymtompoäng | |||||||
| FAS (justerat medelvärde) | 253 | 0,55 | 259 | 0,67 | 0,12 [-0,04; 0,28] | 18,2 % | 0,1349 |
| Rinitmedicineringspoäng | |||||||
| FAS (justerat medelvärde) | 253 | 1,27 | 259 | 1,40 | 0,12 [-0,24; 0,48] | 8,8 % | 0,5071 |
FAS: fullständigt analysset. N: antal patienter med observationer som bidrar till analysen.
a Riniteffektmått
b Absolut skillnad: placebo minus 12 SQ-HDM, 95 % konfidensintervall.
c Relativ skillnad mot placebo: placebo minus 12 SQ-HDM dividerat med placebo.
d p-värdena justerades inte för multiplicitet. Därför är analyserna att betrakta som explorativa.
eAlla tillgängliga data används fullt ut, dvs. patienter som lämnade data under effektbedömningsperioden.
Ungdomar 12-17 år
Effekten av behandling med Acarizax 12 SQ-HDM vid husdammskvalsterallergisk rinit hos ungdomar undersöktes i två dubbelblinda, randomiserade, placebokontrollerade studier (P001 och TO-203-3-2). I dessa studier var en andel av patienterna ungdomar.
-
P001-studien inkluderade 189 ungdomar (av totalt 1482 randomiserade patienter) med måttlig till svår husdammskvalsterallergisk rinit/rinokonjunktivit med eller utan astma. Patienter randomiserades till ca 1 års daglig behandling med 12 SQ-HDM eller placebo och hade fri tillgång till standardiserad behandling med rinitläkemedel.
Primärt effektmått var den genomsnittliga dagliga totala kombinerade rinitpoängen (TCRS) utvärderad under de 8 sista behandlingsveckorna.
Efter 1 års behandling med 12 SQ-HDM var den absoluta skillnaden i medianvärde 1,0 (95 % konfidensintervall [0,1; 2,0]) och den relativa skillnaden 22 % (p = 0,024) jämfört med placebo i ungdomsgruppen.
-
TO-203-3-2 studien inkluderade 278 ungdomar (av totalt 851 randomiserade patienter) med måttlig till svår husdammskvalsterallergisk rinit. Patienterna randomiserades till ca 1 års daglig behandling med 12 SQ-HDM, 6 SQ-HDM, eller placebo och hade fri tillgång till standardiserad behandling med rinitläkemedel.
Primärt effektmål var den genomsnittliga dagliga TCRS utvärderad under de sista 8 behandlingsveckorna.
Vid slutet av studien, efter 1 års behandling med 12 SQ-HDM, var den absoluta skillnaden i medelvärde 1,0 (95 % konfidensintervall [0,1; 1,9], p = 0,037) och den relativa skillnaden 20 % jämfört med placebo i ungdomsgruppen.
| Ungdomssubgrupper | 12 SQ-HDM | Placebo | Behandlingseffekt | ||||
| Primärt effektmått: TCRS | N | Poäng | N | Poäng | Absolut skillnad | Relativ skillnad d | p-värde |
| P001 | |||||||
| FAS (justerat medelvärde) | 76 | 3,6 | 84 | 4,8 | 1,2 a [0,1;2,3] | 25 % | < 0,05 |
| FAS (median) | 76 | 3,3 | 84 | 4,3 | 1,0 b [0,1;2,0] | 22 % | 0,024 |
| TO-203-3-2 | |||||||
| FAS (justerat medelvärde) | 99 | 4,1 | 92 | 5,1 | 1,0 c [0,1;1,9] | 20 % | 0,037 |
| FAS (median) | 99 | 4,2 | 92 | 5,2 | 1,0 | 19 % | - |
TCRS: total kombinerad rinitpoäng a: ANCOVA b: Hodges-Lehmann-estimat med 95 % konfidensintervall (primär analys i P001-studien) c: Modell med linjära blandade effekter (primär analys i TO-203-3-2-studien) d: Relativ skillnad jämfört med placebo: placebo minus 12 SQ-HDM dividerat med placebo | |||||||
Allergisk astma
Barn 5-17 år
MAPIT-studien (MT-11) inkluderade 533 barn och ungdomar (5-17 år) med husdammskvalsterallergisk astma. Patienterna hade en historik av nyligen inträffade astmaexacerbationer under behandling med astmaläkemedel (låg dos ICS plus LABA eller medel/hög dos ICS med eller utan LABA). Patienterna randomiserades till cirka 24-30 månaders daglig behandling med 12 SQ-HDM eller placebo som tillägg till deras behandling med astmaläkemedel. Primärt effektmått var årlig frekvens av kliniskt relevanta astmaexacerbationer beräknat som antal exacerbationer per år och patient under effektutvärderingsperioden.
Justerat frekvensratio (12 SQ-HDM dividerat med placebo) var till fördel för 12 SQ-HDM men det var ingen statistiskt signifikant skillnad i behandlingseffekt mellan behandlingsgrupperna (frekvensratio = 0,89, 95 % CI [0,60; 1,31], p = 0,54).
För patienter som deltog i MAPIT-studien (MT-11) var astmaexacerbationsfrekvensen generellt låg i båda behandlingsgrupperna under studien och minskade med cirka 67 % under covid-19-pandemin jämfört med nivån före covid-19-pandemin, vilket kan ha haft en inverkan på att det inte var möjligt att upptäcka en statistiskt signifikant skillnad (se avsnitt Dosering och administreringssätt för information om pediatrisk användning).
Europeiska läkemedelsmyndigheten har beviljat undantag från kravet att skicka in studieresultat för Acarizax hos barn under 5 år för respiratorisk husdammskvalsterallergi (behandling av allergisk rinit, behandling av astma) (information om pediatrisk användning finns i avsnitt Dosering och administreringssätt).
Äldre population
Acarizax är inte indicerat till patienter > 65 år (se avsnitt Dosering och administreringssätt). Det finns begränsade säkerhets- och tolerabilitetsdata för äldre patienter > 65 år.
Långtidsbehandling
Internationella behandlingsriktlinjer hänvisar till en behandlingstid på 3 år för allergenspecifik immunoterapi för att uppnå sjukdomsmodifierande effekt. Effektdata finns tillgängliga för 18 månaders behandling med Acarizax från MITRA-studien. Långtidseffekt har inte studerats.
Farmakokinetiska egenskaper
Inga kliniska försök har utförts avseende den farmakokinetiska profilen och metabolismen av Acarizax. Effekten av allergenspecifik immunterapi förmedlas genom immunologiska mekanismer, och det finns begränsad information om de farmakokinetiska egenskaperna.
De aktiva molekylerna i ett allergenextrakt består främst av proteiner. För sublingualt administrerade produkter för specifik immunterapi, har studier visat att det inte sker någon passiv absorption av allergenet genom munslemhinnan. Evidens pekar mot att allergener tas upp genom munslemhinnan via dendritiska celler, särskilt langerhanska celler. Allergen som inte absorberas på detta sätt förväntas hydrolyseras till aminosyror och små polypeptider i mag-tarmkanalens lumen. Inga evidens tyder på att allergener i Acarizax absorberas till kärlsystemet i någon större utsträckning efter sublingual administrering.
Prekliniska säkerhetsuppgifter
Gängse studier avseende allmäntoxicitet och reproduktionseffekter i mus visade inte några särskilda risker för människa.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Gelatin (från fisk)
Mannitol
Natriumhydroxid (för pH justering)
Inkompatibiliteter
Ej relevant
Hållbarhet
4 år
Särskilda förvaringsanvisningar
Inga särskilda förvaringsanvisningar.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
ACARIZAX kylmäkuivattu tabletti kielen alle
12 SQ-HDM (L:ei) 30 fol (111,76 €), 90 fol (317,94 €)
PF-selosteen tieto
Aluminium/aluminiumblister i ytterkartong. Varje blisterförpackning innehåller 10 frystorkade sublinguala tabletter.
Förpackningsstorlekar: 10, 30 och 90
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Läkemedlets utseende:
Vit till benvit rund präglad frystorkad sublingual tablett
Särskilda anvisningar för destruktion och övrig hantering
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Ersättning
ACARIZAX kylmäkuivattu tabletti kielen alle
12 SQ-HDM 30 fol
- Peruskorvaus (40 %).
ACARIZAX kylmäkuivattu tabletti kielen alle
12 SQ-HDM 90 fol
- Ei korvausta.
Atc-kod
V01AA03
Datum för översyn av produktresumén
16.12.2024
Yhteystiedot
Linnoitustie 4
02600 Espoo
09 5842 2120
www.alk.fi
infofi@alk.net
