RIGEVIDONCONT tabletti, päällystetty 150/30 mikrog
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Potilas
Kysymyksiä ja vastauksia yhdistelmäehkäisyvalmisteita: Viimeisintä tietoa naisille
Terveydenhuollon ammattilainen
Tarkistuslista yhdistelmäehkäisyvalmisteiden määrääjille
Yhdistelmäehkäisyvalmisteet: Materiaalia naisen yksilöllisten veritulppariskitekijöiden arviointiin, keskustelun tueksi ja sopivimman valmisteen valitsemiseksi
Vaikuttavat aineet ja niiden määrät
21 valkoista päällystettyä tablettia
7 vihreää päällystettyä (vaikuttavaa ainetta sisältämätöntä) lumetablettia
Valkoiset tabletit:
150 mikrogrammaa levonorgestreelia ja 30 mikrogrammaa etinyyliestradiolia.
Apuaineet, joiden vaikutus tunnetaan:
Yksi tabletti sisältää 31,35 mg laktoosia (laktoosimonohydraattina) ja 22,46 mg sakkaroosia.
Vihreät tabletit:
Tabletti ei sisällä vaikuttavia aineita.
Apuaineet, joiden vaikutus tunnetaan:
Yksi tabletti sisältää 37,26 mg vedetöntä laktoosia, 30,58 mg sakkaroosia ja 0,000134 mg paraoranssi alumiinilakkaa (E110).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Päällystetyt tabletit
Kliiniset tiedot
Käyttöaiheet
Raskauden ehkäisy.
Rigevidoncont-valmisteen määräämistä koskevassa päätöksessä on otettava huomioon valmisteen käyttäjän nykyiset riskitekijät, erityisesti laskimotromboembolian (VTE) riskitekijät, ja millainen Rigevidoncont -käytön VTE:n riski on verrattuna muiden yhdistelmäehkäisyvalmisteiden riskeihin (ks. kohdat Vasta-aiheet ja Varoitukset ja käyttöön liittyvät varotoimet).
Annostus ja antotapa
Annostus
Miten Rigevidoncont-valmistetta käytetään
Vaikuttavaa ainetta sisältävät tabletit (valkoiset tabletit) pitää ottaa suun kautta joka päivä suunnilleen samaan aikaan, tarvittaessa pienen nestemäärän kera, läpipainopakkaukseen merkityssä järjestyksessä.
Viimeisen valkoisen tabletin ottamista seuraavana päivänä hoitoa jatketaan seitsemällä vihreällä tabletilla (lumetabletilla) saman läpipainopakkauksen erilliseltä riviltä. Tabletteja otetaan jatkuvasti. Tabletteja otetaan yksi päivässä 28 peräkkäisen päivän ajan.
Uusi pakkaus pitää aloittaa heti edellisen pakkauksen viimeisen tabletin ottamista seuraavana päivänä. Tyhjennysvuoto alkaa yleensä 2–3 päivän kuluttua viimeisen vaikuttavaa ainetta sisältävän tabletin ottamisesta eikä välttämättä ole päättynyt ennen seuraavan pakkauksen aloittamista.
Rigevidoncont-valmisteen käytön aloittaminen
Ei aiempaa hormonaalista ehkäisyä edellisenä kuukautena
Tablettien ottaminen aloitetaan luonnollisen kuukautiskierron ensimmäisenä päivänä (eli ensimmäisenä vuotopäivänä).
Vaihto toisesta yhdistelmäehkäisyvalmisteesta (yhdistelmäehkäisytabletista, emätinrenkaasta tai ehkäisylaastarista)
Rigevidoncont 150 mikrog/30 mikrog -tablettien käyttö aloitetaan mieluiten aiemman yhdistelmäehkäisyvalmisteen viimeisen vaikuttavia aineita sisältävän tabletin ottamista seuraavana päivänä, mutta viimeistään aiemman yhdistelmävalmisteen tablettitauon tai lumetablettijakson jälkeisenä päivänä.
Jos käytössä on ollut ehkäisyrengas tai ehkäisylaastari, voidaan Rigevidoncont 150 mikrog/30 mikrog -tablettien käyttö aloittaa samana päivänä kun valmiste poistetaan, mutta viimeistään silloin, kun uusi ehkäisyrengas tai ehkäisylaastari olisi pitänyt laittaa.
Vaihto pelkkää progestiinia sisältävästä ehkäisyvalmisteesta (minipilleristä, ehkäisyruiskeesta, ehkäisykapselista tai progestiinia vapauttavasta kohdunsisäisestä ehkäisimestä [hormonikierukasta])
Minipilleristä voidaan vaihtaa milloin tahansa kuukautiskierron aikana. Rigevidoncont -tablettien käyttö on aloitettava minipillerin käytön lopettamista seuraavana päivänä. Ehkäisykapselista tai kohdunsisäisestä ehkäisimestä voidaan vaihtaa sen poistopäivänä, ehkäisyruiskeesta seuraavana suunniteltuna injektiopäivänä. Kaikissa näissä tapauksissa on käytettävä lisäehkäisyä 7 ensimmäisen tablettipäivän ajan.
Ensimmäisellä raskauskolmanneksella tapahtuneen raskauden keskeytymisen jälkeen
Tablettien käyttö voidaan aloittaa heti. Muita ehkäisymenetelmiä ei tällöin tarvita.
Synnytyksen tai toisella raskauskolmanneksella tapahtuneen raskauden keskeytymisen jälkeen
Jos nainen ei imetä, tablettien käyttö aloitetaan 21–28 vuorokautta synnytyksen tai toisella raskauskolmanneksella tapahtuneen raskauden keskeytymisen jälkeen, sillä lapsivuodeaikana tromboembolian riski on suurentunut. Jos tablettien käyttö aloitetaan myöhemmin, tulee 7 ensimmäisen tablettipäivän aikana käyttää lisäksi jotain estemenetelmää. Jos nainen on ollut jo yhdynnässä, raskaus on suljettava pois ennen tablettien käytön aloittamista tai hänen on odotettava seuraavien kuukautisten alkamista.
Imetys
Ks. kohta Raskaus ja imetys.
Tablettien unohtaminen
Valmisteen ehkäisyteho voi olla heikentynyt, jos tabletti on unohdettu ottaa ja etenkin silloin, jos tabletin unohtamisesta on kulunut yli 12 tuntia.
Jos nainen on unohtanut ottaa lumetabletteja, valmisteen ehkäisyteho ei ole heikentynyt.
Jos vaikuttavaa ainetta sisältävän tabletin unohtamisesta on kulunut alle 12 tuntia, valmisteen ehkäisyteho ei ole heikentynyt. Tabletti otetaan heti muistettaessa, ja loput tabletit otetaan tavanomaiseen aikaan.
Jos tabletin unohtamisesta on kulunut yli 12 tuntia, valmisteen ehkäisyteho voi olla heikentynyt. Seuraavat kaksi perussääntöä pätevät tapauksissa, joissa vaikuttavaa ainetta sisältävien tablettien ottaminen on unohtunut:
- Tablettien ottamista ei tule koskaan keskeyttää yli 7 päiväksi.
- Hypotalamus-aivolisäke-munasarja-akselin riittävä suppressio edellyttää tablettien ottamista yhtäjaksoisesti 7 päivän ajan.
Yllä olevan perusteella voidaan antaa seuraavat käytännön ohjeet:
Viikko 1:
Viimeinen unohtunut tabletti otetaan heti muistettaessa, vaikka tällöin olisikin otettava kaksi tablettia samalla kertaa. Seuraavat tabletit otetaan tavanomaiseen aikaan. Seuraavan 7 päivän ajan tulee lisäksi käyttää jotain estemenetelmää, kuten kondomia. Jos nainen on ollut yhdynnässä tabletin unohtamista edeltävien 7 päivän aikana, raskauden mahdollisuus on otettava huomioon. Raskauden mahdollisuus on sitä suurempi, mitä useampi tabletti on unohtunut ja mitä lähempänä säännöllistä lumetablettijaksoa unohtuneet tabletit ovat.
Viikko 2:
Viimeinen unohtunut tabletti otetaan heti muistettaessa, vaikka tällöin olisikin otettava kaksi tablettia samalla kertaa. Seuraavat tabletit otetaan tavanomaiseen aikaan. Jos tabletteja on otettu ohjeen mukaan 7 päivän ajan ennen unohtunutta tablettia, lisäehkäisyä ei tarvita. Jos tabletteja ei ole kuitenkaan otettu ohjeiden mukaan tai käyttäjä on unohtanut useamman kuin yhden tabletin, häntä on neuvottava käyttämään lisäksi jotain estemenetelmää (esim. kondomia) seuraavan 7 päivän ajan.
Viikko 3:
Ehkäisyn luotettavuus on voinut heikentyä, koska lumetablettijakso on lähellä. Ehkäisytehon heikkeneminen voidaan kuitenkin estää mukauttamalla tablettien käyttöä. Siten noudattamalla yhtä ohjetta seuraavasta kahdesta vaihtoehdosta, lisäehkäisyä ei tarvita, jos tabletteja on otettu ohjeen mukaan 7 päivän ajan ennen unohtunutta tablettia. Jos tabletteja ei ole otettu ohjeiden mukaan, toimitaan ensimmäisen ohjeen mukaan. Lisäksi jotain estemenetelmää (kuten kondomia) on käytettävä seuraavien 7 päivän ajan.
- Viimeinen unohtunut tabletti otetaan heti muistettaessa, vaikka tällöin olisikin otettava kaksi tablettia samalla kertaa. Seuraavat tabletit otetaan tavanomaiseen aikaan. Seuraava läpipainopakkaus aloitetaan heti, kun käytössä olevan läpipainopakkauksen vaikuttavaa ainetta sisältävät tabletit loppuvat, niin että aktiivista ainetta sisältävien tablettien ottamisen väliin ei jää lumetablettijaksoa. Tyhjennysvuoto jää todennäköisesti tulematta ennen uuden pakkauksen loppumista, mutta tablettien käytön aikana voi esiintyä tiputtelu- tai läpäisyvuotoa.
- Tablettien ottaminen käytössä olleesta läpipainopakkauksesta voidaan myös lopettaa. Tällöin tulee pitää 7 päivän lumetablettijakso, mukaan lukien ne päivät, jolloin tabletit on unohdettu ottaa, ja sen jälkeen aloitetaan tablettien ottaminen uudesta läpipainopakkauksesta.
Jos nainen on unohtanut ottaa tabletteja eikä tyhjennysvuotoa tule ensimmäisen normaalin lumetablettijakson aikana, raskauden mahdollisuus on otettava huomioon.
Ohjeet ruoansulatuskanavan häiriöiden yhteydessä
Vaikeiden ruoansulatuskanavan oireiden (esim. oksentelun tai ripulin) yhteydessä vaikuttavien aineiden imeytyminen saattaa olla epätäydellistä, ja tällöin on käytettävä lisäehkäisyä.
Jos oksentelua tai vaikeaa ripulia esiintyy 3–4 tunnin sisällä tabletin ottamisesta uusi korvaava tabletti pitää ottaa mahdollisimman pian. Jos mahdollista, uusi tabletti otetaan 12 tunnin sisällä tavanomaisesta tabletin ottamisajasta. Jos tabletin ottamisajasta on kulunut yli 12 tuntia, sovelletaan tablettien unohtamista koskevia ohjeita (ks. kohta Annostus ja antotapa). Ripuli voi heikentää tehoa estämällä täydellisen imeytymisen. Jos nainen ei halua muuttaa tablettien normaalia käyttöaikatauluaan, hänen on otettava tarvittavat ylimääräiset tabletit toisesta pakkauksesta.
Tyhjennysvuodon siirtäminen tai alkamispäivän muuttaminen
Tyhjennysvuodon siirtämiseksi seuraava Rigevidoncont 150 mikrog/30 mikrog -läpipainopakkaus aloitetaan heti, kun käytössä olevan pakkauksen vaikuttavaa ainetta sisältävät tabletit loppuvat, niin että lumetablettijaksoa ei pidetä. Kuukautisia voidaan siirtää niin pitkälle kun halutaan, kunnes toinen läpipainopakkaus on loppu. Kuukautisten siirron aikana voi esiintyä tiputtelu- tai läpäisyvuotoa. Rigevidoncont 150 mikrog/30 mikrog -tablettien säännöllinen käyttö aloitetaan uudestaan tavanomaisen 7 päivän lumetablettijakson jälkeen.
Jos nainen haluaa muuttaa tyhjennysvuodon alkamispäivää joksikin toiseksi viikonpäiväksi, häntä voidaan neuvoa lyhentämään seuraavaa lumetablettijaksoa niin monella päivällä kuin hän haluaa. Mitä lyhyempi tauko, sitä suurempi on riski, että tyhjennysvuotoa ei tule ja että toisen läpipainopakkauksen käytön aikana esiintyy läpäisy- ja tiputteluvuotoa (kuten kuukautisten siirtämisessäkin). On tärkeää korostaa, että lumetablettijaksoa ei saa pitkittää.
Pediatriset potilaat
Ei ole asianmukaista käyttää Rigevidoncont-valmistetta pediatrisille potilaille ennen puberteetti-ikää.
Antotapa
Suun kautta
Vasta-aiheet
Yhdistelmäehkäisytabletteja ei saa käyttää alla lueteltujen tilojen yhteydessä. Jos jokin näistä tiloista ilmenee ensimmäisen kerran yhdistelmäehkäisytablettien käytön aikana, valmisteen käyttö on keskeytettävä heti:
-
laskimotromboembolia (VTE) tai sen riski
- laskimotromboembolia – tällä hetkellä esiintyvä VTE (potilas antikoagulanttilääkityksellä) tai anamneesissa VTE (esim. syvä laskimotromboosi [SLT] tai keuhkoembolia)
- tiedossa oleva perinnöllinen tai hankittu laskimotromboembolia-alttius, kuten APCresistenssi (mukaan lukien Faktori V Leiden), antitrombiini III:n puutos, C-proteiinin puutos, S-proteiinin puutos
- suuri leikkaus ja siihen liittyvä pitkittynyt immobilisaatio (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
- useiden riskitekijöiden aiheuttama suuri laskimotromboembolian riski (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
-
valtimotromboembolia tai sen riski
- valtimotromboembolia – tällä hetkellä esiintyvä tai aiemmin esiintynyt valtimotromboembolia (esim. sydäninfarkti) tai sitä ennakoiva tila (esim. angina pectoris)
- aivoverisuonisairaus – tällä hetkellä esiintyvä tai aiemmin esiintynyt aivohalvaus tai sitä ennakoiva tila (esim. ohimenevä aivoverenkiertohäiriö, TIA)
- tiedossa oleva perinnöllinen tai hankittu valtimotromboembolia-alttius, kuten hyperhomokysteinemia ja fosfolipidivasta-aineet (kardiolipiinivasta-aineet, lupusantikoagulantti)
- anamneesissa migreeni, johon liittyy fokaalisia neurologisia oireita
- monista riskitekijöistä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) tai yhden vakavan riskitekijän esiintymisestä johtuva suuri valtimotromboemboliariski. Näitä riskitekijöitä voivat olla:
- diabetes, jossa esiintyy verisuonioireita
- vaikea hypertensio
- vaikea dyslipoproteinemia
- vaikea maksasairaus (nykyinen tai aiempi), niin kauan kuin maksan toimintakoearvot eivät ole normalisoituneet
- nykyiset tai aiemmat maksakasvaimet (hyvän- tai pahanlaatuiset)
- todetut tai epäillyt maligniteetit, joihin sukupuolihormonit vaikuttavat (esim. sukupuolielimissä tai rinnoissa)
- diagnosoimaton emätinverenvuoto
- samanaikainen käyttö mäkikuisman (Hypericum perforatum) kanssa (ks. kohta Yhteisvaikutukset)
- yliherkkyys vaikuttaville aineille (levonorgestreelille tai etinyyliestradiolille) tai kohdassa Apuaineet mainituille apuaineille
Ombitasviirin, paritapreviirin ja ritonaviirin yhdistelmää, dasabuviiria, glekapreviirin ja pibrentasviirin yhdistelmää sekä sofosbuviirin, velpatasviirin ja voksilapreviirin yhdistelmää sisältävien lääkevalmisteiden samanaikainen käyttö Rigevidoncont -tablettien kanssa on vasta-aiheista (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset).
Varoitukset ja käyttöön liittyvät varotoimet
Varoitukset
Minkä tahansa alla mainitun tilan/riskitekijän ilmetessä yhdistelmäehkäisytablettien käytön hyötyjä on punnittava suhteessa mahdollisiin riskeihin kussakin tapauksessa erikseen, ja käyttäjän kanssa on keskusteltava asiasta, ennen kuin hän päättää käytön aloittamisesta. Jos jokin näistä tiloista tai riskitekijöistä pahenee tai ilmenee ensimmäisen kerran, käyttäjän on otettava yhteys lääkäriin. Lääkäri päättää sitten, lopetetaanko yhdistelmäehkäisytablettien käyttö.
1. Verenkiertohäiriöt
Laskimotromboembolian (VTE) riski
Minkä tahansa yhdistelmäehkäisyvalmisteen käyttö lisää laskimotromboembolian (VTE) riskiä verrattuna siihen, että tällaista valmistetta ei käytetä lainkaan. Levonorgestreelia (kuten Rigevidoncont-valmisteeseen), norgestimaattia tai noretisteronia sisältäviin valmisteisiin liittyy pienin VTE:n riski. Päätöksen Rigevidoncont-valmisteen käyttämisestä saa tehdä vasta sen jälkeen, kun ehkäisyä harkitsevan naisen kanssa on keskusteltu. Keskustelussa on varmistettava, että hän ymmärtää Rigevidoncont-valmisteeseen liittyvän VTE:n riskin, miten hänen nykyiset riskitekijänsä vaikuttavat tähän riskiin ja että hänen VTE:n riskinsä on suurimmillaan ensimmäisen vuoden aikana, jona hän käyttää yhdistelmäehkäisyvalmistetta ensimmäistä kertaa elämässään. On myös jonkin verran näyttöä siitä, että riski suurenee, kun yhdistelmäehkäisyvalmisteen käyttö aloitetaan uudelleen vähintään 4 viikon tauon jälkeen.
Noin kahdelle naiselle 10 000:sta, jotka eivät käytä yhdistelmäehkäisyvalmistetta eivätkä ole raskaana, kehittyy VTE yhden vuoden aikana. Yksittäisellä naisella tämä riski voi kuitenkin olla suurempi riippuen hänen omista, taustalla vaikuttavista riskitekijöistä (ks. jäljempänä).
Pieniannoksisia (< 50 mikrog etinyyliestradiolia) suun kautta otettavia yhdistelmäehkäisyvalmisteita käyttäville naisille tehdyissä epidemiologisissa tutkimuksissa on havaittu, että noin 6–12 naiselle 10 000:sta kehittyy VTE yhden vuoden aikana.
Arvioiden mukaan noin kuudelle2 naiselle 10 000:sta, jotka käyttävät levonorgestreelia sisältävää yhdistelmäehkäisyvalmistetta, kehittyy VTE yhden vuoden aikana.
Tämä VTE-tapausten vuotuinen määrä on pienempi kuin määrä, joka on odotettavissa naisilla raskauden aikana tai synnytyksen jälkeisenä aikana.
VTE aiheuttaa kuoleman 1–2 %:ssa tapauksista.
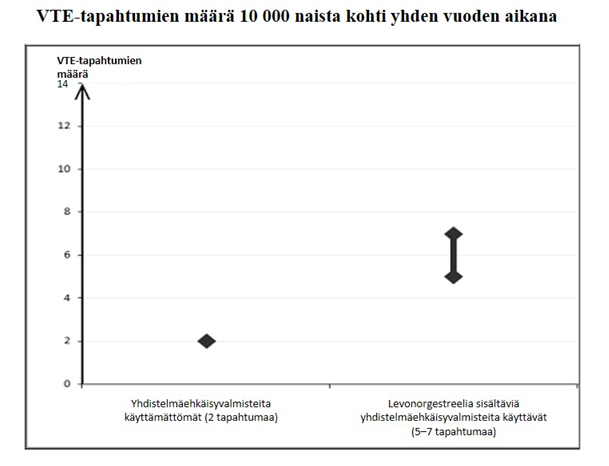
2 Vaihteluvälin 5–7 keskipiste 10 000 naisvuotta kohden, mikä perustuu levonorgestreelia sisältävien yhdistelmäehkäisyvalmisteiden käytön suhteelliseen riskiin verrattuna käyttämättömyyteen, jolloin riski on noin 2,3–3,6.
Yhdistelmäehkäisyvalmisteiden käyttäjillä on erittäin harvoin raportoitu esiintyneen tromboosia muissa verisuonissa (esim. maksan, suoliliepeen, munuaisten tai verkkokalvon laskimoissa ja valtimoissa).
Laskimotromboembolian riskitekijät
Yhdistelmäehkäisyvalmisteiden käyttäjillä esiintyvien laskimotromboembolisten komplikaatioiden riski voi suurentua huomattavasti, jos naisella on muita riskitekijöitä, erityisesti jos riskitekijöitä on useita (ks. taulukko). Rigevidoncont -valmiste on vasta-aiheinen naisella, jolla on useita riskitekijöitä, jotka aiheuttavat suuren VTE:n riskin (ks. kohta Vasta-aiheet). Jos naisella on useampia kuin yksi riskitekijä, nämä yhdessä voivat muodostaa yksittäisten tekijöiden summaa suuremman riskin – tässä tapauksessa VTE:n kokonaisriski on otettava huomioon. Jos hyöty-riski-suhteen katsotaan olevan negatiivinen, yhdistelmäehkäisyvalmistetta ei pidä määrätä (ks. kohta Vasta-aiheet).
Taulukko: Laskimotromboembolian (VTE) riskitekijät
| Riskitekijä | Kommentti |
Ylipaino (painoindeksi yli 30 kg/m2) | Riski suurenee huomattavasti painoindeksin noustessa. Huomioitava erityisesti silloin, jos muita riskitekijöitä on myös olemassa. |
Pitkittynyt immobilisaatio, suuri leikkaus, kaikki jalkojen tai lantion alueen leikkaukset, neurokirurgia tai merkittävä trauma Huomioitavaa: väliaikainen immobilisaatio, mukaan lukien > 4 tunnin lentomatka, voi myös olla VTE:n riskitekijä, erityisesti naisilla, joilla on myös muita riskitekijöitä | Näissä tilanteissa on suositeltavaa lopettaa laastarin/tabletin/renkaan käyttö (elektiivisen leikkauksen kohdalla vähintään neljä viikkoa etukäteen), eikä sitä pidä jatkaa ennen kuin käyttäjä on ollut kaksi viikkoa täysin liikuntakykyinen. Jotain muuta raskaudenehkäisymenetelmää on käytettävä eitoivotun raskauden ehkäisemiseksi. Antitromboottista hoitoa on harkittava, ellei Rigevidoncont-valmisteen käyttöä ole lopetettu etukäteen. |
Positiivinen sukuanamneesi (tämänhetkinen tai aikaisempi VTE sisaruksella tai vanhemmalla, etenkin suhteellisen nuorella iällä, esim. alle 50-vuotiaana) | Jos perinnöllistä alttiutta epäillään, potilas on syytä ohjata erikoislääkärin tutkimuksiin ennen kuin minkään yhdistelmäehkäisyvalmisteen käytöstä päätetään. |
Muut laskimotromboemboliaan liitetyt sairaudet | Syöpä, systeeminen lupus erythematosus, hemolyyttisureeminen oireyhtymä, krooninen tulehduksellinen suolistosairaus (Crohnin tauti tai haavainen koliitti) ja sirppisoluanemia |
Ikääntyminen | Erityisesti yli 35 vuoden ikä |
Suonikohjujen ja pinnallisen laskimontukkotulehduksen mahdollisesta yhteydestä laskimotromboosin alkamiseen tai etenemiseen ei ole yksimielisyyttä.
Laskimotromboembolian suurempi riski raskauden ja erityisesti synnytyksen jälkeisten noin 6 viikon aikana on otettava huomioon (ks. lisätiedot kohdasta ”Raskaus ja imetys”).
Laskimotromboembolian oireet (syvä laskimotromboosi ja keuhkoembolia)
Jos oireita ilmaantuu, naisia on neuvottava hakeutumaan välittömästi lääkärin hoitoon ja kertomaan, että he käyttävät yhdistelmäehkäisyvalmistetta. Syvän laskimotromboosin (SLT) oireita voivat olla:
- toisen jalan ja/tai jalkaterän turvotus tai turvotus jalan laskimon kohdalla
- jalan kipu tai arkuus, joka saattaa tuntua vain seistessä tai kävellessä
- jalan lisääntynyt lämmöntunne, jalan ihon värin muutos tai punoitus.
Keuhkoembolian oireita voivat olla:
- äkillisesti alkanut, selittämätön hengenahdistus tai nopeutunut hengitys
- äkillinen yskä, johon saattaa liittyä veriysköksiä
- pistävä rintakipu
- vaikea pyörrytys tai huimaus
- nopea tai epäsäännöllinen sydämen syke.
Jotkut näistä oireista (esim. hengenahdistus, yskä) ovat epäspesifisiä, ja ne voidaan tulkita virheellisesti yleisluontoisemmiksi tai vähemmän vaikeiksi tapahtumiksi (esim. hengitystieinfektioksi).
Muita verisuonitukoksen merkkejä voivat olla mm.: äkillinen kipu, turvotus ja sinertävä värimuutos raajassa.
Jos tukos tulee silmään, oireena voi olla esim. kivuton näön hämärtyminen, joka voi edetä näön menetykseen. Joskus näön menetys voi tapahtua lähes välittömästi.
Valtimotromboembolian (ATE) riski
Epidemiologisissa tutkimuksissa on osoitettu, että yhdistelmäehkäisyvalmisteiden käyttöön liittyy suurentunut valtimotromboembolian (sydäninfarkti) tai aivoverisuonitapahtuman (esim. aivojen ohimenevä verenkiertohäiriö (TIA), aivohalvaus) riski. Valtimotromboemboliset tapahtumat voivat johtaa kuolemaan.
Valtimotromboembolian (ATE) riskitekijät
Valtimotromboembolisten komplikaatioiden tai aivoverisuonitapahtuman riski yhdistelmäehkäisyvalmisteen käyttäjillä on korkeampi niillä naisilla, joilla on riskitekijöitä (ks. taulukko). Rigevidoncont-valmiste on vasta-aiheinen, jos naisella on joko yksi vakava tai useampia ATE:n riskitekijöitä, mikä aiheuttaa suuren valtimotromboemboliariskin (ks. kohta Vasta-aiheet). Jos naisella on useampi kuin yksi riskitekijä, nämä yhdessä voivat muodostaa yksittäisten tekijöiden summaa suuremman riskin – tässä tapauksessa kokonaisriski on otettava huomioon. Jos hyöty-riski-suhteen katsotaan olevan negatiivinen, yhdistelmäehkäisyvalmistetta ei pidä määrätä (ks. kohta Vasta-aiheet).
Taulukko: Valtimotromboembolian (ATE) riskitekijät
| Riskitekijä | Kommentti |
Ikääntyminen | Erityisesti yli 35 vuoden ikä |
Tupakointi | Yhdistelmäehkäisyvalmistetta käyttäviä naisia on neuvottava olemaan tupakoimatta. Yli 35-vuotiaita, tupakoimista jatkavia naisia on vakavasti kehotettava käyttämään jotakin muuta ehkäisymenetelmää. |
Korkea verenpaine | |
Ylipaino (painoindeksi yli 30 kg/m2) | Riski kasvaa huomattavasti painoindeksin noustessa. Erityisen tärkeää naisilla, joilla on muitakin riskitekijöitä. |
Positiivinen sukuanamneesi (tämänhetkinen tai aikaisempi valtimotromboembolia sisaruksella tai vanhemmalla, etenkin suhteellisen nuorella iällä, alle 50-vuotiaana). | Jos perinnöllistä alttiutta epäillään, potilas on syytä ohjata erikoislääkärin tutkimuksiin ennen kuin minkään yhdistelmäehkäisyvalmisteen käytöstä päätetään. |
Migreeni | Migreenin esiintymistiheyden kasvu tai vaikeusasteen lisääntyminen (mikä saattaa olla aivoverisuonitapahtumaa ennakoiva oire) yhdistelmäehkäisyvalmisteen käytön aikana voi olla syy yhdistelmäehkäisyvalmisteen käytön välittömään keskeyttämiseen. |
Muut verisuoniston haittatapahtumiin liitetyt sairaudet | Diabetes, hyperhomokysteinemia, sydämen läppävika ja eteisvärinä, dyslipoproteinemia ja systeeminen lupus erythematosus (SLE). |
Valtimotromboembolian (ATE) oireet
Jos oireita ilmaantuu, naisia on neuvottava hakeutumaan välittömästi lääkärin hoitoon ja kertomaan, että he käyttävät yhdistelmäehkäisyvalmistetta.
Aivoverisuonitapahtuman oireita voivat olla:
- kasvojen, käsivarren tai jalan äkillinen tunnottomuus tai heikkous (varsinkin vain yhdellä puolella vartaloa esiintyvä)
- äkillinen kävelyn vaikeutuminen, huimaus, tasapainon tai koordinaation menetys
- äkillinen sekavuus, puhe- tai ymmärtämisvaikeudet
- äkillinen näön heikentyminen yhdessä tai molemmissa silmissä
- äkillinen, voimakas tai pitkittynyt päänsärky, jonka syytä ei tiedetä
- tajunnan menetys tai pyörtyminen, johon saattaa liittyä kouristuskohtaus.
Ohimenevät oireet viittaavat siihen, että tapahtuma on ohimenevä aivoverenkiertohäiriö (TIA).
Sydäninfarktin oireita voivat olla:
- kipu, epämiellyttävä tunne, paineen tunne, painon tunne, puristuksen tai täysinäisyyden tunne rinnassa, käsivarressa tai rintalastan takana
- selkään, leukaan, kurkkuun, käsivarteen ja/tai vatsaan säteilevä epämiellyttävä tunne
- täyteläisyyden, ruoansulatushäiriöiden tai tukehtumisen tunne
- hikoilu, pahoinvointi, oksentelu tai huimaus
- erittäin voimakas heikkouden tunne, ahdistuneisuus tai hengenahdistus
- nopea tai epäsäännöllinen sydämen syke.
2. Kasvaimet:
Kohdunkaulasyöpä
Joissakin epidemiologisissa tutkimuksissa on raportoitu kohdunkaulan syövän riskin suurentuneen yhdistelmäehkäisytablettien pitkäaikaiskäytön yhteydessä, mutta vieläkään ei ole yksimielisyyttä siitä, missä määrin tähän havaintoon vaikuttavat sukupuolikäyttäytymisen sekoittavat vaikutukset ja muut tekijät, kuten ihmisen papilloomavirus (HPV).
Rintasyöpä
Meta-analyysi 54 epidemiologisesta tutkimuksesta osoitti, että yhdistelmäehkäisytabletteja käyttävillä naisilla rintasyövän suhteellinen riski (RR = 1,24) on hieman suurentunut. Suurentunut riski häviää vähitellen 10 vuoden kuluessa yhdistelmäehkäisytablettien käytön lopettamisen jälkeen. Koska rintasyöpä on harvinainen alle 40-vuotiailla naisilla, rintasyöpädiagnoosien suurentunut määrä yhdistelmäehkäisytabletteja parhaillaan ja äskettäin käyttäneillä on pieni suhteessa rintasyövän kokonaisriskiin. Tutkimukset eivät anna näyttöä kausaliteetista.
Havaittu riskin suureneminen saattaa johtua yhdistelmäehkäisytablettien käyttäjien rintasyövän varhaisemmasta diagnoosista, yhdistelmäehkäisytablettien biologisista vaikutuksista tai kummastakin tekijästä yhdessä.
Ehkäisytablettien käyttäjillä diagnosoidut rintasyövät eivät ole yleensä edenneet kliinisesti niin pitkälle kuin ehkäisytabletteja käyttämättömillä diagnosoidut rintasyövät.
Maksakasvaimet
Harvoissa tapauksissa yhdistelmäehkäisytablettien käyttäjillä on raportoitu hyvänlaatuisia maksakasvaimia (esim. maksa-adenoomaa, fokaalista nodulaarista hyperplasiaa) ja vieläkin harvemmin pahanlaatuisia maksakasvaimia. Nämä kasvaimet ovat yksittäistapauksissa johtaneet hengenvaaralliseen intra-abdominaaliseen verenvuotoon. Maksakasvain on otettava huomioon erotusdiagnoosina, kun yhdistelmäehkäisytabletteja käyttävällä naisella on voimakas ylävatsakipu, suurentunut maksa tai merkkejä vatsansisäisestä verenvuodosta.
Suuriannoksisten (50 mikrog etinyyliestradiolia) yhdistelmäehkäisyvalmisteiden käyttö vähentää kohdun limakalvon syövän ja kohtusyövän riskiä. Toistaiseksi ei ole vahvistettu, koskeeko tämä myös pieniannoksisia yhdistelmäehkäisyvalmisteita.
3. Muut tilat
Masennus
Masentunut mieliala ja masennus ovat tunnettuja hormonaalisten ehkäisyvalmisteiden käyttöön liittyviä haittavaikutuksia (ks. kohta Haittavaikutukset). Masennus voi olla vakavaa, ja se on itsetuhoisen käyttäytymisen ja itsemurhan tunnettu riskitekijä. Naisia on kehotettava ottamaan yhteyttä lääkäriinsä, jos heillä esiintyy mielialan muutoksia ja masennuksen oireita, myös pian hoidon aloittamisen jälkeen.
Hypertriglyseridemia
Naisilla, joilla on hypertriglyseridemia tai joilla sitä esiintyy suvussa, voi olla suurentunut haimatulehduksen riski, kun he käyttävät yhdistelmäehkäisytabletteja.
Maksasairaudet
Äkillinen tai krooninen maksan toimintahäiriö saattaa edellyttää yhdistelmäehkäisytablettien käytön keskeyttämistä, kunnes maksa-arvot ovat normalisoituneet.
Hypertensio
Vaikka lievää verenpaineen nousua on raportoitu monilla yhdistelmäehkäisytabletteja käyttävillä naisilla, kliinisesti merkityksellinen nousu on harvinaista. Yhdistelmäehkäisytablettien välitön keskeyttäminen on perusteltua vain näissä harvinaisissa tapauksissa. Jos hypertensiopotilaalla verenpainearvot pysyvät jatkuvasti koholla yhdistelmäehkäisytablettien käytön aikana tai jos merkitsevästi kohonnut verenpaine ei reagoi riittävästi verenpainelääkitykseen, yhdistelmäehkäisytablettien käyttö on keskeytettävä. Yhdistelmäehkäisytablettien käyttöä voidaan jatkaa, jos verenpainelääkityksellä saadaan aikaan normotensio ja käytön aloittamista uudelleen pidetään asianmukaisena.
Angiodeema
Eksogeeniset estrogeenit voivat indusoida tai pahentaa perinnöllisen ja hankinnaisen angioedeeman oireita.
Glukoosi-intoleranssi/diabetes
Vaikka yhdistelmäehkäisytabletit saattavat vaikuttaa perifeeriseen insuliiniresistenssiin ja glukoosinsietoon, pieniannoksisia (sisältää alle 0,05 mg etinyyliestradiolia) yhdistelmäehkäisytabletteja käyttävien diabetespotilaiden hoidon muuttamistarpeesta ei ole näyttöä. Diabetespotilaita on kuitenkin seurattava huolellisesti, erityisesti yhdistelmäehkäisytablettien käytön alkuvaiheessa.
Muut
Yhdistelmäehkäisytablettien käyttö on lopetettava, jos aikaisemman raskauden tai sukupuolihormonien käytön aikana esiintynyt kolestaattinen ikterus tai kutina uusiutuu.
Seuraavia sairauksia tai niiden pahenemista on raportoitu ilmenneen sekä raskauden että yhdistelmäehkäisytablettien käytön yhteydessä, mutta niiden yhteydestä yhdistelmäehkäisytablettien käyttöön ei ole pitävää näyttöä: kolestaattinen ikterus ja/tai kutina, sappikivitauti, porfyria, systeeminen lupus erythematosus, hemolyyttis-ureeminen oireyhtymä, Sydenhamin korea, herpes gestationis, otoskleroosiin liittyvä kuulon heikentyminen.
Yhdistelmäehkäisytablettien käytön aikana on joissakin tapauksissa raportoitu endogeenisen masennuksen, Crohnin taudin ja haavaisen paksusuolentulehduksen pahenemista.
Maksaläiskiä voi esiintyä, varsinkin jos niitä on esiintynyt raskausaikana. Maksaläiskiin taipuvaisten käyttäjien tulisi välttää altistumista auringolle ja ultraviolettisäteilylle yhdistelmäehkäisytablettien käytön aikana.
Lääkärintarkastus/neuvonta
Ennen Rigevidoncont-valmisteen käytön aloittamista tai uudelleen aloittamista potilaan anamneesi on selvitettävä täydellisesti (mukaan lukien sukuanamneesi), ja raskaus on suljettava pois. Naisen verenpaine on mitattava, ja hänelle on tehtävä lääkärintarkastus ottaen huomioon vasta-aiheet (ks. kohta Vasta-aiheet) ja varoitukset (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). On tärkeää kiinnittää naisen huomiota laskimo- ja valtimoveritulppia koskeviin tietoihin, kuten Rigevidoncont–valmisteen käyttöön liittyvään riskiin verrattuna muihin yhdistelmäehkäisyvalmisteisiin, laskimo- ja valtimoveritulppien oireisiin, tiedossa oleviin riskitekijöihin sekä siihen, mitä tehdä, jos epäilee veritulppaa.
Naista on myös neuvottava lukemaan pakkausseloste huolellisesti ja noudattamaan siinä annettuja ohjeita. Tarkastuskäyntien tiheyden ja luonteen pitää perustua vakiintuneisiin hoitosuosituksiin, ja ne on toteutettava kunkin naisen kliinisten tarpeiden mukaisesti.
Naisia on varoitettava siitä, että ehkäisytabletit eivät suojaa HIV-infektiolta (AIDS) eivätkä muilta sukupuolitaudeilta.
Tehon heikkeneminen
Tablettien unohtaminen, oksentelu, ripuli (ks. kohta Annostus ja antotapa) tai samanaikainen lääkitys (ks. kohta Yhteisvaikutukset) voivat heikentää yhdistelmäehkäisytablettien tehoa.
Syklikontrollin heikentyminen
Kaikki yhdistelmäehkäisytabletit voivat aiheuttaa epäsäännöllistä vuotoa (tiputtelu- ja läpäisyvuotoa), etenkin ensimmäisten käyttökuukausien aikana. Siksi epäsäännöllisen vuodon arviointi on mielekästä vasta noin kolme kiertoa kestävän sopeutumisvaiheen jälkeen.
Jos vuotohäiriöt jatkuvat tai niitä ilmaantuu kiertojen oltua aiemmin säännölliset, ei-hormonaaliset syyt on syytä ottaa huomioon ja suorittaa asianmukaiset diagnostiset toimenpiteet maligniteetin tai raskauden poissulkemiseksi. Nämä voivat käsittää kaavinnan.
Joillakin naisilla ei tule tyhjennysvuotoa lumetablettijakson aikana. Jos yhdistelmäehkäisytabletteja on otettu kohdan Annostus ja antotapa ohjeiden mukaan, nainen ei todennäköisesti ole raskaana. Jos yhdistelmäehkäisytabletteja ei kuitenkaan ole käytetty ohjeiden mukaan ennen tyhjennysvuodon ensimmäistä poisjääntiä, tai jos kaksi tyhjennysvuotoa on jäänyt tulematta, raskauden mahdollisuus on suljettava pois ennen yhdistelmäehkäisytablettien käytön jatkamista.
ALAT-arvon kohoaminen
Kliinisissä tutkimuksissa, joissa potilaat saivat hepatiitti C -virusinfektion hoitoon ombitasviirin, paritapreviirin ja ritonaviirin yhdistelmää sisältävää lääkevalmistetta sekä dasabuviiria yhdessä ribaviriinin kanssa tai ilman, transaminaasiarvot (ALAT) kohosivat yli 5-kertaisiksi normaaliarvoihin (upper limit of normal, ULN) nähden merkittävästi useammin naisilla, jotka käyttivät etinyyliestradiolia sisältäviä valmisteita (kuten hormonaalisia yhdistelmäehkäisyvalmisteita). ALAT-arvojen kohoamista havaittiin myös glekapreviirin ja pibrentasviirin yhdistelmää sekä sofosbuviirin, velpatasviirin ja voksilapreviirin yhdistelmää sisältävillä hepatiitti C -viruslääkkeillä (ks. kohdat Vasta-aiheet ja Yhteisvaikutukset).
Apuaineet, joiden vaikutus tunnetaan
Laktoosi ja sakkaroosi
Potilaiden, joilla on harvinainen perinnöllinen galaktoosi-intoleranssi, täydellinen laktaasinpuutos tai glukoosi-galaktoosi-imeytymishäiriö tai harvinainen perinnöllinen fruktoosi-intoleranssi tai sakkaroosi-isomaltaasin vajaatoimintaa, ei tule käyttää tätä lääkevalmistetta.
Paraoranssi (E110)
Lumetabletit sisältävät paraoranssia, joka voi aiheuttaa allergisia reaktioita.
Natrium
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Huomautus: Samanaikaisten lääkitysten valmisteyhteenveto on tarkistettava mahdollisten yhteisvaikutusten tunnistamiseksi.
Yhdistelmäehkäisyvalmisteen ja muiden vaikuttavien aineiden väliset yhteysvaikutukset saattavat aiheuttaa estrogeenin ja progesteronin plasmapitoisuuksien nousua tai laskua.
Estrogeenin ja progesteronin plasmapitoisuuksien lasku saattaa aiheuttaa lisääntynyttä läpäisyvuotoa ja heikentää yhdistelmäehkäisyvalmisteen tehoa.
Vasta-aiheiset yhdistelmät
-
Mäkikuisma (Hypericum perforatum) (ks. kohta Vasta-aiheet)
Hormonaalisen ehkäisyvalmisteen plasmapitoisuuksien lasku mäkikuisman maksaentsyymejä indusoivan vaikutuksen vuoksi. Riskinä on ehkäisytehon heikentyminen tai jopa ehkäisyvalmisteen tehottomuus, jonka seuraukset saattavat olla vakavat (raskaus). -
Ombitasviiri/paritapreviiri/ritonaviiri ja dasabuviiri (ks. kohta Vasta-aiheet)
Suurentunut maksatoksisuus.
Farmakodynaamiset yhteisvaikutukset
Samanaikaiseen käyttöön ombitasviirin, paritapreviirin ja ritonaviirin yhdistelmää, dasabuviiria yhdistettynä ribaviriinin kanssa tai ilman, glekapreviirin ja pibrentasviirin yhdistelmää tai sofosbuviirin, velpatasviirin ja voksilapreviirin yhdistelmää sisältävien lääkevalmisteiden kanssa liittyy suurentunut ALAT-arvon kohoamisen riski (ks. kohdat Vasta-aiheet ja Varoitukset ja käyttöön liittyvät varotoimet). Tämän vuoksi Rigevidoncont‑valmisteen käyttäjien pitää vaihtaa toisen ehkäisymenetelmän käyttöön (pelkkää progestiinia sisältävät ehkäisymenetelmät tai ei-hormonaaliset menetelmät) ennen hoidon aloitusta näillä lääkehoidoilla. Rigevidoncont‑valmisteen käyttö voidaan aloittaa uudestaan 2 viikkoa näiden hoitojen päättymisen jälkeen.
Farmakokineettiset yhteisvaikutukset
- Muiden lääkevalmisteiden vaikutukset Rigevidoncont-valmisteeseen
Yhteisvaikutuksia voi esiintyä käytettäessä mikrosomaalisia entsyymejä indusoivia lääkkeitä, mikä voi suurentaa sukupuolihormonien puhdistumaa ja aiheuttaa läpäisyvuotoa ja/tai ehkäisyn pettämisen.
Hoito
Entsyymi-induktio on havaittavissa jo muutaman hoitopäivän jälkeen. Maksimaalinen entsyymiinduktio havaitaan yleensä muutaman viikon sisällä. Entsyymi-induktio voi jatkua vielä noin neljän viikon ajan lääkehoidon päätyttyä.
Lyhytaikainen hoito
Käytettäessä entsyymejä indusoivia lääkkeitä yhdistelmäehkäisytablettien lisäksi on käytettävä tilapäisesti estemenetelmää tai jotain muuta ehkäisymenetelmää. Estemenetelmää on käytettävä koko samanaikaisen lääkehoidon ajan ja vielä 28 päivän ajan sen loppumisen jälkeen. Jos lääkehoito kestää kauemmin kuin yhdistelmäehkäisytablettipakkauksen vaikuttavia aineita sisältävät tabletit, lumetabletit on hävitettävä ja seuraava yhdistelmäehkäisytablettipakkaus on aloitettava heti.
Pitkäaikainen hoito
Naisille, jotka käyttävät pitkäaikaisesti entsyymejä indusoivia lääkeaineita, suositellaan jonkin muun luotettavan, ei-hormonaalisen ehkäisymenetelmän käyttöä.
Kirjallisuudessa on raportoitu seuraavia yhteisvaikutuksia.
Aineet, jotka lisäävät yhdistelmäehkäisytablettien puhdistumaa (entsyymi-induktion aiheuttama yhdistelmäehkäisytablettien tehon heikkeneminen), esimerkiksi:
Barbituraatit, bosentaani, karbamatsepiini, fenytoiini, primidoni, rifampisiini ja HIV-lääkkeet ritonaviiri, nevirapiini ja efavirentsi sekä mahdollisesti myös felbamaatti, griseofulviini, okskarbatsepiini, topiramaatti ja mäkikuismaa (Hypericum perforatum) sisältävät rohdosvalmisteet.
Aineet, joilla on vaihteleva vaikutus yhdistelmäehkäisytablettien puhdistumaan:
Useat HIV-proteaasinestäjien ja ei-nukleosidirakenteisten käänteiskopioijaentsyymin estäjien yhdistelmät (mukaan lukien yhdistelmät HCV:n estäjien kanssa) saattavat suurentaa tai pienentää estrogeenin tai progestiinin pitoisuutta plasmassa, kun yhdistelmäehkäisytabletteja käytetään samanaikaisesti. Näiden muutosten kokonaisvaikutus voi tietyissä tapauksissa olla kliinisesti merkittävä.
Tämän vuoksi samanaikaisen HIV/HCV-lääkityksen valmisteyhteenveto pitää tarkistaa mahdollisten yhteisvaikutusten varalta ja niiden suhteen annettujen suositusten osalta. Naisen, joka käyttää proteaasinestäjää tai ei-nukleosidirakenteista käänteiskopioijaentsyymin estäjää, on käytettävä lisäehkäisynä jotain estemenetelmää, jos yhteisvaikutuksen mahdollisuutta epäillään.
- Rigevidoncont -valmisteen vaikutukset muihin lääkevalmisteisiin
Yhdistelmäehkäisytabletit saattavat muuttaa tiettyjen muiden vaikuttavien aineiden metaboliaa, jolloin niiden pitoisuus plasmassa ja kudoksessa voi joko suurentua (esim. siklosporiini) tai pienentyä (esim. lamotrigiini).
- Muut yhteisvaikutukset
Modafiniili
Ehkäisytehon heikentymisen riski hoidon aikana ja yhden kierron ajan modafiniilihoidon päättymisen jälkeen modafiniilin entsyymi-induktion takia. Suurempiannoksisten (normodosed) ehkäisytablettien tai muun ehkäisymenetelmän käyttö on suositeltavaa.
Vemurafenibi
Estrogeenin ja progestiinin pitoisuuksien pienentymisen riski ja siitä johtuva tehon heikentymisen riski.
Perampaneeli
Vähintään 12 mg/vrk perampaneeliannokset: ehkäisytehon heikentymisen riski. Toisen ehkäisymenetelmän (etenkin estemenetelmän) käyttö on suositeltavaa.
Ulipristaali
Progesteronille antagonistisen vaikutuksen riski. Älä aloita yhdistelmäehkäisyvalmisteen käyttöä uudelleen vähintään 12 päivään ulipristaalin käytön lopettamisen jälkeen.
Rufinamidi
Etinyyliestradiolin pitoisuus pienenee kohtalaisesti. Toisen ehkäisymenetelmän (etenkin estemenetelmän) käyttö on suositeltavaa.
Etorikoksibi
Etinyyliestradiolin pitoisuus suurenee etorikoksibin samanaikaisen käytön yhteydessä.
Laboratoriotutkimukset
Steroidiehkäisyn käyttö voi vaikuttaa eräiden laboratoriokokeiden tuloksiin, kuten maksan, kilpirauhasen, lisämunuaisen ja munuaisten toimintakokeiden biokemiallisiin parametreihin, (kantaja)proteiinien (esim. kortikosteroideja sitovan globuliinin ja lipidi/lipoproteiinifraktioiden) pitoisuuksiin plasmassa, hiilihydraattiaineenvaihdunnan parametreihin ja veren hyytymis- ja fibrinolyysiparametreihin. Muutokset pysyvät yleensä laboratorioarvojen viitealueella.
Raskaus ja imetys
Raskaus
Rigevidoncont-valmistetta ei saa käyttää raskauden aikana.
Jos nainen tulee raskaaksi Rigevidoncont-valmisteen käytön aikana, hoito on lopetettava välittömästi. Laajojen epidemiologisten tutkimusten mukaan synnynnäisten kehityshäiriöiden riski ei ole kuitenkaan suurentunut ennen raskautta yhdistelmäehkäisyvalmistetta käyttäneiden naisten lapsilla, kuten ei myöskään teratogeenisten vaikutusten riski silloin, kun ehkäisytabletteja on käytetty tahattomasti alkuraskauden aikana. Kun Rigevidoncont‑valmisteen käyttö aloitetaan uudelleen, on huomioitava, että laskimotromboembolian riski on suurentunut synnytyksen jälkeisenä aikana (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Imetys
Ehkäisytabletit saattavat vaikuttaa imetykseen, sillä ne voivat vähentää rintamaidon määrää ja muuttaa sen koostumusta. Siksi yhdistelmäehkäisytablettien käyttöä ei yleisesti suositeta, ennen kuin lapsen imetys on lopetettu kokonaan. Pieniä määriä kontraseptiivisia steroideja ja/tai niiden metaboliitteja voi erittyä rintamaitoon. Näillä määrillä voi olla vaikutus lapseen. Jos imetys on kuitenkin toivottua, jotain toista ehkäisymenetelmää on suositeltava.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Tutkimuksia valmisteen vaikutuksesta ajokykyyn ja koneidenkäyttökykyyn ei ole tehty. Vaikutusta ajokykyyn ja koneidenkäyttökykyyn ei ole havaittu yhdistelmäehkäisyvalmisteen käyttäjillä.
Haittavaikutukset
Seuraavia haittavaikutuksia on ilmoitettu levonorgestreelin/etinyyliestradiolin käytön aikana:
| Elinjärjestelmä-luokka | Yleinen (≥ 1/100, < 1/10) | Melko harvinainen (≥ 1/1 000,< 1/100) | Harvinainen (≥ 1/10 000,< 1/1 000) | Hyvin harvinainen (< 1/10 000) | Tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin) |
Hyvän- ja pahanlaatuiset kasvaimet (mukaan lukien kystat ja polyypit) | Hepato-sellulaarinen karsinooma, hyvänlaatuiset maksakasvaimet (esim. fokaalinen nodulaarinen hyperplasia, maksaadenooma) | ||||
Infektiot | Emätintulehdus, myös emättimen kandidiaasi | ||||
| Immuunijärjestelmä | Anafylaktiset reaktiot, joihin liittyy hyvin harvinaisissa tapauksissa nokkosihottuma, angioedeema, verenkiertoelimistön ja vaikeat hengityselinten häiriöt | Systeemisen lupus erythematosuksen paheneminen | Perinnöllisen ja hankinnaisen angioedeeman oireiden paheneminen | ||
Aineenvaihdunta ja ravitsemus | Ruokahalun muutokset (lisääntyminen tai vähentyminen) | Glukoosiintoleranssi | Porfyrian paheneminen | ||
Psyykkiset häiriöt | Mielialan muutokset, myös masennus, libidon muutokset | ||||
Hermosto | Hermostuneisuus, huimaus | Korean paheneminen | |||
Silmät | Piilolinssien huono sieto | Näköhermon tulehdus Retinaalinen vaskulaarinen tromboosi | |||
Verisuonisto | Korkea verenpaine | Laskimo- tromboembolia ja valtimotromboembolia | Suonikohjujen paheneminen | ||
Ruoansulatuselimistö | Pahoinvointi, oksentelu, vatsakipu | Vatsakrampit Vatsan turvotus | Iskeeminen koliitti | Tulehduksellinen suolistosairaus (Crohnin tauti, haavainen paksusuolitulehdus) | |
| Maksa ja sappi | Kolestaattinen ikterus |
Sappikivitauti Kolestaasi | Maksasairaus (esim. maksatulehdus, maksan toimintahäiriö) | ||
Iho ja ihonalainen kudos | Akne | Ihottuma Maksaläiskät, jotka saattavat olla pitkäaikaisia Hirsutismi Hiustenlähtö | Kyhmyruusu | Monimuotoinen punavihoittuma | |
| Munuaiset ja virtsatiet | Hemolyyttisureeminen oireyhtymä | ||||
Sukupuolielimet ja rinnat | Rintojen kipu, arkuus ja turvotus ja eritevuoto rinnoista, Dysmenorrea Kuukautisvuodon muutokset Kohdunkaulan ektropiumin ja emätineritteen muutokset, Amenorrea | ||||
| Yleisoireet ja antopaikassa todettavat haitat | Nesteretentio/ turvotus Painon muutokset (nousu tai lasku) | ||||
Tutkimukset |
| Plasman lipidien muutokset myös hypertriglyseridemia | Seeruminfolaattipitoisuuden pieneneminen |
Tiettyjen haittavaikutusten kuvaus
Yhdistelmäehkäisyvalmisteita käyttävillä naisilla on havaittu valtimoiden ja laskimoiden tromboottisten ja tromboembolisten tapahtumien lisääntynyt riski. Näitä tapahtumia ovat mm. sydäninfarkti, aivohalvaus, ohimenevät aivoverenkiertohäiriöt (TIA), laskimoveritulppa ja keuhkoembolia. Tapahtumia kuvataan tarkemmin kohdassa Varoitukset ja käyttöön liittyvät varotoimet.
Seuraavia vakavia haittatapahtumia on ilmoitettu hormonaalista yhdistelmäehkäisyvalmistetta käyttävillä naisilla. Niistä on kerrottu kohdassa Varoitukset ja käyttöön liittyvät varotoimet:
- laskimotromboemboliset häiriöt
- valtimotromboemboliset sairaudet
- hypertensio
- maksakasvaimet
- Crohnin tauti, haavainen paksusuolitulehdus, porfyria, systeeminen lupus erythematosus, herpes gestationis, Sydenhamin korea, hemolyyttis-ureeminen oireyhtymä, kolestaattinen ikterus
Yhdistelmäehkäisytablettien käyttäjillä rintasyöpädiagnoosien esiintyvyys on hieman suurentunut. Koska rintasyöpä on harvinainen alle 40-vuotiailla naisilla, rintasyöpädiagnoosien ylimäärä on pieni verrattuna rintasyövän kokonaisriskiin. Sen syy-yhteyttä yhdistelmäehkäisytablettien käyttöön ei tunneta. Lisätietoja, ks. kohdat Vasta-aiheet ja Varoitukset ja käyttöön liittyvät varotoimet
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Ehkäisytablettien yliannostuksen oireita on ilmoitettu aikuisilla, nuorilla ja alle 12-vuotiailla lapsilla. Yliannostus saattaa aiheuttaa seuraavia oireita: pahoinvointi, oksentelu, rintojen kipu, huimaus, vatsakipu, uneliaisuus/väsymys ja nuorilla tytöillä verenvuoto emättimestä. Antidoottia ei ole, ja jatkohoito on oireenmukaista.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Sukupuolihormonit ja genitaalijärjestelmään vaikuttavat aineet, progestageenit ja estrogeenit, kiinteät yhdistelmävalmisteet, ATC-koodi: G03AA07
Vaikutusmekanismi
Rigevidoncont 150 mikrog/30 mikrog -tablettien ehkäisyteho perustuu monen eri tekijän yhteisvaikutukseen. Näistä tärkeimpiä ovat ovulaation estyminen ja kohdun limakalvon ja kohdunkaulan liman muutokset.
Pieniannoksisten monofaasisten yhdistelmäehkäisyvalmisteiden, jotka sisältävät 0,15 mg levonorgestreelia ja 0,03 mg etinyyliestradiolia, Pearlin luku (raskauksien määrä 100 naisvuotta kohden) on 0,1 (menetelmän pettäminen).
Farmakokinetiikka
Levonorgestreeli
Imeytyminen
Suun kautta otetun Rigevidoncont 150 mikrog/30 mikrog -valmisteen levonorgestreeli imeytyy nopeasti ja lähes täydellisesti. Levonorgestreelin huippupitoisuus plasmassa saavutetaan 30–120 minuutin kuluttua suun kautta tapahtuneen annon jälkeen. Hyötyosuus on noin 100 prosenttia. Levonorgestreelilla ei ole alkureitin metaboliaa.
Jakautuminen
Levonorgestreeli sitoutuu suuressa määrin plasman albumiiniin ja sukupuolihormoneja sitovaan globuliiniin (SHBG).
Biotransformaatio
Metabolian saa pääasiassa aikaan Δ4-3-okso-ryhmän reduktio ja hydroksylaatio paikoilla 2α, 1β ja 16β, mitäseuraa konjugaatio. Suurin osa veressäkiertäistämetaboliiteista on 3α, 5β-tetrahydrolevonorgestreelin sulfaatteja, kun taas eritys tapahtuu pääasiassa glukuronideina. Osa alkuperäisestä levonorgestreelista kiertää myös 17β-sulfaattina. Metabolinen puhdistuma vaihtelee huomattavasti yksilöiden välillä, mikä saattaa osittain selittää levonorgestreelipitoisuuksissa havaittuja suuria eroja eri käyttäjillä.
Eliminaatio
Levonorgestreelin eliminoitumisen keskimääräinen puoliintumisaika on noin 36 tuntia vakaassa tilassa. Levonorgestreeli ja sen metaboliitit erittyvät pääasiassa virtsaan (40–68 %) ja noin 16–48 % erittyy ulosteisiin.
Etinyyliestradioli
Imeytyminen
Etinyyliestradioli imeytyy nopeasti ja lähes täydellisesti ruoansulatuskanavasta. Huippupitoisuudet plasmassa ilmenevät noin 60–180 minuutissa.
Keskimääräinen hyötyosuus on presysteemisen konjugaation ja alkureitin metabolian seurauksena vain noin 40-45 prosenttia. Käyrän alapuolella olevan alueen (AUC) ja Cmax-arvon odotetaan nousevan hieman ajan kanssa.
Jakautuminen
Etinyyliestradioli sitoutuu plasmaproteiineihin 98,8-prosenttisesti, melkein kokonaan albumiiniin.
Biotransformaatio
Etinyyliestradiolin presysteeminen konjugaatio tapahtuu sekä ohutsuolen limakalvolla että maksassa. Etinyyliestradiolin suorien konjugaattien hydrolyysi suoliston flooran avulla muodostaa etinyyliestradiolia, joka voi imeytyä uudestaan, ja näin syntyy enterohepaattinen kiertokulku. Etinyyliestradiolin ensisijainen metaboliareitti on sytokromi P450 -välitteinen hydroksylaatio, jossa ensisijaisina metaboliitteina ovat 2-OH-etinyyliestradioli ja 2-metoksi-etinyyliestradioli. 2-OH-etinyyliestradioli metaboloituu edelleen kemiallisesti reaktiivisiksi metaboliiteiksi.
Eliminaatio
Etinyyliestradioli häviää plasmasta puoliintumisajan ollessa noin 29 tuntia (26–33 tuntia); plasmapuhdistuma on 10–30 l/tunti. Etinyyliestradiolin konjugaatit ja sen metaboliitit erittyvät virtsan ja ulosteen kautta suhteessa 1:1.
Prekliiniset tiedot turvallisuudesta
Etinyyliestradiolin ja levonorgestreelin akuutti toksisuus on vähäinen. Ilmeisten lajikohtaisten eroavuuksien takia prekliinisillä tuloksilla on vain rajoitetusti ennustearvoa estrogeenien käytöstä ihmisillä.
Koe-eläimillä estrogeenit osoittivat alkioon kohdistuvia letaalisia vaikutuksia suhteellisen alhaisilla annoksilla; näissä havaittiin virtsa- ja sukupuolielimien epämuodostumista ja koiraspuolisten sikiöiden feminisaatiota. Levonorgestreeli osoitti virilisoivia vaikutuksia naaraspuolisissa sikiöissä. Reproduktiivista toksisuutta koskevat tutkimukset rotilla, hiirillä ja kaniineilla eivät paljastaneet muita merkkejä teratogeenisuudesta kuin sukupuolisen erilaistumisen vaikutukset. Prekliiniset tiedot tavanomaisista toistuvien annosten toksisuustutkimuksista ja genotoksisuus- ja karsinogeenisuustutkimuksista eivät tuoneet esiin erityistä vaaraa ihmisille, lukuun ottamatta valmisteyhteenvedon muissa osioissa esitettyjä kohtia.
Farmaseuttiset tiedot
Apuaineet
Vaikuttavaa ainetta sisältävät päällystetyt tabletit:
Tabletin ydin
vedetön kolloidinen piidioksidi, magnesiumstearaatti, talkki, maissitärkkelys, laktoosimonohydraatti
Päällyste
vedetön kolloidinen piidioksidi, talkki, sakkaroosi, kalsiumkarbonaatti, titaanidioksidi (E171), kopovidoni K-28, makrogoli 6000, povidoni K-30, karmelloosinatrium
Päällystetyt lumetabletit:
Tabletin ydin
vedetön laktoosi, mikrokiteinen selluloosa, esigelatinoitu maissitärkkelys, vedetön kolloidinen piidioksidi, magnesiumstearaatti
Päällyste
povidoni K-90, titaanidioksidi (E171), makrogoli 6000, sakkaroosi, indigokarmiini alumiinilakka (E132), kinoliinikeltainen alumiinilakka (E104), natriumbentsoaatti (E211), paraoranssi alumiinilakka (E110), talkki, kalsiumkarbonaatti
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
2 vuotta.
Säilytys
Säilytä alle 25 °C.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
RIGEVIDONCONT tabletti, päällystetty
150/30 mikrog (L:kyllä) 3 x 28 fol (14,71 €)
PF-selosteen tieto
Rigevidoncont 150 mikrog/30 mikrog päällystetyt tabletit on pakattu PVC/PVDC/alumiiniläpipainopakkauksiin. Läpipainopakkaukset on pakattu kartonkipakkauksiin. Jokaisessa pakkauksessa on myös pakkausseloste, säilytyspussi ja viikonpäivätarroja.
Pakkauskoot:
1×(21+7) päällystetyt tabletit
3×(21+7) päällystetyt tabletit
6×(21+7) päällystetyt tabletit
13×(21+7) päällystetyt tabletit
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Vaikuttavaa ainetta sisältävät tabletit ovat valkoisia, pyöreitä, kaksoiskuperia sokeripäällysteisiä tabletteja, joiden halkaisija on noin 6 mm.
Lumetabletit ovat vihreitä, pyöreitä, kaksoiskuperia sokeripäällysteisiä tabletteja, joiden halkaisija on noin 7 mm.
Käyttö- ja käsittelyohjeet
Ei erityisvaatimuksia.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
RIGEVIDONCONT tabletti, päällystetty
150/30 mikrog 3 x 28 fol
- Ei korvausta.
ATC-koodi
G03AA07
Valmisteyhteenvedon muuttamispäivämäärä
26.09.2022
Yhteystiedot
Barnhusgatan 22, 5tr
111 23 Stockholm
Sweden
+358105793700
medinfo.fi@gedeonrichter.eu
