ORFADIN oraalisuspensio 4 mg/ml
Vaikuttavat aineet ja niiden määrät
1 ml sisältää 4 mg nitisinonia.
Apuaineet, joiden vaikutus tunnetaan:
Yksi ml sisältää:
natrium 0,7 mg (0,03 mmol)
glyseroli 500 mg
natriumbentsoaatti 1 mg
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Oraalisuspensio.
Kliiniset tiedot
Käyttöaiheet
Perinnöllinen tyypin 1 tyrosinemia (HT-1)
Orfadin on tarkoitettu diagnosoidun perinnöllisen tyypin 1 tyrosinemian (HT‑1) hoitoon aikuisilla ja pediatrisilla potilailla (kaikissa ikäryhmissä), yhdessä tyrosiinin ja fenyylialaniinin ruokavaliorajoituksen kanssa.
Alkaptonuria (AKU)
Orfadin on tarkoitettu alkaptonurian (AKU) hoitoon aikuisilla potilailla.
Ehto
Hoidon saa aloittaa ja sitä tulee valvoa perinnöllisen tyypin 1 tyrosinemian (HT-1) hoitoon perehtynyt lääkäri.
Annostus ja antotapa
Annostus
HT-1
Nitisinonihoidon aloittaa ja sitä valvoo lääkäri, joka on perehtynyt perinnöllisen tyypin 1 tyrosinemian hoitoon.
Taudin kaikkien genotyyppien hoito on aloitettava mahdollisimman varhain kokonaiselossaolon lisäämiseksi ja komplikaatioiden, kuten maksan vajaatoiminnan, maksasyövän ja munuaissairauden, välttämiseksi. Nitisinonihoitoa on täydennettävä ruokavaliolla, joka sisältää mahdollisimman vähän fenyylialaniinia ja tyrosiinia, ja tämän jälkeen on seurattava plasman aminohappopitoisuuksia (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset).
Aloitusannos HT-1:n hoidossa
Suositeltu aloitusvuorokausiannos lapsille ja aikuisille on 1 mg/painokilo suun kautta. Nitisinoniannos on sovitettava yksilöllisesti. Lääkeannos suositellaan annosteltavaksi kerran vuorokaudessa. Mutta koska on olemassa vähän tietoja potilaista, joiden kehon paino on <20 kg, on suositeltavaa jakaa tälle potilasryhmälle annettava kokonaisvuorokausiannos kahteen päivittäin annettavaan annokseen.
Annoksen muuttaminen HT-1:n hoidossa
Säännöllisen seurannan aikana on asianmukaista seurata myös virtsan sukkinyyliasetonipitoisuutta, maksan toimintakoearvoja ja alfafetoproteiinipitoisuutta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Jos virtsassa havaitaan edelleen sukkinyyliasetonia kuukauden kuluttua nitisinonihoidon aloittamisesta, nitisinoniannos on suurennettava tasolle 1,5 mg/painokilo/vrk. Kaikkien biokemiallisten parametrien arvioinnin tulosten perusteella 2 mg/painokilo/vrk annos saattaa olla tarpeen. Tätä annosta on pidettävä suurimpana annoksena kaikilla potilailla.
Jos biokemiallinen vaste on riittävä, annostusta saa muuttaa vain painon nousun mukaan.
Edellä mainittujen tutkimusten lisäksi hoidon alussa, siirryttäessä kahdesti vuorokaudessa ‑annostuksesta kerran vuorokaudessa ‑annostukseen tai potilaan tilan heikentyessä on seurattava tarkemmin kaikkia käytettävissä olevia biokemiallisia parametreja (eli plasman sukkinyyliasetonipitoisuutta, virtsan 5aminolevulinaattipitoisuutta ja erytrosyyttien porfobilinogeenisynteesin aktiivisuutta).
AKU
Nitisinonihoidon aloittaa ja sitä valvoo lääkäri, joka on perehtynyt alkaptonurian hoitoon.
Suositeltu annos aikuisille AKU-potilaille on 10 mg kerran vuorokaudessa.
Erityisryhmät
Iäkkäille ja munuaisten tai maksan vajaatoimintaa sairastaville ei ole erityisiä annossuosituksia.
Pediatriset potilaat
HT-1: Annossuositus (mg/painokilo) on sama lapsilla ja aikuisilla.
Mutta koska on olemassa vähän tietoja potilaista, joiden kehon paino on <20 kg, on suositeltavaa jakaa tälle potilasryhmälle annettava kokonaisvuorokausiannos kahteen päivittäin annettavaan annokseen.
AKU: Orfadin-valmisteen turvallisuutta ja tehoa 0–18 vuoden ikäisten lasten hoidossa ei ole vielä varmistettu. Tietoja ei ole saatavilla.
Antotapa
Suspensio annetaan laimentamattomana potilaan suuhun mittaruiskulla. Pakkaukseen sisältyvät 1,5 ml:n, 3 ml:n ja 6 ml:n mittaruiskut on tarkoitettu annoksen mittaamiseen millilitroina määrätyn annostuksen mukaisesti. Mittaruiskuissa on vastaavasti 0,05 ml:n, 0,1 ml:n ja 0,25 ml:n asteikkovälit. Alla olevasta taulukosta nähdään annoksen muuntaminen (mg/ml) kaikille kolmelle mittaruiskukoolle.
Annoksen muuntotaulukot kaikille kolmelle mittaruiskukoolle:
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Tärkeää tietoa käyttöohjeista:
Voimakkasti ravistamalla tehtävä dispergointi on tarpeen ennen jokaista käyttökertaa. Ennen dispergointia tämä lääkevalmiste saattaa näyttää kiinteältä paakulta, jossa on hieman opalisoiva supernatantti. Annos vedetään ruiskuun ja annetaan välittömästi dispergoinnin jälkeen.
On tärkeää noudattaa kohdassa Käyttö- ja käsittelyohjeet annettuja annoksen valmistus- ja anto-ohjeita huolellisesti annostuksen tarkkuuden varmistamiseksi.
On suositeltavaa, että terveydenhuollon ammattilainen neuvoo potilasta tai hoitajaa mittaruiskujen käytössä, jotta lääkettä annetaan varmasti oikea määrä, ja että resepti annetaan millilitroina (ml).
Orfadin-valmistetta on saatavana myös 2 mg:n, 5 mg:n 10 mg:n ja 20 mg:n kapseleina, joita voidaan käyttää, jos niiden katsotaan sopivan potilaalle paremmin.
On suositeltavaa ottaa oraalisuspensio ruoan kanssa; ks. kohta Yhteisvaikutukset.
Ennen lääkkeen käsittelyä tai antoa huomioon otettavat varotoimet
Mittaruiskuun ei pidä kiinnittää neulaa, infuusioletkua tai mitään muuta parenteraaliseen antoon tarkoitettua laitetta.
Orfadin on tarkoitettu annettavaksi vain suun kautta.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Nitisinonia käyttävät äidit eivät saa imettää (ks. kohdat Raskaus ja imetys ja Prekliiniset tiedot turvallisuudesta).
Varoitukset ja käyttöön liittyvät varotoimet
Seurantakäyntejä on oltava 6 kuukauden välein. Mikäli haittatapahtumia havaitaan, suositellaan lyhyempiä käyntivälejä.
Plasman tyrosiinipitoisuuksien seuranta
On suositeltavaa tehdä potilaalle silmien rakolamppututkimus ennen nitisinonihoidon aloittamista ja myöhemmin säännöllisesti, vähintään kerran vuodessa. Jos potilaalle kehittyy näköhäiriöitä nitisinonihoidon aikana, silmälääkärin on tutkittava potilas viipymättä.
HT-1: On varmistettava, että potilas noudattaa ruokavaliohoitoa, ja plasman tyrosiinipitoisuus on mitattava. Tyrosiinin ja fenyylialaniinin määrää ruokavaliossa on rajoitettava tiukemmin, jos plasman tyrosiinipitoisuus on yli 500 mikromol/l. Ei ole suositeltavaa pienentää plasman tyrosiinipitoisuutta pienentämällä nitisinoniannosta eikä lopettamalla sen käyttö, sillä metabolinen häiriö voi johtaa potilaan kliinisen tilan heikentymiseen.
AKU: Plasman tyrosiinipitoisuutta on seurattava, jos potilaalle kehittyy keratopatioita. Tyrosiinin ja fenyylialaniinin määrää ruokavaliossa on rajoitettava, jotta plasman tyrosiinipitoisuus pysyy alle tason 500 mikromol/l. Tämän lisäksi nitisinonihoito on keskeytettävä tilapäisesti, ja se voidaan aloittaa uudelleen, kun oireet ovat hävinneet.
Maksaseuranta
HT-1: Maksatoimintaa on seurattava säännöllisesti maksan toimintakokein ja kuvantamistutkimuksin. On myös suositeltavaa seurata seerumin alfafetoproteiinipitoisuutta. Seerumin alfafetoproteiinipitoisuuden suureneminen voi olla merkki hoidon riittämättömyydestä. Jos potilaan alfafetoproteiinipitoisuus suurenee tai maksassa havaitaan merkkejä kasvaimista, potilas on aina tutkittava pahanlaatuisten maksakasvainten varalta.
Verihiutaleiden ja veren valkosolujen seuranta
Verihiutale- ja valkosoluarvojen säännöllistä seurantaa suositellaan sekä HT-1- että AKU-potilaille, sillä lääkkeen kliinisen arvioinnin aikana HT-1-potilailla ilmeni joitakin korjautuvia trombosytopenia- ja leukopeniatapauksia.
Samanaikainen käyttö muiden lääkevalmisteiden kanssa
Nitisinoni on kohtalainen CYP2C9:n estäjä. Sen vuoksi nitisinonihoito voi johtaa samanaikaisesti annettujen, pääasiassa CYP2C9:n kautta metaboloituvien lääkevalmisteiden suurentuneeseen pitoisuuteen plasmassa. Nitisinonihoitoa saavien potilaiden tilaa on tarkkailtava huolellisesti, kun heitä hoidetaan samanaikaisesti CYP2C9:n kautta metaboloituvilla lääkevalmisteilla, joiden terapeuttinen ikkuna on kapea (kuten esimerkiksi varfariini ja fenytoiini). Näiden samanaikaisesti annettavien lääkevalmisteiden annoksia on ehkä muutettava (ks. kohta Yhteisvaikutukset).
Apuaineet, joiden vaikutus tunnetaan:
Glyseroli
Yksi ml sisältää 500 mg. Yksi 20 ml:n oraalisuspensioannos (10 g glyserolia) tai suurempi voi aiheuttaa päänsärkyä, vatsavaivoja ja ripulia.
Natrium
Yksi ml sisältää 0,7 mg (0,03 mmol).
Natriumbentsoaatti
Yksi ml sisältää 1 mg. Bilirubiinin nousu sen jälkeen, kun se on bentsoidihapon ja sen suolojen vaikutuksesta syrjäytynyt albumiinista, voi lisätä keltaisuutta ennenaikaisesti ja täysiaikaisina syntyneillä keltatautisilla vastasyntyneillä ja kehittyä kernikterukseksi (konjugoimattoman bilirubiinin kertyminen aivokudokseen). Tämän vuoksi on erittäin tärkeää seurata tarkasti bilirubiinin plasmapitoisuuksia vastasyntyneellä potilaalla. Bilirubiinipitoisuudet on mitattava ennen hoidon aloittamista. Jos plasman bilirubiinipitoisuudet ovat selvästi kohonneet, on harkittava asianmukaisesti määritetyn osan Orfadin-kapselista antamista oraalisuspension sijaan erityisesti ennenaikaisesti syntyneille potilaille, joilla on riskitekijöitä, kuten asidoosi ja alhainen albumiiinipitoisuus. Orfadin-kapselihoitoa tulee antaa, kunnes konjugoimattoman bilirubiinin pitoisuudet plasmassa ovat normalisoituneet.
Yhteisvaikutukset
Nitisinoni metaboloituu in vitro CYP3A4:n kautta. Tästä syystä annoksen muuttaminen saattaa olla tarpeen, kun nitisinonia annetaan samanaikaisesti tämän entsyymin estäjien tai induktorien kanssa.
Eräästä kliinisestä yhteisvaikutustutkimuksesta saatujen, 80 mg:n nitisinonia vakaassa tilassa koskevien tietojen perusteella nitisinoni on kohtalainen CYP2C9:n estäjä (tolbutamidin AUC‑arvon 2,3‑kertainen nousu), minkä vuoksi nitisinonihoito voi johtaa samanaikaisesti annettujen, pääasiassa CYP2C9:n kautta metaboloituvien lääkevalmisteiden suurentuneeseen pitoisuuteen plasmassa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Nitisinoni on heikko CYP2E1:n induktori (klooritsoksatsonin AUC‑arvon 30 %:n lasku) ja heikko OAT1:n ja OAT3:n estäjä (furosemidin AUC‑arvon 1,7‑kertainen nousu), mutta nitisinoni ei estänyt CYP2D6‑entsyymiä (ks. kohta Farmakokinetiikka).
Ruoka ei vaikuta nitisinonioraalisuspension biologiseen hyötyosuuteen, mutta lääkkeen ottaminen ruoan kanssa hidastaa imeytymisnopeutta ja vähentää siten pitoisuuksien vaihtelua seerumissa annosten välillä. Tästä syystä suositellaan, että oraalisuspensio otettaisiin ruokailun yhteydessä ks. kohta Annostus ja antotapa.
Raskaus ja imetys
Raskaus
Ei ole olemassa riittävästi tietoja nitisinonin käytöstä raskaana oleville naisille. Eläinkokeissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Mahdollista riskiä ihmisille ei tunneta. Orfadin-valmistetta ei pidä käyttää raskauden aikana ellei raskaana olevan potilaan kliininen tilanne edellytä hoitoa Orfadin-valmisteella. Nitisinoni läpäisee ihmisen istukan.
Imetys
Ei tiedetä, erittyykö nitisinoni ihmisen rintamaitoon. Eläinkokeissa on havaittu haitallisia syntymänjälkeisiä vaikutuksia maidon kautta tapahtuneen nitisinonialtistuksen jälkeen. Näin ollen nitisinonia käyttävät äidit eivät saa imettää, sillä imeväiseen kohdistuvia riskejä ei voida poissulkea (ks. kohdat Vasta-aiheet ja Prekliiniset tiedot turvallisuudesta).
Hedelmällisyys
Tietoja nitisinonin vaikutuksesta hedelmällisyyteen ei ole.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Orfadin-valmisteella on vähäinen vaikutus ajokykyyn ja koneiden käyttökykyyn. Silmiin liittyvät haittavaikutukset (ks. kohta Haittavaikutukset) voivat heikentää näkemistä. Jos näköhäiriöitä ilmenee, potilaan ei pidä ajaa tai käyttää koneita ennen kuin häiriöt ovat loppuneet.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Vaikutustapansa perusteella nitisinoni suurentaa tyrosiinipitoisuuksia kaikilla nitisinonihoitoa saavilla potilailla. Täten suurentuneisiin tyrosiinipitoisuuksiin liittyvät silmähaittavaikutukset, kuten konjunktiviitti, sarveiskalvon samentuma, keratiitti, valonarkuus ja silmäkipu, ovat yleisiä sekä HT-1- että AKU-potilailla. HT-1-potilailla muita yleisiä haittavaikutuksia ovat mm. trombosytopenia, leukopenia ja granulosytopenia. Eksfoliatiivista dermatiittia saattaa esiintyä melko harvinaisesti.
Haittavaikutustaulukko
Haittavaikutukset on lueteltu alla MedDRA-elinjärjestelmän ja absoluuttisen esiintymistiheyden mukaan ja ne perustuvat HT-1- ja AKU-potilailla tehtyihin kliinisiin tutkimuksiin ja HT-1-potilaista saatuihin markkinoilletulon jälkeisen käytön tietoihin. Esiintymistiheydet määritellään seuraavasti: hyvin yleinen (≥1/10), yleinen (≥1/100, <1/10), melko harvinainen (≥1/1 000, <1/100), harvinainen (≥1/10 000, <1/1 000), hyvin harvinainen (<1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä arviointiin). Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
MedDRA-elinjärjestelmä | Esiintymistiheys HT-1-potilailla | Esiintymistiheys AKU-potilailla1 | Haittavaikutus |
Infektiot | Yleinen | Keuhkoputkitulehdus, keuhkokuume | |
Veri ja imukudos | Yleinen | Trombosytopenia, leukopenia, granulosytopenia | |
Melko harvinainen | Leukosytoosi | ||
Silmät | Yleinen | Konjunktiviitti, sarveiskalvon samentuma, keratiitti, valonarkuus | |
Hyvin yleinen2 | Keratopatia | ||
Yleinen | Hyvin yleinen2 | Silmäkipu | |
Melko harvinainen | Luomitulehdus | ||
Iho ja ihonalainen kudos | Melko harvinainen | Eksfoliatiivinen dermatiitti, punoittava ihottuma | |
Melko harvinainen | Yleinen | Kutina, ihottuma | |
Tutkimukset | Hyvin yleinen | Hyvin yleinen | Suurentunut tyrosiinipitoisuus |
1Esiintymistiheys perustuu yhteen AKU-potilailla tehtyyn kliiniseen tutkimukseen.
2Suurentuneeseen tyrosiinipitoisuuteen liittyy silmiin kohdistuvia haittavaikutuksia. Tyrosiinin ja fenyylialaniinin määrää AKU-tutkimukseen osallistuneiden potilaiden ruokavaliossa ei rajoitettu.
Valikoitujen haittatapahtumien kuvaus
Nitisinonihoito suurentaa tyrosiinipitoisuuksia. Tyrosiinitason nousun on nähty liittyvän silmiin liittyviä haittavaikutuksia, kuten sarveiskalvon samentumiin ja hyperkeratoottisiin leesioihin HT-1- ja AKU-potilailla. Tyrosiinin ja fenyylialaniinin rajoituksen ruokavaliossa pitäisi torjua tämäntyyppiseen tyrosinemiaan liittyviä toksisia vaikutuksia pienentämällä tyrosiinipitoisuutta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Kliinisissä HT-1-tutkimuksissa granulosytopenia oli vain melko harvoin vaikea (< 0,5 x 109/l) eikä siihen liittynyt infektioita. MedDRA-elinjärjestelmäluokkaan ”veri ja imukudos” liittyvät haittavaikutukset hävisivät nitisinonihoitoa jatkettaessa.
Pediatriset potilaat
Turvallisuusprofiili HT-1-potilailla perustuu pääasiassa pediatrisiin potilaisiin, sillä nitisinonihoito on aloitettava mahdollisimman pian perinnöllisen tyypin I tyrosinemian toteamisen jälkeen. Kliinisen tutkimuksen ja markkinoilletulon jälkeisten tietojen perusteella ei ole viitteitä siitä, että turvallisuusprofiili olisi erilainen pediatristen potilaiden eri alaryhmillä tai erilainen kuin aikuisilla.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista kansallisen ilmoitusjärjestelmän kautta.
Suomi/Finland
[Finnish]
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
[Swedish]
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Yliannostus
Jos normaalia ruokavaliota (ilman tyrosiini- ja fenyylialaniinirajoitusta) noudattava henkilö ottaa vahingossa nitisinonia, tyrosiinipitoisuus suurenee. Tyrosiinipitoisuuden suurenemiseen on liittynyt silmiin, ihoon ja hermostoon kohdistuvia toksisia vaikutuksia. Ruokavalion tyrosiini- ja fenyylialaniinirajoituksen pitäisi rajoittaa tämäntyyppiseen tyrosinemiaan liittyviä toksisia vaikutuksia. Erityistä yliannostuksen hoitoa koskevaa tietoa ei ole.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Muut ruuansulatuselimistön sairauksien ja aineenvaihduntasairauksien lääkkeet, ATC-koodi: A16A X04.
Vaikutusmekanismi
Nitisinoni on 4‑hydroksifenyylipyruvaattidioksigenaasin (tyrosiinimetabolian toinen vaihe) kilpaileva estäjä. Estämällä tyrosiinin normaalia kataboliaa HT‑1‑ ja AKU-potilailla nitisinoni estää haitallisten metaboliittien kumulaatiota 4‑hydroksifenyylipyruvaattidioksigenaasivaiheesta alkaen.
Biokemiallinen häiriö HT‑1:ssa on fumaryyliasetoasetaattihydrolaasin vajaus. Kyseinen entsyymi on tyrosiinikataboliareitin viimeinen entsyymi. Nitisinoni estää myrkyllisten välituotteiden eli maleyyliasetoasetaatin ja fumaryyliasetoasetaatin kumulaatiota. Muuten nämä välituotteet muuntuvat myrkyllisiksi metaboliiteiksi, sukkinyyliasetoniksi ja sukkinyyliasetoasetaatiksi. Sukkinyyliasetoni estää porfyriinisynteesireittiä, mikä johtaa 5‑aminolevulinaatin kumulaatioon.
Biokemiallinen häiriö AKU:ssa on homogentisaatti-1,2-dioksygenaasin (tyrosiinikataboliareitin kolmas entsyymi) vajaus. Nitisinoni estää haitallisen metaboliitin eli homogentisiinihapon (HGA) kumulaatiota, joka muuten johtaisi nivelten ja ruston okronoosiin ja taudin kliinisten piirteiden ilmaantumiseen.
Farmakodynaamiset vaikutukset
HT-1-potilailla nitisinonihoito normalisoi porfyriinimetabolian, punasolujen porfobilinogeenisynteesiaktiivisuuden ja virtsan 5‑aminolevulinaattipitoisuuden, vähentää sukkinyyliasetonin erittymistä virtsaan, suurentaa plasman tyrosiinipitoisuutta ja lisää fenolihappojen erittymistä virtsaan. Kliinisestä tutkimuksesta saadut tiedot osoittavat, että yli 90 %:lla potilaista virtsan sukkinyyliasetonipitoisuus normalisoitui ensimmäisellä hoitoviikolla. Virtsassa ja plasmassa ei pitäisi olla havaittavissa sukkinyyliasetonia, kun nitisinoniannos on sovitettu oikein.
AKU-potilailla nitisinonihoito vähentää HGA:n kumulaatiota. Kliinisestä tutkimuksesta saadut tiedot osoittavat, että virtsan HGA-pitoisuus pieneni 99,7 % ja seerumin HGA-pitoisuus 98,8 % kaksitoista kuukautta kestäneen nitisinonihoidon jälkeen verrattuna verrokkeihin, jotka eivät saaneet hoitoa.
Kliininen teho ja turvallisuus HT-1:n hoidossa
Kliininen tutkimus oli avoin ja kontrolloimaton. Tutkimuksessa käytettiin kahdesti vuorokaudessa ‑annostusta. Yhteenveto eloonjäämistodennäköisyydestä 2, 4 ja 6 vuoden nitisinonihoidon jälkeen on esitetty alla olevassa taulukossa.
NTBC-tutkimus (N=250) | |||
Ikä hoidon aloitushetkellä | 2 vuotta | 4 vuotta | 6 vuotta |
≤ 2 kk | 93 % | 93 % | 93 % |
≤ 6 kk | 93 % | 93 % | 93 % |
> 6 kk | 96 % | 95 % | 95 % |
Yhteensä | 94 % | 94 % | 94 % |
Historiallisena vertailukohteena käytetyssä tutkimuksessa (van Spronsen et al., 1994) eloonjäämistodennäköisyys oli alla esitetyn mukainen.
Ikä oireiden ilmetessä | 1 vuosi | 2 vuotta |
< 2 kk | 38 % | 29 % |
> 2‑6 kk | 74 % | 74 % |
> 6 kk | 96 % | 96 % |
Nitisinonihoidon todettiin myös pienentävän maksasyövän riskiä verrattuna aiempiin tietoihin pelkästä ruokavaliorajoitushoidosta. Lisäksi nitisinonihoidon varhaisen aloittamisen todettiin pienentävän maksasyövän riskiä edelleen.
Todennäköisyys, että maksasyöpää ei esiinny 2, 4 ja 6 vuoden kuluessa nitisinonihoidon aikana potilailla, jotka olivat hoidon alkaessa korkeintaan 24 kuukauden ikäisiä, sekä potilailla, jotka olivat hoidon alkaessa yli 24 kuukauden ikäisiä, on esitetty seuraavassa taulukossa:
NTBC-tutkimus (N=250) | |||||||
Potilaiden lukumäärä | Todennäköisyys, että maksasyöpää ei esiinny (95 %:n luottamusväli) | ||||||
alussa | 2 vuoden kohdalla | 4 vuoden kohdalla | 6 vuoden kohdalla | 2 vuoden kohdalla | 4 vuoden kohdalla | 6 vuoden kohdalla | |
Kaikki potilaat | 250 | 155 | 86 | 15 | 98 % (95; 100) | 94 % (90; 98) | 91 % (81; 100) |
Ikä hoidon alkaessa ≤24 kk | 193 | 114 | 61 | 8 | 99 % (98; 100) | 99 % (97; 100) | 99 % (94; 100) |
Ikä hoidon alkaessa >24 kk | 57 | 41 | 25 | 8 | 92 % (84; 100) | 82 % (70; 95) | 75 % (56; 95) |
Kansainvälisessä tutkimuksessa, jossa tyypin 1 tyrosinemiaa sairastavien potilaiden hoitona oli pelkästään ruokavaliorajoitus, ilmeni, että maksasyöpä oli diagnosoitu 18 %:lla kaikista 2-vuotiaista ja sitä vanhemmista potilaista.
19 HT‑1‑potilaalla suoritettiin tutkimus, jonka tarkoituksena oli arvioida kerran vuorokaudessa ‑annostuksen farmakokinetiikkaa, tehoa ja turvallisuutta verrattuna kahdesti vuorokaudessa ‑annostukseen. Kerran vuorokaudessa- ja kahdesti vuorokaudessa -annostusten haittavaikutuksissa tai muissa turvallisuusarvioissa ei havaittu kliinisesti merkitseviä eroja. Yhdelläkään potilaalla ei havaittu kerran vuorokaudessa -annostusjakson päättyessä virtsassa sukkinyyliasetonia (SA). Tutkimus osoittaa, että kerran vuorokaudessa ‑annostus on turvallinen ja tehokas kaikenikäisille potilaille. Tietoja potilaista, joiden kehon paino on <20 kg, on kuitenkin vähän.
Kliininen teho ja turvallisuus AKU:n hoidossa
Nitisinonin teho ja turvallisuus aikuisten AKU-potilaiden hoidossa annoksena 10 mg kerran vuorokaudessa on osoitettu satunnaistetussa, arvioijan suhteen sokkoutetussa, hoidottomuudella kontrolloidussa, rinnakkaisryhmällä tehdyssä, 48 kuukautta kestäneessä tutkimuksessa 138 potilaalla (joista 69 sai nitisinonihoitoa). Ensisijaisena päätetapahtumana oli vaikutus virtsan HGA-pitoisuuksiin, joissa todettiin 99,7 %:n vähenemä 12 kuukautta kestäneen nitisinonihoidon jälkeen verrattuna verrokkeihin, jotka eivät saaneet hoitoa. Nitisinonihoidolla osoitettiin tilastollisesti merkitsevä myönteinen vaikutus cAKUSSI-pisteisiin, silmien pigmentaatioon, korvien pigmentaatioon, lonkan osteopeniaan ja useisiin selkärangan kipualueisiin verrattuna verrokkeihin, jotka eivät saaneet hoitoa. cAKUSSI-pisteisiin sisältyvät silmien ja korvien pigmentaatio, munuais- ja eturauhaskivet, aorttastenoosi, osteopenia, luunmurtumat, jänteiden/nivelsiteiden/lihasten repeämät, kyfoosi, skolioosi, tekonivelleikkaukset ja muut AKU:n ilmenemismuodot. Nitisinonihoitoa saaneilla potilailla todettu HGA-pitoisuuksien lasku siis vähensi okronoottista prosessia ja taudin kliinisiä ilmentymiä ja hidasti siten taudin etenemistä.
Hoitamattomiin potilaisiin verrattuna nitisinonihoitoa saaneilla potilailla ilmoitettiin enemmän silmiin liittyviä tapahtumia, kuten keratopatiaa ja silmäkipua, infektioita, päänsärkyä ja painonnousua. Keratopatia johti hoidon tilapäiseen tai pysyvään lopettamiseen 14 %:lla nitisinonihoitoa saaneista potilaista, mutta tila korjaantui nitisinonihoidon lopettamisen jälkeen.
Yli 70-vuotiaista potilaista ei ole saatavilla tietoa.
Farmakokinetiikka
Nitisinonin imeytymistä, jakautumista, metaboliaa ja eliminaatiota ei ole tutkittu muodollisissa tutkimuksissa. Kun 10 terveelle miespuoliselle koehenkilölle annettiin kerta-annos nitisinonikapseleita (1 mg/kg), nitisinonin terminaalisen puoliintumisajan mediaani plasmassa oli 54 tuntia (vaihteluväli 39–86 tuntia). Populaatiofarmakokinetiikan analyysi on tehty 207 HT‑1‑potilaan ryhmällä. Puhdistumaksi määritettiin 0,0956 l/kg/vrk ja puoliintumisajaksi 52,1 tuntia.
In vitro -tutkimuksissa, joissa käytettiin ihmisen maksan mikrosomeja ja cDNA:ta ilmentäviä P450‑entsyymejä, todettiin vähäistä CYP 3A4‑välitteistä metaboliaa.
Eräästä kliinisestä yhteisvaikutustutkimuksesta saatujen, 80 mg:n nitisinonia vakaassa tilassa koskevien tietojen perusteella nitisinoni aiheutti tolbutamidin, joka on CYP2C9:n substraatti, AUC∞‑arvon 2,3‑kertaisen nousun, mikä viittaa nitisinonin olevan kohtalainen CYP2C9:n estäjä. Nitisinoni aiheutti noin 30 %:n laskun klooritsoksatsonin AUC∞‑arvoon, mikä viittaa sen olevan heikko CYP2E1:n induktori. Nitisinoni ei estä CYP2D6‑entsyymiä, koska nitisinonin antamisella ei ollut vaikutusta metoprololin AUC∞‑arvoon. Furosemidin AUC-arvo∞ nousi 1,7‑kertaiseksi, mikä viittaa OAT1/OAT3‑proteiinin heikkoon estämiseen (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset).
In vitro -tutkimusten perusteella nitisinoni ei todennäköisesti estä CYP1A2-, 2C19- tai 3A4‑välitteistä metaboliaa eikä todennäköisesti indusoi CYP1A2-, 2B6- tai 3A4/5‑proteiineja. Nitisinoni ei todennäköisesti estä P‑gp-, BCRP- tai OCT2‑välitteistä kuljetusta. Hoitotilanteessa saavutettu nitisinonin pitoisuus plasmassa ei todennäköisesti estä OATP1B1-, OATP1B3‑välitteistä kuljetusta.
Prekliiniset tiedot turvallisuudesta
Nitisinonin on havaittu aiheuttavan alkio- ja sikiötoksisuutta hiirillä ja kaneilla kliinisesti merkittävillä annoksilla. Kaneilla nitisinoni aiheutti annokseen liittyvää epämuodostumien (napatyrä ja vatsahalkio) lisääntymistä, kun annos oli vähintään 2,5‑kertainen verrattuna ihmisen suurimpaan suositeltuun annokseen (2 mg/kg/vrk).
Pre- ja postnataalista kehitystä koskevassa tutkimuksessa hiirillä poikasten elossaolo heikentyi ja poikasten kasvu hidastui vieroitusaikana tilastollisesti merkitsevästi annoksen ollessa ennen syntymää 125‑kertainen ja syntymän jälkeen 25‑kertainen verrattuna ihmisen suurimpaan suositeltuun annokseen. Negatiivinen vaikutus poikasten elossaoloon alkoi suuntauksenomaisesti annoksella 5 mg/kg/vrk. Rotilla altistus maidon kautta aiheutti poikasten keskipainon laskua ja sarveiskalvoleesioita.
In vitro -tutkimuksissa ei havaittu mutageenista vaikutusta, mutta heikko klastogeeninen vaikutus havaittiin. Genotoksisuudesta ei saatu näyttöä in vivo (hiiren pikkutumakoe ja hiiren maksan odottamatonta DNA-synteesiä koskeva koe). Nitisinoni ei osoittautnut karsinogeeniseksi 26 viikon karsinogeenisuustutkimuksessa siirtogeenisillä hiirillä (TgrasH2).
Farmaseuttiset tiedot
Apuaineet
Hydroksipropyylimetyyliselluloosa
Glyseroli
Polysorbaatti 80
Natriumbentsoaatti (E211)
Sitruunahappomonohydraatti
Natriumsitraatti
Mansikka-aromi (keinotekoinen)
Puhdistettu vesi
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta.
Avaamisen jälkeen käytönaikainen stabiiliusaika on yksi 2 kuukauden jakso enintään 25 °C:n lämpötilassa, minkä jälkeen se on hävitettävä.
Säilytys
Säilytä jääkaapissa (2 °C – 8 °C). Ei saa jäätyä.
Säilytä pystyasennossa.
Avatun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
ORFADIN oraalisuspensio
4 mg/ml (L:ei) 90 ml (1927,05 €)
PF-selosteen tieto
100 ml:n ruskea lasipullo (tyyppi III), jossa on valkoinen HDPE-turvakierrekorkki, jossa avaamattomuuden osoittava sinetti. Yksi pullo sisältää 90 ml oraalisuspensiota.
Yksi pakkaus sisältää yhden pullon, yhden LDPE-pulloadapterin ja 3 polypropyleenistä (PP) valmistettua mittaruiskua (1,5 ml, 3 ml ja 6 ml).
Valmisteen kuvaus:
Valkoinen, hieman viskoosi, läpinäkymätön suspensio.
Käyttö- ja käsittelyohjeet
Voimakkaasti ravistamalla tehtävä dispergointi on tarpeen ennen jokaista käyttökertaa. Ennen dispergointia tämä lääkevalmiste saattaa näyttää kiinteältä paakulta, jossa on hieman opalisoiva supernatantti. Annos vedetään ruiskuun ja annetaan välittömästi dispergoinnin jälkeen. On tärkeää noudattaa alla annettuja annoksen valmistus- ja anto-ohjeita huolellisesti annostuksen tarkkuuden varmistamiseksi.
Pakkaus sisältää kolme mittaruiskua (1,5 ml, 3 ml ja 6 ml) lääkärin määräämän annoksen tarkkaa mittaamista varten. On suositeltavaa, että terveydenhuollon ammattilainen neuvoo potilasta tai hoitajaa mittaruiskujen käytössä, jotta lääkettä annetaan varmasti oikea määrä.
Uuden lääkepullon käyttöönoton valmistelu ensimmäistä käyttökertaa varten:
Ennen ensimmäisen annoksen ottamista pulloa on ravistettava voimakkaasti, koska pitkäkestoisen säilytyksen aikana hiukkaset muodostavat kiinteän paakun pullon pohjalle.
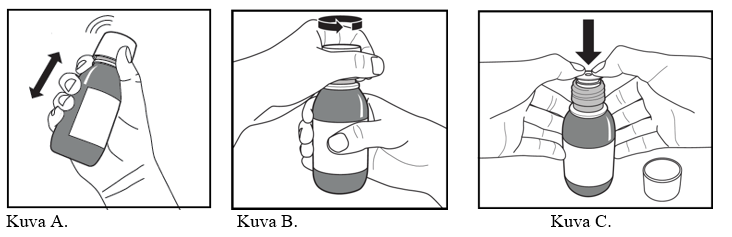
- Pullo otetaan jääkaapista ja pullon etikettiin merkitään päivämäärä, jolloin pullo otettiin jääkaapista.
- Pulloa ravistetaan voimakkaasti vähintään 20 sekunnin ajan kunnes kiinteä paakku pullon pohjalta on täysin hajonnut (kuva A).
- Turvakierrekorkki poistetaan painamalla sitä lujasti alaspäin ja kääntämällä sitä vastapäivään (kuva B).
- Avattu pullo asetetaan pystyasentoon pöydälle. Muovinen adapteri painetaan tiukasti mahdollisimman pitkälle pullon kaulaan (kuva C) ja pullo suljetaan turvakierrekorkilla.
Katso annosteluohjeet seuraavasta kohdasta ”Lääkeannoksen valmistelu”
Lääkeannoksen valmistelu
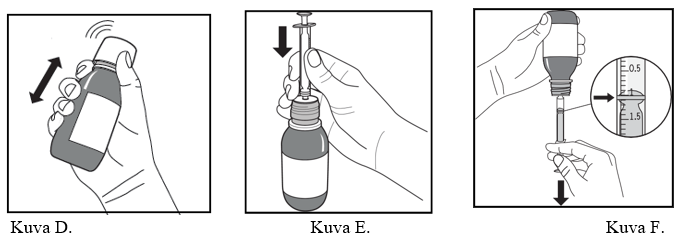
- Pulloa ravistetaan voimakkaasti vähintään 5 sekunnin ajan (kuva D).
- Pullo avataan välittömästi tämän jälkeen poistamalla turvakierrekorkki.
- Mittaruiskun sisällä oleva mäntä painetaan kokonaan pohjaan.
- Pullo pidetään pystyasennossa ja mittaruisku työnnetään tiukasti pullonsuussa olevan adapterin reikään (kuva E).
- Pullo käännetään varovasti ylösalaisin, kun mittaruisku on paikoillaan (kuva F).
- Lääkärin määräämä annos (ml) vedetään mittaruiskuun vetämällä mäntää hitaasti alaspäin, kunnes männän yläreuna on samalla tasolla annosta osoittavan viivan kanssa (kuva F). Jos täytetyn ruiskun sisällä näkyy ilmakuplia, mäntää on painettava takaisin ylös, kunnes ilmakuplat häviävät. Mäntä vedetään tämän jälkeen uudelleen alas, kunnes yläreuna on samalla tasolla annosta osoittavan viivan kanssa.
- Pullo käännetään uudelleen pystyasentoon. Mittaruisku irrotetaan vääntämällä se varovasti irti pullosta.
- Annos on annettava suuhun välittömästi (laimentamatta), jotta mittaruiskuun ei muodostu paakkuja. Mittaruisku on tyhjennettävä hitaasti, jotta nieleminen on mahdollista. Nopea lääkkeen ruiskuttaminen voi aiheuttaa tukehtumisen.
- Turvakierrekorkki on asetettava takaisin heti käytön jälkeen. Pullon adapteria ei saa poistaa.
- Pulloa voidaan säilyttää korkeintaan 25°C:n lämmössä tai jääkaapissa.
Puhdistus
Mittaruisku puhdistetaan heti pelkällä kylmällä hanavedellä ja tarpeen mukaan mäntää painamalla ja vetämällä. Ylimääräinen vesi ravistetaan pois ja mittaruisku jätetään kuivumaan seuraavaa antokertaa varten. Älä irrota mittaruiskun osia toisistaan.
Hävittäminen
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
ORFADIN oraalisuspensio
4 mg/ml 90 ml
- Ylempi erityiskorvaus (100 %). Synnynnäiset aineenvaihduntahäiriöt (124).
- Peruskorvaus (40 %).
ATC-koodi
A16AX04
Valmisteyhteenvedon muuttamispäivämäärä
03.07.2025
Yhteystiedot
Äyritie 18
01510 Vantaa
0201 558 840
www.sobi.fi
mail.fi@sobi.com
