BEVESPI AEROSPHERE inhalaatiosumute, suspensio 7,2/5 mikrog
Vaikuttavat aineet ja niiden määrät
Yksi kerta-annos (suukappaleesta vapautuva annos) sisältää 9 mikrogrammaa glykopyrroniumbromidia, mikä vastaa 7,2:ta mikrogrammaa glykopyrroniumia, ja 5 mikrogrammaa formoterolifumaraattidihydraattia.
Tämän mukainen mitattu annos (eli venttiilistä vapautuva annos) on 10,4 mikrogrammaa glykopyrroniumbromidia, mikä vastaa 8,3:a mikrogrammaa glykopyrroniumia, ja 5,8 mikrogrammaa formoterolifumaraattidihydraattia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Inhalaatiosumute, suspensio (inhalaatiosumute)
Kliiniset tiedot
Käyttöaiheet
Bevespi Aerosphere on tarkoitettu keuhkoputkia laajentavana ylläpitohoitona lievittämään keuhkoahtaumatautia sairastavien aikuisten potilaiden oireita (ks. kohta Farmakodynamiikka).
Annostus ja antotapa
Annostus
Suositeltu annos on kaksi inhalaatiota kaksi kertaa vuorokaudessa (kaksi inhalaatiota aamulla ja kaksi inhalaatiota illalla).
Potilaille on kerrottava, että heidän ei pidä ottaa enempää kuin 2 inhalaatiota kaksi kertaa vuorokaudessa.
Jos annos jää väliin, se on otettava mahdollisimman pian, ja seuraava annos otetaan tavanomaiseen aikaan. Unohtuneen annoksen korvaamiseksi ei pidä ottaa kaksinkertaista annosta.
Erityisryhmät
Iäkkäät
Annoksen muuttaminen ei ole tarpeen iäkkäillä potilailla (ks. kohta Farmakokinetiikka).
Munuaisten vajaatoiminta
Bevespi Aerosphere -valmistetta voidaan käyttää suositusannoksella potilaille, joilla on lievä tai kohtalainen munuaisten vajaatoiminta. Jos potilaalla on vaikea munuaisten vajaatoiminta tai dialyysihoitoa edellyttävä loppuvaiheen munuaissairaus, valmistetta saa käyttää vain, jos odotettavissa oleva hyöty arvioidaan suuremmaksi kuin mahdollinen riski (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Maksan vajaatoiminta
Bevespi Aerosphere -valmistetta voidaan käyttää suositusannoksella potilaille, joilla on lievä tai kohtalainen maksan vajaatoiminta. Bevespi Aerosphere -valmisteen käytöstä vaikeaa maksan vajaatoimintaa sairastaville potilaille ei ole asiaankuuluvaa tietoa, ja lääkevalmisteen käytössä tällaisille potilaille on noudatettava varovaisuutta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet ja kohta Farmakokinetiikka).
Pediatriset potilaat
Ei ole asianmukaista käyttää Bevespi Aerosphere -valmistetta lapsille ja nuorille (alle 18-vuotiaille) keuhkoahtaumataudin hoitoon.
Antotapa
Inhalaatioon.
Käyttöohjeet
Bevespi Aerosphere -inhalaattorin painalluksen yhteydessä painepakkauksesta vapautuu tietty määrä suspensiota suurella nopeudella. Kun potilas hengittää sisään suukappaleen kautta samaan aikaan painalluksen kanssa, lääkeaine kulkeutuu sisään hengitetyn ilman mukana hengitysteihin.
Huom.: Potilaille on neuvottava oikea inhalointitekniikka. On tärkeää, että potilasta kehotetaan
- lukemaan huolellisesti käyttöohjeet pakkausselosteesta, joka toimitetaan jokaisen inhalaattorin mukana
- olemaan käyttämättä inhalaattoria, jos foliopussin sisällä oleva kuivausainepakkaus on vuotanut
- valmistelemaan inhalaattori käyttökuntoon ravistamalla sitä ja tekemällä neljä painallusta ilmaan ennen ensimmäistä käyttöä tai kaksi painallusta, kun inhalaattoria ei ole käytetty yli seitsemään päivään, kun se on altistunut kylmälle tai kun se on pudonnut.
Painallus täytyy ajoittaa samaan aikaan sisäänhengityksen kanssa, jotta vaikuttavia aineita pääsee riittävästi keuhkoihin.
Jos potilaan on vaikeaa ajoittaa painallusta samaan aikaan sisäänhengityksen kanssa, Bevespi Aerosphere -annoksen saamisen varmistamiseen voidaan käyttää tilajatketta. Yhteensopivuus Aerochamber Plus Flow-Vu -tilajatkeen kanssa on osoitettu (ks. kohta Farmakokinetiikka).
Vasta-aiheet
Yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Ei akuuttihoitoon
Bevespi Aerosphere ‑valmistetta ei ole tarkoitettu akuuttien bronkospasmiepisodien hoitoon eli oirelääkkeeksi.
Astma
Bevespi Aerosphere -valmistetta ei pidä käyttää astman hoitoon.
Paradoksaalinen bronkospasmi
Muiden inhalaatiohoitojen tavoin tämänkin lääkevalmisteen anto saattaa aiheuttaa paradoksaalisen bronkospasmin, joka voi olla hengenvaarallinen. Jos potilaalle kehittyy paradoksaalinen bronkospasmi, lääkevalmisteen käyttö on lopetettava ja on harkittava muita hoitoja.
Kardiovaskulaariset vaikutukset
Muskariinireseptorin antagonistien ja sympatomimeettien, kuten glykopyrroniumin tai formoterolin, antamisen jälkeen saatetaan havaita kardiovaskulaarisia vaikutuksia, kuten rytmihäiriöitä, esimerkiksi eteisvärinää ja takykardiaa. Kliinisistä tutkimuksista suljettiin pois potilaat, joilla oli kliinisesti merkityksellinen sydän- ja verisuonitauti, joka ei ollut hoitotasapainossa. Bevespi Aerosphere -valmisteen käytössä on noudatettava varovaisuutta, jos potilaalla on vaikea sydän- ja verisuonitauti, kuten iskeeminen sydänsairaus, takyarytmiaa tai vaikea sydämen vajaatoiminta.
Varovaisuutta on noudatettava myös potilailla, joilla on tyreotoksikoosi tai joilla QTc-ajan tiedetään tai epäillään olevan pidentynyt (ks. kohta Yhteisvaikutukset).
Hypokalemia
Beeta2-agonistit saattavat aiheuttaa merkittävän hypokalemian, joka saattaa suurentaa rytmihäiriöalttiutta. Seerumin kaliumpitoisuuden pieneneminen on yleensä tilapäistä eikä edellytä kaliumlisän käyttöä. Vaikeaa keuhkoahtaumatautia sairastavilla potilailla hypoksia ja samanaikainen hoito saattavat voimistaa hypokalemiaa (ks. kohta Yhteisvaikutukset).
Hyperglykemia
Suurten beeta2-agonistiannosten inhalaatio saattaa suurentaa plasman glukoosiarvoja.
Antikolinerginen vaikutus
Antikolinergisen vaikutuksensa vuoksi Bevespi Aerosphere -valmisteen käytössä on noudatettava varovaisuutta, jos potilaalla on todettu oireinen eturauhasen liikakasvu, virtsaretentio tai ahdaskulmaglaukooma (ks. kohta Haittavaikutukset).
Vaikeaa munuaisten vajaatoimintaa sairastavat potilaat
Glykopyrronium erittyy pääasiassa munuaisten kautta, joten vaikeaa munuaisten vajaatoimintaa (kreatiniinipuhdistuma < 30 ml/min) sairastaville potilaille, mukaan lukien potilaat, joilla on dialyysihoitoa edellyttävä loppuvaiheen munuaissairaus, saa käyttää Bevespi Aerosphere -valmistetta vain, jos odotettavissa oleva hyöty arvioidaan suuremmaksi kuin mahdollinen riski (ks. kohta Farmakokinetiikka).
Vaikeaa maksan vajaatoimintaa sairastavat potilaat
Jos potilaalla on vaikea maksan vajaatoiminta, Bevespi Aerosphere -valmistetta saa käyttää vain, jos odotettavissa oleva hyöty arvioidaan suuremmaksi kuin mahdollinen riski (ks. kohta Farmakokinetiikka). Näitä potilaita on tarkkailtava mahdollisten haittavaikutusten varalta.
Yhteisvaikutukset
Farmakokineettiset yhteisvaikutukset
Bevespi Aerosphere -valmisteella ei ole tehty yhteisvaikutustutkimuksia, mutta in vitro ‑tutkimusten perusteella metabolisten yhteisvaikutusten todennäköisyyden katsotaan olevan pieni (ks. kohta Farmakokinetiikka).
Glykopyrronium poistuu pääasiassa munuaisten kautta, joten yhteisvaikutuksia saattaa ilmetä sellaisten lääkevalmisteiden kanssa, jotka vaikuttavat mekanismeihin, jotka liittyvät lääkeaineiden eritykseen munuaisten kautta. In vitro glykopyrronium on munuaisiin liittyvien OCT2- ja MATE1/2K-kuljettajaproteiinien substraatti. Simetidiini on OCT2:n ja MATE1:n estäjä, ja sen todettiin vaikuttavan inhalaationa annetun glykopyrroniumin jakautumiseen niin, että systeeminen kokonaisaltistus (AUC0-t) glykopyrroniumille suureni hieman (22 %) ja munuaispuhdistuma pieneni hieman (23 %) simetidiinin samanaikaisen käytön vuoksi.
Farmakodynaamiset yhteisvaikutukset
Muut antimuskariiniset ja sympatomimeettiset aineet
Bevespi Aerosphere -valmisteen samanaikaista käyttöä muiden antikolinergeja ja/tai pitkävaikutteisia beeta2-agonisteja sisältävien lääkevalmisteiden kanssa ei ole tutkittu eikä suositella, koska se saattaa voimistaa tunnettuja inhalaationa annettavien muskariiniantagonistien tai beeta2-agonistien haittavaikutuksia (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yliannostus).
Vaikka Bevespi Aerosphere -valmisteella ei ole tehty varsinaisia in vivo -yhteisvaikutustutkimuksia, kliinistä näyttöä yhteisvaikutuksista ei ole saatu tutkimuksista, joissa sitä on käytetty samanaikaisesti muiden keuhkoahtaumataudin hoitoon käytettävien lääkevalmisteiden kanssa, kuten lyhytvaikutteisten beeta2-adrenergisten bronkodilataattorien, metyyliksantiinien ja suun kautta ja inhalaationa annettavien steroidien kanssa.
Lääkkeen aiheuttama hypokalemia
Samanaikainen hoito metyyliksantiinijohdoksilla, steroideilla tai ei-kaliumia säästävillä diureeteilla saattaa voimistaa beeta2-agonistien mahdollista aluksi todettavaa hypokaleemista vaikutusta, joten niiden samanaikaisessa käytössä on noudatettava varovaisuutta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Beetasalpaajat
Beetasalpaajat (mukaan lukien silmätipat) voivat heikentää tai estää beeta2-agonistien, kuten formoterolin, vaikutusta. Sekä ei-selektiivisten että selektiivisten beetasalpaajien samanaikaista käyttöä on vältettävä, ellei niiden käyttöön ole pakottavia syitä. Jos on käytettävä beetasalpaajia (mukaan lukien silmätippoja), suositaan kardioselektiivisiä beetasalpaajia, mutta niidenkin käytössä on noudatettava varovaisuutta.
Muut farmakodynaamiset yhteisvaikutukset
Bevespi Aerosphere -valmisteen käytössä on noudatettava varovaisuutta, kun sitä annetaan potilaille, jotka saavat lääkevalmisteita, joiden tiedetään pidentävän QTc-aikaa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Raskaus ja imetys
Raskaus
Bevespi Aerosphere -valmisteen käytöstä raskaana oleville naisille ei ole olemassa tietoja.
Kerta-annostutkimuksissa ihmisillä todettiin, että hyvin pieni määrä glykopyrroniumia läpäisi veri-istukkaesteen. Eläimillä tehdyissä lisääntymistutkimuksissa formoteroli ja glykopyrronium erikseen ovat aiheuttaneet haittavaikutuksia hyvin suurilla annoksilla tai systeemisillä altistuksilla (ks. kohta Prekliiniset tiedot turvallisuudesta).
Bevespi Aerosphere -valmistetta saa käyttää raskauden aikana vain, jos odotettavissa olevat hyödyt ovat suuremmat kuin mahdolliset riskit.
Imetys
Ei tiedetä, erittyykö glykopyrronium tai formoteroli ihmisillä äidinmaitoon. Glykopyrroniumin ja formoterolin siirtymistä emon maitoon rotilla on raportoitu.
Bevespi Aerosphere -valmisteen käyttöä imettäville äideille voidaan harkita vain, jos hoidosta odotettavissa oleva hyöty äidille on suurempi kuin lapselle mahdollisesti koituva riski (ks. kohta Prekliiniset tiedot turvallisuudesta).
Hedelmällisyys
Rotilla tehdyissä tutkimuksissa osoitettiin hedelmällisyyteen liittyviä haittavaikutuksia vain annoksilla, jotka olivat suurempia kuin suurin formoterolialtistus ihmisillä (ks. kohta Prekliiniset tiedot turvallisuudesta). Glykopyrronium ei aiheuttanut hedelmällisyyteen liittyviä haittavaikutuksia rotilla. On epätodennäköistä, että suositellulla annoksella annettu Bevespi Aerosphere vaikuttaisi hedelmällisyyteen ihmisillä.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Bevespi Aerosphere -valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn. Huimaus ja pahoinvointi ovat kuitenkin yleisiä haittavaikutuksia, jotka on otettava huomioon ajettaessa tai koneita käytettäessä.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Haittavaikutusprofiilille ovat tyypillisiä antikolinergien ja beeta2-adrenergien luokkavaikutukset, jotka liittyvät yhdistelmän yksittäisiin vaikuttaviin aineisiin. Bevespi Aerosphere ‑valmistetta saaneilla potilailla yleisimmin ilmoitettuja haittavaikutuksia olivat päänsärky (1,9 %), pahoinvointi (1,4 %), lihaskouristukset (1,4 %) ja heitehuimaus (1,3 %).
Haittavaikutustaulukko
Haittavaikutustaulukko perustuu Bevespi Aerosphere -valmisteella kliinisissä tutkimuksissa ja myyntiluvan myöntämisen jälkeen saatuihin kokemuksiin sekä yksittäisistä vaikuttavista aineista ja vastaavista valmisteista saatuihin kokemuksiin.
Haittavaikutusten esiintymistiheydet on määritelty seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1 / 1 000, < 1/100), harvinainen (≥ 1 / 10 000, < 1 / 1 000), hyvin harvinainen (< 1 / 10 000) ja tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Taulukko 1 Haittavaikutukset esiintyvyyden ja elinjärjestelmän mukaan
| Elinjärjestelmä | Suositeltu termi | Esiintymistiheys |
| Immuunijärjestelmä | Yliherkkyysreaktiot, mukaan lukien ihottuma ja kutina | Melko harvinainen |
| Aineenvaihdunta ja ravitsemus | Hyperglykemia1 | Melko harvinainen |
| Psyykkiset häiriöt | Ahdistuneisuus | Yleinen |
| Agitaatio Levottomuus Unettomuus | Melko harvinainen | |
| Hermosto | Päänsärky1 Heitehuimaus | Yleinen |
| Vapina1 | Melko harvinainen | |
| Sydän | Takykardia Sydämentykytys Rytmihäiriöt (eteisvärinä, supraventrikulaarinen takykardia ja lisälyöntisyys) | Melko harvinainen |
| Ruoansulatuselimistö | Suun kuivuus2, pahoinvointi | Yleinen |
| Luusto, lihakset ja sidekudos | Lihaskouristukset1 | Yleinen |
| Munuaiset ja virtsatiet | Virtsatieinfektio | Yleinen |
| Virtsaretentio2 | Melko harvinainen | |
| Yleisoireet ja antopaikassa todettavat haitat | Rintakipu | Yleinen |
1 Haittavaikutus liittyy formoteroliin
2 Haittavaikutus liittyy glykopyrroniumiin
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Bevespi Aerosphere -valmisteen yliannostus saattaa voimistaa antikolinergisiä ja/tai beeta2-adrenergisiä merkkejä ja oireita, joista yleisimpiä ovat näön hämärtyminen, suun kuivuus, pahoinvointi, lihaskouristukset, vapina, päänsärky, sydämentykytys ja systolinen hypertensio.
Yliannostustapauksessa potilaalle on annettava asianmukaista tukihoitoa ja hänen tilaansa on seurattava tarpeen mukaan.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Obstruktiivisten hengitystiesairauksien lääkkeet, adrenergisten lääkeaineiden ja antikolinergien yhdistelmävalmisteet, ATC-koodi: R03AL07.
Vaikutusmekanismi
Bevespi Aerosphere sisältää kahta bronkodilataattoria: glykopyrroniumia, joka on pitkävaikutteinen muskariiniantagonisti (kutsutaan myös antikolinergiksi), ja formoterolia, joka on pitkävaikutteinen beeta2-agonisti, jonka vaikutus alkaa nopeasti.
Glykopyrroniumilla on samanlainen affiniteetti muskariinireseptorien eri alatyyppien M1–M5 suhteen. Hengitysteissä sen farmakologiset vaikutukset ilmenevät sileän lihaksen M3-reseptorin inhibitiona, joka johtaa bronkodilataatioon. Formoteroli aktivoi adenylaattisyklaasin, jolloin syklisen AMP:n määrä kasvaa, ja siten formoteroli saa aikaan hengitysteiden sileän lihaksen suoran relaksaation. Näiden eri vaikutusmekanismeilla toimivien lääkeaineiden yhdistelmällä on additiivinen teho verrattuna jommankumman lääkeaineen käyttöön yksinään.
Muskariinireseptorien ja beeta2-adrenergisten reseptorien tiheydet keuhkojen sentraalisissa ja perifeerisissä hengitysteissä ovat erilaiset, minkä seurauksena muskariiniantagonistit relaksoivat tehokkaammin sentraalisia hengitysteitä ja beeta2-agonistit relaksoivat tehokkaammin perifeerisiä hengitysteitä. Yhdistelmähoidolla saavutettavalla sekä sentraalisten että perifeeristen hengitysteiden relaksaatiolla saattaa olla suotuisia vaikutuksia keuhkojen toimintaan.
Farmakodynaamiset vaikutukset
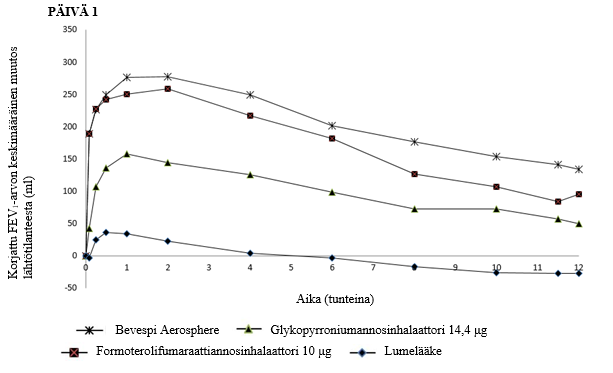
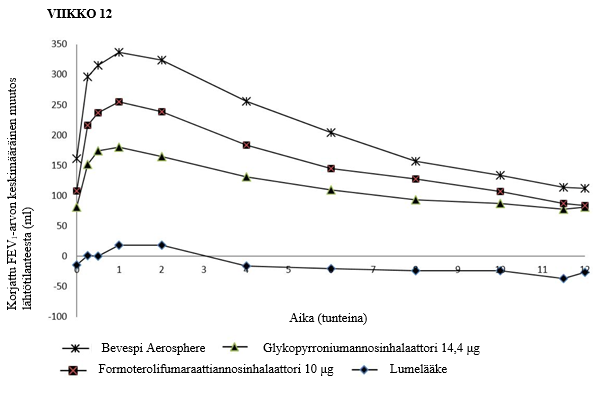
Kolmessa 24 viikon mittaisessa vaiheen III tutkimuksessa (PINNACLE 1, PINNACLE 2 ja PINNACLE 4) Bevespi Aerosphere paransi lumelääkkeeseen verrattuna keuhkojen toimintaa (mitattuna uloshengityksen sekuntikapasiteetin jäännöstilavuuden [jäännös-FEV1] arvolla aamulla ennen annoksen ottamista), ja vaikutuksen osoitettiin alkavan 5 minuutin kuluttua ensimmäisen annoksen saamisesta päivänä 1 (arvojen paraneminen lumelääkkeeseen verrattuna: PINNACLE 1, 187 ml, PINNACLE 2, 186 ml, ja PINNACLE 4, 179 ml) [p < 0,001]). PINNACLE 1 -tutkimuksessa päivänä 1 ja viikolla 12 tehtyjen FEV1-sarjamittauksien perusteella arvioitu keskimääräinen keuhkoputkia laajentava vaikutus on esitetty kuvassa 1. PINNACLE 2 -tutkimuksen tulokset olivat samankaltaisia kuin havaittiin PINNACLE 1 -tutkimuksessa.
Kuva 1 FEV1-arvon keskimääräinen muutos ajan funktiona päivänä 1 ja viikolla 12
Sydämen elektrofysiologia
Lume- ja aktiivikontrolloidussa (moksifloksasiini) 69 terveellä tutkittavalla tehdyssä kattavassa QT-tutkimuksessa ei osoitettu kliinisesti merkityksellistä vaikutusta QT-aikaan käyttämällä 10 ms:n kynnysarvoa. Suurin keskimääräinen (90 %:n luottamusvälin yläraja) ero lumelääkkeeseen nähden lähtötilanteen QT-ajassa ja yksilöllisesti korjatussa QT-ajassa oli 3,1 ms (4,7 ms) Bevespi Aerosphere -valmisteella (14,4/10 mikrogrammaa) ja 7,6 ms (9,2 ms) glykopyrroniumin ja formoterolin yhdistelmällä, kun glykopyrroniumin annos oli 8-kertainen ja formoterolin annos 4-kertainen suositusannokseen nähden.
Kliininen teho
Bevespi Aerosphere -valmisteen kliininen kehitysohjelma sisälsi kolme 24 viikon mittaista satunnaistettua, kaksoissokkoutettua, lumekontrolloitua, rinnakkaisryhmillä toteutettua keskeistä vaiheen III tutkimusta, joihin osallistui 5 433 potilasta, joilla oli keskivaikea, vaikea tai hyvin vaikea keuhkoahtaumatauti (PINNACLE 1, PINNACLE 2 ja PINNACLE 4).
Vaikutukset keuhkojen toimintaan
PINNACLE 1-, PINNACLE 2- ja PINNACLE 4 -tutkimuksissa osoitettiin, että Bevespi Aerosphere ‑valmiste paransi jäännös-FEV1-arvoja 24 viikon aikana lumelääkkeeseen, glykopyrroniumiin ja formoteroliin verrattuna (p < 0,0001) [ks. taulukko 2]. Keuhkoputkia laajentava vaikutus ei heikentynyt ajan myötä. Tutkimuksissa osoitettiin myös, että Bevespi Aerosphere ‑valmiste paransi FEV1-huippuarvoja 2 tunnin kuluessa annoksen saamisesta 24 viikon aikana verrattuna lumelääkkeeseen, glykopyrroniumiin ja formoteroliin (p < 0,0001) [ks. taulukko 2].
Pienimmät FEV1-arvot paranivat riippumatta iästä, sukupuolesta, hengitysteiden ahtautumisen asteesta, lähtötilanteen oireista, tupakoinnista tai inhalaationa otettavien kortikosteroidien käytöstä.
Oireisiin liittyvät tulokset
Hengästyminen
PINNACLE 1- ja PINNACLE 2 -tutkimuksissa osoitettiin, että Bevespi Aerosphere paransi tuloksia hengästyneisyyden suhteen, mikä osoitettiin SAC-dyspneaindeksin (Self-administered Computerised Transitional Dyspnoea Index) fokaalisella pistemäärällä 24 viikon aikana verrattuna lumelääkkeeseen ja glykopyrroniumiin (ks. taulukko 2). Tulosten havaittiin parantuneen formoteroliin verrattuna PINNACLE 2 -tutkimuksessa (ks. taulukko 2). PINNACLE 4 -tutkimuksessa osoitettiin, että Bevespi Aerosphere paransi tuloksia hengästyneisyyden suhteen, mikä osoitettiin dyspneaindeksin (Transitional Dyspnoea Index, TDI) fokaalisella pistemäärällä 24 viikon aikana verrattuna lumelääkkeeseen ja glykopyrroniumiin (ks. taulukko 2).
Terveyteen liittyvä elämänlaatu
PINNACLE 1-, PINNACLE 2- ja PINNACLE 4 -tutkimuksessa Bevespi Aerosphere -hoito paransi tautikohtaista terveyteen liittyvää elämänlaatua, minkä osoitti SGRQ-kyselyn (St. George’s Respiratory Questionnaire) kokonaispistemäärän pieneneminen 24 viikon aikana verrattuna lumelääkkeeseen ja glykopyrroniumiin (ks. taulukko 2). PINNACLE 1- ja PINNACLE 2 ‑tutkimuksissa tulosten todettiin parantuneen formoteroliin verrattuna.
Taulukko 2 Keuhkojen toimintaan, oireisiin ja terveyteen liittyvää elämänlaatua koskevat tulokset 24 viikon ajalta
Hoitovertailut Bevespi Aerosphere ‑valmisteen kanssa | Hoitojen välinen ero (95 %:n luottamusväli, p-arvo) | ||||
| FEV1-jäännösarvo (ml)a | FEV1-huippuarvo (ml) | SAC-TDI / TDI, fokaalinen pistemääräb | SGRQ-kokonaispiste-määrä | Päivittäinen Ventolin-oirelääkitys (inhalaatiota vuorokaudessa)c | |
| PINNACLE 1 | |||||
Bevespi Aerosphere (N = 526) verrattuna lumelääkkeeseen (N = 219) | 158 (132, 183) p < 0,0001 | 288 (259, 317) p < 0,0001# | 0,47 (0,21, 0,72) p = 0,0003 | -2,39 (-4,07, -0,71) p = 0,0053# | -1,08 (-1,43, -0,73) p < 0,0001# |
Bevespi Aerosphere (N = 526) verrattuna glykopyrroniumiin (N = 451) | 60 (39, 80) p < 0,0001 | 123 (100, 146) p < 0,0001# | 0,27 (0,07, 0,47) p = 0,0086# | -1,90 (-3,24, 0,57) p = 0,0052# | -0,26 (-0,53, 0,01) p = 0,0619 |
Bevespi Aerosphere (N = 526) verrattuna formoterolifumaraattiin (N = 449) | 64 (44, 84) p < 0,0001 | 81 (59, 104) p < 0,0001# | 0,16 (-0,03, 0,36) p = 0,1060 | -0,75 (-2,08, 0,57) p = 0,2640 | -0,01 (-0,27, 0,26) p = 0,9683 |
| PINNACLE 2 | |||||
Bevespi Aerosphere (N = 510) verrattuna lumelääkkeeseen (N = 223) | 129 (103, 155) p < 0,0001 | 278 (249, 308) p < 0,0001 | 0,33 (0,11, 0,56) p = 0,0041 | -1,66 (-3,34, 0,02) p = 0,0534 | -1,04 (-1,37, -0,72) p < 0,0001 |
Bevespi Aerosphere (N = 510) verrattuna glykopyrroniumiin (N = 439) | 55 (34, 76) p < 0,0001 | 129 (106, 153) p < 0,0001 | 0,21 (0,03, 0,40) p = 0,0199 | -1,28 (-2,62, 0,06) p = 0,0605 | -0,57 (-0,83, -0,31) p < 0,0001 |
Bevespi Aerosphere (N = 510) verrattuna formoterolifumaraattiin (N = 437) | 57 (36, 78) p < 0,0001 | 76 (52, 99) p < 0,0001 | 0,28 (0,10, 0,46) p = 0,0028 | -1,22 (-2,56, 0,13) p = 0,0760 | -0,29 (-0,55, -0,03) p = 0,0274# |
| PINNACLE 4 | |||||
Bevespi Aerosphere (N = 551) verrattuna lumelääkkeeseen (N = 235) | 155 (129, 180) p < 0,0001 | 293 (265, 321) p < 0,0001 | 0,80 (0,47, 1,13) p < 0,0001 | -3,50 (-5,18, -1,82) p < 0,0001 | -0,98 (-1,47, -0,49) p < 0,0001 |
Bevespi Aerosphere (N = 551) verrattuna glykopyrroniumiin (N = 474) | 55 (35, 76) p < 0,0001 | 141 (119, 163) p < 0,0001 | 0,33 (0,07, 0,59) p = 0,0125 | -1,62 (-2,94, -0,30) p = 0,0165 | -0,77 (-1,16, -0,38) p < 0,0001 |
Bevespi Aerosphere (N = 551) verrattuna formoterolifumaraattiin (N = 480) | 72 (52, 92) p < 0,0001 | 97 (75, 119) p < 0,0001 | 0,15 (-0,11, 0,41) p = 0,2530 | -0,27 (-1,59, 1,05) p = 0,6908 | -0,41 (-0,80, -0,03) p = 0,0345# |
N Hoitoaiepopulaation (ITT) potilaiden määrä
a Ensisijainen päätemuuttuja kaikissa tutkimuksissa
b PINNACLE 1- ja PINNACLE 2 -tutkimuksissa käytettiin SAC-TDI-indeksiä. PINNACLE 4 -tutkimuksessa käytettiin TDI-indeksiä. SAC-TDI oli ensisijainen päätemuuttuja vain PINNACLE 1- ja PINNACLE 2 -tutkimuksissa.
c Ventolin-oirelääkettä PINNACLE 4 -tutkimuksessa käyttäneestä populaatiosta
# Tässä tutkimuksessa käytettiin hierarkkista tilastollista koemenettelyä, ja tämä vertailu oli hierarkiassa alempana kuin vertailu, joka ei saavuttanut tilastollista merkitsevyyttä. Siksi tämän vertailun tilastollista merkitsevyyttä ei voida päätellä.
Keuhkoahtaumataudin pahenemisvaiheet
Yksittäisiä tutkimuksia ei ollut nimenomaisesti suunniteltu arvioimaan hoitojen vaikutusta keuhkoahtaumataudin pahenemisvaiheisiin, ja osallistuminen tutkimukseen keskeytettiin, jos potilaalla ilmeni vaikea pahenemisvaihe tai yli kaksi keskivaikeaa pahenemisvaihetta.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Bevespi Aerosphere -valmisteen käytöstä keuhkoahtaumataudin hoidossa kaikissa pediatrisissa potilasryhmissä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Kun glykopyrroniumin ja formoterolin yhdistelmää annettiin inhalaationa, kummankin lääkeaineen farmakokinetiikan todettiin olevan samanlainen kuin annettaessa vaikuttavia aineita erikseen. Näin ollen kumpaakin lääkeainetta voidaan tarkastella farmakokineettisiä tarkoituksia varten erikseen.
Tilajatkeen vaikutus
Bevespi Aerosphere -inhalaattorin käyttö Aerochamber Plus Flow-Vu -tilajatkeen kanssa keuhkoahtaumatautipotilaille suurensi systeemistä kokonaisaltistusta glykopyrroniumille (mittana AUC0-12) 16 %, mutta formoterolialtistus ei muuttunut.
Imeytyminen
Kun keuhkoahtaumatautia sairastaville tutkittaville annettiin Bevespi Aerosphere -valmistetta inhalaationa, glykopyrroniumin Cmax todettiin noin 5 minuutin kuluttua ja formoterolin Cmax 20−60 minuutin kuluttua. Vakaa tila saavutetaan 2–3 vuorokauden kuluessa Bevespi Aerosphere ‑valmistetta toistuvasti annettaessa, ja glykopyrroniumaltistus on noin 2,3 kertaa ja formoterolialtistus noin 1,5 kertaa suurempi kuin ensimmäisen annoksen antamisen jälkeen.
Bevespi Aerosphere -valmistetta koskenut terveillä vapaaehtoisilla tehty keuhkokertymätutkimus osoitti, että keskimäärin 38 % nimellisestä annoksesta kertyy keuhkoihin. Sekä sentraalista että perifeeristä kertymistä havaittiin.
Jakautuminen
Glykopyrronium
Populaatiofarmakokineettisen analyysin mukaan arvioitu glykopyrroniumin Vc/F (sentraalisen osan jakautumistilavuus) on 741 l ja Vp1/F (perifeeristen osien jakautumistilavuus) 2 990 l. Pitoisuusvälillä 2–500 nmol/l glykopyrronium sitoutui plasman proteiineihin 43–54-prosenttisesti.
Formoteroli
Populaatiofarmakokineettisen analyysin mukaan arvioitu formoterolin Vc/F (sentraalisen osan jakautumistilavuus) on 1 030 l ja Vp1/F (perifeeristen osien jakautumistilavuus) 647 l. Pitoisuusvälillä 10–500 nmol/l formoteroli sitoutui plasman proteiineihin 46–58-prosenttisesti.
Biotransformaatio
Glykopyrronium
Kirjallisuuden ja erään ihmisen maksasoluilla tehdyn in vitro -tutkimuksen perusteella metabolian merkitys glykopyrroniumin kokonaiseliminaatiossa on vähäinen. CYP 2D6:n on todettu olevan merkittävin glykopyrroniumin metaboliaan osallistuva entsyymi.
In vitro -tutkimukset osoittavat, että glykopyrronium ei ole minkään sytokromi P450:n alatyypin estäjä eikä entsyymien CYP 1A2, CYP 2B6 tai CYP 3A4 induktiota tapahdu.
Formoteroli
Formoteroli metaboloituu ensisijaisesti suoran glukuronidaation ja O-demetylaation kautta ja sen jälkeen konjugoitumalla inaktiivisiksi metaboliiteiksi. Toissijaisia metaboliareittejä ovat deformylaatio ja sulfaattikonjugaatio. CYP 2D6 ja CYP 2C on tunnistettu ensisijaisiksi O-demetylaatiosta vastaaviksi entsyymeiksi.
In vitro -tutkimukset osoittavat, että formoteroli ei estä sytokromi P450 -entsyymejä terapeuttisesti merkittävinä pitoisuuksina.
Eliminaatio
Kun radioaktiivisesti merkittyä glykopyrroniumia annettiin 0,2 mg:n annos laskimoon, 85 % annoksesta oli erittynyt virtsaan 48 tunnin kuluttua annoksen antamisesta. Lisäksi osa radioaktiivisuudesta erittyi sappinesteeseen. Suun kautta inhalaationa annetun glykopyrroniumin terminaalinen eliminaation puoliintumisaika oli populaatiofarmakokineettisen analyysin mukaan 15 tuntia.
Formoterolin eritystä tutkittiin kuudella terveellä tutkittavalla, joille annettiin radioaktiivisesti merkittyä formoterolia samanaikaisesti suun kautta tai laskimoon. Tässä tutkimuksessa 62 % radioaktiivisesti merkitystä formoterolista erittyi virtsaan ja 24 % poistui ulosteeseen. Suun kautta inhalaationa annetun formoterolin terminaalinen eliminaation puoliintumisaika oli populaatiofarmakokineettisen analyysin mukaan 13 tuntia.
Lineaarisuus/ei-lineaarisuus
Suun kautta inhalaatioina annetuilla glykopyrroniumilla (annosalue: 14,4–115,2 μg) ja formoterolilla (annosalue: 2,4–19,2 μg) havaittiin olevan lineaarinen farmakokinetiikka.
Erityisryhmät
Iäkkäät
Saatavilla olevan tiedon perusteella Bevespi Aerosphere -annostusta ei ole tarpeen muuttaa iäkkäillä potilailla.
Munuaisten vajaatoiminta
Ei ole tehty tutkimuksia, joissa arvioitaisiin munuaisten vajaatoiminnan vaikutusta glykopyrroniumin ja formoterolin farmakokinetiikkaan. Populaatiofarmakokineettisessä analyysissä arvioitiin munuaisten vajaatoiminnan vaikutusta glykopyrronium- ja formoterolialtistukseen enintään 12 viikon aikana. Glomerulusten laskennallisen suodatusnopeuden (eGFR) vaihteluväli oli 30–196 ml/min. Tämä vaihteluväli ulottuu keskivaikeasta munuaisten vajaatoiminnasta munuaisten normaaliin toimintaan. Systeeminen glykopyrroniumaltistus (AUC0-12) keuhkoahtaumatautia sairastavilla tutkittavilla, joilla on keskivaikea tai vaikea munuaisten vajaatoiminta (eGFR 30–45 ml/min), on noin 30 % suurempi kuin keuhkoahtaumatautia sairastavilla tutkittavalla, joilla munuaiset toimivat normaalisti (eGFR > 90 ml/min). Keuhkoahtaumatautia sairastavilla tutkittavilla, joiden paino on alhainen ja joilla on keskivaikea tai vaikea munuaisten vajaatoiminta, systeeminen glykopyrroniumaltistus saattaa olla suunnilleen kaksinkertainen. Munuaisten toiminnan ei todettu vaikuttavan formoterolialtistukseen.
Maksan vajaatoiminta
Maksan vajaatoimintaa sairastavilla potilailla ei ole tehty Bevespi Aerosphere -valmisteen farmakokinetiikkaa koskevia tutkimuksia. Formoteroli kuitenkin eliminoituu pääasiassa metaboloitumalla maksassa, joten altistuksen voidaan odottaa olevan suurempi vaikeaa maksan vajaatoimintaa sairastavilla potilailla. Glykopyrronium poistuu systeemisestä verenkierrosta pääasiassa erittymällä munuaisten kautta, joten maksan vajaatoiminnan ei odoteta johtavan vaaralliseen systeemiseen altistukseen.
Muut erityisryhmät
Glykopyrroniumin populaatiofarmakokineettinen analyysi tehtiin keuhkoahtaumatautia sairastavista yhteensä 311 tutkittavasta kerättyjen tietojen pohjalta. Glykopyrroniumin farmakokinetiikkaa kuvasi parhaiten kahden jakautumistilan malli, jossa imeytyminen noudatti ensimmäisen asteen kinetiikkaa ja eliminaatio oli lineaarista. Glykopyrroniumin tyypillinen puhdistuma (puhdistuma/hyötyosuus, CL/F) oli 124 l/h.
Formoterolin populaatiofarmakokineettinen analyysi tehtiin keuhkoahtaumatautia sairastavista yhteensä 437 tutkittavasta kerättyjen tietojen pohjalta. Formoterolin farmakokinetiikkaa kuvasi parhaiten kahden jakautumistilan malli, jossa imeytymisen nopeusvakio vastasi ensimmäisen asteen kinetiikkaa ja eliminaatio oli lineaarista. Glykopyrroniumin tyypillinen puhdistuma (puhdistuma/hyötyosuus, CL/F) oli 99 l/h.
Farmakokineettisiin parametreihin kohdistuvien iän, sukupuolen ja painon vaikutusten vuoksi glykopyrroniumin ja formoterolin annosten muuttaminen ei ole tarpeen.
Systeemisissä kokonaisaltistuksissa (AUC) kummallekaan yhdisteelle ei havaittu merkittäviä eroja terveiden japanilaisten ja länsimaisten tutkittavien välillä. Farmakokinetiikasta ei ole saatavilla riittävästi tietoja altistusten vertailemiseksi muilla etnisillä ryhmillä tai roduilla.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, genotoksisuutta ja karsinogeenisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Glykopyrroniumin ja formoterolin yhdistelmän käytön yhteydessä kokeissa havaitut toksiset vaikutukset liittyivät formoterolin farmakologisiin vaikutuksiin koirilla, kuten vaikutukset, jotka kohdistuivat lähinnä sydämeen ja verisuoniin, esimerkiksi hyperemia, takykardia, rytmihäiriöt ja sydänlihasvauriot. Nämä ovat tunnettuja farmakologisia ilmentymiä, joita havaitaan suurten beeta-agonistiannosten antamisen jälkeen. Mitään merkittäviä glykopyrroniumista johtuvia vaikutuksia ei havaittu.
Formoterolilla tehdyt eläinten lisääntymistutkimukset osoittivat, että suurella systeemisellä altistuksella urosrottien hedelmällisyys hieman heikentyi. Systeemisillä altistuksilla, jotka olivat huomattavasti suurempia kuin kliinisen käytön aikana on saavutettu, kiinnittyneitä alkioita irtosi ja varhainen postnataalinen eloonjäänti ja syntymäpaino vähenivät. Näiden eläinkokeiden tulosten merkitys ihmiselle on kuitenkin vähäinen. Kohtumyoomien ilmaantuvuuden havaittiin hieman suurentuneen formoterolia saaneilla rotilla ja hiirillä. Tämän katsotaan olevan luokkavaikutus, jota todetaan pitkäaikaisesti suurille beeta2-agonistiannoksille altistuneilla jyrsijöillä.
Glykopyrroniumilla tehdyt eläinten lisääntymistutkimukset osoittivat, että rottien ja kanien sikiöiden paino pieneni ja rottien jälkeläisillä havaittiin hidastunutta painonnousua ennen vieroitusta systeemisillä altistuksilla, jotka olivat huomattavasti suurempia kuin kliinisessä käytössä saavutettavat altistukset. Kahden vuoden pituisissa rotilla ja hiirillä tehdyissä tutkimuksissa ei havaittu näyttöä karsinogeenisuudesta.
Farmaseuttiset tiedot
Apuaineet
Norfluraani
1,2-distearoyyli-sn-glysero-3-fosfokoliini
Kalsiumkloridi
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
30 kuukautta
Käytettävä 3 kuukauden kuluessa pussin avaamisesta.
Säilytys
Säilytä alle 30 °C.
Ei saa altistaa yli 50 °C:n lämpötilalle.
Painepakkausta ei saa puhkaista.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
BEVESPI AEROSPHERE inhalaatiosumute, suspensio
7,2/5 mikrog (L:ei) 120 annosta (58,04 €), 3 x 120 annosta (162,04 €)
PF-selosteen tieto
Inhalaattori on paineistettu annosinhalaattori, joka sisältää alumiinipainepakkauksen ja siihen kiinnitetyn annoslaskurin sekä valkoisen muovikotelon ja suukappaleen, jossa on oranssi korkki. Inhalaattori on yksittäispakattu foliolaminaattipussiin, joka sisältää kuivausainepussin, ja pakattu pahvikoteloon.
Pakkauskoot:
Pakkaus, jossa on yksi 120 annosta sisältävä inhalaattori.
Monipakkaus, jossa on 360 annosta (kolme 120 annosta sisältävää inhalaattoria).
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Valkoinen suspensio.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Painepakkausta ei saa rikkoa, puhkaista eikä polttaa, vaikka se vaikuttaisi tyhjältä.
Korvattavuus
BEVESPI AEROSPHERE inhalaatiosumute, suspensio
7,2/5 mikrog 120 annosta, 3 x 120 annosta
- Alempi erityiskorvaus (65 %). Krooninen keuhkoastma ja sitä läheisesti muistuttavat krooniset obstruktiiviset keuhkosairaudet (203).
- Peruskorvaus (40 %).
ATC-koodi
R03AL07
Valmisteyhteenvedon muuttamispäivämäärä
02.12.2024
Yhteystiedot
Keilaranta 18
02150 Espoo
010 23 010
www.astrazeneca.fi
