ABASAGLAR 100 U/ml KWIKPEN injektioneste, liuos
Vaikuttavat aineet ja niiden määrät
Yksi ml sisältää 100 yksikköä glargininsuliinia* (vastaten 3,64 mg).
Yksi kynä sisältää 3 ml injektionestettä, joka vastaa 300 yksikköä.
* tuotettu yhdistelmä-DNA-tekniikalla Escherichia colia käyttäen.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, liuos (injektio)
Kliiniset tiedot
Käyttöaiheet
Aikuisten, nuorten sekä vähintään 2-vuotiaiden lasten diabetes mellituksen hoitoon.
Annostus ja antotapa
Annostus
ABASAGLAR sisältää glargininsuliinia, insuliinianalogia, ja sillä on pitkä vaikutusaika.
ABASAGLAR-insuliinia pistetään kerran vuorokaudessa mihin aikaan tahansa, mutta pistosajankohdan tulee olla sama joka päivä.
Annostus (annos ja sen ajoitus) tulee sovittaa yksilöllisesti. Tyypin 2 diabeetikoille ABASAGLAR-insuliinia voidaan käyttää myös yhdessä suun kautta otettavien diabeteslääkkeiden kanssa.
Tämän lääkevalmisteen vahvuus on ilmoitettu yksikköinä. Nämä yksiköt koskevat yksinomaan glargininsuliinia eivätkä vastaa kansainvälisiä yksikköjä (IU) tai muita insuliinianalogien vahvuutta ilmaisevia yksikköjä (ks. kohta Farmakodynamiikka).
Erityisryhmät
Iäkkäät potilaat (≥ 65-vuotiaat)
Ikääntymisen myötä heikkenevä munuaisten toiminta voi tasaisesti vähentää iäkkäiden potilaiden insuliinintarvetta.
Munuaisten vajaatoiminta
Potilaiden, joilla on munuaisten vajaatoiminta, insuliinintarve saattaa pienentyä insuliinin metabolian hidastumisesta johtuen.
Maksan vajaatoiminta
Potilaiden, joilla on maksan vajaatoiminta, insuliinintarve voi olla pienentynyt, koska heidän elimistönsä glukoneogeneesikapasiteetti on heikentynyt ja insuliinin metabolia hidastunut.
Pediatriset potilaat
Nuoret ja vähintään 2-vuotiaat lapset
Glargininsuliinin turvallisuus ja teho nuorilla ja vähintään 2-vuotiailla lapsilla on varmistettu (ks. kohta Farmakodynamiikka). Annostus (annos ja sen ajoitus) tulee sovittaa yksilöllisesti.
Alle 2-vuotiaat lapset
Glargininsuliinin turvallisuutta ja tehoa ei ole varmistettu. Tietoja ei ole saatavilla.
Vaihtaminen muista insuliineista ABASAGLAR-insuliiniin
Vaihdettaessa keskipitkävaikutteisesta tai pitkävaikutteisesta insuliinihoidosta ABASAGLAR-insuliinihoitoon, perusinsuliiniannosta sekä muuta meneillään olevaa diabeteslääkitystä voi olla tarpeen muuttaa (lyhytvaikutteisen insuliinin tai nopeavaikutteisen insuliinianalogin tai suun kautta otettavien diabeteslääkkeiden annos ja ajoitus).
Vaihtaminen kahdesti päivässä pistettävästä NPH-insuliinista ABASAGLAR-insuliiniin
Yöllä tai varhain aamulla esiintyvän hypoglykemian riskin vähentämiseksi tulee potilaiden, jotka vaihtavat perusinsuliininsa kahdesti päivässä pistettävästä NPH-insuliinista kerran päivässä pistettävään ABASAGLAR-insuliiniin, pienentää perusinsuliininsa annosta 20–30 % hoidon ensimmäisten viikkojen aikana.
Vaihtaminen 300 yksikköä/ml sisältävästä glargininsuliinista ABASAGLAR-insuliiniin
ABASAGLAR ja Toujeo (glargininsuliini 300 yksikköä/ml) eivät ole bioekvivalentteja eivätkä suoraan keskenään vaihtokelpoisia. Hypoglykemian riskin vähentämiseksi potilaiden, jotka vaihtavat perusinsuliininsa kerran päivässä pistettävästä 300 yksikköä/ml sisältävästä glargininsuliinista kerran päivässä pistettävään ABASAGLAR-insuliiniin, on pienennettävä annostaan 20 %:lla.
Ensimmäisten viikkojen aikana annosten pienentämistä tulisi ainakin osittain kompensoida aterian yhteydessä otettavalla insuliinilla. Tämän jälkeen annos tulee sovittaa yksilöllisesti.
Siirtymisen aikana ja heti sitä seuraavina viikkoina suositellaan hoitotasapainon huolellista seurantaa. Hoitotasapainon parantuessa ja sen seurauksena insuliiniherkkyyden lisääntyessä saattaa annoksen säätäminen edelleen olla tarpeen. Annoksen muuttaminen voi olla tarpeen, jos esimerkiksi potilaan paino tai elämäntyyli, insuliiniannoksen ajoitus tai muut olosuhteet muuttuvat siten, että hypo- tai hyperglykemia-alttius lisääntyy (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Insuliinivasta-aineiden vuoksi suuria insuliiniannoksia käyttävien potilaiden insuliinivaste voi parantua ABASAGLAR-insuliiniin siirryttäessä.
Antotapa
ABASAGLAR pistetään ihon alle.
ABASAGLAR-insuliinia ei saa antaa laskimoon. Glargininsuliinin vaikutusajan pituus riippuu sen pistämisestä ihonalaiskudokseen. Tavanomainen, ihon alle tarkoitettu annos voi aiheuttaa vaikean hypoglykemian annettuna laskimoon.
Seerumin insuliini- tai plasman verensokeripitoisuuksissa ei ole havaittu kliinisesti merkitseviä eroja pistettäessä glargininsuliinia vatsan, olkavarren tai reiden alueelle.
Pistoskohtia on vaihdeltava sovitun pistosalueen sisällä lipodystrofian ja ihoamyloidoosin vaaran pienentämiseksi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset).
ABASAGLAR-insuliinia ei saa sekoittaa muihin insuliineihin eikä laimentaa. Sekoittaminen tai laimentaminen voi muuttaa sen vaikutusaikaprofiilia, lisäksi sekoittaminen voi aiheuttaa saostumista.
Käsittelyä koskevat tarkemmat ohjeet, ks. kohta Käyttö- ja käsittelyohjeet.
Ennen ABASAGLAR injektionesteen, liuos esitäytetyssä kynässä käyttöönottoa pakkausselosteen käyttöohjeet tulee lukea huolellisesti (ks. kohta Erityiset varotoimet hävittämiselle ja muut käsittelyohjeet).
KwikPen
KwikPen-kynästä on rekisteröity kaksi mallia. Yksi kynä annostelee yhdellä injektiolla 1-60 yksikköä yhden yksikön välein ja toinen kynä annostelee yhdellä injektiolla 1-80 yksikköä yhden yksikön välein. Tarvittava annos valitaan yksiköissä. Yksiköiden määrä näkyy kynän annosikkunassa.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun lääkevalmisteen nimi ja eränumero dokumentoitava selkeästi.
Diabeettinen ketoasidoosi
ABASAGLAR ei ole ensisijainen insuliini diabeettisen ketoasidoosin hoidossa. Näissä tapauksissa suositellaan laskimoon annettavaa lyhytvaikutteista insuliinia.
Insuliinin tarve ja annosmuutokset
Verensokeritasapainon hallinnan ollessa riittämätön, tai kun potilaalla on taipumusta hyper- tai hypoglykemioihin, on ennen annoksen muuttamista tarkistettava, että potilas noudattaa hänelle määrättyä hoito-ohjelmaa pistoskohtien ja asianmukaisen pistostekniikan, samoin kuin kaikkien muiden asiaan liittyvien tekijöiden suhteen.
Siirtyminen toiseen insuliinityyppiin tai -valmisteeseen on toteutettava tarkassa lääkärin valvonnassa. Muutokset vahvuudessa, valmisteessa (valmistaja), tyypissä (lyhytvaikutteinen insuliini, NPH-ihmisinsuliini, eläininsuliini, pitkävaikutteinen insuliini jne.), alkuperässä (eläinperäinen, ihmisperäinen, ihmisinsuliinianalogi) ja/tai valmistusmenetelmässä voivat vaatia annoksen muuttamista.
Hypoglykemia
Hypoglykemian esiintymisajankohta riippuu käytettyjen insuliinien vaikutusprofiilista ja voi näin ollen muuttua hoito-ohjelmaa muutettaessa. Paremmin ylläpidetystä perusinsuliinin saannista johtuen glargininsuliinihoidossa voidaan odottaa vähemmän yöllisiä, mutta enemmän varhaiseen aamuun ajoittuvia hypoglykemioita.
Verensokerin seurantaa tulee tehostaa ja erityistä varovaisuutta noudattaa silloin, kun potilaan hypoglykemiakohtauksilla voi olla erityistä kliinistä merkitystä, esimerkiksi jos potilaalla on merkittävä sepelvaltimoiden tai aivoja huoltavien valtimoiden ahtauma (hypoglykemian aiheuttama sydän- tai aivokomplikaatioiden vaara) tai proliferatiivinen retinopatia, erityisesti silloin, jos häntä ei hoideta fotokoagulaatiolla (hypoglykemiaa seuraavan ohimenevän näönmenetyksen vaara).
Potilaiden tulee olla tietoisia tilanteista, joissa hypoglykemian varoitusoireet heikkenevät. Hypoglykemian varoitusoireet voivat muuttua, vähentyä tai puuttua eräissä riskiryhmissä, esim. seuraavissa tapauksissa:
- potilaan hoitotasapainon selvästi parannuttua
- hypoglykemia kehittyy vähitellen
- potilas on iäkäs
- siirryttäessä eläinperäisestä insuliinista ihmisinsuliiniin
- potilaalla on autonominen neuropatia
- potilaalla on ollut pitkään diabetes
- potilaalla on psykiatrinen sairaus
- potilas saa samanaikaisesti tiettyjä muita lääkkeitä (katso kohta Yhteisvaikutukset).
Tällaisissa tilanteissa voi seurata vaikea hypoglykemia (ja mahdollisesti tajunnan menetys), ennen kuin potilas tajuaa, että hänellä on hypoglykemia.
Ihon alle pistetyn glargininsuliinin pidentynyt vaikutuksen kesto saattaa viivästyttää hypoglykemiasta toipumista.
Jos glykohemoglobiini on viitealueella tai sen alapuolella, tulee toistuvien, havaitsemattomien (varsinkin yöllisten) hypoglykemioiden mahdollisuus ottaa huomioon.
Annos- ja ravitsemusohjeiden noudattaminen, oikea insuliinin annostelu ja hypoglykemiaoireiden tiedostaminen ovat oleellisia tekijöitä hypoglykemiariskin vähentämiseksi. Erityisen tarkkaa seurantaa ja mahdollisesti annoksen sovittamista vaativat hypoglykemia-alttiutta lisäävät tekijät, kuten:
- pistosalueen muutos
- insuliiniherkkyyden paraneminen (esim. stressitekijöiden poistumisesta johtuen)
- epätavallinen, lisääntynyt tai pitkäaikainen fyysinen rasitus
- muu sairaus (esim. oksentelu, ripuli)
- riittämätön ruokailu
- ruokailun jättäminen väliin
- alkoholinkäyttö
- tietyt hoitamattomat endokriiniset häiriöt (esim. kilpirauhasen ja aivolisäkkeen etulohkon tai lisämunuaisen kuoren vajaatoiminta)
- tiettyjen muiden lääkkeiden samanaikainen käyttö.
Pistostekniikka
Potilaita on ohjeistettava vuorottelemaan pistoskohtaa jatkuvasti lipodystrofian ja ihoamyloidoosin kehittymisen vaaran vähentämiseksi. Jos insuliinin pistämistä jatketaan niihin kohtiin, joilla esiintyy näitä muutoksia, on olemassa mahdollinen vaara, että insuliinin imeytyminen hidastuu ja verensokerin hallinta heikentyy. Injektiokohdan äkillisestä vaihtamisesta terveelle alueelle on ilmoitettu aiheutuvan hypoglykemiaa. Verensokerin seurantaa suositellaan pistoskohdan vaihtamisen jälkeen, ja diabeteslääkkeiden annoksen muuttamista voidaan harkita.
Muut sairaudet
Muu sairaus vaatii tehostettua hoitotasapainon seurantaa. Monissa tapauksissa ketoaineiden määritys virtsasta on aiheellista ja insuliiniannosta on usein muutettava. Insuliinin tarve usein lisääntyy. Tyypin 1 diabetesta sairastavien potilaiden tulee saada ainakin pieniä määriä hiilihydraatteja säännöllisesti, vaikka he eivät pystyisi juuri lainkaan syömään tai oksentelisivat jne., eikä insuliinia saa koskaan jättää kokonaan ottamatta.
Insuliinivasta-aineet
Insuliinin antaminen voi aiheuttaa insuliinivasta-aineiden muodostusta. Näiden insuliinivasta-aineiden esiintyminen voi harvoissa tapauksissa vaatia insuliiniannoksen säätämistä hyper- tai hypoglykemiataipumuksen korjaamiseksi (ks. kohta Farmakodynamiikka).
Lääkehoitoon liittyvät virheet
On raportoitu lääkehoitoon liittyviä virhetilanteita, joissa muita insuliineja, erityisesti lyhytvaikutteisia insuliineja, on vahingossa pistetty glargininsuliinin sijaan. Insuliinin etiketti on tarkistettava aina ennen pistämistä, jotta lääkitysvirheet ABASAGLAR esitäytetyn kynän sekä muiden insuliinien välillä vältetään.
ABASAGLARyhdistelmähoidossa pioglitatsonin kanssa
Sydämen vajaatoimintatapauksia on raportoitu esiintyneen, kun pioglitatsonia käytettiin yhdistelmähoitona insuliinin kanssa, erityisesti potilailla, joilla on riskitekijöitä sydämen vajaatoiminnan kehittymiseen. Tämä on pidettävä mielessä, jos harkitaan pioglitatsonin ja ABASAGLAR-insuliinin yhdistelmähoitoa. Jos tätä yhdistelmää käytetään, on potilailta seurattava sydämen vajaatoiminnan, painon nousun ja turvotuksen merkkejä ja oireita. Pioglitatsonin käyttö on lopetettava, jos ilmaantuu sydämen vajaatoiminnan oireita.
Natriumpitoisuus
Tämä lääkevalmiste sisältää natriumia vähemmän kuin 1 mmol (23 mg) annosta kohden eli se on käytännössä natriumiton.
Yhteisvaikutukset
Monet aineet vaikuttavat sokeriaineenvaihduntaan ja voivat vaatia glargininsuliinin annoksen muuttamista.
Aineita, jotka voivat voimistaa verensokeria alentavaa vaikutusta ja lisätä hypoglykemiariskiä, ovat oraaliset diabeteslääkkeet, angiotensiinikonvertaasin (ACE:n) estäjät, disopyramidi, fibraatit, fluoksetiini, monoamiinioksidaasin (MAO:n) estäjät, pentoksifylliini, propoksifeeni, salisylaatit, somatostatiinianalogit ja sulfonamidiantibiootit.
Aineita, jotka voivat heikentää verensokeria alentavaa vaikutusta, ovat kortikosteroidit, danatsoli, diatsoksidi, diureetit, glukagoni, isoniatsidi, estrogeenit ja progestiinit, fentiatsiinin johdokset, kasvuhormoni, sympatomimeetit (esim. adrenaliini, salbutamoli, terbutaliini), kilpirauhashormonit, epätyypilliset psykoosilääkkeet (esim. klotsapiini ja olantsapiini) ja proteaasi-inhibiittorit.
Beetasalpaajat, klonidiini, litiumsuolat tai alkoholi voivat joko voimistaa tai heikentää insuliinin verensokeria alentavaa vaikutusta. Pentamidiini voi aiheuttaa hypoglykemiaa, jota voi joskus seurata hyperglykemia.
Lisäksi sympatolyyttisten lääkkeiden, kuten beetasalpaajien, klonidiinin, guanetidiinin ja reserpiinin, käytön aikana adrenergisen vasteen aiheuttamat oireet voivat heiketä tai puuttua.
Raskaus ja imetys
Raskaus
Glargininsuliinin käytöstä raskaana olevien naisten hoidossa ei ole saatavilla kliinistä tietoa kontrolloiduista kliinisistä tutkimuksista. Laajat tiedot (yli 1000 raskaudesta) eivät viittaa glargininsuliinin erityisen haitallisiin vaikutuksiin raskauden aikana eikä erityiseen epämuodostumia aiheuttavaan, fetaaliseen tai neonataaliseen toksisuuteen.
Eläinkokeissa ei ole havaittu lisääntymistoksisuutta.
ABASAGLAR-insuliinin käyttöä raskauden aikana voidaan harkita, jos se on kliinisesti tarpeen.
Potilailla, joilla on diabetes tai raskausdiabetes, hyvän hoitotasapainon säilyttäminen on tärkeää koko raskausajan hyperglykemiaan liittyvien haitallisten vaikutusten estämiseksi. Insuliinin tarve voi vähentyä ensimmäisen raskauskolmanneksen aikana ja se lisääntyy yleensä toisen ja kolmannen raskauskolmanneksen aikana. Heti synnytyksen jälkeen insuliinintarve vähenee nopeasti (hypoglykemiariski lisääntyy). Huolellinen verensokerin seuranta on oleellista.
Imetys
Ei tiedetä, erittyykö glargininsuliini ihmisen rintamaitoon. Oletetaan, ettei glargininsuliini vaikuta vastasyntyneiden tai lasten, jotka ovat saaneet glargininsuliinia äidinmaidossa, aineenvaihduntaan, koska glargininsuliini on peptidi, joka hajoaa ihmisen ruuansulatuskanavassa aminohapoiksi.
Imetyksen aikana voi olla tarpeen muuttaa insuliiniannosta ja ruokavaliota.
Hedelmällisyys
Eläinkokeissa ei ole havaittu suoria vaikutuksia hedelmällisyyteen.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Potilaan kyky keskittyä ja reagoida saattaa olla heikentynyt hypoglykemian tai hyperglykemian seurauksena tai esimerkiksi näön heikkenemisen seurauksena. Tämä voi aiheuttaa vaaraa tilanteissa, joissa näillä taidoilla on suuri merkitys (esim. autolla ajaminen tai koneiden käyttäminen).
Potilaita tulee neuvoa varautumaan hypoglykemian välttämiseen autoa ajaessaan. Tämä on erityisen tärkeää niille potilaille, joiden kyky tunnistaa hypoglykemian varoitusoireita on huonontunut tai puuttuu tai joilla on toistuvia hypoglykemioita. Näissä tapauksissa tulee harkita, onko suositeltavaa ajaa autolla tai käyttää koneita.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Hypoglykemia (hyvin yleinen), yleensä insuliinihoidon yleisin haittavaikutus, voi kehittyä, jos insuliiniannos ylittää insuliinintarpeen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Taulukoitu lista haittavaikutuksista
Seuraavat kliinisissä tutkimuksissa esiintyneet haittavaikutukset on luokiteltu alla MedDRAn suositteleman elinluokituksen ja yleisyyden perusteella (hyvin yleinen: ≥ 1/10; yleinen: ≥ 1/100 – < 1/10; melko harvinainen: ≥ 1/1000 – < 1/100; harvinainen: ≥ 1/10000 – < 1/1000; hyvin harvinainen: < 1/10000 sekä tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin)).
Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
MedDRA elinluokitus | Hyvin yleinen | Yleinen | Melko harvinainen | Harvinainen | Hyvin harvinainen | Tuntematon | |||||
Immuunijärjestelmä | |||||||||||
Allergiset reaktiot | X | ||||||||||
Aineenvaihdunta ja ravitsemus | |||||||||||
Hypoglykemia | X | ||||||||||
Hermosto | |||||||||||
Dysgeusia | X | ||||||||||
Silmät | |||||||||||
Näön heikkeneminen | X | ||||||||||
Retinopatia | X | ||||||||||
Iho ja ihonalainen kudos | |||||||||||
Lipohypertrofia | X | ||||||||||
Lipoatrofia | X | ||||||||||
| Ihoamyloidoosi | X | ||||||||||
Luusto, lihakset ja sidekudos | |||||||||||
Myalgia | X | ||||||||||
Yleisoireet ja antopaikassa todettavat haitat | |||||||||||
Pistoskohdan reaktiot | X | ||||||||||
Turvotus | X | ||||||||||
Kuvaus tietyistä haittavaikutuksista
Aineenvaihdunta ja ravitsemus
Vaikeat hypoglykemiakohtaukset, erityisesti toistuessaan, voivat aiheuttaa neurologisia vaurioita. Pitkäaikaiset tai vaikeat hypoglykemiakohtaukset voivat olla hengenvaarallisia. Monilla potilailla adrenergisten vastavaikutusten merkit ilmenevät ennen neuroglykopenian oireita ja merkkejä. Yleensä mitä suurempi ja nopeampi verensokerin lasku on, sitä tuntuvampia ovat vastavaikutusilmiö ja sen oireet.
Immuunijärjestelmä
Välittömät allergiset reaktiot insuliinille ovat harvinaisia. Näitä reaktioita insuliinille (glargininsuliini mukaan lukien) tai apuaineille voivat olla esimerkiksi yleistyneet ihoreaktiot, angioedeema, bronkospasmi, hypotensio ja sokki, ja ne voivat olla hengenvaarallisia.
Silmät
Huomattava muutos verensokeritasapainossa voi aiheuttaa tilapäistä näön heikkenemistä, joka johtuu tilapäisestä mykiön turpoamisesta ja valontaittokyvyn muuttumisesta.
Pitkäaikaisesti parantunut verensokeritasapaino vähentää diabeettisen retinopatian etenemisriskiä. Insuliinihoidon tehostaminen ja äkillinen hoitotasapainon paraneminen voivat kuitenkin aiheuttaa tilapäistä diabeettisen retinopatian pahenemista. Silloin, kun potilaalla on proliferatiivinen retinopatia, erityisesti ellei sitä ole hoidettu fotokoagulaatiolla, vaikeat hypoglykemiakohtaukset voivat aiheuttaa ohimenevän näönmenetyksen.
Iho ja ihonalainen kudos
Lipodystrofiaa ja ihoamyloidoosia voi esiintyä pistoskohdassa, ja ne voivat hidastaa insuliinin paikallista imeytymistä. Jatkuva pistoskohtien vuorottelu sovituilla pistosalueilla voi vähentää tai estää näitä reaktioita (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Yleisoireet ja antopaikassa todettavat haitat
Pistoskohdan reaktioita ovat punoitus, kipu, kutina, nokkosrokko, turvotus tai tulehdus. Useimmat lievät insuliinin aiheuttamat reaktiot pistoskohdassa menevät yleensä ohi muutamassa päivässä tai muutamassa viikossa.
Insuliini voi harvinaisena haittavaikutuksena aiheuttaa natriumin retentiota ja turvotusta, etenkin jos aiemmin huono hoitotasapaino korjaantuu insuliinihoidon tehostamisen seurauksena.
Pediatriset potilaat
Tavallisesti valmisteen turvallisuusprofiili on lasten ja nuorten osalta (≤ 18-vuotiaat) samanlainen kuin aikuisten. Markkinoille tulon jälkeisessä seurannassa raportoidut, lapsia ja nuoria (≤ 18-vuotiaat) koskeneet haittavaikutukset sisälsivät suhteellisesti useammin pistoskohdan reaktioita (kipu pistoskohdassa, pistoskohdan reaktio) ja ihoreaktioita (ihottuma, urtikaria) kuin aikuisia koskeneet haittavaikutukset. Kliinisistä tutkimuksista ei ole saatavilla turvallisuustietoja alle 2-vuotiaista lapsista.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista kansallisen ilmoitusjärjestelmän kautta:
www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
FI-00034 Fimea
Yliannostus
Oireet
Insuliinin yliannostus voi johtaa vaikeaan ja joskus pitkäaikaiseen ja hengenvaaralliseen hypoglykemiaan.
Hoito
Lievät hypoglykemiakohtaukset voidaan yleensä hoitaa nauttimalla hiilihydraatteja suun kautta. Lääkevalmisteen annoksen, ateriarytmin tai fyysisen aktiivisuuden muuttaminen voi olla tarpeen.
Vaikeat kohtaukset, joihin kuuluu tajuttomuus, kouristelu tai neurologisia oireita, voidaan hoitaa antamalla glukagonia lihakseen/ihon alle tai väkevää glukoosiliuosta laskimoon. Hiilihydraattien jatkuva saanti ja tarkkailu voi olla tarpeen, koska hypoglykemia voi uusiutua ilmeisen kliinisen tilan paranemisen jälkeen.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Diabeteslääkkeet. Insuliinit ja insuliinijohdokset, ylipitkävaikutteiset, ATC-koodi: A10AE04.
ABASAGLAR on biosimilaarilääke. Lisätietoa on saatavilla Euroopan Lääkeviraston verkkosivuilta
http://www.ema.europa.eu.
Vaikutusmekanismi
Glargininsuliini on ihmisinsuliinin analogi, jonka liukoisuus neutraalissa pH:ssa on vähäinen. Se liukenee täysin ABASAGLAR-injektionesteen happamassa pH:ssa (pH 4). Ihonalaisen injektion jälkeen hapan liuos neutraloituu, ja muodostuu mikrosaostumia, joista vapautuu jatkuvasti glargininsuliinia pieninä määrinä. Tuloksena on tasainen, huiputon, ennakoitavissa oleva pitoisuusaikaprofiili ja pidentynyt vaikutusaika.
Glargininsuliini metaboloituu kahdeksi aktiiviseksi metaboliitiksi M1 ja M2 (ks. kohta Farmakokinetiikka).
Insuliinireseptoriin sitoutuminen
In vitro -tutkimukset osoittavat, että glargininsuliinin ja sen metaboliittien M1 ja M2 affiniteetti insuliinireseptoriin on vastaava kuin ihmisinsuliinin.
Tyypin 1 insuliinin kaltaisen kasvutekijän (IGF-1) reseptoriin sitoutuminen: Glargininsuliinin affiniteetti ihmisen IGF-1-reseptoriin on noin 5−8 kertaa suurempi kuin ihmisinsuliinin (mutta noin 70−80 kertaa pienempi kuin IGF-1:n), kun taas M1 ja M2 sitoutuvat IGF-1-reseptoriin hieman pienemmällä affiniteetilla kuin ihmisinsuliini.
Tyypin 1 diabetespotilailla todettu terapeuttinen kokonaisinsuliinipitoisuus (glargininsuliini ja sen metaboliitit) oli merkittävästi matalampi kuin pitoisuus, joka tarvittaisiin IGF-1-reseptorin puolimaksimaaliseen miehittämiseen ja sitä seuraavaan IGF-1-reseptorin kautta välittyvään mitogeenis-proliferatiivisen reitin aktivaatioon. Fysiologisilla endogeenisen IGF-1:n pitoisuuksilla mitogeenis-proliferatiivinen reitti saattaa aktivoitua, vaikka insuliinihoidon, mukaan lukien ABASAGLAR-hoito, aikana insuliinin terapeuttiset pitoisuudet ovat huomattavasti matalampia kuin IGF-reitin aktivoitumiseen tarvittavat farmakologiset pitoisuudet.
Farmakodynaamiset vaikutukset
Insuliinin, kuten myös glargininsuliinin, päävaikutus on glukoosiaineenvaihdunnan säätely. Insuliini ja sen analogit alentavat verensokerin pitoisuutta stimuloimalla perifeeristä glukoosinottoa erityisesti luurankolihaksiin ja rasvaan sekä estämällä maksan glukoosituotantoa. Insuliini estää rasvakudoksen lipolyysiä, estää proteolyysiä sekä voimistaa proteiinisynteesiä.
Kliinisfarmakologisissa tutkimuksissa laskimoon annettu glargininsuliini ja ihmisinsuliini on todettu ekvipotenteiksi käytettäessä samoja annoksia. Kuten insuliineilla yleensäkin, fyysinen aktiivisuus ja muut tekijät voivat vaikuttaa glargininsuliinin vaikutusaikaan.
Tutkittaessa terveitä vapaaehtoisia ja tyypin 1 diabetespotilaita euglykeemistä clamp-tekniikkaa käyttäen ihon alle annetun glargininsuliinin vaikutuksen alkaminen oli hitaampaa kuin NPH-insuliinin, sen vaikutusprofiili oli tasainen ja huiputon ja vaikutuksen kesto pidempi.
Seuraavassa kaaviossa nähdään tulokset potilaille suoritetusta tutkimuksesta:
Kuva 1. Vaikutusprofiili tyypin 1 diabetespotilailla
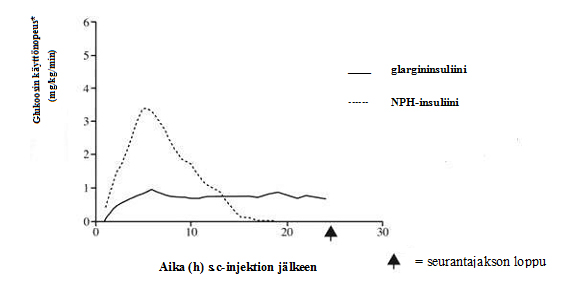
*määritetty verensokerin tasaisena pitävän infusoidun glukoosin määränä (keskiarvot tunneittain)
Ihonalaisen glargininsuliinin pidempi vaikutuksen kesto on suorassa suhteessa sen hitaampaan imeytymiseen ja tukee kerran vuorokaudessa tapahtuvaa pistosta. Insuliinin ja insuliinianalogien, kuten glargininsuliinin, vaikutusaika voi vaihdella huomattavasti potilaiden välillä ja yksittäisellä potilaalla.
Kliinisessä tutkimuksessa hypoglykemian oireet tai vastavaikuttajahormonivasteet olivat samanlaiset sekä terveillä vapaaehtoisilla että tyypin 1 diabetespotilailla glargininsuliinin ja ihmisinsuliinin laskimoinjektion jälkeen.
Kliininen teho ja turvallisuus
Kliinisissä tutkimuksissa vasta-aineita, jotka ristireagoivat ihmisinsuliinin ja glargininsuliinin kanssa, havaittiin samalla esiintymistiheydellä sekä NPH-insuliiniryhmässä että glargininsuliiniryhmässä.
Glargininsuliinin (pistos kerran vuorokaudessa) vaikutuksia diabeettiseen retinopatiaan verrattiin NPH-insuliiniin (pistos kahdesti vuorokaudessa) avoimessa 5 vuoden tutkimuksessa, johon osallistui 1024 tyypin 2 diabetesta sairastavaa potilasta. Silmänpohjavalokuvauksin tutkittiin, miten usein retinopatia lisääntyi ETDRS-luokittelun (Early Treatment Diabetic Retinopathy Study) mukaan vähintään kolme astetta. Glargininsuliinin ja NPH-insuliinin välillä ei todettu merkitsevää eroa diabeettisen retinopatian etenemisessä.
ORIGIN-tutkimus (Outcome Reduction with Initial Glargine Intervention) oli satunnaistettu, 2x2-faktorikokeena toteutettu monikeskustutkimus, jonka 12537 tutkimushenkilöllä oli suuri sydän- ja verisuonitautiriski ja heikentynyt paastosokeri tai heikentynyt glukoosinsieto (12 % tutkimushenkilöistä) tai tyypin 2 diabetes, jota hoidettiin ≤ 1 tablettimuotoisella diabeteslääkkeellä (88 % tutkimushenkilöistä). Tutkimushenkilöt satunnaistettiin (1:1) käyttämään glargininsuliinia (n = 6264), jonka annos titrattiin niin, että plasman paastoglukoosipitoisuus oli enintään 95 mg/dl (5,3 mmol/l), tai saamaan tavanomaista hoitoa (n = 6273). Ensimmäinen ensisijainen tehon päätetapahtuma oli aika ennen ensimmäistä kardiovaskulaarikuolemaa, ei-fataalia sydäninfarktia tai ei-fataalia aivohalvausta. Toinen ensisijainen tehon päätetapahtuma oli aika ennen jonkin ensimmäisen ensisijaisen päätetapahtuman tapahtumista, revaskularisaatiotoimenpidettä (sydän, kaulavaltimot tai ääreisverisuonet) tai sydämen vajaatoiminnasta johtunutta sairaalahoitoa.
Toissijaisia päätetapahtumia olivat mistä tahansa syystä johtuva kuolleisuus ja yhdistetty mikrovaskulaaritulos.
Glargininsuliini ei muuttanut kardiovaskulaarisairauden ja -kuolleisuuden suhteellista riskiä tavanomaiseen hoitoon verrattuna. Glargininsuliinin ja tavanomaisen hoidon välillä ei ollut eroja kahden ensisijaisen päätetapahtuman suhteen, minkään näihin päätetapahtumiin kuuluneen osapäätetapahtuman suhteen, mistä tahansa syystä johtuvan kuolleisuuden suhteen eikä yhdistetyn mikrovaskulaarituloksen suhteen.
Glargininsuliinin keskimääräinen annos oli 0,42 yksikköä/kg tutkimuksen lopussa. Lähtötilanteessa tutkimushenkilöiden HbA1c-mediaaniarvo oli 6,4 %. Hoidonaikaisten HbA1c-mediaaniarvojen vaihteluväli oli glargininsuliiniryhmässä 5,9–6,4 % ja tavanomaisen hoidon ryhmässä 6,2–6,6 % koko seurannan ajan. Vaikean hypoglykemian esiintymistiheys (tutkimushenkilöitä 100 altistusvuotta kohti) oli glargininsuliiniryhmässä 1,05 ja tavanomaisen hoidon ryhmässä 0,30. Vahvistetun, ei-vaikean hypoglykemian esiintymistiheys oli 7,71 glargininsuliiniryhmässä ja 2,44 tavanomaisen hoidon ryhmässä. Tämän 6 vuoden tutkimuksen aikana 42 %:lla glargininsuliiniryhmän tutkimushenkilöistä ei ollut hypoglykemioita.
Glargininsuliiniryhmässä keskimääräinen painonnousu lähtötilanteesta viimeiseen hoidonaikaiseen käyntiin oli 1,4 kg ja tavanomaisen hoidon ryhmässä vastaavasti keskimääräinen painonlasku oli 0,8 kg.
Pediatriset potilaat
Satunnaistetussa kontrolloidussa kliinisessä tutkimuksessa pediatrisia potilaita (ikäjakauma 6–15 vuotta), joilla oli tyypin 1 diabetes (n = 349), hoidettiin 28 viikkoa monipistosinsuliinihoidolla, jossa tavallista ihmisinsuliinia käytettiin ennen jokaista ateriaa. Glargininsuliini pistettiin kerran päivässä nukkumaanmenoaikaan ja NPH-insuliini pistettiin kerran tai kaksi kertaa päivässä. Vaikutukset glykohemoglobiiniarvoon ja oireisten hypoglykemioiden määrään olivat samanlaiset molemmissa hoitoryhmissä, vaikkakin plasman paastosokeriarvot vähenivät tutkimuksen aikana enemmän glargininsuliini- kuin NPH-ryhmässä. Myös vakavia hypoglykemioita oli vähemmän glargininsuliiniryhmässä. 143 potilasta, joita hoidettiin tässä tutkimuksessa glargininsuliinilla, jatkoivat hoitoa ei-kontrolloidussa jatkotutkimuksessa, jonka keskimääräinen seuranta-aika oli 2 vuotta. Tämän jatkotutkimuksen aikana ei glargininsuliinista todettu uusia haittavaikutuksia.
Vaihtovuoroisessa, 26 nuorelle tyypin 1 diabetespotilaalle, jotka olivat 12–18-vuotiaita, tehdyssä tutkimuksessa verrattiin glargininsuliinia ja lisproinsuliinia NPH-insuliiniin ja tavalliseen ihmisinsuliiniin (kumpaakin hoitoa annettiin 16 viikkoa satunnaistetussa järjestyksessä). Kuten edellä lapsipotilaille tehdyssä tutkimuksessa myös tässä tutkimuksessa plasman paastosokeriarvot laskivat enemmän glargininsuliini- kuin NPH-ryhmässä. HbA1c-arvon lasku tutkimuksen aikana oli samanlainen molemmissa hoitoryhmissä. Kuitenkin yöaikaiset verensokeriarvot olivat selvästi korkeampia glargininsuliini/lisproinsuliiniryhmässä kuin NPH/tavallinen ihmisinsuliini-ryhmässä, keskiarvo 5,4 mM vs. 4,1 mM. Vastaavasti yöllisten hypoglykemioiden ilmaantuvuus oli 32 % glargininsuliini/lisproinsuliiniryhmässä vs. 52 % NPH/tavallinen ihmisinsuliini-ryhmässä.
24 viikon kestoisessa rinnakkaisryhmätutkimuksessa, johon osallistui 125 iältään 2–6 -vuotiasta lasta, joilla oli tyypin 1 diabetes, verrattiin glargininsuliinia kerran vuorokaudessa aamuisin annosteltuna ja NPH-insuliinia kerran tai kaksi kertaa vuorokaudessa annosteltuna. Molemmat ryhmät käyttivät myös ateriainsuliinia. Ensisijaisena tavoitteena oli osoittaa vertailukelpoisuus (non-inferiority) kaikissa hypoglykemioissa glargininsuliinin ja NPH-insuliinin kesken. Tätä tavoitetta ei saavutettu, ja glargininsuliinilla esiintyi trendimäisesti enemmän hypoglykemiatapahtumia [glargininsuliini vs. NPH esiintyvyyssuhde (95 % luottamusväli) = 1,18 (0,97−1,44)]. HbA1c ja verensokerin vaihtelut olivat verrannollisia molemmissa hoitoryhmissä. Uusia turvallisuussignaaleja ei tässä tutkimuksessa havaittu.
Farmakokinetiikka
Imeytyminen
Terveille vapaaehtoisille ja diabetespotilaille ihon alle pistetyn glargininsuliinin tuottamat seerumin insuliinipitoisuudet osoittivat imeytymisen olevan hitaampaa ja pitkäkestoisempaa sekä huiputonta verrattuna ihmisen NPH-insuliiniin. Glargininsuliinin pitoisuudet olivat siten johdonmukaisessa suhteessa glargininsuliinin farmakodynaamiseen aktiivisuuteen. Kuvassa 1 nähdään glargininsuliinin ja NPH-insuliinin vaikutusprofiilit ajan funktiona.
Kerran päivässä pistettynä glargininsuliinin pitoisuudet saavuttavat vakaan tilan 2–4 vuorokaudessa ensimmäisestä annoksesta.
Biotransformaatio
Diabetespotilailla ihonalaisen injektion jälkeen glargininsuliini metaboloituu nopeasti beeta-ketjun karboksiterminaalipäästä muodostaen kaksi aktiivista metaboliittia M1 (21A-Gly-insuliini) ja M2 (21A-Gly-des-30B-Thr-insuliini). Pääasiallinen metaboliitti plasmassa on M1. Glargininsuliiniannoksen kasvaessa M1-altistus kasvaa.
Farmakokineettiset ja farmakodynaamiset löydökset osoittavat, että glargininsuliinin ihonalaisen pistoksen pääasiallinen vaikutus perustuu M1-altistukseen. Glargininsuliinia ja sen M2-metaboliittia ei havaittu valtaosalla tutkimuspotilaista, ja kun pitoisuus oli havaittavissa, se oli riippumaton annostellun glargininsuliinin määrästä.
Eliminaatio
Eliminaation puoliintumisaika laskimoon annon jälkeen oli glargininsuliinilla samaa luokkaa kuin ihmisinsuliinilla.
Erityisryhmät
Kliinisissä tutkimuksissa ikään ja sukupuoleen perustuvien alaryhmien analyysit eivät osoittaneet eroa tehossa tai turvallisuudessa glargininsuliinilla hoidettujen potilaiden ja muun tutkimuspopulaation välillä.
Pediatriset potilaat
Yhdessä kliinisessä tutkimuksessa arvioitiin farmakokinetiikkaa lapsilla, jotka olivat iältään 2 vuodesta alle 6 vuoteen ja joilla oli tyypin 1 diabetes (ks. kohta Farmakodynamiikka). Plasman matalimmat glargininsuliinin ja sen päämetaboliittien M1 ja M2 pitoisuudet juuri ennen seuraavaa annosta mitattiin lapsilta, joita hoidettiin glargininsuliinilla. Plasmapitoisuudet olivat samankaltaisia kuin aikuisilla, ja mitään näyttöä glargininsuliinin tai sen metaboliittien kertymisestä pitkäaikaiskäytössä ei todettu.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, geenitoksisuutta, karsinogeenisuutta sekä lisääntymis- ja kehitystoksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Farmaseuttiset tiedot
Apuaineet
Sinkkioksidi
Metakresoli
Glyseroli
Vetykloridihappo (pH:n säätely)
Natriumhydroksidi (pH:n säätely)
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
2 vuotta.
Kestoaika käyttöönoton jälkeen
Lääkevalmistetta voidaan säilyttää korkeintaan 30 °C suoralta kuumuudelta ja valolta suojattuna enimmillään 28 päivän ajan. Käytössä olevaa kynää ei saa säilyttää jääkaapissa.
Kynänsuojus on asetettava takaisin paikalleen jokaisen pistoksen jälkeen suojaamaan valolta.
Säilytys
Ennen käyttöä
Säilytä jääkaapissa (2 °C–8 °C).
Ei saa jäätyä.
Älä säilytä ABASAGLARia lähellä jääkaapin pakastuslokeroa tai kylmäelementtiä.
Pidä esitäytetty kynä ulkopakkauksessa. Herkkä valolle.
Käyttöönotetut
Avatun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
ABASAGLAR KWIKPEN injektioneste, liuos, esitäytetty kynä
100 U/ml (L:ei) 5 x 3 ml (55,60 €), 10 x 3 ml (2x(5 x 3 ml)) (105,74 €)
PF-selosteen tieto
KwikPen
3 ml liuosta sylinteriampullissa (väritön tyypin 1 lasi), jossa mäntä (halobutyylikumi) ja suljin (alumiini), jossa tulppa (polyisopreenikumin ja halobutyylikumin laminaatti).
Sylinteriampulli on suljettu kertakäyttöiseen esitäytettyyn kynään.
Pakkaukset, joissa 5 esitäytettyä kynää ja monipakkaukset, joissa 10 kynää (2 kappaletta esitäytettyä 5 kynää sisältävää pakkausta).
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Neulat eivät sisälly pakkaukseen.
Valmisteen kuvaus:
Kirkas, väritön liuos.
Käyttö- ja käsittelyohjeet
ABASAGLAR-insuliinia ei saa sekoittaa muihin insuliineihin tai lääkevalmisteisiin eikä laimentaa. Sekoittaminen tai laimentaminen voi muuttaa sen vaikutusaikaprofiilia, lisäksi sekoittaminen voi aiheuttaa saostumista.
Sylinteriampulli on tarkistettava ennen käyttöä. Sitä saa käyttää vain, jos liuos on kirkasta, väritöntä eikä siinä näy kiinteitä hiukkasia, ja jos se on vesimäistä. Koska ABASAGLAR on kirkas insuliiniliuos, se ei vaadi sekoittamista ennen käyttöä.
ABASAGLAR-insuliinia ei saa sekoittaa muihin insuliineihin eikä laimentaa. Sekoittaminen tai laimentaminen voi muuttaa sen vaikutusaikaprofiilia, lisäksi sekoittaminen voi aiheuttaa saostumista.
Tyhjiä kyniä ei saa käyttää uudelleen, vaan ne on hävitettävä asianmukaisesti.
Mahdollisten sairauksien leviämisen ehkäisemiseksi, jokainen kynä on tarkoitettu vain yhden potilaan käyttöön.
Insuliinin etiketti on tarkistettava aina ennen pistämistä, jotta lääkitysvirheet glargininsuliinin ja muiden insuliinien välillä vältetään (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Potilasta tulee neuvoa lukemaan pakkausselosteessa oleva käyttöohje huolellisesti ennen ABASAGLAR injektioneste, liuos esitäytetyssä kynässä käyttöä.
Korvattavuus
ABASAGLAR KWIKPEN injektioneste, liuos, esitäytetty kynä
100 U/ml 5 x 3 ml, 10 x 3 ml
- Ylempi erityiskorvaus (100 %). Diabetes, insuliinihoito (103).
- Peruskorvaus (40 %).
- Oikeus käyttää samaa biologista lääkettä (sama kauppanimi) 6 kk ajan.
ATC-koodi
A10AE04
Valmisteyhteenvedon muuttamispäivämäärä
06.01.2026
Yhteystiedot
 OY ELI LILLY FINLAND AB
OY ELI LILLY FINLAND AB Mannerheimintie 117
00280 Helsinki
09 854 5250
www.lilly.com/fi
medinfo_finland@lilly.com
Lääketietopalvelu puh. 0800-140 240
