ACTILYSE injektio/infuusiokuiva-aine, liuosta varten 2 mg
Vaikuttavat aineet ja niiden määrät
1 injektiopullo, jossa on kuiva-ainetta sisältää:
2 mg (vastaa 1 160 000 IU:ta) alteplaasia
Alteplaasi tuotetaan yhdistelmä-DNA-tekniikalla käyttäen kiinalaisen hamsterin munasarjasolulinjaa. WHO:n toisen kansainvälisen t-PA-standardin mukaan määritetyn valmistajan alteplaasireferenssin spesifinen aktiivisuus on 580 000 IU/mg. Alteplaasierien spesifinen aktiivisuus vaihtelee välillä 522 000 – 696 000 IU/mg.
Jokainen käyttökuntoon saatettu injektiopullo sisältää 2 mg alteplaasia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektio-/infuusiokuiva-aine liuosta varten
Kliiniset tiedot
Käyttöaiheet
Tukkeutuneiden keskuslaskimokatetrien, myös hemodialyysissä käytettävien katetrien, trombolyyttinen hoito
Vain 2 mg:n alteplaasi-injektiopulloa suositellaan tähän käyttötarkoitukseen.
Annostus ja antotapa
Actilyse-valmiste pitää antaa niin aikaisin kuin mahdollista katetrin tukkeutumisen jälkeen. Annostuksessa noudatetaan seuraavia ohjeita.
Annostus
Kutakin tukkeumaa kohden tukkeutuneeseen keskuslaskimokatetriin voidaan injisoida enintään kaksi korkeintaan 2 mg:n annosta liuottamaan porttien, yksi- tai useampi luumenisten katetrien sekä hemodialyysissä käytettävien katetrien tromboottiset tukkeumat.
Tähän käyttötarkoitukseen suositellaan alteplaasin laimentamista pitoisuuteen 1 mg/ml. Potilaille, jotka painavat 30 kg tai enemmän, injisoidaan tukkeutuneeseen keskuslaskimokatetriin enintään 2 mg:n kokonaisannos alteplaasia 2 ml:ssa käyttökuntoon saatettua liuosta.
Potilaille, jotka painavat alle 30 kg, tukkeutuneeseen keskuslaskimokatetriin injisoitavan liuoksen tilavuuden tulisi olla 110 % luumenin tilavuudesta. Alteplaasin kokonaismäärä injektiota kohti ei saa ylittää 2 mg. Esimerkiksi jos katetrin tilavuus on 1,0 ml, Actilyse-valmisteen kokonaisannos on 1,1 mg 1,1 ml:ssa.
Uudelleen antaminen
Jos tukkeutunut keskuslaskimokatetri ei ole alkanut toimia 120 minuutissa ensimmäisen annoksen jälkeen, voidaan antaa toinen vastaava annos.
Pediatriset potilaat
Edellä kuvattu yleinen annosteluohje koskee myös pediatrisia potilaita.
Katetrien puhdistusmenetelmä
Käyttökuntoon saatettu liuos injisoidaan tukkeutuneeseen keskuslaskimokatetriin, ja on tarkoitettu välittömästi käytettäväksi.
Ainoastaan alteplaasin 2 mg:n injektiopullo on tarkoitettu tähän käyttötarkoitukseen. Ohjeet liuoksen käyttökuntoon saattamisesta/annostelusta löytyvät kohdasta Käyttö- ja käsittelyohjeet.
- Sekoita injektiopullon sisältö käyttökuntoon niin, että sen alteplaasipitoisuus on 1 mg/ml. Jos katetrin luumenin tilavuus on suurempi kuin 2 ml, käyttökuntoon saatettu liuos voidaan vielä laimentaa steriilillä 9 mg/ml (0,9 %) natriumkloridiliuoksella haluttuun tilavuuteen. Esimerkiksi jos katetrin tilavuus on 2,5 ml, Actilyse-valmisteen kokonaisannos on 2,0 mg 2,5 ml:ssa.
- Injisoi sopiva annos Actilyse-valmistetta tukkeutuneeseen keskuslaskimokatetriin.
- Tarkista katetrin toimivuus 30 minuutin jälkeen yrittämällä aspiroida verta. Jos katetri toimii, siirry vaiheeseen 6. Jos katetri ei toimi, siirry vaiheeseen 4.
- Tarkista katetrin toimivuus 120 minuutin jälkeen yrittämällä aspiroida verta ja katetrin sisältöä. Jos katetri toimii, siirry vaiheeseen 6. Jos katetri ei toimi, siirry vaiheeseen 5.
- Jos katetri ei ole alkanut toimia ensimmäisen annoksen jälkeen, voidaan antaa toinen vastaava annos. Toista menettely vaiheesta 1 alkaen. Jos katetri ei ole alkanut toimia toisenkaan annoksen jälkeen, harkitse katetrin vaihtamista.
- Jos katetri on alkanut toimia, aspiroi 4–5 ml (jos potilas painaa yli 10 kg) tai 3 ml (jos potilas painaa alle 10 kg) verta poistaaksesi Actilyse-valmisteen ja jäljelle jääneen tukoksen, ja huuhtele katetri varovasti steriilillä 9 mg/ml (0,9 %) natriumkloridi-injektionesteellä.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Käytettävä alteplaasivalmisteen pakkauskoko tulee valita huolellisesti käyttötarkoituksen mukaisesti. 2 mg:n alteplaasi-injektiopulloja ei ole tarkoitettu akuutin sydäninfarktin, akuutin keuhkoembolian tai akuutin iskeemisen aivohalvauksen hoitoon (suuresta aliannostuksen riskistä johtuen). Ainoastaan 10, 20 tai 50 mg injektiopullot on tarkoitettu näihin käyttöaiheisiin.
Hepariinin samanaikainen injisointi
Hepariinin samanaikaisen injisoinnin alteplaasin kanssa ei ole todettu parantavan katetrien toimivuuden palautumista, eikä sitä suositella. Jos hepariinia pidetään välttämättömänä estämään uutta tukkeumaa, se tulee injisoida erikseen sen jälkeen kun katetrin toiminta on palautunut.
Verisuonen seinämän vaurio ja katetrin kokoon painuminen
Katetrin toimimattomuus voi johtua monista muista tekijöistä kuin veritulpista, kuten katetrin virheasennosta, mekaanisesta viasta, ompeleen kuroumasta, ja lipidi- tai lääkesaostumista katetrin luumenessa. Verisuonen seinämän vaurion tai pehmeäseinämäisten katetrien kokoon painumisen riskin vuoksi rajua imua ei saa käyttää katetrin avausyrityksiin. Liiallista painetta on vältettävä injisoitaessa alteplaasia katetriin. Liiallinen voima voi aiheuttaa katetrin repeämisen tai tukoksen työntymisen verenkiertoon.
Erityistä varovaisuutta on noudatettava, jos antamiseen käytettävien ruiskujen tilavuus on pieni (≤ 1 ml), etenkin jos käytetään katetreja, joiden tilavuus on pieni kuten tyypillisesti lapsipotilailla.
Verenvuoto
Yleisin haittavaikutus kaikkien trombolyyttien yhteydessä kaikissa hyväksytyissä käyttöaiheissa on verenvuoto. Alteplaasia ei ole tutkittu potilailla, joilla on tukkeutunut katetri ja tunnettu trombolyyttien käyttöön liittyvä verenvuototapahtumien riski. Varovaisuutta tulee noudattaa potilailla, joilla on aktiivinen sisäinen verenvuoto tai joilla on ollut jokin seuraavista 48 tunnin sisällä ennen injisoinnin alkua: leikkaus, synnytys, perkutaaninen koepalan otto sisäelimistä tai syvistä kudoksista tai ei-puristettavien suonten punktio. Lisäksi varovaisuutta tulee noudattaa potilailla, joilla on trombosytopenia, muu hemostaattinen häiriö (mukaan lukien vaikean maksa- tai munuaissairauden aiheuttamat), tai mikä tahansa sairaus, jossa verenvuoto on merkittävä riski tai olisi erityisen vaikea hoitaa sen sijainnin takia, tai joilla embolisten komplikaatioiden (kuten laskimotukos katetrin alueella) riski on suuri. Kuolemaa ja pysyvää vammautumista on raportoitu potilailla, jotka ovat saaneet aivohalvauksen ja muun vakavan verenvuototapahtuman saadessaan farmakologisia annoksia trombolyyttiä. Jos vakavaa verenvuotoa ilmenee kriittisessä paikassa (kuten kallon sisällä, mahasuolikanavassa, vatsakalvon takana, sydänpussissa), alteplaasihoito tulee lopettaa ja lääke poistaa katetrista.
Tulehdus
Alteplaasin käyttö potilailla, joilla katetri on tukkeutunut tulehtuneiden hyytymien takia, voi vapauttaa mikro-organismeja systeemiseen verenkiertoon ja aiheuttaa sepsiksen. Kuten kaikissa katetroinneissa aseptisen tekniikan ylläpidosta tulee huolehtia ja tarvittaessa käyttää sopivaa antibioottista hoitoa.
Yliherkkyys
Vasta-aineiden muodostumista potilailla, jotka ovat saaneet yhden tai useamman annoksen alteplaasia tukkeutuneiden keskuslaskimokatetrien korjaamiseen, ei ole tutkittu. Vaikuttava aine alteplaasi tai mikä tahansa apuaine voi aiheuttaa yliherkkyysreaktioita alteplaasin injisoinnin yhteydessä.
Jos potilas saa vaikean yliherkkyysreaktion, injisointi on lopetettava ja asianmukainen hoito aloitettava heti.
Yhteisvaikutukset
Actilyse 2 mg -valmisteella ei ole tehty varsinaisia yhteisvaikutustutkimuksia.
Veren hyytymiseen/verihiutaleiden toimintaan vaikuttavat lääkevalmisteet
Kumariinijohdosten, oraalisten antikoagulanttien, verihiutaleiden aggregaatiota estävien aineiden, fraktioimattoman hepariinin tai pienimolekyylisen hepariinin tai muiden veren hyytymiseen vaikuttavien aineiden käyttö (ennen Actilyse-hoitoa, hoidon aikana tai 24 tuntia hoidon jälkeen) lisää verenvuotoriskiä.
ACE-estäjät
ACE-estäjien samanaikainen käyttö voi lisätä yliherkkyysreaktioiden esiintymisriskiä.
Raskaus ja imetys
Raskaus
On vain vähän tietoja alteplaasin käytöstä raskaana oleville naisille. Ei-kliinisissä tutkimuksissa alteplaasilla havaittiin lääkkeen tunnetun farmakologisen vaikutuksen lisäksi sikiön epäkypsyyttä ja/tai alkiotoksisuutta, kun sitä annosteltiin ihmisille annettavia annoksia suuremmilla annoksilla. Alteplaasia ei pidetä teratogeenisenä (ks. kohta Prekliiniset tiedot turvallisuudesta).
Akuuteissa, henkeäuhkaavissa tilanteissa mahdollinen hyöty ja riski pitää punnita tarkkaan.
Imetys
Ei tiedetä erittyykö alteplaasi ihmisen rintamaitoon. Ei ole riittävästi tietoa alteplaasin erittymisestä koe-eläinten rintamaitoon.
Varovaisuutta on noudatettava käytettäessä Actilyse-valmistetta imettävälle äidille. On päätettävä tauotetaanko imetys 24 tunnin ajaksi Actilyse-valmisteen käytön jälkeen.
Hedelmällisyys
Actilyse-valmisteen vaikutuksesta hedelmällisyyteen ei ole saatavissa kliinisiä tietoja. Alteplaasilla tehdyt ei-kliiniset tutkimukset eivät osoittaneet hedelmällisyyteen liittyviä haittavaikutuksia (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Ei merkityksellinen
Haittavaikutukset
Alla luetellut haittavaikutukset on luokiteltu yleisyyden ja elinjärjestelmien mukaisesti. Haittavaikutukset on lajiteltu niiden esiintymistiheyden mukaisesti käyttäen seuraavaa tapaa:
hyvin yleinen (≥1/10); yleinen (≥1/100, <1/10); melko harvinainen (≥1/1 000, <1/100); harvinainen (≥1/10 000, <1/1 000); hyvin harvinainen (<1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Kliinisissä tutkimuksissa, joissa tutkittiin Actilyse-valmisteen käyttöä tukkeutuneiden katetrien hoidossa, havaittiin seuraavia haittavaikutuksia:
Elinjärjestelmä | Haittavaikutus |
Infektiot | |
melko harvinainen | sepsis |
Yleisoireet ja antopaikassa todettavat haitat | |
melko harvinainen | katetriin liittyvät komplikaatiot |
harvinainen | kuume |
Alteplaasin systeemisessä käytössä (kuten korkeat annokset tromboembolisissa käyttöaiheissa) on raportoitu seuraavia annoksesta riippumattomia haittavaikutuksia:
Immuunijärjestelmä | |
harvinainen | yliherkkyysreaktiot (esim. ihottuma, nokkosrokko, keuhkoputkien supistuminen, angioedeema, hypotensio, shokki)* |
hyvin harvinainen | vakava anafylaksia |
*Ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset
Periaatteessa kaikkia haittavaikutuksia, joita on havaittu Actilyse-valmisteen systeemisessä käytössä (10, 20, 50 mg:n alteplaasi-injektiopulloja käytettäessä, ks. näiden valmisteiden valmisteyhteenveto), voi ilmetä myös tukkeutuneiden katetrien hoidossa tapauksissa, joissa Actilyse (2 mg alteplaasia) saavuttaa systeemisen verenkierron (esim. verenvuoto, embolia, yliherkkyysreaktiot, alentunut verenpaine, pahoinvointi, oksentelu, kohonnut kehon lämpötila). Farmakokineettiset tiedot kuitenkin osoittavat, että tällä annostuksella ei saavuteta fysiologisesti merkittäviä pitoisuuksia plasmassa.
Koska immuunijärjestelmään kohdistuvia haittavaikutuksia voidaan pitää annoksesta riippumattomina, ne on kopioitu systeemisen annostelun haittavaikutustiedoista. Actilyse 2 mg -valmisteella tehdyissä kliinisissä tutkimuksissa ei kuitenkaan ole havaittu immuunijärjestelmän haittavaikutuksia.
Pediatriset potilaat
Kliinisten tutkimustietojen perusteella valmisteen turvallisuusprofiili lapsipotilailla on verrattavissa aikuisilla potilailla havaittuun turvallisuusprofiiliin.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Oireet
Alteplaasin suhteellisesta fibriiniselektiivisyydestä huolimatta yliannostus voi johtaa kliinisesti merkittävään fibrinogeenin ja muiden hyytymistekijöiden vähenemiseen.
Hoito
Useimmissa tapauksissa riittää, että hoidon keskeyttämisen jälkeen odotetaan hyytymistekijöiden fysiologista palautumista. Jos kuitenkin vakava verenvuoto ilmenee, suositellaan tuorepakastetun plasman (jääplasma) antoa ja mikäli välttämätöntä myös synteettisiä antifibrinolyyttejä voidaan käyttää.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Antitromboottiset lääkeaineet, ATC-koodi: B01AD02
Vaikutusmekanismi
Alteplaasi on rekombinantti ihmisen kudostyypin plasminogeeniaktivaattori, glykoproteiini, joka aktivoi plasminogeenin suoraan plasmiiniksi. Laskimoon annon jälkeen alteplaasi pysyy suhteellisen inaktiivina verenkierrossa. Sitouduttuaan fibriiniin alteplaasi aktivoituu ja muuttaa plasminogeenin plasmiiniksi, joka liuottaa fibriinihyytymän.
Farmakodynaamiset vaikutukset
Annoksella 100 mg verenkierron fibrinogeenitasot laskevat alteplaasin suhteellisesta fibriiniselektiivisyydestä johtuen 4 tunnissa noin 60 prosenttiin alkutasosta ja palautuvat tavallisesti yli 80 prosenttiin 24 tunnin kuluttua. Plasminogeeni vähenee noin 20 prosenttiin ja α-2-antiplasmiini noin 35 prosenttiin alkuarvoista 4 tunnissa ja arvot palautuvat taas yli 80 prosenttiin 24 tunnissa. Vain muutamilla potilailla on havaittu verenkierron fibrinogeenitason merkittävää ja pitkäaikaisempaa laskua.
Kliininen teho ja turvallisuus
Tukkeutuneet keskuslaskimoyhteydet, mukaan lukien hemodialyysissä käytettävät
Kahdessa kliinisessä tutkimuksessa hoidettiin alteplaasilla yli 1 100 enimmäkseen aikuista potilasta, joilla oli viallisesti toimiva keskuslaskimokatetri. Katetrien toiminnan palautumistaso oli 74 % - 77 % yhden alteplaasiannoksen jälkeen ja 87 % - 90 % kahden annoksen jälkeen. Hemodialyysikatetreilla tehdyissä tutkimuksissa raportoitiin vastaavia palautumistasoja kun aika seuraavaan dialyysikertaan oli ≥ 2 tuntia.
Pediatriset potilaat
Tutkimuksessa 310 lapsella katetrien toiminnan palautumistaso oli kaiken kaikkiaan 83 % korkeintaan kahden alteplaasiannoksen jälkeen eli vastaava kuin aikuisissa havaittu. Yhteensä 432 alle 17-vuotiasta potilasta on saanut keskeisissä katetripuhdistumatutkimuksissa enintään kaksi korkeintaan 2 mg:n annosta alteplaasia. Kaiken kaikkiaan turvallisuus ja teho olivat samanlaisia lapsi- ja aikuispotilailla.
Farmakokinetiikka
Alteplaasi metaboloituu pääosin maksassa ja poistuu nopeasti verenkierrosta (plasmapuhdistuma 550–680 ml/min). Fysiologisissa olosuhteissa suurin osa verenkierrossa olevasta alteplaasista sitoutuu estäjään. Muut proteiinit, mukaan lukien alteplaasin estäjät, eivät estä alteplaasin maksapuhdistumaa. Alteplaasin ja sen estäjän muodostamat kompleksit poistuvat vapaana alteplaasina. Puoliintumisaika plasmassa t½α on 4–5 minuuttia, joten pitoisuus plasmassa putoaa alle 10 prosenttiin lähtöarvosta 20 minuutissa. Ääreistilassa jäljellä olevalle alteplaasille laskettu puoliintumisaika t½ß on 40 minuuttia.
Injisoitaessa alteplaasia tukkeutuneiden keskuslaskimokatetrien korjaamiseen ohjeiden mukaisesti, alteplaasin pitoisuuden plasmassa ei odoteta saavuttavan farmakologista pitoisuutta. Jos 2 mg:n annos alteplaasia annettaisiin bolusinjektiona suoraan systeemiseen verenkiertoon (katetrin sijaan), alteplaasipitoisuus todennäköisesti palaisi havaitsemattomalle tasolle 30–60 minuutin sisällä.
Prekliiniset tiedot turvallisuudesta
Rotilla ja silkkiapinoilla tehdyissä subkroonisissa toksisuustutkimuksissa ei havaittu odottamattomia haittavaikutuksia. Mutageenisuustutkimuksissa alteplaasilla ei havaittu mutageenisia ominaisuuksia.
Tiineillä eläimillä tehdyissä tutkimuksissa alteplaasilla ei havaittu olevan teratogeenisia vaikutuksia annettaessa sitä suonensisäisenä infuusiona farmakologisesti tehokkaina annoksina. Kaneille alteplaasi oli embryotoksinen (sikiökuolleisuus, kasvun hidastuminen) annoksina > 3 mg/kg/päivä. Rotissa ei havaittu vaikutusta peri-postnataaliseen kehitykseen eikä lisääntymisparametreihin annoksen ollessa ≤ 10 mg/kg/päivä.
Farmaseuttiset tiedot
Apuaineet
Kuiva-aine: arginiini, fosforihappo (pH:n säätöön), polysorbaatti 80
Yhteensopimattomuudet
Käyttökuntoon saatettu liuos voidaan laimentaa steriilillä injektionesteisiin käytettävällä natriumkloridiliuoksella 9 mg/ml (0,9 %) siten, että pitoisuus on vähintään 0,2 mg/ml, koska käyttökuntoon saatetun liuoksen samentumista ei voida poissulkea.
Lisälaimentamista tai injektionesteisiin käytettävän veden käyttöä laimentamiseen tai yleisesti hiilihydraattipitoisten infuusioliuosten, kuten esim. glukoosiliuoksen, käyttöä ei suositella käyttökuntoon saatetun liuoksen lisääntyneen samentumisen vuoksi.
Actilyse-valmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa (ei edes hepariinin kanssa).
Kestoaika
Avaamattomat injektiopullot
3 vuotta
Käyttökuntoon saatettu liuos
Käyttökuntoon saatetun liuoksen on osoitettu säilyvän enimmillään 24 tunnin ajalla 2–8 ° C:ssa ja 8 tunnin ajalla 25 °C:ssa.
Mikrobiologiselta kannalta valmiste pitää käyttää heti käyttökuntoon saattamisen jälkeen. Ellei sitä käytetä heti, käytönaikainen säilytysaika ja käyttöä edeltävät olosuhteet ovat käyttäjän vastuulla, ja aika ei yleensä ole yli 24 tuntia 2–8°C:ssa.
Säilytys
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Säilytä jääkaapissa (2–8 °C).
Käyttökuntoon saatetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
ACTILYSE injektio/infuusiokuiva-aine, liuosta varten
2 mg (L:ei) 5 x 2 mg (403,20 €)
PF-selosteen tieto
Kuiva-aine:
2 ml:n steriloitu lasinen injektiopullo, joka on sinetöity steriilillä silikonipäällysteisellä harmaalla butyylityyppisellä tulpalla ja alumiini/muovi-repäisykapselilla.
Pakkauskoot:
5 injektiopulloa, joissa on 93 mg injektio-/infuusiokuiva-ainetta liuosta varten
Valmisteen kuvaus:
Väritön tai vaaleankeltainen lyofilisoitu jauhekakku. Käyttökuntoon saatettu liuos on kirkas ja väritön tai vaaleankeltainen.
Käyttö- ja käsittelyohjeet
Alteplaasin 2 mg:n injektiopulloja ei ole tarkoitettu akuutin sydäninfarktin, akuutin keuhkoembolian tai akuutin iskeemisen aivohalvauksen hoitoon (suuresta aliannostuksen riskistä johtuen). Ainoastaan 10, 20 tai 50 mg injektiopullot on tarkoitettu näihin käyttöaiheisiin.
2 mg:n injektiopullon sisältö (sisältää ylimäärän) liuotetaan 2,2 ml:aan steriiliä injektionesteisiin käytettävää vettä, jolloin liuoksen lopulliseksi alteplaasipitoisuudeksi tulee 1 mg/ml.
Ohjeet Actilyse 2 mg -valmisteen käyttökuntoon saattamiseen
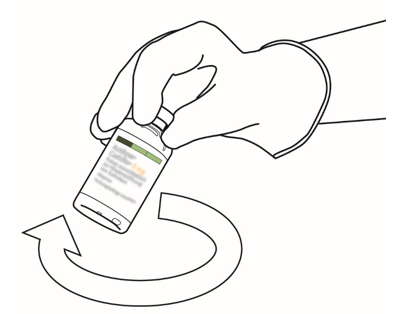
| 1 | Saata käyttökuntoon juuri ennen lääkkeen antamista. |  |
| 2 | Poista Actilyse-kuiva-ainetta sisältävän injektiopullon muovinen repäisysuojus kääntämällä sitä ylöspäin peukalon avulla. | 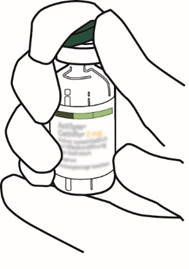 |
| 3 | Pyyhi injektiopullon kumitulpan pinta alkoholipyyhkeellä. | 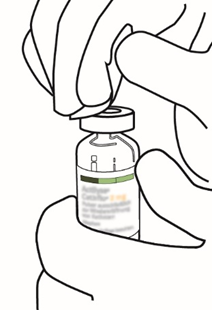 |
| 4 | Vedä aseptisesti 2,2 ml steriiliä injektionesteisiin käytettävää vettä ruiskuun, jossa on riittävä mittaustarkkuus. | 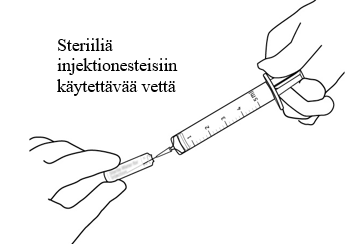 |
| 5 | Siirrä 2,2 ml steriiliä injektionesteisiin käytettävää vettä Actilyse-injektiopulloon työntämällä neula kohtisuoraan kumitulpan keskustan läpi. Ruiskuta liuotin suoraan kuiva-aineeseen. | 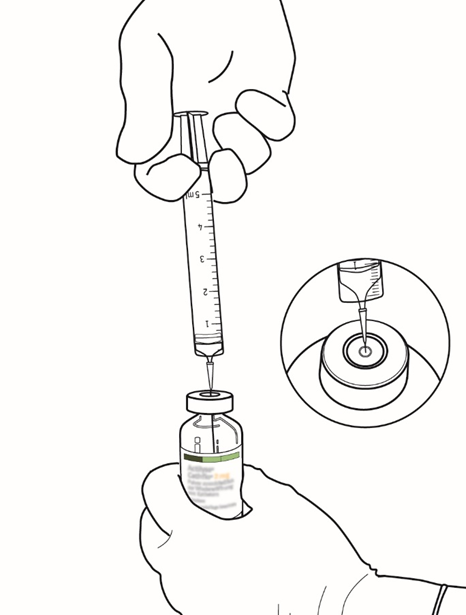 |
| 6 | Ota käyttökuntoon saatettua Actilyse-valmistetta sisältävä injektiopullo ja pyörittele sitä kevyesti, jotta kaikki kuiva-aine liukenee. Älä ravista, jotta liuos ei vaahtoudu.
Jos liuoksessa on kuplia, anna sen olla paikoillaan muutaman minuutin ajan, jotta kuplat katoavat. |
|
| 7 | Käyttökuntoon saatettu liuos sisältää 1 mg/ml alteplaasia. Liuoksen tulee olla kirkasta ja väritöntä tai vaaleankeltaista, eikä se saa sisältää minkäänlaisia partikkeleita. | |
| 8 | Ota tarvittava määrä liuosta käyttämällä neulaa ja ruiskua. | 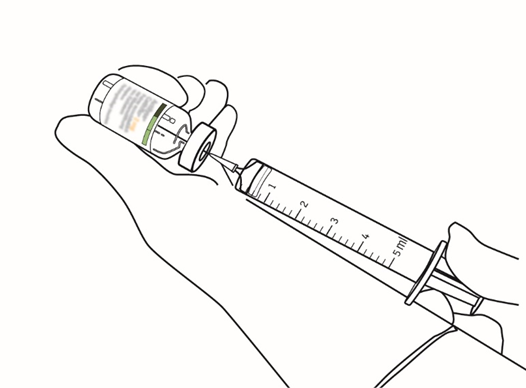 |
| 9 | Käytä välittömästi. Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti. | |
Käyttökuntoon saatettu liuos injisoidaan tukkeutuneeseen keskuslaskimokatetriin. Se voidaan edelleen laimentaa steriilillä injektionesteisiin käytettävällä natriumkloridiliuoksella 9 mg/ml (0,9 %) siten, että pitoisuus on vähintään 0,2 mg/ml, koska käyttökuntoon saatetun liuoksen samentumista ei voida poissulkea. Käyttökuntoon saatetun 1 mg/ml liuoksen edelleen laimentamista steriilillä injektionesteisiin käytettävällä vedellä tai yleisesti hiilihydraattipitoisten infuusioliuosten, kuten esim. glukoosiliuoksen, käyttöä ei suositella, koska käyttökuntoon saatetun liuoksen sameus lisääntyy. Actilyse-valmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa samaan katetriin (ei edes hepariinin kanssa).
Yhteensopimattomuudet ks. kohta Yhteensopimattomuudet.
Korvattavuus
ACTILYSE injektio/infuusiokuiva-aine, liuosta varten
2 mg 5 x 2 mg
- Ei korvausta.
ATC-koodi
B01AD02
Valmisteyhteenvedon muuttamispäivämäärä
13.02.2024
Yhteystiedot
 BOEHRINGER INGELHEIM FINLAND KY
BOEHRINGER INGELHEIM FINLAND KY Tammasaarenkatu 5
00180 Helsinki
010 310 2800
www.boehringer-ingelheim.fi
medinfo.finland@boehringer-ingelheim.com