OCTAFIL LOW injektiokuiva-aine ja liuotin, liuosta varten 200 IU/ml
Vaikuttavat aineet ja niiden määrät
Octafil Low 200 IU/ml
Yhden injektiopullon nimellinen sisältö on 1000 IU ihmisen veren hyytymistekijää VIII.
Valmiste sisältää noin 200 IU* per ml ihmisen veren hyytymistekijää VIII, kun se on tehty käyttövalmiiksi 5 ml:lla liuotinta.
Valmiste sisältää noin ≤ 120 IU per ml von Willebrand -tekijää (VWF:RCo).
*Valmisteen vahvuus (IU) on määritetty Euroopan farmakopean kromogeenisellä menetelmällä. Octafil Low -valmisteen keskimääräinen spesifinen aktiivisuus on ≥ 100 IU/mg proteiinia.
Valmistettu ihmisluovuttajien plasmasta.
Apuaineet joiden vaikutus tunnetaan:
Natriumia enintään 1,75 mmol (40 mg) per annos.
Natriumpitoisuus käyttövalmiiksi tekemisen jälkeen: 250–350 mmol/l.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektiokuiva-aine ja liuotin, liuosta varten.
Kliiniset tiedot
Käyttöaiheet
Verenvuotojen hoito ja ennaltaehkäisy potilaille, joilla on A-hemofilia (synnynnäinen hyytymistekijä VIII:n puutos).
Octafil Low -valmistetta voi käyttää kaikille ikäryhmille.
Tämä valmiste ei sisällä farmakologisesti tehokasta määrää von Willebrand -tekijää eikä sitä sen vuoksi ole indikoitu von Willebrandin tautiin.
Ehto
Hoito tulee aloittaa hemofilian hoitoon perehtyneen lääkärin valvonnassa.
Annostus ja antotapa
Hoito pitää aloittaa ja toteuttaa hemofilian hoitoon perehtyneen lääkärin valvonnassa.
Hoidon seuranta
Hoidon aikana on hyytymistekijä VIII:n määrää seurattava asianmukaisesti oikean annoksen ja antovälin varmistamiseksi.
Yksittäisten potilaiden vaste hyytymistekijä VIII:lle voi olla erilainen, jolloin myös puoliintumisaika ja saanto vaihtelevat. Kehon painoon perustuvaa annosta voi olla tarpeen muuttaa ali- tai ylipainoisilla potilailla. Erityisesti suurissa kirurgisissa toimenpiteissä korvaushoidon tarkka seuranta hyytymisanalyysin avulla (plasman hyytymistekijä VIII:n aktiivisuus) on välttämätöntä.
Annostus
Annos ja korvaushoidon kesto riippuvat hyytymistekijä VIII:n puutoksen vaikeusasteesta, vuodon sijainnista ja määrästä sekä potilaan kliinisestä tilasta.
Annettavien hyytymistekijä VIII:n yksiköiden määrä ilmaistaan kansainvälisinä yksikköinä (IU), jotka on suhteutettu WHO:n nykyiseen hyytymistekijä VIII:n valmisteita koskevaan konsentraattistandardiin. Plasman hyytymistekijä VIII -aktiivisuus ilmaistaan joko prosentteina (suhteessa normaaliin ihmisplasmaan) tai mieluummin kansainvälisinä yksikköinä (suhteessa hyytymistekijää VIII koskevaan kansainväliseen standardiin).
Yksi kansainvälinen yksikkö (IU) hyytymistekijä VIII:n aktiivisuutta vastaa hyytymistekijä VIII:n määrää yhdessä millilitrassa normaalia ihmisplasmaa.
Tarpeenmukainen hoito
Tarvittavan hyytymistekijä VIII:n annostuksen laskeminen perustuu siihen kokeelliseen havaintoon, että yksi kansainvälinen yksikkö (IU) hyytymistekijää VIII kehon painokiloa kohti lisää plasman hyytymistekijä VIII:n aktiivisuutta 1,5–2 %:lla normaalista aktiivisuudesta. Tarvittava annos määritellään seuraavan kaavan avulla:
Tarvittava yksikkömäärä = potilaan paino (kg) x haluttu hyytymistekijä VIII -nousu (%) x 0,5
Annettava määrä ja antotiheys on aina päätettävä yksilöllisesti kliinisen vasteen mukaan.
Seuraavankaltaisia vuototilanteita hoidettaessa hyytymistekijä VIII:n aktiivisuus ei saa laskea alle ilmoitetun plasman aktiivisuuspitoisuuden (% normaalista) vastaavan ajan kuluessa. Seuraavaa taulukkoa voidaan käyttää annostusohjeena verenvuodoissa ja leikkauksissa:
| Vuodon määrä/ leikkaustyyppi | Tarvittava hyytymistekijä VIII:n taso (%) | Annostiheys (tunteina) / Hoidon kesto (vrk) |
| Verenvuoto | ||
| Varhaisvaiheen vuoto niveleen tai lihakseen tai suun limakalvovuoto | 20–40 | Toistetaan 12–24 tunnin välein. Ainakin 1 päivä, kunnes tilaan liittyvä kipu lakkaa tai vuoto paranee. |
| Laajempi vuoto niveleen tai lihakseen tai hematooma | 30–60 | Infuusio toistetaan 12–24 tunnin välein 3–4 päivän ajan tai pidempään, kunnes kipu ja akuutti haitta häviävät. |
| Hengenvaaralliset vuodot | 60–100 | Infuusio toistetaan 8–24 tunnin välein, kunnes vaara on ohi. |
| Leikkaus | ||
| Pienet leikkaukset mukaan lukien hampaanpoisto | 30–60 | 24 tunnin välein, vähintään 1 päivän ajan, kunnes tila paranee. |
| Suuret leikkaukset | 80–100 (ennen leikkausta ja sen jälkeen) | Infuusio toistetaan 8–24 tunnin välein, kunnes haava on parantunut asianmukaisesti. Sen jälkeen hoitoa jatketaan vähintään 7 päivän ajan, jotta tekijä VIII:n aktiivisuus pysyy 30–60 %:ssa. |
Ennaltaehkäisevä hoito
Vaikeaa A-hemofiliaa sairastavien potilaiden pitkäaikaisessa vuotoja ennaltaehkäisevässä hoidossa tavallinen annos on 20–40 IU hyytymistekijä VIII:aa painokiloa kohti 2–3 päivän välein.
Joissakin tapauksissa, erityisesti nuoremmille potilaille, lyhyemmät antovälit tai suuremmat annokset voivat olla välttämättömiä.
Jatkuva infuusio
Ennen leikkausta on suoritettava farmakokineettinen analyysi, jotta saadaan arvio puhdistumasta.
Infuusion aloitusnopeus voidaan laskea seuraavasti: puhdistuma x haluttu pitoisuus tasapainotilassa = infuusionopeus (IU/kg/h).
Ensimmäisen 24 tunnin jatkuvan infuusion jälkeen puhdistuma on laskettava joka päivä uudelleen mitatun pitoisuuden ja tunnetun infuusionopeuden perusteella tasapainotilan yhtälöä käyttäen.
Pediatriset potilaat
Viidellätoista enintään 6-vuotiaalla potilaalle tehdyssä kliinisessä tutkimuksessa lapsille ei todettu erityisiä annosteluun liittyviä vaatimuksia.
Annostus on sekä hoidossa että ennaltaehkäisevässä hoidossa aikuisille ja lapsille sama.
Antotapa
Valmiste annetaan laskimoon.
Suositeltavaa on, että annostelunopeus ei ylitä 2–3 ml/minuutti.
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen saattamisesta käyttökuntoon ennen lääkkeen antoa.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkkeiden jäljitettävyyden parantamiseksi annetun valmisteen nimi ja eränumero on kirjattava selkeästi muistiin.
Yliherkkyys
Allergiatyyppiset yliherkkyysreaktiot ovat Octafil Low -valmisteen käytön yhteydessä mahdollisia. Valmiste sisältää jäämiä muistakin ihmisen proteiineista kuin hyytymistekijä VIII:sta. Jos yliherkkyysoireita ilmenee, potilaita on neuvottava keskeyttämään lääkevalmisteen käyttö välittömästi ja ottamaan yhteyttä lääkäriinsä. Potilaille on kerrottava yliherkkyysreaktioiden varhaisista oireista, joita ovat nokkosihottuma, yleistynyt urtikaria, puristava tunne rinnassa, hengityksen vinkuminen, verenpaineen lasku ja anafylaksia.
Sokkitapauksissa on noudatettava sokin hoidon nykykäytäntöjä.
Inhibiittorit
Tekijä VIII:aa neutraloivien vasta-aineiden (inhibiittoreiden) muodostuminen on tunnettu komplikaatio hemofilia A -potilaiden hoidossa. Inhibiittorit ovat yleensä IgG-immunoglobuliineja, jotka estävät tekijä VIII hyytymistoiminnan aktivoitumisen ja joiden määrä ilmaistaan Bethesda yksikköinä (Bethesda Units, BU) millilitrassa plasmaa käyttämällä muunneltua määritystä. Inhibiittoreiden muodostumisen riski riippuu taudin vaikeusasteesta ja altistumisesta tekijä VIII:lle. Riski on suurin 50 ensimmäisen altistuspäivän aikana, mutta säilyy koko eliniän, vaikka riski on pieni.
Inhibiittorien muodostumisen kliininen merkitys riippuu inhibiittori titteristä. Riittämättömän kliinisen vasteen riski on pienempi, jos potilaalle muodostuu alhaisen titterin inhibiittoreita verrattuna tilanteeseen, jossa potilaalla on korkean titterin inhibiittoreita.
Hyytymistekijä VIII -valmisteilla hoidettavien potilaiden inhibiittoreiden esiintyvyyttä on seurattava tarkkaan asianmukaisin kliinisin havainnoin ja laboratoriokokein. Jos odotettuja tekijä VIII:n aktiivisuuden plasmapitoisuuksia ei saavuteta tai jos verenvuotoa ei saada hallintaan asianmukaisella annoksella, on potilaalta testattava tekijä VIII:n inhibiittorin esiintyminen. Jos potilaalla on korkea inhibiittoripitoisuus, tekijä VIII -hoito ei ehkä ole tehokasta ja on harkittava muita terapeuttisia vaihtoehtoja. Näiden potilaiden hoidon on tapahduttava sellaisten lääkäreiden valvonnassa, joilla on kokemusta hemofiliasta ja tekijä VIII:n inhibiittoreista.
Sydän- ja verisuonitapahtumat
Korvaushoito hyytymistekijä VIII:lla voi nostaa sydän- ja verisuonitautien riskiä potilaille, joilla on sydän- ja verisuonitautien riskitekijöitä.
Katetriin liittyvät komplikaatiot
Jos tarvitaan keskuslaskimokatetri, keskuslaskimokatetriin liittyvät komplikaatiot, kuten paikalliset infektiot, bakteriemi ja katetritromboosi, on otettava huomioon.
Tartuntavaaralliset aineet
Ihmisen verestä tai plasmasta valmistettujen lääkkeiden välittämien infektioiden estämiseksi käytetään vakiintuneita toimenpiteitä. Näitä ovat luovuttajien valinta, yksittäisten luovutusten ja plasmapoolien tutkiminen tiettyjen infektiomarkkereiden suhteen sekä viruksia tehokkaasti inaktivoivat ja poistavat valmistusvaiheet. Tästä huolimatta taudinaiheuttajien siirtymismahdollisuutta ei voida täysin sulkea pois, kun annetaan ihmisen verestä tai plasmasta valmistettuja lääkkeitä. Tämä koskee myös tuntemattomia tai uusia viruksia ja muita patogeenejä.
Käytettyjen toimenpiteiden katsotaan olevan tehokkaita vaipallisiin viruksiin, kuten ihmisen immuunikatovirus (HIV), B-hepatiittivirus (HBV) ja C-hepatiittivirus (HCV), sekä vaipattomaan A‑hepatiittivirukseen (HAV). Niistä saattaa olla jonkin verran hyötyä parvovirus B19:n kaltaisia vaipattomia viruksia vastaan. Parvovirustartunta saattaa olla vakava raskaana oleville naisille (sikiön saama tartunta) ja henkilöille, joilla on immuunipuutos tai lisääntynyt punasolujen tuotanto (esim. hemolyyttinen anemia).
Asiankuuluvaa rokotussuojaa (hepatiitti A ja B) on harkittava potilaille, jotka käyttävät säännöllisesti tai toistuvasti ihmisplasmaperäisiä hyytymistekijä VIII -valmisteita.
Valmisteen nimi ja eränumero suositellaan kirjattavaksi ylös joka kerta, kun Octafil Low -valmistetta annetaan potilaalle, jotta säilytetään yhteys potilaan ja käytetyn valmiste-erän välillä.
Tämä lääkevalmiste sisältää enintään 1,75 mmol natriumia (40 mg) per injektiopullo, joka vastaa 2 % WHO:n suosittelemasta natriumin 2 g:n päivittäisestä enimmäissaannista aikuisille.
Pediatriset potilaat
Luetellut varoitukset ja varotoimet koskevat sekä aikuisia että lapsia.
Yhteisvaikutukset
Ihmisen hyytymistekijä VIII -valmisteiden ja muiden lääkevalmisteiden yhteisvaikutuksia ei ole raportoitu.
Raskaus ja imetys
Hyytymistekijä VIII:aan liittyviä lisääntymistä koskevia eläintutkimuksia ei ole tehty. Koska A-hemofilia on naisilla harvinainen, kokemusta hyytymistekijä VIII:n käytöstä raskauden ja imetyksen aikana ei ole. Siksi hyytymistekijä VIII:aa saa käyttää raskauden ja imetyksen aikana vain, jos se on selvästi tarpeen.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Octafil Low -valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneiden käyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Harvoin on havaittu yliherkkyys- tai allergiareaktioita (joihin voi kuulua angioödeemaa, infuusiokohdan kirvelyä ja pistelyä, vilunväristyksiä, ihon punoitusta, yleistynyttä urtikariaa, päänsärkyä, nokkosihottumaa, verenpaineen laskua, letargiaa, pahoinvointia, levottomuutta, tiheäpulssisuutta, puristavaa tunnetta rinnassa, pistelyä, oksentelua, hengityksen vinkumista), ja joissakin tapauksissa ne voivat johtaa vaikeaan anafylaksiaan (myös sokkiin).
Harvinaisissa tapauksissa on havaittu kuumetta.
Neutraloivia vasta-aineita (inhibiittoreita) voi kehittyä hemofilia A -potilaille, jotka saavat tekijä VIII hoitoa, kuten Octafil Low -valmistetta, ks. kohta Farmakodynamiikka. Mikäli tällaisia inhibiittoreita ilmaantuu, se näkyy riittämättömänä kliinisenä vasteena hoidolle. Tällaisissa tapauksissa on suositeltavaa ottaa yhteyttä erikoistuneeseen hemofiliakeskukseen.
Tartuntavaarallisiin aineisiin liittyvää turvallisuustietoa, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Haittavaikutukset taulukkomuodossa
Alla oleva taulukko on MedDRA-järjestelmän elinluokituksen mukainen (elinluokitus ja suositeltu termi).
Yleisyys on arvioitu seuraavasti: hyvin yleinen ((≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
MedDRA:n vakio elinluokitus | Haittavaikutus | Haittavaikutuksen esiintyvyys |
Immuunijärjestelmä | Yliherkkyysreaktio Anafylaktinen sokki | Harvinainen Hyvin harvinainen |
Yleisoireet ja antopaikassa todettavat haitat | Pyreksia | Harvinainen |
| Veri ja imukudos | Tekijä VIII:n inhibitio | Melko harvinainen (PTP)* Hyvin harvinainen (PUP)* |
Tutkimukset | Hyytymistekijän VIII vasta-aineet positiiviset | Harvinainen |
| *Yleisyys perustuu kaikilla tekijä VIII -valmisteilla tehtyihin tutkimuksiin, joihin osallistui vaikeaa hemofilia A:ta sairastavia potilaita. PTP = aiemmin hoidetut potilaat, PUP = aiemmin hoitamattomat potilaat | ||
Pediatriset potilaat
Haittavaikutusten esiintymistiheys, tyyppi ja vakavuusaste on lapsilla sama kuin aikuisilla.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
FI-00034 Fimea
Yliannostus
Yliannostustapauksia ei ole raportoitu.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: hemostaatit: veren hyytymistekijä VIII, ATC-koodi: B02BD02
Hyytymistekijä VIII / von Willebrand -tekijä -kompleksi koostuu kahdesta molekyylistä (hyytymistekijä VIII ja von Willebrand -tekijä), joiden fysiologiset funktiot ovat erilaiset. Kun hyytymistekijää VIII annetaan infuusiona hemofiliapotilaalle, se sitoutuu potilaan verenkierrossa olevaan von Willebrand -tekijään.
Aktivoitu hyytymistekijä VIII toimii aktivoidun hyytymistekijän IX kofaktorina nopeuttaen hyytymistekijän X muuttumista aktivoiduksi hyytymistekijäksi X. Aktivoitu hyytymistekijä X muuttaa protrombiinin trombiiniksi. Sen jälkeen trombiini muuttaa fibrinogeenin fibriiniksi, ja muodostuu hyytymä.
A-hemofilia on sukupuoleen kytkeytynyt perinnöllinen veren hyytymishäiriö, joka johtuu normaalia pienemmästä hyytymistekijä VIII:C -pitoisuudesta. Se aiheuttaa verenvuototaipumusta niveliin, lihaksiin ja sisäelimiin. Vuotoja ilmenee spontaanisti tai onnettomuuden tai leikkauksen aiheuttaman kudosvaurion seurauksena. Korvaushoidolla suurennetaan hyytymistekijän VIII pitoisuutta plasmassa, jolloin puutos ja vuototaipumus pystytään väliaikaisesti korjaamaan.
On huomattava, että vuosittaista vuotomäärää (ABR) ei voida verrata eri hyytymistekijäkonsentraattien ja eri kliinisten tutkimusten välillä.
Aiemmin hoitamattomat potilaat
Vasta-aineita hyytymistekijää VIII kohtaan muodostuu pääasiassa aiemmin hoitamattomille potilaille. Prospektiivisessa avoimessa tutkimuksessa, jossa tarkasteltiin Octafil Low -valmisteen immunogeenisuutta aiemmin hoitamattomissa potilaissa, oli mukana 51 potilasta. Kaksikymmentä potilasta sai ensisijaisesti tarpeenmukaista hoitoa, ja 31 potilasta sai ennaltaehkäisevää hoitoa. Immunogeenisuuden arviointia koskevat kriteerit (ts. > 50 hoitopäivää ja tekijä VIII:n aktiivisuus perustasossa < 1 %) täytti 44 potilasta. Inhibiittorit poistuivat tavanomaisen Octafil Low -hoidon aikana ilman annoksen tai antovälin muutosta kahdella potilaalla (joista yhdellä oli korkean titterin ja yhdellä alhaisen titterin inhibiittoreita) kaikkiaan viidestä potilaasta, joilla oli inhibiittoreita. Kaikki inhibiittorit havaittiin potilailla, jotka saivat hoitoa tarpeen mukaan. Keskimääräinen aika korkean titterin ja alhaisen titterin inhibiittoreiden muodostumiseen oli 10 hoitopäivää (alue 3–19) ja vastaavasti 48 hoitopäivää.
Octafil Low -valmistetta arvioidaan immuunivasteen siedätyshoidon (ITI) induktiossa meneillään olevassa havainnoivassa kliinisessä tutkimuksessa.
Välianalyysissä niistä 69 potilaasta, jotka saivat Octafil Low -valmistetta immuunivasteen siedätyshoitoon, 49 on päättänyt tutkimuksen. Niillä potilailla, joilla inhibiittori saatiin poistettua, kuukausittaista verenvuotojen määrää saatiin huomattavasti alennettua.
Farmakokinetiikka
Hyytymistekijävalmisteen sisältämä hyytymistekijä VIII on ihmisplasman normaali aineosa ja toimii kuten endogeeninen hyytymistekijä VIII. Injektion jälkeen noin 2/3–¾ hyytymistekijä VIII:sta jää verenkiertoon. Plasmassa saavutettu hyytymistekijä VIII:n aktiivisuus pitää olla 80 %–120 % ennustetusta hyytymistekijä VIII:n aktiivisuudesta. Hyytymistekijä VIII:n aktiivisuus vähenee eksponentiaalisesti kaksitilamallin mukaisesti. Alkuvaiheessa tapahtuu jakaantuminen intravaskulaaristen ja muiden komponenttien (kehon nesteiden) välillä, eliminaation puoliintumisaika plasmassa on 3–6 tuntia. Seuraavassa hitaammassa vaiheessa (mikä luultavasti kuvastaa tekijä VIII kulutusta) puoliintumisaika vaihtelee 8–20 tuntiin, ollen keskimäärin 12 tuntia. Tämä vastaa todellista biologista puoliintumisaikaa.
Seuraavat Octafil Low -valmistetta koskevat tulokset saatiin kahdessa farmakokineettisessä tutkimuksessa, jotka tehtiin 10 ja 14 hemofilia A potilaalla:
| Saanto (% x IU-1 x kg) | AUC*standardi (% x h x IU-1 x kg) | Puoliin-tumisaika (h) | MRT* (h) | Puhdistuma (ml x h-1 x kg) | |
Tutkimus 1, n = 10 Keskiarvo ± SD* | 2,4 ± 0,36 | 45,5 ± 17,2 | 14,3 ± 4,01 | 19,6 ± 6,05 | 2,6 ± 1,21 |
Tutkimus 2, n = 14 Keskiarvo ± SD* | 2,4 ± 0,25 | 33,4 ± 8,50 | 12,6 ± 3,03 | 16,6 ± 3,73 | 3,2 ± 0,88 |
| AUC* = Alue käyrän alapuolella MRT* = Keskimääräinen viipymisaika SD* = Keskihajonta | |||||
Prekliiniset tiedot turvallisuudesta
Tri(n-butyyli)fosfaattia (TNBP) ja polysorbaattia 80 (tween 80), joita käytetään liuotin/detergentti- reagensseina SD-virus-inaktivointimenetelmässä Octafil Low -valmisteen valmistuksen aikana, koskevat toksikologiset tiedot, vaikkakin rajalliset jälkimmäisen suhteen, osoittavat että haittavaikutukset ovat epätodennäköisiä ennakoiduilla ihmisten annoksilla.
Moninkertaisetkaan annokset verrattuna ihmisille painokiloa kohden suositeltuihin eivät aiheuta toksisia vaikutuksia laboratorioeläimillä. Kummallakaan aineella ei todettu mutageenista vaikutusta.
Farmaseuttiset tiedot
Apuaineet
Injektiokuiva-aine
Natriumsitraatti
Natriumkloridi
Kalsiumkloridi
Glysiini
Liuotin
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Valmisteen antamiseen saa käyttää ainoastaan pakkauksessa olevia injektiovälineitä, koska hoito voi epäonnistua, jos ihmisen hyytymistekijää VIII adsorboituu joidenkin injektio- tai infuusiovälineiden sisäpintaan.
Kestoaika
2 vuotta
Käyttövalmis liuos on käytettävä välittömästi ja vain yhdellä hoitokerralla.
Säilytys
Säilytä jääkaapissa (2-8 °C).
Ei saa jäätyä.
Pidä injektiopullot ulkopakkauksessa. Herkkä valolle.
Käyttökuntoon saatetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
OCTAFIL LOW injektiokuiva-aine ja liuotin, liuosta varten
200 IU/ml (L:ei) 1000 IU + 5ml (688,77 €)
PF-selosteen tieto
1 Octafil Low -pakkaus sisältää:
- injektiokuiva-aine injektiopullossa (tyypin I lasi), jossa on bromobutyylikumitulppa ja repäisykorkki.
- 5 ml liuotinta injektiopullossa (tyypin I lasi), jossa on bromobutyylikumitulppa ja repäisykorkki.
- 1 välineistö laskimonsisäistä injektiota varten (1 siirtolaite, 1 infuusiovälineistö, 1 kertakäyttöinen ruisku)
-
2 desinfiointipyyhettä.
Saatavilla oleva pakkauskoko sisältää ihmisen veren hyytymistekijä VIII:aa:
1000 IU / injektiopullo: käyttövalmiiksi saattaminen 5 ml:lla liuotinta.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Yksi Octafil-injektiopullo sisältää 1000 IU ihmisen veren hyytymistekijää VIII.
Valmisteen kuvaus:
Kuiva-aine on valkoista tai vaaleankeltaista jauhetta tai murenevaa massaa.
Liuotin on kirkas, väritön neste.
Käyttö- ja käsittelyohjeet
- Lue kaikki ohjeet ja noudata niitä huolellisesti!
- Älä käytä Octafil Low -valmistetta etikettiin merkityn viimeisen käyttöpäivän jälkeen.
- Säilytä steriiliys kaikkien alla kuvattujen työvaiheiden aikana!
- Tarkasta käyttökuntoon saatettu lääkevalmiste ennen sen antamista silmämääräisesti ja varmista, ettei siinä ole näkyviä hiukkasia eikä värimuutoksia.
- Liuoksen pitää olla kirkasta tai hieman läpikuultavaa. Älä käytä liuoksia, jotka ovat sameita tai joissa on hiukkasia.
- Käytä valmis liuos välittömästi mikrobikontaminaation välttämiseksi.
- Käytä ainoastaan mukana olevia infuusiovälineitä. Muiden injektio/infuusiolaitteiden käyttö saattaa lisätä riskejä ja aiheuttaa hoidon epäonnistumisen.
Ohjeet liuoksen valmistamiseksi:
1. Älä käytä valmistetta heti jääkaapista ottamisen jälkeen. Anna liuottimen ja kuiva-aineen lämmetä suljetuissa injektiopulloissa huoneenlämpöisiksi.
2. Irrota repäisykorkit molemmista injektiopulloista ja puhdista kummankin pullon kumitulppa pakkauksessa olevalla alkoholipyyhkeellä.
3. Siirtolaite on esitetty kuvassa 1. Aseta liuotinpullo tasaiselle alustalle ja pidä siitä tukevasti kiinni. Ota siirtolaite ja käännä se ylösalaisin. Aseta sen sininen osa liuotinpulloa vasten ja paina tiukasti, kunnes kuulet napsahduksen (kuvat 2+3). Älä väännä osia kiinnittäessäsi niitä toisiinsa.
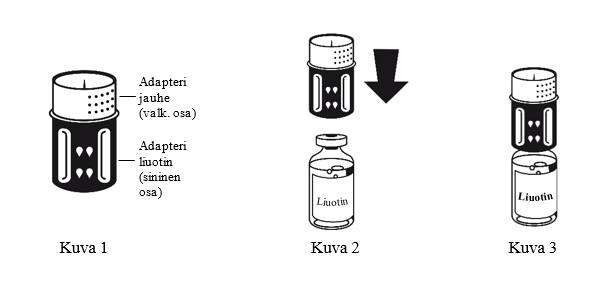
4. Aseta kuiva-ainepullo tasaiselle alustalle ja pidä siitä tukevasti kiinni. Käännä liuotinpullo, johonsiirtolaite on kiinnitetty, ylösalaisin. Aseta valkoinen osa kuiva-ainepulloa (jauhe) vasten ja paina lujasti, kunnes kuulet napsahduksen (kuva 4). Älä väännä osia kiinnittäessäsi niitä toisiinsa. Liuotin valuu automaattisesti kuiva-ainepulloon.
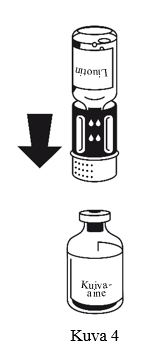
5. Pidä molemmat injektiopullot edelleen kiinni toisissaan ja pyöritä kuiva-ainepulloa varovasti, kunnes valmiste on liuennut.
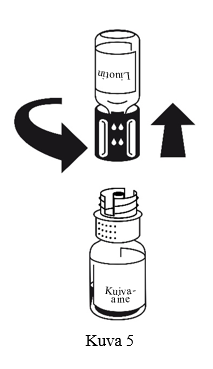
Injektiokuiva-aine liukenee huoneenlämmössä alle 10 minuutissa. Valmisteeseen voi muodostua hieman vaahtoa. Kierrä siirtolaite irti (kuva 5), jolloin vaahto häviää.
Hävitä tyhjä liuotinainepullo ja siinä oleva siirtolaitteen sininen osa.
Injisointiohjeet:
Pulssi on varmuuden vuoksi mitattava ennen lääkkeen injisointia ja sen aikana. Jos pulssi nousee selvästi, injektiota on hidastettava tai lääkkeen antaminen on keskeytettävä lyhyeksi aikaa.
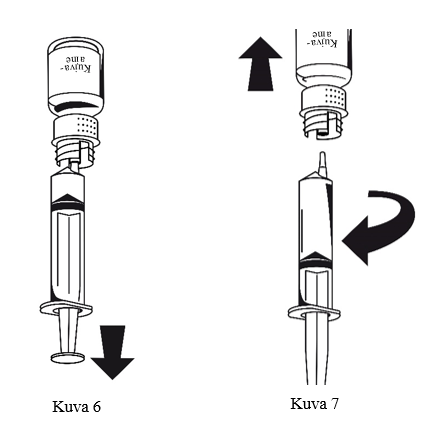
1. Kiinnitä ruisku siirtolaitteen valkoiseen osaan. Käännä pullo ylösalaisin ja vedä liuos ruiskuun (kuva 6).
Liuoksen tulee olla kirkasta tai hieman läpikuultavaa.
Kun liuos on siirretty, pidä ruiskun männästä tukevasti kiinni (ruisku edelleen ylösalaisin) ja irrota ruisku siirtolaitteesta (kuva 7).
Hävitä tyhjä injektiopullo yhdessä siirtolaitteen valkoisen osan kanssa.
2. Pyyhi aiottu injektiokohta pakkauksessa olevalla alkoholipyyhkeellä.
3. Kiinnitä mukana oleva infuusiovälineistö ruiskuun.
4. Työnnä neula ennalta valitsemaasi laskimoon. Jos olet käyttänyt kiristyssidettä suonen löytämiseksi, side tulee poistaa ennen Octafil Low -valmisteen injisointia. Ruiskuun ei saa päästä verta, sillä tällöin on vaarana fibriinihyytymien muodostuminen.
5. Ruiskuun ei saa päästä verta, sillä tällöin on vaarana fibriinihyytymien muodostuminen.
6. Ruiskuta liuos hitaasti laskimoon. Injektionopeus: 2–3 ml minuutissa. Jos käytät useamman Octafil Low -injektiokuiva-ainepullollisen yhden hoitokerran aikana, voit käyttää samaa neulaa ja ruiskua. Siirtolaite on tarkoitettu kertakäyttöön. Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
OCTAFIL LOW injektiokuiva-aine ja liuotin, liuosta varten
200 IU/ml 1000 IU + 5ml
- Ylempi erityiskorvaus (100 %). Krooniset hyytymishäiriöt (126).
- Peruskorvaus (40 %).
ATC-koodi
B02BD02
Valmisteyhteenvedon muuttamispäivämäärä
20.11.2023
Yhteystiedot
Rajatorpantie 41 C
01640 Vantaa
09 8520 2710
www.octapharma.fi
info@octapharma.fi
