TEMODAL infuusiokuiva-aine, liuosta varten 2,5 mg/ml
Vaikuttavat aineet ja niiden määrät
Yksi injektiopullo sisältää 100 mg temotsolomidia.
Käyttökuntoon saattamisen jälkeen 1 ml infuusioliuosta sisältää 2,5 mg temotsolomidia.
Apuaine(et), joiden vaikutus tunnetaan:
Yksi injektiopullo sisältää 55,2 mg natriumia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Infuusiokuiva-aine, liuosta varten
Kliiniset tiedot
Käyttöaiheet
Temodal on tarkoitettu:
- aikuisille vastikään todetun glioblastoma multiformen hoitoon annettuna sädehoidon yhteydessä ja sen jälkeen yksinään.
- yli 3-vuotiaille lapsille, nuorille ja aikuisille malignin gliooman, kuten glioblastoma multiformen tai anaplastisen astrosytooman hoitoon, kun näiden todetaan uusiutuvan tai etenevän tavanomaisen hoidon jälkeen.
Ehto
Temotsolomidia määräävän lääkärin tulee olla perehtynyt aivokasvainten hoitoon.
Annostus ja antotapa
Temodal-valmistetta määräävän lääkärin tulee olla perehtynyt aivokasvainten onkologiseen hoitoon.
Antiemeettistä hoitoa voidaan antaa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Annostus
Aikuiset, joilla on vastikään todettu glioblastoma multiforme
Temodal-valmistetta annetaan samanaikaisesti fokaalisen sädehoidon kanssa (samanaikainen vaihe) ja sen jälkeen enintään 6 syklin pituisena temotsolomidimonoterapiana (monoterapiavaihe).
Samanaikainen vaihe
Temotsolomidi annetaan annoksena 75 mg/m² päivässä 42 päivän ajan samanaikaisesti fokaalisen sädehoidon kanssa (60 Gy annettuna 30 fraktiona). Annoksen pienentämistä ei suositella, mutta temotsolomidin annon myöhäistämisestä tai keskeyttämisestä päätetään viikoittain hematologisten ja ei-hematologisten toksisuuskriteerien mukaan.
Temotsolomidin antamista voidaan jatkaa 42 päivän pituisen samanaikaisen vaiheen ajan, enintään 49 päivän ajan, jos kaikki seuraavat ehdot täyttyvät:
- neutrofiilien absoluuttinen määrä (ANC) on ≥ 1,5 x 109/l
- verihiutaleiden määrä ≥ 100 x 109/l
- yleisten toksisuuskriteerien (Common Toxicity Criteria, CTC) luokka on ≤ 1 (lukuun ottamatta alopesiaa, pahoinvointia ja oksentelua).
Hoidon aikana viikoittain määritetään täydellinen verenkuva. Temotsolomidin anto keskeytetään väliaikaisesti tai lopetetaan pysyvästi samanaikaisen vaiheen aikana hematologisten ja ei-hematologisten toksisuuskriteerien mukaan kuten on esitetty taulukossa 1.
Taulukko 1. Temotsolomidin antamisen keskeyttäminen tai lopettaminen samanaikaisen sädehoito- ja temotsolomidivaiheen aikana | ||
Toksisuus | Temotsolomidin keskeyttäminena | Temotsolomidin lopettaminen |
Neutrofiilien absoluuttinen määrä | ≥ 0,5 ja < 1,5 x 109/l | < 0,5 x 109/l |
Verihiutaleiden määrä | ≥ 10 ja < 100 x 109/l | < 10 x 109/l |
CTC ei-hematologinen toksisuus (lukuun ottamatta alopesiaa, pahoinvointia, oksentelua) | CTC luokka 2 | CTC luokka 3 tai 4 |
a: Samanaikaista hoitoa temotsolomidilla voidaan jatkaa, jos kaikki seuraavat ehdot täyttyvät: neutrofiilien absoluuttinen määrä ≥ 1,5 x 109/l; verihiutaleiden määrä ≥ 100 x 109/l; CTC ei-hematologinen toksisuus ≤ luokka 1 (lukuun ottamatta alopesiaa, pahoinvointia, oksentelua). | ||
Monoterapiavaihe
Neljä viikkoa temotsolomidi + sädehoito – vaiheen jälkeen temotsolomidia annetaan yksinään enintään 6 hoitosyklin ajan. Annos hoitosyklissä 1 (monoterapia) on 150 mg/m² kerran päivässä 5 päivän ajan, minkä jälkeen on 23 päivän tauko. Syklin 2 alussa annosta suurennetaan tasolle 200 mg/m², jos CTC:n kriteerin luokka ei-hematologiselle toksisuudelle syklissä 1 on ≤ 2 (lukuun ottamatta alopesiaa, pahoinvointia ja oksentelua), neutrofiilien absoluuttinen määrä (ANC) on ≥ 1,5 x 109/l ja verihiutaleiden määrä ≥ 100 x 109/l. Jos annosta ei suurennettu syklissä 2, suurentamista ei pidä tehdä myöhemmissäkään sykleissä. Jos annosta suurennettiin, se jätetään tasolle 200 mg/m² kerran päivässä ensimmäisten 5 päivän ajan jokaisessa seuraavassa syklissä, paitsi jos ilmenee toksisuutta. Annoksen pienentämiseen ja keskeyttämiseen monoterapiavaiheen aikana tulee soveltaa taulukoiden 2 ja 3 ohjeita.
Hoidon aikana määritetään täydellinen verenkuva 22. päivänä (21 päivää ensimmäisen temotsolomidi-annoksen jälkeen). Annosta tulee pienentää tai hoito keskeyttää taulukon 3 mukaisesti.
Taulukko 2. Temotsolomidin annostasot monoterapiahoidossa | ||
Annostaso | Temotsolomidi-annos (mg/m2/vrk) | Huomioita |
–1 | 100 | Annoksen pienentäminen aiemman toksisuuden vuoksi |
0 | 150 | Annos syklin 1 aikana |
1 | 200 | Annos sykleissä 2-6, jos ei toksisuutta |
Taulukko 3. Temotsolomidiannoksen pienentäminen tai hoidon keskeyttäminen monoterapiahoidossa | ||
Toksisuus | Pienennä temotsolomidi-annos yhdellä annostasollaa | Keskeytä temotsolomidi |
Neutrofiilien absoluuttinen määrä | < 1,0 x 109/l | Katso alaviite b |
Verihiutaleiden määrä | < 50 x 109/l | Katso alaviite b |
CTC ei-hematologinen toksisuus (lukuun ottamatta alopesiaa, pahoinvointia, oksentelua) | CTC luokka 3 | CTC luokka 4b |
a: temotsolomidin annostasot lueteltu taulukossa 2.
| ||
Aikuiset ja yli 3-vuotiaat pediatriset potilaat, joilla on uusiutuva tai etenevä maligni gliooma:
Hoitosyklin pituus on 28 päivää. Potilaille, jotka eivät aiemmin ole saaneet kemoterapia-aineita, temotsolomidia annetaan 200 mg/m² kerran päivässä ensimmäisten 5 päivän ajan, minkä jälkeen on 23 päivän tauko (yhteensä 28 päivää). Kemoterapia-aineita aiemmin saaneilla potilailla alkuannos on 150 mg/m² kerran päivässä, seuraavassa syklissä 200 mg/m² kerran päivässä 5 päivän ajan, jos hematologista toksisuutta ei havaita (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Erityiset potilasryhmät
Pediatriset potilaat
3-vuotiaille ja sitä vanhemmille potilaille temotsolomidia käytetään vain uusiutuvan tai etenevän malignin gliooman hoitoon. Tietoja lääkkeen käytöstä tässä ikäryhmässä on erittäin vähän (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakodynamiikka). Temotsolomidin turvallisuutta ja tehoa alle 3 vuoden ikäisten lasten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Potilaat, joilla on maksan tai munuaisten toimintahäiriö
Temotsolomidin farmakokinetiikka oli samanlainen potilailla, joilla oli normaali maksan toiminta kuin niillä potilailla, joilla oli lievä tai kohtalainen maksan toimintahäiriö. Ei ole tietoa temotsolomidin antamisesta potilaille, joilla on vakava maksan toimintahäiriö (Child’in luokka C) tai munuaisten toimintahäiriö. Temotsolomidin farmakokineettisien ominaisuuksien perusteella on epätodennäköistä, että potilailla, joilla on vakava maksan toimintahäiriö tai minkä tahansa asteinen munuaisten toimintahäiriö, tarvittaisiin annoksen pienentämistä. On kuitenkin syytä noudattaa varovaisuutta, kun temotsolomidia annetaan näille potilaille.
Iäkkäät potilaat
Populaatiofarmakokineettisen analyysin perusteella 19-78-vuotiailla potilailla ikä ei vaikuta temotsolomidin munuaispuhdistumaan. Iäkkäillä potilailla (yli 70-vuotiailla) neutropenian ja trombosytopenian riski on kuitenkin kohonnut (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Antotapa
Temodal 2,5 mg/ml infuusiokuiva-aine, liuosta varten, annetaan vain infuusiona laskimoon. Sitä ei saa antaa käyttäen muita antoreittejä kuten selkäydinnesteeseen, lihakseen tai ihon alle. Temodal 2,5 mg/ml infuusiokuiva-aine, liuosta varten, voidaan antaa saman laskimolinjan kautta kuin 0,9 % natriumkloridiliuos. Se on yhteensopimaton glukoosin kanssa.
Tarvittava annos temotsolomidia annetaan laskimoon 90 minuutin kestoisena infuusiona infuusiopumppua käyttäen.
Kuten muillakin vastaavanlaisilla kemoterapia-aineilla, varovaisuutta on syytä noudattaa, jotta vältettäisiin ekstravasaatio. Paikallisia pistokohdan reaktioita, jotka olivat enimmäkseen lieviä ja lyhytkestoisia, on raportoitu Temodal 2,5 mg/ml infuusiokuiva-ainetta, liuosta varten, saaneilla potilailla. Prekliinisissä tutkimuksissa ei havaittu pysyviä kudosvaurioita (ks. kohdat Haittavaikutukset ja Prekliiniset tiedot turvallisuudesta).
Temodal-valmiste on saatavilla myös kovina kapseleina (suun kautta otettavaksi). Temodal 2,5 mg/ml infuusiokuiva-aine, liuosta varten, annettuna 90 minuutin kestoisena infuusiona laskimoon on bioekvivalentti kovien kapselien kanssa (ks. kohta Farmakokinetiikka).
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Yliherkkyys dakarbatsiinille (DTIC).
Vakava myelosuppressio (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Varoitukset ja käyttöön liittyvät varotoimet
Opportunistiset infektiot ja infektioiden reaktivaatio
Opportunistisia infektioita (kuten Pneumocystis jirovecii -keuhkokuumetta) ja infektioiden (kuten hepatiitti B -viruksen ja sytomegaloviruksen) reaktivaatiota on havaittu temotsolomidihoidon aikana (ks. kohta Haittavaikutukset).
Herpeettinen meningoenkefaliitti
Myyntiluvan myöntämisen jälkeisessä seurannassa on havaittu herpeettistä meningoenkefaliittia (myös kuolemaan johtaneita tapauksia) potilailla, jotka ovat saaneet temotsolomidia sädehoitoon yhdistettynä, mukaan lukien tapaukset, joissa on annettu samanaikaisesti steroideja.
Pneumocystis jirovecii –keuhkokuume
Potilailla, jotka saivat pilottitutkimuksessa temotsolomidia ja samanaikaisesti sädehoitoa 42 päivän pituisen tutkimusohjelman mukaisesti, näytti olevan erityinen riski saada Pneumocystis jirovecii –keuhkokuume (PCP). Siksi on tarpeen antaa estolääkitys PCP:tä vastaan kaikille potilaille, jotka saavat samanaikaisesti temotsolomidia ja sädehoitoa 42 päivän hoitojakson ajan (enintään 49 päivää) huolimatta lymfosyyttien määrästä. Jos havaitaan lymfopeniaa, estolääkitystä tulee jatkaa kunnes lymfopenia korjaantuu niin, että sen luokka on ≤ 1.
PCP-keuhkokuumetta saattaa esiintyä enemmän käytettäessä temotsolomidia pitkäaikaisesti. Kaikkia temotsolomidia saavia potilaita, erityisesti potilaita, jotka saavat myös steroideja, on kuitenkin tarkkailtava huolellisesti hoito-ohjelmasta riippumatta, jotta havaitaan PCP:n ilmaantuminen. Temotsolomidia saaneilla potilailla on raportoitu kuolemaan johtanutta hengityksen vajaatoimintaa, erityisesti käytettäessä samanaikaisesti deksametasonia tai muita steroideja.
Hepatiitti B -virus
Hepatiitti B -viruksen aktivoitumisesta johtuvaa hepatiittia, joka joissain tapauksissa on johtanut kuolemaan, on raportoitu. Maksasairauksiin perehtynyttä asiantuntijaa on syytä konsultoida ennen hoidon aloitusta, jos potilaalla on positiivinen hepatiitti B -viruksen serologia (myös jos potilaalla on aktiivinen tauti). Hoidon aikana potilaan tilaa pitää seurata ja hoitaa asianmukaisesti.
Maksatoksisuus
Maksavaurioita, myös kuolemaan johtanutta maksan vajaatoimintaa, on raportoitu temotsolomidia saaneilla potilailla (ks. kohta Haittavaikutukset). Maksan toimintakokeet pitää tehdä lähtötilanteessa ennen hoidon aloitusta. Jos niissä ilmenee poikkeavuuksia, lääkärin pitää ennen hoidon aloitusta arvioida hyöty–haitta-suhde sekä fataalin maksan vajaatoiminnan mahdollisuus. Potilaille, jotka saavat lääkettä 42 päivän syklissä, maksan toimintakokeet pitää tehdä uudelleen syklin puolivälissä. Kaikille potilaille maksan toimintakokeet pitää tehdä jokaisen hoitosyklin jälkeen. Lääkärin pitää arvioida hoidon jatkamisen hyöty–haitta-suhde, jos potilaan maksan toiminta on merkittävästi heikentynyt. Maksatoksisuus voi ilmaantua useita viikkoja tai kauemminkin viimeisen temotsolomidihoidon jälkeen.
Maligniteetit
Hyvin harvoin on havaittu myelodysplastista oireyhtymää ja sekundaarisia maligniteetteja, mukaan lukien myelooinen leukemia (ks. kohta Haittavaikutukset).
Antiemeettihoito
Pahoinvointi ja oksentelu liittyvät erittäin yleisesti temotsolomidihoitoon.
Antiemeettihoitoa voidaan antaa ennen temotsolomidia tai sen jälkeen.
Aikuiset potilaat, joilla on vastikään todettu glioblastoma multiforme
Pahoinvoinnin estolääkitystä suositellaan ennen ensimmäistä samanaikaista temotsolomidiannosta ja se on erittäin suositeltavaa monoterapiavaiheen aikana.
Potilaat, joilla on uusiutuva tai etenevä maligni gliooma
Potilaat, joilla on ollut voimakasta (luokkaa 3 tai 4) pahoinvointia aikaisempien hoitosyklien aikana, saattavat tarvita antiemeettihoitoa.
Laboratorioarvot
Temotsolomidilla hoidetuilla potilailla saattaa esiintyä myelosuppressiota, mukaan lukien pitkittynyttä pansytopeniaa. Myelosuppression seurauksena saattaa kehittyä aplastinen anemia, joka on joissain tilanteissa johtanut kuolemaan. Joissain tapauksissa samanaikainen altistus aplastisen anemian ilmaantumiseen liitetyille lääkkeille kuten karbamatsepiinille, fenytoiinille ja sulfametoksatsoli/trimetopriimille vaikeuttaa arviointia. Ennen annon aloittamista tulee saavuttaa seuraavat laboratorioarvot: neutrofiilien absoluuttinen määrä (ANC) ≥ 1,5 x 109/l ja verihiutaleiden määrä ≥ 100 x 109/l. Täydellinen verenkuva tulee määrittää 22. päivänä (21 päivän kuluttua ensimmäisestä annoksesta) tai 48 tunnin sisällä tuosta päivästä, ja sitten viikoittain, kunnes ANC on yli 1,5 x 109/l ja verihiutaleiden määrä yli 100 x 109/l. Mikäli jonkin syklin aikana ANC laskee arvoon < 1,0 x 109/l tai verihiutaleiden määrä on < 50 x 109/l, annosta pienennetään seuraavan syklin aikana yhtä alemmalle tasolle (ks. kohta Annostus ja antotapa). Annostasot ovat 100 mg/m², 150 mg/m² ja 200 mg/m². Pienin suositeltava annos on 100 mg/m².
Pediatriset potilaat
Alle 3-vuotiaiden lasten hoidosta temotsolomidilla ei ole kliinistä kokemusta. Kokemukset tätä vanhempien lasten ja nuorten hoidosta ovat hyvin vähäisiä (ks. kohdat Annostus ja antotapa ja Farmakodynamiikka).
Iäkkäät potilaat (yli 70-vuotiaat)
Iäkkäillä potilailla näyttää olevan suurempi neutropenian ja trombosytopenian riski nuorempiin potilaisiin verrattuna. Siksi tulee noudattaa erityistä varovaisuutta annettaessa temotsolomidia iäkkäille potilaille.
Naispotilaat
Hedelmällisessä iässä olevien naisten on käytettävä tehokasta ehkäisymenetelmää välttääkseen raskaaksi tulon temotsolomidihoidon aikana ja vähintään 6 kuukauden ajan hoidon lopettamisen jälkeen.
Miespotilaat
Temotsolomidilla hoidettavien miesten tulee välttää saattamasta kumppaniaan raskaaksi vähintään 3 kuukauden ajan viimeisen annoksen saamisesta ja kysyä neuvoa sperman pakastamisesta ennen hoitoa (ks. kohta Raskaus ja imetys).
Natrium
Tämä lääkevalmiste sisältää 55,2 mg natriumia per injektiopullo, joka vastaa 2,8 % WHO:n suosittelemasta natriumin 2 g:n päivittäisestä enimmäissaannista aikuisille. Tämä tulee ottaa huomioon potilailla, joilla on ruokavalion natriumrajoitus.
Yhteisvaikutukset
Yksittäisessä faasi I:n tutkimuksessa temotsolomidin anto ranitidiinin kanssa ei muuttanut imeytyvän temotsolomidin määrää tai altistusta sen aktiiviselle metaboliitille monometyylitriatsenoimidatsolikarboksamidille (MTIC:lle).
Faasi II:n tutkimusten populaatiofarmakokineettisen analyysin perusteella samanaikaisesti annettu deksametasoni, proklooriperatsiini, fenytoiini, karbamatsepiini, ondansetroni, H2-reseptoriantagonistit tai fenobarbitaali eivät muuttaneet temotsolomidin puhdistumaa. Valproaattihapon samanaikaiseen käyttöön liittyi pieni, mutta tilastollisesti merkitsevä väheneminen temotsolomidin puhdistumassa.
Ei ole tehty tutkimuksia, joissa selvitettäisiin temotsolomidin vaikutusta muiden lääkeaineiden metaboliaan tai eliminaatioon. Koska temotsolomidi ei kuitenkaan käy läpi maksametaboliaa ja se sitoutuu vain vähän proteiineihin, on epätodennäköistä, että se vaikuttaisi muiden lääkevalmisteiden farmakokinetiikkaan (ks. kohta Farmakokinetiikka).
Käytettäessä temotsolomidia muiden myelosuppressiivisten aineiden kanssa myelosuppression todennäköisyys voi kasvaa.
Pediatriset potilaat
Yhteisvaikutuksia on tutkittu vain aikuisilla tehdyissä tutkimuksissa.
Raskaus ja imetys
Raskaus
Ei ole olemassa tietoja temotsolomidin käytöstä raskaana oleville naisille. Prekliinisissä kokeissa rotilla ja kaniineilla temotsolomidiannoksella 150 mg/m² ilmeni teratogeenisuutta ja/tai fetaalista toksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Temodal-valmistetta ei tule antaa raskaana oleville naisille. Jos käyttöä raskauden aikana kuitenkin harkitaan, sikiölle mahdollisesti aiheutuva riski tulee selvittää potilaalle.
Imetys
Ei tiedetä, erittyykö temotsolomidi ihmisen rintamaitoon. Siten imettäminen tulisi lopettaa temotsolomidihoidon ajaksi.
Hedelmällisyys
Hedelmällisessä iässä olevien naisten on käytettävä tehokasta ehkäisymenetelmää välttääkseen raskaaksi tulon temotsolomidihoidon aikana ja vähintään 6 kuukauden ajan hoidon lopettamisen jälkeen.
Miesten hedelmällisyys
Temotsolomidilla saattaa olla genotoksisia vaikutuksia. Tästä johtuen temotsolomidilla hoidettujen miesten tulee käyttää tehokasta ehkäisymenetelmää ja välttää saattamasta kumppaniaan raskaaksi vähintään 3 kuukauden ajan viimeisen annoksen saamisen jälkeen ja kysyä neuvoa sperman pakastamisesta ennen hoitoa, sillä temotsolomidihoito saattaa aiheuttaa pysyvän hedelmättömyyden.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Temotsolomidilla on vähäinen vaikutus ajokykyyn ja koneiden käyttökykyyn väsymyksestä ja uneliaisuudesta johtuen (ks. kohta Haittavaikutukset).
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Kokemukset kliinisistä tutkimuksista kovilla kapseleilla
Kliinisissä tutkimuksissa temotsolomidia saaneilla potilailla yleisimpiä haittavaikutuksia olivat pahoinvointi, oksentelu, ummetus, ruokahaluttomuus, päänsärky, väsymys, kouristukset ja ihottuma. Useimpia hematologisia haittavaikutuksia raportoitiin yleisesti. Luokan 3-4 laboratoriolöydösten esiintymistiheydet esitetään taulukon 4 alla.
Potilailla, joilla oli uusiutuva tai etenevä gliooma, pahoinvointi (43 %) ja oksentelu (36 %) olivat tavallisesti luokkaa 1 tai 2 (0–5 oksennuskohtausta 24 tunnin aikana), ja ne joko lievittyivät itsestään tai saatiin hyvin hallintaan antiemeettihoidolla. Vaikea-asteista pahoinvointia ja oksentelua havaittiin 4 %:lla potilaista.
Haittavaikutustaulukko
Kliinisissä tutkimuksissa havaitut sekä temotsolomidin markkinoillaolon aikana raportoidut haittavaikutukset on esitetty taulukossa 4. Nämä haittavaikutukset on lueteltu elinjärjestelmäluokkien ja esiintymistiheyksien mukaan. Esiintymistiheyksien luokat on määritelty seuraavasti: Hyvin yleinen (≥ 1/10); yleinen (≥ 1/100, < 1/10); melko harvinainen (≥ 1/1 000, < 1/100); harvinainen (≥ 1/10 000, < 1/1000); hyvin harvinainen (< 1/10 000); tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin). Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 4. Haittavaikutukset temotsolomidia saavilla potilailla | |
Infektiot | |
Yleinen: | Infektiot, herpes zoster, nielutulehdusa, suun kandidiaasi |
Melko harvinainen: | Opportunisti-infektiot (mukaan lukien PCP), sepsis†,herpeettinen meningoenkefaliitti†, sytomegalovirusinfektio, sytomegaloviruksen reaktivaatio, hepatiitti B -virus†, herpes simplex, infektion reaktivaatio, haavainfektio, maha-suolitulehdusb |
Hyvän- ja pahanlaatuiset kasvaimet | |
Melko harvinainen: | Myelodysplastinen oireyhtymä (MDS), sekundaariset maligniteetit mukaan lukien myelooinen leukemia |
Veri ja imukudos | |
Yleinen: | Kuumeinen neutropenia, neutropenia, trombosytopenia, lymfopenia, leukopenia, anemia |
Melko harvinainen: | Pitkittynyt pansytopenia, aplastinen anemia†, pansytopenia, petekia |
Immuunijärjestelmä | |
Yleinen: | Allerginen reaktio |
Melko harvinainen: | Anafylaksi |
Umpieritys | |
Yleinen: | Cushingoidic |
Melko harvinainen: | Diabetes insipidus |
Aineenvaihdunta ja ravitsemus | |
Hyvin yleinen: | Ruokahaluttomuus |
Yleinen: | Hyperglykemia |
Melko harvinainen: | Hypokalemia, alkalisen fosfataasin lisääntyminen |
Psyykkiset häiriöt | |
Yleinen: | Kiihtyneisyys, muistinmenetys, masentuneisuus, ahdistuneisuus, sekavuus, unettomuus |
Melko harvinainen: | Käytöshäiriö, mielialan horjuvuus, aistiharhat, välinpitämättömyys |
Hermosto | |
Hyvin yleinen: | Kouristukset, hemipareesi, afasia/dysfasia, päänsärky |
Yleinen: | Ataksia, heikentynyt tasapaino, heikentynyt kognitio, keskittymisvaikeudet, alentunut tajunnantaso, heitehuimaus, alentunut tuntoherkkyys, muistin heikkeneminen, neurologinen häiriö, neuropatiad, tuntohäiriö, uneliaisuus, puhehäiriö, makuaistin muutokset, vapina |
Melko harvinainen: | Status epilepticus, toispuolihalvaus, ekstrapyramidaalinen häiriö, hajuharha, epänormaali käynti, lisääntynyt tuntoherkkyys, aistihäiriö, poikkeava koordinaatio |
Silmät | |
Yleinen: | Toispuoleinen näkökenttäpuutos, näön sumentuminen, näköhäiriöe, näkökentän häiriö, kahtena näkeminen, kipu silmässä |
Melko harvinainen: | Näöntarkkuuden heikkeneminen, silmien kuivuminen |
Kuulo ja tasapainoelin | |
Yleinen: | Kuurousf, kiertohuimaus, tinnitus, kipu korvassag |
Melko harvinainen: | Kuulon heikkeneminen, hyperakusia, välikorvatulehdus |
Sydän | |
Melko harvinainen: | Palpitaatio |
Verisuonisto | |
Yleinen: | Verenvuoto, keuhkoveritulppa, syvä laskimotukos, hypertensio |
Melko harvinainen: | Aivoverenvuoto, punastuminen, kuumat aallot |
Hengityselimet, rintakehä ja välikarsina | |
Yleinen: | Keuhkokuume, hengenahdistus, sinuiitti, keuhkoputkitulehdus, yskä, ylähengitystieinfektio |
Melko harvinainen: | Hengityksen vajaatoiminta†, interstitiaalinen keuhkokuume/keuhkokuume, keuhkofibroosi, nenän tukkoisuus |
Ruoansulatuselimistö | |
Hyvin yleinen: | Ripuli, ummetus, pahoinvointi, oksentelu |
Yleinen: | Suutulehdus, vatsakipuh, dyspepsia, nielemishäiriöt |
Melko harvinainen: | Vatsan pullistuminen, ulosteenpidätyskyvyttömyys, ruoansulatuskanavan häiriö, peräpukamat, suun kuivuminen |
Maksa ja sappi | |
Melko harvinainen: | Maksan vajaatoiminta†, maksavaurio, maksatulehdus, kolestaasi, hyperbilirubinemia |
Iho ja ihonalainen kudos | |
Hyvin yleinen: | Ihottuma, alopesia |
Yleinen: | Eryteema, ihon kuivuminen, kutina |
Melko harvinainen: | Toksinen epidermaalinen nekrolyysi, Stevens-Johnsonin oireyhtymä, angioedeema, erythema multiforme, erytrodermia, ihon hilseily, valoherkkyysreaktio, urtikaria, eksanteema, ihotulehdus, lisääntynyt hikoilu, epänormaali pigmentaatio |
Tuntematon: | Lääkeainereaktio, johon liittyy eosinofiliaa ja systeemisiä oireita (DRESS) |
Luusto, lihakset ja sidekudos | |
Yleinen: | Myopatia, lihasten heikkous, nivelkipu, selkäkipu, luu- ja lihaskipu, lihassärky |
Munuaiset ja virtsatiet | |
Yleinen: | Runsas virtsaaminen, virtsainkontinenssi |
Melko harvinainen: | Dysuria |
Sukupuolielimet ja rinnat | |
Melko harvinainen: | Verenvuoto emättimessä, menorragia, amenorrea, emätintulehdus, kipu rinnoissa, impotenssi |
Yleisoireet ja antopaikassa todettavat haitat | |
Hyvin yleinen: | Väsymys |
Yleinen: | Kuume, influenssan kaltaiset oireet, astenia, huonovointisuus, kipu, turvotus, perifeerinen turvotusi |
Melko harvinainen: | Voinnin huononeminen, vilunväreet, kasvojen turvotus, kielen värjäytyminen, janon tunne, hampaan häiriö |
Tutkimukset | |
Yleinen: | Maksaentsyymien kohoaminenj, painon aleneminen, painon lisääntyminen |
Melko harvinainen: | Gamma GT-arvon kohoaminen |
Vammat, myrkytykset ja hoitokomplikaatiot | |
Yleinen: | Sädetysvauriok |
| aSisältää: nielutulehdus, nasofaryngeaalinen nielutulehdus, streptokokin aiheuttama nielutulehdus bSisältää: maha-suolitulehdus, viruksen aiheuttama maha-suolitulehdus cSisältää: cushingoidi, Cushingin oireyhtymä dSisältää: neuropatia, perifeerinen neuropatia, polyneuropatia, perifeerinen sensorinen neuropatia, perifeerinen motorinen neuropatia eSisältää: näön heikkeneminen, silmän toimintahäiriö fSisältää: kuurous, molemminpuolinen kuurous, neurosensorinen kuurous, toispuoleinen kuurous gSisältää: korvakipu, epämiellyttävä tuntemus korvassa hSisältää: vatsakipu, alavatsakipu, ylävatsakipu, epämiellyttävä tuntemus vatsassa iSisältää: perifeerinen edeema, perifeerinen turvotus jSisältää: maksan toimintakokeiden arvojen kohoaminen, ALAT-arvon kohoaminen, ASAT-arvon kohoaminen, maksaentsyymien kohoaminen kSisältää: sädetysvaurio, ihon sädetysvaurio † Sisältää: kuolemaan johtaneet tapaukset | |
Vastikään todettu glioblastoma multiforme
Laboratoriotulokset
Hoidon aikana havaittiin luuydinsuppressiota (neutropeniaa ja trombosytopeniaa), jonka tiedetään olevan useimpien sytotoksisten aineiden, mukaan lukien temotsolomidin, annosta rajoittava haittavaikutus. Kun samanaikaisen vaiheen ja monoterapiavaiheen laboratorioarvojen poikkeamat ja haittavaikutukset yhdistettiin, havaittiin luokan 3 tai 4 neutrofiilisia poikkeamia mukaan lukien neutropeniaa 8 %:lla potilaista. Luokan 3 tai 4 trombosyyttisiä poikkeamia, mukaan lukien trombosytopeeniset tapahtumat, havaittiin 14 %:lla temotsolomidia saaneista potilaista.
Uusiutuva tai etenevä maligni gliooma
Laboratoriotulokset
Luokan 3 tai 4 trombosytopeniaa ilmeni 19 %:lla ja neutropeniaa 17 %:lla malignia glioomaa sairastavista potilaista. Tämä johti potilaan ottamiseen sairaalaan ja/tai temotsolomidihoidon keskeyttämiseen 8 %:lla (trombosytopenia) ja 4 %:lla (neutropenia) glioomapotilaista. Myelosuppressio oli ennustettavissa (yleensä ensimmäisten hoitosyklien aikana, nadiiriarvon ollessa päivien 21 ja 28 välillä) ja toipuminen siitä tapahtui nopeasti, tavallisesti 1 - 2 viikossa. Kumulatiivista myelosuppressiota ei ollut havaittavissa. Trombosytopenia saattaa lisätä verenvuodon mahdollisuutta ja neutropenia tai leukopenia saattavat suurentaa infektioriskiä.
Sukupuoli
Kliinisten tutkimusten populaatiofarmakokineettisessä analyysissä oli mukana 101 naispuolista ja 169 miespuolista koehenkilöä, joilta neutrofiilimäärien nadiiriarvot olivat saatavilla ja 110 naista ja 174 miestä, joilta oli saatavilla trombosyyttien nadiiriarvot. Naisilla oli luokan 4 neutropeniaa (ANC < 0,5 x 109/l) enemmän kuin miehillä, 12 % vs 5 %, ja naisilla oli enemmän trombosytopeniaa (< 20 x 109/l) kuin miehillä, 9 % vs 3 % ensimmäisen hoitosyklin aikana. 400:n uusiutuvaa glioomaa sairastavan koehenkilön tiedostossa luokan 4 neutropeniaa todettiin 8 %:lla naispotilaista ja 4 %:lla miespotilaista ensimmäisen hoitosyklin aikana ja luokan 4 trombosytopeniaa 8 %:lla naisista ja 3 %:lla miehistä ensimmäisen hoitosyklin aikana. Tutkimuksessa, jossa oli mukana 288 vastikään todettua glioblastoma multiformea sairastavaa henkilöä, luokan 4 neutropeniaa havaittiin 3 %:lla naisista ja 0 %:lla miehistä ja luokan 4 trombosytopeniaa 1 %:lla naisista ja 0 %:lla miehistä ensimmäisen hoitosyklin aikana.
Pediatriset potilaat
Suun kautta otettavaa temotsolomidia tutkittiin lapsipotilailla (ikä 3 - 18 vuotta), joilla oli uusiutuva aivorungon gliooma tai uusiutuva korkea-asteinen astrosytooma. Potilaat saivat päivittäisen annoksen 5 päivän ajan 28 päivän välein. Vaikka saatavilla olevat tiedot ovat vähäiset, toleranssin oletetaan olevan lapsilla sama kuin aikuisilla. Temotsolomidin turvallisuutta alle 3 vuoden ikäisten lasten hoidossa ei ole varmistettu.
Kokemukset kliinisistä tutkimuksista iv-valmistemuodolla
Temodal 2,5 mg/ml infuusiokuiva-aineesta, liuosta varten, saadaan ekvivalentti temotsolomidiannos ja altistus sekä temotsolomidille että sen aktiiviselle metaboliitille MTIC:lle kuin vastaavasta määrästä Temodal kovia kapseleita (ks. kohta Farmakokinetiikka). Haittavaikutukset, joita raportoitiin kahdessa kliinisessä tutkimuksessa laskimoon annettavalla valmistemuodolla (n = 35), mutta joita ei raportoitu kovilla kapseleilla tehdyissä tutkimuksissa, olivat infuusiokohdan reaktioita: kipu, ärsytys, kutina, lämmön tunne, turvotus ja eryteema, kuten myös mustelmat.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksistaseuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Potilailla on kliinisesti arvioitu 500, 750, 1 000 ja 1 250 mg/m2:n annoksia (5 päivän pituisen hoitosyklin kokonaisannos). Annosta rajoittava toksisuus oli hematologista ja sitä raportoitiin kaikilla annoksilla, mutta sen odotetaan olevan vaikeampaa suuremmilla annoksilla. Yksi potilas otti 10 000 mg yliannoksen (yhden hoitosyklin kokonaisannos 5 päivän aikana). Todetut haittavaikutukset olivat pansytopenia, pyreksia, monielinhäiriö ja kuolema. On olemassa tietoja potilaista, jotka ovat ottaneet suositeltuja annoksia yli 5 vuorokauden ajan (jopa 64 vuorokautta). Raportoituihin haittavaikutuksiin kuului luuydinsuppressio, johon toisinaan liittyi infektio ja joka joissain tapauksissa oli vaikea ja pitkittynyt johtaen kuolemaan. Yliannostustapauksessa on tarpeen tutkia veriarvot. Korjaavat toimenpiteet tulee suorittaa tarvittaessa.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Alkyloivat lääkeaineet, Muut alkyloivat aineet, ATC-koodi: L01A X03
Vaikutusmekanismi
Temotsolomidi on triatseenityyppinen aine, joka muuttuu fysiologisessa pH:ssa nopeasti kemiallisesti aktiiviseksi yhdisteeksi monometyylitriatsenoimidatsolikarboksamidiksi (MTIC). MTIC:n sytotoksisuuden oletetaan johtuvan lähinnä guaniinin alkyloitumisesta asemassa O6 lisäalkyloinnin tapahtuessa myös asemassa N7. Kehittyviin sytotoksisiin leesioihin liittyy oletettavasti metyyliadduktin poikkeavaa korjaantumista.
Kliininen teho ja turvallisuus
Vastikään todettu glioblastoma multiforme
Yhteensä 573 potilasta satunnaistettiin saamaan joko temotsolomidia + sädehoitoa (n = 287) tai pelkkää sädehoitoa (n = 286). Potilaat temotsolomidi + sädehoito -tutkimushaarassa saivat samanaikaisesti temotsolomidia (75 mg/m²) kerran päivässä, alkaen ensimmäisenä sädehoitopäivänä ja jatkuen koko sädehoidon ajan eli 42 päivää (enintään 49 päivää). Tämän jälkeen seurasi hoito pelkällä temotsolomidilla (150 - 200 mg/m²) jokaisen 28 päivän pituisen hoitosyklin päivinä 1 – 5, enintään 6 hoitosyklin ajan, alkaen 4 viikkoa sädehoidon päättymisen jälkeen. Verrokkiryhmän potilaat saivat ainoastaan sädehoidon. Pneumocystis jirovecii –keuhkokuumeen (PCP) estolääkitystä tuli antaa sädehoidon ja siihen yhdistetyn temotsolomidihoidon aikana.
Temotsolomidia annettiin toisen linjan hoitona (salvage-hoitona) seurantavaiheessa 161 potilaalle 282:sta (57 %) pelkkää sädehoitoa saaneiden tutkimushaarassa ja 62 potilaalle 277:stä (22 %) temotsolomidia yhdessä sädehoidon kanssa saaneista.
Kokonaiseloonjäämisen riskisuhde (hazard ratio, HR) oli 1,59 (95 % CI, HR = 1,33 – 1,91) ja log-rank-testillä p < 0,0001 temotsolomidiryhmän eduksi. Arvioitu todennäköisyys vähintään kahden vuoden eloonjäämiselle oli korkeampi sädehoitoa + temotsolomidia saaneiden ryhmässä (26 % vs 10 %). Temotsolomidin lisäämisellä sädehoidon yhteyteen ja sen jälkeen pelkän temotsolomidin antamisella potilaille, joilla oli vastikään todettu glioblastoma multiforme, osoitettiin saavutettavan tilastollisesti merkitsevästi parempi kokonaiseloonjääminen verrattuna pelkkään sädehoitoon (kuva 1).
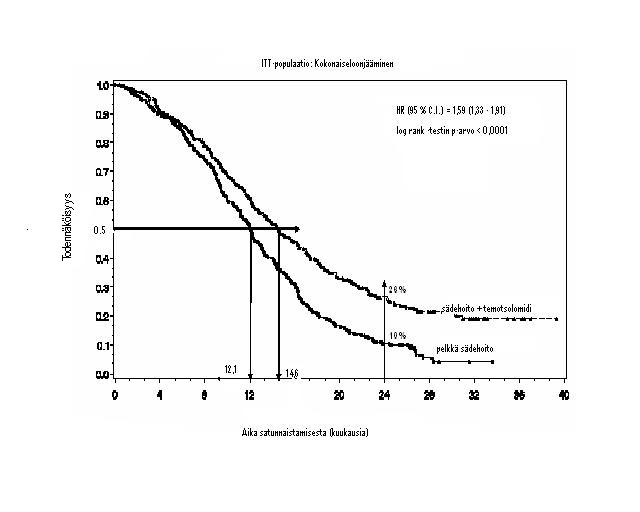
Kuva 1 Kaplan-Meier -käyrät kokonaiseloonjäämiselle (Intent-to-Treat [ITT]-populaatio)
Tutkimuksen tulokset eivät olleet yhdenmukaisia niiden potilaiden alaryhmässä, joilla toimintakyky oli heikko (WHO:n pistemäärä = 2, n = 70). Näillä kokonaiseloonjääminen ja progressioon kuluva aika olivat samat molemmissa hoitoryhmissä. Tässä potilasjoukossa ei kuitenkaan havaittu kohtuuttomia riskejä.
Uusiutuva tai etenevä maligni gliooma
Tiedot kliinisestä tehosta potilailla, joilla on leikkauksen ja sädehoidon jälkeen etenevä tai uusiutuva glioblastoma multiforme (Karnofskyn toimintakykypisteytys, Karnofsky performance status [KPS] ≥ 70), perustuvat kahteen kliiniseen tutkimukseen, joissa käytettiin suun kautta otettavaa temotsolomidia. Toinen oli ei-vertaileva tutkimus, jossa oli 138 potilasta (29 % sai edeltävänä hoitona kemoterapiaa) ja toinen satunnaistettu, aktiivikontrolloitu tutkimus temotsolomidin ja prokarbatsiinin välillä, yhteensä 225 potilasta (67 % sai edeltävänä hoitona nitrosoureaan perustunutta kemoterapiaa). Molemmissa tutkimuksissa ensisijainen päätetapahtuma oli progressioton elinaika (progression-free survival, PFS) määritettynä magneettikuvauksella tai neurologisen tilan huononemisena. Ei-vertailevassa tutkimuksessa PFS oli 6 kuukauden kuluttua 19 %, progressiottoman elinajan mediaani 2,1 kuukautta ja kokonaiselinajan mediaani 5,4 kuukautta. Objektiivinen vaste magneettikuvausten perusteella oli 8 %.
Satunnaistetussa aktiivikontrolloidussa tutkimuksessa 6 kuukauden PFS oli merkitsevästi suurempi temotsolomidilla (21 %) kuin prokarbatsiinilla (8 %, khiin neliö -testin p = 0,008) PFS:n mediaanin ollessa temotsolomidilla 2,89 ja prokarbatsiinilla 1,88 kuukautta (log rank -testin p = 0,0063). Elinajan mediaani oli 7,34 kuukautta temotsolomidilla ja vastaavasti 5,66 kuukautta prokarbatsiinilla (log rank -testin p = 0,33). 6 kuukauden kuluttua elossa olevien potilaiden määrä oli merkitsevästi suurempi temotsolomidiryhmässä (60 %) kuin prokarbatsiiniryhmässä (44 %) (khiin neliö -testin p = 0,019). Aiemmin kemoterapiaa saaneista potilaista hyötyivät ne, joilla KPS-pistemäärä oli vähintään 80.
Tulokset neurologisen statuksen heikentymisen alkamiseen saakka kuluneesta ajasta olivat parempia temotsolomidilla kuin prokarbatsiinilla kuten myös tulokset kuluneesta ajasta toimintakyvyn heikentymiseen (KPS laski alle 70 pisteen tai aleni vähintään 30 pistettä) saakka. Näissä päätetapahtumissa progression havaitsemiseen saakka kuluneen ajan mediaani oli 0,7-2,1 kuukautta pidempi temotsolomidilla kuin prokarbatsiinilla (log rank -testin p = <0,01 – 0,03).
Uusiutuva anaplastinen astrosytooma
Prospektiivisessa faasi II:n monikeskustutkimuksessa, jossa arvioitiin suun kautta otettavan temotsolomidin tehoa ja turvallisuutta hoidettaessa potilaita, joilla oli anaplastisen astrosytooman ensimmäinen relapsivaihe, 46 %:lla tauti ei ollut progredioinut 6 kuukauden kuluttua. Progressiottoman elinajan mediaani oli 5,4 kuukautta. Kokonaiselinajan mediaani oli 14,6 kuukautta. Keskeiseen arviointiin perustuen vaste todettiin 35 %:lla (13 täydellinen vaste ja 43 osittainen vaste) intent-to-treat(ITT) –populaatiosta, n = 162. Taudin todettiin stabiloituneen 43 potilaalla. Kuuden kuukauden jälkeen oli ITT-populaatiosta elossa 44 % ilman mitään tapahtumia. Elossaoloajan mediaani ilman tapahtumia oli 4,6 kuukautta. Tulos oli samanlainen kuin progressiottoman elinajan kyseessä ollessa. Sopivaa histologista populaatiota arvioitaessa tulokset tehon suhteen olivat samanlaiset. Radiologisen objektiivisen vasteen saavuttaminen tai progressiottoman tilan ylläpitäminen oli voimakkaasti yhteydessä elämänlaadun ylläpitämiseen tai paranemiseen.
Pediatriset potilaat
Suun kautta otettavaa temotsolomidia tutkittiin lapsipotilailla (ikä 3−18 vuotta), joilla oli uusiutuva aivorungon gliooma tai uusiutuva korkea-asteinen astrosytooma. Potilaat saivat päivittäisen annoksen 5 päivän ajan 28 päivän välein. Lapsipotilaat sietivät temotsolomidin samalla lailla kuin aikuiset.
Farmakokinetiikka
Temotsolomidi hydrolysoituu spontaanisti fysiologisessa pH:ssa pääasiassa aktiiviseksi muodoksi, 3-metyyli-(triatseeni-1-yyli)imidatsoli-4-karboksamidiksi (MTIC). MTIC hydrolysoituu spontaanisti 5-amino-imidatsoli-4-karboksamidiksi (AIC), joka on tunnettu välituote puriinin ja nukleiinihapon biosynteesissä, sekä metyylihydratsiiniksi, jonka uskotaan olevan aktiivinen alkyloiva muoto. MTIC:n sytotoksisuuden uskotaan johtuvan ensisijaisesti DNA:n alkylaatiosta pääasiassa guaniinin O6 - ja N7-asemissa. Suhteessa temotsolomidin AUC-arvoon altistumiset MTIC:lle ja AIC:lle ovat likimain 2,4 % ja 23 %. MTIC:n puoliintumisaika in vivo oli sama kuin temotsolomidin, 1,8 tuntia.
Avoimessa, kaksisuuntaisesti vaihtovuoroisessa bioekvivalenssitutkimuksessa selvitettiin suun kautta otettavan ja laskimoon annettavan temotsolomidin farmakokinetiikkaa potilailla, joilla oli primaari keskushermoston maligniteetti. Tutkimuksessa Temodal 2,5 mg/ml infuusiokuiva-aine, liuosta varten, jota annettiin 90 minuutin kestoisena infuusiona, oli bioekvivalentti Temodal kovien kapseleiden kanssa temotsolomidin ja MTIC:n Cmax- ja AUC-arvojen suhteen, kun käytettiin annosta 150 mg/m². Keskimääräinen Cmax-arvo temotsolomidille oli 7,4 μg/ml ja MTIC:lle vastaavasti 320 ng/ml 90 minuutin kestoisen laskimoon annetun infuusion jälkeen. Keskimääräinen AUC(0 → ∞)-arvo temotsolomidille oli 25 μg•h/ml ja MTIC:lle vastaavasti 1004 ng•h /ml.
Imeytyminen
Aikuispotilailla oraalisesti annettu temotsolomidi imeytyy nopeasti, huippupitoisuus saavutetaan jopa 20 minuutin kuluttua annosta (keskimääräinen aika 0,5 h−1,5 h). Oraalisesti annetulla 14C-leimatulla temotsolomidilla keskimääräinen 14C:n erittyminen ulosteisiin oli 7 päivää annon jälkeen 0,8 %, mikä osoittaa täydellistä absorboitumista.
Jakautuminen
Temotsolomidi sitoutuu niukasti proteiineihin (10−20 %), eikä siten ole odotettavissa, että sillä olisi yhteisvaikutusta voimakkaasti proteiineihin sitoutuvien aineiden kanssa.
Ihmisillä tehtyjen PET-tutkimusten ja prekliinisten tutkimusten perusteella on ilmeistä, että temotsolomidi läpäisee veri-aivoesteen nopeasti ja sitä siirtyy aivo-selkäydinnesteeseen. Tämä siirtyminen on varmistettu yhdellä potilaalla, jolla temotsolomidin AUC-arvo aivo-selkäydinnesteessä oli noin 30 % vastaavasta arvosta plasmassa. Tämä tulos on yhdenmukainen eläinkokeista saadun tiedon kanssa.
Eliminaatio
Puoliintumisaika (t½) plasmassa on noin 1,8 tuntia. 14C:n erittyminen tapahtuu pääasiassa munuaisten kautta. Oraalisen annon jälkeen noin 5−10 % annoksesta kerääntyy muuttumattomana virtsaan 24 tunnin aikana, loppu erittyy temotsolomidihappona, 5-aminoimidatsoli-4-karboksamidina (AIC) tai tunnistamattomina polaarisina metaboliitteina.
Pitoisuudet plasmassa lisääntyvät annosriippuvaisesti. Plasmapuhdistuma, jakautumistilavuus ja puoliintumisaika eivät ole annosriippuvaisia.
Erityiset potilasryhmät
Temotsolomidin farmakokineettinen populaatioanalyysi osoitti, etteivät ikä, munuaisten toimintakyky tai tupakointi vaikuta temotsolomidin plasmapuhdistumaan. Toisessa farmakokineettisessä tutkimuksessa potilailla, joilla oli lievä tai kohtalainen maksan toimintahäiriö, todettiin, että plasman farmakokineettinen kuva oli samanlainen kuin potilailla, joilla maksan toimintakyky oli normaali.
Lapsipotilaiden AUC-arvo oli korkeampi kuin aikuispotilaiden, mutta suurin siedetty annos (MTD) oli 1 000 mg/m² per sykli sekä lapsilla että aikuisilla.
Prekliiniset tiedot turvallisuudesta
Rotilla ja koirilla tehtiin yhden syklin (5 päivänä annos, 23 päivänä ei hoitoa), 3 syklin ja 6 syklin toksisuuskokeet. Ensisijaisina toksisuuden kohteina olivat luuydin, lymforetikulaarinen järjestelmä, kivekset ja maha-suolikanavan alue. Suuremmilla annoksilla, jotka olivat letaaleja 60−100 %:lla tutkituista rotista ja koirista, todettiin verkkokalvon rappeutumista. Havaittu toksisuus oli yleensä ohimenevää, lukuun ottamatta urosten lisääntymiselimissä todettuja haittatapahtumia sekä verkkokalvon rappeutumista. Koska verkkokalvon rappeutumista aiheuttaneet annokset olivat letaalilla tasolla eikä kliinisissä tutkimuksissa ole tullut esille vastaavanlaisia vaikutuksia, näillä löydöksillä ei katsottu olevan kliinistä merkitystä.
Temotsolomidi on embryotoksinen, teratogeeninen ja genotoksinen alkyloiva aine. Temotsolomidi on toksisempaa rotilla ja koirilla kuin ihmisellä, ja kliininen annostaso lähentelee pienintä letaalia annosta rotilla ja koirilla. Annosriippuvainen leukosyyttien ja verihiutaleiden väheneminen näyttää olevan herkkä toksisuuden osoitin. 6 syklin pituisessa rottakokeessa havaittiin seuraavia kasvaintyyppejä: rintasyöpä, keratoakantooma ja tyvisoluadenooma. Koirilla suoritetuissa kokeissa ei havaittu kasvaimia tai preneoplastisia muutoksia. Rotta näyttää olevan erityisen herkkä temotsolomidin kasvaimia aiheuttavalle vaikutukselle. Ensimmäiset kasvaimet ilmenivät 3 kuukauden kuluessa hoidon aloituksesta. Tämä latenssivaihe on hyvin lyhyt jopa alkyloivalle aineelle.
Ames/Salmonella- ja ihmisen perifeeristen lymfosyyttien (HPBL) kromosomipoikkeamakokeiden tuloksena oli positiivinen mutageenisuusvaste.
Laskimoon annettava lääkemuoto aiheutti paikallista ärsytystä pistokohdassa sekä kaniineilla että rotilla. Ärsytys oli ohimenevää eikä siihen liittynyt pysyvää kudosvauriota.
Farmaseuttiset tiedot
Apuaineet
Mannitoli (E421)
Treoniini
Polysorbaatti 80
Natriumsitraatti (pH:n säätöön)
Kloorivetyhappo, väkevä (pH:n säätöön)
Yhteensopimattomuudet
Koska yhteensopimattomuustutkimuksia ei ole tehty, lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
Avaamaton injektiopullo: 4 vuotta.
Käyttökuntoon saatettu liuos: Käyttökuntoon saatetun liuoksen on osoitettu olevan käytön aikana kemiallisesti ja fysikaalisesti stabiili 14 tuntia 25 ºC:ssa, mukaan lukien infuusioaika.
Mikrobiologiselta kannalta valmiste tulisi käyttää välittömästi. Jos sitä ei käytetä välittömästi, säilytysaika ja -olosuhteet ennen käyttöä ovat käyttäjän vastuulla eivätkä saisi normaalisti ylittää 24 tuntia 2 ºC − 8 ºC:ssa, ellei käyttökuntoon saattaminen ole tapahtunut kontrolloiduissa ja validoiduissa aseptisissa olosuhteissa.
Säilytys
Säilytä jääkaapissa (2 ºC – 8 ºC).
Käyttökuntoon saatetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
TEMODAL infuusiokuiva-aine, liuosta varten
2,5 mg/ml (L:ei) 1 kpl (100 mg) (377,58 €)
PF-selosteen tieto
Kirkasta tyypin I lasia oleva injektiopullo, joka on suljettu bromobutyylikumitulpalla sekä alumiinisinetillä ja persikanvärisellä suojakorkilla. Yksi injektiopullo sisältää 100 mg temotsolomidia.
Temodal 2,5 mg/ml on saatavana yhden injektiopullon pakkauksina.
Valmisteen kuvaus:
Valkoinen jauhe
Käyttö- ja käsittelyohjeet
Varovaisuutta on noudatettava, kun käsitellään Temodal 2,5 mg/ml infuusiokuiva-ainetta, liuosta varten. Käsineiden käyttö ja aseptinen tekniikka on välttämätöntä. Jos Temodal 2,5 mg/ml joutuu kosketuksiin ihon tai limakalvojen kanssa, se pestään pois välittömästi ja perusteellisesti saippualla ja vedellä.
Jokaiseen injektiopulloon sekoitetaan 41 ml steriiliä injektionesteisiin käytettävää vettä. Näin saadaan liuos, joka sisältää 2,5 mg/ml temotsolomidia. Injektiopulloa pyöritellään varovaisesti, sitä ei saa ravistaa. Liuos tarkastetaan ja jos siinä on silmin havaittavia hiukkasia, sitä ei tule käyttää. Vedetään enintään 40 ml käyttövalmiiksi sekoitettua liuosta, tarvittavan kokonaisannoksen mukaan, ja siirretään se tyhjään 250 ml:n infuusiopussiin (PVC tai polyolefiini). Pumpun letku kiinnitetään pussiin, letku puhdistetaan ja korkki laitetaan päälle. Temodal 2,5 mg/ml annetaan vain 90 minuutin kestoisena infuusiona laskimoon.
Temodal 2,5 mg/ml infuusiokuiva-aine, liuosta varten, voidaan antaa saman laskimolinjan kautta kuin 0,9 % natriumkloridiliuos. Se on yhteensopimaton glukoosin kanssa.
Koska enempää tietoa ei ole, lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa tai antaa samanaikaisesti saman laskimolinjan kautta.
Tämä lääkevalmiste on tarkoitettu vain kertakäyttöön. Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
TEMODAL infuusiokuiva-aine, liuosta varten
2,5 mg/ml 1 kpl
- Ei korvausta.
ATC-koodi
L01AX03
Valmisteyhteenvedon muuttamispäivämäärä
21.02.2023
Yhteystiedot
 MSD FINLAND OY
MSD FINLAND OY Keilaniementie 1, PL 46
02151 Espoo
09 804 650
www.msd.fi
info@msd.fi
