INTRAROSA emätinpuikko 6,5 mg
Vaikuttavat aineet ja niiden määrät
Yksi emätinpuikko sisältää 6,5 mg prasteronia (prasteron.).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Emätinpuikko
Kliiniset tiedot
Käyttöaiheet
Intrarosa on tarkoitettu vaihdevuodet ohittaneiden naisten ulkosynnyttimien ja emättimen atrofian hoitoon, kun oireet ovat keskivaikeat tai vaikeat.
Annostus ja antotapa
Annostus
Suositeltu annos on 6,5 mg prasteronia (yksi emätinpuikko) kerran päivässä nukkumaanmenon yhteydessä.
Vaihdevuosien jälkeisten oireiden hoidossa Intrarosan käytön saa aloittaa vain elämänlaatua heikentävien oireiden yhteydessä. Kaikissa tapauksissa riskit ja hyödyt on arvioitava huolellisesti uudestaan vähintään kuuden kuukauden välein, ja Intrarosa-hoitoa tulee jatkaa vain niin kauan kuin hyöty on riskejä suurempi.
Mikäli annos on jäänyt ottamatta, se on otettava heti muistettaessa. Jos seuraava annos on määrä ottaa alle kahdeksan tunnin kuluttua, unohtunut emätinpuikko on jätettävä käyttämättä. Unohtunutta annosta ei saa korvata kahdella emätinpuikolla yhdellä kertaa.
Erityispotilasryhmät
Iäkkäät potilaat
Iäkkäiden naisten annosta ei tarvitse muuttaa.
Munuaisten ja/tai maksan vajaatoimintaa sairastavat potilaat
Koska Intrarosa vaikuttaa paikallisesti emättimessä, annosta ei tarvitse muuttaa vaihdevuodet ohittaneilla naisilla, joilla on munuaisten tai maksan vajaatoiminta tai jokin muu systeeminen anomalia tai sairaus.
Pediatriset potilaat
Intrarosalla ei ole käyttötarvetta minkään ikäryhmän tytöillä vaihdevuosista johtuva ulkosynnyttimien ja emättimen atrofinen tulehdus -käyttöaiheessa.
Antotapa
Emättimeen
Intrarosa voidaan asettaa emättimeen sormella tai pakkauksessa olevalla asettimella.
Emätinpuikko on työnnettävä niin pitkälle emättimeen kuin se helposti menee voimaa käyttämättä.
Jos se asetetaan paikalleen asettimella, on toimittava seuraavasti:
- Asetin aktivoidaan (vetämällä asettimen mäntää taaksepäin) ennen käyttöä.
- Emätinpuikon tasainen pää asetetaan aktivoidun asettimen avoimeen päähän.
- Asetin työnnetään niin pitkälle emättimeen kuin se helposti menee voimaa käyttämättä.
- Seuraavaksi emätinpuikko vapautetaan asettimesta painamalla asettimen mäntää.
- Sen jälkeen asetin vedetään pois emättimestä ja puretaan. Asettimen kahta osaa huuhdellaan juoksevan veden alla 30 sekuntia. Lopuksi osat kuivataan paperipyyhkeellä ja liitetään taas yhteen. Asetin on säilytettävä puhtaassa paikassa ennen seuraavaa käyttöä.
- Asetin on hävitettävä, kun sitä on käytetty viikko (pakkauksessa on kaksi lisäasetinta).
Vasta-aiheet
- yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille
- selittämättömästä syystä johtuva emätinverenvuoto
- diagnosoitu, sairastettu tai epäilty rintasyöpä
- diagnosoidut tai epäillyt estrogeeniriippuvaiset pahanlaatuiset kasvaimet (esimerkiksi kohdun limakalvon syöpä)
- hoitamaton kohdun limakalvon liikakasvu
- akuutti maksasairaus tai sairastettu maksasairaus niin kauan kuin maksan toimintakokeiden tulokset eivät ole palautuneet normaaleiksi
- aiemmin sairastettu tai parhaillaan hoidettava laskimotromboembolia (syvä laskimotukos, keuhkoembolia)
- diagnosoidut trombofiiliset häiriöt (esimerkiksi proteiini C:n, proteiini S:n tai antitrombiinin puutos, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
- aktiivinen tai äskettäin sairastettu valtimon tromboembolinen sairaus (esimerkiksi angina pectoris, sydäninfarkti)
- porfyria.
Varoitukset ja käyttöön liittyvät varotoimet
Vaihdevuosien jälkeisten oireiden hoidossa Intrarosan käytön saa aloittaa vain elämänlaatua heikentävien oireiden yhteydessä. Kaikissa tapauksissa riskit ja hyöty on arvioitava huolellisesti uudestaan vähintään kuuden kuukauden välein, ja Intrarosa-hoitoa tulee jatkaa vain niin kauan kuin hyöty on riskejä suurempi potilaan ja lääkärin käymän keskustelun perusteella.
Lääkärintarkastus/seuranta
Ennen Intrarosa-hoidon aloittamista potilaan henkilökohtainen ja potilaan suvun sairaushistoria on selvitettävä perin pohjin. Tämän sekä vasta-aiheiden ja käyttöä koskevien erityisvaroitusten ja -varotoimien perusteella on tehtävä kliininen (myös lantion alueen ja rintojen) tutkimus lääkärin harkinnan mukaan. Hoidon aikana suositellaan tehtävän säännöllisiä tarkastuksia, joiden tiheys ja laajuus määräytyvät potilaan yksilöllisen tilanteen mukaan. Naisille on kerrottava, millaisista muutoksista rinnoissa on ilmoitettava lääkärille tai sairaanhoitajalle (ks. jäljempänä oleva kohta ”Rintasyöpä”). Tutkimukset, kuten papakoe ja verenpaineen mittaukset, on tehtävä nykyisten hyväksyttyjen seulontakäytäntöjen mukaisesti yksilöllisiin kliinisiin tarpeisiin mukautettuna.
Seurantaa edellyttävät sairaudet
-
Jos potilaalla on tai on ollut jokin seuraavista sairauksista ja/tai jos se on pahentunut raskauden tai aiempien hormonihoitojen aikana, potilasta on seurattava tiiviisti. Lisäksi on muistettava, että nämä sairaudet voivat uusiutua tai pahentua Intrarosa-hoidon aikana. Tämä koskee etenkin seuraavia sairauksia:
- leiomyooma (kohdun fibroidit) tai endometrioosi
- tromboembolisten häiriöiden riskitekijät (ks. jäljempänä)
- estrogeeniriippuvaisten kasvainten riskitekijät, esimerkiksi ensimmäisen asteen perinnöllisyys rintasyövän osalta
- hypertensio
- maksan toimintahäiriöt (esimerkiksi maksan adenooma)
- diabetes mellitus, johon liittyy tai ei liity verisuoniperäisiä ongelmia
- sappikivitauti
- migreeni tai (vaikea) päänsärky
- systeeminen lupus erythematosus
- aiemmin sairastettu kohdun limakalvon liikakasvu (ks. jäljempänä)
- epilepsia
- astma
- otoskleroosi.
Hoidon välittömän keskeyttämisen syyt
Hoito on keskeytettävä, jos havaitaan jokin vasta-aihe, ja seuraavissa tilanteissa:
- keltaisuus tai maksan toiminnan heikkeneminen
- verenpaineen merkitsevä kohoaminen
- migreenityyppisen päänsäryn ilmaantuminen ensimmäisen kerran
- raskaus.
Kohdun limakalvon liikakasvu ja karsinooma
- Estrogeeni on prasteronin metaboliitti. Naisilla, joilla on terve kohtu, kohdun limakalvon liikakasvun ja karsinooman riski suurenee, kun ulkoisia estrogeenivalmisteita käytetään pidempiä aikoja. Kohdun limakalvon liikakasvutapauksista ei ole ilmoitettu naisilta, joita on hoidettu 52 viikkoa kliinisten tutkimusten aikana. Intrarosaa ei ole tutkittu naisilla, jotka sairastavat kohdun limakalvon liikakasvua.
- Sellaisten emättimeen asetettavien valmisteiden yhteydessä, joita käytettäessä systeeminen altistuminen estrogeenille pysyy normaalin vaihdevuosien jälkeisen vaihtelun rajoissa, ei suositella lisättäväksi keltarauhashormonia.
- Paikallisesti emättimeen annostellun prasteronin pitkäaikaista turvallisuutta kohdun limakalvon osalta ei ole tutkittu vuotta pidemmältä ajalta. Sen vuoksi hoito on arvioitava uudelleen vähintään kerran vuodessa.
- Jos missä tahansa hoidon vaiheessa ilmaantuu verenvuotoa tai tiputteluvuotoa, sen syy on selvitettävä, ja kohdun limakalvolta on tarvittaessa otettava kudosnäyte, jotta limakalvoon liittyvät pahanlaatuiset muutokset voidaan sulkea pois.
- Pelkkä estrogeenistimulaatio voi johtaa endometrioosin jäännöspesäkkeiden premaligneihin tai pahanlaatuisiin muutoksiin. Sen vuoksi on syytä noudattaa varovaisuutta, kun valmiste on sellaisten naisten käytössä, joilta on poistettu kohtu endometrioosin vuoksi, etenkin, jos heillä tiedetään olevan jäännös endometrioosia, sillä emättimensisäisesti käytettävää prasteronia ei ole tutkittu endometrioosia sairastavilla naisilla.
Prasteroni metaboloituu estrogeenin kaltaisiksi yhdisteiksi. Systeemiseen hormonikorvaushoitoon on yhdistetty seuraavat riskit, jotka koskevat vähemmän emättimensisäisesti käytettäviä estrogeenivalmisteita, koska niiden yhteydessä systeeminen altistuminen estrogeenille pysyy vaihdevuosien jälkeisen normaalin vaihteluvälin rajoissa. Ne on kuitenkin muistettava ottaa huomioon, jos tätä valmistetta käytetään pitkäaikaisesti tai toistuvasti.
Rintasyöpä
Kokonaisnäyttö viittaa siihen, että rintasyövän riski on suurentunut estrogeenin ja keltarauhashormonin yhdistelmää käyttävillä naisilla ja mahdollisesti myös naisilla, jotka saavat pelkästään estrogeenia sisältävää systeemistä hormonikorvaushoitoa, mutta tällöin riskiin vaikuttaa se, kauanko nainen on saanut hormonikorvaushoitoa. Riskin suureneminen ilmenee muutaman vuoden käytön jälkeen mutta se palautuu perustasolle muutaman (enintään viiden vuoden) kuluttua hoidon lopettamisesta.
Intrarosaa ei ole tutkittu naisilla, joilla on aktiivinen rintasyöpä tai jotka ovat sairastaneet sen. Tutkimuksesta, johon osallistui 1 196 naista, jotka altistuivat 6,5 mg:n annokselle, ilmoitettiin yksi rintasyöpätapaus viikolta 52, mikä on vähemmän kuin normaalissa samanikäisessä populaatiossa havaittu ilmaantuminen.
Munasarjasyöpä
Munasarjasyöpä on huomattavasti harvinaisempi kuin rintasyöpä.
Laajasta meta-analyysista saatu epidemiologinen näyttö viittaa siihen, että pelkästään estrogeenia sisältävää hormonikorvaushoitoa saavilla naisilla on hieman suurentunut riski, joka ilmenee viiden vuoden käytön aikana ja pienenee vähitellen käytön lopettamisen jälkeen.
Intrarosaa ei ole tutkittu naisilla, joilla on aktiivinen munasarjasyöpä tai jotka ovat sairastaneet sen. Tutkimuksesta, johon osallistui 1 196 naista, jotka altistuivat 6,5 mg:n annokselle, ilmoitettiin yksi munasarjasyöpätapaus, mikä on enemmän kuin normaalissa samanikäisessä populaatiossa havaittu ilmaantuminen. Tämä tapaus oli kuitenkin tiedossa ennen hoidon aloittamista, ja siihen liittyi BRCA1-mutaatio.
Poikkeava papakokeen tulos
Intrarosaa ei ole tutkittu naisilla, joiden papakoevastauksen luokitus on ollut poikkeava (ASCUS (levyepiteelin merkitykseltään määrittämätön atypia)) tai sitä vakavampi. Naisilta, joita on hoidettu 6,5 mg:n annoksella, on ilmoitettu tapauksia, joissa poikkeava papakoevastaus vastaa luokituksia ASCUS tai LSIL (lievä epiteelivaurio) (esiintymisen yleisyys ”yleinen”).
Laskimotromboembolia
Intrarosaa ei ole tutkittu naisilla, joilla on tai on ollut laskimotromboembolinen sairaus.
- Systeemiseen hormonikorvaushoitoon liittyy laskimotromboembolian eli syvän laskimotukoksen tai keuhkoembolian kehittymisen 1,3–3-kertainen riski. Tällaisen tapahtuman ilmaantuminen on todennäköisempää hormonikorvaushoidon ensimmäisenä vuotena kuin myöhemmin (ks. kohta Haittavaikutukset).
- Potilailla, joilla tiedetään olevan tromboembolisia häiriöitä, on suurentunut laskimotromboembolian riski, jota hormonikorvaushoito voi lisätä. Sen vuoksi hormonikorvaushoito on vasta-aiheinen näillä potilailla (ks. kohta Vasta-aiheet).
-
Yleisesti tiedettyjä laskimotromboembolian riskitekijöitä ovat estrogeenien käyttö, ikääntyminen, suuret leikkaukset, pidempiaikainen immobilisaatio, lihavuus (painoindeksi > 30 kg/m2), raskaus/postpartaalivaihe, systeeminen lupus erythematosus (SLE) ja syöpä. Suonikohjujen mahdollisesta osuudesta laskimotromboembolian kehittymisessä ei ole yksimielisyyttä.
Kuten kaikkien leikkauksen läpikäyneiden potilaiden kanssa, leikkauksen jälkeen on ryhdyttävä laskimotromboemboliaa ehkäiseviin toimiin. Jos elektiivisen leikkauksen jälkeen seuraa pidempi immobilisaatio, hormonikorvaushoito on suositeltavaa keskeyttää tilapäisesti 4–6 viikkoa aikaisemmin. Hoitoa ei saa aloittaa uudelleen, ennen kuin potilas on taas täysin liikuntakykyinen. -
Naisille, jotka eivät ole itse sairastaneet laskimotromboemboliaa mutta joiden lähisukulaisella on ollut se nuorella iällä, voidaan tarjota seulontaa sen jälkeen, kun seulonnan rajoitukset on selvitetty perusteellisesti (seulonnassa löydetään vain pieni osuus trombofiilisistä häiriöistä).
Jos todetaan sellainen trombofiilinen häiriö, joka eroaa perheenjäsenillä olleista trombooseista tai jos häiriö on vakava (esimerkiksi antitrombiinin, proteiini S:n tai proteiini C:n puutokset tai puutosten yhdistelmä), hormonikorvaushoito on vasta-aiheista. - Niiden naisten osalta, joilla jo on krooninen antikoagulanttihoito, hormonikorvaushoidon käytön hyöty ja riskit on punnittava huolellisesti.
- Jos laskimotromboembolia kehittyy hoidon aloittamisen jälkeen, Intrarosa-hoito on keskeytettävä. Potilaita on kehotettava ottamaan yhteyttä lääkäriin välittömästi, jos he havaitsevat mahdollisen tromboembolisen oireen (esimerkiksi säären kivulias turvotus, äkillinen rintakipu, hengenahdistus).
Kliinisten tutkimusten aikana on ilmoitettu yksi keuhkoemboliatapaus 6,5 mg:n ryhmästä ja yksi lumelääkeryhmästä.
Sepelvaltimotauti/hypertensio
Intrarosaa ei ole tutkittu naisilla, joilla on hoitamaton hypertensio (verenpaine yli 140/90 mmHg) ja kardiovaskulaarinen sairaus. Kliinisistä tutkimuksista on ilmoitettu hypertensiotapauksia, jotka ovat kuitenkin harvinaisia, ja niitä esiintyi yhtä paljon kummassakin ryhmässä (6,5 mg prasteronia saanut ryhmä ja lumelääkeryhmä). Kliinisten tutkimusten aikana ei ole ilmoitettu yhtään sepelvaltimotautitapausta.
Iskeeminen aivohalvaus
Systeemiseen pelkästään estrogeenilla annettavaan hoitoon liittyy noin 1,5 kertaa suurentunut iskeemisen aivohalvauksen riski. Suhteellinen riski ei muutu iän tai ajan myötä vaihdevuosien jälkeen. Koska ikä kuitenkin vaikuttaa aivohalvauksen perusriskiin, hormonikorvaushoitoa saavien naisten kokonaisriski suurenee iän myötä (ks. kohta Haittavaikutukset).
Intrarosaa ei ole tutkittu naisilla, joilla on tai on ollut valtimotromboembolinen sairaus. Kliinisten tutkimusten aikana ei ole ilmoitettu yhtään valtimotromboembolista sairaustapausta.
Muut hormonikorvaushoidon yhteydessä havaitut sairaudet
- Estrogeenit voivat aiheuttaa nesteen kertymistä, ja sen vuoksi sydämen tai munuaisten vajaatoiminnasta kärsiviä potilaita on seurattava tarkoin.
- Naisia, joilla on hypertriglyseridemia, on seurattava tiiviisti estrogeeni- tai hormonikorvaushoidon aikana, koska tämän sairauden ja estrogeenikorvaushoidon yhteydessä on ilmoitettu harvinaisia tapauksia, joissa plasman triglyseridipitoisuus suurenee niin paljon, että seurauksena on haimatulehdus.
- Estrogeenit kasvattavat tyroksiinia sitovan globuliinin (TBG:n) pitoisuutta, mikä johtaa verenkierrossa olevan kilpirauhashormonin kokonaispitoisuuden suurenemiseen valkuaisaineeseen sitoutuneen jodin (PBI:n), T4-hormonin (pylväskromatografian tai radioimmunoanalyysin perusteella) tai T3-hormonin (radioimmunoanalyysin perusteella) pitoisuuksilla mitattuna. T3-resiinin takaisinotto pienenee, mikä viittaa kohonneeseen TBG-arvoon. Vapaan T4:n ja T3:n pitoisuudet eivät muutu. Muiden sitovien proteiinien, kuten kortikoidia sitovan globuliinin (CBG:n) ja sukupuolihormonia sitovan globuliinin (SHBG:n), pitoisuus seerumissa voi suurentua, jolloin myös verenkierrossa olevien kortikosteroidien ja sukupuolisteroidien pitoisuus lisääntyy. Vapaan tai biologisesti aktiivisen hormonin pitoisuudet eivät muutu. Muut plasman proteiinipitoisuudet voivat suurentua (angiotensinogeeni/reniinin substraatti, alfa-I-antitrypsiini, keruloplasmiini).
- Hormonikorvaushoidon käyttö ei paranna kognitiivisia toimintoja. Jonkin verran näyttöä on todennäköisen dementian riskin suurenemisesta jatkuvan yhdistelmähormonikorvaushoidon tai pelkästään estrogeenilla annettavan hormonikorvaushoidon yli 65-vuotiaana aloittavilla naisilla.
Kliinisissä tutkimuksissa yhtäkään näistä sairauksista ei kuitenkaan ole todettu Intrarosaa käytettäessä.
Jos naisella on emätininfektio, se on hoidettava asianmukaisella mikrobilääkehoidolla ennen Intrarosa-hoidon aloittamista.
Hoidon odotetaan lisäävän valkovuodon määrää. Lisäksi emätinpuikon kovarasvasta valmistettu ydin sulaa, joten valkovuotoa voi esiintyä, joskaan se ei vaadi Intrarosa-lääkityksen lopettamista (ks. kohta Haittavaikutukset).
Intrarosa-hoidon aikana lateksista valmistettujen kondomien sekä emätin- tai kohdunkaulapessaarien käyttöä on vältettävä, koska valmiste voi vaurioittaa kumia.
Intrarosaa ei ole tutkittu naisilla, jotka parhaillaan käyttävät hormonihoitoa, joko hormonikorvaushoitoa (pelkästään estrogeeneja tai niiden ja keltarauhashormonien yhdistelmää) tai androgeenihoitoa.
Yhteisvaikutukset
Samanaikaista käyttöä systeemisen hormonikorvaushoidon (pelkästään estrogeenien, estrogeeni-keltarauhashormoniyhdistelmän tai androgeenihoidon) tai emättimen kautta käytettävien estrogeenivalmisteiden kanssa ei ole tutkittu, eikä sitä siksi suositella.
Raskaus ja imetys
Raskaus
Intrarosaa ei ole tarkoitettu annettavaksi premenopausaalisessa siirtymävaiheessa oleville naisille, jotka voivat saada lapsia, eikä raskaana oleville.
Jos nainen tulee raskaaksi Intrarosa-hoidon aikana, hoito on lopetettava välittömästi. Tietoja Intrarosan käytöstä raskaana olevilla naisilla ei ole.
Eläimillä ei ole tehty lisääntymismyrkyllisyyteen liittyviä tutkimuksia (ks. kohta Prekliiniset tiedot turvallisuudesta). Mahdollista riskiä ihmisille ei tunneta.
Imetys
Intrarosaa ei saa käyttää imetyksen aikana.
Hedelmällisyys
Intrarosaa ei ole tarkoitettu käytettäväksi hedelmällisessä iässä olevilla naisilla.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Intrarosalla ei ole vaikutusta ajokykyyn eikä koneiden käyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisin havaittu haittavaikutus oli valkovuoto. Tämä johtuu emätinpuikossa kantaja-aineena käytetyn kovarasvan sulamisesta, jolloin emätineritteen määrä lisääntyy hoidon aikana. Intrarosa-hoitoa ei tarvitse lopettaa, jos valkovuotoa esiintyy (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Taulukko haittavaikutuksista
Kliinisistä tutkimuksista 6,5 mg:n prasteroniemätinpuikkojen käytön yhteydessä havaitut haittavaikutukset on esitetty alla olevassa taulukossa 1.
Taulukko 1: Kliinisistä tutkimuksista 6,5 mg:n prasteroniemätinpuikkojen käytön yhteydessä havaitut haittavaikutukset
| MedDRAn elinjärjestelmä | Yleinen (≥ 1/100, < 1/10) | Melko harvinainen (≥ 1/1 000, < 1/100) |
| Yleisoireet ja antopaikassa todettavat haitat | Erite asetuspaikasta | - |
| Sukupuolielimet ja rinnat | Poikkeava papanäytteen tulos (useimmiten ASCUS tai LGSIL) | Kohdunkaulan/kohdun runko-osan polyypit Rintakyhmy (hyvänlaatuinen) |
| Tutkimukset | Painon vaihtelu | - |
Rintasyövän riski
- Naisilta, jotka ovat käyttäneet estrogeeni-keltarauhashormoniyhdistelmähoitoa yli viiden vuoden ajan, on ilmoitettu jopa kaksi kertaa suurentuneesta riskistä saada rintasyöpä.
- Pelkästään estrogeenia sisältävän hoidon käyttäjillä mahdollinen suurentunut riski on merkittävästi pienempi kuin estrogeenin ja keltarauhashormonin yhdistelmien käyttäjillä.
- Riskin suuruus määräytyy käytön pituuden mukaan (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
- Seuraavaksi esitellään tulokset suurimmasta satunnaistetusta lumelääkekontrolloidusta tutkimuksesta (WHI-tutkimus) ja suurimmasta epidemiologisesta tutkimuksesta (MWS).
Million Women -tutkimus – arvioitu rintasyöpään liittyvä lisäriski viiden vuoden käytön jälkeen
Ikäryhmä (vuotta) | Lisätapaukset tuhatta sellaista naista kohti, jotka eivät ole koskaan käyttäneet hormonikorvaushoitoa viiden vuoden ajanjaksolla1 | Riskisuhde ja 95 prosentin luottamusväli# | Lisätapaukset tuhatta hormonikorvaushoidon käyttäjää kohti viiden vuoden aikana (95 prosentin luottamusväli) |
| Pelkkää estrogeenia sisältävä hormonikorvaushoito | |||
| 50-65 | 9-12 | 1,2 | 1–2 (0–3) |
#Kokonaisriskisuhde. Riskisuhde ei ole vakio, vaan se suurenee lääkkeiden käytön keston pidentyessä.
Huomautus: Koska rintasyövän perusilmaantuvuus vaihtelee EU-maittain, myös rintasyöpään liittyvien lisätapausten määrä vaihtelee suhteellisesti.
US WHI -tutkimukset – rintasyöpään liittyvä lisäriski viiden vuoden käytön jälkeen
Ikäryhmä (vuotta) | Ilmaantuvuus tuhatta naista kohti lumelääkeryhmässä viiden vuoden aikana | Riskisuhde ja 95 prosentin luottamusväli | Lisätapaukset tuhatta hormonikorvaushoidon käyttäjää kohti viiden vuoden aikana (95 prosentin luottamusväli) |
| Pelkkä konjugoitu hevosestrogeeni | |||
| 50-79 | 21 | 0,8 (0,7–1,0) | -4 (-6–0)2 |
Munasarjasyöpä
Pelkkää estrogeenia sisältävän tai estrogeenin ja keltarauhashormonin yhdistelmää sisältävän hormonikorvaushoidon käyttöön on liitetty pieni munasarjasyövän riskin suureneminen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
52 epidemiologisen tutkimuksen meta-analyysissä havaittiin, että hormonikorvaushoitoa käyttävillä naisilla oli suurempi munasarjasyövän riski kuin naisilla, jotka eivät olleet koskaan saaneet hormonikorvaushoitoa (riskisuhde 1,43, 95 prosentin luottamusväli 1,31–1,56). Naisilla, joiden ikä on 50–54 vuotta ja jotka saavat hormonikorvaushoitoa viisi vuotta, tämä aiheuttaa noin yhden lisätapauksen 2 000:ta käyttäjää kohden. Naisilla, joiden ikä on 50–54 vuotta ja jotka eivät saa hormonikorvaushoitoa, munasarjasyöpä todetaan viiden vuoden aikana noin kahdella naisella 2 000:sta.
Laskimotromboembolian riski
Hormonikorvaushoitoon liittyy laskimotromboembolian eli syvän laskimotukoksen tai keuhkoembolian kehittymisen 1,3–3 kertaa suurempi suhteellinen riski. Tällaisen tapahtuman ilmaantuminen on todennäköisempää hormonihoidon ensimmäisenä vuotena kuin myöhemmin (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Seuraavassa esitetään WHI-tutkimusten tulokset:
WHI-tutkimukset – laskimotromboemboliaan liittyvä lisäriski viiden vuoden käytön jälkeen
| Ikäryhmä (vuotta) | Ilmaantuvuus tuhatta naista kohti lumelääkeryhmässä viiden vuoden aikana | Riskisuhde ja 95 prosentin luottamusväli | Lisätapaukset tuhatta hormonikorvaushoidon käyttäjää kohti |
| Vain suun kautta otettava estrogeeni3 | |||
| 50-59 | 7 | 1,2 (0,6–2,4) | 1 (-3–10) |
Sepelvaltimotaudin riski
- Sepelvaltimotaudin riski on hieman suurentunut estrogeenin ja keltarauhashormonin yhdistelmällä annettavan hormonikorvaushoidon käyttäjillä, jotka ovat yli 60-vuotiaita (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Iskeemisen aivohalvauksen riski
- Pelkästään estrogeenilla sekä estrogeenin ja keltarauhashormonin yhdistelmällä annettavaan hoitoon liittyy noin 1,5 kertaa suurentunut iskeemisen aivohalvauksen suhteellinen riski. Aivoverenvuodon aiheuttaman halvauksen riski ei ole suurentunut hormonikorvaushoidon käytön aikana.
- Ikä ja lääkityksen käytön pituus eivät vaikuta tähän suhteelliseen riskiin, mutta koska ikä vaikuttaa perusriskiin voimakkaasti, aivohalvauksen kokonaisriski hormonikorvaushoitoa käyttävillä naisilla suurenee iän myötä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Yhdistetyt WHI-tutkimukset – iskeemiseen aivohalvaukseen4 liittyvä lisäriski viiden vuoden käytön jälkeen
| Ikä (vuotta) | Ilmaantuvuus tuhatta naista kohti lumelääkeryhmässä viiden vuoden aikana | Riskisuhde ja 95 prosentin luottamusväli | Lisätapaukset tuhatta hormonikorvaushoidon käyttäjää kohti viiden vuoden aikana |
| 50-59 | 8 | 1,3 (1,1–1,6) | 3 (1–5) |
Muita haittavaikutuksia on ilmoitettu estrogeeni-keltarauhashormonihoidon yhteydessä:
- Sappirakon sairaus.
- Ihon ja ihonalaiset häiriöt: maksaläiskät, erythema multiforme, erythema nodosum, verisuonisyntyinen purppura.
- Mahdollinen dementia yli 65-vuotiaana (ks. kohtaVaroitukset ja käyttöön liittyvät varotoimet).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-riskisuhteen jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yliannostuksen yhteydessä suositellaan emätinhuuhtelua.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Muut sukupuolihormonit, ATC-koodi: G03XX01.
Vaikutusmekanismi
Intrarosa sisältää vaikuttavana aineena prasteronia eli dehydroepiandrosteronia (DHEA:ta). Se on biokemiallisesti ja biologisesti samanlainen kuin endogeeninen ihmisen DHEA, joka on steroidien prekursori; se on sinänsä inaktiivinen ja muuntuu kehossa estrogeeneiksi ja androgeeneiksi. Intrarosa siis eroaa muista estrogeenivalmisteista siinä, että se tuottaa myös androgeenien metaboliitteja.
Estrogeenivälitteistä emättimen limakalvon pinta- ja välisolujen määrän lisääntymistä ja parabasaalisolujen määrän vähenemistä on todettu. Myös emättimen pH-arvo pieneni normaaliarvon vaihteluväliin nähden, mikä edistää normaalin bakteeriflooran kasvua.
Kliininen teho
Fysiologiset vasteet (objektiiviset mittaukset)
Tehoa koskevia tietoja saatiin kahdesta yhdysvaltalaisesta ja kanadalaisesta tutkimuksesta, jotka olivat kaksoissokkoutettuja, lumelääkevertailtuja vaiheen III keskeisiä monikeskustutkimuksia (ERC-231 / tutkimus 1 ja ERC-238 / tutkimus 2). Nämä tutkimukset tehtiin vaihdevuodet ohittaneilla naisilla, joiden ikä oli 40–80 vuotta (keski-ikä = 58,6 vuotta tutkimuksessa 1 ja 59,5 vuotta tutkimuksessa 2) ja joilla oli ulkosynnyttimien ja emättimen atrofia. Tutkimuksen alkaessa pintasolujen määrä naisten emätinnäytteissä oli ≤ 5,0 prosenttia, emättimen pH-arvo oli > 5,0, ja naiset olivat nimenneet (keskivaikeat tai vaikeat) yhdyntäkivut ulkosynnyttimien ja emättimen atrofian haitallisimmaksi oireeksi. Kun päivittäinen prasteronihoito 6,5 mg:n vahvuisella emätinpuikolla (n = 81 tutkimuksessa 1 ja n = 325 tutkimuksessa 2) oli kestänyt 12 viikkoa, muutos lähtötilanteesta lumelääkehoitoon (n = 77 tutkimuksessa 1 ja n = 157 tutkimuksessa 2) verrattuna osoitti merkitsevää parantumista kolmessa yhdistetyssä ‑päätetapahtumassa lumelääkkeeseen verrattuna kummassakin tutkimuksessa: pintasolujen määrä oli lisääntynyt (p < 0,0001), parabasaalisolujen määrä oli vähentynyt (p < 0,0001) ja emättimen pH-arvo oli pienentynyt (p < 0,0001).
Oireet (subjektiiviset mittaukset)
Haitallisinta oiretta, yhdyntäkipuja (yhdistetty päätetapahtuma), arvioitiin tutkimuksen alussa ja 12 viikon kuluttua, ja oireen vaikeusaste pisteytettiin seuraavasti: ei oireita = 0, lievä = 1, keskivaikea = 2 ja vaikea = 3. Taulukossa 2 esitetään vaikeuspisteiden keskimääräinen muutos haitallisimman oireen eli yhdyntäkipujen osalta 12 viikon kuluttua sekä tähän liittyvä tilastollinen testaus lumelääkkeeseen liittyvän eron osalta tutkimuksessa 1 (ERC‑231) ja tutkimuksessa 2 (ERC‑238).
Taulukko 2: Ensisijainen tehokkuusanalyysi – haitallisimmassa oireessa eli yhdyntäkivuissa tapahtunut muutos lähtötilanteesta viikolle 12 (ITT; LOCF)
| Tutkimus | Yhdyntäkivut | ||
| Intrarosa 6,5 mg | Lumelääke | p-arvo | |
| Tutkimus 1 | -1,27 | -0,87 | 0,0132 |
| Tutkimus 2 | -1,42 | -1,06 | 0,0002 |
Taulukossa 3 esitetään niiden tutkimuspotilaiden määrä, jotka ilmoittivat haitallisimmassa oireessa eli yhdyntäkivuissa tapahtuneesta muutoksesta lähtötilanteesta viikolle 12 mentäessä. ”Lieventymiseksi” määriteltiin vaikeusastepisteiden väheneminen vähintään yhdellä pisteellä. ”Parantumiseksi” määriteltiin se, jos viikolla 12 ei ollut lainkaan oireita tai jos ne olivat vain lieviä. ”Huomattava lieventyminen” rajattiin potilaisiin, joiden haitallisin oire oli lähtötilanteessa keskivaikea tai vaikea ja joka muuttui vaikeasta lieväksi tai vaikeasta tai keskivaikeasta olemattomaksi.
Taulukko 3: Niiden potilaiden määrä, joiden haitallisin oire eli yhdyntäkivut lievittyi, parani tai lievittyi huomattavasti 12 viikon Intrarosa-hoidon jälkeen lumelääkkeeseen verrattuna (ITT, LOCF)
| Lieventyminen | Paraneminen | Huomattava lieventyminen | |||||
| Intrarosa | Lumelääke | Intrarosa | Lumelääke | Intrarosa | Lumelääke | ||
| Tutkimus 1 (Intrarosa: n=81) Lumelääke (n=77) | 72,8 % (p=0,0565) | 58,4 % | 58,0 % (p=0,0813) | 44,2 % | 43,2 % (p=0,0821) | 29,9 % | |
| Tutkimus 2 (Intrarosa: n=325) (Lumelääke: n= 157) |
80,3 % | 65,0 % | 68,6 % (p=0,0003) | 51,6 % | 47,1 % (p=0,0179) | 35,7 % | |
Kliininen turvallisuus
Kahden 12 viikkoa kestäneen vaiheen III kliinisen päätutkimuksen lisäksi Intrarosan turvallisuutta koskevia tietoja on saatu myös yhdestä vertailuryhmättömästä avoimesta turvallisuustutkimuksesta, joka kesti vuoden.
Naisilta, joita on hoidettu 6,5 mg:n prasteroniannoksella 52 viikkoa, on ilmoitettu rinta- ja munasarjasyöpätapauksia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Naisilta, joita on hoidettu Intrarosalla 52 viikkoa, on ilmoitettu tapauksia, joissa papakokeen tulos on ollut poikkeava (joko levyepiteelin merkitykseltään määrittämätön atypia, ASCUS, tai lievä epiteelivaurio LSIL) ja jonka esiintyminen on ollut yleistä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Kohdun limakalvoon liittyvä turvallisuus
Niistä 389 arviointikelpoisesta limakalvobiopsiasta, jotka otettiin tutkimuksen päätteeksi 52 viikon pituisen Intrarosa-hoidon jälkeen, ei ilmoitettu histologisia poikkeavuuksia.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Intrarosan käytöstä kaikkien pediatristen potilasryhmien hoidossa.
Farmakokinetiikka
Imeytyminen
Prasteroni asetetaan emättimeen inaktiivisena prekursorina, joka siirtyy emättimen soluihin ja muuttuu solunsisäisesti sekä estrogeeneiksi että androgeeneiksi, joiden solukohtaiset määrät ovat pieniä kunkin solutyypin entsyymimäärästä johtuen. Ulkosynnyttimien ja emättimen atrofiaan liittyviin oireisiin ja merkkeihin kohdistuvat suotuisat vaikutukset aiheutuvat emättimen estrogeeni- ja androgeenireseptoreiden aktivoinnista.
Vaihdevuodet ohittaneilla naisilla tehdyssä tutkimuksessa, jossa käytettiin yksi Intrarosa-emätinpuikko kerran päivässä seitsemän päivän ajan, prasteronin keskimääräinen Cmax-arvo ja käyrän alla oleva pinta-ala nollan ja 24 tunnin välillä (AUC0-24) päivänä 7 oli 4,4 ng/ml ja 56,2 ng h/ml. Nämä arvot olivat merkitsevästi suuremmat kuin lumelääkettä saaneiden ryhmässä (taulukko 4, kuva 1). Myös testosteroni- ja estradiolimetaboliittien Cmax- ja AUC0-24-arvot olivat hieman suuremmat Intrarosa-emätinpuikolla hoidetuilla naisilla lumelääkettä saaneisiin verrattuna, mutta kaikki arvot olivat kuitenkin vaihdevuodet ohittaneiden naisten normaalien arvojen mukaisia (< 10 pg estradiolia/ml; < 0,26 ng testosteronia/ml). Sekä tutkimuksen näytteet että viitearvot mitattiin validoiduilla massaspektrometriamäärityksillä.
Taulukko 4: Prasteronin, testosteronin ja estradiolin Cmax ja AUC0-24 päivänä 7 lumelääkkeen tai Intrarosan päivittäisen käytön jälkeen (keskiarvo ± keskihajonta)
| Lumelääke (n=9) | Intrarosa (n=10) | ||
| Prasteroni | Cmax (ng/ml) | 1,60 (±0,95) | 4,42 (±1,49) |
| AUC0-24 (ng·h/ml) | 24,82 (±14,31) | 56,17 (±28,27) | |
| Testosteroni | Cmax (ng/ml) | 0,12 (±0,04)1 | 0,15 (±0,05) |
| AUC0-24 (ng·h/ml) | 2,58 (±0,94)1 | 2,79 (±0,94) | |
| Estradioli | Cmax (pg/ml) | 3,33 (±1,31) | 5,04 (±2,68) |
| AUC0-24 (pg·h/ml) | 66,49 (±20,70) | 96,93 (±52,06) |
1 : N=8
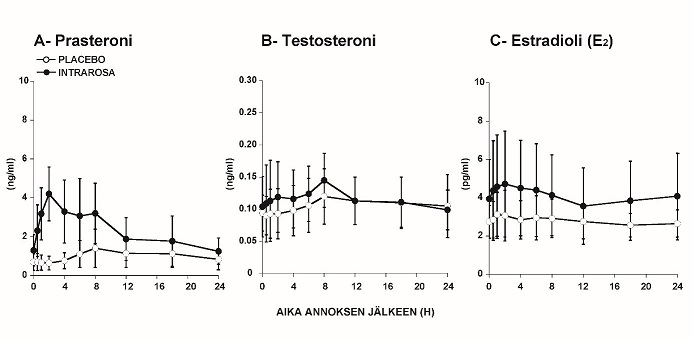
Kuva 1: Prasteronin (A), testosteronin (B) ja estradiolin (C) seerumipitoisuudet mitattuna 24 tunnin ajanjaksolta päivänä 7 lumelääkkeen tai Intrarosan päivittäisen käytön jälkeen (keskiarvo ± keskihajonta)
Jakautuminen
Emättimensisäinen (eksogeeninen) prasteroni jakautuu pääasiassa paikallisesti. Systeemisen altistumisen pientä suurenemista on havaittu etenkin metaboliittien osalta, mutta se on kuitenkin normaaliarvojen mukaista.
Biotransformaatio
Eksogeeninen prasteroni metaboloituu samalla tavalla kuin endogeeninen prasteroni. Systeemistä metabolismia ei ole tutkittu tämän hakemuksen yhteydessä.
Eliminaatio
Systeemistä eliminaatiota ei ole varsinaisesti tutkittu tämän hakemuksen yhteydessä.
Prekliiniset tiedot turvallisuudesta
Prasteroni ei ollut mutageeninen tai klastogeeninen in vitro- ja in vivo -vakiotutkimusten sarjassa.
Karsinogeenisuutta sekä lisääntymis- ja kehitystoksisuutta koskevia tutkimuksia ei ole tehty.
Farmaseuttiset tiedot
Apuaineet
Kova rasva (adeps solidus)
Yhteensopimattomuudet
Ei oleellinen
Kestoaika
3 vuotta
Säilytys
Säilytä alle 30 °C.
Ei saa jäätyä.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
INTRAROSA emätinpuikko
6,5 mg (L:ei) 28 fol (6 asetinta) (34,25 €)
PF-selosteen tieto
Läpipainopakkaus, jonka ulkokerros on valmistettu PVC:stä ja sisäkerros LDPE:stä.
Asetin on valmistettu LDPE:stä ja 1-prosenttisesta väriaineesta (titaanidioksidi).
Pakkauksessa on 28 emätinpuikkoa ja kuusi asetinta.
Valmisteen kuvaus:
Valkoinen tai luonnonvalkoinen luodinmuotoinen emätinpuikko, jonka pituus on noin 28 mm ja läpimitta 9 mm leveämmässä päässä.
Käyttö- ja käsittelyohjeet
Korvattavuus
INTRAROSA emätinpuikko
6,5 mg 28 fol
- Ei korvausta.
ATC-koodi
G03XX01
Valmisteyhteenvedon muuttamispäivämäärä
07.12.2023
Yhteystiedot
Box 7688
103 95 Stockholm
Sverige
+46 8 544 900 22
info@aviapharma.se
