OZEMPIC injektioneste, liuos, esitäytetty kynä 0,25 mg, 0,5 mg, 1 mg, 2 mg (2 mg ei kaupan Suomessa)
Vaikuttavat aineet ja niiden määrät
Ozempic 0,25 mg injektioneste, liuos
Yksi ml liuosta sisältää 1,34 mg semaglutidia*. Yksi esitäytetty kynä sisältää 2 mg semaglutidia* 1,5 ml:ssa liuosta. Jokainen annos sisältää 0,25 mg semaglutidia 0,19 ml:ssa liuosta.
Ozempic 0,5 mg injektioneste, liuos
1,5 ml: Yksi ml liuosta sisältää 1,34 mg semaglutidia*. Yksi esitäytetty kynä sisältää 2 mg semaglutidia* 1,5 ml:ssa liuosta. Jokainen annos sisältää 0,5 mg semaglutidia 0,37 ml:ssa liuosta.
3 ml: Yksi ml liuosta sisältää 0,68 mg semaglutidia*. Yksi esitäytetty kynä sisältää 2 mg semaglutidia* 3 ml:ssa liuosta. Jokainen annos sisältää 0,5 mg semaglutidia 0,74 ml:ssa liuosta. (ei kaupan Suomessa)
3 ml: Yksi ml liuosta sisältää 1,34 mg semaglutidia*. Yksi esitäytetty kynä sisältää 4 mg semaglutidia* 3 ml:ssa liuosta. Jokainen annos sisältää 0,5 mg semaglutidia 0,37 ml:ssa liuosta. (ei kaupan Suomessa)
Ozempic 1 mg injektioneste, liuos
Yksi ml liuosta sisältää 1,34 mg semaglutidia*. Yksi esitäytetty kynä sisältää 4 mg semaglutidia* 3 ml:ssa liuosta. Jokainen annos sisältää 1 mg semaglutidia 0,74 ml:ssa liuosta.
Yksi ml liuosta sisältää 2,68 mg semaglutidia*. Yksi esitäytetty kynä sisältää 8 mg semaglutidia* 3 ml:ssa liuosta. Jokainen annos sisältää 1 mg semaglutidia 0,37 ml:ssa liuosta.
Ozempic 2 mg injektioneste, liuos (ei kaupan Suomessa)
Yksi ml liuosta sisältää 2,68 mg semaglutidia*. Yksi esitäytetty kynä sisältää 8 mg semaglutidia* 3 ml:ssa liuosta. Jokainen annos sisältää 2 mg semaglutidia 0,74 ml:ssa liuosta.
* Ihmisen glukagonin kaltaisen peptidi 1:n (GLP-1) analogi, joka on tuotettu yhdistelmä-DNA-tekniikalla Saccharomyces cerevisiae -soluissa.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, liuos (injektio).
Kliiniset tiedot
Käyttöaiheet
Ozempic on tarkoitettu aikuisille riittämättömässä hoitotasapainossa oleville tyypin 2 diabetespotilaille ruokavalion ja liikunnan lisänä
- monoterapiana, kun metformiinin käyttöä ei voida pitää tarkoituksenmukaisena intoleranssin tai vasta-aiheiden vuoksi
- muiden diabeteksen hoitoon käytettävien lääkevalmisteiden lisänä.
Tutkimustulokset eri yhdistelmähoidoista, vaikutuksista glukoositasapainoon, sydän- ja verisuonitautiin ja munuaistapahtumiin, sekä tutkimuspopulaatioista ovat luettavissa kohdissa Varoitukset ja käyttöön liittyvät varotoimet, Yhteisvaikutukset ja Farmakodynamiikka.
Annostus ja antotapa
Annostus
Aloitusannos on 0,25 mg semaglutidia kerran viikossa. Neljän viikon kuluttua annos pitää suurentaa 0,5 mg:aan kerran viikossa. Kun annosta 0,5 mg kerran viikossa on käytetty vähintään 4 viikon ajan, annos voidaan suurentaa 1 mg:aan kerran viikossa glukoositasapainon parantamiseksi edelleen. Kun 1 mg:n viikkoannosta on käytetty vähintään 4 viikon ajan, annos voidaan suurentaa 2 mg:aan kerran viikossa glukoositasapainon parantamiseksi edelleen (myyntiluvan mukaan 2 mg:n annos on tarkoitettu otettavaksi 2 mg -valmisteesta, joka ei ole kaupan Suomessa).
Semaglutidi 0,25 mg ei ole ylläpitoannos. Yli 2 mg:n viikkoannoksia ei suositella.
Kun Ozempic lisätään käytössä olevaan metformiini- ja/tai tiatsolidiinidionilääkitykseen tai natriumin- ja glukoosinkuljettajaproteiini 2:n (SGLT2) estäjään, metformiinin ja/tai tiatsolidiinidionin tai SGLT2:n estäjän senhetkistä annosta ei tarvitse muuttaa.
Kun Ozempic lisätään käytössä olevaan sulfonyyliurealääkitykseen tai insuliiniin, sulfonyyliurea- tai insuliiniannoksen pienentämistä tulee harkita hypoglykemiariskin pienentämiseksi (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset).
Verensokerin omaseuranta ei ole tarpeen Ozempic-annoksen säätämiseksi. Verensokerin omaseuranta on tarpeen sulfonyyliurea- ja insuliiniannoksen säätämiseksi, etenkin Ozempic-hoitoa aloitettaessa ja insuliiniannosta pienennettäessä. Insuliiniannosta on suositeltavaa pienentää asteittain.
Annoksen unohtuminen
Unohtunut annos tulee ottaa mahdollisimman pian ja 5 päivän kuluessa annoksen unohtamisesta. Jos aikaa on kulunut yli 5 päivää, unohtunut annos jätetään väliin, ja seuraava annos otetaan tavanomaisen aikataulun mukaisena päivänä. Molemmissa tapauksissa potilas voi palata tavanomaiseen kerran viikossa tapahtuvaan annosteluun.
Antopäivän muuttaminen
Viikoittaista antopäivää voidaan tarpeen mukaan muuttaa, kunhan kahden annoksen väliin jää aina vähintään 3 päivän (> 72 tunnin) tauko. Kun uusi antopäivä on valittu, jatketaan kerran viikossa tapahtuvaa annostelua.
Erityisryhmät
Iäkkäät
Annosta ei tarvitse säätää iän perusteella.
Munuaisten vajaatoiminta
Annoksen säätäminen ei ole tarpeen, jos potilaalla on lievä, keskivaikea tai vaikea munuaisten vajaatoiminta. Semaglutidihoidosta potilailla, joilla on loppuvaiheen munuaissairaus, on vain vähän kokemusta.
Maksan vajaatoiminta
Annoksen säätäminen ei ole tarpeen, jos potilaalla on maksan vajaatoiminta. Vaikeaa maksan vajaatoimintaa sairastavien potilaiden semaglutidihoidosta on vain vähän kokemusta. Varovaisuutta on noudatettava kun näitä potilaita hoidetaan semaglutidilla (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Semaglutidin turvallisuutta ja tehoa alle 18 vuoden ikäisten lasten ja nuorten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Antotapa
Ihon alle.
Ozempic pistetään ihon alle vatsaan, reiteen tai olkavarteen. Pistoskohtaa voidaan muuttaa annosta säätämättä. Ozempic-valmistetta ei saa pistää laskimoon tai lihakseen.
Ozempic annetaan kerran viikossa mihin vuorokaudenaikaan tahansa, aterian kanssa tai ilman.
Lisätietoja annostelusta on kohdassa Käyttö- ja käsittelyohjeet.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Yleistä
Semaglutidia ei saa käyttää tyypin 1 diabetes mellituksen tai diabeettisen ketoasidoosin hoitoon. Semaglutidi ei korvaa insuliinia. Diabeettista ketoasidoosia on raportoitu insuliinista riippuvaisilla potilailla, joiden insuliinihoito on äkillisesti lopetettu tai joiden insuliiniannosta on äkillisesti pienennetty, kun hoito GLP‑1-reseptoriagonistilla on aloitettu (ks. kohta Annostus ja antotapa).
New York Heart Associationin (NYHA) luokan IV sydämen vajaatoimintapotilaiden hoidosta ei ole hoitokokemusta, ja sen vuoksi semaglutidia ei suositella käytettäväksi näille potilaille.
Aspiraatio yleisanestesian tai syvän sedaation yhteydessä
GLP-1-reseptoriagonisteja yleisanestesiassa tai syvässä sedaatiossa saaneilla potilailla on ilmoitettu aspiraatiopneumoniatapauksista. Siksi on otettava huomioon lisääntynyt riski mahaan jääneestä sisällöstä viivästyneen tyhjentymisen takia (ks. kohta Haittavaikutukset) ennen yleisanestesian tai syvän sedaation aikana suoritettavia toimenpiteitä.
Vaikutukset ruoansulatuselimistöön ja kuivuminen
GLP-1-reseptoriagonistien käyttöön voi liittyä ruoansulatuselimistön haittavaikutuksia. Tämä on otettava huomioon hoidettaessa munuaisten vajaatoimintaa sairastavia potilaita, sillä pahoinvointi, oksentelu ja ripuli voivat aiheuttaa kuivumista, joka voi harvinaisissa tapauksissa johtaa munuaisten toiminnan heikkenemiseen (ks. kohta Haittavaikutukset). Semaglutidia saaville potilaille on kerrottava ruoansulatuselimistön haittavaikutuksiin liittyvästä mahdollisesta kuivumisen riskistä, ja heitä on neuvottava ryhtymään varotoimiin nestevajeen välttämiseksi.
Akuutti haimatulehdus
GLP-1-reseptoriagonistien käytön yhteydessä on todettu akuutteja haimatulehduksia. Potilaille tulee kertoa akuutille haimatulehdukselle tyypillisistä oireista. Jos haimatulehdusta epäillään, semaglutidilääkitys tulee keskeyttää. Jos akuutti haimatulehdus varmistuu, semaglutidilääkitystä ei pidä aloittaa uudelleen. Varovaisuutta on noudatettava sellaisten potilaiden kohdalla, joilla on joskus ollut haimatulehdus.
Hypoglykemia
Potilailla, jotka saavat semaglutidia yhdessä sulfonyyliurean tai insuliinin kanssa, voi olla suurentunut hypoglykemian riski. Hypoglykemian riskiä voidaan pienentää sulfonyyliurea- tai insuliiniannosta pienentämällä, kun semaglutidihoito aloitetaan (ks. kohta Haittavaikutukset).
Diabeettinen retinopatia
Diabeettisen retinopatian komplikaatioiden kehittymisriskin on todettu suurentuneen diabeettista retinopatiaa sairastavilla, insuliini- ja semaglutidihoitoa saavilla potilailla (ks. kohta Haittavaikutukset). Varovaisuutta on noudatettava, kun semaglutidia käytetään diabeettista retinopatiaa sairastaville, insuliinihoitoa saaville potilaille. Näitä potilaita on seurattava huolellisesti, ja hoidettava kliinisten suositusten mukaisesti. Diabeettisen retinopatian tilapäinen vaikeutuminen on liittynyt verensokeritasapainon nopeaan paranemiseen, mutta muitakaan mekanismeja ei voida poissulkea. Semaglutidin 2 mg:n annoksen käytöstä tyypin 2 diabetesta sairastaville potilaille, joilla on kontrolloimaton tai mahdollisesti epävakaa diabeettinen retinopatia, ei ole kokemusta. Semaglutidin 2 mg:n annoksen käyttöä ei tämän vuoksi suositella näille potilaille.
Non-arteriittinen anteriorinen iskeeminen optikusneuropatia (NAION)
Epidemiologisista tutkimuksista saatujen tietojen perusteella non-arteriittisen anteriorisen iskeemisen optikusneuropatian (NAION) riski on suurentunut semaglutidihoidon aikana. Aikaväli, jolla NAION saattaa kehittyä hoidon aloittamisen jälkeen, ei ole tiedossa. Äkillisen näönmenetyksen tapauksessa on tehtävä silmätutkimus, ja jos NAION-diagnoosi varmistuu, semaglutidihoito on lopetettava (ks. kohta Haittavaikutukset).
Potilaat, joilla on gastropareesi
Gastropareesia sairastavat potilaat, joita hoidetaan semaglutidilla, voivat saada vakavampia tai vaikeampia ruoansulatuselimistön haittavaikutuksia. Semaglutidia tulee käyttää varoen näillä potilailla ja sitä ei suositella käytettäväksi, mikäli gastropareesi on vaikea (ks. kohta Haittavaikutukset).
Natriumpitoisuus
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Semaglutidi hidastaa mahan tyhjentymistä ja saattaa vaikuttaa suun kautta samanaikaisesti otettavien lääkkeiden imeytymisnopeuteen. Semaglutidia on käytettävä varoen, jos potilas saa samanaikaisesti suun kautta otettavia lääkevalmisteita, jotka vaativat nopeaa imeytymistä ruoansulatuskanavasta.
Parasetamoli
Parasetamolin farmakokinetiikan perusteella arvioituna semaglutidin todettiin hidastavan mahan tyhjenemistä vakioidun ateriatestin aikana. Parasetamolin AUC0-60min pieneni 27 % ja Cmax 23 %, kun samanaikaisesti annettiin 1 mg semaglutidia. Parasetamolin kokonaisaltistus (AUC0‑5h) ei muuttunut. Kliinisesti merkittävää vaikutusta mahan tyhjenemisen nopeuteen ei havaittu semaglutidin 2,4 mg:n annosta käytettäessä, 20 viikon pituisen semaglutidin annon jälkeen. Tämä johtui todennäköisesti toleranssivaikutuksesta. Semaglutidin kanssa samanaikaisesti annettavan parasetamolin annosta ei tarvitse muuttaa.
Suun kautta otettavat ehkäisyvalmisteet
Semaglutidin ei odoteta heikentävän suun kautta otettavien ehkäisyvalmisteiden tehoa, koska semaglutidi ei muuttanut etinyyliestradiolin eikä levonorgestreelin kokonaisaltistusta kliinisesti merkittävässä määrin, kun suun kautta otettavaa yhdistelmäehkäisyvalmistetta (0,03 mg etinyyliestradiolia/0,15 mg levonorgestreelia) annettiin samanaikaisesti semaglutidin kanssa. Etinyyliestradiolialtistus ei muuttunut. Levonorgestreelialtistuksen todettiin suurentuneen 20 % vakaassa tilassa. Minkään yhdisteen Cmax ei muuttunut.
Atorvastatiini
Semaglutidi ei muuttanut atorvastatiinin kokonaisaltistusta atorvastatiinikerta-annoksen (40 mg) jälkeen. Atorvastatiinin Cmax pieneni 38 %. Tätä ei pidetty kliinisesti merkittävänä.
Digoksiini
Semaglutidi ei muuttanut digoksiinin kokonaisaltistusta tai Cmax-arvoa digoksiinikerta-annoksen (0,5 mg) jälkeen.
Metformiini
Semaglutidi ei muuttanut metformiinin kokonaisaltistusta tai Cmax-arvoa, kun metformiinia annettiin 500 mg kahdesti päivässä 3,5 päivän ajan.
Varfariini ja muut kumariinijohdokset
Semaglutidi ei muuttanut R- tai S-varfariinin kokonaisaltistusta tai Cmax-arvoa varfariinikerta-annoksen (25 mg) jälkeen, ja INR-arvona (International Normalised Ratio) mitatut varfariinin farmakodynaamiset vaikutukset eivät muuttuneet kliinisesti merkittävässä määrin. Tapauksia, joissa INR-arvo on pienentynyt, on kuitenkin raportoitu käytettäessä asenokumarolia ja semaglutidia samanaikaisesti. On suositeltavaa, että varfariinia tai muita kumariinijohdoksia saavien potilaiden INR-arvoa seurataan useammin semaglutidihoidon alussa.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi
Naisten, jotka voivat tulla raskaaksi, suositellaan käyttävän ehkäisyä semaglutidihoidon aikana.
Raskaus
Eläimillä tehdyissä tutkimuksissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Semaglutidin käytöstä raskaana oleville naisille on vain vähän tietoja. Siksi semaglutidia ei pidä käyttää raskauden aikana. Jos potilas suunnittelee raskautta tai tulee raskaaksi, semaglutidihoito on lopetettava. Semaglutidin käyttö on lopetettava vähintään 2 kuukautta ennen aiotun raskauden alkua pitkän puoliintumisajan vuoksi (ks. kohta Farmakokinetiikka).
Imetys
Semaglutidi erittyi imettävien rottien maitoon. Imetettävään vauvaan kohdistuvia riskejä ei voida sulkea pois, joten semaglutidia ei pidä käyttää imetyksen aikana.
Hedelmällisyys
Semaglutidin vaikutusta ihmisen hedelmällisyyteen ei tunneta. Semaglutidi ei vaikuttanut urosrottien hedelmällisyyteen. Naarasrottien kiimakierron todettiin pidentyneen ja ovulaatioiden lukumäärän hieman pienentyneen käytettäessä annoksia, joihin liittyi emon painon laskua (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Semaglutidilla ei ole haitallista vaikutusta ajokykyyn tai koneidenkäyttökykyyn. Kun sitä käytetään yhdessä sulfonyyliurean tai insuliinin kanssa, potilaita tulee neuvoa ryhtymään varotoimiin hypoglykemian välttämiseksi autoa ajettaessa ja koneita käyttäessä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Kahdeksassa faasin 3a tutkimuksessa 4 792 potilaalle annettiin enintään 1 mg semaglutidia. Kliinisissä tutkimuksissa yleisimmin raportoituja haittavaikutuksia olivat ruoansulatuskanavan häiriöt, mukaan lukien pahoinvointi (hyvin yleinen), ripuli (hyvin yleinen) ja oksentelu (yleinen). Nämä reaktiot olivat yleensä lieviä tai keskivaikeita ja lyhytkestoisia.
Taulukoitu haittavaikutuslista
Taulukossa 1 luetellaan haittavaikutukset, joita on todettu kaikissa faasin 3 tutkimuksissa (mukaan lukien pitkäkestoinen sydän- ja verisuonivaikutustutkimus) ja joista on raportoitu myyntiluvan myöntämisen jälkeen tyypin 2 diabetes mellitusta sairastavilla potilailla (kuvattu tarkemmin kohdassa Farmakodynamiikka). Haittavaikutusten (paitsi diabeettiseen retinopatiaan liittyvien komplikaatioiden, ks. taulukon 1 alaviite) esiintymistiheydet perustuvat yhdistettyihin faasin 3a tutkimuksiin sydän- ja verisuonivaikutustutkimusta lukuun ottamatta (ks. lisätietoja taulukon alla olevasta tekstistä).
Haittavaikutukset on lueteltu alla elinjärjestelmän ja absoluuttisen esiintymistiheyden mukaan. Haittavaikutusten esiintymistiheydet on määritetty seuraavasti: hyvin yleinen (≥1/10); yleinen (≥1/100, <1/10); melko harvinainen (≥1/1 000, <1/100); harvinainen (≥1/10 000, <1/1 000); hyvin harvinainen (<1/10 000) ja tuntematon: koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin. Jokaisessa esiintymistiheysryhmässä haittavaikutukset on esitetty vakavuuden mukaan vähenevässä järjestyksessä.
Taulukko 1 Semaglutidin haittavaikutusten esiintymistiheydet
| MedDRA elinjärjestelmäluettelo | Hyvin yleinen | Yleinen | Melko harvinainen | Harvinainen | Hyvin harvinainen | Tuntematon |
| Immuunijärjestelmä | Yliherkkyysc | Anafylaktinen reaktio | ||||
| Aineenvaihdunta ja ravitsemus | Hypoglykemiaa insuliinin tai sulfonyyliurean kanssa käytettynä | Hypoglykemiaa muiden suun kautta otettavien diabeteslääkkeiden kanssa käytettynä Ruokahalun heikkeneminen | ||||
| Hermosto | Heitehuimaus Päänsärky | Makuhäiriöt | Tuntohäiriöd | |||
| Silmät | Diabeettisen retinopatian komplikaatiotb | Non-arteriittinen anteriorinen iskeeminen optikusneuropatia (NAION) | ||||
| Sydän | Nopeutunut sydämen syke | |||||
| Ruoansulatuselimistö | Pahoinvointi Ripuli | Oksentelu Vatsakipu Vatsan turvotus Ummetus Dyspepsia Mahatulehdus Gastroesofageaalinen refluksitauti Röyhtäily Ilmavaivat | Akuutti haimatulehdus Viivästynyt mahan tyhjeneminen | Suolitukosd | ||
| Maksa ja sappi | Sappikivitauti | |||||
| Iho ja ihonalainen kudos | Angioedeemad | |||||
| Yleisoireet ja antopaikassa todettavat haitat | Uupumus | Pistospaikan reaktiot | ||||
| Tutkimukset | Suurentunut lipaasiarvo Suurentunut amylaasiarvo Painon lasku |
a) Vakavaksi määritetty hypoglykemia (joka edellyttää toisen henkilön apua) tai oireinen hypoglykemia yhdistettynä verenglukoosipitoisuuteen < 3,1 mmol/l.
b) Diabeettisen retinopatian komplikaatiot ovat yhdistelmä seuraavista: verkkokalvon fotokoagulaatio, lasiaisensisäinen hoito, lasiaisen verenvuoto, diabetekseen liittyvä sokeus (melko harvinainen). Esiintymistiheys perustuu sydän- ja verisuonivaikutustutkimukseen.
c) Yhdistetty termi, joka kattaa myös yliherkkyyteen liittyvät haittatapahtumat, kuten ihottuman ja nokkosihottuman.
d) Perustuu ilmoituksiin myyntiluvan myöntämisen jälkeen.
Kaksi vuotta kestänyt sydän- ja verisuonivaikutus- ja turvallisuustutkimus
Suuren sydän- ja verisuoniriskin populaatiossa haittavaikutusprofiili oli samankaltainen kuin muissakin faasin 3a tutkimuksissa (kuvattu kohdassa Farmakodynamiikka).
Valittujen haittavaikutusten kuvaus
Hypoglykemia
Vakavia hypoglykemiatapauksia ei todettu, kun semaglutidia käytettiin yksinään. Vakavaa hypoglykemiaa todettiin ensisijaisesti silloin, kun semaglutidia käytettiin yhdessä sulfonyyliurean kanssa (1,2 % koehenkilöistä, 0,03 tapahtumaa/potilasvuosi) tai insuliinin kanssa (1,5 % koehenkilöistä, 0,02 tapahtumaa/potilasvuosi). Tapauksia todettiin harvoin (0,1 % koehenkilöistä, 0,001 tapahtumaa/potilasvuosi), kun semaglutidia käytettiin yhdessä muiden suun kautta otettavien diabeteslääkkeiden kuin sulfonyyliureoiden kanssa.
Kun SUSTAIN 9 ‑tutkimuksessa SGLT2:n estäjään lisättiin 1 mg semaglutidia, American Diabetes Association -yhdistyksen (ADA) määritelmän mukaista hypoglykemiaa ilmeni 11,3 %:lla potilaista (0,3 tapahtumaa/potilasvuosi) verrattuna 2,0 %:iin (0,04 tapahtumaa/potilasvuosi) lumelääkettä saaneista potilaista. Vakavaa hypoglykemiaa ilmoitettiin 0,7 %:lla semaglutidia saaneista potilaista (0,01 tapahtumaa/potilasvuosi) ja 0 %:lla lumelääkettä saaneista potilaista.
40 viikon pituisessa faasin 3b tutkimuksessa, jossa potilaat saivat semaglutidin 1 mg:n ja 2 mg:n annoksina, suurin osa hypoglykemiatapauksista (45/49 tapausta) ilmeni, kun semaglutidia käytettiin yhdistelmähoitona sulfonyyliurean tai insuliinin kanssa. Yleisesti ottaen semaglutidin 2 mg:n annoksen käyttöön ei liittynyt kohonnutta hypoglykemian riskiä.
Ruoansulatuselimistön haittavaikutukset
Pahoinvointia esiintyi 17 %:lla semaglutidia 0,5 mg saaneista ja 19,9 %:lla semaglutidia 1 mg saaneista potilaista. Ripulia esiintyi vastaavasti 12,2 %:lla ja 13,3 %:lla ja oksentelua 6,4 %:lla ja 8,4 %:lla näistä potilaista. Useimmat tapahtumat olivat lieviä tai keskivaikeita ja lyhytkestoisia. Tapahtumat johtivat hoidon keskeyttämiseen 3,9 %:lla ja 5 %:lla potilaista. Tapahtumia ilmoitettiin useimmiten ensimmäisten hoitokuukausien aikana.
Pienipainoisilla potilailla voi esiintyä enemmän ruoansulatuskanavan haittavaikutuksia semaglutidihoidon aikana.
40 viikon pituisessa faasin 3b tutkimuksessa, jossa potilaat saivat semaglutidia 1 mg:n ja 2 mg:n annoksina, pahoinvointia ilmeni lähes yhtä suurina suhteellisina osuuksina 1 mg:n ja 2 mg:n semaglutidiannoksella hoidetuilla potilailla. Ripulia ja oksentelua ilmeni suuremmalla osalla 2 mg:n semaglutidiannosta saaneista potilaista kuin 1 mg:n semaglutidiannosta saaneista potilaista. Ruoansulatuselimistön haittavaikutuksia, jotka johtivat hoidon keskeyttämiseen, ilmeni lähes yhtä suurina suhteellisina osuuksina hoitoryhmissä, jotka saivat 1 mg:n ja 2 mg:n semaglutidiannosta.
Kun semaglutidia käytettiin samanaikaisesti SGLT2:n estäjän kanssa SUSTAIN 9 ‑tutkimuksessa, ummetusta ilmeni 6,7 %:lla ja gastroesofageaalista refluksitautia 4 %:lla 1 mg semaglutidia saaneista potilaista. Lumelääkettä saaneilla potilailla ei todettu tapahtumia. Näiden tapahtumien esiintyvyys ei pienentynyt ajan myötä.
Gastropareesia sairastavilla potilailla voi esiintyä vakavampia tai vaikeampia ruoansulatuselimistön haittavaikutuksia semaglutidihoidon aikana.
Akuutti haimatulehdus
Faasin 3a kliinisissä tutkimuksissa raportoitiin vahvistettua akuuttia haimatulehdusta 0,3 %:lla semaglutidia saaneista ja 0,2 %:lla vertailuvalmistetta saaneista potilaista. Kahden vuoden mittaisessa sydän- ja verisuonivaikutustutkimuksessa vahvistetun akuutin haimatulehduksen esiintymistiheys oli 0,5 % semaglutidia saaneilla ja 0,6 % lumelääkettä saaneilla potilailla (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Diabeettisen retinopatian komplikaatiot
Kaksi vuotta kestäneessä kliinisessä tutkimuksessa tutkittiin 3 297 tyypin 2 diabetesta sairastavaa potilasta, joilla oli suuri sydän- ja verisuonitapahtumien riski ja huonossa hoitotasapainossa oleva verensokeri, ja jotka olivat sairastaneet diabetesta kauan. Tässä tutkimuksessa vahvistettuja diabeettisen retinopatian komplikaatioita esiintyi useammin semaglutidihoitoa saaneilla (3 %) kuin lumelääkettä saaneilla (1,8 %) potilailla. Tämä havainto tehtiin niiden insuliinihoitoa saaneiden potilaiden kohdalla, joiden tiedettiin sairastavan diabeettista retinopatiaa. Ero hoidoissa ilmaantui aikaisin ja kesti koko tutkimuksen ajan. Järjestelmällinen diabeettisen retinopatian komplikaatioiden arviointi tehtiin vain sydän- ja verisuonivaikutustutkimuksessa. Enintään vuoden kestäneissä kliinisissä tutkimuksissa, joihin osallistui 4 807 tyypin 2 diabetesta sairastavaa potilasta, diabeettiseen retinopatiaan liittyviä haittatapahtumia raportoitiin suurin piirtein yhtä paljon semaglutidihoitoa saaneilla koehenkilöillä (1,7 %) ja verrokeilla (2,0 %).
Non-arteriittinen anteriorinen iskeeminen optikusneuropatia (NAION)
Useista laajoista epidemiologisista tutkimuksista saadut tulokset viittaavat siihen, että NAION-tilan kehittymisen suhteellinen riski suurenee tyypin 2 diabetesta sairastavilla aikuisilla semaglutidialtistuksen yhteydessä noin kaksinkertaiseksi, mikä vastaa noin yhtä lisätapausta 10 000:ta henkilöhoitovuotta kohti.
Hoidon lopettaminen haittatapahtuman takia
Semaglutidia 0,5 mg ja 1 mg saaneista potilaista 6,1 % ja 8,7 % ja lumelääkettä saaneista potilaista 1,5 % keskeytti hoidon haittatapahtumien takia. Ruoansulatuskanavan haittatapahtumat olivat yleisimpiä hoidon lopettamiseen johtaneita haittatapahtumia.
Pistoskohdan reaktiot
Pistoskohdan reaktioita (esim. pistoskohdan ihottuma, punoitus) on raportoitu 0,6 %:lla semaglutidia 0,5 mg saaneista ja 0,5 %:lla semaglutidia 1 mg saaneista potilaista. Nämä reaktiot ovat yleensä olleet lieviä.
Immunogeenisuus
Proteiineja tai peptidejä sisältävillä lääkevalmisteilla saattaa olla immunogeenisiä vaikutuksia, joten potilaille voi kehittyä vasta-aineita semaglutidihoidon jälkeen. Niiden potilaiden osuus, joilla todettiin semaglutidivasta-aineita milloin tahansa lähtötilanteen jälkeen, oli pieni (1–3 %), eikä yhdelläkään potilaalla ollut tutkimuksen päättyessä semaglutidia neutraloivia vasta-aineita tai semaglutidivasta-aineita, joilla oli endogeenistä GLP-1:tä neutraloiva vaikutus.
Sydämen sykkeen nousu
GLP-1 reseptoriagonistien on todettu nostaneen sydämen sykettä. Faasi 3a tutkimuksissa todettiin Ozempic-valmisteella hoidetuilla tutkittavilla keskimääräinen nousu 1–6 lyöntiä/minuutti (bpm) lähtötasosta 72–76 lyöntiä/minuutti. Pitkäaikaisessa tutkimuksessa, jossa tutkittavilla oli sydän- ja verisuonitapahtumien riskitekijöitä, Ozempic-hoitoa saaneista tutkittavista 16 %:lla sydämen syke nousi > 10 lyöntiä/minuutti kahden vuoden hoidon jälkeen, kun lumelääkkeitä saavista vastaava nousu todettiin 11 %:lla tutkittavista.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Kliinisissä tutkimuksissa on raportoitu tapauksia, joissa valmistetta on otettu enintään 4 mg:n yliannostus kerta-annoksena tai viikossa. Pahoinvointi oli yleisimmin raportoitu haittavaikutus. Kaikki potilaat toipuivat ilman komplikaatioita.
Semaglutidin yliannostukseen ei ole mitään spesifistä vastalääkettä. Yliannostustapauksissa tulee aloittaa asianmukainen tukihoito potilaan kliinisten oireiden perusteella. Semaglutidin pitkän, noin viikon mittaisen puoliintumisajan takia näiden oireiden pitkäkestoinen tarkkailu ja hoito voi olla tarpeen (ks. kohta Farmakokinetiikka).
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Diabeteslääkkeet, GLP-1-analogit. ATC-koodi: A10BJ06
Vaikutusmekanismi
Semaglutidi on GLP-1-analogi, jonka aminohappojärjestys on 94-prosenttisesti homologinen ihmisen GLP-1:n kanssa. Semaglutidi vaikuttaa GLP-1-reseptoriagonistina, joka sitoutuu selektiivisesti GLP-1-reseptoriin ja aktivoi sen. GLP-1-reseptori on luontaisen GLP-1:n kohde.
GLP-1 on fysiologinen hormoni, jolla on useita tehtäviä glukoosin ja ruokahalun säätelyssä, sydän- ja verisuonijärjestelmässä sekä munuaisissa. Glukoosiin ja ruokahaluun kohdistuvat vaikutukset välittyvät spesifisesti haiman ja aivojen GLP-1-reseptorien kautta.
Semaglutidi pienentää veren glukoosipitoisuutta glukoosista riippuvaisesti stimuloimalla insuliinin eritystä ja vähentämällä glukagonin eritystä, kun veren glukoosipitoisuus on korkea. Verenglukoosia alentavaan vaikutukseen liittyy myös lievä mahan tyhjenemisen hidastuminen pian aterian jälkeen. Hypoglykemian aikana semaglutidi vähentää insuliinin eritystä eikä vaikuta glukagonin eritykseen.
Semaglutidi alentaa painoa ja vähentää kehon rasvan määrää vähentämällä elimistön energiansaantia mm. heikentämällä yleisesti ruokahalua. Lisäksi semaglutidi vähentää mieltymystä runsaasti rasvaa sisältäviin ruokiin.
GLP-1-reseptorit ilmentyvät myös sydämessä, verisuonistossa, immuunijärjestelmässä ja munuaisissa. Semaglutidin vaikutusmekanismi on todennäköisesti monitekijäinen. Epäsuoriin vaikutuksiin viittaavat semaglutidin suotuisa vaikutus plasman lipideihin, systolisen verenpaineen lasku ja tulehduksen väheneminen kliinisissä tutkimuksissa, mutta semaglutidilla on todennäköisesti myös suoria vaikutuksia. Eläinkokeissa semaglutidi vähensi ateroskleroosin kehittymistä ehkäisemällä aorttaplakin etenemistä ja vähentämällä plakin tulehdusta.
Kliiniset tiedot osoittivat, että semaglutidi vähensi albuminuriaa potilailla, joilla oli munuaissairaus.
Farmakodynaamiset vaikutukset
Kaikki farmakodynaamiset arvioinnit tehtiin 12 viikkoa kestäneen hoidon jälkeen (annoksen suurentaminen mukaan lukien) vakaassa tilassa, kun semaglutidiannos oli 1 mg kerran viikossa.
Paastoglukoosi ja aterianjälkeinen glukoosi
Semaglutidi pienentää glukoosipitoisuuden paastoarvoja ja aterianjälkeisiä arvoja. Tyypin 2 diabetesta sairastavilla potilailla semaglutidi 1 mg pienensi glukoosiarvoja, kun mittarina käytettiin absoluuttista muutosta lähtötasosta (mmol/l) ja suhteellista vähenemistä (%) seuraavissa arvoissa lumelääkkeeseen verrattuna: paastoglukoosi (1,6 mmol/l; 22 %:n väheneminen), glukoosiarvo 2 tuntia aterian jälkeen (4,1 mmol/l; 37 %:n väheneminen), 24 tunnin glukoosipitoisuuden keskiarvo (1,7 mmol/l; 22 %:n väheneminen) ja glukoosiarvojen vaihtelu 3 aterian jälkeen (0,6–1,1 mmol/l). Semaglutidi pienensi glukoosin paastoarvoa ensimmäisen annoksen jälkeen.
Beetasolujen toiminta ja insuliinin eritys
Semaglutidi parantaa beetasolujen toimintaa. Lumelääkkeeseen verrattuna semaglutidi kolminkertaisti ensimmäisen vaiheen ja kaksinkertaisti toisen vaiheen insuliinivasteen ja suurensi beetasolujen maksimaalista erityskapasiteettia tyypin 2 diabetesta sairastavilla potilailla. Lisäksi semaglutidihoito suurensi insuliinin paastoarvoja lumelääkkeeseen verrattuna.
Glukagonin eritys
Semaglutidi pienentää glukagonipitoisuuden paastoarvoja ja aterianjälkeisiä arvoja. Tyypin 2 diabetesta sairastavilla potilailla semaglutidilla saavutettiin seuraavat glukagonipitoisuuden suhteelliset laskut lumelääkkeeseen verrattuna: glukagonin paastoarvo (8–21 %), aterianjälkeinen glukagonivaste (14–15 %) ja 24 tunnin glukagonipitoisuuden keskiarvo (12 %).
Glukoosista riippuvainen insuliinin ja glukagonin eritys
Semaglutidi pienensi veren korkeita glukoosipitoisuuksia glukoosista riippuvaisesti stimuloimalla insuliinin eritystä ja vähentämällä glukagonin eritystä. Semaglutidihoidon aikana tyypin 2 diabetespotilaiden insuliinin erittymisnopeus oli verrattavissa terveisiin koehenkilöihin.
Indusoidun hypoglykemian aikana semaglutidi ei muuttanut glukagonipitoisuuden nousun säätelyvasteita eikä vaikuttanut C-peptidiarvon pienenemiseen tyypin 2 diabetespotilailla lumelääkkeeseen verrattuna.
Mahan tyhjeneminen
Semaglutidi hidasti aterianjälkeistä varhaisvaiheen mahan tyhjenemistä hieman ja hidasti siten myös glukoosin siirtymistä verenkiertoon aterian jälkeen.
Ruokahalu, energiansaanti ja ruokamieltymykset
Lumelääkkeeseen verrattuna semaglutidi pienensi kolmesta peräkkäisestä ad libitum -ateriasta saadun energian määrää 18–35 %. Tätä tukivat myös semaglutidin ruokahalua hillitsevä vaikutus sekä paastotilassa että aterian jälkeen, parantunut syömisen hallinta, mielitekojen vähentyminen ja koehenkilöiden suhteellisesti vähentynyt mieltymys runsaasti rasvaa sisältäviin ruokiin.
Paasto- ja aterianjälkeiset lipidit
Lumelääkkeeseen verrattuna semaglutidi pienensi triglyseridien paastoarvoja 12 % ja VLDL-kolesterolin paastoarvoja 21 %. Aterian jälkeinen triglyseridi- ja VLDL-kolesterolivaste runsaasti rasvaa sisältävään ateriaan pieneni > 40 %.
Sydämen elektrofysiologia (QTc)
Semaglutidin vaikutusta sydämen repolarisaatioon testattiin perusteellisessa QTc-tutkimuksessa. Semaglutidi ei pidentänyt QTc-välejä annostasoilla, jotka olivat enintään 1,5 mg vakaassa tilassa.
Kliininen teho ja turvallisuus
Glukoositasapainon parantaminen, sydän- ja verisuonitauteihin liittyvän sairastuvuuden ja kuolleisuuden vähentäminen, painon lasku ja kroonisen munuaissairauden etenemisen riskin pienentäminen kuuluvat olennaisina osina tyypin 2 diabeteksen hoitoon.
Kerran viikossa annettujen 0,5 mg:n ja 1 mg:n semaglutidiannosten tehoa ja turvallisuutta arvioitiin kuudessa satunnaistetussa, kontrolloidussa faasin 3a tutkimuksessa, joihin osallistui 7 215 tyypin 2 diabetesta sairastavaa potilasta (joista 4 107 sai semaglutidihoitoa). Glykeemisen tehon arviointi oli ensisijainen tavoite viidessä tutkimuksessa (SUSTAIN 1–5) ja sydän- ja verisuonivaikutukset yhdessä tutkimuksessa (SUSTAIN 6).
Kerran viikossa annetun 2 mg:n semaglutidin tehoa ja turvallisuutta arvioitiin faasin 3b tutkimuksessa (SUSTAIN FORTE), jossa oli mukana 961 potilasta.
Lisäksi faasin 3b tutkimuksessa (SUSTAIN 7), jossa oli mukana 1 201 potilasta, kerran viikossa annettavien semaglutidi 0,5 mg ja 1 mg -valmisteiden tehoa ja turvallisuutta verrattiin kerran viikossa annettaviin dulaglutidi 0,75 mg ja 1,5 mg -valmisteisiin. Toisessa faasin 3b tutkimuksessa (SUSTAIN 9) arvioitiin SGLT2:n estäjähoidon lisänä annetun semaglutidin tehoa ja turvallisuutta.
Lumelääkkeeseen ja vaikuttavaan vertailuvalmisteeseen (sitagliptiini, glargininsuliini, hitaasti vapautuva eksenatidi ja dulaglutidi) verrattuna semaglutidihoidon todettiin pienentävän HbA1c-arvoa ja painoa pitkäkestoisesti, tilastollisesti paremmin ja kliinisesti merkittävässä määrin jopa 2 vuoden ajan.
Ikä, sukupuoli, rotu, etninen tausta, lähtötason painoindeksi (BMI), lähtötason paino (kg), diabeteksen kesto ja munuaisten vajaatoiminnan vaikeusaste eivät vaikuttaneet semaglutidin tehoon.
Tulokset koskevat kaikkien satunnaistettujen tutkittavien hoitojaksoaikaa (analyysit perustuvat toistomittausten tai moni-imputaatioiden sekamalleihin).
Lisäksi tehtiin faasin 3b tutkimus (SUSTAIN 11), jossa tutkittiin semaglutidin vaikutusta aspartinsuliiniin verrattuna sekä metformiinin että optimoidun glargininsuliinin (U100) lisänä.
Munuaisiin liittyviä hoitotuloksia koskeneessa faasin 3b tutkimuksessa (FLOW), jossa oli mukana 3 533 potilasta, verrattiin semaglutidin (1 mg kerran viikossa) ja lumelääkkeen vaikutuksia munuaisten vajaatoiminnan etenemiseen potilailla, joilla oli tyypin 2 diabetes ja krooninen munuaissairaus.
Toimintakykyä koskeneessa faasin 3b tutkimuksessa (STRIDE), jossa oli mukana 792 potilasta, verrattiin semaglutidin (1 mg kerran viikossa) ja lumelääkkeen vaikutuksia potilailla, joilla oli tyypin 2 diabetes ja ääreisvaltimosairaus.
Lisätietoa on jäljempänä.
SUSTAIN 1 – monoterapia
30 viikkoa kestäneessä, kaksoissokkoutetussa, lumelääkekontrolloidussa tutkimuksessa 388 potilasta, joiden hoitotasapaino oli riittämätön ruokavaliolla ja liikunnalla, satunnaistettiin saamaan kerran viikossa semaglutidi 0,5 mg:aa tai 1 mg:aa tai lumelääkettä.
Taulukko 2 SUSTAIN 1: Viikon 30 tulokset
| Semaglutidi 0,5 mg | Semaglutidi 1 mg | Lumelääke | |
| Hoitoaikeen mukainen (ITT) populaatio (N) | 128 | 130 | 129 |
| HbA1c (%) | |||
| Lähtötaso (keskiarvo) | 8,1 | 8,1 | 8,0 |
| Muutos lähtötasosta viikolla 30 | -1,5 | -1,6 | 0 |
| Ero lumelääkkeeseen nähden [95 %:n luottamusväli] | -1,4 [-1,7, -1,1]a | -1,5 [-1,8, -1,2]a | - |
| Potilaat (%), jotka saavuttivat HbA1c-arvon < 7 % | 74 | 72 | 25 |
| Paastoglukoosi (mmol/l) | |||
| Lähtötaso (keskiarvo) | 9,7 | 9,9 | 9,7 |
| Muutos lähtötasosta viikolla 30 | -2,5 | -2,3 | -0,6 |
| Paino (kg) | |||
| Lähtötaso (keskiarvo) | 89,8 | 96,9 | 89,1 |
| Muutos lähtötasosta viikolla 30 | -3,7 | -4,5 | -1,0 |
| Ero lumelääkkeeseen nähden [95 %:n luottamusväli] | -2,7 [-3,9, -1,6]a | -3,6 [-4,7, -2,4]a | - |
aparemmuus: p < 0,0001 (kaksisuuntainen)
SUSTAIN 2 – Semaglutidi vs. sitagliptiini, molemmat yhdistelmähoitona 1–2 suun kautta otettavan diabeteslääkkeen (metformiinin ja/tai tiatsolidiinidionien) kanssa
56 viikkoa kestäneessä, aktiivikontrolloidussa, kaksoissokkoutetussa tutkimuksessa 1 231 potilasta satunnaistettiin saamaan semaglutidi 0,5 mg:aa kerran viikossa, semaglutidi 1 mg:aa kerran viikossa tai sitagliptiinia 100 mg kerran päivässä. Kaikkia näitä käytettiin yhdessä metformiinin (94 %) ja/tai tiatsolidiinidionien (6 %) kanssa.
Taulukko 3 SUSTAIN 2: Viikon 56 tulokset
| Semaglutidi 0,5 mg | Semaglutidi 1 mg | Sitagliptiini 100 mg | |
| Hoitoaikeen mukainen (ITT) populaatio (N) | 409 | 409 | 407 |
| HbA1c (%) | |||
| Lähtötaso (keskiarvo) | 8,0 | 8,0 | 8,2 |
| Muutos lähtötasosta viikolla 56 | -1,3 | -1,6 | -0,5 |
| Ero sitagliptiiniin nähden [95 %:n luottamusväli] | -0,8 [-0,9, -0,6]a | -1,1 [-1,2, -0,9]a | - |
| Potilaat (%), jotka saavuttivat HbA1c-arvon < 7 % | 69 | 78 | 36 |
| Paastoglukoosi (mmol/l) | |||
| Lähtötaso (keskiarvo) | 9,3 | 9,3 | 9,6 |
| Muutos lähtötasosta viikolla 56 | -2,1 | -2,6 | -1,1 |
| Paino (kg) | |||
| Lähtötaso (keskiarvo) | 89,9 | 89,2 | 89,3 |
| Muutos lähtötasosta viikolla 56 | -4,3 | -6,1 | -1,9 |
| Ero sitagliptiiniin nähden [95 %:n luottamusväli] | -2,3 [-3,1, -1,6]a | -4,2 [-4,9, -3,5]a | - |
aparemmuus: p < 0,0001 (kaksisuuntainen)
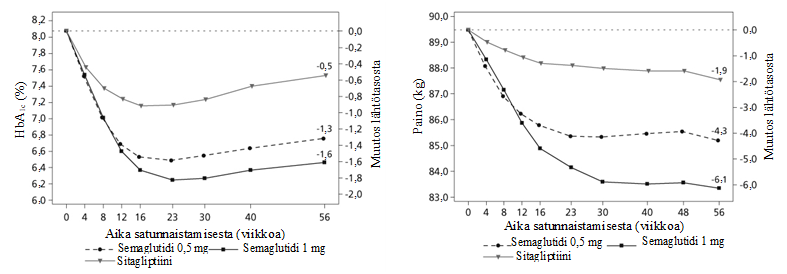
Kuva 1 Keskimääräinen muutos HbA1c-arvossa (%) ja painossa (kg) lähtötilanteen ja viikon 56 välisenä aikana
SUSTAIN 7 – Semaglutidi vs. dulaglutidi, molemmat yhdistelmähoitona metformiinin kanssa
40 viikkoa kestäneessä avoimessa tutkimuksessa 1 201 metformiinia saavaa potilasta satunnaistettiin 1:1:1:1 saamaan semaglutidia 0,5 mg, dulaglutidia 0,75 mg, semaglutidia 1 mg tai dulaglutidia 1,5 mg kerran viikossa. Tutkimuksessa verrattiin semaglutidin 0,5 mg:n annosta dulaglutidin 0,75 mg:n annokseen ja semaglutidin 1 mg:n annosta dulaglutidin 1,5 mg:n annokseen.
Ruoansulatuselimistön häiriöt olivat yleisimmät haittatapahtumat ja niitä esiintyi samassa suhteessa potilailla, jotka saivat semaglutidia 0,5 mg (129 potilasta [43 %]), semaglutidia 1 mg (133 [44 %]), ja dulaglutidia 1,5 mg (143 [48 %]); ruoansulatuselimistön häiriöitä esiintyi harvemmin potilailla, jotka saivat dulaglutidia 0,75 mg (100 [33 %]).
Viikolla 40 syketiheyden nousu semaglutidilla (0,5 mg ja 1 mg) ja dulaglutidilla (0,75 mg ja 1,5 mg) oli 2,4 ja 4,0, ja 1,6 ja 2,1 lyöntiä/minuutti.
Taulukko 4 SUSTAIN 7: Viikon 40 tulokset
| Semaglutidi 0,5 mg | Semaglutidi 1 mg | Dulaglutidi 0,75 mg | Dulaglutidi 1,5 mg | |
| Hoitoaikeen mukainen (ITT) populaatio (N) | 301 | 300 | 299 | 299 |
| HbA1c (%) | ||||
| Lähtötaso (keskiarvo) | 8,3 | 8,2 | 8.2 | 8.2 |
| Muutos lähtötasosta viikolla 40 | -1,5 | -1,8 | -1.1 | -1.4 |
| Ero dulaglutidiin nähden [95 %:n luottamusväli] | -0,4b [-0,6, -0,2]a | -0,4c [-0,6, -0,3]a | - | - |
| Potilaat (%), jotka saavuttivat HbA1c-arvon < 7 % | 68 | 79 | 52 | 67 |
| Paastoglukoosi (mmol/l) | ||||
| Lähtötaso (keskiarvo) | 9,8 | 9,8 | 9,7 | 9,6 |
| Muutos lähtötasosta viikolla 40 | -2,2 | -2,8 | -1,9 | -2,2 |
| Paino (kg) | ||||
| Lähtötaso (keskiarvo) | 96,4 | 95,5 | 95,6 | 93,4 |
| Muutos lähtötasosta viikolla 40 | -4,6 | -6,5 | -2,3 | -3,0 |
| Ero dulaglutidiin nähden [95 %:n luottamusväli] | -2,3b [-3,0, -1,5]a | -3,6c [-4,3, -2,8]a | - | - |
a paremmuus: p < 0,0001 (kaksisuuntainen)
b semaglutidi 0,5 mg vs. dulaglutidi 0,75 mg
c semaglutidi 1 mg vs. dulaglutidi 1,5 mg
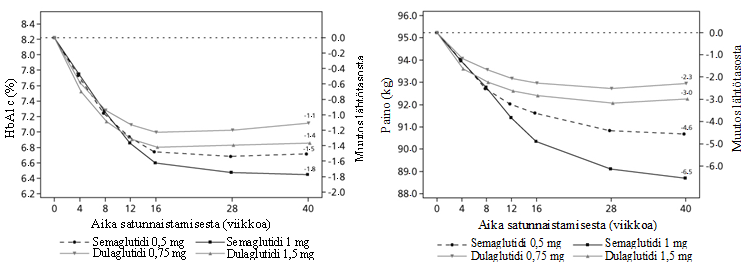
Kuva 2 Keskimääräinen muutos HbA1c-arvossa (%) ja painossa (kg) lähtötilanteen ja viikon 40 välisenä aikana
SUSTAIN 3 – Semaglutidi vs. hitaasti vapautuva eksenatidi, molemmat yhdistelmähoitona metformiinin tai metformiinin ja sulfonyyliurean kanssa
56 viikkoa kestäneessä avoimessa tutkimuksessa 813 potilasta, jotka saivat pelkkää metformiinia (49 %), metformiinia ja sulfonyyliureaa (45 %) tai muuta hoitoa (6 %) satunnaistettiin saamaan 1 mg semaglutidia tai 2 mg hitaasti vapautuvaa eksenatidia kerran viikossa.
Taulukko 5 SUSTAIN 3: Viikon 56 tulokset
| Semaglutidi 1 mg | Hitaasti vapautuva eksenatidi 2 mg | |
| Hoitoaikeen mukainen (ITT) populaatio (N) | 404 | 405 |
| HbA1c (%) | ||
| Lähtötaso (keskiarvo) | 8,4 | 8,3 |
| Muutos lähtötasosta viikolla 56 | -1,5 | -0,9 |
| Ero eksenatidiin nähden [95 %:n luottamusväli] | -0,6 [-0,8, -0,4]a | - |
| Potilaat (%), jotka saavuttivat HbA1c-arvon < 7 % | 67 | 40 |
| Paastoglukoosi (mmol/l) | ||
| Lähtötaso (keskiarvo) | 10,6 | 10,4 |
| Muutos lähtötasosta viikolla 56 | -2,8 | -2,0 |
| Paino (kg) | ||
| Lähtötaso (keskiarvo) | 96,2 | 95,4 |
| Muutos lähtötasosta viikolla 56 | -5,6 | -1,9 |
| Ero eksenatidiin nähden [95 %:n luottamusväli] | -3,8 [-4,6, -3,0]a | - |
aparemmuus: p < 0,0001 (kaksisuuntainen)
SUSTAIN 4 – Semaglutidi vs. glargininsuliini, molemmat yhdistelmähoitona 1–2 suun kautta otettavan diabeteslääkkeen (metformiini tai metformiini ja sulfonyyliurea) kanssa
30 viikkoa kestäneessä avoimessa vertailututkimuksessa 1 089 potilasta satunnaistettiin saamaan semaglutidia 0,5 mg kerran viikossa, semaglutidia 1 mg kerran viikossa tai glargininsuliinia kerran päivässä. Potilaiden taustahoitona oli metformiini (48 %) tai metformiini ja sulfonyyliurea (51 %).
Taulukko 6 SUSTAIN 4: Viikon 30 tulokset
| Semaglutidi 0,5 mg | Semaglutidi 1 mg | Glargininsuliini | |
| Hoitoaikeen mukainen (ITT) populaatio (N) | 362 | 360 | 360 |
| HbA1c (%) | |||
| Lähtötaso (keskiarvo) | 8,1 | 8,2 | 8,1 |
| Muutos lähtötasosta viikolla 30 | -1,2 | -1,6 | -0,8 |
| Ero glargininsuliiniin nähden [95 %:n luottamusväli] | -0,4 [-0,5, -0,2]a | -0,8 [-1,0, -0,7]a | - |
| Potilaat (%), jotka saavuttivat HbA1c-arvon < 7 % | 57 | 73 | 38 |
| Paastoglukoosi (mmol/l) | |||
| Lähtötaso (keskiarvo) | 9,6 | 9,9 | 9,7 |
| Muutos lähtötasosta viikolla 30 | -2,0 | -2,7 | -2,1 |
| Paino (kg) | |||
| Lähtötaso (keskiarvo) | 93,7 | 94,0 | 92,6 |
| Muutos lähtötasosta viikolla 30 | -3,5 | -5,2 | +1,2 |
| Ero glargininsuliiniin nähden [95 %:n luottamusväli] | -4,6 [-5,3, -4,0]a | -6,34 [-7,0, -5,7]a | - |
aparemmuus: p < 0,0001 (kaksisuuntainen)
SUSTAIN 5 – Semaglutidi vs. lumelääke, molemmat yhdistelmähoitona perusinsuliinin kanssa
30 viikkoa kestäneessä, kaksoissokkoutetussa, lumelääkekontrolloidussa tutkimuksessa 397 potilasta, joiden hoitotasapaino oli riittämätön perusinsuliinilla joko yksin tai metformiiniin yhdistettynä, satunnaistettiin saamaan kerran viikossa 0,5 mg tai 1 mg semaglutidia tai lumelääkettä.
Taulukko 7 SUSTAIN 5: Viikon 30 tulokset
| Semaglutidi 0,5 mg | Semaglutidi 1 mg | Lumelääke | |
| Hoitoaikeen mukainen (ITT) populaatio (N) | 132 | 131 | 133 |
| HbA1c (%) | |||
| Lähtötaso (keskiarvo) | 8,4 | 8,3 | 8,4 |
| Muutos lähtötasosta viikolla 30 | -1,4 | -1,8 | -0,1 |
| Ero lumelääkkeeseen nähden [95 %:n luottamusväli] | -1,4 [-1,6, -1,1]a | -1,8 [-2,0, -1,5]a | - |
| Potilaat (%), jotka saavuttivat HbA1c-arvon < 7 % | 61 | 79 | 11 |
| Paastoglukoosi (mmol/l) | |||
| Lähtötaso (keskiarvo) | 8,9 | 8,5 | 8,6 |
| Muutos lähtötasosta viikolla 30 | -1,6 | -2,4 | -0,5 |
| Paino (kg) | |||
| Lähtötaso (keskiarvo) | 92,7 | 92,5 | 89,9 |
| Muutos lähtötasosta viikolla 30 | -3,7 | -6,4 | -1,4 |
| Ero lumelääkkeeseen nähden [95 %:n luottamusväli] | -2,3 [-3,3, -1,3]a | -5,1 [-6,1, -4,0]a | - |
aparemmuus: p < 0,0001 (kaksisuuntainen)
SUSTAIN FORTE – Semaglutidi 2 mg vs. semaglutidi 1 mg
40 viikon pituisessa kaksoissokkoutetussa tutkimuksessa 961 potilasta, joiden sairaus oli riittämättömästi hallinnassa metformiinilla yhdessä sulfonyyliurean kanssa tai ilman sitä, satunnaistettiin saamaan semaglutidi 2 mg:aa kerran viikossa tai semaglutidi 1 mg:aa kerran viikossa.
Semaglutidi 2 mg -hoito sai aikaan tilastollisesti paremman HbA1c -arvon pienentymisen 40 hoitoviikon jälkeen semaglutidi 1 mg -annostukseen verrattuna.
Taulukko 8 SUSTAIN FORTE: Tulokset viikolla 40
Semaglutidi 1 mg | Semaglutidi 2 mg | |
| Hoitoaikeen mukainen (ITT) populaatio (N) | 481 | 480 |
| HbA1c (%) | ||
| Lähtötaso (keskiarvo) | 8,8 | 8,9 |
| Muutos lähtötasosta viikolla 40 | -1,9 | -2,2 |
| Ero semaglutidi 1 mg:aan nähden [95 %:n luottamusväli] | - | -0,2 [-0,4; -0,1]a |
| Potilaat (%), jotka saavuttivat HbA1c -arvon < 7 % | 58 | 68 |
| Paastoglukoosi (mmol/l) | ||
| Lähtötaso (keskiarvo) | 10,9 | 10,7 |
| Muutos lähtötasosta viikolla 40 | -3,1 | -3,4 |
| Paino (kg) | ||
| Lähtötaso (keskiarvo) | 98,6 | 100,1 |
| Muutos lähtötasosta viikolla 40 | -6,0 | -6,9 |
| Ero semaglutidi 1 mg:aan nähden [95 %:n luottamusväli] | -0,9 [-1,7; -0,2]b |
aparemmuus: p < 0,001 (kaksisuuntainen)
bparemmuus: p < 0,05 (kaksisuuntainen)
SUSTAIN 9 – Semaglutidi vs. lumelääke SGLT2:n estäjän ± metformiinin tai sulfonyyliurean lisänä
30 viikkoa kestäneessä kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa 302 potilasta, joiden hoitotasapaino oli riittämätön SGLT2:n estäjällä joko yksin tai metformiiniin tai sulfonyyliureaan yhdistettynä, satunnaistettiin saamaan semaglutidi 1 mg:aa kerran viikossa tai lumelääkettä.
Taulukko 9 SUSTAIN 9: Tulokset viikolla 30
| Semaglutidi 1 mg | Lumelääke | |
| Hoitoaikeen mukainen (ITT) populaatio (N) | 151 | 151 |
| HbA1c (%) | ||
| Lähtötaso (keskiarvo) | 8,0 | 8,1 |
| Muutos lähtötasosta viikolla 30 | -1,5 | -0,1 |
| Ero lumelääkkeeseen nähden [95 %:n luottamusväli] | -1,4 [-1,6, -1,2]a | - |
| Potilaat (%), jotka saavuttivat HbA1c-arvon < 7 % | 78,7 | 18,7 |
| Paastoglukoosi (mmol/l) | ||
| Lähtötaso (keskiarvo) | 9,1 | 8,9 |
| Muutos lähtötasosta viikolla 30 | -2,2 | 0,0 |
| Paino (kg) | ||
| Lähtötaso (keskiarvo) | 89,6 | 93,8 |
| Muutos lähtötasosta viikolla 30 | -4,7 | -0,9 |
| Ero lumelääkkeeseen nähden [95 %:n luottamusväli] | -3,8 [-4,7, -2,9]a | - |
aparemmuus: p < 0,0001 (kaksisuuntainen), korjattu kerrannaisuuden suhteen HbA1c-arvon ja painon hierarkkisen testauksen perusteella
SUSTAIN-11 – Semaglutidi vs. aspartinsuliini glargininsuliinin + metformiinin lisänä
52 viikkoa kestäneessä avoimessa tutkimuksessa 1 748 tutkittavaa, joiden tyypin 2 diabeteksen hoitotasapaino oli riittämätön 12 viikon pituisen alkuseurantajakson aikana glargininsuliinilla ja metformiinilla, satunnaistettiin 1:1 saamaan joko semaglutidia kerran viikossa (0,5 mg tai 1,0 mg) tai aspartinsuliinia kolme kertaa vuorokaudessa. Tutkimukseen osallistuneella populaatiolla oli ollut diabetes keskimäärin 13,4 vuotta ja HbA1c-keskiarvo oli 8,6 % ja HbA1c-tavoite 6,5–7,5 %.
Hoito semaglutidilla johti HbA1c-arvon pienentymiseen viikolla 52 (-1,5 % semaglutidilla vs. -1,2 % aspartinsuliinilla).
Vakavien hypoglykemiatapausten määrä molemmissa hoitoryhmissä oli pieni (4 tapausta semaglutidilla ja 7 tapausta aspartinsuliinilla).
Lähtötason keskimääräinen paino aleni semaglutidilla (-4,1 kg) ja nousi aspartinsuliinilla (+2,8 kg) ja arvioitu ero hoidoissa oli -6,99 kg (95 %:n luottamusväli -7,41 – -6,57) viikolla 52.
Yhdistelmähoito pelkän sulfonyyliurean kanssa
SUSTAIN 6 -tutkimuksessa (ks. alakohta "Sydän- ja verisuonitaudit") 123 potilasta sai lähtötilanteessa pelkkää sulfonyyliureaa. HbA1c oli lähtötilanteessa 8,2 % semaglutidin 0,5 mg:n annosta saaneilla, 8,4 % semaglutidin 1 mg:n annosta saaneilla ja 8,4 % lumelääkettä saaneilla potilailla. Viikolla 30 HbA1c-arvon muutos oli -1,6 % semaglutidin 0,5 mg:n annosta saaneilla, -1,5 % semaglutidin 1 mg:n annosta saaneilla ja 0,1 % lumelääkettä saaneilla potilailla.
Yhdistelmähoito sekoiteinsuliinin (± 1–2 suun kautta otettavan diabeteslääkkeen) kanssa
SUSTAIN 6 -tutkimuksessa (ks. alakohta "Sydän- ja verisuonitaudit") 867 potilasta sai lähtötilanteessa sekoiteinsuliinia (yksin tai yhdessä suun kautta otettavan/ien diabeteslääkkeen/iden kanssa). HbA1c oli lähtötilanteessa 8,8 % semaglutidin 0,5 mg:n annosta saaneilla, 8,9 % semaglutidin 1 mg:n annosta saaneilla ja 8,9 % lumelääkettä saaneilla potilailla. Viikolla 30 HbA1c-arvon muutos oli -1,3 % semaglutidin 0,5 mg:n annosta saaneilla, -1,8 % semaglutidin 1 mg:n annosta saaneilla ja -0,4 % lumelääkettä saaneilla potilailla.
Sydän- ja verisuonitaudit
104 viikkoa kestäneessä kaksoissokkoutetussa tutkimuksessa (SUSTAIN 6) 3 297 tyypin 2 diabetespotilasta, joilla oli suuri sydän- ja verisuonitapahtumien riski, satunnaistettiin saamaan joko semaglutidi 0,5 mg:aa tai 1 mg:aa kerran viikossa tai vastaavaa lumelääkettä perushoidon lisänä, minkä jälkeen heidän tilaansa seurattiin 2 vuoden ajan. Yhteensä 98 % potilaista suoritti tutkimuksen loppuun, ja 99,6 %:n vitaalitila oli tiedossa tutkimuksen päättyessä.
Tutkimuspopulaation ikäjakauma oli seuraava: 1 598 potilasta (48,5 %) oli ≥ 65-vuotiaita, 321 (9,7 %) ≥ 75-vuotiaita ja 20 (0,6 %) ≥ 85-vuotiaita. Potilaista 2 358:lla oli normaali munuaistoiminta tai lievä munuaisten vajaatoiminta, 832:lla keskivaikea munuaisten vajaatoiminta ja 107:lla vaikea tai loppuvaiheen munuaisten vajaatoiminta. Potilaista 61 % oli miehiä. Potilaiden keski-ikä oli 65 vuotta ja keskimääräinen BMI oli 33 kg/m2. Keskimääräinen diabeteksen kesto oli 13,9 vuotta.
Ensisijainen päätetapahtuma oli aika satunnaistamisesta ensimmäiseen vakavaan sydän- ja verisuonihaittatapahtumaan (major adverse cardiovascular event, MACE): sydän- ja verisuonikuolemaan, ei-fataaliin sydäninfarktiin tai ei-fataaliin aivohaveriin.
Ensisijaisten yhdistettyjen MACE-päätetapahtumien kokonaismäärä oli 254, joista 108 (6,6 %) semaglutidia saaneilla ja 146 (8,9 %) lumelääkettä saaneilla potilailla. Tulokset ensisijaisista ja toissijaisista sydän- ja verisuonipäätetapahtumista on esitetty kuvassa 4. Semaglutidihoito pienensi 26 %:lla ensisijaisen yhdistetyn päätetapahtuman eli sydän- ja verisuonikuoleman, ei-fataalin sydäninfarktin tai ei-fataalin aivohaverin riskiä. Sydän- ja verisuonikuolemia ilmeni yhteensä 90, ei-fataaleja sydäninfarkteja 111 ja ei-fataaleja aivohavereita 71. Vastaavasti 44 (2,7 %), 47 (2,9 %) ja 27 (1,6 %) näistä ilmeni potilailla, jotka saivat semaglutidihoitoa (kuva 4). Ensisijaisen yhdistetyn päätetapahtuman riskin pieneneminen johtui pääasiassa ei-fataalien aivohavereiden (39 %) ja ei-fataalien sydäninfarktien (26 %) vähenemisestä (kuva 3).
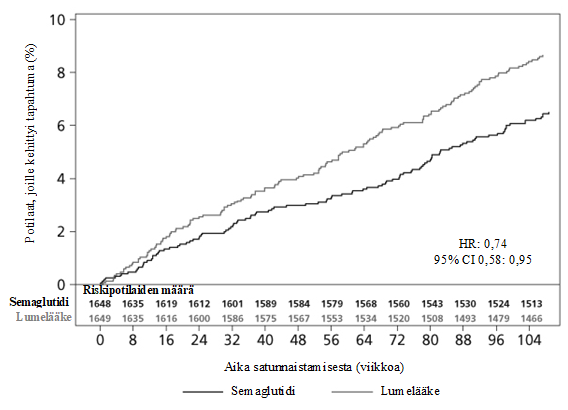
Kuva 3 Kaplan-Meier-kuvaaja: aika ensimmäiseen yhdistettyyn päätetapahtumaan: sydän- ja verisuonikuolema, ei-fataali sydäninfarkti tai ei-fataali aivohaveri (SUSTAIN 6)
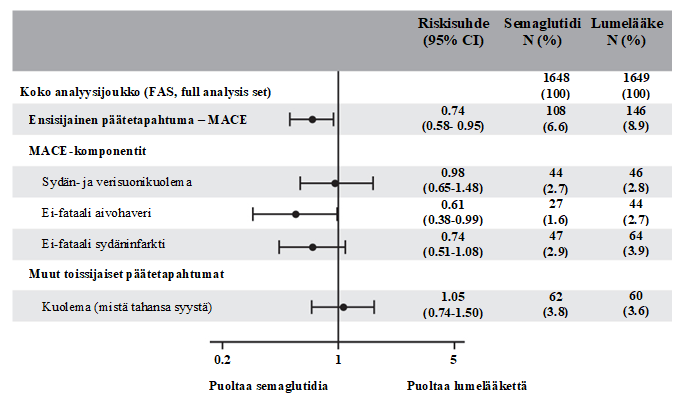
Kuva 4 Forest plot -analyysi: aika ensimmäiseen yhdistettyyn päätetapahtumaan, sen komponentit ja kuolema (mistä tahansa syystä) (SUSTAIN 6)
Nefropatian kehittymis- tai pahenemistapahtumia oli 158. Nefropatian kehittymiseen (pysyvän makroalbuminurian kehittyminen, seerumin kreatiniiniarvon pysyvä kaksinkertaistuminen, jatkuvan munuaiskorvaushoidon tarve ja munuaissairaudesta johtuva kuolema) kuluneen ajan riskisuhde [95 %:n luottamusväli] oli 0,64 [0,46; 0,88], ja pysyvän makroalbuminurian kehittyminen oli näistä yleisin.
52 viikkoa kestäneessä kaksoissokkoutetussa tutkimuksessa (STRIDE, NCT04560998) 792 potilasta, joilla oli tyypin 2 diabetes ja ääreisvaltimosairaus, johon liittyi katkokävelyä (Fontainen luokka IIa), satunnaistettiin saamaan perushoidon lisänä joko semaglutidia 1 mg kerran viikossa tai lumelääkettä. Ensisijainen päätetapahtuma oli pisimmän kävelymatkan muutos lähtötilanteesta viikkoon 52 kävelymattotestissä tasaisella kuormituksella. Vahvistavia toissijaisia päätetapahtumia olivat verisuonistoon liittyvää elämänlaatua koskevan kyselyn (Vascular Quality of Life Questionnaire‑6, VascuQoL‑6) pistemäärän muutos lähtötilanteesta viikkoon 52 sekä kivuttoman kävelymatkan muutos lähtötilanteesta viikkoon 52. VascuQoL‑6 on kyselylomake, jonka osa-alueita ovat kipu, sosiaaliset vaikutukset ja vaikutukset henkiseen hyvinvointiin sekä toimintarajoitteet. Kysely pisteytetään asteikolla 6–24, ja suuremmat pistemäärät viittaavat parempaan terveydentilaan. Keskimääräinen ikä tutkimuspopulaatiossa oli 67 vuotta, ja 75,4 % potilaista oli miehiä. Keskimääräinen painoindeksi (BMI) oli 29,6 kg/m2, ja keskimääräinen diabeteksen kesto oli 13,3 vuotta.
STRIDE-tutkimuksessa semaglutidihoito (1 mg kerran viikossa) paransi lumelääkkeeseen verrattuna tilastollisesti merkitsevästi toimintakykyä koskevia tuloksia (pisin kävelymatka ja kivuton kävelymatka) sekä potilaiden ilmoittamia oireita ja vaikutuksia katkokävelyyn (VascuQol‑6-kokonaispistemäärä) viikon 52 kohdalla. 13 % parempi tulos suhteessa lumelääkkeeseen kuvastaa sitä, että kävelymattotestissä tasaisella kuormituksella todetun pisimmän kävelymatkan muutoksen mediaani oli 26 metriä (95 %:n luottamusväli 12–41) (taulukko 10).
Taulukko 10: STRIDE-tutkimuksen toimintakykyä koskevat tulokset ja VascuQoL‑6-kokonaispistemäärät
| Hoitoaikeen mukainen (ITT) populaatioa | Ozempic N = 396 | Lumelääke N = 396 |
| Pisin kävelymatka (metreinä) | ||
| Viikko 52 | ||
| Lähtötasonb mediaani | 184,50 | 185,75 |
| Suhde lähtötason mediaaniin | 1,21 | 1,08 |
| Hoitojen välinen suhde (HL‑estimaatti) [95 %:n luottamusväli]c | 1,13 [1,056, 1,211]* | |
| Potilaat (%), joilla ilmeni merkityksellinen potilaskohtainen muutosd | 49,1 | 35,1 |
| Kivuton kävelymatka (metreinä), viikko 52 | ||
| Lähtötasonb mediaani | 119,00 | 109,00 |
| Suhde lähtötason mediaaniin | 1,21 | 1,10 |
| Hoitojen välinen suhde (HL-estimaatti) [95 %:n luottamusväli]c | 1,11 [1,033, 1,197]* | |
| VascuQol‑6-kokonaispistemäärä, viikko 52 | ||
| Lähtötason mediaani | 15,0 | 15,0 |
| Muutos lähtötason mediaanista | 2,0 | 1,0 |
| Hoitojen välinen ero (HL-estimaatti) [95 %:n luottamusväli]c | 1,00 [0,478, 1,518]* | |
HL = Hodges–Lehmann-estimaatti sijainnin siirrosta (semaglutidin ja lumelääkkeen välisten kaikkien parittaisten erojen mediaani).
a Hoitoaikeen mukainen populaatio käsittää kaikki satunnaistetut potilaat. Viikon 52 kohdalla puuttuvat tiedot, kun niiden puuttuminen johtui kuolemasta tai fyysisestä kyvyttömyydestä suorittaa kävelymattotestejä, käsiteltiin käyttäen yhdistettyä strategiaa. Muista syistä puuttuvat tiedot lähtötilanteen jälkeisiltä vastaanottokäynneiltä imputoitiin käyttäen moni-imputointia ryhmien sisällä. Ryhmien muodostaminen perustui siihen, kumpaan hoitoon tutkittavat oli satunnaistettu, sekä siihen, olivatko tutkittavat jatkaneet osallistumistaan tutkimuksen loppuun asti viikon 52 kohdalla.
b Lähtötasona käytettiin lähtötilanteen (viikko 0) vastaanottokäynnillä mitattujen kävelymatkojen keskiarvoa.
c 95 %:n luottamusvälit arvioitiin Hodges–Lehmann-menetelmällä.
* p < 0,05 (kaksitahoinen) semaglutidin paremmuudelle verrattuna lumelääkkeeseen saatiin Wilcoxonin järjestyssummatestillä käyttäen monivertailukorjausta.
d Pisimmän kävelymatkan merkityksellinen potilaskohtainen muutos viikon 52 kohdalla määritellään siten, että kävelymatka viikon 52 kohdalla oli vähintään 1,2‑kertainen (20 % parempi) suhteessa lähtötason kävelymatkaan. Nämä estimaatit saatiin ankkurimenetelmällä (anchor-based analysis), joka perustui yhden luokan paranemiseen PGI‑S-asteikolla (tutkittavan yleisarvio vaikeusasteesta, Patient Global Impression of Severity). Binaarinen päätemuuttuja analysoitiin logistisella regressiomallilla, jossa kiinteänä tekijänä oli hoito, johon tutkittava oli satunnaistettu.
Munuaisiin liittyvät hoitotulokset
Munuaisiin liittyviä hoitotuloksia koskeneessa kaksoissokkoutetussa tutkimuksessa (FLOW) 3 533 potilasta, joilla oli tyypin 2 diabetes ja krooninen munuaissairaus (glomerulusten laskennallinen suodatusnopeus [eGFR] 50–75 ml/min/1,73 m2 ja albumiinin ja kreatiniinin suhde virtsassa > 300 ja < 5 000 mg/g tai eGFR 25 – < 50 ml/min/1,73 m2 ja albumiinin ja kreatiniinin suhde virtsassa > 100 ja < 5 000 mg/g), satunnaistettiin saamaan joko semaglutidia 1 mg kerran viikossa tai vastaavaa lumelääkettä perushoidon lisänä.
Tutkimus lopetettiin tehoon liittyneistä syistä odotettua aiemmin suunnitellun välianalyysin jälkeen, koska riippumaton seurantaryhmä suositteli sen lopettamista. Seuranta-ajan mediaani oli 40,9 kuukautta.
Keskimääräinen ikä tutkimuspopulaatiossa oli 66,6 vuotta, ja 69,7 % potilaista oli miehiä. Lähtötason keskimääräinen painoindeksi (BMI) oli 32,0 kg/m2. Keskimääräinen diabeteksen kesto lähtötilanteessa oli 17,4 vuotta, ja keskimääräinen HbA1c-arvo lähtötilanteessa oli 7,8 % (61,5 mmol/mol). Keskimääräinen eGFR lähtötilanteessa oli 47 ml/min/1,73 m2, ja albumiinin ja kreatiniinin suhteen mediaani oli 568 mg/g. Lähtötilanteessa noin 95 % potilaista sai reniini-angiotensiini-aldosteronijärjestelmän estäjiä ja 16 % sai SGLT2:n estäjiä.
Perushoidon lisänä annettu semaglutidi esti ensisijaista yhdistettyä päätetapahtumaa (eGFR-arvon pysyvä ≥ 50 %:n pieneneminen, eGFR-arvon pysyvä pieneneminen tasolle < 15 ml/min/1,73 m2, pitkäaikaisen munuaiskorvaushoidon aloittaminen, munuaisiin liittyvä kuolema tai sydän- ja verisuonikuolema) paremmin kuin lumelääke. Riskisuhde oli 0,76 [95 %:n luottamusväli 0,66; 0,88], mikä vastasi munuaissairauden etenemisen suhteellisen riskin 24 %:n vähenemää (ks. kuva 5). Ensisijaisen yhdistetyn päätetapahtuman yksittäiset komponentit vaikuttivat hoitovaikutukseen, mutta munuaisiin liittyviä kuolemia oli hyvin vähän (ks. kuva 6).
Semaglutidin osoitettiin perushoidon lisänä pienentävän eGFR-arvojen vuotuista muutosta lumelääkettä paremmin; arvioitu hoitojen välinen ero oli 1,16 ml/min/1,73 m2/vuosi [95 %:n luottamusväli 0,86; 1,47]. Semaglutidihoito paransi kokonaisvaltaisesti eloonjäämistä pienentämällä merkittävästi mistä tahansa syystä johtuvaa kuolleisuutta (ks. kuva 6).
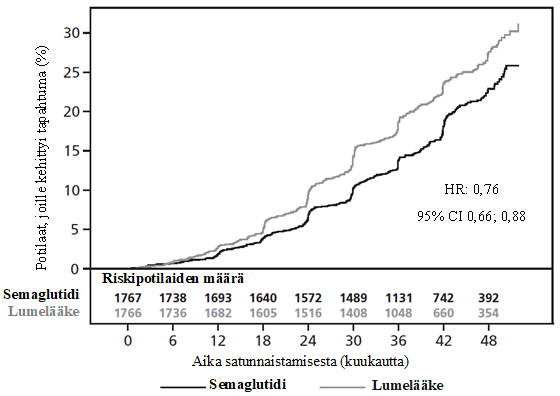
Kuva 5 Kumulatiivisen ilmaantuvuuden funktio: aika ensisijaisen yhdistetyn päätetapahtuman (eGFR-arvon pysyvä ≥ 50 %:n pieneneminen, eGFR-arvon pysyvä pieneneminen tasolle < 15 ml/min/1,73 m2, pitkäaikaisen munuaiskorvaushoidon aloittaminen, munuaisiin liittyvä kuolema tai sydän- ja verisuonikuolema [FLOW]) ensimmäiseen ilmaantumiseen
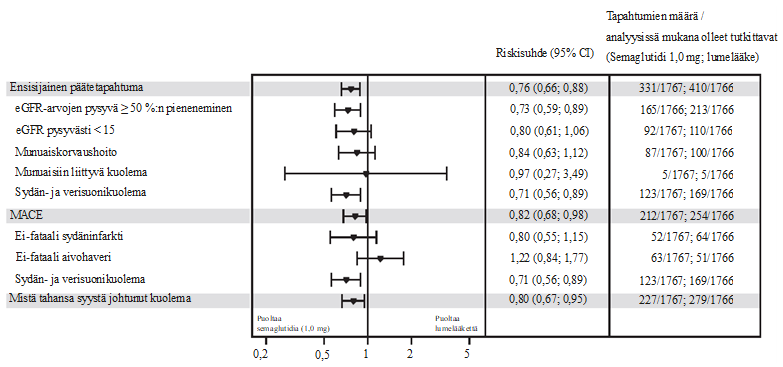
Kuva 6 Forest plot ‑analyysit: aika ensisijaisen yhdistetyn päätetapahtuman ja sen komponenttien ensimmäiseen ilmaantumiseen, MACE-tapahtuman ja sen komponenttien ensimmäiseen ilmaantumiseen sekä kuolemaan (mistä tahansa syystä johtuvaan) (FLOW)
Paino
Yhden vuoden hoidon jälkeen ≥ 5 %:n ja ≥ 10 %:n painon lasku oli saavutettu useammalla semaglutidi 0,5 mg:aa saaneella potilaalla (46 % ja 13 %) ja semaglutidi 1 mg:aa saaneella potilaalla (52–62 % ja 21–24 %) kuin potilailla, jotka olivat saaneet vaikuttavia vertailuvalmisteita eli sitagliptiinia (18 % ja 3 %) ja hitaasti vapautuvaa eksenatidia (17 % ja 4 %).
40 viikon tutkimuksessa dulaglutidiin verrattuna ≥ 5 %:n ja ≥ 10 %:n painonlaskun saavutti useampi (44 % ja 14 %) semaglutidi 0,5 mg:aa saaneista kuin 0,75 mg :n dulaglutidiannosta saaneista (23 % ja 3 %), ja semaglutidi 1 mg:aa saaneista (jopa 63 % ja 27 %) kuin 1,5 mg:n dulaglutidiannosta saaneista (30 % ja 8 %).
Perushoidon lisänä semaglutidi 0,5 mg:aa ja 1 mg:aa saaneilla potilailla todettiin SUSTAIN 6 -tutkimuksessa merkitsevä ja pysyvä painon lasku lähtötilanteesta viikolle 104 verrattuna potilaisiin, jotka saivat 0,5 mg ja 1 mg lumelääkettä (-3,6 kg ja -4,9 kg vs. -0,7 kg ja 0,5 kg).
Munuaisiin liittyviä hoitotuloksia koskeneessa FLOW-tutkimuksessa semaglutidihoitoa (1 mg) perushoidon lisänä saaneilla potilailla todettiin viikon 104 kohdalla pysyvä painon lasku (‑5,6 kg) verrattuna lumelääkettä saaneisiin potilaisiin (‑1,4 kg).
Verenpaine
Keskimääräisessä systolisessa verenpaineessa todettiin merkitsevää laskua, kun semaglutidia käytettiin annoksella 0,5 mg (3,5–5,1 mmHg) ja 1 mg (5,4–7,3 mmHg) yhdessä suun kautta otettavien diabeteslääkkeiden tai perusinsuliinin kanssa. Diastolisen verenpaineen suhteen semaglutidin ja vertailuvalmisteiden välillä ei todettu merkitseviä eroja. Havaittu systolisen verenpaineen lasku viikolla 40 oli -5,3 mmHg semaglutidi 2 mg:aa saaneilla ja -4,5 mmHg semaglutidi 1 mg:aa saaneilla.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset Ozempic-valmisteen käytöstä tyypin 2 diabeteksen hoidossa yhdessä tai useammassa pediatrisessa potilasryhmässä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Luonnolliseen GLP-1:een verrattuna semaglutidin puoliintumisaika on pitkä (noin 1 viikko), minkä vuoksi semaglutidi sopii annettavaksi ihon alle kerran viikossa. Pääasiallinen puoliintumisaikaa pidentävä mekanismi on sitoutuminen albumiiniin, mikä pienentää yhdisteen munuaispuhdistumaa ja suojaa sitä metaboliselta hajoamiselta. Semaglutidi on stabiloitu myös DPP-4-entsyymin hajotusvaikutukselta.
Imeytyminen
Huippupitoisuus saavutettiin 1–3 päivää annoksen ottamisesta. Vakaan tilan altistus saavutettiin 4–5 viikkoa jatkuneen, kerran viikossa tapahtuneen annostelun jälkeen. Kun semaglutidia annettiin 0,5 mg tai 1 mg ihon alle, tyypin 2 diabetespotilaiden keskimääräiset vakaan tilan pitoisuudet olivat noin 16 nmol/l ja vastaavasti 30 nmol/l. Tutkimuksessa, jossa verrattiin 1 mg:n semaglutidiannosta ja 2 mg:n semaglutidiannosta, keskimääräinen vakaan tilan pitoisuus oli 27 nmol/l 1 mg:n annoksella ja 54 nmol/l 2 mg:n annoksella. Käytettäessä annoksia 0,5 mg, 1 mg ja 2 mg, semaglutidille altistuminen lisääntyi suhteessa annokseen. Altistus oli samaa luokkaa riippumatta siitä, annettiinko semaglutidi vatsan, reiden vai olkavarren ihon alle. Semaglutidin absoluuttinen biologinen hyötyosuus ihonalaisen annon jälkeen oli 89 %.
Jakautuminen
Ihon alle annetun semaglutidin keskimääräinen jakautumistilavuus tyypin 2 diabetespotilailla oli noin 12,5 l. Semaglutidi sitoutui suuressa määrin plasman albumiiniin (> 99 %).
Biotransformaatio
Ennen elimistöstä poistumista semaglutidi metaboloituu suuressa määrin peptidirungon proteolyyttisen pilkkoutumisen ja rasvahapposivuketjun sekventiaalisen beetaoksidaation kautta. Neutraali endopeptidaasi (NEP-entsyymi) osallistuu ilmeisesti semaglutidin metaboliaan.
Eliminaatio
Ihon alle annetulla radiomerkityllä semaglutidin kerta-annoksella tehdyssä tutkimuksessa havaittiin, että semaglutidiin liittyvät metaboliitit erittyvät pääasiassa virtsaan ja ulosteeseen, noin 2/3 virtsaan ja noin 1/3 ulosteeseen. Noin 3 % annoksesta erittyi virtsaan muuttumattomassa muodossa olevana semaglutidina. Tyypin 2 diabetespotilailla semaglutidin puhdistuma oli noin 0,05 l/h. Semaglutidin eliminaation puoliintumisaika on noin 1 viikko, joten sitä on verenkierrossa noin 5 viikon ajan viimeisestä annoksesta.
Erityisryhmät
Iäkkäät
Faasin 3a tutkimukset, joihin osallistui 20–86-vuotiaita potilaita, osoittivat, että ikä ei vaikuta semaglutidin farmakokinetiikkaan.
Sukupuoli, rotu ja etninen tausta
Sukupuoli, rotu (valkoihoinen, mustaihoinen tai afroamerikkalainen, aasialainen) ja etninen tausta (latinalaisamerikkalainen, ei-latinalaisamerikkalainen) eivät vaikuttaneet semaglutidin farmakokinetiikkaan.
Paino
Paino vaikuttaa semaglutidialtistukseen. Suurempi paino pienentää altistusta; 20 %:n ero henkilöiden painossa aiheuttaa noin 16 %:n eron altistuksessa. Semaglutidiannoksilla 0,5 mg ja 1 mg saavutetaan riittävä systeeminen altistus, jos potilaan paino on 40–198 kg.
Munuaisten vajaatoiminta
Munuaisten vajaatoiminta ei vaikuttanut semaglutidin farmakokinetiikkaan kliinisesti merkittävässä määrin. Tämä osoitettiin antamalla 0,5 mg:n kerta-annos semaglutidia eriasteista munuaisten vajaatoimintaa (lievä, keskivaikea, vaikea ja dialyysiä vaativa) sairastaville potilaille ja vertaamalla tuloksia koehenkilöihin, joiden munuaiset toimivat normaalisti. Se osoitettiin myös tyypin 2 diabetesta ja munuaisten vajaatoimintaa sairastavien potilaiden kohdalla faasin 3a tutkimuksista saatujen tietojen perusteella, vaikkakin loppuvaiheen munuaissairautta sairastavista potilaista oli vain vähän kokemusta.
Maksan vajaatoiminta
Maksan vajaatoiminta ei vaikuttanut semaglutidialtistukseen millään tavalla. Semaglutidin farmakokinetiikkaa arvioitiin tutkimuksessa, jossa eriasteista maksan vajaatoimintaa (lievä, keskivaikea, vaikea) sairastaville potilaille annettiin 0,5 mg:n kerta-annos semaglutidia, ja tuloksia verrattiin potilaisiin, joiden maksa toimi normaalisti.
Pediatriset potilaat
Semaglutidia ei ole tutkittu pediatristen potilaiden hoidossa.
Immunogeenisuus
Semaglutidivasta-aineita kehittyi harvinaisissa tapauksissa 1 mg:n ja 2,4 mg:n semaglutidiannoksella toteutetun hoidon aikana (ks. kohta Haittavaikutukset). Tällä vasteella ei havaittu olevan vaikutusta semaglutidin farmakokinetiikkaan.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta tai genotoksisuutta koskevien konventionaalisten tutkimusten prekliiniset tulokset eivät viittaa erityiseen vaaraan ihmisille.
Jyrsijöillä todetut ei-letaalit kilpirauhasen C-solukasvaimet ovat GLP-1-reseptoriagonistien luokkavaikutus. Rotilla ja hiirillä tehdyissä, 2 vuotta kestäneissä karsinogeenisuustutkimuksissa kliinisesti merkityksellinen semaglutidialtistus aiheutti kilpirauhasen C-solukasvaimia. Muita hoitoon liittyviä kasvaimia ei havaittu. Jyrsijöiden C-solukasvaimet johtuvat ei-genotoksisesta, erityisestä GLP-1-reseptorivälitteisestä mekanismista, jolle jyrsijät ovat erityisen herkkiä. Merkityksen ihmiselle katsotaan olevan pieni, mutta sitä ei voida sulkea täysin pois.
Rotilla tehdyissä hedelmällisyystutkimuksissa semaglutidi ei vaikuttanut parittelukäyttäytymiseen tai urosrottien hedelmällisyyteen. Naarasrottien kiimakierron todettiin pidentyneen ja keltarauhasten (ovulaatioiden) lukumäärän hieman pienentyneen käytettäessä annoksia, joihin liittyi emon painon laskua.
Rotilla tehdyissä alkion- ja sikiönkehitystä koskeneissa tutkimuksissa semaglutidi aiheutti alkiotoksisuutta kliinisesti merkityksellistä altistusta pienempinä annoksina. Semaglutidi aiheutti emoille huomattavaa painon laskua ja heikensi alkioiden eloonjäämistä ja kasvua. Sikiöillä todettiin merkittäviä luuston ja sisäelinten epämuodostumia, mukaan lukien pitkiin luihin, kylkiluihin, nikamiin, häntään, verisuoniin ja aivokammioihin kohdistuneita vaikutuksia. Mekanistiset arvioinnit viittasivat siihen, että alkiotoksisuuteen vaikutti GLP-1-reseptorivälitteinen häiriö ravinteiden kulkeutumisessa ruskuaispussin kautta rotan sikiöille. Ruskuaispussin anatomiassa ja toiminnassa on lajikohtaisia eroja, eikä GLP-1-reseptori ilmennyt muiden kädellisten ruskuaispussissa, joten pidetään epätodennäköisenä, että tällä mekanismilla olisi merkitystä ihmisille. Semaglutidin suoraa vaikutusta sikiöön ei kuitenkaan voida poissulkea.
Kaneilla ja cynomolgus-apinoilla tehdyissä kehitystoksisuustutkimuksissa kliinisesti merkityksellisen altistuksen todettiin aiheuttavan enemmän keskenmenoja ja sikiöpoikkeavuuksien ilmaantuvuuden lievää nousua. Löydöksiä todettiin emoilla, joilla esiintyi huomattavaa painon laskua (jopa 16 %). Ei ole tiedossa, liittyvätkö nämä vaikutukset emon vähentyneeseen ruoankulutukseen, joka on suora GLP-1-vaikutus.
Syntymänjälkeistä kasvua ja kehitystä arvioitiin cynomolgus-apinoilla. Poikaset olivat syntyessään hieman pienempiä, mutta kasvu tasoittui imetyksen aikana.
Nuorilla rotilla semaglutidi aiheutti sukupuolisen kypsymisen viivästymistä sekä uroksilla ja naarailla. Tämä viive ei vaikuttanut kummankaan sukupuolen hedelmällisyyteen tai lisääntymiskapasiteettiin eikä aiheuttanut naarasrotille keskenmenoja.
Farmaseuttiset tiedot
Apuaineet
Dinatriumfosfaattidihydraatti
Propyleeniglykoli
Fenoli
Kloorivetyhappo (pH:n säätöön)
Natriumhydroksidi (pH:n säätöön)
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
Ennen käyttöönottoa
Ozempic 0,25 mg, 0,5 mg, 1 mg ja 2 mg (2 mg ei kaupan Suomessa)
3 vuotta
Ensimmäisen avaamisen jälkeen
Käyttöönoton jälkeen
Ozempic 0,25 mg, 0,5 mg, 1 mg ja 2 mg (4 annoksen kynät) (Ozempic 2 mg 4 annoksen kynä ei kaupan Suomessa)
6 viikkoa
Ozempic 0,5 mg ja 1 mg (8 annoksen kynät) (Ozempic 0,5 mg 8 annoksen kynä ei kaupan Suomessa)
8 viikkoa
Säilytä alle 30 °C tai jääkaapissa (2 °C - 8 °C). Ozempic ei saa jäätyä. Pidä kynän suojus paikoillaan, kun et käytä kynää. Herkkä valolle.
Säilytys
Säilytä jääkaapissa (2 °C - 8 °C). Älä säilytä lähellä jääkaapin kylmälevyä.
Ozempic ei saa jäätyä.
Pidä kynän suojus paikoillaan. Herkkä valolle.
Avatun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
OZEMPIC injektioneste, liuos, esitäytetty kynä
0,25 mg (L:ei) 1,5 ml (4x0,25 mg annos, 4 neulaa) (109,81 €)
0,5 mg (L:ei) 1,5 ml (4x0,5 mg annos, 4 neulaa) (109,81 €)
1 mg (L:ei) 3 ml (8x1 mg annos, 8 neulaa) (210,61 €), 3 ml (4x1 mg annos, 4 neulaa) (109,81 €)
PF-selosteen tieto
1,5 ml:n tai 3 ml:n sylinteriampulli (tyypin I lasia) on suljettu toisesta päästä kumisella männällä (klorobutyyliä) ja toisesta päästä alumiinikorkilla, jossa on laminoitu kumisuljin (bromobutyyliä/polyisopreenia). Sylinteriampulli on esitäytetyssä, kertakäyttöisessä, polypropeenista, polyoksimetyleenistä, polykarbonaatista ja akrylonitriilibutadieenistyreenistä valmistetussa kynässä.
Pakkauskoot
Ozempic 0,25 mg injektioneste, liuos
Jokaisessa esitäytetyssä kynässä on 1,5 ml liuosta, ja kynästä saa neljä 0,25 mg:n annosta.
1 esitäytetty kynä ja 4 kertakäyttöistä NovoFine Plus -neulaa
Ozempic 0,5 mg injektioneste, liuos
1,5 ml: Jokaisessa esitäytetyssä kynässä on 1,5 ml liuosta, ja kynästä saa neljä 0,5 mg:n annosta.
1 esitäytetty kynä ja 4 kertakäyttöistä NovoFine Plus -neulaa
3 esitäytettyä kynää ja 12 kertakäyttöistä NovoFine Plus -neulaa (ei kaupan Suomessa)
3 ml: Jokaisessa esitäytetyssä kynässä on 3 ml liuosta, ja kynästä saa neljä 0,5 mg:n annosta.
1 esitäytetty kynä ja 4 kertakäyttöistä NovoFine Plus -neulaa (ei kaupan Suomessa)
3 esitäytettyä kynää ja 12 kertakäyttöistä NovoFine Plus -neulaa (ei kaupan Suomessa)
3 ml: Jokaisessa esitäytetyssä kynässä on 3 ml liuosta, ja kynästä saa kahdeksan 0,5 mg:n annosta.
1 esitäytetty kynä ja 8 kertakäyttöistä NovoFine Plus -neulaa (ei kaupan Suomessa)
Ozempic 1 mg injektioneste, liuos
Jokaisessa esitäytetyssä kynässä on 3 ml liuosta, ja kynästä saa neljä 1 mg:n annosta.
1 esitäytetty kynä ja 4 kertakäyttöistä NovoFine Plus -neulaa
3 esitäytettyä kynää ja 12 kertakäyttöistä NovoFine Plus -neulaa (ei kaupan Suomessa)
Jokaisessa esitäytetyssä kynässä on 3 ml liuosta, ja kynästä saa kahdeksan 1 mg:n annosta.
1 esitäytetty kynä ja 8 kertakäyttöistä NovoFine Plus -neulaa
Ozempic 2 mg injektioneste, liuos (ei kaupan Suomessa)
Jokaisessa esitäytetyssä kynässä on 3 ml liuosta, ja kynästä saa neljä 2 mg:n annosta.
1 esitäytetty kynä ja 4 kertakäyttöistä NovoFine Plus -neulaa
3 esitäytettyä kynää ja 12 kertakäyttöistä NovoFine Plus -neulaa
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kirkas ja väritön tai melkein väritön, isotoninen liuos, pH=7,4.
Käyttö- ja käsittelyohjeet
Potilasta tulee neuvoa hävittämään injektioneula aina pistoksen jälkeen ja säilyttämään kynä ilman injektioneulaa. Näin voidaan ehkäistä neulojen tukkeutuminen, kontaminoituminen, infektiot, liuoksen vuotaminen ja epätarkka annostus.
Kynä on tarkoitettu vain henkilökohtaiseen käyttöön.
Ozempic-liuosta ei pidä käyttää, jos se ei ole kirkasta ja väritöntä tai melkein väritöntä.
Jäätynyttä Ozempic-valmistetta ei saa käyttää.
Ozempic-valmiste voidaan antaa 30G, 31G, ja 32G kertakäyttöisillä enintään 8 mm:n pituisilla neuloilla.
Käyttämätön lääkevalmiste ja muu jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
OZEMPIC injektioneste, liuos, esitäytetty kynä
0,25 mg 1,5 ml
0,5 mg 1,5 ml
1 mg 3 ml, 3 ml
- Alempi erityiskorvaus (65 %). Dulaglutidi, liraglutidi ja semaglutidi (tyypin 2 diabetes, aikuiset): Vaikeahoitoisen tyypin 2 diabeteksen hoito erityisin edellytyksin (285).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Dulaglutidi, liraglutidi ja semaglutidi (tyypin 2 diabetes, aikuiset): Vaikeahoitoisen tyypin 2 diabeteksen hoito erityisin edellytyksin (346).
ATC-koodi
A10BJ06
Valmisteyhteenvedon muuttamispäivämäärä
27.11.2025
Yhteystiedot
 NOVO NORDISK FARMA OY
NOVO NORDISK FARMA OY Linnoitustie 6
02600 Espoo
020 762 5300
www.novonordisk.fi
