VOTRIENT tabletti, kalvopäällysteinen 200 mg, 400 mg
Vaikuttavat aineet ja niiden määrät
Votrient 200 mg tabletti, kalvopäällysteinen
Yksi kalvopäällysteinen tabletti sisältää 200 mg patsopanibia (hydrokloridina).
Votrient 400 mg tabletti, kalvopäällysteinen
Yksi kalvopäällysteinen tabletti sisältää 400 mg patsopanibia (hydrokloridina).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Kalvopäällysteinen tabletti.
Kliiniset tiedot
Käyttöaiheet
Munuaissyöpä
Votrient on tarkoitettu aikuisille edenneen munuaissyövän ensilinjan hoitoon ja potilaille, jotka aikaisemmin ovat saaneet sytokiinihoitoa edenneen taudin hoitoon.
Pehmytkudossarkooma
Votrient on tarkoitettu edenneen pehmytkudossarkooman tiettyjen alatyyppien hoitoon potilaille, jotka ovat aikaisemmin saaneet solusalpaajahoitoa metastasoituneen taudin hoitoon tai joilla tauti on edennyt 12 kuukauden sisällä (neo)adjuvanttihoidon jälkeen.
Patsopanibin teho ja turvallisuus on osoitettu vain tietyissä pehmytkudossarkooman histologisissa alatyypeissä (ks. kohta Farmakodynamiikka).
Ehto
Ainoastaan syöpälääkkeiden antoon perehtyneen lääkärin tulee aloittaa hoito.
Annostus ja antotapa
Ainoastaan syöpälääkkeiden antoon perehtyneen lääkärin tulee aloittaa Votrient-hoito.
Annostus
Aikuiset
Suositeltu patsopanibiannos munuaissyövässä tai pehmytkudossarkoomassa on 800 mg kerran vuorokaudessa.
Annoksen muuttaminen
Annosta muutetaan (lasketaan tai nostetaan) asteittain 200 mg kerrallaan yksilöllisen sietokyvyn mukaan, jotta haittavaikutukset pysyvät hallinnassa. Patsopanibiannos ei saa ylittää 800 mg.
Pediatriset potilaat
Patsopanibia ei pidä käyttää alle kahden vuoden ikäisten lasten hoitoon elimien kasvuun ja kehitykseen liittyvien turvallisuusriskien vuoksi (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Prekliiniset tiedot turvallisuudesta).
Patsopanibin turvallisuutta ja tehoa 2–18 vuoden ikäisten lasten hoidossa ei ole vielä varmistettu.
Saatavissa olevan tiedon perusteella, joka on kuvattu kohdissa Haittavaikutukset, Farmakodynamiikka ja Farmakokinetiikka, ei voida antaa suosituksia annostuksesta.
Iäkkäät
Patsopanibin käytöstä yli 65-vuotiaiden potilaiden hoidossa on rajallisesti tutkimustietoa. Kliinisissä munuaissyöpätutkimuksissa patsopanibin turvallisuudessa ei havaittu kliinisesti merkitseviä eroja 65 vuotta täyttäneiden ja nuorempien potilaiden välillä. Kliinisten kokemusten perusteella iäkkäiden ja nuorempien potilaiden hoitovasteessa ei ole eroa, mutta joidenkin iäkkäiden potilaiden suurempaa herkkyyttä ei voida sulkea pois.
Munuaisten vajaatoiminta
Munuaisten vajaatoiminta ei todennäköisesti vaikuta kliinisesti merkittävästi patsopanibin farmakokinetiikkaan, sillä patsopanibi ja sen metaboliitit erittyvät hyvin vähäisessä määrin munuaisten kautta (ks. kohta Farmakokinetiikka). Annoksen muuttaminen ei siis ole tarpeen, jos kreatiniinipuhdistuma on yli 30 ml/min. Varovaisuutta on noudatettava, jos kreatiniinipuhdistuma on alle 30 ml/min, sillä patsopanibin käytöstä ei ole kokemuksia tässä potilasryhmässä.
Maksan vajaatoiminta
Patsopanibin annostusohjeet maksan vajaatoiminnassa perustuvat farmakokineettisiin tutkimuksiin eriasteista maksan vajaatoimintaa sairastavilla potilailla (ks. kohta Farmakokinetiikka). Maksan toimintakokeet tulee ottaa kaikilta potilailta ennen patsopanibihoidon aloittamista ja hoidon aikana, jotta selviää mahdollinen maksan vajaatoiminta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Jos potilaalla on lievä tai kohtalainen maksan vajaatoiminta, patsopanibin käytössä on noudatettava varovaisuutta ja potilaan tilaa on seurattava tarkoin siedettävyyden suhteen. Patsopanibin annostus on 800 mg kerran vuorokaudessa potilailla, joilla on lieviä muutoksia seerumista mitattavissa maksan toimintakokeissa (määritellään joko normaalina bilirubiinina ja pienenäkin ALAT-arvojen nousuna tai bilirubiinin nousuna (> 35 % konjugoitunut bilirubiini) aina 1,5 x normaaliarvojen ylärajaan asti (ULN) ALAT-arvosta riippumatta). Kohtalaisessa maksan vajaatoiminnassa (määritellään bilirubiinin nousuna > 1,5–3 x ULN, ALAT-arvosta riippumatta) suositellaan patsopanibiannoksen pienentämistä tasolle 200 mg kerran vuorokaudessa (ks. kohta Farmakokinetiikka).
Patsopanibin käyttöä ei suositella potilaille, joilla on vaikea maksan vajaatoiminta (määritellään kokonaisbilirubiinina > 3 x ULN, ALAT-arvosta riippumatta).
Ks. kohta Varoitukset ja käyttöön liittyvät varotoimet koskien maksan toiminnan seurantaa ja annoksen sovittamista potilailla, joilla on lääkkeen aiheuttama hepatotoksisuus.
Antotapa
Patsopanibi otetaan suun kautta. Se otetaan tyhjään mahaan, tai vähintään tunti ennen ateriaa tai kaksi tuntia aterian jälkeen (ks. kohta Farmakokinetiikka). Kalvopäällysteiset tabletit niellään kokonaisina veden kanssa. Niitä ei saa jakaa eikä murskata (ks. kohta Farmakokinetiikka).
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Maksavaikutukset
Patsopanibin käytön aikana on ilmennyt vaikeita maksan toimintahäiriöitä (myös kuolemaan johtaneita). Patsopanibi tulee antaa varoen potilaille, joilla on lievä tai kohtalainen maksan vajaatoiminta ja heitä tulee seurata huolellisesti. Patsopanibin suositeltu annostus on 800 mg kerran vuorokaudessa potilailla, joilla on lieviä muutoksia seerumista mitattavissa maksan toimintakokeissa (joko normaali bilirubiini ja pienikin ALAT-arvojen nousu tai bilirubiinin nousu aina 1,5 x UNL, ALAT-arvosta riippumatta). Kohtalaisessa maksan vajaatoiminnassa suositellaan patsopanibin annoksen laskemista 200 milligrammaan kerran vuorokaudessa (bilirubiinin nousu > 1,5−3 x ULN, ALAT-arvosta riippumatta) (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka). Patsopanibin käyttöä ei suositella potilaille, joilla on vaikea maksan vajaatoiminta (kokonaisbilirubiini > 3 x ULN, ALAT-arvosta riippumatta (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka). Altistuminen on huomattavasti vähäisempää 200 mg annoksella, mutta siinä havaitaan suurta vaihtelevuutta. Kliininen vaste on näillä potilailla riittämätöntä.
Patsopanibin kliinisissä tutkimuksissa todettiin seerumin aminotransferaasi- (ALAT-, ASAT-) ja bilirubiiniarvojen nousua (ks. kohta Haittavaikutukset). Useimmissa tapauksissa on raportoitu yksittäisiä kohonneita ALAT- ja ASAT-arvoja, joihin ei ole liittynyt alkalisen fosfataasin eikä bilirubiinin kohonneita arvoja. Yli 60 vuoden ikäiset potilaat saattavat olla riskialttiimpia saada lievistä (> 3 x ULN) vaikeisiin (> 8 x ULN) ALAT-arvojen nousuja. Potilailla, joilla on HLA-B*57-01 alleeli, on suurempi riski ALAT-arvon nousuun patsopanibin käytön yhteydessä. Patsopanibilla hoidettavien potilaiden maksan toimintaa tulee seurata riippumatta potilaan genotyypistä tai iästä (ks. kohta Farmakodynamiikka).
Seerumin maksa-arvot on tarkistettava ennen patsopanibihoidon aloittamista, viikoilla 3, 5, 7 ja 9, sitten 3. ja 4. kuukauden kohdalla ja lisätestejä kliinisen tilanteen mukaan. Arvojen säännöllistä seurantaa on jatkettava myös 4. kuukauden jälkeen.
Ks. taulukko 1 koskien annoksen sovittamista potilaille, joilla lähtötilanteessa kokonaisbilirubiiniarvo on ≤ 1,5 x viitealueen yläraja (ULN) ja ASAT ja ALAT ≤ 2 x viitealueen yläraja (ULN).
Taulukko 1 Annoksen sovittaminen potilailla, joilla on lääkkeen aiheuttama hepatotoksisuus
Maksan toimintakokeiden arvot | Annoksen sovittaminen |
Transaminaasien arvot kohonneet 3−8 x ULN | Patsopanibihoitoa voidaan jatkaa. Maksan toimintakokeet otetaan viikoittain, kunnes transaminaasit palaavat 1. asteen muutosten tasolle tai lähtötasolle. |
Transaminaasien arvot kohonneet > 8 x ULN | Patsopanibihoito keskeytetään, kunnes transaminaasit palaavat 1. asteen muutosten tasolle tai lähtötasolle. Jos patsopanibihoidon uudelleenaloittamisen mahdollinen hyöty katsotaan suuremmaksi kuin maksatoksisuuden riski, patsopanibi aloitetaan uudelleen pienemmällä 400 mg:n päivittäisellä annoksella, ja seerumin maksa-arvoja seurataan viikoittain 8 viikon ajan. Patsopanibihoito on lopetettava pysyvästi, jos transaminaasiarvojen nousu tasolle > 3 x ULN uusiutuu, kun patsopanibi on aloitettu uudelleen. |
Transaminaasien arvot kohonneet > 3 x ULN, bilirubiini samanaikaisesti kohonnut > 2 x ULN. | Patsopanibihoito tulee lopettaa pysyvästi. Potilaita tulee seurata, kunnes arvot palaavat 1. asteen muutosten tasolle tai lähtötasolle. Patsopanibi on UGT1A1 estäjä. Lievää, epäsuoraa (ei-konjugoitu) hyperbilirubinemiaa saattaa ilmaantua potilailla, joilla on Gilbertin oireyhtymä. Potilaita, joilla on vain lievää epäsuoraa hyperbilirubinemiaa ja joilla tiedetään tai epäillään olevan Gilbertin oireyhtymä, ja joilla ALAT on > 3 x ULN, tulee hoitaa kuten potilaita, joilla pelkkä ALAT on kohonnut. |
Patsopanibin ja simvastatiinin samanaikainen käyttö lisää kohonneiden ALAT-arvojen riskiä (ks. kohta Yhteisvaikutukset). Samanaikainen käyttö edellyttää varovaisuutta ja huolellista seurantaa.
Hypertensio
Patsopanibin kliinisissä tutkimuksissa on ilmennyt hypertensiotapahtumia, mukaan lukien kohonneen verenpaineen symptomaattisten episodien uudet diagnoosit (hypertensiiviset kriisit). Verenpaineen on oltava hyvin tasapainossa ennen patsopanibihoidon aloittamista. Potilaiden verenpainetta on seurattava hypertension varalta heti hoidon alussa (yhden viikon sisällä hoidon aloituksesta) ja tämän jälkeen säännöllisesti. Kohonneita verenpainearvoja (systolinen verenpaine ≥ 150 mmHg tai diastolinen verenpaine ≥ 100 mmHg) ilmeni patsopanibihoidon alkuvaiheessa (noin 40 % tapauksista ilmeni ennen 9. päivää ja noin 90 % tapauksista ilmeni ensimmäisten 18 viikon aikana). Verenpainetta on seurattava ja verenpainelääkitys tulee aloittaa nopeasti samalla, kun patsopanibin annosta pienennetään (hoidon keskeytys ja uudelleen aloitus pienemmällä annoksella kliinisen tilanteen mukaan) (ks. kohdat Annostus ja antotapa ja Haittavaikutukset). Patsopanibihoito tulee lopettaa, jos on todisteita hypertensiivisestä kriisistä tai jos hypertensio on vaikea ja jatkuu verenpainelääkityksestä ja patsopanibiannoksen pienentämisestä huolimatta.
Posteriorinen reversiibeli enkefalopatia syndrooma (PRES)/ Reversiibeli posteriorinen leukoenkefalopatia syndrooma (RPLS)
PRES/RPLS oireyhtymää on raportoitu patsopanibin käytön yhteydessä. Oireyhtymään kuuluu päänsärky, verenpaine, kohtaukset, uneliaisuus, sekavuus, sokeus ja muita näkö- ja neurologisia häiriöitä. Oireyhtymä voi olla kuolemaan johtava. Votrient‑hoito on pysyvästi lopetettava, jos potilaalle kehittyy PRES/RPLS oireyhtymä.
Interstitiaalinen keuhkosairaus/Pneumoniitti
Patsopanibilla on raportoitu potentiaalisesti hengenvaarallista interstitiaalista keuhkosairautta (ks. kohta Haittavaikutukset). Potilaiden interstitiaaliseen keuhkosairauteen/pneumoniittiin viittavia keuhko-oireita on seurattava ja patsopanibihoito on lopetettava, jos potilaalle kehittyy interstitiaalista keuhkosairautta tai pneumoniittia.
Sydämen toimintahäiriö
Patsopanibin riskejä ja hyötyjä tulee punnita ennen kuin hoito aloitetaan potilailla, joilla on sydämen toimintahäiriö. Patsopanibin turvallisuutta ja farmakokinetiikkaa ei ole tutkittu potilailla, joilla on kohtalainen tai vaikea sydämen vajaatoiminta, eikä potilailla, joiden vasemman kammion ejektiofraktio (LVEF) on alle normaalin.
Patsopanibin kliinisissä tutkimuksissa on esiintynyt sydämen toimintahäiriöitä, kuten kongestiivista sydämen vajaatoimintaa ja pienentynyttä vasemman kammion ejektiofraktiota (LVEF) (ks. kohta Haittavaikutukset). Satunnaistetussa tutkimuksessa, jossa patsopanibia verrattiin sunitinibiin munuaissyövässä (VEG108844), potilailta mitattiin vasemman kammion ejektiofraktio (LVEF) lähtötilanteessa ja seurannassa. Sydänlihaksen vajaatoimintaa havaittiin 13 %:lla (47/362) patsopanibihaarassa ja 11 %:lla (42/369) sunitinibihaarassa. Kongestiivista sydämen vajaatoimintaa havaittiin 0,5 %:lla kummassakin hoitohaarassa. Kongestiivista sydämen vajaatoimintaa raportoitiin 3 henkilöllä 240:sta (1 %) vaiheen III VEG110727- pehmytkudossarkoomatutkimuksessa. Pienentynyttä vasemman kammion ejektiofraktiota havaittiin 11 %:lla (15/140) patsopanibihaarassa verrattuna 3 %:iin (1/39) plasebohaarassa lähtötilanteen jälkeen ja seurannassa tehdyissä tutkimuksissa.
Riskitekijät
Vaiheen III pehmytkudossarkoomatutkimuksessa samanaikaista verenpainetta havaittiin 13 henkilöllä patsopanibihaaran 15 henkilöstä, mikä on saattanut vaikeuttaa sydämen toimintahäiriötä riskipotilailla lisäämällä sydämen jälkikuormitusta. 99 % vaiheen III pehmytkudossarkoomatutkimukseen osallistuneista potilaista (243/246), mukaan lukien nämä 15 potilasta, saivat antrasykliinihoitoa. Aikaisempi antrasykliinihoito saattaa olla sydämen toiminnanhäiriön riskitekijä.
Lopputulos
Neljä potilasta 15:stä toipui täysin (5 % sisällä lähtötilanteesta) ja viisi potilasta osittain (normaaliarvojen puitteissa, mutta > 5 % alle lähtötilanteen). Yksi henkilö ei toipunut ja viiden muun henkilön seurantatiedot puuttuvat.
Hoito
Patsopanibihoidon keskeyttämisen ja/tai annoksen pienentämisen tulee tapahtua samanaikaisesti verenpainehoidon kanssa (ks. edellä verenpainetta koskeva varoitus) potilailla, joilla vasemman kammion ejektiofraktio on pienentynyt huomattavasti, kliinisen tilanteen mukaan.
Potilaita on seurattava huolella kongestiivisen sydämen vajaatoiminnan kliinisten oireiden ja löydösten varalta. Vasemman kammion ejektiofraktion seurantaa lähtötilanteessa ja säännöllisesti tämän jälkeen suositellaan potilailla, joilla on riski saada sydämen toiminnanhäiriö.
QT-ajan pidentyminen ja kääntyvien kärkien takykardia
Patsopanibin kliinisissä tutkimuksissa on ilmennyt QT-ajan pidentymistä ja kääntyvien kärkien takykardiaa (torsades de pointes) (ks. kohta Haittavaikutukset). Patsopanibin käytössä on noudatettava varovaisuutta, jos potilaalla on aikaisemmin todettu QT-ajan pidentymistä, jos potilas saa rytmihäiriölääkkeitä tai muita lääkkeitä, jotka saattavat pidentää QT-aikaa, tai jos potilaalla on aikaisemmin todettu relevantti sydänsairaus. EKG-rekisteröinti tulisi tehdä ennen patsopanibi-hoidon aloitusta ja säännöllisin välein hoidon aikana. Elektrolyyttien (esim. kalsiumin, magnesiumin, kaliumin) pitoisuudet tulisi pitää viitealueella.
Valtimotukokset
Kliinisissä tutkimuksissa patsopanibihoidon yhteydessä ilmeni sydäninfarktia, sydänlihasiskemiaa, iskeemistä aivohalvausta ja ohimenevää aivoverenkierron häiriötä (ks. kohta Haittavaikutukset). Kuolemaan johtaneita tapahtumia on raportoitu. Patsopanibin käytössä on noudatettava varovaisuutta hoidettaessa potilaita, joilla tromboottisten tapahtumien riski on suurentunut, tai hoidettaessa potilaita, joilla aikaisemmin on ollut tromboottinen tapahtuma. Patsopanibia ei ole tutkittu potilailla, joilla on ollut tapahtuma edellisen kuuden kuukauden aikana. Hoitopäätös on tehtävä kunkin potilaan hyöty-riskisuhteen arvioinnin perusteella.
Laskimotukokset
Patsopanibin kliinisissä tutkimuksissa on havaittu laskimotukostapahtumia, mukaan lukien laskimotrombooseja ja kuolemaan johtaneita keuhkoembolioita. Näitä on esiintynyt sekä munuaissyöpä- että pehmytkudossarkoomapotilailla, mutta insidenssi oli korkeampi pehmytkudossarkoomapotilailla (5 %) kuin munuaissyöpäpotilailla (2 %).
Tromboottinen mikroangiopatia (TMA)
Tromboottista mikroangiopatiaa on raportoitu patsopanibin kliinisissä tutkimuksissa, joissa patsopanibi annettiin monoterapiana, yhdessä bevasitsumabin kanssa ja yhdessä topotekaanin kanssa (ks. kohta Haittavaikutukset). Patsopanibihoito tulee pysyvästi lopettaa potilailla, joille kehittyy tromboottista mikroangiopatiaa. Tromboottisen mikroangiopatian korjaantumista on ollut havaittavissa, kun patsopanibihoito lopetettiin. Patsopanibin käyttö muiden lääkkeiden kanssa ei ole käyttöaiheen mukaista.
Verenvuototapahtumat
Patsopanibin kliinisissä tutkimuksissa on raportoitu verenvuototapahtumia (ks. kohta Haittavaikutukset). Kuolemaan johtaneita verenvuototapahtumia on raportoitu. Patsopanibia ei ole tutkittu potilailla, joilla on ollut veriyskää, aivoverenvuoto tai kliinisesti merkittävä maha-suolikanavan verenvuoto 6 edellisen kuukauden aikana. Patsopanibin käytössä on noudatettava varovaisuutta hoidettaessa potilaita, joilla on merkittävä verenvuotoriski.
Aneurysmat ja valtimon dissekaatiot
VEGF-reitin estäjien käyttö potilailla, joilla on kohonnut verenpaine tai joilla ei ole kohonnutta verenpainetta, saattaa edistää aneurysmien ja/tai valtimon dissekaatioiden muodostumista. Tämä riski on arvioitava tarkoin ennen patsopanibihoidon aloittamista potilaille, joilla on riskitekijöitä, kuten kohonnut verenpaine tai aikaisempia aneurysmoja.
Maha-suolikanavan perforaatiot ja fistelit
Patsopanibin kliinisissä tutkimuksissa on todettu maha-suolikanavan perforaatioita ja fisteleitä (ks. kohta Haittavaikutukset). Kuolemaan johtaneita perforaatiotapahtumia on raportoitu. Patsopanibin käytössä on noudatettava varovaisuutta hoidettaessa potilaita, joilla on riski saada maha-suolikanavan perforaatio tai fisteli.
Haavojen paraneminen
Patsopanibin vaikutuksista haavojen paranemiseen ei ole tehty varsinaisia tutkimuksia. Koska verisuonten endoteelikasvutekijän (VEGF) estäjät saattavat vaikeutta haavojen paranemista, patsopanibihoito on lopetettava vähintään 7 vuorokautta ennen suunniteltua leikkausta. Leikkauksen jälkeen patsopanibihoidon uudelleenaloittamisen on perustuttava kliiniseen arvioon haavan asianmukaisesta paranemisesta. Patsopanibihoito on lopetettava, jos leikkaushaava avautuu.
Hypotyreoosi
Patsopanibin kliinisissä tutkimuksissa on ilmennyt hypotyreoosia (ks. kohta Haittavaikutukset). Kilpirauhasen toimintakokeet tulisi tehdä ennen hoidon aloittamista, ja mahdollinen hypotyreoosi on hoidettava tavanomaisen käytännön mukaisesti ennen kuin patsopanibihoito aloitetaan. Kaikkien potilaiden tilaa on seurattava tarkoin patsopanibihoidon aikana kilpirauhasen vajaatoimintaan viittaavien löydösten ja oireiden havaitsemiseksi. Kilpirauhasen toimintaa on seurattava säännöllisten laboratoriokokeiden avulla, ja mahdolliset toimintahäiriöt on hoidettava tavanomaisen käytännön mukaisesti.
Proteinuria
Patsopanibin kliinisissä tutkimuksissa on raportoitu proteinuriaa. Virtsakokeet tulisi tehdä ennen hoitoa ja säännöllisin välein hoidon aikana, ja potilaiden tilaa on seurattava mahdollisen proteinurian vaikeutumisen varalta. Patsopanibihoito on lopetettava, jos potilaalle kehittyy nefroottinen syndrooma.
Tuumorilyysioireyhtymä
Patsopanibin käyttöön on liittynyt tuumorilyysioireyhtymää, joka on osassa tapauksista johtanut kuolemaan (ks. kohta Haittavaikutukset). Tuumorilyysioireyhtymän riski on suurentunut, jos potilaalla on nopeasti kasvavia kasvaimia, suuri kasvainkuorma, munuaisten toimintahäiriö tai nestehukka. Ehkäiseviä toimia kuten suurten virtsahappopitoisuuksien hoitoa ja nesteytystä laskimoon on harkittava ennen Votrient‑hoidon aloittamista. Riskipotilaita on seurattava tarkasti ja hoidettava kliinisen tarpeen mukaan.
Pneumothorax
Patsopanibin kliinisissä tutkimuksissa edenneessä pehmytkudossarkoomassa on ilmennyt pneumothoraxtapahtumia (ks. kohta Haittavaikutukset). Patsopanibipotilaita on seurattava huolella pneumothoraxin oireiden ja löydösten varalta.
Pediatriset potilaat
Vaikutusmekanismista johtuen patsopanibi voi jyrsijöillä vahingoittaa elinten kehitystä ja maturaatiota aikaisessa postnataalivaiheessa (ks. kohta Prekliiniset tiedot turvallisuudesta). Tämän vuoksi patsopanibia ei tule antaa alle 2 vuoden ikäisille lapsipotilaille.
Infektiot
Vakavia infektiotapauksia (joihin on voinut liittyä neutropeniaa) on raportoitu. Joissakin tapauksissa infektiot ovat olleet kuolemaan johtaneita.
Samanaikainen käyttö muiden systeemisten syöpähoitojen kanssa
Kliiniset tutkimukset patsopanibilla yhdistettynä muiden syöpähoitojen kanssa (kuten pemetreksedi, lapatinibi tai pembrolitsumabi) lopetettiin aikaisin, koska huolena oli lisääntynyt toksisuus ja/tai kuolleisuus. Näille yhdistelmähoidoille ei ole osoitettu turvallista ja tehokasta annosta.
Raskaus
Prekliinisissä tutkimuksissa eläimillä on ilmennyt lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Jos patsopanibia käytetään raskauden aikana tai jos potilas tulee raskaaksi patsopanibin käytön aikana, hänelle on kerrottava mahdollisesta sikiöön kohdistuvasta vaarasta. Hedelmällisessä iässä olevia naisia on kehotettava välttämään raskaaksi tulemista patsopanibihoidon aikana (ks. kohta Raskaus ja imetys).
Yhteisvaikutukset
Vahvojen CYP3A4-estäjien, P-glykoproteiinin (P-gp) estäjien tai BCRP- (breast cancer resistance protein) estäjien samanaikaista käyttöä tulee välttää, sillä patsopanibialtistus saattaa nousta (ks. kohta Yhteisvaikutukset). Vaihtoehtona tulee harkita sellaisten samanaikaisten hoitojen antamista, joilla ei ole tai joilla on vähän CYP3A4, P-gp tai BCRP estovaikutusta.
Samanaikaista hoitoa CYP3A4-induktoreilla tulisi välttää, koska se voi johtaa patsopanibialtistuksen pienenemiseen (ks. kohta Yhteisvaikutukset).
Hyperglykemiaa on havaittu, kun ketokonatsolia on annettu samanaikaisesti.
Varovaisuutta on noudatettava, jos patsopanibia annetaan samanaikaisesti uridiinidifosfaattiglukuronosyylitransferaasi 1A1:n (UGT1A1) substraattien (esim. irinotekaanin) kanssa, koska patsopanibi on UGT1A1:n estäjä (ks. kohta Yhteisvaikutukset).
Greippimehun nauttimista on vältettävä patsopanibihoidon aikana (ks. kohta Yhteisvaikutukset).
Apuaineet
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per kalvopäällysteinen tabletti eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Muiden lääkkeiden vaikutukset patsopanibiin
In vitro -tutkimukset viittaavat siihen, että patsopanibin oksidatiivinen metabolia ihmisen maksan mikrosomeissa välittyy pääasiassa CYP3A4-entsyymin ja hyvin vähäisessä määrin CYP1A2- ja CYP2C8-entsyymien kautta. Siksi CYP3A4:n estäjät ja induktorit voivat muuttaa patsopanibin metaboliaa.
CYP3A4-, P-gp- ja BCRP-estäjät
Patsopanibi on CYP3A4:n, P-gp:n ja BCRP:n substraatti.
Patsopanibin (400 mg kerran vuorokaudessa) samanaikainen anto voimakkaan CYP3A4- ja P-gp- inhibiittorin ketokonatsolin (400 mg kerran vuorokaudessa) kanssa 5 peräkkäisenä päivänä johti patsopanibin keskimääräisen AUC(0-24)-arvon 66 % nousuun ja keskimääräisen Cmax-arvon 45 % nousuun verrattuna arvoihin, joita saadaan, kun patsopanibia annetaan yksinään (400 mg kerran vuorokaudessa 7 päivän ajan). Pelkän patsopanibin 800 mg annoksen jälkeen Cmax-arvon keskiarvojen vaihteluväli oli 27,5−58,1 mikrog/ml ja AUC(0-24)-keskiarvojen vaihteluväli oli 48,7−1040 mikrog*h/ml. Kun 400 mg patsopanibia annettiin yhdessä 400 mg ketokonatsolin kanssa, keskimääräinen Cmax oli 59,2 mikrog/ml ja keskimääräinen AUC(0-24) 1 300 mikrog*h/ml. Kun patsopanibin annosta pienennetään tasolle 400 mg kerran päivässä voimakkaan CYP3A4- ja P-gp- inhibiittorin läsnä ollessa, patsopanibin systeeminen altistus näyttäisi farmakokineettisten parametrien vertailussa valtaosalla potilaista nousevan tasolle, joka nähdään pelkällä 800 mg kerran vuorokaudessa annostelulla, Joillakin potilailla systeeminen altistus patsopanibille voi olla suurempi kuin pelkän 800 mg annostuksen jälkeen.
Patsopanibin pitoisuus saattaa suurentua, jos sitä annetaan samanaikaisesti muiden CYP3A4-entsyymiryhmän voimakkaiden estäjien (esim. itrakonatsolin, klaritromysiinin, atatsanaviirin, indinaviirin, nefatsodonin, nelfinaviirin, ritonaviirin, sakinaviirin, telitromysiinin, vorikonatsolin) kanssa. Greippimehu sisältää CYP3A4:n estäjää, ja myös se saattaa suurentaa patsopanibin pitoisuutta plasmassa.
Kun 800 mg:n patsopanibiannoksen kanssa annettiin 1 500 mg lapatinibia, joka on CYP3A4:n ja P-gp:n substraatti ja heikko estäjä ja BCRP:n voimakas estäjä, patsopanibin AUC(0-24)‑ ja Cmax-keskiarvot olivat noin 50‑60 % suuremmat kuin silloin, kun 800 mg:n patsopanibiannos annettiin yksinään. P-gp:n ja/tai BCRP:n esto lapatinibilla johtaa todennäköisesti patsopanibialtistuksen nousuun.
Patsopanibin yhteiskäyttö CYP3A4:n, P-gp:n ja BCRP:n estäjän, kuten lapatinibin, kanssa johtaa patsopanibipitoisuuksien suurenemiseen plasmassa. Vahvojen P-gp- tai BCRP-estäjien samanaikainen anto saattaa myös muuttaa patsopanibin altistusta ja jakautumista, myös jakautumista keskushermostoon.
Patsopanibin ja voimakkaiden CYP3A4-inhibiittorien samanaikaista käyttöä tulee välttää (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Jos voimakkaalle CYP3A4-inhibiittorille ei ole (lääketieteellisesti hyväksyttävää) vaihtoehtoa, patsopanibin annosta tulee laskea tasolle 400 mg päivässä yhteisannon ajaksi. Haittavaikutusten huolellinen seuranta on näissä tilanteissa tarpeen ja annosta tulee laskea edelleen, jos havaitaan mahdollisesti lääkkeen aiheuttamia haittatapahtumia.
Yhteiskäyttöä voimakkaiden P-gp- tai BCRP-estäjien kanssa tulisi näin ollen välttää tai valita jokin vaihtoehtoinen lääkevalmiste, jolla ei ole P-gp:tä tai BCRP:tä estävää vaikutusta tai jolla tällainen vaikutus on vähäinen.
CYP3A4-, P-gp-, BCRP-induktorit
CYP3A4:n induktorit, kuten rifampisiini, voivat pienentää plasman patsopanibipitoisuuksia. Vahvojen P-gp- tai BCRP-induktorien samanaikainen anto patsopanibin kanssa saattaa muuttaa patsopanibin altistusta ja jakautumista, myös jakautumista keskushermostoon. Niiden sijasta tulisi valita jokin vaihtoehtoinen lääke, jolla ei ole näiden entsyymien toimintaa tai kuljetusta indusoivaa vaikutusta tai jolla tällainen vaikutus on vähäinen.
Patsopanibin vaikutukset muihin lääkevalmisteisiin
In vitro -tutkimukset ihmisen maksan mikrosomeilla osoittivat, että patsopanibi estää CYP-entsyymien 1A2, 3A4, 2B6, 2C8, 2C9, 2C19 ja 2E1 toimintaa. Ihmisen CYP3A4:n mahdollinen induktio osoitettiin in vitro ihmisen pregnaani X-reseptorin (PXR) analyysissä. Kliinisen farmakologian tutkimukset, joissa patsopanibia annettiin 800 mg kerran vuorokaudessa, ovat osoittaneet, ettei patsopanibilla ole kliinisesti merkittävää vaikutusta kofeiinin (CYP1A2:n substraatti), varfariinin (CYP2C9:n substraatti) eikä omepratsolin (CYP2C19:n substraatti) farmakokinetiikkaan syöpäpotilailla. Patsopanibi suurensi midatsolaamin (CYP3A4:n substraatti) AUC- ja Cmax-arvoja noin 30 % ja virtsan dekstrometorfaani/dekstrofaanipitoisuuksien suhdetta 33–64 %, kun dekstrometorfaania (CYP2D6:n substraatti) annettiin suun kautta. Kun patsopanibia annettiin 800 mg kerran vuorokaudessa yhdessä (CYP3A4:n ja CYP2C8:n substraatin) paklitakselin (80 mg/m2 kerran viikossa) kanssa, paklitakselin AUC-arvo suureni keskimäärin 26 % ja Cmax-arvo keskimäärin 31 %.
In vitro IC50 -arvoihin ja Cmax -plasma-arvoihin perustuen patsopanibin metaboliitit GSK1268992 ja GSK1268997 saattavat myötävaikuttaa patsopanibin BCRP:n kokonaisestovaikutuksiin. Lisäksi patsopanibin BCRP ja P-gp estovaikutusta maha-suolikanavassa ei voida sulkea pois. Huolellisuutta on noudatettava annettaessa patsopanibia samanaikaisesti muiden oraalisten BCRP- ja P-gp-substraattien kanssa.
Patsopanibi esti in vitro ihmisen orgaanista anionikuljettajaproteiinia (OATP1B1). Patsopanibin vaikutuksia OATP1B1-substraattien (esim. statiinien) farmakokinetiikkaan ei voida sulkea pois. (Ks. alla ”Patsopanibin ja simvastatiinin samanaikaisen käytön vaikutukset”.)
Patsopanibi on uridiinidifosfaattiglukuronyylitransferaasin 1A1 (UGT1A1) estäjä in vitro. Irinotekaanin aktiivinen metaboliitti SN-38 on OATP1B1:n ja UGT1A1:n substraatti. Kun patsopanibia annettiin 400 mg kerran päivässä samanaikaisesti setuksimabin (annos 250 mg/m2) ja irinotekaanin (annos 150 mg/m2) kanssa, SN-38 systeeminen altistus kohosi noin 20 %. Patsopanibin vaikutus SN-38:n jakautumiseen ja eliminaatioon elimistöstä voi olla suurempi UGT1A1*28 polymorfismin omaavilla henkilöillä kuin villin alleelin omaavilla henkilöillä. UGT1A1 genotyyppi ei kuitenkaan aina ole prediktiivinen. Varovaisuutta on noudatettava, kun patsopanibia annetaan samanaikaisesti UGT1A1-substraattien kanssa.
Patsopanibin ja simvastatiinin samanaikaisen käytön vaikutukset
Patsopanibin ja simvastatiinin samanaikainen käyttö lisää kohonneiden ALAT-arvojen insidenssiä. Tämä on havaittu meta-analyysissä, jossa yhdistettiin patsopanibin eri kliinisistä tutkimuksista saatuja tietoja. ALAT-arvot olivat > 3 x ULN 14 %:lla potilaista (126/895), jotka eivät käyttäneet statiineja ja 27 %:lla potilasta (11/41), jotka saivat samanaikaisesti simvastatiinia (p=0,038). Patsopanibin annostusohjeita tulee noudattaa ja simavastatiinihoito tulee lopettaa, jos ALAT-arvot nousevat samanaikaisesti simvastatiinia saavilla potilailla (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Lisäksi muiden statiinien ja patsopanibin samanaikaisessa käytössä on noudatettava varovaisuutta, sillä tiedot yhteisvaikutuksista ALAT-arvoihin ovat riittämättömät. Patsopanibin vaikutuksia muiden statiinien (esim. atorvastatiinin, fluvastatiinin, pravastatiinin, rosuvastatiinin) farmakokinetiikkaan ei voida poissulkea.
Ruoan vaikutus patsopanibiin
Jos patsopanibia annetaan runsaasti rasvaa sisältävän tai vähärasvaisen aterian yhteydessä, AUC- ja Cmax-arvo suurenevat noin kaksinkertaisiksi. Siksi patsopanibi tulisi ottaa vähintään tunti ennen ateriaa tai kaksi tuntia aterian jälkeen.
Mahan pH:ta nostavat lääkevalmisteet
Patsopanibin samanaikainen anto esomepratsolin kanssa vähentää patsopanibin biologista hyötyosuutta noin 40 %:lla (AUC ja Cmax). Patsopanibin ja mahan pH:ta nostavien lääkkeiden samanaikaista käyttöä tulee välttää. Jos protonipumpun estäjän käyttö on lääketieteellisesti välttämätöntä, patsopanibin annos tulee ottaa tyhjään vatsaan kerran päivässä illalla yhdessä protonipumpun estäjän kanssa. Jos H2-reseptoriantagonistin samanaikainen käyttö on lääketieteellisesti välttämätöntä, patsopanibi tulee ottaa tyhjään vatsaan vähintään 2 tuntia ennen tai vähintään 10 tuntia H2-resptorin oton jälkeen. Patsopanibi pitää ottaa vähintään 1 tunti ennen tai 2 tuntia lyhytvaikutteisen antasidin oton jälkeen. Suositukset protonipumpun estäjien ja H2-reseptoriantagonistien samanaikaisesta käytöstä patsopanibin kanssa perustuvat fysiologiseen pohdintaan.
Raskaus ja imetys
Raskaus/ Ehkäisy miehillä ja naisilla
Patsopanibin käytöstä raskaana olevilla naisilla ei ole riittävästi tietoa. Eläinkokeissa on ilmennyt lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Mahdollista vaaraa ihmisille ei tunneta.
Patsopanibia ei pidä käyttää raskauden aikana, paitsi jos naisen kliininen tila vaatii patsopanibihoitoa. Jos patsopanibia käytetään raskauden aikana tai jos potilas tulee raskaaksi patsopanibin käytön aikana, hänelle on kerrottava mahdollisesta sikiöön kohdistuvasta vaarasta.
Hedelmällisessä iässä olevia naisia on kehotettava käyttämään tehokkaita ehkäisymenetelmiä hoidon aikana ja vähintään 2 viikon ajan viimeisen patsopanibiannoksen jälkeen ja välttämään raskaaksi tulemista patsopanibihoidon aikana.
Miespotilaiden (mukaan lukien potilaat, joille on tehty vasektomia) on käytettävä sukupuoliyhdynnässä kondomia patsopanibihoidon aikana ja vähintään 2 viikon ajan viimeisen patsopanibiannoksen jälkeen välttääkseen raskaana olevien ja hedelmällisessä iässä olevien kumppaneiden mahdollista altistumista lääkevalmisteelle.
Imetys
Patsopanibin turvallisuutta imetyksen aikana ei ole osoitettu. Patsopanibin tai sen metaboliittien erittymisestä äidinmaitoon ei ole tietoa. Patsopanibin erittymistä imettävän eläimen maitoon ei ole tutkittu. Äidinmaitoa saavaan lapseen kohdistuvaa riskiä ei voida sulkea pois. Imettäminen on keskeytettävä patsopanibihoidon ajaksi.
Hedelmällisyys
Eläinkoetulokset viittaavat siihen, että patsopanibihoito saattaa vaikuttaa miesten ja naisten hedelmällisyyteen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Votrient-valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn. Patsopanibin farmakologisten ominaisuuksien perusteella ei voida ennustaa, että lääke vaikuttaisi näihin toimintoihin haitallisesti. Potilaan kliininen tila ja patsopanibin haittavaikutukset on otettava huomioon arvioitaessa potilaan kykyä suoriutua harkintaa tai motorisia tai kognitiivisia taitoja vaativista tehtävistä. Potilaiden tulee välttää autolla-ajoa ja koneiden käyttöä, jos heillä on huimausta tai jos he tuntevat itsensä väsyneiksi tai heikoiksi.
Haittavaikutukset
Haittavaikutusten yhteenveto
Yleisarvio patsopanibin turvallisuudesta ja siedettävyydestä munuaissyöpäpotilaiden hoidossa perustui keskeisen munuaissyöpätutkimuksen (VEG105192, n=290), jatkotutkimuksen (VEG107769, n=71), näitä tukevan vaiheen II tutkimuksen (VEG102616, n=225) ja satunnaistetun, avoimen, vertailukelpoisuutta (non-inferiority) osoittavan, rinnakkaisen vaiheen III tutkimuksen (VEG108844, n=557) yhdistettyihin tietoihin (yhteensä n=1149) (ks. kohta Farmakodynamiikka).
Yhdistetyt tiedot keskeisestä pehmytkudossarkoomatutkimuksesta (VEG110727, n=369) ja tukevasta vaiheen II tutkimuksesta (VEG20002, n=142) arvioitiin patsopanibin turvallisuuden ja siedettävyyden kokonaisarvioinnissa (turvallisuutta koskeva kokonaisjoukko n=382) pehmytkudossarkoomapotilailla (ks. kohta Farmakodynamiikka).
Tärkeimmät hoitoon liittyvät vakavat haittavaikutukset, jotka todettiin munuaissyöpä- tai pehmytkudossarkoomatutkimuksissa, olivat ohimenevä aivoverenkierron häiriö, iskeeminen aivohalvaus, sydänlihasiskemia, sydäninfarkti ja aivoinfarkti, sydämen toimintahäiriö, maha-suolikanavan perforaatio ja fisteli, QT-ajan pidentyminen, kääntyvien kärkien takykardia (torsades de pointes) sekä keuhkoverenvuoto, maha-suolikanavan verenvuoto ja aivoverenvuoto. Näitä kaikkia haittavaikutuksia raportoitiin alle yhdellä prosentilla hoitoa saaneista potilasta. Muita pehmytkudossarkoomatutkimuksissa todettuja tärkeitä vakavia haittavaikutuksia olivat laskimoveritukokset, vasemman kammion toimintahäiriö ja pneumothorax.
Kuolemaan johtaneet tapahtumat, joiden katsottiin liittyneen mahdollisesti patsopanibiin, olivat maha-suolikanavan verenvuoto, keuhkoverenvuoto/veriyskä, maksan toimintahäiriö, suoliston perforaatio ja iskeeminen aivohalvaus.
Yleisimmät haittavaikutukset (ilmeni vähintään 10 prosentilla potilaista), kaikki vaikeusasteet mukaan luettuina munuaissyöpä- ja pehmytkudossarkoomatutkimuksissa, olivat: ripuli, hiusten värimuutokset, ihon hypopigmentaatio, hilseilevä ihottuma, hypertensio, pahoinvointi, päänsärky, väsymys, ruokahaluttomuus, oksentelu, makuhäiriö, stomatiitti, painon lasku, kipu, kohonnut alaniiniaminotransferaasiarvo ja kohonnut aspartaattiaminotransferaasiarvo.
Alla luetellaan MedDRA-elinjärjestelmän, yleisyyden ja vaikeusasteen mukaan ne haittavaikutukset, joita raportoitiin munuaissyöpä- ja pehmytkudossarkoomapotilailla tai markkinoille tulon jälkeisessä seurannassa, kaikki vaikeusasteet mukaan luettuina. Yleisyysluokituksessa on noudatettu seuraavaa käytäntöä: hyvin yleinen (≥ 1/10); yleinen (≥ 1/100, < 1/10); melko harvinainen (≥ 1/1 000, < 1/100); harvinainen (≥ 1/10 000, < 1/1 000); hyvin harvinainen (< 1/10 000); ja tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
Jako yleisyysluokkiin perustuu kliinisistä tutkimuksista saatuihin absoluuttisiin esiintymistiheyksiin. Arvio perustuu myös niihin tietoihin, joita on saatu patsopanibin markkinoille tulon jälkeisessä turvallisuus- ja tehoseurannassa kaikista kliinisistä tutkimuksista tai spontaanisti. Haittavaikutukset, joiden esiintymistiheys on sama, on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Luettelo haittavaikutuksista
Taulukko 2 Hoitoon liittyvät haittavaikutukset, joita on raportoitu munuaissyöpätutkimuksissa (n = 1149) tai markkinoille tulon jälkeisessä seurannassa
Elinjärjestelmä | Yleisyys (kaikki vaikeusasteet) | Haittavaikutukset | Kaikki vaikeus-asteet n (%) | Vaikeus-aste 3 n (%) | Vaikeus-aste 4 n (%) |
Infektiot | Yleiset | Infektiot (joihin on voinut liittyä neutropeniaa)† | tuntematon | tuntematon | tuntematon |
Melko harvinaiset | Ientulehdus | 1 (< 1 %) | 0 | 0 | |
Vatsakalvotulehdus | 1 (< 1 %) | 0 | 0 | ||
Hyvän- ja pahanlaatuiset sekä määrittelemättömät kasvaimet (mukaan lukien kystat ja polyypit) | Melko harvinaiset | Tuumorikipu | 1 (< 1 %) | 1 (< 1 %) | 0 |
Veri ja imukudos | Yleiset | Trombosytopenia | 80 (7 %) | 10 (< 1 %) | 5 (< 1 %) |
Neutropenia | 79 (7 %) | 20 (2 %) | 4 (< 1 %) | ||
Leukopenia | 63 (5 %) | 5 (< 1 %) | 0 | ||
Melko harvinaiset | Polysytemia | 6 (0,03 %) | 1 | 0 | |
Harvinaiset | Tromboottinen mikroangiopatia (mukaan lukien tromboottinen trombosytopeeninen purppura ja hemolyyttis- ureeminen syndrooma) † | tuntematon | tuntematon | tuntematon | |
Umpieritys | Yleiset | Hypotyreoosi | 83 (7 %) | 1 (< 1 %) | 0 |
Aineenvaihdunta ja ravitsemus | Hyvin yleiset | Heikentynyt ruokahalue | 317 (28 %) | 14 (1 %) | 0 |
Yleiset | Hypofosfatemia | 21 (2 %) | 7 (< 1 %) | 0 | |
Dehydraatio | 16 (1 %) | 5 (< 1 %) | 0 | ||
Melko harvinaiset | Hypomagnesemia | 10 (< 1 %) | 0 | 0 | |
Tuntematon | Tuumorilyysioireyhtymä* | tuntematon | tuntematon | tuntematon | |
Psyykkiset häiriöt | Yleiset | Unettomuus | 30 (3 %) | 0 | 0 |
Hermosto | Hyvin yleiset | Makuhäiriöc | 254 (22 %) | 1 (< 1 %) | 0 |
Päänsärky | 122 (11 %) | 11 (< 1 %) | 0 | ||
Yleiset | Huimaus | 55 (5 %) | 3 (< 1 %) | 1 (< 1 %) | |
Letargia | 30 (3 %) | 3 (< 1 %) | 0 | ||
Parestesia | 20 (2 %) | 2 (< 1 %) | 0 | ||
Perifeerinen sensorinen neuropatia | 17 (1 %) | 0 | 0 | ||
Melko harvinaiset | Hypoestesia | 8 (< 1 %) | 0 | 0 | |
Ohimenevä aivoverenkierron häiriö (TIA) | 7 (< 1 %) | 4 (< 1 %) | 0 | ||
Uneliaisuus | 3 (< 1 %) | 1 (< 1 %) | 0 | ||
Aivoverisuonistoon liittyvä tapahtuma | 2 (< 1 %) | 1 (< 1 %) | 1 (< 1 %) | ||
Iskeeminen aivohalvaus | 2 (< 1 %) | 0 | 1 (< 1 %) | ||
Harvinaiset | Posteriorinen reversiibeli enkefalopatiasyndrooma/ reversiibeli posteriorinen leukoenkefalopatia syndrooma. † | tuntematon | tuntematon | tuntematon | |
Silmät | Yleiset | Näön hämärtyminen | 19 (2 %) | 1 (< 1 %) | 0 |
Melko harvinaiset | Verkkokalvon irtoaminen† | 1 (< 1 %) | 1 (< 1 %) | 0 | |
Verkkokalvon repeytyminen† | 1 (< 1 %) | 1 (< 1 %) | 0 | ||
Silmäripsien värimuutokset | 4 (< 1 %) | 0 | 0 | ||
Sydän | Melko harvinaiset | Bradykardia | 6 (< 1 %) | 0 | 0 |
Sydäninfarkti | 5 (< 1 %) | 1 (< 1 %) | 4 (< 1 %) | ||
Sydämen toimintahäiriö f | 4 (< 1 %) | 1 (< 1 %) | 0 | ||
Sydänlihaksen iskemia | 3 (< 1 %) | 1 (< 1 %) | 0 | ||
Verisuonisto | Hyvin yleiset | Hypertensio | 473 (41 %) | 115 (10 %) | 1 (< 1 %) |
Yleiset | Kuumat aallot | 16 (1 %) | 0 | 0 | |
Laskimoveritulppatapahtumag | 13 (1 %) | 6 (< 1 %) | 7 (< 1 %) | ||
Punastuminen | 12 (1 %) | 0 | 0 | ||
Melko harvinaiset | Hypertensiivinen kriisi | 6 (< 1 %) | 0 | 2 (< 1 %) | |
Verenvuoto | 1 (< 1 %) | 0 | 0 | ||
Harvinaiset | Aneurysmat ja valtimon dissekaatiot† | tuntematon | tuntematon | tuntematon | |
Hengityselimet, rintakehä ja välikarsina | Yleiset | Nenäverenvuoto | 50 (4 %) | 1 (< 1 %) | 0 |
Dysfonia | 48 (4 %) | 0 | 0 | ||
Dyspnea | 42 (4 %) | 8 (< 1 %) | 1 (< 1 %) | ||
Veriyskä | 15 (1 %) | 1 (< 1 %) | 0 | ||
Melko harvinaiset | Rinorrea | 8 (< 1 %) | 0 | 0 | |
Keuhkoverenvuoto | 2 (< 1 %) | 0 | 0 | ||
Pneumothorax | 1 (< 1 %) | 0 | 0 | ||
Harvinaiset | Interstitiaalinen keuhkosairaus/ pneumoniitti† | tuntematon | tuntematon | tuntematon | |
Ruoansulatuselimistö | Hyvin yleiset | Ripuli | 614 (53 %) | 65 (6 %) | 2 (< 1 %) |
Pahoinvointi | 386 (34 %) | 14 (1%) | 0 | ||
Oksentelu | 225 (20 %) | 18 (2 %) | 1 (< 1 %) | ||
Vatsakipua | 139 (12 %) | 15 (1 %) | 0 | ||
Yleiset | Stomatiitti | 96 (8 %) | 4 (< 1 %) | 0 | |
Dyspepsia | 83 (7 %) | 2 (< 1 %) | 0 | ||
Ilmavaivat | 43 (4 %) | 0 | 0 | ||
Vatsan pingotus | 36 (3 %) | 2 (< 1 %) | 0 | ||
Suun haavat | 28 (2 %) | 3 (< 1 %) | 0 | ||
Suun kuivuminen | 27 (2 %) | 0 | 0 | ||
Melko harvinaiset | Haimatulehdus | 8 (< 1 %) | 4 (< 1 %) | 0 | |
Peräsuolen verenvuoto | 8 (< 1 %) | 2 (< 1 %) | 0 | ||
Veriuloste | 6 (< 1 %) | 0 | 0 | ||
Maha-suolikanavan verenvuoto | 4 (< 1 %) | 2 (< 1 %) | 0 | ||
Meleena | 4 (< 1 %) | 1(< 1 %) | 0 | ||
Suolen liikaliikehdintä | 3 (< 1 %) | 0 | 0 | ||
Peräaukon verenvuoto | 2 (< 1 %) | 0 | 0 | ||
Paksusuolen perforaatio | 2 (< 1 %) | 1 (< 1 %) | 0 | ||
Suun verenvuoto | 2 (< 1 %) | 0 | 0 | ||
Maha-suolikanavan yläosan verenvuoto | 2 (< 1 %) | 1 (< 1 %) | 0 | ||
Enterokutaaninen fisteli | 1 (< 1 %) | 0 | 0 | ||
Verioksennus | 1 (< 1 %) | 0 | 0 | ||
Peräpukamien verenvuoto | 1 (< 1 %) | 0 | 0 | ||
Ileaalinen perforaatio | 1 (< 1 %) | 0 | 1 (< 1 %) | ||
Ruokatorven verenvuoto | 1 (< 1 %) | 0 | 0 | ||
Retroperitoneaalinen verenvuoto | 1 (< 1 %) | 0 | 0 | ||
Maksa ja sappi | Yleiset | Hyperbilirubinemia | 38 (3 %) | 2 (< 1 %) | 1 (< 1 %) |
Maksan toimintahäiriö | 29 (3 %) | 13 (1 %) | 2 (< 1 %) | ||
Maksatoksisuus | 18 (2 %) | 11(< 1 %) | 2 (< 1 %) | ||
Melko harvinaiset | Keltaisuus | 3 (< 1 %) | 1 (< 1 %) | 0 | |
Lääkkeen aiheuttama maksavaurio | 2 (< 1 %) | 2 (< 1 %) | 0 | ||
Maksan vajaatoiminta† | 1 (< 1 %) | 0 | 1 (< 1 %) | ||
Iho ja ihonalainen kudos | Hyvin yleiset | Hiusten värimuutokset | 404 (35 %) | 1 (< 1 %) | 0 |
Kämmenten ja jalkapohjien erytrodysestesia | 206 (18 %) | 39 (3 %) | 0 | ||
Hiustenlähtö | 130 (11 %) | 0 | 0 | ||
Ihottuma | 129 (11 %) | 7 (< 1 %) | 0 | ||
Yleiset | Ihon hypopigmentaatio | 52 (5 %) | 0 | 0 | |
Kuiva iho | 50 (4 %) | 0 | 0 | ||
Kutina | 29 (3 %) | 0 | 0 | ||
Punoitus | 25 (2 %) | 0 | 0 | ||
Ihon depigmentaatio | 20 (2 %) | 0 | 0 | ||
Voimakas hikoilu | 17 (1 %) | 0 | 0 | ||
Melko harvinaiset | Kynsiongelmat | 11 (< 1 %) | 0 | 0 | |
Ihon hilseily | 10 (< 1 %) | 0 | 0 | ||
Herkistyminen valolle | 7 (< 1 %) | 0 | 0 | ||
Punoittava ihottuma | 6 (< 1 %) | 0 | 0 | ||
Iho-ongelmat | 5 (< 1 %) | 0 | 0 | ||
Makulaarinen ihottuma | 4 (< 1 %) | 0 | 0 | ||
Kutiseva ihottuma | 3 (< 1 %) | 0 | 0 | ||
Vesikulaarinen ihottuma | 3 (< 1 %) | 0 | 0 | ||
Laajalle levinnyt kutina | 2 (< 1 %) | 1 (< 1 %) | 0 | ||
Laajalle levinnyt ihottuma | 2 (< 1 %) | 0 | 0 | ||
Papulaarinen ihottuma | 2 (< 1 %) | 0 | 0 | ||
Jalkapohjien punoitus | 1 (< 1 %) | 0 | 0 | ||
Ihohaava† | tuntematon | tuntematon | tuntematon | ||
Luusto, lihakset ja sidekudos | Yleiset | Nivelkipu | 48 (4 %) | 8 (< 1 %) | 0 |
Lihaskipu | 35 (3 %) | 2 (< 1 %) | 0 | ||
Lihaskouristukset | 25 (2 %) | 0 | 0 | ||
Melko harvinaiset | Luustoon ja lihaksiin liittyvä kipu | 9 (< 1 %) | 1 (< 1 %) | 0 | |
Munuaiset ja virtsatiet | Hyvin yleiset | Proteinuria | 135 (12 %) | 32 (3 %) | 0 |
Melko harvinaiset | Virtsateiden verenvuoto | 1 (< 1 %) | 0 | 0 | |
Sukupuolielimet ja rinnat | Melko harvinaiset | Runsaat kuukautiset | 3 (< 1 %) | 0 | 0 |
Emättimen verenvuoto | 3 (< 1 %) | 0 | 0 | ||
Epäsäännölliset kuukautiset | 1 (< 1 %) | 0 | 0 | ||
Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleiset | Väsymys | 415 (36 %) | 65 (6 %) | 1 (< 1 %) |
Yleiset | Limakalvotulehdus | 86 (7 %) | 5 (< 1 %) | 0 | |
Voimattomuus | 82 (7 %) | 20 (2 %) | 1 (< 1 %) | ||
Turvotusb | 72 (6 %) | 1 (< 1 %) | 0 | ||
Rintakipu | 18 (2 %) | 2 (< 1 %) | 0 | ||
Melko harvinaiset | Vilunväristykset | 4 (< 1 %) | 0 | 0 | |
Limakalvon häiriö | 1 (< 1 %) | 0 | 0 | ||
Tutkimukset | Hyvin yleiset | Kohonnut alaniini aminotransferaasiarvo | 246 (21 %) | 84 (7 %) | 14 (1 %) |
Kohonnut aspartaattiaminotransferaasiarvo | 211 (18 %) | 51 (4 %) | 10 (< 1 %) | ||
Yleiset | Painon lasku | 96 (8 %) | 7 (< 1 %) | 0 | |
Kohonnut bilirubiiniarvo | 61 (5 %) | 6 (< 1 %) | 1 (< 1 %) | ||
Kohonnut kreatiniiniarvo | 55 (5 %) | 3 (< 1 %) | 0 | ||
Kohonnut lipaasiarvo | 51 (4 %) | 21 (2 %) | 7 (< 1 %) | ||
Pienentynyt veren valkosolujen määräd | 51 (4 %) | 3 (< 1 %) | 0 | ||
Kohonnut TSH‑arvo | 36 (3 %) | 0 | 0 | ||
Kohonnut amylaasi | 35 (3 %) | 7 (< 1 %) | 0 | ||
Kohonnut gamma-glutamyylitransferaasiarvo | 31 (3 %) | 9 (< 1 %) | 4 (< 1 %) | ||
Kohonnut verenpaine | 15 (1 %) | 2 (< 1 %) | 0 | ||
Kohonnut veren urea-arvo | 12 (1 %) | 1 (< 1 %) | 0 | ||
Epänormaalit maksan toimintakokeet | 12 (1 %) | 6 (< 1 %) | 1 (< 1 %) | ||
Melko harvinaiset | Kohonneet maksaentsyymiarvot | 11 (< 1 %) | 4 (< 1 %) | 3 (< 1 %) | |
Pienentynyt veren sokeriarvo | 7 (< 1 %) | 0 | 1 (< 1 %) | ||
EKG:n QT-ajan pidentyminen | 7 (< 1 %) | 2 (< 1 %) | 0 | ||
Transaminaasien nousu | 7 (< 1 %) | 1 (< 1 %) | 0 | ||
Epänormaalit kilpirauhasen toimintakokeet | 3 (< 1 %) | 0 | 0 | ||
Kohonnut diastolinen verenpaine | 2 (< 1 %) | 0 | 0 | ||
Kohonnut systolinen verenpaine | 1 (< 1 %) | 0 | 0 | ||
† Hoitoon liittyvät haittavaikutukset, joita on raportoitu markkinoille tulon jälkeisessä seurannassa (spontaanit raportit ja vakavat haittavaikutukset kaikista patsopanibin kliinisistä tutkimuksista) * Hoitoon liittyvät haittavaikutukset, joita on raportoitu vain markkinoille tulon jälkeisessä seurannassa. Saatavissa oleva tieto ei riitä esiintyvyyden arviointiin. Seuraavat käsitteet on yhdistetty: a Vatsakipu, ylävatsakipu, alavatsakipu b Turvotus, perifeerinen turvotus, silmäturvotus, paikallinen turvotus ja kasvojen turvotus c Makuhäiriö, makuaistin puute, makuaistin vajavuus d Valkosolujen, neutrofiilien ja leukosyyttien määrän väheneminen e Vähentynyt ruokahalu ja ruokahaluttomuus f Sydämen toimintahäiriö, vasemman kammion toimintahäiriö, sydämen vajaatoiminta ja restriktiivinen kardiomyopatia g Laskimotukostapahtumat, syvä laskimotromboosi, keuhkoembolia ja tromboosit | |||||
Neutropeniaa, trombosytopeniaa ja kämmenten- ja jalkapohjien erytrodysestesiaa havaittiin useammin potilailla, jotka olivat itäaasialaista alkuperää.
Taulukko 3 Pehmytkudossarkoomatutkimuksissa (n = 382) tai markkinoille tulon jälkeisessä seurannassa raportoidut hoitoon liittyvät haittavaikutukset
Elinjärjestelmä | Yleisyys (kaikki vaikeusasteet) | Haittavaikutukset | Kaikki vaikeus-asteet n (%) | Vaikeus-aste 3 n (%) | Vaikeus-aste 4 n (%) |
Infektiot | Yleiset | Ientulehdus | 4 (1 %) | 0 | 0 |
Hyvän- ja pahanlaatuiset sekä määrittelemättömät kasvaimet (mukaan lukien kystat ja polyypit) | Hyvin yleiset | Tuumorikipu | 121 (32 %) | 32 (8 %) | 0 |
Veri ja imukudosf | Hyvin yleiset | Leukopenia | 106 (44 %) | 3 (1 %) | 0 |
Trombosytopenia | 86 (36 %) | 7 (3 %) | 2 (< 1 %) | ||
Neutropenia | 79 (33 %) | 10 (4 %) | 0 | ||
Melko harvinaiset | Tromboottinen mikroangiopatia (mukaan lukien tromboottinen trombosytopeeninen purppura ja hemolyyttis-ureeminen oireyhtymä)† | 1 (< 1 %) | 1 (< 1 %) | 0 | |
Umpieritys | Yleiset | Hypotyreoosi | 18 (5 %) | 0 | 0 |
Aineenvaihdunta ja ravitsemus | Hyvin yleiset | Heikentynyt ruokahalu | 108 (28 %) | 12 (3 %) | 0 |
Hypoalbuminemiaf | 81 (34 %) | 2 (< 1 %) | 0 | ||
Yleiset | Dehydraatio | 4 (1 %) | 2 (1 %) | 0 | |
Melko harvinaiset | Hypomagnesemia | 1 (< 1 %) | 0 | 0 | |
Tuntematon | Tuumorilyysioireyhtymä* | tuntematon | tuntematon | tuntematon | |
Psyykkiset häiriöt | Yleiset | Unettomuus | 5 (1 %) | 1 (< 1 %) | 0 |
Hermosto | Hyvin yleiset | Makuhäiriö | 79 (21 %) | 0 | 0 |
Päänsärky | 54 (14 %) | 2 (< 1 %) | 0 | ||
Yleiset | Perifeerinen sensorinen neuropatia | 30 (8 %) | 1 (< 1 %) | 0 | |
Huimaus | 15 (4 %) | 0 | 0 | ||
Melko harvinaiset | Unettomuus | 3 (< 1 %) | 0 | 0 | |
Tuntoharha | 1 (< 1 %) | 0 | 0 | ||
Aivoinfarkti | 1 (< 1 %) | 0 | 1 (< 1 %) | ||
Silmät | Yleiset | Näön hämärtyminen | 15 (4 %) | 0 | 0 |
Sydän | Yleiset | Sydämen toimintahäiriög | 21 (5 %) | 3 (< 1 %) | 1 (< 1 %) |
Vasemman kammion toimintahäiriö | 13 (3 %) | 3 (< 1 %) | 0 | ||
Bradykardia | 4 (1 %) | 0 | 0 | ||
Melko harvinaiset | Sydäninfarkti | 1 (< 1 %) | 0 | 0 | |
Verisuonisto | Hyvin yleiset | Hypertensio | 152 (40 %) | 26 (7 %) | 0 |
Yleiset | Laskimotukostapahtumatd | 13 (3 %) | 4 (1 %) | 5 (1 %) | |
Kuumat aallot | 12 (3 %) | 0 | 0 | ||
Punastuminen | 4 (1 %) | 0 | 0 | ||
Melko harvinaiset | Verenvuoto | 2 (< 1 %) | 1 (< 1 %) | 0 | |
Harvinaiset | Aneurysmat ja valtimon dissekaatiot | tuntematon | tuntematon | tuntematon | |
Hengityselimet, rintakehä ja välikarsina | Yleiset | Nenäverenvuoto | 22 (6 %) | 0 | 0 |
Ääntöhäiriö | 20 (5 %) | 0 | 0 | ||
Hengenahdistus | 14 (4 %) | 3 (< 1 %) | 0 | ||
Yskä | 12 (3 %) | 0 | 0 | ||
Pneumothorax | 7 (2 %) | 2 (< 1 %) | 1 (< 1 %) | ||
Hikka | 4 (1 %) | 0 | 0 | ||
Keuhkoverenvuoto | 4 (1 %) | 1 (< 1 %) | 0 | ||
Melko harvinaiset | Suunielukipu | 3 (< 1 %) | 0 | 0 | |
Keuhkoputkien verenvuoto | 2 (< 1 %) | 0 | 0 | ||
Voimakas nuha | 1 (< 1 %) | 0 | 0 | ||
Veriyskä | 1 (< 1 %) | 0 | 0 | ||
Harvinaiset | Interstitiaalinen keuhkosairaus/ pneumoniitti† | tuntematon | tuntematon | tuntematon | |
Ruoansulatuselimistö | Hyvin yleiset | Ripuli | 174 (46 %) | 17 (4 %) | 0 |
Pahoinvointi | 167 (44 %) | 8 (2 %) | 0 | ||
Oksentelu | 96 (25 %) | 7 (2 %) | 0 | ||
Vatsakipua | 55 (14 %) | 4 (1 %) | 0 | ||
Stomatiitti | 41 (11 %) | 1 (< 1 %) | 0 | ||
Yleiset | Vatsan pingotus | 16 (4 %) | 2 (1 %) | 0 | |
Suun kuivuminen | 14 (4 %) | 0 | 0 | ||
Ruoansulatushäiriö | 12 (3 %) | 0 | 0 | ||
Suun verenvuoto | 5 (1 %) | 0 | 0 | ||
Ilmavaivat | 5 (1 %) | 0 | 0 | ||
Peräaukon verenvuoto | 4 (1 %) | 0 | 0 | ||
Melko harvinaiset | Maha-suolikanavan verenvuoto | 2 (< 1 %) | 0 | 0 | |
Peräsuolen verenvuoto | 2 (< 1 %) | 0 | 0 | ||
Enterokutaaninen fistula | 1 (< 1 %) | 1 (< 1 %) | 0 | ||
Mahan verenvuoto | 1 (< 1 %) | 0 | 0 | ||
Meleena | 2 (< 1 %) | 0 | 0 | ||
Ruokatorven verenvuoto | 1 (< 1 %) | 0 | 1 (< 1 % | ||
Vatsakalvotulehdus | 1 (< 1 %) | 0 | 0 | ||
Vatsakalvon takainen verenvuoto | 1 (< 1 %) | 0 | 0 | ||
Maha-suolikanavan yläosan verenvuoto | 1 (< 1 %) | 1 (< 1 %) | 0 | ||
Ileaalinen perforaatio | 1 (< 1 %) | 0 | 1 (< 1 % | ||
Maksa ja sappi | Melko harvinaiset | Maksan toimintahäiriö | 2 (< 1 %) | 0 | 1 (< 1 % |
Tuntematon | Maksan vajaatoiminta* | tuntematon | tuntematon | tuntematon | |
Iho ja ihonalainen kudos | Hyvin yleiset | Hiusten värimuutokset | 93 (24 %) | 0 | 0 |
Ihon hypopigmentaatio | 80 (21 %) | 0 | 0 | ||
Hilseilevä ihottuma | 52 (14 %) | 2 (< 1 %) | 0 | ||
Yleiset | Hiustenlähtö | 30 (8 %) | 0 | 0 | |
Iho-ongelmatc | 26 (7 %) | 4 (1 %) | 0 | ||
Kuiva iho | 21 (5 %) | 0 | 0 | ||
Hyperhydroosi | 18 (5 %) | 0 | 0 | ||
Kynsiongelmat | 13 (3 %) | 0 | 0 | ||
Kutina | 11 (3 %) | 0 | 0 | ||
Punoitus | 4 (1 %) | 0 | 0 | ||
Melko harvinaiset | Ihohaavat | 3 (< 1 %) | 1 (< 1 %) | 0 | |
Ihottuma | 1 (< 1 %) | 0 | 0 | ||
Papulaarinen ihottuma | 1 (< 1 %) | 0 | 0 | ||
Herkistyminen valolle | 1 (< 1 %) | 0 | 0 | ||
Kämmenten ja jalkapohjien erytrodysestesia | 2 (<1 %) | 0 | 0 | ||
Luusto, lihakset ja sidekudos | Yleiset | Luustoon ja lihaksiin liittyvä kipu | 35 (9 %) | 2 (< 1 %) | 0 |
Lihaskipu | 28 (7 %) | 2 (< 1 %) | 0 | ||
Lihaskouristukset | 8 (2 %) | 0 | 0 | ||
Melko harvinaiset | Nivelkipu | 2 (< 1 %) | 0 | 0 | |
Munuaiset ja virtsatiet | Melko harvinaiset | Proteinuria | 2 (<1 %) | 0 | 0 |
Sukupuolielimet ja rinnat | Melko harvinaiset | Emättimen verenvuoto | 3 (< 1 %) | 0 | 0 |
Runsaat kuukautiset | 1 (< 1 %) | 0 | 0 | ||
Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleiset | Väsymys | 178 (47 %) | 34 (9 %) | 1 (< 1 %) |
Yleiset | Turvotusb | 18 (5 %) | 1 (< 1 %) | 0 | |
Rintakipu | 12 (3 %) | 4 (1 %) | 0 | ||
Vilunväristykset | 10 (3 %) | 0 | 0 | ||
Melko harvinaiset | Limakalvotulehdus e | 1 (<1 %) | 0 | 0 | |
Voimattomuus | 1 (< 1 % | 0 | 0 | ||
Tutkimukseth | Hyvin yleiset | Painon lasku | 86 (23 %) | 5 (1 %) | 0 |
Yleiset | Korvan, nenän ja kurkun epänormaalit löydöksete | 29 (8 %) | 4 (1 %) | 0 | |
Kohonnut alaniiniaminotrans-feraasiarvo | 8 (2 %) | 4 (1 %) | 2 (< 1 %) | ||
Epänormaali veren kolesteroli | 6 (2 %) | 0 | 0 | ||
Kohonnut aspartaattiaminotransferaasiarvo | 5 (1 %) | 2 (< 1 %) | 2 (< 1 %) | ||
Kohonnut gammaglutamyylitransferaasiarvo | 4 (1 %) | 0 | 3 (< 1 %) | ||
Melko harvinaiset | Kohonnut veren bilirubiiniarvo | 2 (<1 %) | 0 | 0 | |
Aspartaattiaminotransferaasi | 2 (< 1 %) | 0 | 2 (< 1 %) | ||
Alaniiniaminotransferaasi | 1 (< 1 %) | 0 | 1 (< 1 %) | ||
Verihiutaleiden määrän lasku | 1 (< 1 %) | 0 | 1 (< 1 %) | ||
EKG:n QT-ajan pidentyminen | 2 (< 1 %) | 1 (< 1 %) | 0 | ||
† Hoitoon liittyvät haittavaikutukset, joita on raportoitu markkinoille tulon jälkeisessä seurannassa (spontaanit raportit ja vakavat haittavaikutukset kaikista patsopanibin kliinisistä tutkimuksista). * Hoitoon liittyvät haittavaikutukset, joita on raportoitu vain markkinoille tulon jälkeisessä seurannassa. Saatavissa oleva tieto ei riitä esiintyvyyden arviointiin. Seuraavat käsitteet on yhdistetty: a Vatsakipu, ylävatsakipu, maha-suolikanavan kipu b Turvotus, perifeerinen turvotus, silmäluomien turvotus c Tapaukset olivat pääasiassa kämmenten ja jalkapohjien erytrodysestesiasyndroomaa d Laskimotukostapahtumat – pitää sisällään syvän laskimotromboosin, keuhkoembolian ja tromboottiset tapahtumat e Tapaukset kuvaavat pääasiassa mukosiittia f Frekvenssit perustuvat laboratorioarvotaulukkoihin tutkimuksesta VEG110727 (N=240). Tutkijat raportoivat näitä harvemmin haittatapahtumina kuin mitä oli kirjattu laboratorioarvotaulukkoihin. g Sydämen toimintahäiriötapahtumat – pitää sisällään vasemman kammion toiminnanhäiriön, sydämen vajaatoiminnan ja restriktiivisen kardiomyopatian. h Frekvenssit perustuvat tutkijoiden raportoimiin haittatapahtumiin. Tutkijat raportoivat epänormaaleja laboratorioarvoja haittatapahtumina harvemmin kuin mitä oli kirjattu laboratorioarvotaulukkoihin. | |||||
Neutropeniaa, trombosytopeniaa ja kämmenten- ja jalkapohjien erytrodysestesiaa havaittiin useammin potilailla, jotka olivat itäaasialaista alkuperää.
Pediatriset potilaat
Turvallisuusprofiili oli pediatrisilla potilailla samankaltainen kuin patsopanibin ilmoitettu turvallisuusprofiili hyväksytyissä käyttöaiheissa aikuisilla. Tiedot perustuivat 44 pediatriseen potilaaseen vaiheen I tutkimuksessa ADVL0815 ja 57 pediatriseen potilaaseen vaiheen II tutkimuksessa PZP034X2203 (ks. kohta Farmakodynamiikka).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty‑haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Kliinisissä tutkimuksissa on arvioitu enintään 2 000 mg patsopanibiannoksia.3. asteen väsymystä (annosta rajoittava toksisuus) ja 3. asteen hypertensiota havaittiin kumpaakin yhdellä potilaalla kolmesta annoksen ollessa 2 000 mg ja 1 000 mg vastaavasti.
Spesifistä vastalääkettä ei ole käytettävissä patsopanibin yliannostustapauksissa. Yliannostuksen hoidon tulee perustua yleisiin tukihoitotoimenpiteisiin.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Syöpälääkkeet, proteiinikinaasin estäjät, muut proteiinikinaasin estäjät, ATC-koodi: L01EX03
Vaikutusmekanismi
Patsopanibi on potentti, monikohteinen, suun kautta annettava verisuonten endoteelikasvutekijän reseptorin (VEGFR) tyyppien 1, 2 ja 3, verihiutalekasvutekijä (PDGFR) –alfan ja –beetan ja kantasolukasvutekijän reseptorin (c-KIT) tyrosiinikinaasiestäjä (TKI), jonka vastaavat IC50-arvot ovat 10, 30, 47, 71, 84 ja 74 nM. Prekliinisissä tutkimuksissa patsopanibi esti annoksesta riippuvasti ligandin aiheuttamaa VEGFR-2, c-Kit ja PDGFR-beeta-reseptorien autofosforylaatiota soluissa. In vivo patsopanibi esti VEGF:n aiheuttamaa VEGFR-2:n fosforylaatiota hiiren keuhkoissa, angiogeneesia eri eläinmalleissa ja useiden ihmisen kasvainten ksenograftien kasvua hiirissä.
Farmakogenomiikka
Farmakogeneettisessä meta-analyysissä tarkasteltiin tietoja 31 kliinisestä tutkimuksesta, joissa annosteltiin patsopanibia joko monoterapiana tai yhdessä muiden lääkkeiden kanssa. ALAT > 5 x ULN (NCI CTC luokka 3) ilmaantui 19 %:lle potilaista, joilla oli HLA-B*57:01 alleeli ja 10 %:lle potilaista, joilla tätä alleelia ei ollut. Tarkastelun kohteena olevissa tiedoissa 133 potilaalla (6 %) 2 235:sta oli HLA-B*57:01 alleeli (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Kliiniset tutkimukset
Munuaissyöpä
Patsopanibin turvallisuutta ja tehoa munuaissyövän hoidossa arvioitiin satunnaistetussa, kaksoissokkoutetussa plasebokontrolloidussa monikeskustutkimuksessa. Potilaat (n = 435), joilla oli paikallisesti levinnyt ja/tai metastasoitunut munuaissyöpä, saivat satunnaistetusti joko patsopanibia 800 mg kerran vuorokaudessa tai plaseboa. Tutkimuksen ensisijainen tavoite oli arvioida ja verrata potilaiden progressiovapaata elinaikaa (PFS) näissä kahdessa hoitohaarassa, ja tärkein toissijainen päätetapahtuma oli kokonaiselinaika (OS). Muita tavoitteita olivat kokonaisvasteen ja vasteen keston arvioiminen.
Tämän tutkimuksen yhteensä 435 potilaasta 233 ei ollut aikaisemmin saanut hoitoa ja 202 oli toisen linjan hoitoa saavia potilaita, jotka olivat saaneet aikaisemmin interleukiini 2:ta tai alfainterferonia. Toimintakyky (ECOG) oli patsopanibi- ja plaseboryhmässä samantasoinen (ECOG 0: 42 % vs. 41 %, ECOG 1: 58 % vs. 59 %). Suurimmalla osalla potilaista MSKCC (Memorial Sloan Kettering Cancer Centre) / Motzer-ennustetekijät olivat joko hyvät (39 %) tai kohtalaiset (54 %). Kaikilla potilailla oli kirkassoluinen histologia tai vallitsevasti kirkassoluinen histologia. Noin puolella kaikista potilaista tauti oli levinnyt vähintään kolmeen elimeen, ja lähtötilanteessa useimmilla potilailla oli taudin etäpesäkkeitä keuhkoissa (74 %) ja/tai imusolmukkeissa (54 %).
Kummassakin hoitohaarassa yhtä suuri osa potilaista oli aikaisemmin hoitamattomia ja aikaisemmin sytokiinihoitoa saaneita (53 % ja 47 % patsopanibihaarassa, 54 % ja 46 % plasebohaarassa). Aiemmin sytokiineja saaneiden potilaiden alaryhmässä suurin osa (75 %) oli saanut interferonipohjaista hoitoa.
Kummassakin haarassa niiden potilaiden osuus, joille oli aikaisemmin tehty nefrektomia (89 %:lle patsopanibi- ja 88 %:lle plaseboryhmän potilaista) ja/tai jotka olivat aikaisemmin saaneet sädehoitoa (22 % patsopanibi- ja 15 % plaseboryhmän potilaista) oli yhtä suuri.
Ensisijaisen päätetapahtuman, PFS:n, ensisijainen analyysi perustuu taudin riippumattomaan radiologiseen arviointiin koko tutkimusjoukossa (aikaisemmin hoitamattomat ja aikaisemmin sytokiinihoitoa saaneet).
Taulukko 4 Kokonaistehokkuutta kuvaavat tulokset munuaissyövässä riippumattoman arvioinnin perusteella (VEG105192)
Päätetapahtumat/Tutkimusjoukko | Patsopanibi | Plasebo | HR (95 % CI) | p-arvo (yksisuuntainen) |
PFS | ||||
Kokonais*‑ITT | (N = 290) | (N = 145) | ||
Mediaani (kuukautta) | 9,2 | 4,2 | 0,46 (0,34, 0,62) | <0,0000001 |
Vaste % | (N = 290) | (N = 145) | ||
(95 % CI) | 30 (25,1, 35,6) | 3 (0,5, 6,4) | – | <0,001 |
HR = hazard ratio = riskisuhde; ITT = intent to treat = hoitoaie; PFS = progression-free survival = progressiovapaa elinaika. *Aikaisemmin hoitamattomat ja aikaisemmin sytokiineilla hoidetut potilaat | ||||
Kuva 1 Kaplan–Meierin käyrä progressiovapaalle elinajalle (PFS) riippumattoman arvion perusteella koko potilasjoukossa (aikaisemmin hoitamattomat ja aikaisemmin sytokiineja saaneet potilaat) (VEG105192)
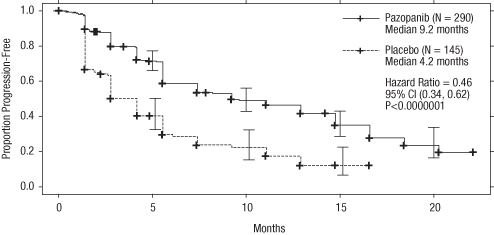
X-akseli; Kuukaudet, Y-akseli; Osuus potilaista, joilla tauti ei ollut edennyt - Patsopanibi (N=290) Mediaani 9,2 kuukautta; Plasebo (N=145) Mediaani 4,2 kuukautta; Riskisuhde = 0,46, 95 % CI (0,34, 0,62), P < 0,0000001
Kuva 2 Kaplan–Meierin käyrä progressiovapaalle elinajalle (PFS) riippumattoman arvion perusteella aikaisemmin hoitamattomien potilaiden ryhmässä (VEG105192)
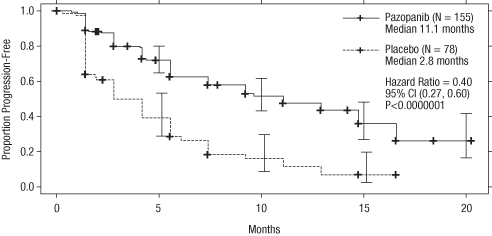
X-akseli; Kuukaudet, Y-akseli; Osuus potilaista, joilla tauti ei ollut edennyt - Patsopanibi (N=155) Mediaani 11,1 kuukautta; Plasebo (N=78) Mediaani 2,8 kuukautta; Riskisuhde = 0,40, 95 % CI (0,27, 0,60), P < 0,0000001
Kuva 3 Kaplan–Meierin käyrä progressiovapaalle elinajalle (PFS) riippumattoman arvion perusteella aikaisemmin sytokiineja saaneiden potilaiden ryhmässä (VEG105192)
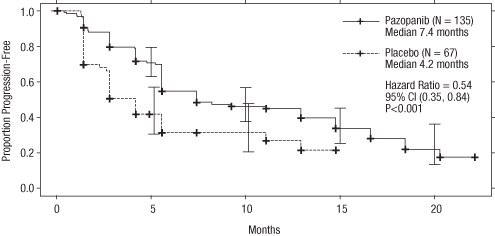
X-akseli; Kuukaudet, Y-akseli; Osuus potilaista, joilla tauti ei ollut edennyt - Patsopanibi (N=135) Mediaani 7,4 kuukautta; Plasebo (N=67) Mediaani 4,2 kuukautta; Riskisuhde = 0,54, 95 % CI (0,35, 0,84), P < 0,001
Riippumattoman arvioinnin mukaan hoitovasteen saavuttaneiden potilaiden ryhmässä aika vasteen saavuttamiseen oli 11,9 viikkoa (mediaani) ja vasteen kesto oli 58,7 viikkoa (mediaani). (VEG105192).
Tutkimussuunnitelman mukaisessa elinaika-analyysissä kokonaiselinaika (OS) oli 22,9 kuukautta (mediaaniarvo) patsopanibihaarassa ja 20,5 kuukautta (mediaaniarvo) plasebohaarassa [HR = 0,91 (95 % CI: 0,71, 1,16; p=0,224)]. Tuloksissa voi olla tilastollista harhaa, sillä tutkimusta seuranneessa jatkotutkimuksessa 54 % plaseboa saaneista potilaista sai myös patsopanibia taudin etenemisvaiheessa. Plaseboa saaneista potilaista 66 % sai hoitoa tutkimuksen loputtua. Vastaava luku oli 30 % patsopanibihaarassa.
Yleisessä elämänlaadussa ei havaittu eroja hoitoryhmien välillä EORTC QLQ-C30 ja EuroQoL EQ-5D-asteikoilla mitattuna.
Vaiheen II tutkimuksessa, johon osallistuneilla 225 potilaalla oli paikallisesti uusiutunut tai metastasoitunut munuaisten kirkassolukarsinooma, objektiivinen vaste oli 35 % ja vasteen keston mediaani 68 viikkoa riippumattoman arvioinnin perusteella. Progressiovapaan elinajan (PFS) mediaani oli 11,9 kuukautta.
Patsopanibin turvallisuutta, tehoa ja vaikutuksia elämänlaatuun verrattiin sunitinibiin satunnaistetussa, avoimessa, vertailukelpoisuutta (non-inferior) osoittavassa, rinnakkaisessa vaiheen III tutkimuksessa (VEG108844).
Tutkimuksessa VEG108844 potilaat (N=1 110), joilla oli paikallisesti edennyt ja/tai metastasoinut munuaissyöpä ja jotka eivät aikaisemmin olleet saaneet systeemistä hoitoa, satunnaistettiin saamaan joko patsopanibia 800 mg kerran päivässä jatkuvasti tai sunitinibia 50 mg kerran päivässä 6 viikon sykleissä, jotka koostuivat 4 viikon hoitojaksoista ja 2 viikon jaksoista ilman hoitoa.
Tutkimuksen ensisijainen tavoite oli arvioida ja verrata patsopanibihoitoa ja sunitinibihoitoa saaneiden potilaiden progressiovapaan elinajan (PFS) pituutta. Demografiset tekijät olivat samankaltaiset molemmissa hoitoryhmissä. Taudinkuvat diagnoosihetkellä ja seulonnassa olivat myös samankaltaisia hoitoryhmien välillä. Valtaosalla potilaista oli kirkassoluhistologia ja IV vaiheen tauti.
VEG108844 tutkimus saavutti ensisijaisen tavoitteensa osoittaen, että patsopanibi oli vertailukelpoinen (non-inferior) sunitinibin kanssa päävastemuuttujan (PFS) suhteen, kun riskisuhteen 95 % CI:n ylempi raja-arvo oli pienempi kuin tutkimusprotokollassa määritelty vertailukelpoisuusmarginaali (non-inferiority margin) 1,25. Tehoa mittaavat tulokset on esitetty taulukossa 5.
Taulukko 5 Tehoa mittaavat tulokset (VEG108844)
Päätetapahtuma | Patsopanibi N=557 | Sunitinibi N=553 | Riskisuhde (HR) (95 % CI) |
Progressiovapaa elinaika (PFS) | |||
Kokonaisarvo | |||
Mediaani (kuukausia) | 8,4 | 9,5 | 1,047 |
(95 % CI) | (8,3, 10,9) | (8,3, 11,0) | (0,898, 1,220) |
Kokonaiselinaika | |||
Mediaani (kuukausia) | 28,3 | 29,1 | 0,915a |
(95 % CI) | (26,0, 35,5) | (25,4, 33,1) | (0,786, 1,065) |
HR = hazard ratio = riskisuhde; PFS = progressiovapaa elinaikaa. P‑arvo = 0,245 (2-suuntainen) | |||
Kuva 4 Kaplan–Meierin käyrä progressiovapaalle elinajalle (PFS) riippumattoman arvion perusteella koko potilasjoukossa (VEG108844)
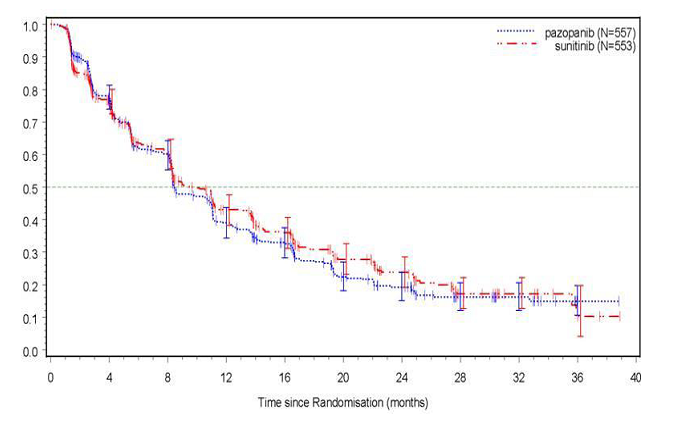
Progressiovapaasta elinajasta tehtiin ala-analyysit 20 demografiselle ja prognostiselle tekijälle. 95 % luottamusvälit kaikille alaryhmille pitävät sisällään riskisuhteen 1. Arvioitu riskisuhde ylitti 1,25 arvon näiden 20 alaryhmän kolmessa pienimmässä ryhmässä, toisin sanoen potilailla, joilla munuaisen poistoa ei ollut tehty (n=186, HR=1,403, 95 % CI [0,955, 2,061]), lähtötilanteen laktaattidehydrogenaasi >1,5x ULN (n=68, HR=1,72, 95 % CI [0,943, 3,139]) ja MSKCC (Memorial Sloan-Kettering Cancer Center): matala riski (n=119, HR=1,472, 95 % CI [0,937, 2,313]).
Pehmytkudossarkooma
Patsopanibin tehoa ja turvallisuutta pehmytkudossarkoomassa tutkittiin keskeisessä vaiheen III satunnaistetussa, kaksoissokkoutetussa, plasebokontrolloidussa monikeskustutkimuksessa (VEG110727). Edennyttä pehmytkudossarkoomaa sairastavat potilaat (N=369) satunnaistettiin saamaan patsopanibia 800 mg kerran päivässä tai plaseboa.
On tärkeää huomioida, että vain tiettyjä pehmytkudossarkooman histologisia alatyyppejä sairastavat potilaat otettiin mukaan tutkimukseen. Tästä syystä patsopanibin teho ja turvallisuus katsotaan osoitetuksi vain näissä pehmytkudossarkooman alaryhmissä ja patsopanibihoito tulee rajata vain näihin pehmytkudossarkooman alatyyppeihin.
Seuraavat tuumorityypit otettiin mukaan tutkimukseen:
Fibroblastiset (aikuisten fibrosarkooma, myksofibrosarkooma, skleroottinen epitelioidinen fibrosarkooma, maligni yksittäinen fibroottinen tuumori), niin sanotut fibrohistiosyyttiset (pleomorfinen maligni fibroottinen histiosytooma [MFH], suurisoluinen MFH, tulehduksellinen MFH), leiomyosarkoomat, malignit glomustuumorit, luustoon liittyvät lihakset (pleomorfinen ja alveolaarinen rabdomyosarkooma), vaskulaariset (epitelioidinen hemangioendoteliooma, angiosarkooma), erilaistumiseltaan epäselvät (synoviaalinen, epitelioidinen, alveolaarinen pehmytosa, kirkassoluinen, desmoplastinen pieni pyöreäsoluinen, ekstrarenaalinen rabdoidinen, maligni mesenkymooma, PECooma, intimaalinen sarkooma), maligni perifeerinen hermotuppituumori, erilaistumaton pehmytkudossarkooma, jota ei ole muuten määritelty (NOS) ja muut sarkoomatyypit, joita ei ollut rajattu tutkimuksen ulkopuolelle.
Seuraavia tuumorityyppejä ei otettu mukaan tutkimukseen:
Adiposyyttinen sarkooma (kaikki alatyypit), kaikki rabdomyosarkoomat, jotka eivät olleet alveolaarisia tai pleomorfisia, kondrosarkooma, osteosarkooma, Ewingin tuumorit/primitiiviset neuroektodermaaliset tuumorit (PNET), GIST, dermatofibrosarcoma protuberans, tulehduksellinen myofibroblastinen sarkooma, maligni mesoteliooma ja sekalaiset kohdun mesodermaaliset tuumorit.
On huomattava, että adiposyyttistä sarkoomaa sairastavat potilaat suljettiin pois keskeisestä vaiheen III tutkimuksesta, koska aikaisemmassa vaiheen II tutkimuksessa (VEG20002) oli käynyt ilmi, että patsopanibin aktiviteetti (progressiovapaa elinaika (PFS) viikolla 12) adiposyyttisessä sarkoomassa ei saavuttanut sitä ennalta määriteltyä tasoa, joka olisi puoltanut lisätutkimuksia.
Muita tutkimuksen VEG110727 keskeisiä sisäänottokriteerejä olivat: histologian perusteella korkea-asteinen tai keskiasteinen maligni pehmytkudossarkooma ja taudin eteneminen 6 kuukauden sisällä metastaattisen tautiin annetusta hoidosta tai taudin uusiutuminen 12 kuukauden sisällä (neo)-/adjuvanttihoidosta.
98 % tutkittavista oli saanut aikaisemmin doksorubisiinia, 70 % oli saanut aikaisemmin ifosfamidia ja 65 % oli saanut vähintään kolme solunsalpaajaa ennen tutkimuksen alkua.
Potilaat ositettiin lähtötilanteen WHO:n suorituskykyluokan (WHO PS 0 tai 1) ja edenneeseen tautiin annettujen hoitolinjojen lukumäärän perusteella (0 tai 1 vs. 2+). Molemmissa hoitoryhmissä oli hieman korkeampi prosentuaalinen osuus henkilöitä, jotka olivat saaneet vähintään 2 hoitolinjaa edenneeseen tautiin (58 % plasebo- ja 55 % patsopanibiryhmässä) verrattuna 0 tai 1 hoitolinjaa saaneisiin (42 % plasebo- ja 45 % patsopanibiryhmässä). Seuranta-ajan mediaani (määritelty satunnaistamisen päivämäärästä viimeiseen kontaktiin tai kuolemaan) oli samanlainen molemmissa hoitohaaroissa (9,36 kuukautta plasebolla [vaihteluväli 0,69−23,0 kuukautta] ja 10,04 kuukautta patsopanibilla [vaihteluväli 0,2−24,3 kuukautta].
Tutkimuksen ensisijainen tavoite oli progressiovapaa elossaoloaika (PFS) riippumattoman radiologisen arvioinnin perusteella; toissijaiset päätetapahtumat käsittivät kokonaiselinajan (OS), vasteiden kokonaismäärän ja vasteen keston.
Taulukko 6 Tehoa mittaavat tulokset pehmytkudossarkoomassa riippumattoman arvioinnin perusteella (VEG110727)
Päätetapahtumat / Tutkimusjoukko | Patsopanibi | Plasebo | HR (95% CI) | P‑arvo (kaksisuuntainen) | |
PFS | |||||
Kaikki tutkittavat (ITT) | N = 246 | N = 123 | |||
Mediaani (viikkoja) | 20,0 | 7,0 | 0,35 (0,26, 0,48) | < 0,001 | |
Leiomyosarkooma | N = 109 | N = 49 | |||
Mediaani (viikkoja) | 20,1 | 8,1 | 0,37 (0,23, 0,60) | < 0,001 | |
Synoviaalisarkooma-alaryhmät | N = 25 | N = 13 | |||
Mediaani (viikkoja) | 17,9 | 4,1 | 0,43 (0,19, 0,98) | 0,005 | |
‘Muut pehmytkudossarkoomat’ alaryhmät | N = 112 | N = 61 | |||
Mediaani (viikkoja) | 20,1 | 4,3 | 0,39 (0,25, 0,60) | < 0,001 | |
OS | |||||
Kaikki tutkittavat (ITT) | N = 246 | N = 123 | |||
Mediaani (kuukausia) | 12,6 | 10,7 | 0,87 (0,67, 1,12) | 0,256 | |
Leiomyosarkooma* | N = 109 | N = 49 | |||
Mediaani (kuukausia) | 16,7 | 14,1 | 0,84 (0,56, 1.26) | 0,363 | |
Synoviaalisarkooma-alaryhmät* | N = 25 | N = 13 | |||
Mediaani (kuukausia) | 8,7 | 21,6 | 1,62 (0,79, 3.33) | 0,115 | |
‘Muut pehmytkudossarkoomat’ -alaryhmät* | N = 112 | N = 61 | |||
Mediaani (kuukausia) | 10,3 | 9,5 | 0,84 (0,59, 1,21) | 0,325 | |
Kokonaisvaste (CR+PR) | |||||
% (95 % CI) | 4 (2,3, 7,9) | 0 (0.0, 3,0) | |||
Vasteen kesto | |||||
Mediaani (viikkoja) (95 % CI) | 38,9 (16,7, 40,0) | ||||
HR = hazard ratio = riskisuhde; ITT = intent to treat = hoitoaie; PFS = progression-free survival = progressiovapaa elinaika. CR = complete response = täydellinen vaste; PR = partial response = osittainen vaste. OS = overall survival = kokonaiselinaika * Pehmytkudossarkooman eri histologisten alaryhmien (leiomyosarkooma, synoviaalisarkooma ja “muut” pehmytkudossarkoomat) kokonaiselinaikaa tulee tulkita varoen, sillä tutkittavien lukumäärä on pieni ja luottamusväli laaja. | |||||
Tutkijoiden tekemässä arvioinnissa havaittiin samanlainen progressiovapaan elinajan (PFS) piteneminen patsopanibiryhmässä plaseboryhmään verrattuna ITT populaatiossa (HR:0,39; 95 % CI, 0,30−0,52, p < 0,001).
Kuva 5 Kaplan–Meierin käyrä progressiovapaalle elinajalle pehmytkudossarkoomapotilailla riippumattoman arvion perusteella koko potilasjoukossa (VEG110727)
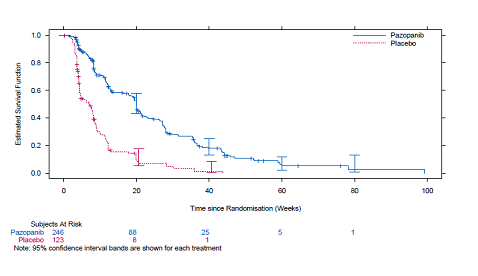
Kokonaiselinajan lopullisessa analyysissä, joka suoritettiin kun 76 % (280/369) tapahtumista oli ilmaantunut, ei havaittu merkitsevää eroa hoitohaarojen välillä (HR 0,87, 95 % CI 0,67, 1,12 p=0,256).
Pediatriset potilaat
Vaiheen I patsopanibitutkimukseen (ADVL0815) osallistui 44 pediatrista potilasta, joilla oli erityyppisiä uusiutuneita tai resistenttejä kiinteitä kasvaimia. Ensisijainen tavoite oli tutkia patsopanibin suurinta siedettyä annosta, turvallisuusprofiilia ja farmakokineettisiä ominaisuuksia lapsilla. Tutkimuksessa altistuksen mediaanikesto oli 3 kk (1–23 kk).
Vaiheen II patsopanibitutkimukseen (PZP034X2203) osallistui 57 pediatrista potilasta, joilla oli resistenttejä kiinteitä kasvaimia, kuten rabdomyosarkooma (N = 12), muu pehmytkudossarkooma kuin rabdomyosarkooma (N = 11), Ewingin sarkooma / pPNET (N = 10), osteosarkooma (N = 10), neuroblastooma (N = 8) tai hepatoblastooma (N = 6). Tutkimus oli yhdellä valmisteella toteutettu, kontrolloimaton, avoin tutkimus, jossa selvitettiin patsopanibin terapeuttista vaikutusta 1 – < 18-vuotiaisiin lapsiin ja nuoriin. Patsopanibia annettiin päivittäin tabletteina annoksella 450 mg/m2 tai oraalisuspensiona annoksella 225 mg/m2. Sallittu enimmäisvuorokausiannos oli tablettien osalta 800 mg ja oraalisuspension osalta 400 mg. Tutkimuksessa altistuksen mediaanikesto oli 1,8 kk (1 vrk – 29 kk).
Tutkimuksen tuloksissa ei todettu merkittävää vaikutusta kasvaimeen kyseisillä pediatrisilla potilailla. Siksi patsopanibia ei suositella näiden kasvainten hoitoon pediatrisilla potilailla (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Votrient-valmisteen käytöstä munuais- ja munuaisaltaan sarkoomien hoidossa (pois lukien nefroblastooma, nefroblatomatoosi, kirkassolusarkooma, mesoblastinen nefrooma, munuaisten medullaarinen karsinooma ja munuaisten rabdoidi tuumori) kaikissa pediatrisissa potilasryhmissä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Kun patsopanibia annettiin 800 mg kerta-annoksena suun kautta potilaille, joilla oli kiinteitä kasvaimia, maksimipitoisuus plasmassa (Cmax) oli noin 19 ±13 mikrog/ml ja se saavutettiin keskimäärin 3,5 tunnin kuluttua (mediaani, vaihteluväli 1,0‑11,9 tuntia), ja AUC0-∞ oli noin 650 ± 500 mikrog.h/ml. Päivittäinen anto johtaa AUC0-∞-arvon 1,23–4-kertaiseen nousuun.
Yli 800 mg:n patsopanibiannoksiin ei liittynyt johdonmukaista AUC- eikä Cmax-arvojen suurenemista.
Systeeminen patsopanibialtistus suurenee, jos lääke otetaan ruoan kanssa. Jos patsopanibia annetaan runsaasti rasvaa sisältävän tai vähärasvaisen aterian yhteydessä, AUC- ja Cmax-arvo suurenevat noin kaksinkertaisiksi. Siksi patsopanibi on annettava vähintään kaksi tuntia ruokailun jälkeen tai vähintään tunti ennen ruokailua (ks. kohta Annostus ja antotapa).
Kun 400 mg:n patsopanibitabletti annettiin murskattuna, AUC(0-72)-arvo suureni 46 %, Cmax-arvo nousi noin kaksinkertaiseksi ja tmax lyheni noin 2 tuntia kokonaisena niellyn tabletin jälkeen saatuihin arvoihin verrattuna. Nämä tulokset osoittavat, että patsopanibin hyötyosuus ja suun kautta annetun annoksen imeytymisnopeus suurenevat, kun tabletti annetaan murskattuna, kokonaisena nieltyyn tablettiin verrattuna (ks. kohta Annostus ja antotapa).
Jakautuminen
Patsopanibi sitoutui ihmisen plasman proteiineihin in vivo yli 99-prosenttisesti pitoisuudesta riippumatta pitoisuusalueella 10–100 mikrog/ml. In vitro tutkimukset viittaavat siihen, että patsopanibi on P-gp:n ja BCRP:n substraatti.
Biotransformaatio
In vitro -tutkimusten tulokset osoittavat, että patsopanibin metabolia välittyy pääasiassa CYP3A4-entsyymin kautta ja vähäisessä määrin CYP1A2- ja CYP2C8-entsyymien välityksellä. Patsopanibin neljän pääasiallisen metaboliitin osuus on vain 6 % plasman lääkeainealtistuksesta. Yksi näistä metaboliiteista estää VEGF:n stimuloimaa ihmisen napalaskimon endoteelisolujen proliferaatiota yhtä voimakkaasti kuin patsopanibi; muiden metaboliittien aktiivisuus on 10–20 kertaa heikompi. Patsopanibin aktiivisuus riippuu siis pääasiassa lähtöaineen, patsopanibin altistuksesta.
Eliminaatio
Patsopanibi eliminoituu hitaasti. Suositellun 800 mg:n annoksen jälkeen puoliintumisen keskiarvo on 30,9 tuntia. Patsopanibi erittyy pääasiassa ulosteeseen. Munuaisten kautta tapahtuvan eliminaation osuus on < 4 % annetusta annoksesta.
Erityispotilasryhmät
Munuaisten vajaatoiminta
Tulokset osoittavat, että alle 4 % suun kautta annetusta patsopanibiannoksesta erittyy virtsaan patsopanibina ja metaboliitteina. Populaatiofarmakokineettisten mallintamisen tulokset (niiden tutkittavien tulokset, joiden kreatiniinipuhdistuman lähtöarvo on 30,8–150 ml/min) osoittavat, ettei munuaisten vajaatoiminnalla ole todennäköisesti kliinisesti merkittävää vaikutusta patsopanibin farmakokinetiikkaan. Annoksen muuttaminen ei siis ole tarpeen, jos kreatiniinipuhdistuma on yli 30 ml/min. Varovaisuutta on noudatettava, jos kreatiniinipuhdistuma on alle 30 ml/min, sillä patsopanibin käytöstä ei ole kokemuksia tässä potilasryhmässä (ks. kohta Annostus ja antotapa).
Maksan vajaatoiminta
Lievä
Potilailla, joilla on lieviä muutoksia maksan parametreissä (määritellään joko normaalina bilirubiinina ja pienenäkin ALAT-arvojen nousuna tai bilirubiinin nousuna aina 1,5 x normaaliarvojen ylärajaan asti (UNL) ALAT-arvosta riippumatta), patsopanibin Cmax-arvo ja AUC(0-24)-arvo vastasivat mediaaniarvoja, joita tavataan potilailla, joilla on normaali maksan toiminta (ks. taulukko 7). Patsopanibin suositeltu annostus on 800 mg kerran vuorokaudessa potilailla, joilla on lieviä muutoksia seerumista mitattavissa maksan toimintakokeissa (ks. kohta Annostus ja antotapa).
Kohtalainen
Korkein siedetty annos kohtalaisessa maksan vajaatoiminnassa (määritellään bilirubiinin nousuna > 1,5−3 x ULN, ALAT-arvosta riippumatta) oli 200 mg kerran vuorokaudessa. Kohtalaisessa maksan vajaatoiminnassa kerran päivässä annetun 200 mg patsopanibiannoksen jälkeen Cmax oli noin 44 % ja AUC(0-24) noin 39 % (mediaaniarvot steady state ‑tilassa) niistä vastaavista mediaaniarvoista, joita havaitaan normaalin maksatoiminnan omaavilla potilailla kerran päivässä annetun 800 mg annoksen jälkeen (ks. taulukko 7).
Turvallisuus- ja siedettävyystutkimusten ja farmakokineettisten tutkimusten perusteella kohtalaista maksan vajaatoimintaa sairastavien potilaiden patsopanibiannos tulisi laskea 200 mg:aan kerran vuorokaudessa (ks. kohta Annostus ja antotapa).
Vaikea
Vaikeassa maksan vajaatoiminnassa kerran vuorokaudessa annetun 200 mg patsopanibiannoksen jälkeen Cmax oli noin 18 % ja AUC(0-24) noin 15 % (mediaaniarvot steady state ‑tilassa) niistä vastaavista mediaaniarvoista, joita havaitaan normaalin maksatoiminnan omaavilla potilailla kerran päivässä annetun 800 mg annoksen jälkeen. Alentuneesta altistumisesta ja rajoitetusta maksan kapasiteetista johtuen, patsopanibia ei suositella potilaille, joilla on vaikea maksan vajaatoiminta (määritellään kokonaisbilirubiinina > 3 x ULN, ALAT-arvosta riippumatta (ks. kohta Annostus ja antotapa).
Taulukko 7 Patsopanibin farmakokineettisiä steady state ‑arvoja (mediaani) maksan vajaatoimintapotilailla
Ryhmä | Tutkittu annos | Cmax (mikrog/ml) | AUC (0-24) (mikrog x hr/ml) | Suositeltu annostus |
Normaali maksan toiminta | 800 mg kerran päivässä | 52,0 (17,1-85,7) | 888,2 (345,5-1482) | 800 mg kerran päivässä |
Lievä maksan vajaatoiminta | 800 mg kerran päivässä | 33,5 (11,3-104,2) | 774,2 (214,7-2034,4) | 800 mg kerran päivässä |
Kohtalainen maksan vajaatoiminta | 200 mg kerran päivässä | 22,2 (4,2-32,9) | 256,8 (65,7-487,7) | 200 mg kerran päivässä |
Vaikea maksan vajaatoiminta | 200 mg kerran päivässä | 9,4 (2,4-24,3) | 130,6 (46,9-473,2) | Ei suositella |
Pediatriset potilaat
Kun patsopanibia annettiin pediatrisille potilaille oraalisuspensiona annoksella 225 mg/m2, farmakokineettiset parametrit (Cmax, Tmax ja AUC) olivat samankaltaisia kuin aiemmin ilmoitetut parametrit 800 mg patsopanibia saaneilla aikuispotilailla. Tuloksissa lasten ja aikuisten välillä ei todettu selvää eroa patsopanibin puhdistumassa suhteessa kehon pinta-alaan.
Prekliiniset tiedot turvallisuudesta
Patsopanibin prekliinistä turvallisuusprofiilia arvioitiin hiirillä, rotilla, kaniineilla ja apinoilla. Jyrsijöille tehdyissä toistuvan annoksen tutkimuksissa eri kudoksiin (luustoon, hampaisiin, kynnenalustaan, lisääntymiselimiin, hematologisiin kudoksiin, munuaisiin ja haimaan) kohdistuvat vaikutukset näyttävät liittyvän farmakologiseen vaikutukseen eli VEGF-reseptorien estoon ja/tai VEGF:n signaalivälitysketjun toiminnan häiriintymiseen. Useimmat vaikutukset ilmenivät kliinistä altistusta pienemmillä altistustasoilla. Muita havaittuja vaikutuksia ovat painon lasku, ripuli ja/tai sairastavuus, jotka johtuivat joko lääkeaineen suurten paikallisten limakalvoaltistusten aiheuttamista paikallisista maha-suolikanavaan kohdistuvista vaikutuksista (apinat) tai lääkkeen farmakologisista vaikutuksista (jyrsijät). Proliferatiivisia maksavaurioita (eosinofiiliset fokukset ja adenooma) todettiin naarashiirillä, kun altistus oli 2,5-kertainen ihmisen altistukseen verrattuna AUC-arvon perusteella.
Juveniilitoksisuustutkimuksissa, joissa rotille annettiin ennen vieroitusta patsopanibia 9 päivän iästä 14 päivän ikään, havaittiin kuolleisuutta ja elinten epänormaalia kasvua/maturaatiota munuaisissa, keuhkoissa, maksassa ja sydämessä annoksilla, jotka olivat noin 0,1-kertaiset AUC-arvoon perustuvaan kliiniseen altistumiseen aikuisilla ihmisillä. Kun rotille annettiin vieroituksen jälkeen patsopanibia 21 päivän iästä 62 päivän ikään, toksikologiset löydökset olivat samanlaiset kuin aikuisilla rotilla altistusten ollessa verrannollisia. Lapsipotilailla on aikuisiin verrattuna lisääntynyt riski saada luihin ja hampaisiin kohdistuvia vaikutuksia, sillä näitä muutoksia, mukaan lukien kasvun hidastuminen (lyhyemmät raajat), hauraat luut ja muutokset hampaissa, oli havaittavissa juveniilirotissa annoksilla ≥ 10 mg/kg/päivä (vastaa noin 0,1–0,2-kertaista AUC-arvoon perustuvaa kliinistä altistumista aikuisilla ihmisillä) (ks. Kohta Varoitukset ja käyttöön liittyvät varotoimet).
Lisääntymiseen ja hedelmällisyyteen kohdistuvat ja teratogeeniset vaikutukset
Patsopanibin on osoitettu aiheuttavan alkioon kohdistuvia vaikutuksia ja sikiöepämuodostumia rotille ja kaniineille altistuksen ollessa yli 300 kertaa alhaisempi ihmisen altistukseen verrattuna (AUC-arvon perusteella). Vaikutuksia olivat naaraiden hedelmällisyyden heikkeneminen, implantaatiota edeltävien ja implantaation jälkeisten keskenmenojen lisääntyminen, varhaiset resorptiot, alkiokuolleisuus, sikiöiden painon lasku ja kardiovaskulaariset epämuodostumat. Jyrsijöillä on todettu myös keltarauhasen pienenemistä, kystien lisääntymistä ja munasarjojen atrofiaa. Urosrottien fertiliteettitutkimuksessa ei havaittu paritteluun eikä hedelmällisyyteen kohdistuvia vaikutuksia. Sen sijaan todettiin kivesten ja lisäkivesten painon laskua ja siittiöiden tuotannon ja liikkuvuuden vähenemistä, sekä lisäkivesten ja kivesten siemennestemäärien vähenemistä altistuksen ollessa 0,3-kertainen ihmisen altistukseen verrattuna AUC-arvon perusteella.
Genotoksisuus
Genotoksisuustutkimuksissa (Amesin testissä, ihmisen perifeeristen lymfosyyttien kromosomipoikkeavuustesteissä ja in vivo rotan mikrotumatestissä) patsopanibi ei aiheuttanut geenivaurioita. Patsopanibin valmistusprosessin synteettinen välituote, jota on pieniä määriä myös lopullisessa lääkeaineessa, ei ollut mutageeninen Amesin testissä mutta se oli genotoksinen hiiren lymfoomatestissä ja in vivo hiiren mikrotumatestissä.
Karsinogeenisuus
Patsopanibilla tehdyissä kaksi vuotta kestäneissä karsinogeenisuustutkimuksissa havaittiin hiirillä maksan adenoomien ja rotilla pohjukaissuolen adenokarsinoomien määrän lisääntymistä. Jyrsijöille ominaiseen patogeneesiin ja mekanismiin perustuen näiden löydösten ei katsota viittaavaan lisääntyneeseen karsinogeenisuusriskiin patsopanibia saavilla potilailla.
Farmaseuttiset tiedot
Apuaineet
Votrient 200 mg tabletti, kalvopäällysteinen
Tabletin ydin
Magnesiumstearaatti
Mikrokiteinen selluloosa
Povidoni (K30)
Natriumtärkkelysglykolaatti
Tabletin päällyste
Hypromelloosi
Punainen rautaoksidi (E172)
Makrogoli 400
Polysorbaatti 80
Titaanidioksidi (E171)
Votrient 400 mg tabletti, kalvopäällysteinen
Tabletin ydin
Magnesiumstearaatti
Mikrokiteinen selluloosa
Povidoni (K30)
Natriumtärkkelysglykolaatti
Tabletin päällyste
Hypromelloosi
Makrogoli 400
Polysorbaatti 80
Titaanidioksidi (E171)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta.
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
VOTRIENT tabletti, kalvopäällysteinen
200 mg (L:ei) 90 kpl (2436,05 €)
400 mg (L:ei) 60 kpl (3187,86 €)
PF-selosteen tieto
Votrient 200 mg tabletti, kalvopäällysteinen
HDPE purkki, jossa polypropyleenistä valmistettu lapsiturvallinen korkki. Pakkauskoko 30 tai 90 tablettia.
Votrient 400 mg tabletti, kalvopäällysteinen
HDPE purkki, jossa polypropyleenistä valmistettu lapsiturvallinen korkki. Pakkauskoko 30 tai 60 tablettia.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Votrient 200 mg tabletti, kalvopäällysteinen
Kapselimuotoinen, vaaleanpunainen kalvopäällysteinen tabletti, jossa on toisella puolella merkintä GS JT.
Votrient 400 mg tabletti, kalvopäällysteinen
Kapselimuotoinen, valkoinen kalvopäällysteinen tabletti, jossa on toisella puolella merkintä GS UHL.
Käyttö- ja käsittelyohjeet
Ei erityisvaatimuksia.
Korvattavuus
VOTRIENT tabletti, kalvopäällysteinen
200 mg 90 kpl
400 mg 60 kpl
- Ylempi erityiskorvaus (100 %). Patsopanibi: Edenneen munuaissyövän hoito ja edenneen pehmytkudossarkooman toisen linjan hoito erityisin edellytyksin (159).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Patsopanibi: Edenneen munuaissyövän hoito ja edenneen pehmytkudossarkooman toisen linjan hoito erityisin edellytyksin (343).
ATC-koodi
L01EX03
Valmisteyhteenvedon muuttamispäivämäärä
28.10.2025
Yhteystiedot
 NOVARTIS FINLAND OY
NOVARTIS FINLAND OY Revontulenkuja 1
02100 Espoo
010 613 3200
www.novartis.fi
Lääkeinformaatiopalvelu 010 6133 210,
medinfo.nordics@novartis.com
