XIGDUO tabletti, kalvopäällysteinen 5/850 mg, 5/1000 mg
Vaikuttavat aineet ja niiden määrät
Xigduo 5 mg/850 mg kalvopäällysteinen tabletti
Yksi tabletti sisältää dapagliflotsiinipropaanidiolimonohydraattia määrän, joka vastaa 5 mg dapagliflotsiinia ja 850 mg metformiinihydrokloridia.
Xigduo 5 mg/1 000 mg kalvopäällysteinen tabletti
Yksi tabletti sisältää dapagliflotsiinipropaanidiolimonohydraattia määrän, joka vastaa 5 mg dapagliflotsiinia ja 1 000 mg metformiinihydrokloridia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Kalvopäällysteinen tabletti (tabletti).
Kliiniset tiedot
Käyttöaiheet
Xigduo on tarkoitettu aikuisille potilaille tyypin 2 diabeteksen hoitoon ruokavalion ja liikunnan lisäksi:
- kun hoitotasapaino on riittämätön, vaikka potilas käyttää suurinta siedettyä annosta pelkkää metformiinia
- yhdistettynä muihin diabeteslääkkeisiin, kun metformiinin ja näiden lääkevalmisteiden käytöllä ei saavuteta riittävää hoitotasapainoa
- kun potilasta hoidetaan jo samanaikaisesti dapagliflotsiinilla ja metformiinilla, jotka otetaan erillisinä tabletteina.
Yhdistelmähoitoja, vaikutuksia glukoositasapainoon, sydän- ja verisuonitapahtumia sekä tutkittuja populaatioita koskevat tutkimustulokset on kuvattu kohdissa Varoitukset ja käyttöön liittyvät varotoimet, Yhteisvaikutukset ja Farmakodynamiikka.
Annostus ja antotapa
Annostus
Aikuiset, joiden munuaistoiminta on normaali (glomerulusten suodatusnopeus [GFR] ≥ 90 ml/min)
Suositusannos on yksi tabletti kaksi kertaa vuorokaudessa. Yksi tabletti sisältää kiinteän annoksen dapagliflotsiinia ja metformiinia (ks. kohta Vaikuttavat aineet ja niiden määrät).
Potilaat, joiden hoitotasapaino on riittämätön pelkällä metformiinihoidolla tai metformiinin ja muiden diabeteslääkkeiden yhdistelmähoidolla
Potilaille, joiden hoitotasapaino on riittämätön pelkällä metformiinihoidolla tai metformiinin ja muiden diabeteslääkkeiden yhdistelmähoidolla, annetaan Xigduo-valmistetta kokonaisannos, joka vastaa 10 mg:aa dapagliflotsiinia vuorokaudessa ja entuudestaan käytössä olevaa metformiinin kokonaisvuorokausiannosta tai sitä lähinnä olevaa terapeuttisesti asianmukaista annosta. Kun Xigduo-valmistetta käytetään yhdessä insuliinin tai insuliinin eritystä lisäävän lääkkeen, kuten sulfonyyliurean kanssa, voidaan harkita insuliinin tai sulfonyyliurean annoksen pienentämistä hypoglykemian riskin pienentämiseksi (ks. kohdat Yhteisvaikutukset ja Haittavaikutukset).
Potilaat, jotka käyttävät erillisiä dapagliflotsiini- ja metformiinitabletteja
Potilaille, jotka vaihtavat erilliset dapagliflotsiini- (kokonaisvuorokausiannos 10 mg) ja metformiinitabletit Xigduo-valmisteeseen, käytetään entuudestaan käytössä olevaa dapagliflotsiinin ja metformiinin vuorokausiannosta tai metformiinin sitä lähinnä olevaa terapeuttisesti asianmukaista annosta.
Erityisryhmät
Munuaisten vajaatoiminta
GFR on arvioitava ennen metformiinia sisältävien lääkevalmisteiden käytön aloittamista ja vähintään kerran vuodessa sen jälkeen. Jos munuaisten vajaatoiminnan etenemisriski on suurentunut tai kyseessä on iäkäs potilas, munuaistoiminta on arvioitava tiheämmin, esim. 3–6 kuukauden välein.
Metformiinin enimmäisvuorokausiannos on hyvä jakaa 2–3 annokseen vuorokaudessa. Ennen kuin harkitaan metformiinihoidon aloittamista potilaille, joiden GFR on < 60 ml/min, on arvioitava tekijät, jotka saattavat suurentaa maitohappoasidoosin riskiä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Mikäli Xigduo-valmisteesta ei ole saatavilla asianmukaista vahvuutta, vaikuttavia aineita on käytettävä erillisinä valmisteina kiinteän yhdistelmävalmisteen sijasta.
Taulukko 1. Annostus potilailla, joilla on munuaisten vajaatoiminta
| GFR ml/min | Metformiini | Dapagliflotsiini |
60–89
| Enimmäisvuorokausiannos on 3 000 mg. Annoksen pienentämistä voidaan harkita munuaisten toiminnan heikentymisen mukaan. | Enimmäisvuorokausiannos on 10 mg. |
45–59
| Enimmäisvuorokausiannos on 2 000 mg. Aloitusannos on enintään puolet enimmäisannoksesta. | Enimmäisvuorokausiannos on 10 mg. |
30–44
| Enimmäisvuorokausiannos on 1 000 mg. Aloitusannos on enintään puolet enimmäisannoksesta. | Enimmäisvuorokausiannos on 10 mg. Dapagliflotsiinin teho glukoosipitoisuuksien pienentämisessä on alentunut. |
| < 30 | Metformiini on vasta-aiheinen. | Enimmäisvuorokausiannos on 10 mg. Vähäisen kokemuksen vuoksi ei ole suositeltavaa aloittaa dapagliflotsiinihoitoa potilaille, joiden GFR on alle 25 ml/min. Dapagliflotsiinin teho glukoosipitoisuuksien pienentämisessä todennäköisesti puuttuu. |
Maksan vajaatoiminta
Tätä lääkevalmistetta ei saa käyttää potilaille, joilla on maksan vajaatoiminta (ks. kohdat Vasta-aiheet, Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Iäkkäät (vähintään 65-vuotiaat)
Metformiini poistuu osittain munuaisten kautta ja iäkkäillä potilailla heikentyneen munuaisten toiminnan todennäköisyys kasvaa, joten tämän lääkevalmisteen käytössä iäkkäiden potilaiden hoidossa on noudatettava varovaisuutta. Munuaistoimintaa on seurattava metformiiniin liittyvän maitohappoasidoosin ehkäisemiseksi etenkin iäkkäillä potilailla (ks. kohdat Vasta-aiheet ja Varoitukset ja käyttöön liittyvät varotoimet).
Pediatriset potilaat
Xigduo-valmisteen turvallisuutta ja tehoa 0–18 vuoden ikäisten lasten ja nuorten hoidossa ei ole vielä varmistettu. Tietoja ei ole saatavilla.
Antotapa
Xigduo otetaan kahdesti vuorokaudessa aterioiden yhteydessä metformiinin käyttöön liittyvien ruuansulatuskanavan haittojen vähentämiseksi.
Vasta-aiheet
Xigduo on vasta-aiheinen, jos potilaalla on jokin seuraavista:
- yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille
- akuutti metabolinen asidoosi tyypistä riippumatta (esim. maitohappoasidoosi, diabeettinen ketoasidoosi)
- diabeettisen kooman esivaihe (prekooma)
- vaikea munuaisten vajaatoiminta (GFR < 30 ml/min) (ks. kohdat Annostus ja antotapa, Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka)
-
akuutti tila, joka saattaa vaikuttaa munuaisten toimintaan, kuten:
- nestehukka
- vaikea infektio
- sokki
-
akuutti tai krooninen sairaus, joka voi aiheuttaa kudoshypoksiaa, kuten:
- sydämen vajaatoiminta tai hengitysvajaus
- hiljattain sairastettu sydäninfarkti
- sokki
- maksan vajaatoiminta (ks. kohdat Annostus ja antotapa, Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka)
- akuutti alkoholimyrkytys, alkoholismi (ks. kohta Yhteisvaikutukset).
Varoitukset ja käyttöön liittyvät varotoimet
Maitohappoasidoosi
Maitohappoasidoosi on hyvin harvinainen mutta vakava metabolinen komplikaatio, jota ilmenee useimmiten munuaistoiminnan akuutin heikkenemisen yhteydessä tai kardiorespiratorisen sairauden tai sepsiksen yhteydessä. Munuaistoiminnan akuutin heikkenemisen yhteydessä metformiinia kertyy elimistöön, mikä suurentaa maitohappoasidoosin riskiä.
Nestehukan (vaikea ripuli tai oksentelu, kuume tai vähentynyt nesteen saanti) yhteydessä Xigduo-valmisteen käyttö on tauotettava, ja on suositeltavaa ottaa yhteys terveydenhuoltohenkilöstöön.
Jos potilas saa metformiinihoitoa, munuaistoimintaa potentiaalisesti heikentävien lääkevalmisteiden (kuten verenpainelääkkeiden, diureettien ja tulehduskipulääkkeiden [NSAID]) käyttö on aloitettava varoen. Muita maitohappoasidoosin riskitekijöitä ovat liiallinen alkoholinkäyttö, maksan vajaatoiminta, huonossa hoitotasapainossa oleva diabetes, ketoosi, pitkittynyt paasto ja kaikki tilat, joihin liittyy hypoksiaa, sekä maitohappoasidoosia potentiaalisesti aiheuttavien lääkevalmisteiden samanaikainen käyttö (ks. kohdat Vasta-aiheet ja Yhteisvaikutukset).
Potilaille ja/tai hoitajille on kerrottava maitohappoasidoosin riskistä. Maitohappoasidoosin tyyppioireita ovat asidoottinen hengenahdistus, vatsakipu, lihaskrampit, voimattomuus ja hypotermia. Tilan edetessä kehittyy kooma. Jos potilaalla epäillään näitä oireita, hänen on lopetettava Xigduo-valmisteen käyttö ja hakeuduttava välittömästi lääkärin hoitoon. Diagnostisia laboratoriolöydöksiä ovat veren matala pH (< 7,35), suurentunut plasman laktaattipitoisuus (> 5 mmol/l), suurentunut anionivaje ja suurentunut laktaatti-pyruvaattisuhde.
Potilaat, joilla on tai joilla epäillään olevan mitokondriotauteja
Potilaille, joilla tiedetään olevan mitokondriotauteja kuten MELAS (Mitochondrial Encephalomyopathy with Lactic Acidosis, and Stroke-like episodes) ‑oireyhtymä ja MIDD (Maternally Inherited Diabetes and Deafness) ‑diabetes, ei suositella metformiinia maitohappoasidoosin pahenemisen ja mahdollisesti taudin pahenemiseen johtavien neurologisten komplikaatioiden vaaran vuoksi.
Jos metformiinin ottamisen jälkeen ilmenee MELAS-oireyhtymään tai MIDD-diabetekseen viittaavia merkkejä tai oireita, metformiinihoito on keskeytettävä välittömästi ja diagnostinen arviointi tehtävä.
Munuaistoiminta
Dapagliflotsiinin teho glukoosipitoisuuksien pienentämisessä riippuu munuaisten toiminnasta. Teho on alentunut potilailla, joiden GFR on alle 45 ml/min, ja todennäköisesti puuttuu potilailta, joilla on vaikea munuaisten vajaatoiminta (ks. kohdat Annostus ja antotapa, Farmakodynamiikka ja Farmakokinetiikka).
Metformiini erittyy munuaisten kautta, ja kohtalainen tai vaikea munuaisten vajaatoiminta suurentaa maitohappoasidoosin riskiä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Munuaisten toiminta on arvioitava ennen hoidon aloittamista ja säännöllisesti sen jälkeen (ks. kohta Annostus ja antotapa). Metformiini on vasta-aiheinen potilailla, joiden GFR-arvo on < 30 ml/min, ja se on tauotettava, jos potilaalla on jokin munuaistoimintaan vaikuttava tila (ks. kohta Vasta-aiheet).
Munuaistoiminnan heikkeneminen on iäkkäillä potilailla yleistä ja oireetonta. Erityinen varovaisuus on tarpeen tilanteissa, joissa munuaistoiminta saattaa huonontua, esim. verenpainelääkitystä, diureettihoitoa tai tulehduskipulääkitystä aloitettaessa.
Käyttö nestehukan ja/tai hypotension riskiryhmään kuuluville potilaille
Vaikutusmekanisminsa vuoksi dapagliflotsiini lisää virtsaneritystä, mikä voi johtaa kliinisissä tutkimuksissa todettuun vähäiseen verenpaineen laskuun (ks. kohta Farmakodynamiikka). Lasku voi olla merkittävämpi potilailla, joilla on korkea veren glukoosipitoisuus.
Varovaisuutta on noudatettava potilailla, joille dapagliflotsiinin aiheuttama verenpaineen lasku saattaa olla riski, kuten potilailla, joilla on ollut hypotensiota verenpainelääkityksen yhteydessä, tai iäkkäillä potilailla.
Jos potilaalla on lisäksi muita sairaustiloja, jotka saattavat johtaa nestehukkaan (esim. maha-suolikanavan sairaus), suositellaan nestetasapainon huolellista seurantaa (esim. lääkärintarkastus, verenpainemittaukset, laboratoriotutkimukset, mukaan lukien hematokriitti ja elektrolyyttitasapaino). Tämän lääkevalmisteen käytön tilapäistä keskeyttämistä suositellaan, jos potilaalle kehittyy nestehukka, kunnes nestehukka on korjaantunut (ks. kohta Haittavaikutukset).
Diabeettinen ketoasidoosi
Harvinaisia diabeettisen ketoasidoosin tapauksia, myös henkeä uhkaavia ja kuolemaan johtaneita, on ilmoitettu potilailla, joita on hoidettu natriumin- ja glukoosinkuljettajaproteiini 2:n (SGLT2:n) estäjillä, dapagliflotsiini mukaan lukien. Useissa tapauksissa sairaustila ilmeni epätyypillisenä sikäli, että veren glukoosipitoisuudet olivat vain jonkin verran koholla, alle 14 mmol/l (250 mg/dl). Ei tiedetä, ilmeneekö diabeettista ketoasidoosia todennäköisemmin käytettäessä suuria dapagliflotsiiniannoksia.
Diabeettisen ketoasidoosin riski täytyy ottaa huomioon, jos potilaalla on epäspesifisiä oireita, kuten pahoinvointia, oksentelua, ruokahaluttomuutta, vatsakipua, epänormaalin voimakasta janoa, hengitysvaikeuksia, sekavuutta, epätavallista väsymystä tai uneliaisuutta. Jos tällaisia oireita ilmenee, potilas on tutkittava ketoasidoosin varalta välittömästi veren glukoosipitoisuudesta riippumatta.
Dapagliflotsiinihoito on lopetettava välittömästi, jos potilaalla epäillään olevan tai todetaan diabeettinen ketoasidoosi.
Hoito on keskeytettävä potilailta, jotka ovat sairaalahoidossa suuren kirurgisen toimenpiteen tai äkillisen vakavan sairauden takia. Näillä potilailla suositellaan ketonien seurantaa. Ketonipitoisuus kannattaa mitata verestä eikä virtsasta. Dapagliflotsiinihoito voidaan aloittaa uudelleen, kun ketonipitoisuus on normaali ja potilaan tila on jälleen vakaa.
Ennen dapagliflotsiinihoidon aloittamista on otettava huomioon potilaalla aiemmin ilmenneet tekijät, jotka saattavat altistaa ketoasidoosille.
Suurentuneen diabeettisen ketoasidoosin riskiryhmään saattavat kuulua potilaat, joiden toiminnallisten beetasolujen määrä on vähentynyt (kuten tyypin 2 diabetesta sairastavat potilaat, joiden C-peptidiarvot ovat pienet, tai potilaat, joilla on aikuisiällä alkava autoimmuunityyppinen diabetes (LADA) tai joilla on aiemmin ollut haimatulehdus), potilaat, joilla on rajoittuneeseen ravinnonsaantiin tai vaikeaan nestehukkaan johtava tila, potilaat, joiden insuliiniannosta on pienennetty, ja potilaat, joiden insuliinin tarve on lisääntynyt akuutin sairauden, leikkauksen tai alkoholin väärinkäytön vuoksi. SGLT2:n estäjiä on käytettävä varoen tällaisille potilaille.
Hoitoa SGLT2:n estäjällä ei suositella aloittamaan uudelleen, jos potilaalla on aiemmin ollut diabeettinen ketoasidoosi SGLT2-hoidon aikana eikä diabeettiselle ketoasidoosille ole löytynyt muuta selkeää selittävää syytä, joka on korjautunut.
Xigduo-valmisteen turvallisuutta ja tehoa tyypin 1 diabetesta sairastavilla potilailla ei ole varmistettu eikä Xigduo-valmistetta pidä käyttää tyypin 1 diabetesta sairastavien potilaiden hoitoon. Tyypin 1 diabetesta koskeneissa tutkimuksissa diabeettista ketoasidoosia raportoitiin yleisenä haittavaikutuksena.
Välilihan nekrotisoiva faskiitti (Fournier’n gangreeni)
Markkinoille tulon jälkeisistä välilihan nekrotisoivan faskiitin (tämä tunnetaan myös nimellä Fournier’n gangreeni) tapauksista on ilmoitettu nais- ja miespotilailla, jotka käyttävät SGLT2:n estäjiä (ks. kohta Haittavaikutukset). Tämä on harvinainen, mutta vakava ja mahdollisesti hengenvaarallinen tapahtuma, joka edellyttää kiireellistä leikkausta ja antibioottihoitoa.
Potilaita on kehotettava kääntymään lääkärin puoleen, jos heillä on kipua, aristusta, punoitusta tai turvotusta genitaali- tai perineaalialueella ja tähän liittyy kuumetta tai huonovointisuutta. Huomatkaa, että nekrotisoivaa faskiittia voi edeltää urogenitaali-infektio tai perineaaliabsessi. Jos Fournier’n gangreenia epäillään, Xigduo-valmisteen käyttö on keskeytettävä ja hoito (mukaan lukien antibioottihoito ja puhdistusleikkaus) on aloitettava.
Virtsatieinfektiot
Glukoosin erittyminen virtsaan saattaa lisätä virtsatieinfektion riskiä. Siksi hoidon väliaikaista keskeyttämistä on harkittava hoidettaessa pyelonefriittiä tai urosepsista.
Iäkkäät (vähintään 65-vuotiaat)
Iäkkäillä potilailla voi olla suurempi nestehukan riski, ja heitä hoidetaan todennäköisemmin diureeteilla.
Munuaisten vajaatoiminta ja/tai munuaisten toimintaan mahdollisesti vaikuttavien verenpainelääkkeiden, kuten angiotensiinikonvertaasin estäjien (ACE-I) ja angiotensiinireseptorin (tyypin 1) salpaajien (ATR-salpaajien), käyttö on todennäköisempää iäkkäillä potilailla. Kaikille potilaille munuaisten toiminnasta annetut suositukset koskevat myös iäkkäitä potilaita (ks. kohdat Annostus ja antotapa, Varoitukset ja käyttöön liittyvät varotoimet, Haittavaikutukset ja Farmakodynamiikka).
Sydämen vajaatoiminta
Dapagliflotsiinin käytöstä New York Heart Association (NYHA) -luokan IV potilailla on vain vähän kokemusta.
Suurentunut hematokriittiarvo
Dapagliflotsiinihoidon yhteydessä on havaittu hematokriittiarvon suurenemista (ks. kohta Haittavaikutukset). Jos hematokriittiarvo on merkittävästi suurentunut, potilasta on seurattava ja hänet on tutkittava hematologisen perussairauden varalta.
Alaraajojen amputaatiot
Käynnissä olevissa toisella SGLT2:n estäjällä tehdyissä pitkäaikaisissa kliinisissä tutkimuksissa on havaittu alaraaja-amputaatioiden (pääasiassa varvasamputaatioiden) määrän lisääntymistä. Ei tiedetä, onko kyseessä luokkavaikutus. Kuten kaikkien diabetespotilaiden kohdalla, on tärkeää antaa potilaalle ohjeita rutiininomaisesta ennaltaehkäisevästä jalkojenhoidosta.
Virtsan laboratoriotutkimukset
Tämän lääkevalmisteen vaikutusmekanismin vuoksi potilaiden virtsan glukoosimääritys on positiivinen.
Jodivarjoaineiden anto
Jodivarjoaineiden intravaskulaarinen anto voi johtaa varjoainenefropatiaan, joka johtaa metformiinin kumuloitumiseen ja maitohappoasidoosin riskin suurenemiseen. Xigduo-hoito on lopetettava ennen kuvantamistutkimusta tai sen yhteydessä ja aloitettava uudelleen vasta vähintään 48 tunnin kuluttua, kun munuaistoiminta on ensin arvioitu uudelleen ja todettu stabiiliksi (ks. kohdat Annostus ja antotapa ja Yhteisvaikutukset).
Leikkaushoito
Xigduo-hoito on tauotettava yleisanestesiassa tai spinaali- tai epiduraalianestesiassa tehtävän leikkauksen yhteydessä. Hoito voidaan aloittaa uudelleen aikaisintaan 48 tunnin kuluttua leikkauksesta tai peroraalisen ravitsemuksen aloittamisesta, mikäli munuaistoiminta on arvioitu uudelleen ja todettu stabiiliksi.
Kliinisen tilan muutokset potilailla, joilla on aiemmin hyvässä hoitotasapainossa ollut tyypin 2 diabetes
Tämä lääkevalmiste sisältää metformiinia. Mikäli potilaalle, jonka tyypin 2 diabetes on aiemmin ollut hyvässä hoitotasapainossa tämän lääkevalmisteen käytön aikana, kehittyy laboratorioarvojen poikkeavuuksia tai kliininen sairaus (etenkin oireiltaan epäselvä sairaus, jonka diagnosointi on vaikeaa), on tutkimukset ketoasidoosin ja maitohappoasidoosin toteamiseksi aloitettava viipymättä. Tutkimuksiin on liitettävä seerumin elektrolyytti- ja ketoainearvot, verensokeri ja, mikäli aiheellista, veren pH:n ja laktaatti-, pyruvaatti- ja metformiinipitoisuuksien määritykset. Jos potilaalla todetaan jompikumpi asidoosimuoto, hoito on lopetettava heti ja on ryhdyttävä asianmukaisiin toimiin tilanteen korjaamiseksi.
Pienentynyt B12-vitamiinin pitoisuus / B12-vitamiinin puutos
Metformiini voi pienentää B12-vitamiinin pitoisuuksia seerumissa. B12-vitamiinin pitoisuuden pienuuden riski suurenee metformiiniannoksen suurentuessa, hoidon pitkittyessä ja/tai jos potilaalla on riskitekijöitä, joiden tiedetään aiheuttavan B12-vitamiinin puutosta. Jos potilaalla epäillään B12-vitamiinin puutosta (esimerkiksi anemian tai neuropatian yhteydessä), B12-vitamiinin pitoisuuksia seerumissa on seurattava. B12-vitamiinin pitoisuuksien säännöllinen seuranta saattaa olla tarpeen, jos potilaalla on B12-vitamiinin puutoksen riskitekijöitä. Metformiinihoitoa on jatkettava niin kauan kuin se on hyvin siedetty eikä sille ole vasta-aiheita, ja B12-vitamiinin puutoksen yhteydessä on tarjottava asianmukaista korjaavaa hoitoa voimassa olevien hoitosuositusten mukaisesti.
Natrium
Tämä lääkevalmiste sisältää alle 1 mmol (23 mg) natriumia per tabletti eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Dapagliflotsiinin ja metformiinin samanaikainen toistuva anto ei muuttanut merkittävästi dapagliflotsiinin eikä metformiinin farmakokinetiikkaa terveillä tutkittavilla.
Xigduo-valmisteella ei ole tehty yhteisvaikutustutkimuksia. Seuraavassa kerrotaan saatavilla olevat tiedot molemmista vaikuttavista aineista.
Dapagliflotsiini
Farmakodynaamiset yhteisvaikutukset
Diureetit
Tämä lääkevalmiste voi lisätä tiatsidi- ja loop-diureettien diureettisia vaikutuksia, ja nestehukan ja hypotension riski voi suurentua (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Insuliini ja insuliinin eritystä lisäävät lääkeaineet
Insuliini ja insuliinin eritystä lisäävät lääkeaineet, kuten sulfonyyliureat, aiheuttavat hypoglykemiaa. Siksi insuliiniannosta tai insuliinin eritystä lisäävän lääkeaineen annosta voidaan joutua pienentämään hypoglykemiariskin pienentämiseksi, kun niitä käytetään samanaikaisesti dapagliflotsiinin kanssa (ks. kohdat Annostus ja antotapa ja Haittavaikutukset).
Farmakokineettiset yhteisvaikutukset
Dapagliflotsiini metaboloituu pääasiassa UDP-glukuronosyylitransferaasi 1A9 -entsyymin (UGT1A9) välittämän glukuronidikonjugaation kautta.
In vitro -tutkimuksissa dapagliflotsiini ei estänyt sytokromi P450 (CYP) 1A2-, CYP2A6-, CYP2B6-, CYP2C8-, CYP2C9-, CYP2C19-, CYP2D6- ja CYP3A4-entsyymejä eikä indusoinut CYP1A2-, CYP2B6- tai CYP3A4-entsyymejä. Tämän vuoksi tämän lääkevalmisteen ei odoteta muuttavan näiden entsyymien kautta metaboloituvien, samanaikaisesti annettavien lääkevalmisteiden metabolista puhdistumaa.
Muiden lääkevalmisteiden vaikutukset dapagliflotsiiniin
Terveillä tutkittavilla pääasiassa kerta-annosta käyttämällä tehdyt yhteisvaikutustutkimukset viittaavat siihen, että pioglitatsoni, sitagliptiini, glimepiridi, vogliboosi, hydroklooritiatsidi, bumetanidi, valsartaani tai simvastatiini eivät muuta dapagliflotsiinin farmakokinetiikkaa.
Kun rifampisiinia (useiden aktiivisten kuljettajaproteiinien ja lääkkeitä metaboloivien entsyymien indusori) annettiin samanaikaisesti dapagliflotsiinin kanssa, dapagliflotsiinin systeemisessä altistuksessa (AUC) havaittiin rifampisiinin annon jälkeen 22 %:n pieneneminen, mutta kliinisesti merkittävää vaikutusta glukoosin erittymiseen virtsaan 24 tunnin aikana ei todettu. Annoksen muuttamista ei suositella. Kliinisesti merkityksellistä vaikutusta ei odoteta muiden indusorien (esim. karbamatsepiini, fenytoiini, fenobarbitaali) samanaikaisen annon yhteydessä.
Dapagliflotsiinin ja mefenaamihapon (UGT1A9:n estäjä) samanaikaisen annon jälkeen havaittiin 55 %:n suureneminen dapagliflotsiinin systeemisessä altistuksessa, mutta ei kliinisesti merkityksellistä vaikutusta glukoosin erittymiseen virtsaan 24 tunnin aikana. Annoksen muuttamista ei suositella.
Dapagliflotsiinin vaikutukset muihin lääkevalmisteisiin
Dapagliflotsiini saattaa lisätä litiumin erittymistä munuaisten kautta, ja veren litiumpitoisuudet saattavat pienentyä. Seerumin litiumpitoisuutta on seurattava useammin dapagliflotsiinihoidon aloittamisen jälkeen. Potilas tulee ohjata litiumia määränneen lääkärin vastaanotolle seerumin litiumpitoisuuden seurantaa varten.
Terveillä tutkittavilla pääasiassa kerta-annoksia käyttämällä tehdyissä yhteisvaikutustutkimuksissa dapagliflotsiinin ei todettu muuttavan pioglitatsonin, sitagliptiinin, glimepiridin, hydroklooritiatsidin, bumetanidin, valsartaanin, digoksiinin (Pgp-substraatti) tai varfariinin (S-varfariini, CYP2C9-substraatti) farmakokinetiikkaa tai varfariinin veren hyytymistä estäviä vaikutuksia INR-lukemilla mitattuna. Dapagliflotsiinin 20 mg kerta-annoksen ja simvastatiinin (CYP3A4-substraatti) samanaikainen käyttö suurensi simvastatiinin AUC-arvoa 19 % ja simvastatiinihapon AUC-arvoa 31 %. Suurentunutta simvastatiini- ja simvastatiinihappoaltistusta ei pidetä kliinisesti merkittävinä.
Häiriöt 1,5-anhydroglusitolin (1,5-AG) määrityksessä
Glukoositasapainon seurantaa 1,5-AG-määrityksellä ei suositella, koska SGLT2:n estäjiä käyttäviltä potilailta 1,5-AG-määrityksellä mitatut arvot eivät luotettavasti kuvaa glukoositasapainoa. Vaihtoehtoisten menetelmien käyttöä glukoositasapainon seurantaan suositellaan.
Pediatriset potilaat
Yhteisvaikutuksia on tutkittu vain aikuisille tehdyissä tutkimuksissa.
Metformiini
Samanaikaista käyttöä ei suositella
Kationisilla lääkeaineilla, jotka eliminoituvat erittymällä munuaisten kautta tubulussekreetion välityksellä (esim. simetidiini) voi olla yhteisvaikutuksia metformiinin kanssa, sillä ne kilpailevat munuaistubuluksessa samoista kuljetusmekanismeista. Tutkimus, johon osallistui seitsemän tervettä vapaaehtoista, osoitti, että simetidiini (400 mg x 2) suurensi systeemistä metformiinialtistusta (AUC) 50 % ja maksimipitoisuutta (Cmax) 81 %. Siksi glukoositasapainon tarkkaa seurantaa, annosten muuttamista annostussuosituksen puitteissa ja diabeteshoitojen muuttamista on harkittava, jos potilas käyttää samanaikaisesti kationisia lääkevalmisteita, jotka eliminoituvat erittymällä munuaistiehyistä.
Alkoholi
Metformiinin, tämän lääkevalmisteen vaikuttavan aineen, vuoksi alkoholi-intoksikaatioon liittyy suurentunut maitohappoasidoosin riski etenkin paaston, vajaaravitsemuksen tai maksan vajaatoiminnan yhteydessä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Alkoholin ja alkoholia sisältävien lääkevalmisteiden käyttöä tulee välttää.
Jodivarjoaineet
Jodivarjoaineiden anto verisuoneen saattaa johtaa varjoaineen aiheuttamaan nefropatiaan, joka saa aikaan metformiinin kertymistä elimistöön ja suurentaa maitohappoasidoosin riskiä. Xigduo-hoito on lopetettava ennen kuvantamistutkimusta tai sen yhteydessä ja aloitettava uudelleen vasta vähintään 48 tunnin kuluttua, kun munuaistoiminta on ensin arvioitu uudelleen ja todettu stabiiliksi (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Varotoimia vaativat yhdistelmät
Glukokortikoideilla (sekä systeemisesti että paikallisesti käytettäessä), beeta2-agonisteilla ja diureeteilla on luonnostaan verensokeriarvoja suurentava vaikutus. Potilaalle on ilmoitettava asiasta, ja verensokeriarvojen seurantaa on tehostettava etenkin tällaisten lääkevalmisteiden käytön alkuvaiheessa. Verensokeriarvoja pienentävän lääkevalmisteen annosta on tarvittaessa muutettava sekä toisen lääkevalmisteen käytön aikana että sen käytön lopettamisen yhteydessä.
Jotkin lääkevalmisteet voivat huonontaa munuaistoimintaa, mikä voi suurentaa maitohappoasidoosin riskiä. Tällaisia ovat esimerkiksi tulehduskipulääkkeet, myös selektiiviset syklo-oksigenaasi [COX] II:n estäjät, ACE:n estäjät, angiotensiini II ‑reseptorin salpaajat ja diureetit, etenkin loop-diureetit. Munuaistoiminnan tarkka seuranta on tarpeen, jos tällaisia valmisteita otetaan käyttöön tai käytetään yhdessä metformiinin kanssa.
Insuliini ja insuliinin eritystä lisäävät lääkeaineet
Insuliini ja insuliinin eritystä lisäävät lääkeaineet, kuten sulfonyyliureat, aiheuttavat hypoglykemiaa. Siksi insuliiniannosta tai insuliinin eritystä lisäävän lääkeaineen annosta voidaan joutua pienentämään hypoglykemiariskin pienentämiseksi, kun niitä käytetään samanaikaisesti metformiinin kanssa (ks. kohdat Annostus ja antotapa ja Haittavaikutukset).
Raskaus ja imetys
Raskaus
Xigduo-valmisteen tai dapagliflotsiinin käytöstä raskaana oleville naisille ei ole olemassa tietoja. Dapagliflotsiinia saaneilla rotilla tehdyissä tutkimuksissa on osoitettu toksisia vaikutuksia kehittyvään munuaiseen ajanjaksolla, joka vastaa ihmisen toista ja kolmatta raskauskolmannesta (ks. kohta Prekliiniset tiedot turvallisuudesta). Tämän vuoksi tämän lääkevalmisteen käyttöä ei suositella toisen ja kolmannen raskauskolmanneksen aikana. Vähäiset tiedot metformiinin käytöstä raskauden aikana eivät viittaa synnynnäisten epämuodostumien riskin suurenemiseen. Metformiinilla tehtyjen eläinkokeiden tulokset eivät viittaa siihen, että lääkeaineella olisi haitallisia vaikutuksia raskauteen, alkion tai sikiön kehitykseen, synnytykseen tai postnataaliseen kehitykseen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Jos potilas suunnittelee raskautta tai on raskaana, tätä lääkevalmistetta ei suositella hänelle diabeteksen hoitoon. Sen sijaan suositellaan insuliinihoitoa verensokeriarvojen pitämiseen mahdollisimman normaaleina poikkeaviin verensokeriarvoihin liittyvän sikiön epämuodostumien riskin pienentämiseksi.
Imetys
Ei tiedetä, erittyykö tämä lääkevalmiste tai dapagliflotsiini (ja/tai sen metaboliitit) ihmisillä äidinmaitoon. Olemassa olevat farmakodynaamiset/toksikologiset tiedot koe-eläimistä ovat osoittaneet dapagliflotsiinin ja/tai sen metaboliittien erittyvän maitoon sekä farmakologisesti välittyviä vaikutuksia imeväisiin (ks. kohta Prekliiniset tiedot turvallisuudesta). Metformiini erittyy ihmisillä pieninä määrinä äidinmaitoon. Imetettävään vauvaan kohdistuvia riskejä ei voida sulkea pois.
Tätä lääkevalmistetta ei pidä käyttää imetyksen aikana.
Hedelmällisyys
Tämän lääkevalmisteen tai dapagliflotsiinin vaikutusta ihmisten hedelmällisyyteen ei ole tutkittu. Millään tutkitulla dapagliflotsiiniannoksella ei ollut vaikutusta uros- ja naarasrottien hedelmällisyyteen. Metformiinilla tehdyissä eläinkokeissa ei ole havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Xigduo-valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn. Potilaita on varoitettava hypoglykemian riskistä, kun tätä lääkevalmistetta käytetään samanaikaisesti muiden verensokeria alentavien lääkevalmisteiden kanssa, joiden tiedetään aiheuttavan hypoglykemiaa.
Haittavaikutukset
Xigduo-tablettien biologinen samanarvoisuus samanaikaisesti käytettävien dapagliflotsiini- ja metformiinivalmisteiden kanssa on osoitettu (ks. kohta Farmakokinetiikka). Xigduo-tableteilla ei ole tehty kliinisiä hoitotutkimuksia.
Dapagliflotsiinin ja metformiinin yhdistelmä
Haittavaikutusprofiilin yhteenveto
Viidestä lumelääkekontrolloidusta tutkimuksesta, joissa dapagliflotsiinia käytettiin metformiinin lisälääkkeenä, saatujen tulosten analyysissä todettiin, että turvallisuutta koskevat tulokset olivat vastaavat kuin ennalta määritellyssä 13 lumelääkekontrolloidun dapagliflotsiinitutkimuksen yhdistetyssä analyysissä (ks. kohta Dapagliflotsiini, Haittavaikutusprofiilin yhteenveto jäljempänä). Sekä dapagliflotsiinia että metformiinia saaneiden ryhmässä ei todettu enempää haittavaikutuksia kuin oli ilmoitettu yksittäisille aineille. Erillisessä yhdistetyssä analyysissä, jossa käytettiin dapagliflotsiinia metformiinin lisälääkkeenä, 623 tutkittavaa sai 10 mg dapagliflotsiinia metformiinin lisälääkkeenä ja 523 tutkittavaa sai lumelääkettä yhdessä metformiinin kanssa.
Dapagliflotsiini
Haittavaikutusprofiilin yhteenveto
Tyypin 2 diabetesta koskevissa kliinisissä tutkimuksissa yli 15 000:ta potilasta on hoidettu dapagliflotsiinilla.
Ensisijainen turvallisuutta ja siedettävyyttä koskeva arviointi tehtiin ennalta määritellyssä kolmentoista lyhyen (enintään 24 viikkoa kestäneen) lumelääkekontrolloidun tutkimuksen yhdistetyssä analyysissa. Tutkimuksissa 2 360 tutkittavaa sai 10 mg dapagliflotsiinia ja 2 295 tutkittavaa sai lumelääkettä.
Dapagliflotsiinilla tehdyssä sydän- ja verisuonituloksia koskevassa tutkimuksessa (DECLARE, ks. kohta Farmakodynamiikka) 8 574 potilasta sai dapagliflotsiinia 10 mg:n annoksella ja 8 569 potilasta sai lumelääkettä. Altistuksen keston mediaani oli 48 kuukautta. Tutkimuksessa dapagliflotsiinialtistus oli yhteensä 30 623 potilasvuotta.
Kliinisissä tutkimuksissa yleisimmin ilmoitettuja haittavaikutuksia olivat genitaali-infektiot.
Haittavaikutustaulukko
Seuraavia haittavaikutuksia on havaittu dapagliflotsiinin ja metformiinin yhdistelmällä tehdyissä lumelääkekontrolloiduissa kliinisissä tutkimuksissa, dapagliflotsiinilla tehdyissä kliinisissä tutkimuksissa ja metformiinilla tehdyissä kliinisissä tutkimuksissa sekä myyntiluvan myöntämisen jälkeen. Minkään niistä ei todettu riippuvan annoksesta. Seuraavassa luetellut haittavaikutukset on luokiteltu esiintymistiheyden ja elinjärjestelmäluokituksen mukaan. Esiintymistiheydet on määritelty seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000) ja tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Taulukko 2. Dapagliflotsiinia ja metformiinia välittömästi vapauttavien valmisteiden kliinisessä tutkimuksessa ja myyntiluvan myöntämisen jälkeen havaitut haittavaikutukseta
| Elinjärjestelmä | Hyvin yleinen | Yleinen
| Melko harvinainen
| Harvinainen | Hyvin harvinainen |
|---|---|---|---|---|---|
| Infektiot | Vulvovaginiitti, balaniitti ja vastaavat genitaali-infektiot*,b,c Virtsatieinfektiot*,b,d | Sieni-infektio** | Välilihan nekrotisoiva faskiitti (Fournier’n gangreeni)b, j | ||
| Aineenvaihdunta ja ravitsemus | Hypoglykemia (kun käytettiin yhdessä sulfonyyliurean tai insuliinin kanssa)b | Pienentynyt B12-vitamiinin pitoisuus / B12-vitamiinin puutos j,§ | Nestehukkab,e Jano** | Diabeettinen ketoasidoosib, j, k | Maitohappoasidoosi |
| Hermosto | Makuhäiriö§ Huimaus | ||||
| Ruoansulatus-elimistö | Maha-suolikanava-oireeth,§ | Ummetus** Suun kuivuus** | |||
| Maksa ja sappi | Maksan toimintahäiriöt§ Hepatiitti§ | ||||
| Iho ja ihonalainen kudos | Ihottumal | Nokkos-ihottuma§ Punoitus§ Kutina§ | |||
| Luusto, lihakset ja sidekudos | Selkäkipu* | ||||
| Munuaiset ja virtsatiet | Dysuria Polyuria*,f | Nokturia** | Tubulointerstitiaalinen nefriitti | ||
| Sukupuolielimet ja rinnat | Vulvovaginaalinen kutina** Sukupuolielinten kutina** | ||||
| Tutkimukset | Hematokriitti-arvon kohoamineng Pienentynyt kreatiniinin munuaispuhdistuma hoidon alussab Dyslipidemiai | Veren kreatiniini-pitoisuuden kohoaminen hoidon alussa**,b Veren urea-pitoisuuden kohoaminen** Painon lasku** |
aTaulukossa näkyvät haittavaikutukset viikolle 24 saakka (lyhytkestoinen) glukoositasapainon palauttamisesta (glycaemic rescue) riippumatta, lukuun ottamatta §:lla merkittyjä haittavaikutuksia (ks. jäljempänä).
bLisätietoja on vastaavassa alakohdassa.
cVulvovaginiitti, balaniitti ja vastaavat genitaali-infektiot sisältävät esim. seuraavat ennalta määritellyt termit: vulvovaginaalinen mykoottinen infektio, vaginaalinen infektio, balaniitti, genitaalialueen sieni-infektio, vulvovaginaalinen kandidiaasi, vulvovaginiitti, Candidan aiheuttama balaniitti, genitaalialueen kandidiaasi, sukupuolielinten infektio, miehen sukupuolielinten infektio, penistulehdus, vulviitti, bakteerin aiheuttama vaginiitti, vulvan absessi.
dVirtsatieinfektio sisältää seuraavat suositellut termit, jotka on lueteltu ilmoitetun esiintymistiheyden mukaisessa järjestyksessä: virtsatieinfektio, virtsarakkotulehdus, Escherichia colin aiheuttama virtsatieinfektio, virtsa- ja sukupuolielinten infektio, pyelonefriitti, trigoniitti, virtsaputkitulehdus, munuaisinfektio ja eturauhastulehdus.
eVähentynyt nestetilavuus sisältää esim. seuraavat ennalta määritellyt termit: dehydraatio, hypovolemia, alhainen verenpaine.
fPolyuria sisältää seuraavat termit: pollakisuria, polyuria, lisääntynyt virtsantuotanto.
gHematokriittiarvon keskimääräinen muutos lähtötilanteesta oli 2,30 % 10 mg dapagliflotsiinia saaneiden ryhmässä ja -0,33 % lumelääkeryhmässä. Yli 55 %:n hematokriittiarvoja raportoitiin 1,3 %:lla tutkittavista 10 mg dapagliflotsiinia saaneiden ryhmässä ja 0,4 %:lla tutkittavista lumelääkeryhmässä.
hRuuansulatuskanavan oireita, kuten pahoinvointia, oksentelua, ripulia, vatsakipua ja ruokahaluttomuutta esiintyy tiheimmin hoidon alussa, ja ne menevät useimmiten ohi itsestään.
iKeskimääräiset prosentuaaliset muutokset lähtötilanteesta 10 mg dapagliflotsiinia saaneilla verrattuna lumelääkettä saaneisiin olivat: kokonaiskolesteroli 2,5 % (lumelääke: 0,0 %); HDL-kolesteroli 6,0 % (lumelääke: 2,7 %); LDL-kolesteroli 2,9 % (lumelääke: -1,0 %); triglyseridit -2,7 % (lumelääke: -0,7 %).
jKs. kohta Varoitukset ja käyttöön liittyvät varotoimet.
kRaportoitiin tyypin 2 diabetesta sairastavilla potilailla tehdyssä sydän- ja verisuonituloksia koskevassa tutkimuksessa (DECLARE). Esiintymistiheys perustuu vuosittaiseen määrään.
lHaittavaikutus havaittiin myyntiintulon jälkeisessä haittaseurannassa. Ihottuma sisältää seuraavat suositellut termit, jotka on lueteltu kliinisisissä tutkimuksissa todetun esiintymistiheyden mukaisessa järjestyksessä: ihottuma, yleistynyt ihottuma, kutiava ihottuma, täpläinen ihottuma, täpläinen ja näppyläinen ihottuma, märkärakkulainen ihottuma, vesirakkulainen ihottuma ja punoittava ihottuma. Aktiivi- ja lumekontrolloiduissa kliinisissä tutkimuksissa (dapagliflotsiini n = 5 936, verrokkiryhmät n = 3 403) ihottuman esiitymistiheys oli samanlainen dapagliflotsiini- (1,4 %) ja verrokkiryhmissä (1,4 %).
*Raportoitiin ≥ 2 %:lla tutkittavista ja lumelääkkeeseen verrattuna ≥ 1 % useammin ja vähintään 3 tutkittavalla enemmän niistä tutkittavista, jotka saivat 10 mg dapagliflotsiinia.
**Tutkija ilmoitti mahdollisesti tutkimushoitoon liittyvänä, todennäköisesti tutkimushoitoon liittyvänä tai tutkimushoitoon liittyvänä haittavaikutuksena, jota raportoitiin ≥ 0,2 %:lla tutkittavista ja lumelääkkeeseen verrattuna ≥ 0,1 % useammin ja vähintään 3 tutkittavalla enemmän niistä tutkittavista, jotka saivat 10 mg dapagliflotsiinia.
§Metformiinin haittavaikutusten esiintymisluokittelu perustuu Euroopan unionissa hyväksyttyyn metformiinin valmisteyhteenvetoon.
Valikoitujen haittavaikutusten kuvaus
Dapagliflotsiinin ja metformiinin yhdistelmä
Hypoglykemia
Tutkimuksissa, joissa dapagliflotsiinia arvioitiin metformiinin lisälääkkeenä, lievien hypoglykemiatapahtumien esiintymistiheydet olivat samanlaisia ryhmissä, joissa käytettiin dapagliflotsiinia 10 mg ja metformiinia (6,9 %), ja ryhmissä, joissa käytettiin lumelääkettä ja metformiinia (5,5 %). Merkittäviä hypoglykemiatapahtumia ei ilmoitettu. Samanlaisia havaintoja tehtiin, kun dapagliflotsiinin ja metformiinin yhdistelmää annettiin potilaille, jotka eivät aiemmin olleet saaneet lääkehoitoa.
24 viikkoa kestäneessä tutkimuksessa, jossa dapagliflotsiinia arvioitiin metformiinin ja sulfonyyliurean lisälääkkeenä, lieviä hypoglygemiatapahtumia raportoitiin 12,8 %:lla dapagliflotsiinia 10 mg, metformiinia ja sulfonyyliureaa saaneista tutkittavista ja 3,7 %:lla lumelääkettä, metformiinia ja sulfonyyliureaa saaneista tutkittavista. Merkittäviä hypoglykemiatapahtumia ei ilmoitettu.
Dapagliflotsiini
Vulvovaginiitti, balaniitti ja vastaavat genitaali-infektiot
13 tutkimuksen yhdistetyssä turvallisuusanalyysissä vulvovaginiittia, balaniittia ja niihin liittyviä genitaali-infektioita raportoitiin 5,5 %:lla dapagliflotsiinin 10 mg:n annosta saaneista tutkimushenkilöistä ja 0,6 %:lla lumelääkettä saaneista tutkimushenkilöistä. Useimmat infektiot olivat lieviä tai kohtalaisia, ja tutkittavat saivat hoitovasteen ensimmäiseen tavanomaiseen hoitoon. Infektiot johtivat harvoin dapagliflotsiinihoidon keskeyttämiseen. Nämä infektiot olivat yleisempiä naisilla (dapagliflotsiinilla 8,4 % ja lumelääkkeellä 1,2 %), ja aiemmin infektioita sairastaneilla infektion uusiutuminen oli todennäköisempää.
DECLARE-tutkimuksessa vakavia genitaali-infektiotapahtumia ilmeni pienellä määrällä potilaita, ja niitä ilmeni tasaisesti sekä dapagliflotsiini- että lumelääkeryhmässä: 2 potilaalla kummassakin.
Dapagliflotsiinin käytön yhteydessä on raportoitu esiintyvän fimoosia / hankinnaista fimoosia samanaikaisesti sukupuolielinten infektioiden kanssa, ja joissakin tapauksissa tarvittiin ympärileikkaus.
Välilihan nekrotisoiva faskiitti (Fournier’n gangreeni)
Fournier’n gangreenin tapauksia on ilmoitettu markkinoille tulon jälkeen potilailla, jotka käyttävät SGLT2:n estäjiä, dapagliflotsiini mukaan lukien (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
DECLARE-tutkimuksessa, johon osallistui 17 160 potilasta, joilla oli tyypin 2 diabetes, ja jossa altistuksen keston mediaani oli 48 kuukautta, raportoitiin yhtensä kuusi Fournier’n gangreenin tapausta, yksi dapagliflotsiiniryhmässä ja viisi lumelääkeryhmässä.
Hypoglykemia
Hypoglykemian ilmeneminen riippui kussakin tutkimuksessa käytetystä taustahoidosta.
Tutkimuksissa, joissa dapagliflotsiinia arvioitiin metformiinin lisälääkkeenä tai sitagliptiinin lisälääkkeenä (metformiinin kanssa tai ilman sitä), lievien hypoglykemiatapahtumien esiintymistiheys oli samanlainen (< 5 %) hoitoryhmien välillä, lumelääkeryhmä mukaan lukien, kun hoitoa jatkettiin 102 viikkoon asti. Kaikissa tutkimuksissa merkittävät hypoglykemiatapahtumat olivat melko harvinaisia ja niitä oli saman verran dapagliflotsiini- ja lumelääkeryhmässä. Hypoglykemiatapahtumien määrä oli korkeampi tutkimuksissa, joissa käytettiin insuliinia lisähoitona (ks. kohta Yhteisvaikutukset).
104 viikkoa kestäneessä tutkimuksessa, jossa arvioitiin insuliinin lisälääkkeitä, merkittäviä hypoglykemiatapahtumia ilmoitettiin dapagliflotsiinia 10 mg ja insuliinia saaneista tutkittavista 0,5 %:lla viikkoon 24 mennessä ja 1,0 %:lla viikkoon 104 mennessä ja 0,5 %:lla tutkittavista, jotka olivat saaneet lumelääkettä ja insuliinia, viikkoihin 24 ja 104 mennessä. Lieviä hypoglykemiatapahtumia ilmoitettiin viikkoon 24 mennessä 40,3 %:lla ja viikkoon 104 mennessä 53,1 %:lla tutkittavista, jotka olivat saaneet dapagliflotsiinia 10 mg ja insuliinia, ja 34,0 %:lla (viikkoon 24 mennessä) ja 41,6 %:lla (viikkoon 104 mennessä) tutkittavista, jotka olivat saaneet lumelääkettä ja insuliinia.
DECLARE-tutkimuksessa merkittävien hypoglykemiatapahtumien riskin ei havaittu suurentuneen dapagliflotsiinihoitoa saaneilla lumelääkettä saaneisiin verrattuna. Merkittäviä hypoglykemiatapahtumia ilmoitettiin 58:lla dapagliflotsiinia saaneella potilaalla (0,7 %) ja 83:lla lumelääkettä saaneella potilaalla (1,0 %).
Nestehukka
13 tutkimuksen yhdistetyssä turvallisuusanalyysissä nestehukkaan viittaavia haittavaikutuksia (mm. dehydraatio, hypovolemia tai alhainen verenpaine) raportoitiin 1,1 %:lla tutkittavista, joita hoidettiin dapagliflotsiinin 10 mg:n annoksella, ja 0,7 %:lla tutkittavista, jotka saivat lumelääkettä. Vakavia haittavaikutuksia esiintyi < 0,2 %:lla tutkittavista ja niitä todettiin saman verran dapagliflotsiinin 10 mg:n annosta ja lumelääkettä saaneilla potilailla (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
DECLARE-tutkimuksessa potilaita, joilla todettiin nestehukkaan viittaavia tapahtumia, oli saman verran eri hoitoryhmissä: 213 (2,5 %) dapagliflotsiiniryhmässä ja 207 (2,4 %) lumelääkeryhmässä. Vakavia haittatapahtumia raportoitiin 81:llä dapagliflotsiiniryhmän potilaista (0,9 %:lla) ja 70:llä lumelääkeryhmän potilaista (0,8 %:lla). Tapahtumia oli yleisesti saman verran eri hoitoryhmissä ikään, diureettien käyttöön, verenpaineeseen ja ACE:n estäjien tai ATR:n salpaajien käyttöön perustuvissa alaryhmissä. Potilailla, joiden eGFR oli lähtötilanteessa < 60 ml/min/1,73 m2, todettiin 19 nestehukkaan viittaavaa vakavaa haittatapahtumaa dapagliflotsiiniryhmässä ja 13 tapahtumaa lumelääkeryhmässä.
Diabeettinen ketoasidoosi
DECLARE-tutkimuksessa, jossa altistuksen keston mediaani oli 48 kuukautta, diabeettista ketoasidoosia raportoitiin 27 potilaalla 10 mg dapagliflotsiinia saaneiden ryhmässä ja 12 potilaalla lumelääkeryhmässä. Tapahtumat jakautuivat tasaisesti koko tutkimusjaksolle. 27:stä dapagliflotsiiniryhmän potilaasta, joilla esiintyi diabeettista ketoasidoosia, 22:ta hoidettiin tapahtumahetkellä samanaikaisesti insuliinilla. Diabeettisen ketoasidoosin taustalla olevat syyt olivat tyypin 2 diabetesta sairastavien potilaiden populaatiossa odotusten mukaisia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Virtsatieinfektiot
13 tutkimuksen yhdistetyssä turvallisuusanalyysissä virtsatieinfektioita raportoitiin useammin dapagliflotsiinilla hoidetuilla (4,7 %) kuin lumelääkettä saaneilla (3,5 %) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Useimmat infektiot olivat lieviä tai kohtalaisia, ja tutkittavat saivat hoitovasteen ensimmäiseen tavanomaiseen hoitoon. Infektiot johtivat harvoin dapagliflotsiinihoidon keskeyttämiseen. Nämä infektiot olivat yleisempiä naisilla, ja aiemmin infektioita sairastaneilla infektion uusiutuminen oli todennäköisempää.
DECLARE-tutkimuksessa vakavia virtsatieinfektioita ilmoitettiin harvemmin 10 mg dapagliflotsiinia saaneiden ryhmässä, 79 (0,9 %) verrattuna lumelääkeryhmään 109 (1,3 %).
Suurentuneet kreatiniiniarvot
Suurentuneisiin kreatiniiniarvoihin liittyvät haittavaikutukset koottiin ryhmäksi (esim. pienentynyt kreatiniinin munuaispuhdistuma, munuaisten vajaatoiminta, kohonneet kreatiniiniarvot veressä ja pienentynyt glomerulusten suodatusnopeus). Tähän ryhmään kuuluvia haittavaikutuksia ilmoitettiin 3,2 %:lla potilaista, jotka saivat 10 mg dapagliflotsiinia, ja 1,8 %:lla potilaista, jotka saivat lumelääkettä. Potilailla, joiden munuaisten toiminta oli normaali tai joilla oli lievä munuaisten vajaatoiminta (lähtötilanteen eGFR ≥ 60 ml/min/1,73 m2), tähän ryhmään kuuluvia haittavaikutuksia ilmoitettiin 1,3 %:lla potilaista, jotka saivat 10 mg dapagliflotsiinia, ja 0,8 %:lla potilaista, jotka saivat lumelääkettä. Nämä haittavaikutukset olivat yleisempiä potilailla, joiden lähtötilanteen eGFR oli ≥ 30 ja < 60 ml/min/1,73 m2 (10 mg dapagliflotsiinia saaneiden ryhmässä 18,5 % ja lumelääkeryhmässä 9,3 %).
Munuaisiin liittyneitä haittavaikutuksia saaneiden potilaiden tarkempi arviointi osoitti, että useimmilla seerumin kreatiniiniarvot olivat muuttuneet ≤ 44 mikromoolia/l (≤ 0,5 mg/dl) lähtötilanteesta. Kreatiniiniarvojen suureneminen oli yleensä tilapäistä jatkuvan hoidon aikana tai palautuvaa hoidon lopettamisen jälkeen.
DECLARE-tutkimuksessa, johon osallistui myös iäkkäitä potilaita ja potilaita, joilla oli munuaisten vajaatoiminta (eGFR alle 60 ml/min/1,73 m2), eGFR pieneni ajan myötä molemmissa hoitoryhmissä. 1 vuoden kohdalla keskimääräinen eGFR oli dapagliflotsiiniryhmässä hieman pienempi ja 4 vuoden kohdalla hieman suurempi verrattuna lumelääkeryhmään.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Dapagliflotsiinin poistamista hemodialyysilla ei ole tutkittu. Metformiinin ja laktaatin poistaminen elimistöstä onnistuu tehokkaimmin hemodialyysin avulla.
Dapagliflotsiini
Dapagliflotsiinin ei osoitettu aiheuttavan minkäänlaista toksisuutta terveillä tutkittavilla, kun se otettiin suun kautta enintään 500 mg:n kerta-annoksina (50-kertainen ihmiselle suositeltuun enimmäisannokseen nähden). Näillä tutkittavilla havaittiin glukoosia virtsassa aikana, joka oli suhteessa annoksen suuruuteen (vähintään 5 vuorokauden ajan 500 mg:n annoksella), ilman ilmoituksia nestehukasta, hypotensiosta tai elektrolyyttihäiriöstä tai kliinisesti merkittävästä vaikutuksesta QTc-aikaan. Hypoglykemian esiintyvyys oli samankaltainen kuin lumelääkeryhmässä. Kliinisissä tutkimuksissa, joissa terveille tutkittaville ja tyypin 2 diabetesta sairastaville tutkittaville annettiin kerran päivässä 2 viikon ajan enintään 100 mg:n annoksia (10-kertainen ihmisen suositeltuun enimmäisannokseen nähden), hypoglykemiaa ilmaantui hieman useammin kuin lumelääkeryhmässä, eikä ilmaantuvuus ollut annoksesta riippuvainen. Haittavaikutusten määrät,nestehukka ja hypotensio mukaan lukien, olivat samankaltaiset kuin lumelääkeryhmässä. Laboratorioparametreissa, seerumin elektrolyytit ja munuaistoiminnan biomerkkiaineet mukaan lukien, ei ollut kliinisesti merkittäviä annoksesta riippuvia muutoksia.
Yliannostustapauksessa on aloitettava asianmukainen tukihoito potilaan kliinisen tilan mukaan.
Metformiini
Metformiinin suuri yliannostus tai muut samanaikaiset riskitekijät voivat johtaa maitohappoasidoosiin. Maitohappoasidoosi on lääketieteellinen hätätilanne, joka vaatii sairaalahoitoa.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Diabeteslääkkeet, oraalisten veren glukoosipitoisuutta pienentävien lääkkeiden yhdistelmävalmisteet, ATC-koodi: A10BD15
Vaikutusmekanismi
Xigduo on yhdistelmävalmiste, joka sisältää kahta kohonneita verensokeripitoisuuksia pienentävää lääkettä. Niiden erilaiset vaikutusmekanismit täydentävät toisiaan, mikä parantaa tyypin 2 diabeetikon glukoositasapainon hallintaa. Nämä lääkkeet ovat dapagliflotsiini, joka on SGLT2:n estäjä, ja metformiinihydrokloridi, joka kuuluu biguanidien lääkeryhmään.
Dapagliflotsiini
Dapagliflotsiini on erittäin voimakas (Ki: 0,55 nM), selektiivinen ja reversiibeli SGLT2 estäjä.
Dapagliflotsiinin aikaansaama SGLT2:n esto vähentää glukoosin takaisinimeytymistä glomerulussuodoksesta proksimaalisessa munuaistiehyessä, ja samalla natriumin takaisinimeytyminen vähenee, mikä johtaa glukoosin erittymiseen virtsaan ja osmoottiseen diureesiin. Näin dapagliflotsiini lisää natriumin siirtymistä distaaliseen munuaistiehyeen, mikä lisää tubuloglomerulaarista palautetta ja pienentää intraglomerulaarista painetta. Tämä yhdistettynä osmoottiseen diureesiin johtaa tilavuusylikuormituksen vähenemiseen, verenpaineen laskuun ja sydämen esikuormituksen ja jälkikuormituksen vähenemiseen, millä voi olla suotuisia vaikutuksia sydämen uudelleen muotoutumiseen ja diastoliseen toimintaan ja mikä voi ylläpitää munuaistoimintaa. Dapagliflotsiinin hyödyt sydämelle ja munuaisille eivät riipu pelkästään dapagliflotsiinin veren glukoosipitoisuuksia pienentävästä vaikutuksesta. Muita vaikutuksia ovat hematokriitin suureneminen ja painon lasku.
Dapagliflotsiini parantaa sekä plasman paastoglukoosia että aterian jälkeistä glukoosia vähentämällä glukoosin takaisinimeytymistä munuaisissa, mikä johtaa glukoosin erittymiseen virtsaan. Tämä glukoosin erittyminen (glukosuurinen vaikutus) havaitaan ensimmäisen annoksen jälkeen, se jatkuu 24 tunnin annosvälien aikana ja kestää koko hoidon ajan. Munuaisten tällä mekanismilla poistaman glukoosin määrä riippuu veren glukoosipitoisuudesta ja glomerulusten suodatusnopeudesta. Henkilöillä, joilla veren glukoosipitoisuus on normaali, dapagliflotsiinin taipumus aiheuttaa hypoglykemiaa on siis pieni. Dapagliflotsiini ei heikennä normaalia hypoglykemian aiheuttamaa endogeenista glukoosin tuotantoa. Dapagliflotsiini toimii insuliinin erityksestä ja toiminnasta riippumatta. Beetasolujen toiminnan on havaittu parantuneen homeostaasimallimäärityksessä (HOMA beta-cell) dapagliflotsiinin kliinisissä tutkimuksissa.
SGLT2 ilmentyy selektiivisesti munuaisissa. Dapagliflotsiini ei estä muita glukoosin kuljettajaproteiineja, jotka ovat tärkeitä glukoosin kuljettamisessa perifeerisiin kudoksiin. Se on > 1 400 kertaa selektiivisempi SGLT2- kuin SGLT1-kuljettajaproteiinia kohtaan, joka on tärkein glukoosin imeytymisestä vastaava kuljettajaproteiini suolessa.
Metformiini
Metformiini on biguanidien ryhmään kuuluva lääke, joka pienentää kohonneita verensokeripitoisuuksia. Sen vaikutus kohdistuu sekä basaalisiin että aterianjälkeisiin plasman glukoosipitoisuuksiin. Se ei stimuloi insuliinieritystä eikä siten aiheuta hypoglykemiaa.
Metformiinilla on kolme mahdollista vaikutusmekanismia:
- maksan glukoosituotanto vähenee, kun glukoneogeneesi ja glykogenolyysi estyvät;
- lihasten insuliiniherkkyys paranee jonkin verran, mikä tehostaa glukoosin soluunottoa ja käyttöä lihaksessa;
- glukoosin imeytyminen suolesta viivästyy.
Metformiini stimuloi solunsisäistä glykogeenisynteesiä vaikuttamalla glykogeenisyntaasientsyymiin. Metformiini parantaa solukalvon tiettyjen glukoosinkuljettajaproteiinien (GLUT 1 ja GLUT 4) kuljetuskapasiteettia.
Farmakodynaamiset vaikutukset
Dapagliflotsiini
Virtsaan erittyvän glukoosin määrän havaittiin lisääntyneen terveillä tutkittavilla ja tyypin 2 diabetesta sairastavilla tutkittavilla dapagliflotsiinin antamisen jälkeen. Kun tyypin 2 diabetesta sairastaville tutkittaville annettiin 12 viikon ajan 10 mg:n vuorokausiannos dapagliflotsiinia, virtsaan erittyi noin 70 grammaa glukoosia vuorokaudessa (mikä vastaa 280 kcal:a vuorokaudessa). Jatkuvaa glukoosin erittymistä havaittiin tyypin 2 diabetesta sairastavilla tutkittavilla, joille annettiin 10 mg dapagliflotsiinia vuorokaudessa 2 vuoden ajan.
Tämä dapagliflotsiinin aikaansaama glukoosin erittyminen virtsaan johtaa lisäksi osmoottiseen diureesiin ja virtsamäärän lisääntymiseen tyypin 2 diabetesta sairastavilla henkilöillä. Virtsamäärän lisääntyminen tyypin 2 diabetesta sairastavilla tutkittavilla, joita hoidettiin 10 mg:n dapagliflotsiiniannoksella, oli pysyvää 12 viikon ajan, ja virtsamäärä lisääntyi noin 375 ml vuorokaudessa. Virtsan tilavuuden lisääntyminen lisäsi vähän ja ohimenevästi natriumin erittymistä virtsaan, mihin ei liittynyt seerumin natriumpitoisuuksien muutoksia.
Myös virtsahapon erittyminen virtsaan lisääntyi hetkellisesti (3–7 päivän ajaksi), mitä seurasi pysyvä lasku seerumin virtsahappopitoisuudessa. Viikolla 24 seerumin virtsahappopitoisuuden väheneminen vaihteli välillä -48,3 – -18,3 mikromoolia/l (-0,87 – -0,33 mg/dl).
Kaksi kertaa vuorokaudessa annettavan 5 mg:n dapagliflotsiiniannoksen ja kerran vuorokaudessa annettavan 10 mg dapagliflotsiiniannoksen farmakodynamiikkaa verrattiin terveillä tutkittavilla. Munuaisissa tapahtuvan glukoosin takaisin imeytymisen vakaan tilan estyminen ja glukoosin eritys virtsaan 24 tunnin aikana olivat samanlaiset molemmille lääkeannoksille.
Metformiini
Metformiinilla on suotuisa vaikutus ihmisen lipidiaineenvaihduntaan. Vaikutus ei riipu sen glukoosiarvoihin kohdistuvasta vaikutuksesta. Tämä on todettu hoitoannoksilla kontrolloiduissa keskipitkissä ja pitkissä kliinisissä tutkimuksissa, joissa metformiini pienensi kokonaiskolesterolin, LDL-kolesterolin ja triglyseridien pitoisuuksia.
Kliinisissä tutkimuksissa metformiinin käytön yhteydessä paino joko säilyi ennallaan tai hiukan laski.
Kliininen teho ja turvallisuus
Sekä glukoositasapainon parantaminen että sydämeen ja verisuoniin liittyvän sairastuvuuden ja kuolleisuuden vähentäminen ovat olennainen osa tyypin 2 diabeteksen hoitoa.
Dapagliflotsiinin ja metformiinin yhdistelmää on arvioitu tyypin 2 diabetesta sairastavilla tutkittavilla, joiden hoitotasapaino on riittämätön pelkällä ruokavaliolla ja liikunnalla, ja tutkittavilla, joiden hoitotasapaino on riittämätön käytettäessä pelkkää metformiinia tai metformiinin ja dipeptidyylipeptidaasi-4:n (DPP-4:n) estäjän (sitagliptiinin), sulfonyyliurean tai insuliinin yhdistelmää. Dapagliflotsiinin ja metformiinin yhdistelmän kaikki annokset paransivat kliinisesti ja tilastollisesti merkitsevästi HbA1c-arvoja ja paastoglukoosiarvoja verrokkiin nähden. Kliinisesti merkittävät glykeemiset vaikutukset säilyivät pitkäaikaisessa tutkimuksessa 104 viikkoon asti. HbA1c-arvo laski kaikissa alaryhmissä, kun ryhmittelyperusteena olivat sukupuoli, ikä, rotu, sairauden kesto ja lähtötilanteen painoindeksi. Lisäksi kehon painon keskimääräiset muutokset lähtötilanteesta paranivat kliinisesti ja tilastollisesti merkitsevästi dapagliflotsiinin ja metformiinin yhdistelmähoidoilla verrokkiryhmään nähden. Painon väheneminen säilyi pitkäaikaisessa tutkimuksessa 208 viikkoon asti. Lisäksi metformiinin lisänä käytetyn kaksi kertaa vuorokaudessa annetun dapagliflotsiinihoidon todettiin olevan tehokas ja hyvin siedetty tyypin 2 diabetesta sairastaville tutkittaville. Lisäksi tehtiin kaksi 12 viikon pituista lumelääkekontrolloitua tutkimusta potilailla, joiden tyypin 2 diabeteksen hoitotasapaino oli riittämätön ja joilla oli verenpainetauti.
DECLARE-tutkimuksessa dapagliflotsiini vakiohoidon lisälääkkeenä vähensi sydän-, verisuoni- ja munuaistapahtumia tyypin 2 diabetesta sairastavilla potilailla.
Glukoositasapaino
Hoito lisälääkeyhdistelmillä
52 viikkoa kestäneessä aktiivikontrolloidussa tutkimuksessa (52 ja 104 viikon pituiset jatkovaiheet mukaan lukien), jossa pyrittiin osoittamaan dapagliflotsiini vertailukelpoiseksi (non-inferior), verrattiin 10 mg:n dapagliflotsiiniannosta metformiinin lisähoitona sulfonyyliureaan (glipitsidiin) metformiinin lisähoitona tutkittavilla, joiden glukoositasapaino oli riittämätön (HbA1c > 6,5 % ja < 10 %). Tulokset osoittivat HbA1c-arvon keskimääräisen pienenemisen lähtötilanteesta viikolle 52 olevan samankaltainen verrattuna glipitsidiin, mikä osoittaa vertailukelpoisuuden (taulukko 3). HbA1c-arvon korjattu keskimääräinen muutos lähtötilanteesta viikolla 104 oli -0,32 % dapagliflotsiinia saaneiden ryhmässä ja -0,14 % glipitsidia saaneiden ryhmässä. HbA1c-arvon korjattu keskimääräinen muutos lähtötilanteesta viikolla 208 oli -0,10 % dapagliflotsiinia saaneiden ryhmässä ja 0,20 % glipitsidia saaneiden ryhmässä. Dapagliflotsiinilla hoidetun ryhmän tutkittavista huomattavasti pienempi osuus (3,5 % viikolla 52, 4,3 % viikolla 104 ja 5,0 % viikolla 208) koki vähintään yhden hypoglykemiatapahtuman verrattuna glipitsidilla hoidettuun ryhmään (40,8 % viikolla 52, 47,0 % viikolla 104 ja 50,0 % viikolla 208). Niiden tutkittavien osuus, jotka olivat jatkaneet tutkimusta viikkoon 104 asti, oli 56,2 % dapagliflotsiinilla hoidettujen ryhmässä ja 50,0 % glipitsidilla hoidettujen ryhmässä, ja niiden tutkittavien osuus, jotka olivat jatkaneet tutkimusta viikkoon 208 asti, oli 39,7 % dapagliflotsiinilla hoidettujen ryhmässä ja 34,6 % glipitsidilla hoidettujen ryhmässä.
Taulukko 3. Tulokset viikolla 52 (LOCFa) aktiivikontrolloidussa tutkimuksessa, jossa verrattiin dapagliflotsiinia glipitsidiin metformiinin lisähoitona
| Parametri | Dapagliflotsiini + metformiini | Glipitsidi + metformiini |
| Nb | 400 | 401 |
| HbA1c (%) | ||
| Lähtötilanne (keskiarvo) | 7,69 | 7,74 |
| Muutos lähtötilanteestac | -0,52 | -0,52 |
| Ero glipitsidiin + metformiiniin nähdenc (95 %:n luottamusväli) | 0,00d (-0,11, 0,11) | - |
| Paino (kg) | ||
| Lähtötilanne (keskiarvo) | 88,44 | 87,60 |
| Muutos lähtötilanteestac | -3,22 | 1,44 |
| Ero glipitsidiin + metformiiniin nähdenc (95 %:n luottamusväli) | -4,65* (-5,14, -4,17) | - |
aLOCF: Viimeisestä havainnosta laskettu arvio (last observation carried forward).
bSatunnaistetut ja hoidetut tutkittavat, joilla teho mitattiin lähtötilanteessa ja ainakin kerran lähtötilanteen jälkeen.
cPienimmän neliösumman keskiarvo suhteutettuna lähtötilanteen arvoon.
dVertailukelpoinen glipitsidin + metformiinin kanssa.
*p-arvo < 0,0001.
Dapagliflotsiini joko pelkän metformiinin tai metformiinin ja sitagliptiinin yhdistelmän, sulfonyyliurean tai insuliinin lisälääkkeenä (suun kautta lisäksi annettujen glukoosipitoisuutta pienentävien lääkkeiden, kuten metformiinin, kanssa tai ilman niitä) laski keskimääräisiä HbA1c-arvoja tilastollisesti merkitsevästi viikolla 24 verrattuna lumelääkettä saaneisiin tutkittaviin (p < 0,0001, taulukot 4, 5 ja 6). Kaksi kertaa vuorokaudessa annettu 5 mg:n dapagliflotsiiniannos pienensi tilastollisesti merkitsevästi HbA1c-arvoja viikolla 16 verrattuna lumelääkettä saaneisiin tutkittaviin (p < 0,0001, taulukko 4).
Viikolla 24 todettu HbA1c-arvojen pieneneminen säilyi lisälääkeyhdistelmiä arvioineissa tutkimuksissa. Tutkimuksessa, jossa arvioitiin dapagliflotsiinia metformiinin lisälääkkeenä, HbA1c-arvojen pieneneminen säilyi viikolle 102 saakka (korjattu HbA1c-arvon muutos lähtötilanteesta 10 mg:n dapagliflotsiiniannoksella 0,78 % ja lumelääkkeellä 0,02 %). Metformiinin ja sitagliptiinin yhdistelmää saaneilla korjattu keskimääräinen muutos lähtötilanteesta viikolla 48 oli 10 mg:n dapagliflotsiiniannoksella 0,44 % ja lumelääkeryhmässä 0,15 %. Insuliinia (yhdessä suun kautta lisäksi annettujen glukoosipitoisuutta pienentävien lääkkeiden, kuten metformiinin, kanssa tai ilman niitä) saaneilla HbA1c-arvon korjattu keskimääräinen muutos lähtötilanteesta viikolla 104 oli -0,71 % dapagliflotsiiniryhmässä (10 mg:n annoksella) ja -0,06 % lumelääkeryhmässä. Viikoilla 48 ja 104 insuliiniannos oli pysynyt vakaana lähtötilanteeseen nähden tutkittavilla, joita hoidettiin 10 mg:n dapagliflotsiiniannoksella, joka tarkoittaa keskimäärin 76 IU:n annosta vuorokaudessa. Lumelääkettä saaneiden ryhmässä annos oli suurentunut lähtötilanteesta keskimäärin 10,5 IU/vrk viikolla 48 (keskimääräinen annos 84 IU/vrk) ja 18,3 IU/vrk viikolla 104 (keskimääräinen annos 92 IU/vrk). Niiden tutkittavien osuus, jotka olivat jatkaneet tutkimusta viikkoon 104 asti, oli dapagliflotsiinilla hoidettujen ryhmässä 72,4 % ja lumelääkettä saaneiden ryhmässä 54,8 %.
Erillisessä insuliinin ja metformiinin yhdistelmää saaneilla tutkittavilla tehdyssä analyysissä dapagliflotsiinia ja insuliinin ja metformiinin yhdistelmää saaneilla todettiin samanlainen HbA1c-arvojen pieneneminen kuin kokonaistutkimuspopulaatiossa. Viikolla 24 HbA1c-arvojen muutos lähtötilanteesta oli dapagliflotsiinia ja insuliinia sekä metformiinia saaneilla tutkittavilla 0,93 %.
Taulukko 4. Tulokset 24 viikkoa kestäneistä (LOCFa) lumevertailututkimuksista, joissa dapagliflotsiini oli metformiinin tai metformiinin ja sitagliptiinin yhdistelmän lisälääkkeenä
| Lisälääkeyhdistelmä | ||||||
| Metformiini1 | Metformiini1,b | Metformiini1 + sitagliptiini2 | ||||
| Dapagliflotsiini 10 mg QD | Lumelääke QD | Dapagliflotsiini 5 mg BID | Lumelääke BID | Dapagliflotsiini 10 mg QD | Lumelääke QD | |
| Nc | 135 | 137 | 99 | 101 | 113 | 113 |
| HbA1c (%) | ||||||
| Lähtötilanne (keskiarvo) | 7,92 | 8,11 | 7,79 | 7,94 | 7,80 | 7,87 |
| Muutos lähtötilanteestad | -0,84 | -0,30 | -0,65 | -0,30 | -0,43 | -0,02 |
| Ero lumelääkkeeseen verrattunad (95 %:n luottamusväli) | -0,54* (-0,74, -0,34) | - | -0,35* (-0,52, -0,18) | - | -0,40* (-0,58, -0,23) | - |
| Tutkittavat (%), jotka saavuttivat seuraavat arvot: HbA1c < 7 % | ||||||
| Korjattuna suhteessa lähtötilanteeseen | 40,6** | 25,9 | 38,2** (n=90) | 21,4 (n=87) | ||
| Paino (kg) | ||||||
| Lähtötilanne (keskiarvo) | 86,28 | 87,74 | 93,62 | 88,82 | 93,95 | 94,17 |
| Muutos lähtötilanteestad | -2,86 | -0,89 | -2,74 | -0,86 | -2,35 | -0,47 |
| Ero lumelääkkeeseen verrattunad (95 %:n luottamusväli) | -1,97* (-2,63, -1,31) | - | -1,88*** (-2,52, -1,24) | - | -1,87* (-2,61, -1,13) | - |
Lyhenteet: QD: kerran vuorokaudessa; BID: kaksi kertaa vuorokaudessa.
1Metformiini ≥ 1 500 mg/vrk.
2Sitagliptiini 100 mg/vrk.
aLOCF: Viimeisestä havainnosta (ennen glukoositason korjaamista (glycaemic rescue) sitä edellyttäneillä tutkittavilla) laskettu arvio (last observation carried forward).
b16 viikkoa kestänyt lumelääkekontrolloitu tutkimus.
cKaikki satunnaistetut tutkittavat, jotka saivat vähintään yhden annoksen kaksoissokkoutettua tutkimuslääkettä lyhytkestoisen kaksoissokkoutetun hoitojakson aikana.
dPienimmän neliösumman keskiarvo suhteutettuna lähtötilanteen arvoon.
*p-arvo < 0,0001 verrattuna lumelääkkeeseen + suun kautta otettavaan glukoosipitoisuutta pienentävään lääkevalmisteeseen.
**p-arvo < 0,05 verrattuna lumelääkkeeseen + suun kautta otettavaan glukoosipitoisuutta pienentävään lääkevalmisteeseen.
***Painon prosentuaalinen muutos analysoitiin keskeisenä toissijaisena päätemuuttujana (p < 0,0001); absoluuttinen painon muutos (kg) analysoitiin käyttämällä nimellistä p-arvoa (p < 0,0001).
Taulukko 5. Tulokset 24 viikkoa kestäneestä lumelääkekontrolloidusta tutkimuksesta, jossa tutkittiin dapagliflotsiinia metformiinin ja sulfonyyliurean lisälääkkeenä.
| Lisälääkeyhdistelmä | ||
| Sulfonyyliurea + metformiini1 | ||
| Dapagliflotsiini 10 mg | Lumelääke | |
| Na | 108 | 108 |
| HbA1c (%)b | ||
| Lähtötilanne (keskiarvo) | 8,08 | 8,24 |
| Muutos lähtötilanteestac | -0,86 | -0,17 |
| Ero lumelääkkeeseen verrattunac (95 %:n luottamusväli) | -0,69* (-0,89, -0,49) | - |
| Tutkittavat (%), jotka saavuttivat seuraavat arvot: | ||
| HbA1c < 7% | ||
| Korjattuna suhteessa lähtötilanteeseen | 31,8* | 11,1 |
| Paino (kg) | ||
| Lähtötilanne (keskiarvo) | 88,57 | 90,07 |
| Muutos lähtötilanteestac | -2,65 | -0,58 |
| Ero lumelääkkeeseen verrattunac (95 %:n luottamusväli) | -2,07* (-2,79, -1,35) | - |
1Metformiini (välittömästi tai hitaasti vapautuvat lääkemuodot) ≥ 1 500 mg/vrk; lisäksi suurin siedetty annos sulfonyyliureaa, joka oli kuitenkin vähintään puolet enimmäisannoksesta ja jota annettiin vähintään 8 viikon ajan ennen osallistumista.
a Satunnaistetut ja hoidetut tutkittavat, joilla teho mitattiin lähtötilanteessa ja ainakin kerran lähtötilanteen jälkeen.
bHbA1c analysoitiin käyttäen pitkittäistä toistomittausten analyysia.
cPienimmän neliösumman keskiarvo suhteutettuna lähtötilanteen arvoon.
*p-arvo < 0,0001 verrattuna lumelääkkeen ja suun kautta otettavan glukoosipitoisuutta pienentävän lääkevalmisteen yhdistelmään.
Taulukko 6. Tulokset viikolla 24 (LOCFa) lumelääkekontrolloidussa tutkimuksessa, jossa tutkittiin dapagliflotsiinin ja insuliinin yhdistelmää (yksin tai yhdessä suun kautta annettavien glukoosipitoisuutta pienentävien lääkevalmisteiden, kuten metformiinin, kanssa)
| Parametri | Dapagliflotsiini 10 mg + insuliini ± suun kautta otettavat glukoosipitoisuutta pienentävät lääkevalmisteet2 | Lumelääke + insuliini ± suun kautta otettavat glukoosipitoisuutta pienentävät lääkevalmisteet2 |
| Nb | 194 | 193 |
| HbA1c (%) | ||
| Lähtötilanne (keskiarvo) | 8,58 | 8,46 |
| Muutos lähtötilanteestac | -0,90 | -0,30 |
| Ero lumelääkkeeseen verrattunac (95 %:n luottamusväli) | -0,60* (-0,74, -0,45) | - |
| Paino (kg) | ||
| Lähtötilanne (keskiarvo) | 94,63 | 94,21 |
| Muutos lähtötilanteestac | -1,67 | 0,02 |
| Ero lumelääkkeeseen verrattunac (95 %:n luottamusväli) | -1,68* (-2,19, -1,18) | - |
| Insuliinin keskimääräinen vuorokausiannos (IU)1 | ||
| Lähtötilanne (keskiarvo) | 77,96 | 73,96 |
| Muutos lähtötilanteestac | -1,16 | 5,08 |
| Ero lumelääkkeeseen verrattunac (95 %:n luottamusväli) | -6,23* (-8,84, -3,63) | - |
| Tutkittavat (%), joiden insuliinin vuorokausiannos on pienentynyt keskimäärin vähintään 10 % | 19,7** | 11,0 |
aLOCF: Viimeisestä havainnosta laskettu arvo (juuri ennen tai sinä päivänä kun insuliiniannosta on ensimmäisen kerran nostettu, mikäli tarpeen; last observation carried forward).
bKaikki satunnaistetut tutkittavat, jotka saivat vähintään yhden annoksen kaksoissokkoutettua tutkimuslääkettä lyhytkestoisen kaksoissokkoutetun hoitojakson aikana.
cPienimmän neliösumman keskiarvo suhteutettuna lähtötilanteen arvoon ja suun kautta otettavan glukoosipitoisuutta pienentävän lääkevalmisteen käyttö.
*p-arvo < 0,0001 verrattuna lumelääkkeeseen + insuliiniin ± suun kautta otettavaan glukoosipitoisuutta pienentävään lääkevalmisteeseen.
**p-arvo < 0,05 verrattuna lumelääkkeeseen + insuliiniin ± suun kautta otettavaan glukoosipitoisuutta pienentävään lääkevalmisteeseen.
1Insuliinihoitojen (lyhytvaikutteisen, keskipitkävaikutteisen ja perusinsuliinin) titraus ylöspäin sallittiin vain tutkittavilla, jotka täyttivät paastoverensokeria koskevat ennalta asetetut kriteerit.
250 % tutkittavista sai insuliinia monoterapiana lähtötilanteessa; 50 % sai yhtä tai kahta suun kautta otettavaa glukoosipitoisuutta pienentävää lääkevalmistetta insuliinin lisäksi: Jälkimmäisestä ryhmästä 80 % sai pelkästään metformiinia, 12 % metformiinia ja sulfonyyliureaa ja loput muita suun kautta otettavia glukoosipitoisuutta pienentäviä lääkevalmisteita.
Yhdistelmähoito metformiinin kanssa, kun potilaat eivät ole aiemmin saaneet lääkehoitoa
Kahteen aktiivikontrolloituun 24 viikkoa kestäneeseen tutkimukseen osallistui 1 236 potilasta, jotka eivät olleet aiemmin saaneet lääkehoitoa ja joilla oli tyypin 2 diabetes, jonka hoitotasapaino ei ollut riittävä (HbA1c ≥ 7,5 % ja ≤ 12 %). Tutkimuksissa arvioitiin yhdessä metformiinin kanssa annetun dapagliflotsiinin (5 mg tai 10 mg) tehoa ja turvallisuutta potilailla, jotka eivät olleet aiemmin saaneet lääkehoitoa, verrattuna hoitoon yksittäisillä aineilla.
Hoito dapagliflotsiinin 10 mg:n annoksen ja metformiinin (enintään 2 000 mg vuorokaudessa) yhdistelmällä paransi HbA1c-arvoja selvästi verrattuna yksittäisiin aineisiin (taulukko 7) ja pienensi plasman paastoglukoosiarvoja (enemmän kuin yksittäiset aineet) ja painoa (enemmän kuin metformiini).
Taulukko 7. Tulokset viikolla 24 (LOCFa) aktiivikontrolloidussa tutkimuksessa, jossa tutkittiin dapagliflotsiinin ja metformiinin yhdistelmää potilailla, jotka eivät olleet aiemmin saaneet lääkehoitoa
| Parametri | Dapagliflotsiini 10 mg + metformiini | Dapagliflotsiini 10 mg | Metformiini |
|---|---|---|---|
| Nb | 211b | 219b | 208b |
HbA1c (%) Lähtötilanne (keskiarvo) Ero metformiiniin verrattunac |
9,10 ‑0,54* |
9,03
‑0,01 |
9,03
|
| aLOCF: viimeisestä havainnosta (ennen glukoositason korjaamista (glycaemic rescue) sitä edellyttäneillä potilailla) laskettu arvio. bKaikki satunnaistetut potilaat, jotka saivat vähintään yhden annoksen kaksoissokkoutettua tutkimuslääkevalmistetta lyhytkestoisen kaksoissokkoutetun hoitojakson aikana. cPienimmän neliösumman keskiarvo suhteutettuna lähtötilanteen arvoon. *p-arvo < 0,0001. | |||
Yhdistelmähoito depotmuotoisen eksenatidin kanssa
28 viikkoa kestäneessä kaksoissokkoutetussa, aktiivisella vertailuvalmisteella kontrolloidussa tutkimuksessa dapagliflotsiinin ja depotmuotoisen eksenatidin (GLP‑1‑reseptoriagonisti) yhdistelmää verrattiin pelkkään dapagliflotsiiniin ja pelkkään depotmuotoiseen eksenatidiin pelkästään metformiinia saaneilla tutkimushenkilöillä, joiden glukoositasapaino oli riittämätön (HbA1c ≥ 8 % ja ≤ 12 %). HbA1c‑arvo pieneni kaikissa hoitoryhmissä lähtötilanteeseen verrattuna. Yhdistelmähoito dapagliflotsiinin 10 mg:n annoksella ja depotmuotoisella eksenatidilla pienensi HbA1c‑arvoa lähtötilanteesta enemmän kuin pelkkä dapagliflotsiini tai pelkkä depotmuotoinen eksenatidi (taulukko 8).
Taulukko 8. Tulokset 28 viikkoa kestäneestä tutkimuksesta, jossa verrattiin dapagliflotsiinia ja depotmuotoista eksenatidia pelkkään dapagliflotsiiniin ja pelkkään depotmuotoiseen eksenatidiin yhdistelmänä metformiinin kanssa (intent to treat -potilaat)
| Parametri | Dapagliflotsiini 10 mg kerran vuorokaudessa + depotmuotoinen eksenatidi 2 mg kerran viikossa | Dapagliflotsiini 10 mg kerran vuorokaudessa + lumelääke kerran viikossa | Depotmuotoinen eksenatidi 2 mg kerran viikossa + lumelääke kerran vuorokaudessa |
| N | 228 | 230 | 227 |
HbA1c (%)
| 9,29
‑1,98
| 9,25
‑1,39
‑0,59* (‑0,84, ‑0,34)
| 9,26
‑1,60
‑0,38** (‑0,63, ‑0,13)
|
| Tutkimushenkilöt(%), jotka saavuttivat alle 7 %:n HbA1c-arvon | 44,7 | 19,1 | 26,9 |
| Paino (kg) Lähtötilanne (keskiarvo) Muutos lähtötilanteestaa Keskimääräinen ero muutoksessa lähtötilanteesta yhdistelmän ja yksittäisen vaikuttavan aineen välillä (95 %:n luottamusväli) | 92,13
‑3,55
| 90,87
‑2,22
‑1,33* (‑2,12, ‑0,55)
| 89,12
‑1,56
‑2,00* (‑2,79, ‑1,20)
|
| N = potilaiden määrä aKorjatut pienimmän neliösumman keskiarvot ja tutkimusryhmien ero(t) lähtötilanteessa todetuista arvoista tapahtuneen muutoksen suhteen viikolla 28 mallinnettiin käyttämällä toistettujen mittausten sekamallia. Malli sisälsi kiinteinä tekijöinä hoidon, alueen, lähtötilanteen HbA1c-ositteen (< 9,0 % tai ≥ 9,0 %), viikon sekä hoitoon liittyvät yhteisvaikutukset viikoittain. Kovariaattina oli lähtötilanteessa mitattu arvo. *p < 0,001, **p < 0,01 Kaikki p-arvot ovat kerrannaisuuden suhteen korjattuja p-arvoja. Analyysit eivät sisällä mittauksia, jotka on tehty hätälääkityksen käytön jälkeen tai tutkimuslääkkeen käytön ennenaikaisen lopettamisen jälkeen. | |||
Plasman paastoglukoosi
Dapagliflotsiini lisälääkkeenä joko pelkälle metformiinille (dapagliflotsiini 10 mg kerran vuorokaudessa tai dapagliflotsiini 5 mg kaksi kertaa vuorokaudessa) tai metformiinin ja sitagliptiinin yhdistelmälle, sulfonyyliurealle tai insuliinille laski plasman paastoglukoosiarvoa tilastollisesti merkitsevästi (-1,90 – -1,20 mmol/l [-34,2 – -21,7 mg/dl]) verrattuna lumelääkkeeseen (-0,58 – 0,18 mmol/l [-10,4 – 3,3 mg/dl]) viikolla 16 (5 mg kaksi kertaa vuorokaudessa) tai viikolla 24. Tämä vaikutus havaittiin hoitoviikolla 1, ja vaikutus säilyi niissä tutkimuksissa, joita jatkettiin viikolle 104.
Yhdistelmähoito dapagliflotsiinin 10 mg:n annoksella ja depotmuotoisella eksenatidilla oli pienentänyt huomattavasti enemmän plasman paastoglukoosiarvoa viikolla 28: -3,66 mmol/l (-65,8 mg/dl), verrattuna pelkkään dapagliflotsiiniin: -2,73 mmol/l (-49,2 mg/dl), p < 0,001, tai pelkkään eksenatidiin: -2,54 mmol/l (-45,8 mg/dl), p < 0,001.
Tutkimuksessa, joka tehtiin nimenomaan diabetespotilailla, joiden eGFR oli ≥ 45 − < 60 ml/min/1,73 m2, dapagliflotsiinihoito oli pienentänyt paastoglukoosiarvoa viikolla 24: ‑1,19 mmol/l (‑21,46 mg/dl), verrattuna lumelääkkeeseen: ‑0,27 mmol/l (‑4,87 mg/dl) (p = 0,001).
Aterianjälkeinen glukoosi
Dapagliflotsiinin 10 mg:n annos sitagliptiinin ja metformiinin yhdistelmän lisälääkkeenä alensi kaksi tuntia aterian jälkeen mitattua glukoosipitoisuutta viikolla 24, ja tämä tulos säilyi viikkoon 48 saakka.
Yhdistelmähoito dapagliflotsiinin 10 mg:n annoksella ja depotmuotoisella eksenatidilla oli pienentänyt kaksi tuntia aterian jälkeen mitattua glukoosipitoisuutta viikolla 28 huomattavasti enemmän kuin kumpikaan lääkeaine yksinään.
Paino
Dapagliflotsiini pelkän metformiinin tai metformiinin ja sitagliptiinin yhdistelmän, sulfonyyliurean tai insuliinin lisälääkkeenä (suun kautta lisäksi annettujen glukoosipitoisuutta pienentävien lääkkeiden, kuten metformiinin, kanssa tai ilman niitä) laski tutkittavien painoa tilastollisesti merkitsevästi viikkoon 24 saakka (p < 0,0001, taulukot 4, 5 ja 6). Nämä vaikutukset säilyivät pitkäaikaistutkimuksissa. Viikolla 48 ero lumelääkkeeseen verrattuna oli dapagliflotsiinia metformiinin ja sitagliptiinin yhdistelmän lisälääkkeenä saaneilla -2,07 kg. Viikolla 102 ero lumelääkkeeseen verrattuna oli dapagliflotsiinia metformiinin lisälääkkeenä saaneilla -2,14 kg ja insuliinin lisälääkkeenä saaneilla -2,88 kg.
Aktiivikontrolloidussa tutkimuksessa, jossa pyrittiin osoittamaan dapagliflotsiini vertailukelpoiseksi (non-inferior) glipitsidiin verrattuna, dapagliflotsiini metformiinin lisälääkkeenä oli laskenut painoa glipitsidiin verrattuna tilastollisesti merkitsevästi 4,65 kg viikolla 52 (p < 0,0001, taulukko 3), ja tämä vaikutus oli säilynyt viikolla 104 (-5,06 kg) ja viikolla 208 (-4,38 kg).
Dapagliflotsiinin 10 mg:n annoksen ja depotmuotoisen eksenatidin yhdistelmän käyttö laski painoa huomattavasti enemmän kuin kumpikaan lääkeaine yksinään (taulukko 8).
24 viikkoa kestäneessä tutkimuksessa, johon osallistui 182 diabetesta sairastavaa potilasta, kehon koostumusta tutkittiin kaksienergiaisella röntgenabsorptiometrialla (DEXA). Tutkimus osoitti, että lumelääkkeen ja metformiinin yhdistelmään verrattuna dapagliflotsiini 10 mg yhdistettynä metformiiniin vähensi DEXA-mittausten mukaan kehon painoa ja kehon rasvakudosta eikä rasvatonta kudosta tai nestettä. Magneettikuvauksella tehty alatutkimus osoitti dapagliflotsiinin (10 mg) ja metformiinin yhdistelmähoidon vähentävän numeerisesti viskeraalisen rasvakudoksen määrää verrattuna lumelääkkeen ja metformiinin yhdistelmähoitoon.
Verenpaine
13 lumelääkekontrolloidun tutkimuksen ennalta määritellyssä yhdistetyssä analyysissä dapagliflotsiini annoksella 10 mg aiheutti systolisen verenpaineen muutoksen lähtötilanteesta -3,7 mmHg (lumelääkkeellä -0,5 mmHg) ja diastolisen verenpaineen muutoksen -1,8 mmHg (lumelääkkeellä -0,5 mmHg) viikolla 24. Samanlaista verenpaineen alenemista todettiin viikolle 104 asti.
Yhdistelmähoito dapagliflotsiinin 10 mg:n annoksella ja depotmuotoisella eksenatidilla oli laskenut systolista verenpainetta huomattavasti enemmän viikolla 28 (-4,3 mmHg) kuin pelkkä dapagliflotsiini (‑1,8 mmHg, p < 0,05) tai pelkkä depotmuotoinen eksenatidi (-1,2 mmHg, p < 0,01).
Kahdessa 12 viikon pituisessa lumelääkekontrolloidussa tutkimuksessa, joihin osallistui yhteensä 1 062 potilasta, joiden tyypin 2 diabeteksen hoitotasapaino oli riittämätön ja joilla oli verenpainetauti (siitä huolimatta, että he toisessa tutkimuksessa käyttivät jo tutkimuksen aloittaessaan pysyvänä lääkityksenä angiotensiinikonvertaasin estäjää (ACE:n estäjää) tai angiotensiinireseptorin salpaajaa (ATR-salpaajaa) ja toisessa tutkimuksessa angiotensiinikonvertaasin estäjää tai angiotensiinireseptorin salpaajaa sekä lisäksi yhtä verenpainelääkettä), potilaille annettiin dapagliflotsiinia 10 mg:n annoksella tai lumelääkettä. Viikon 12 kohdalla 10 mg:n dapagliflotsiiniannos yhdessä tavallisen diabeteshoidon kanssa oli parantanut HbA1c-arvoja ja pienentänyt lumelääkkeen suhteen korjattua systolista verenpainetta toisessa tutkimuksessa keskimäärin 3,1 mmHg ja toisessa tutkimuksessa 4,3 mmHg.
Tutkimuksessa, joka tehtiin nimenomaan diabetespotilailla, joiden eGFR oli ≥ 45 − < 60 ml/min/1,73 m2, dapagliflotsiinihoito oli pienentänyt potilaan istuessa mitattua systolista verenpainetta viikolla 24: ‑4,8 mmHg, verrattuna lumelääkkeeseen: ‑1,7 mmHg (p < 0,05).
Potilaat, joiden HbA1c-arvo lähtötilanteessa oli ≥ 9 %
Ennalta määritellyssä analyysissä tutkittavista, joiden HbA1c-arvo lähtötilanteessa oli ≥ 9,0 %, todettiin, että hoito dapagliflotsiinilla 10 mg:n annoksella sai aikaan tilastollisesti merkitsevän HbA1c-arvojen pienenemisen viikolla 24 metformiinin lisälääkkeenä (korjattu keskimääräinen muutos lähtötilanteesta: -1,32 % dapagliflotsiiniryhmässä ja -0,53 % lumelääkeryhmässä).
Glukoositasapaino potilailla, joilla oli keskivaikea munuaisten vajaatoiminta CKD-luokka 3A (eGFR ≥ 45 – < 60 ml/min/1,73 m2)
Dapagliflotsiinin tehoa arvioitiin tutkimuksessa, joka tehtiin nimenomaan diabetespotilailla, joiden eGFR oli ≥ 45 − 60 ml/min/1,73 m2 ja joiden glukoositasapaino oli tavanomaisella hoidolla riittämätön. Dapagliflotsiinihoito pienensi HbA1c-arvoja ja painoa lumelääkkeeseen verrattuna (taulukko 9).
Taulukko 9. Tulokset viikolla 24 lumevertailututkimuksessa, jossa tutkittiin dapagliflotsiinia diabetespotilailla, joiden eGFR oli ≥ 45 − 60 ml/min/1,73 m2
| Dapagliflotsiinia 10 mg | Lumelääkea | |
| Nb | 159 | 161 |
| HbA1c (%) | ||
| Lähtötilanne (keskiarvo) | 8,35 | 8,03 |
| Muutos lähtötilanteestab | ‑0,37 | ‑0,03 |
| Ero lumelääkkeeseen verrattunab (95 %:n luottamusväli) | ‑0,34* (‑0,53, ‑0,15) | |
| Paino (kg) | ||
| Lähtötilanne (keskiarvo) | 92,51 | 88,30 |
| Prosentuaalinen muutos lähtötilanteestac | -3,42 | -2,02 |
| Prosentuaalisen muutoksen ero lumelääkkeeseen verrattunac (95 %:n luottamusväli) | -1,43* (-2,15, -0,69) | |
| a Metformiini tai metformiinihydrokloridi olivat osa tavanomaista hoitoa 69,4 %:lla dapagliflotsiiniryhmän potilaista ja 64,0 %:lla lumeryhmän potilaista. b Pienimmän neliösumman keskiarvo suhteutettuna lähtötilanteen arvoon. c Johdettu pienimmän neliösumman keskiarvosta suhteutettuna lähtötilanteen arvoon. * p < 0,001. | ||
Sydän-, verisuoni- ja munuaistulokset
Dapagliflotsiinin vaikutusta sydän- ja verisuonitapahtumiin arvioinut tutkimus (Dapagliflozin Effect on Cardiovascular Events, DECLARE) oli kansainvälinen, satunnaistettu, kaksoissokkoutettu, lumekontrolloitu kliininen monikeskustutkimus, jossa verrattiin käytössä olevaan taustahoitoon lisätyn dapagliflotsiinin ja lumelääkkeen vaikutusta sydän- ja verisuonituloksiin. Kaikilla potilailla oli tyypin 2 diabetes ja joko vähintään kaksi muuta sydän- ja verisuonisairauksien riskitekijää (ikä ≥ 55 vuotta miehillä tai ≥ 60 vuotta naisilla ja vähintään yksi seuraavista: dyslipidemia, kohonnut verenpaine tai tupakointi) tai todettu sydän- ja verisuonisairaus.
17 160 satunnaistetusta potilaasta 6 974:llä (40,6 %:lla) oli todettu sydän- ja verisuonisairaus ja 10 186:lla (59,4 %:lla) ei ollut todettua sydän- ja verisuonisairautta. 8 582 potilasta satunnaistettiin saamaan 10 mg dapagliflotsiinia ja 8 578 saamaan lumelääkettä, ja seurannan keston mediaani oli 4,2 vuotta.
Tutkimuspopulaation keski-ikä oli 63,9 vuotta, ja 37,4 % potilaista oli naisia. Yhteensä 22,4 %:lla oli ollut diabetes ≤ 5 vuotta, ja diabeteksen keskimääräinen kesto oli 11,9 vuotta. Keskimääräinen HbA1c oli 8,3 % ja keskimääräinen painoindeksi oli 32,1 kg/m2.
Lähtötilanteessa 10,0 %:lla potilaista oli aiemmin todettu sydämen vajaatoiminta. Keskimääräinen eGFR oli 85,2 ml/min/1,73 m2, potilaista 7,4 %:lla eGFR oli < 60 ml/min/1,73 m2, ja potilaista 30,3 %:lla oli mikroalbuminuria (virtsan albumiinin ja kreatiniinin suhde [U-AlbKrea] ≥ 30− ≤ 300 mg/g) tai makroalbuminuria (virtsan albumiinin ja kreatiniinin suhde [U-AlbKrea] > 300 mg/g).
Suurin osa potilaista (98 %) käytti lähtötilanteessa vähintään yhtä diabeteslääkettä, kuten metformiinia (82 %), insuliinia (41 %) tai sulfonyyliureaa (43 %).
Ensisijaiset päätetapahtumat olivat aika sydän- ja verisuonikuoleman, sydäninfarktin ja iskeemisen aivohalvauksen muodostaman yhdistelmäpäätetapahtuman (merkittävät sydänperäiset haittatapahtumat, MACE) ensimmäiseen tapahtumaan ja aika sydämen vajaatoiminnasta johtuvan sairaalahoitojakson ja sydän- ja verisuonikuoleman muodostaman yhdistelmäpäätetapahtuman ensimmäiseen tapahtumaan. Toissijaiset päätetapahtumat olivat munuaisiin liittyvä yhdistelmäpäätetapahtuma ja kaikista syistä johtuva kuolleisuus.
Merkittävät sydänperäiset haittatapahtumat
10 mg:n dapagliflotsiiniannos osoitettiin vähintään samanveroiseksi kuin lumelääke sydän- ja verisuonikuoleman, sydäninfarktin ja iskeemisen aivohalvauksen muodostaman yhdistelmäpäätetapahtuman suhteen (yksitahoinen p < 0,001).
Sydämen vajaatoiminta tai sydän- ja verisuonikuolema
10 mg:n dapagliflotsiiniannoksen osoitettiin ehkäisevän sydämen vajaatoiminnasta johtuvan sairaalahoitojakson ja sydän- ja verisuonikuoleman yhdistelmää paremmin kuin lumelääke (kuva 1). Ero hoitovaikutuksessa liittyi sydämen vajaatoiminnasta johtuviin sairaalahoitojaksoihin, eikä sydän- ja verisuonikuolemissa ollut eroa (kuva 2).
Dapagliflotsiinihoidon hyöty lumelääkkeeseen verrattuna havaittiin riippumatta siitä, oliko potilailla todettu sydän- ja verisuonisairaus, ja oliko potilailla lähtötilanteessa sydämen vajaatoiminta. Hyöty oli johdonmukainen kaikissa keskeisissä alaryhmissä, mukaan lukien ikä, sukupuoli, munuaisten toiminta (eGFR) ja maantieteellinen alue.
Kuva 1: Aika ensimmäiseen sydämen vajaatoiminnasta johtuvaan sairaalahoitojaksoon tai sydän- ja verisuonikuolemaan
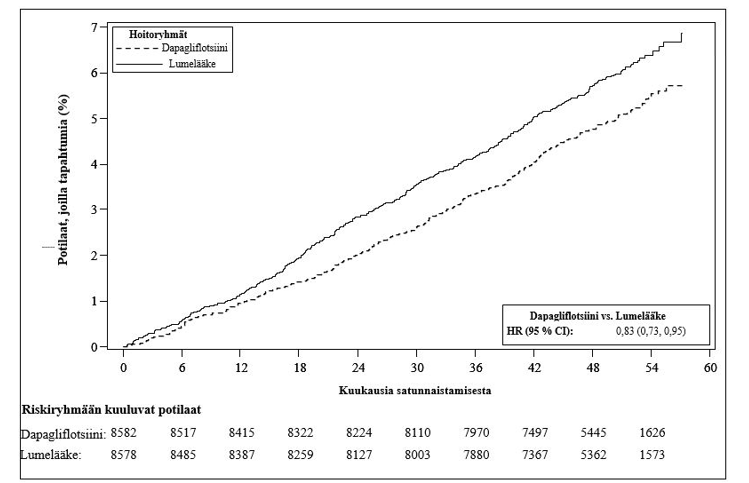
Riskiryhmään kuuluvien potilaiden määrä on riskiryhmään kuuluvien potilaiden määrä jakson alussa.
HR = riskisuhde CI = luottamusväli
Ensisijaisia ja toissijaisia päätemuuttujia koskevat tulokset on esitetty kuvassa 2. Dapagliflotsiinin paremmuutta lumelääkkeeseen nähden ei osoitettu MACE:n suhteen (p = 0,172). Munuaisia koskevaa yhdistelmäpäätetapahtumaa ja kaikista syistä johtuvaa kuolleisuutta ei näin ollen testattu osana tulokset vahvistavaa testaustoimenpidettä.
Kuva 2: Hoitovaikutukset ensisijaisten yhdistelmäpäätetapahtumien ja niiden komponenttien sekä toissijaisten päätetapahtumien ja niiden komponenttien suhteen
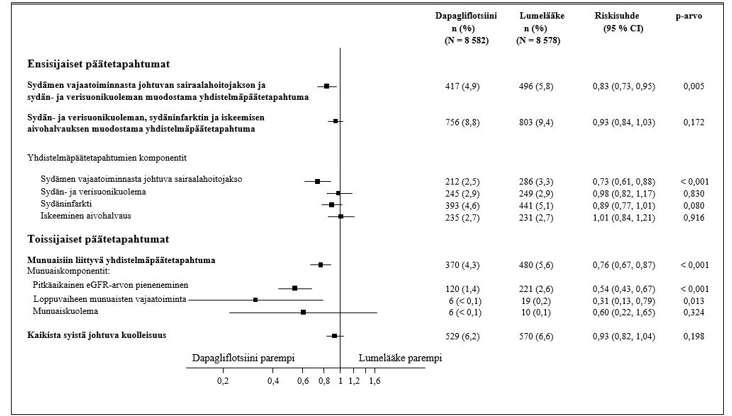
Munuaisiin liittyvän yhdistelmäpäätetapahtuman määritelmä: pitkäaikainen vahvistettu eGFR-arvon ≥ 40 %:n pieneneminen arvoon eGFR < 60 ml/min/1,73 m2 ja/tai loppuvaiheen munuaisten vajaatoiminta (≥ 90 päivää dialyysihoitoa tai munuaisensiirto, pitkäaikainen vahvistettu eGFR < 15 ml/min/1,73 m2) ja/tai munuais- tai sydän- ja verisuonikuolema.
p-arvot ovat kaksitahoisia. Toissijaisten päätetapahtumien ja yksittäisten komponenttien osalta p-arvot ovat nimellisiä. Aika ensimmäiseen tapahtumaan analysoitiin käyttämällä Coxin suhteellisten riskitiheyksien mallia. Yksittäisten komponenttien ensimmäisten tapahtumien lukumäärät ovat kunkin komponentin ensimmäisten tapahtumien todelliset lukumäärät, eikä niiden yhteenlaskettu summa vastaa yhdistelmäpäätetapahtuman tapahtumien lukumäärää.
CI = luottamusväli.
Nefropatia
Dapagliflotsiini vähensi vahvistetun pitkäaikaisen eGFR-arvon pienenemisen, loppuvaiheen munuaisten vajaatoiminnan ja munuais- tai sydän- ja verisuonikuoleman muodostaman yhdistelmäpäätetapahtuman tapahtumien ilmaantuvuutta. Ryhmien välinen ero liittyi munuaiskomponenttien (pitkäaikaisen eGFR-arvon pienenemisen, loppuvaiheen munuaisten vajaatoiminnan ja munuaiskuoleman) tapahtumien vähenemiseen (kuva 2).
Dapagliflotsiinin ja lumelääkkeen välinen riskisuhde nefropatian (pitkäaikainen eGFR:n pieneneminen, loppuvaiheen munuaissairaus ja munuaiskuolema) ilmenemiseen kuluneen ajan suhteen oli 0,53 (95 %:n luottamusväli 0,43, 0,66).
Lisäksi dapagliflotsiini pienensi pitkäkestoisen albuminurian ilmaantuvuutta (riskisuhde 0,79 [95 %:n luottamusväli 0,72, 0,87]) ja johti makroalbuminurian suurempaan regressioon (riskisuhde 1,82 [95 %:n luottamusväli 1,51, 2,20]) verrattuna lumelääkkeeseen.
Metformiini
Tiukan glukoosikontrollin pitkäaikaiset edut tyypin 2 diabeteksen hoidossa on vahvistettu prospektiivisessa, satunnaistetussa UKPDS-tutkimuksessa. Kun ylipainoisia potilaita hoidettiin metformiinilla pelkän ruokavaliohoidon epäonnistuttua, analyysissä todettiin seuraavaa:
- minkä tahansa diabeteskomplikaation absoluuttinen riski oli metformiiniryhmässä merkitsevästi pienempi (29,8 tapahtumaa / 1 000 potilasvuotta) kuin pelkkää ruokavaliohoitoa käytettäessä (43,3 tapahtumaa / 1 000 potilasvuotta), p = 0,0023, ja merkitsevästi pienempi kuin pelkkää sulfonyyliureaa tai pelkkää insuliinia käyttäneissä ryhmissä yhteensä (40,1 tapahtumaa / 1 000 potilasvuotta), p = 0,0034;
- diabetekseen liittyvän kuolleisuuden absoluuttinen riski pieneni merkitsevästi (metformiini: 7,5 tapahtumaa / 1 000 potilasvuotta, pelkkä ruokavalio: 12,7 tapahtumaa / 1 000 potilasvuotta, p = 0,017);
- kokonaiskuolleisuuden absoluuttinen riski oli metformiiniryhmässä merkitsevästi pienempi (13,5 tapahtumaa / 1 000 potilasvuotta) kuin pelkkää ruokavaliohoitoa käytettäessä (20,6 tapahtumaa / 1 000 potilasvuotta), p = 0,011, ja merkitsevästi pienempi kuin pelkkää sulfonyyliureaa tai pelkkää insuliinia käyttäneissä ryhmissä yhteensä (18,9 tapahtumaa / 1 000 potilasvuotta), p = 0,021;
- sydäninfarktin absoluuttinen riski pieneni merkitsevästi: metformiini: 11 tapahtumaa / 1 000 potilasvuotta, pelkkä ruokavalio: 18 tapahtumaa / 1 000 potilasvuotta, p = 0,01.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Xigduo-valmisteen käytöstä tyypin 2 diabeteksen hoidossa kaikissa pediatrisissa potilasryhmissä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Xigduo-yhdistelmätabletit katsotaan biologisesti samanarvoisiksi kuin vastaavat dapagliflotsiini- ja metformiinihydrokloridiannokset yhtä aikaa erillisinä tabletteina käytettyinä.
Kaksi kertaa vuorokaudessa annettavan 5 mg dapagliflotsiiniannoksen ja kerran vuorokaudessa annettavan 10 mg dapagliflotsiiniannoksen farmakokinetiikkaa verrattiin terveissä tutkittavissa. Kaksi kertaa vuorokaudessa annetulle 5 mg:n dapagliflotsiiniannokselle todettiin samanlaiset kokonaisaltistukset (AUCss) 24 tunnin aikana kuin kerran vuorokaudessa annetulle 10 mg:n dapagliflotsiiniannokselle. Kaksi kertaa vuorokaudessa annettu 5 mg:n dapagliflotsiiniannos verrattuna kerran vuorokaudessa annettuun 10 mg:n dapagliflotsiiniannokseen pienensi dapagliflotsiinin huippupitoisuuksia plasmassa (Cmax) ja suurensi dapagliflotsiinin minimipitoisuuksia plasmassa (Cmin) odotetulla tavalla.
Yhteisvaikutukset ruuan kanssa
Tämän lääkevalmisteen antaminen terveille vapaaehtoisille runsasrasvaisen aterian jälkeen verrattuna antamiseen paastotilan jälkeen johti samansuuruiseen altistukseen sekä dapagliflotsiinille että metformiinille. Ruokailu pidensi huippupitoisuuksien saavuttamiseen kuluvaa aikaa 1–2 tuntia ja pienensi dapagliflotsiinin maksimipitoisuutta plasmassa 29 % ja metformiinin maksimipitoisuutta plasmassa 17 %. Näitä muutoksia ei pidetty kliinisesti merkittävinä.
Pediatriset potilaat
Farmakokinetiikkaa ei ole tutkittu pediatrisilla potilailla.
Tämän lääkevalmisteen molempien vaikuttavien aineiden farmakokineettisistä ominaisuuksista kerrotaan seuraavassa.
Dapagliflotsiini
Imeytyminen
Dapagliflotsiini imeytyi nopeasti ja tehokkaasti suun kautta annettuna. Dapagliflotsiinin huippupitoisuus plasmassa (Cmax) saavutettiin paastotilassa yleensä kahdessa tunnissa lääkkeen antamisen jälkeen. Dapagliflotsiinin geometrinen vakaan tilan Cmax-keskiarvo oli 158 ng/ml ja AUCτ-keskiarvo oli 628 ng h/ml kerran vuorokaudessa otetun 10 mg dapagliflotsiiniannoksen jälkeen. Suun kautta otetun 10 mg dapagliflotsiiniannoksen absoluuttinen hyötyosuus oli 78 %.
Jakautuminen
Dapagliflotsiini sitoutuu proteiineihin noin 91-prosenttisesti. Sitoutuminen proteiiniin ei vaihdellut eri sairaustiloissa (esim. munuaisen tai maksan vajaatoiminta). Dapagliflotsiinin keskimääräinen jakautumistilavuus vakaassa tilassa oli 118 litraa.
Biotransformaatio
Dapagliflotsiini metaboloituu suuressa määrin, ja sen päämetaboliitti on inaktiivinen dapagliflotsiini-3-O-glukuronidi. Dapagliflotsiini-3-O-glukuronidilla tai muilla metaboliiteilla ei ole glukoosipitoisuutta pienentävää vaikutusta. Dapagliflotsiini-3-O-glukuronidin muodostumiseen vaikuttaa UGT1A9-entsyymi, jota esiintyy maksassa ja munuaisissa. CYP-välitteinen metabolia oli ihmisillä vähäisempi puhdistumareitti.
Eliminaatio
Dapagliflotsiinin keskimääräinen terminaalinen puoliintumisaika (t1/2) plasmassa oli terveillä tutkittavilla 12,9 tuntia yhden suun kautta otetun dapagliflotsiinin 10 mg annoksen jälkeen. Laskimoon annetun dapagliflotsiinin keskimääräinen systeeminen kokonaispuhdistuma oli 207 ml/min. Dapagliflotsiini ja sen metaboliitit poistuvat pääasiassa erittymällä virtsaan, jolloin alle 2 % erittyneestä lääkeaineesta on muuttumatonta dapagliflotsiinia. 50 mg:n [14C]-dapagliflotsiiniannoksesta 96 % voitiin jäljittää: 75 % virtsasta ja 21 % ulosteista. Noin 15 % annoksesta erittyi ulosteeseen metaboloitumattomana lääkkeenä.
Lineaarisuus
Dapagliflotsiinialtistus suureni dapagliflotsiiniannoksen mukaisesti alueella 0,1–500 mg, eikä sen farmakokinetiikka muuttunut ajan myötä, kun toistuvia vuorokausiannoksia jatkettiin viikolle 24.
Erityisryhmät
Munuaisten vajaatoiminta
Vakaassa tilassa (20 mg dapagliflotsiinia kerran vuorokaudessa 7 päivän ajan) olevilla tutkittavilla, jotka sairastivat tyypin 2 diabetesta ja munuaisten vajaatoimintaa (plasman ioheksolipuhdistumalla määritettynä), keskimääräinen systeeminen dapagliflotsiinialtistuma oli 32 % (lievä munuaisten vajaatoiminta), 60 % (kohtalainen munuaisten vajaatoiminta) ja 87 % (vaikea munuaisten vajaatoiminta) suurempi kuin tutkittavilla, joilla oli tyypin 2 diabetes ja normaali munuaisten toiminta. Vakaassa tilassa glukoosin eritys virtsaan 24 tunnin aikana riippui voimakkaasti munuaisten toiminnasta: tyypin 2 diabetesta sairastavilla tutkimushenkilöillä glukoosia erittyi päivässä 85 g normaalissa munuaisten toiminnassa, 52 g lievässä vajaatoiminnassa, 18 g kohtalaisessa vajaatoiminnassa ja 11 g vaikeassa vajaatoiminnassa. Hemodialyysin vaikutusta dapagliflotsiinialtistukseen ei tunneta.
Maksan vajaatoiminta
Tutkittavilla, joilla oli lievä tai kohtalainen maksan vajaatoiminta (Child-Pugh-luokat A ja B), dapagliflotsiinin Cmax-keskiarvo oli enintään 12 % suurempi ja AUC-keskiarvo oli enintään 36 % suurempi kuin kaltaistetuilla terveillä verrokeilla. Näitä eroja ei pidetty kliinisesti merkittävinä. Vaikeaa maksan vajaatoimintaa sairastavilla tutkittavilla (Child-Pugh-luokka C) dapagliflotsiinin Cmax-keskiarvo oli 40 % suurempi ja AUC-keskiarvo oli 67 % suurempi kuin terveillä kaltaistetuilla verrokeilla.
Iäkkäät (vähintään 65-vuotiaat)
Korkeintaan 70-vuotiailla tutkittavilla altistus ei lisääntynyt kliinisesti merkittävästi pelkästään iän perusteella. Altistumisen voidaan kuitenkin olettaa lisääntyvän ikään liittyvän munuaistoiminnan heikkenemisen vuoksi. Tutkimustuloksia ei ole riittävästi, jotta voitaisiin tehdä johtopäätöksiä yli 70-vuotiaiden potilaiden altistuksesta.
Sukupuoli
Dapagliflotsiinin AUCss-keskiarvon arvioitiin olevan naisilla noin 22 % korkeampi kuin miehillä.
Rotu
Systeemisessä altistumisessa ei ollut kliinisesti merkitseviä eroja valkoisten, mustien ja aasialaisten välillä.
Paino
Dapagliflotsiinialtistuksen havaittiin vähenevän painon noustessa. Tämän vuoksi hoikkien potilaiden altistuminen saattaa olla hieman lisääntynyt ja tavallista painavampien potilaiden altistuminen hieman vähentynyt. Näitä eroja ei kuitenkaan pidetty kliinisesti merkitsevinä.
Pediatriset potilaat
Tyypin 2 diabetesta sairastavilla 10–17‑vuotiailla lapsilla farmakokinetiikka ja farmakodynamiikka (glukosuria) olivat samankaltaiset kuin tyypin 2 diabetesta sairastavilla aikuisilla on todettu.
Metformiini
Imeytyminen
Kun metformiini otetaan suun kautta, tmax-aika on 2,5 tuntia. 500 mg:n tai 850 mg:n metformiinitablettien absoluuttinen hyötyosuus on terveillä henkilöillä noin 50–60 %. 20–30 % suun kautta otetusta annoksesta erittyi imeytymättömänä ulosteeseen.
Niellyn metformiinin imeytyminen on saturoituvaa ja epätäydellistä. Metformiinin imeytymisen farmakokinetiikan oletetaan olevan epälineaarinen. Kun metformiinia käytetään tavanomaisina annoksina ja ajankohtina, plasman vakaan tilan pitoisuudet saavutetaan 24–48 tunnissa ja ne ovat yleensä alle 1 mikrog/ml. Kliinisissä vertailututkimuksissa metformiinin maksimipitoisuudet plasmassa (Cmax) olivat maksimiannoksillakin enintään 5 mikrog/ml.
Jakautuminen
Sitoutuminen plasman proteiineihin on hyvin vähäistä. Metformiini jakautuu punasoluihin. Veren huippupitoisuudet ovat pienemmät kuin plasman huippupitoisuudet, mutta ne saavutetaan suurin piirtein samaan aikaan. Punasolut ovat todennäköisesti toissijainen jakautumistila. Vd-keskiarvo vaihteli välillä 63–276 l.
Biotransformaatio
Metformiini erittyy muuttumattomana virtsaan. Ihmisestä ei ole havaittu metaboliitteja.
Eliminaatio
Metformiinin munuaispuhdistuma on > 400 ml/min, mikä viittaa siihen, että se poistuu sekä glomerulussuodatuksella että tubulaarisella erityksellä. Niellyn annoksen näennäinen terminaalinen eliminaation puoliintumisaika on noin 6,5 tuntia.
Erityisryhmät
Munuaisten vajaatoiminta
Jos potilaan munuaistoiminta heikkenee (mitatun kreatiniinipuhdistuman perusteella), metformiinin puoliintumisaika plasmassa ja veressä pitenee ja munuaispuhdistuma pienenee suhteessa kreatiniinipuhdistuman pienenemiseen, jolloin plasman metformiinipitoisuudet suurenevat.
Prekliiniset tiedot turvallisuudesta
Dapagliflotsiinin ja metformiinin samanaikainen käyttö
Toistuvan altistuksen aiheuttamaa toksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Xigduo-valmisteen molempien vaikuttavien aineiden turvallisuutta koskevista prekliinisistä tiedoista kerrotaan seuraavassa.
Dapagliflotsiini
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, genotoksisuutta, karsinogeenisuutta sekä hedelmällisyyttä koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille. Dapagliflotsiini ei aiheuttanut kasvaimia hiirille tai rotille millään tutkitulla annoksella kaksi vuotta kestäneissä karsinogeenisuustutkimuksissa.
Lisääntymis- ja kehitystoksisuus
Dapagliflotsiinin suora antaminen vastavieroitetuille rotanpoikasille ja epäsuora altistus myöhäisen tiineyden (aika, joka vastaa raskauden toista ja kolmatta kolmannesta ihmisen munuaisten kehittymisen suhteen) ja imetyksen aikana johtivat jälkeläisten munuaisaltaan ja munuaistiehyiden laajenemisen esiintymistiheyden ja/tai vaikeusasteeseen kasvamiseen.
Nuorten eläinten toksisuustutkimuksessa dapagliflotsiinia annettiin suoraan rotanpoikasille 21.:stä syntymän jälkeisestä päivästä päivään 90 saakka. Munuaisaltaan ja munuaistiehyiden laajenemista raportoitiin kaikilla annoksilla. Poikasten altistukset pienimmällä tutkitulla annoksella olivat ≥ 15 kertaa ihmisille suositeltuja maksimiannoksia suurempia. Näihin löydöksiin liittyi annosriippuvaista munuaisen painon kasvua ja makroskooppista munuaisten suurenemista, jota havaittiin kaikilla annoksilla. Nuorilla eläimillä havaitut munuaisaltaan ja -tiehyiden laajenemiset eivät täysin palautuneet noin yhden kuukauden mittaisen palautumisjakson aikana.
Erillisessä synnytystä edeltävää ja synnytyksen jälkeistä kehitystä arvioineessa tutkimuksessa emorotille annettiin tutkimuslääkettä kuudennesta tiineyspäivästä 21. syntymänjälkeiseen päivään, ja poikaset altistuivat epäsuorasti in utero ja koko imetyksen ajan. (Satelliittitutkimuksessa arvioitiin dapagliflotsiinialtistusta maidossa ja poikasissa.) Munuaisaltaan laajenemisen esiintymistiheyden tai vaikeusasteen kasvua havaittiin käsiteltyjen emojen aikuisissa jälkeläisissä, kuitenkin vain suurimmilla tutkituilla annoksilla (emon dapagliflotsiinialtistukset olivat 1 415 kertaa ja poikasten altistukset 137 kertaa suurempia kuin ihmiselle saadut arvot ihmiselle suositellulla maksimiannoksella). Lisätoksisuus kehityksessä rajoittui poikasten annoksesta riippuvaiseen painon laskuun, ja sitä havaittiin vain annoksilla ≥ 15 mg/kg/vrk (poikasten altistuksen ollessa ≥ 29-kertaisia ihmiselle saatuihin arvoihin nähden ihmiselle suositellulla maksimiannoksella). Maternaalinen toksisuus oli ilmeistä vain suurimmalla tutkitulla annoksella, ja se rajoittui ohimenevään painonlaskuun ja ruuankulutuksen vähenemiseen. Kehitystoksisuuden suhteen suurin annos, jolla ei saada merkitsevää vastetta (NOAEL-arvo), pienin tutkittu annos, liittyy emon systeemiseen altistukseen, joka on noin 19-kertainen verrattuna ihmiselle saatuihin arvoihin ihmiselle suositellulla maksimiannoksella.
Rotilla ja kaneilla tehdyissä alkioiden ja sikiöiden lisätutkimuksissa dapagliflotsiinia annettiin kyseisten lajien organogeneesin tärkeimpinä kehitysjaksoina. Kaneilla ei havaittu maternaalista toksisuutta tai kehitystoksisuutta millään tutkitulla annoksella; suurimpaan tutkittuun annokseen liittyy systeeminen altistus, joka on noin 1 191 kertaa ihmiselle suositeltu maksimiannos. Rotissa dapagliflotsiini ei ollut alkiolle letaali eikä teratogeeninen altistuksella, joka oli 1 441 kertaa ihmiselle suositeltava maksimiannos.
Metformiini
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, genotoksisuutta, karsinogeenisuutta sekä lisääntymis- ja kehitystoksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Farmaseuttiset tiedot
Apuaineet
Tabletin ydin
Hydroksipropyyliselluloosa (E463)
Mikrokiteinen selluloosa (E460(i))
Magnesiumstearaatti (E470b)
Natriumtärkkelysglykolaatti (tyyppi A)
Kalvopäällyste
Xigduo 5 mg/850 mg kalvopäällysteinen tabletti
Polyvinyylialkoholi (E1203)
Makrogoli 3350 (E1521)
Talkki (E553b)
Titaanidioksidi (E171)
Keltainen rautaoksidi (E172)
Punainen rautaoksidi (E172)
Xigduo 5 mg/1 000 mg kalvopäällysteinen tabletti
Polyvinyylialkoholi (E1203)
Makrogoli 3350 (E1521)
Talkki (E553b)
Titaanidioksidi (E171)
Keltainen rautaoksidi (E172)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta.
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
XIGDUO tabletti, kalvopäällysteinen
5/850 mg (L:ei) 56 fol (51,19 €), 196 fol (151,74 €)
5/1000 mg (L:ei) 56 fol (51,19 €), 196 fol (151,74 €)
PF-selosteen tieto
PVC/PCTFE/Alu-läpipainopakkaus.
Pakkauskoot
14, 28, 56 ja 60 kalvopäällysteistä tablettia läpipainopakkauksissa, joissa ei ole repäisyviivoja.
60 x 1 kalvopäällysteistä tablettia kerta-annosläpipainopakkauksissa, joissa on repäisyviivat.
Monipakkaus sisältää 196 (2 x 98) kalvopäällysteistä tablettia läpipainopakkauksissa, joissa ei ole repäisyviivoja.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Xigduo 5 mg/850 mg kalvopäällysteinen tabletti
Ruskea, kaksoiskupera, 9,5 x 20 mm:n kokoinen soikea kalvopäällysteinen tabletti, jonka toisella puolella on merkintä "5/850" ja toisella puolella merkintä "1067".
Xigduo 5 mg/1 000 mg kalvopäällysteinen tabletti
Keltainen, kaksoiskupera, 10,5 x 21,5 mm:n kokoinen soikea kalvopäällysteinen tabletti, jonka toisella puolella on merkintä "5/1000" ja toisella puolella merkintä "1069".
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
XIGDUO tabletti, kalvopäällysteinen
5/850 mg 56 fol, 196 fol
5/1000 mg 56 fol, 196 fol
- Alempi erityiskorvaus (65 %). Diabetes, muu kuin insuliinihoito (215).
- Peruskorvaus (40 %).
ATC-koodi
A10BD15
Valmisteyhteenvedon muuttamispäivämäärä
08.05.2025
Yhteystiedot
Keilaranta 18
02150 Espoo
010 23 010
www.astrazeneca.fi
