SOMATULINE AUTOGEL injektioneste, liuos, esitäytetty ruisku 60 mg, 90 mg, 120 mg
Vaikuttavat aineet ja niiden määrät
Lanreotidi 60 mg, 90 mg, 120 mg lanreotidiasetaattina.
Jokaisessa esitäytetyssä ruiskussa on ylisaturoitunutta lanreotidiasetaattiliuosta vastaten 0,246 mg lanreotidiemästä/mg liuosta, mikä tuottaa injisoitavat annokset 60 mg, 90 mg tai 120 mg lanreotidia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, liuos esitäytetyssä ruiskussa
Kliiniset tiedot
Käyttöaiheet
Somatuline Autogel on tarkoitettu:
- akromegalian pitkäaikaishoitoon potilailla, joilla veren kasvuhormoni- (GH) ja/tai insuliinin kaltaisen kasvutekijä-1:n (IGF-1) pitoisuudet pysyvät epänormaaleina leikkauksen ja/tai sädehoidon jälkeen tai potilailla, joita ei voida hoitaa leikkauksella ja/tai sädehoidolla. Tavoitteena akromegalian hoidossa on alentaa kasvuhormonin ja IGF-1:n pitoisuuksia ja mahdollisuuksien mukaan normalisoida nämä arvot.
- akromegaliaan liittyvien oireiden lievitykseen.
- neuroendokriinisiin kasvaimiin liittyvien oireiden hoitoon.
- paikallisesti edenneiden tai metastasoivien gastroenteropankreaattisten neuroendokriinisten kasvainten (GEP-NET), gradus 1 ja tietyt gradus 2 (Ki-67-indeksi enintään 10 %), hoitoon aikuisille silloin, kun kasvain on saanut alkunsa keskisuolesta, haimasta tai tuntemattomasta paikasta ja lähtökohta takasuolesta on poissuljettu eikä kasvainta voida operoida (ks. kohta Farmakodynamiikka).
Annostus ja antotapa
Annostus
Somatuline Autogel -valmistetta on saatavana kolmea vahvuutta, joissa on 60 mg, 90 mg tai 120 mg lanreotidia.
Akromegalia
Suositeltu aloitusannos on 60–120 mg joka 28. päivä.
Aloitusannoksen jälkeen annos pitää määrittää yksilöllisesti hoitovasteen mukaan (oireiden väheneminen ja/tai kasvuhormonin ja/tai IGF-1:n pitoisuuksien lasku).
Jos haluttua vastetta ei saavuteta, voidaan annosta suurentaa.
Annosta voidaan suurentaa, jos GH-tasot ovat yli 2,5 ng/ml.
Jos GH-tasot ovat välillä 2,5 ng/ml-1 ng/ml, annos voidaan säilyttää, jos ikään mukautettu IGF-1-taso on normaali.
Jos täydellinen kontrolli saavutetaan (perusteena GH-pitoisuus alle 1 ng/ml, normalisoitunut IGF-1:n pitoisuus ja/tai oireiden katoaminen), annosta voidaan pienentää.
Somatostatiinianalogilla hyvässä kontrollissa olevia potilaita voidaan hoitaa Somatuline Autogel 120 mg:lla joka 42.tai 56. päivä. Esimerkiksi potilaita, jotka ovat hyvässä kontrollissa joka 28. päivä annetulla Somatuline Autogel 60 mg ‑injektiolla, voidaan hoitaa Somatuline Autogel 120 mg:lla joka 56. päivä, ja potilaita, jotka ovat hyvässä kontrollissa joka 28. päivä annetulla Somatuline Autogel 90 mg ‑injektiolla, voidaan hoitaa Somatuline Autogel 120 mg:lla joka 42. päivä.
Pitkäaikainen oireiden sekä GH- ja IGF-1-pitoisuuksien seuranta tulee toteuttaa kuten on kliinisesti aiheellista.
Neuroendokriinisiin kasvaimiin liittyvät oireet
Suositeltu aloitusannos on 60–120 mg joka 28. päivä.
Aloitusannoksen jälkeen annos pitää määrittää yksilöllisesti oireiden lievittymisen mukaisesti. Suositeltu enimmäisannos on 120 mg Somatuline Autogel ‑valmistetta joka 28. päivä.
Somatostatiinianalogilla hyvässä kontrollissa olevia potilaita voidaan hoitaa Somatuline Autogel 120 mg:lla joka 42. tai 56. päivä. Esimerkiksi potilaita, jotka ovat hyvässä kontrollissa joka 28. päivä annetulla Somatuline Autogel 60 mg ‑injektiolla, voidaan hoitaa Somatuline Autogel 120 mg:lla joka 56. päivä, ja potilaita, jotka ovat hyvässä kontrollissa joka 28. päivä annetulla Somatuline Autogel 90 mg ‑injektiolla, voidaan hoitaa Somatuline Autogel 120 mg:lla joka 42. päivä. Oireita on seurattava tarkkaan, kun hoidossa siirrytään pidennettyyn antoväliin.
Paikallisesti edenneet tai metastasoivat gastroenteropankreaattiset neuroendokriiniset kasvaimet (GEP-NET), gradus 1 ja tietyt gradus 2 (Ki-67-indeksi enintään 10 %), hoito aikuisille silloin, kun kasvain on saanut alkunsa keskisuolesta, haimasta tai tuntemattomasta paikasta ja lähtökohta takasuolesta on poissuljettu eikä kasvainta voida operoida.
Suositeltava annos on yksi Somatuline Autogel 120 mg ‑injektio joka 28. päivä. Somatuline Autogel -hoitoa jatketaan niin kauan kuin on tarpeen kasvaimen kasvun hallitsemiseksi.
Munuaisten ja/tai maksan vajaatoiminta
Munuaisten tai maksan vajaatoimintaa sairastavilla ei tarvitse muuttaa annosta, koska lanreotidilla on suuri terapeuttinen leveys (katso kohta Farmakokinetiikka).
Iäkkäät potilaat
Iäkkäillä potilailla ei tarvitse muuttaa annosta, koska lanreotidilla on suuri terapeuttinen leveys (katso kohta Farmakokinetiikka).
Pediatriset potilaat
Somatuline Autogelin turvallisuutta ja tehoa lasten ja nuorten hoidossa ei ole varmistettu.
Antotapa
Somatuline Autogel annetaan syvänä ihonalaisena injektiona pakaran ylä-ulkoneljännekseen tai ulkoreiden yläosaan.
Jos potilaan saama Somatuline Autogel -annos on vakio, valmisteen voi antaa potilas itse tai valmisteen antoon koulutettu henkilö terveydenhuollon ammattilaisen antaman asianmukaisen koulutuksen jälkeen. Jos potilas antaa injektion itse, injektio tulee antaa ulkoreiden yläosaan.
Terveydenhuollon ammattilainen tekee päätöksen siitä, voiko potilas itse tai valmisteen antoon koulutettu henkilö antaa valmisteen.
Riippumatta antopaikasta ihoa ei tule rypistää ja neula tulee työntää nopeasti koko pituudeltaan kohtisuorasti ihoon.
Injektiokohtaa tulee vuorotella vasemman ja oikean puolen kesken.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle somatostatiinille tai muille saman sukuisille peptideille tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Sappikivitauti ja sappikivitaudin komplikaatiot:
Lanreotidi saattaa heikentää sappirakon motiliteettia ja aiheuttaa sappikivien muodostumista. Tämän vuoksi potilaita tulee seurata ajoittain. Pitkäaikaisen hoidon aikana on suositeltavaa tehdä ennen hoitoa ja 6 kuukauden välein sappirakon kaikukuvaus (ks. kohta Haittavaikutukset).
Sappikiviä, jotka ovat johtaneet komplikaatioihin, kuten sappirakkotulehdukseen, sappitietulehdukseen ja haimatulehdukseen, jotka ovat edellyttäneet sappirakon poistoa, on ilmoitettu lanreotidia saavilla potilailla valmisteen markkinoille tulon jälkeen. Jos epäillään sappikivitautiin liittyviä komplikaatioita, lopetetaan lanreotidihoito ja potilasta hoidetaan asianmukaisesti.
Hyperglykemia ja hypoglykemia:
Eläimillä ja ihmisellä suoritetut farmakologiset tutkimukset osoittavat, että lanreotidi estää somatostatiinin ja muiden somatostatiinianalogien tavoin insuliinin ja glukagonin erittymistä. Tästä johtuen lanreotidilla hoidetuilla potilailla saattaa esiintyä hypoglykemiaa tai hyperglykemiaa. Verensokeriarvoja tulee seurata lanreotidihoitoa aloitettaessa tai annostusta muutettaessa ja diabeteksen hoitoa tulee muuttaa vastaavasti.
Kilpirauhasen vajaatoiminta:
Lievää kilpirauhasen toiminnan heikkenemistä on havaittu akromegaliapotilailla lanreotidihoidon aikana, mutta kliininen hypotyreoosi on harvinainen. Kilpirauhasen toimintakokeita suositellaan kliinisen tarpeen mukaan.
Bradykardia:
Lanreotidi saattaa alentaa sykettä potilailla, joilla ei ole sydänongelmia, mutta se ei välttämättä aiheuta bradykardiaa. Potilailla, joilla on todettu sydänsairaus ennen lanreotidihoitoa, voi esiintyä sinusbradykardiaa. Tarkkuutta on noudatettava, kun lanreotidilla aletaan hoitaa potilaita, joilla on bradykardia (katso kohta Yhteisvaikutukset).
Haiman toiminta:
Joillakin potilailla, jotka saavat lanreotidia gastroenteropankreaattisten neuroendokriinisten kasvainten hoitoon, on havaittu haiman eksokriinista vajaatoimintaa. Haiman eksokriinisen vajaatoiminnan oireita voivat olla rasvaripuli, löysät ulosteet, vatsan turvotus ja painon lasku. Oireisille potilaille on harkittava haiman eksokriinisen vajaatoiminnan seulontaa ja asianmukaista hoitoa kliinisten ohjeistojen mukaisesti.
Aivolisäkekasvaimen seuranta:
Akromegaliaa sairastavilla potilailla lanreotidin käyttö ei vapauta aivolisäkekasvaimen koon seurannasta.
Yhteisvaikutukset
Lanreotidin farmakologiset gastrointestinaaliset vaikutukset saattavat vähentää samanaikaisesti otettujen lääkkeiden, mm. siklosporiinin imeytymistä suolesta.
Siklosporiinin ja lanreotidin samanaikainen käyttö voi vähentää siklosporiinin hyötyosuutta ja siksi voi olla tarpeen muuttaa siklosporiinin annosta terapeuttisen pitoisuuden ylläpitämiseksi.
Yhteisvaikutukset plasmaan runsaasti sitoutuneiden lääkkeiden kanssa ovat epätodennäköisiä, koska lanreotidi sitoutuu vain kohtalaisesti plasman proteiineihin.
Vähäisen julkaistun tiedon mukaan samanaikainen somatostatiinianalogien ja bromokriptiinin antaminen voi lisätä bromokriptiinin hyötyosuutta.
Insuliinin ja diabeteslääkkeiden annoksen sovittaminen voi olla tarpeen, kun Somatulinea annetaan samanaikaisesti:
Hypoglykemian tai hyperglykemian riski: diabeteslääkityksen tarpeen väheneminen endogeenisen glukagonin erityksen vähenemisen tai lisääntymisen seurauksena.
Glykeemistä omaseurantaa on tehostettava ja diabeteslääkehoidon annostusta lanreotidihoidon aikana on mukautettava tarpeen mukaan.
Samanaikainen bradykardiaa indusoivien lääkkeiden (esimerkiksi beetasalpaajat) antaminen voi hieman lisätä lanreotidin sydämen sykettä alentavaa vaikutusta. Tämänkaltaisten samanaikaisesti käytettävien lääkkeiden annoksen muuttaminen voi olla tarpeen.
Vähäinen julkaistu tieto viittaa siihen, että somatostaniinianalogit voivat vähentää sytokromi P450-järjestelmän kautta metaboloituvien aineiden metabolista puhdistumaa, mikä saattaa johtua kasvuhormonin suppressiosta. Koska ei voida sulkea pois mahdollisuutta, että lanreotidilla on tämänlaista vaikutusta, muita pääosin CYP3A4:n kautta metaboloituvia ja kapean terapeuttisen leveyden omaavia lääkkeitä (esim. kinidiini, terfenadiini) tulisi käyttää varoen.
Raskaus ja imetys
Raskaus
On vain vähän tietoja (alle 300 raskauden lopputuloksesta) lanreotidin käytöstä raskaana oleville naisille.
Eläimillä tehdyissä tutkimuksissa on havaittu lisääntymistoksisuutta, mutta ei merkkejä teratogeenisistä vaikutuksista (ks. kohta Prekliiniset tiedot turvallisuudesta). Mahdollista riskiä ihmiselle ei tunneta.
Varmuuden vuoksi lanreotidin käyttöä on suositeltavaa välttää raskauden aikana.
Imetys
Ei tiedetä, erittyykö tämä lääke ihmisillä äidinmaitoon.
Vastasyntyneeseen/imeväiseen kohdistuvia riskejä ei voida sulkea pois. Somatuline Autogelia ei pidä käyttää rintaruokinnan aikana.
Hedelmällisyys
Naarasrotilla havaittiin GH:n erityksen estymisestä johtuvaa hedelmällisyyden heikkenemistä annoksilla, jotka olivat suurempia kuin ihmisille annettavat hoitoannokset.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Somatuline Autogelilla on vähäinen tai kohtalainen vaikutus ajokykyyn tai koneidenkäyttökykyyn. Vaikutuksia ajokykyyn tai koneidenkäyttökykyyn ei ole tutkittu, mutta huimausta on raportoitu Somatuline Autogelin käytön aikana (ks. kohta Haittavaikutukset). Jos potilaalla on oireita, hänen ei tulisi ajaa autoa tai käyttää koneita.
Haittavaikutukset
Kliinisissä tutkimuksissa akromegaliaa ja GEP-NET-kasvaimia sairastavien, lanreotidilla hoidettujen potilaiden raportoimat haittavaikutukset on lueteltu elinjärjestelmittäin seuraavan luokittelun mukaisesti: Hyvin yleinen (≥ 1/10); yleinen (≥ 1/100,< 1/10); melko harvinainen (≥ 1/1000, < 1/100), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Todennäköisimmät lanreotidihoidosta aiheutuvat haittavaikutukset ovat ruoansulatuselimistön häiriöt (useimmin raportoituja ovat ripuli ja vatsakipu, jotka ovat lieviä tai keskivaikeita ja ohimeneviä), sappikivitauti (usein oireeton) ja pistospaikan reaktiot (kipu, kyhmyt ja kovettumat).
Haittavaikutusprofiili on samankaltainen kaikissa käyttöaiheissa.
| Elinjärjestelmä | Hyvin yleinen (≥ 1/10) | yleinen (≥ 1/100, < 1/10) | melko harvinainen (≥ 1/1 000, < 1/100) | Markkinoille tulon jälkeiset tiedot turvallisuudesta (yleisyys tuntematon) |
| Immuunijärjestelmä | Allergiset reaktiot (mukaan lukien angioedeema, anafylaksia, yliherkkyys) | |||
| Aineenvaihdunta ja ravitsemus | Hypoglykemia, ruokahalun väheneminen**, hypergykemia, diabetes mellitus | |||
| Psyykkiset häiriöt | Unettomuus* | |||
| Hermosto | Huimaus, päänsärky, letargia** | |||
| Sydän | Sinusbradykardia* | |||
| Verisuonisto | Kuumat aallot* | |||
| Ruoansulatuselimistö | Ripuli, löysät ulosteet*, vatsakipu | Pahoinvointi, oksentelu, ummetus, ilmavaivat, vatsan pingotus, vatsavaivat*, dyspepsia, rasvaripuli** | Värjäytyneet ulosteet* | Haiman eksokriininen vajaatoiminta, haimatulehdus |
| Maksa ja sappi | Sappikivitauti | Sappiteiden laajeneminen* | Sappirakkotulehdus, sappitietulehdus | |
| Iho ja ihonalainen kudos | Alopesia, niukkakarvaisuus* | |||
| Luusto, lihakset ja sidekudos | Muskuloskeletaalinen kipu**, lihaskipu** | |||
| Yleisoireet ja antopaikassa todettavat haitat | Astenia, väsymys, pistoskohdan reaktiot (kipu, kyhmy, kovettuma, kutina) | Pistoskohdan abskessi | ||
| Tutkimukset | Kohonneet ALAT-arvot*, poikkeavat ASAT-arvot*, poikkeavat ALAT-arvot*, veren bilirubiinin lisääntyminen*, veren glukoosin lisääntyminen*, glykosyloituneen hemoglobiinin lisääntyminen*, painon lasku, haimaentsyymien väheneminen** | Kohonneet ASAT-arvot*, veren alkalisen fosfataasin lisääntyminen*, poikkeavat veren bilirubiiniarvot*, veren natriumin väheneminen* |
* perustuu akromegaliapotilaille tehtyihin tutkimuksiin
** perustuu GEP-NET-potilaille tehtyihin tutkimuksiin
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Mahdollisen yliannostuksen hoidon tulee olla oireiden mukaista.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Aivolisäkkeen ja hypotalamuksen hormonit sekä analogit, somatostatiini ja sen analogit, ATC-koodi: H01C B03.
Vaikutusmekanismi
Lanreotidi on luonnollisen somatostatiinin oktapeptidianalogi. Se on somatostatiinin tavoin useiden endokriinisten, neuroendokriinisten, eksokriinisten ja parakriinisten toimintojen inhibiittori. Lanreotidi sitoutuu hyvin ihmisen somatostatiinireseptoreihin (SSTR) 2 ja 5 ja heikommin ihmisen somatostatiinireseptoreihin 1, 3 ja 4. Vaikutuksen ihmisen somatostatiinireseptoreihin 2 ja 5 uskotaan olevan kasvuhormoni-inhibition ensisijainen mekanismi. Lanreotidi on aktiivisempi ja sen vaikutusaika on pitempi kuin luonnollisen somatostatiinin.
Somatostatiinin tavoin lanreotidilla on yleistä eksokriinista eritystä estävää vaikutusta.
Se estää motiliinin, mahan inhibitorisen peptidin ja haiman polypeptidin basaalieritystä, mutta sillä ei ole merkittävää vaikutusta paaston aikaiseen sekretiinin tai gastriinin eritykseen. Lisäksi se pienentää kromograniini A:n pitoisuutta plasmassa ja 5-HIAA:n (5-hydroksi-indoliasetaattihappo) pitoisuutta virtsassa GEP-NET-potilailla, joilla näiden kasvainmerkkiaineiden pitoisuudet ovat suurentuneet. Lanreotidi estää merkittävästi ruuan aiheuttamaa valtimoveren virtausta ylemmässä suoliliepeessä ja porttilaskimon verenvirtausta.
Lanreotidi vähentää merkittävästi prostaglandiini E1:n stimuloimaa veden, natriumin, kaliumin ja kloridin eritystä tyhjäsuolesta (jejunum). Lanreotidi alentaa pitkäaikaishoidossa olevien akromegaliapotilaiden prolaktiinitasoja.
Akromegaliapotilailla lanreotidi voi pienentää kasvainkudoksen tilavuutta.
Avoimessa kontrolloimattomassa tutkimuksessa 90 aiemmin hoitamatonta akromegaliapotilasta, joilla oli aivolisäkkeen makroadenooma ja joille ei suunniteltu leikkausta tai sädehoitoa, sai Somatuline Autogel 120 mg ‑valmistetta joka 28. päivä 48 viikon ajan.
Vasteen saaneiden osuus ei ollut tilastollisesti merkitsevä, mutta 56/89 potilaalla (63 %, 95 %:n luottamusväli: 52-73 %) todettiin kasvaintilavuuden pienentyneen ≥ 20 % viikolla 48.
Viikolla 48 kasvaintilavuus oli pienentynyt keskimäärin 26,8 %.
Viikolla 48 kasvuhormonin pitoisuus oli alle 2,5 µg/l 77,8 %:lla potilaista ja IGF-1:n pitoisuudet olivat normalisoituneet 50 %:lla potilaista. 43,5 %:lla potilaista IGF-1:n pitoisuus oli normalisoitunut ja kasvuhormonin pitoisuus oli alle 2,5 µg/l.
Useimmat potilaat ilmoittivat akromegalian oireiden, kuten päänsäryn (38,7 %), uupumuksen (56,5 %), liikahikoilun (66,1 %), nivelkivun (59,7 %) ja pehmytkudosturvotuksen (66,1 %) lieventyneen selvästi.
Sekä varhaista että pysyvää kasvaintilavuuden, kasvuhormonin pitoisuuden ja IGF-1:n pitoisuuden pienenemistä havaittiin viikolta 12 alkaen ja vaste säilyi 48 viikkoa.
Satunnaistetussa kaksoissokkoutetussa lumekontrolloidussa 96 viikkoa kestäneessä faasin III monikeskustutkimuksessa Somatuline Autogeliä annettiin potilaille, joilla oli gastroenteropankreaattisia neuroendokriinisiä kasvaimia. Tutkimuksen kesto oli määritetty ennalta, ja tutkimuksen tarkoituksena oli arvioida lanreotidin kasvainten kasvua estävää vaikutusta.
Potilaat satunnaistettiin suhteessa 1:1 saamaan joko Somatuline Autogel 120 mg ‑valmistetta joka 28. päivä (n=101) tai lumetta (n=103). Satunnaistamisessa ryhmät stratifioitiin sen mukaan, mitä hoitoa potilas sai tutkimukseen sisäänottohetkellä ja etenikö sairaus lähtötilanteessa RECIST 1.0 (Response Evaluation Criteria in Solid Tumours) ‑asteikolla mitattuna 3–6 kuukautta kestäneen aloitusvaiheen aikana.
Potilailla oli metastasoinut ja/tai paikallisesti edennyt syöpä, jota ei voitu hoitaa leikkauksella, ja histologisesti varmistettuja hyvin tai kohtalaisesti erilaistuneita primaarikasvaimia haimassa (44,6 %), keskisuolessa (35,8 %), takasuolessa (6,9 %) tai muussa/tuntemattomassa paikassa (12,7 %).
69 %:lla potilaista, joilla oli GEP-NET-kasvain, kasvaimen aste oli 1 (G1), jonka määritelmänä oli Ki-67-proliferaatioindeksi ≤ 2 % (50,5 % koko potilasjoukosta) tai mitoosi-indeksi < 2/10 HPF (18,5 % koko potilasjoukosta), ja 30 %:lla potilaista, joilla oli GEP-NET-kasvain, oli Ki-67-indeksiltään pienempi 2. asteen kasvain (G2) (jonka määritelmänä oli Ki-67-indeksi > 2 % – ≤ 10 %). Astetietoa ei ollut saatavana 1 %:sta potilaita. Tutkimuksesta suljettiin pois potilaat, joilla oli 2. asteen GEP-NET-kasvain, jonka proliferaatioindeksi oli suuri (Ki-67-indeksi > 10 % – ≤ 20 %), tai 3.asteen GEP neuroendokriininen karsinooma (Ki-67-indeksi > 20 %).
Kaikkiaan 52,5 %:lla potilaista maksatuumoritaakka oli ≤ 10 %, 14,5 %:lla taakka oli 10 - ≤ 25 % ja 33 %:lla se oli > 25 %.
Ensisijainen päätetapahtuma oli etenemättömyysaika, jota mitattiin joko aikana sairauden etenemiseen RECIST 1.0 ‑asteikolla tai kuolemaan tutkimushoidon ensimmäisen annon jälkeisen 96 viikon aikana. Etenemättömyysajan analyysissa käytettiin riippumattomia keskitetysti tehtyjä radiologisia arvioita sairauden etenemisestä.
Taulukko 1: Faasin III tutkimuksen tehoa koskevat tulokset
Etenemättömyysajan mediaani (viikkoa) | Riskisuhde (95 %:n CI) | Etenemisen tai kuoleman riskin pienenemä | p-arvo | |
Somatuline Autogel (n = 101 ) | Lume (n = 103 ) | |||
| > 96 viikkoa | 72,00 viikkoa (95 %:n CI: 48,57, 96,00) | 0,470 (0,304, 0,729) | 53 % | 0,0002 |
Kuva 1: Etenemättömyysaikaa kuvaavat Kaplan-Meierin käyrät
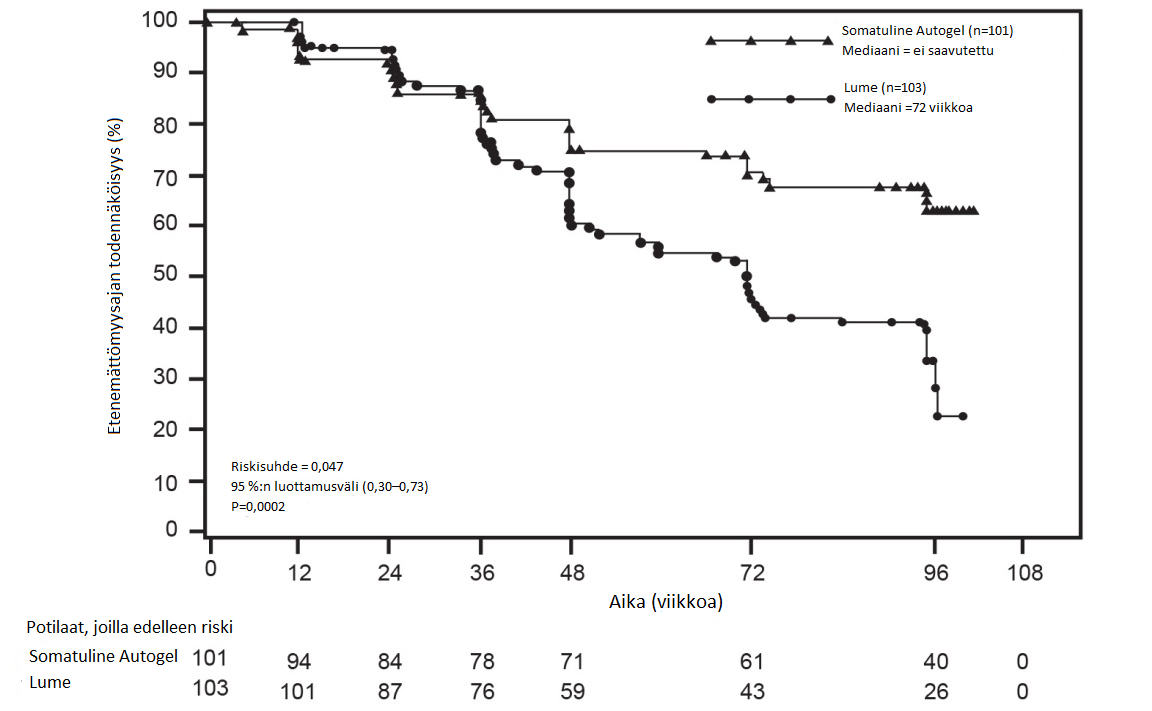
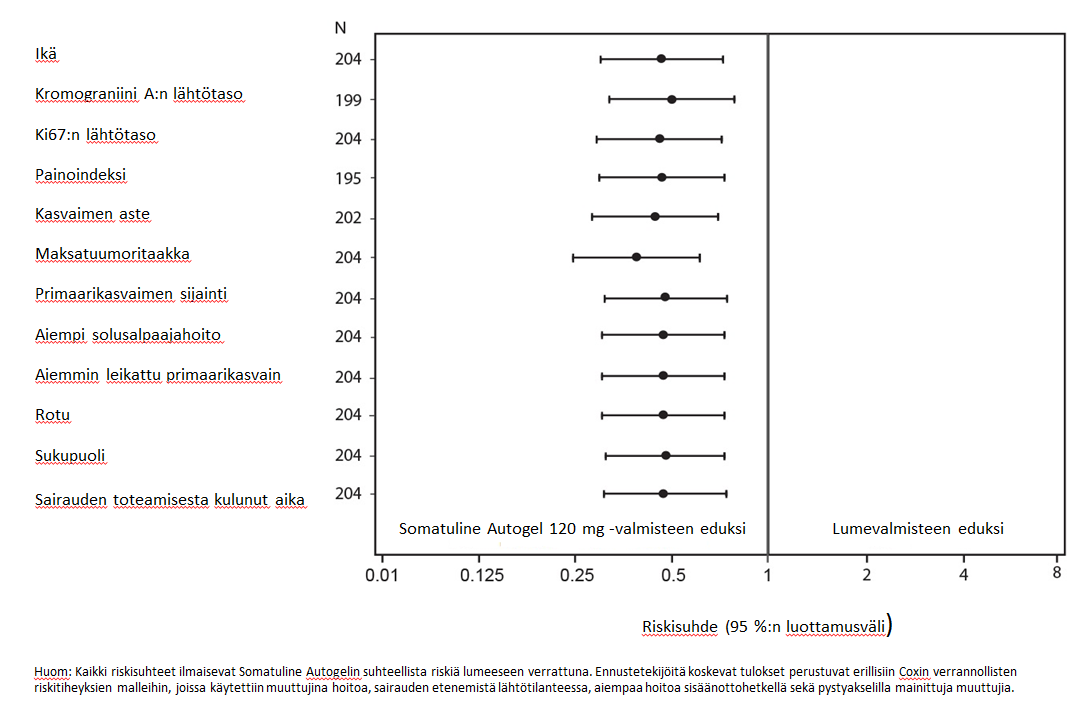
Lanreotidi pienensi sairauden etenemisen tai kuoleman riskiä riippumatta primaarikasvaimen paikasta, maksatuumoritaakasta, aiemmasta solusalpaajahoidosta, lähtötilanteen Ki-67-pitoisuudesta, kasvaimen asteesta tai muista ennalta määritetyistä tekijöistä kuvan 2 mukaisesti.
Somatuline Autogel ‑hoidon hyöty osoitettiin niiden potilaiden alaryhmissä, joilla oli haimassa, keskisuolessa (midgut) tai muussa/tuntemattomassa paikassa sijaitseva kasvain, sekä koko tutkimusväestössä. Potilaita, joilla kasvain sijaitsi takasuolessa, oli vähän (14/204), joten tuloksia oli vaikea tulkita tämän potilasryhmän osalta. Käytettävissä olevat tiedot eivät viittaa siihen, että lanreotidista olisi hyötyä näiden potilaiden hoidossa.
Kuva 2: Etenemättömyysajan kovariaatteja koskevan Coxin verrannollisen riskitiheysanalyysin tulokset
Jatkotutkimuksessa 45,6 % potilaista (47/103 potilasta) siirtyi lumeryhmästä avoimeen Somatuline Autogel ‑ryhmään.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Somatuline Autogel ‑valmisteen käytöstä kaikkien pediatristen potilasryhmien hoidossa käyttöaiheissa akromegalia ja aivolisäkeperäinen jättikasvu (ks. kohta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa). Gastroenteropankreaattiset neuroendokriiniset kasvaimet (neuroblastoomaa, neuroengioglioblastomomaa ja feokromosytoomaa lukuun ottamatta) kuuluvat Euroopan lääkeviraston luetteloon sairauksista, joiden osalta on myönnetty vapautus toimittaa tutkimustulokset pediatristen potilaiden hoidossa.
Farmakokinetiikka
Lanreotidin oleelliset farmakokineettiset parametrit terveillä vapaaehtoisilla henkilöillä laskimonsisäisen annostelun jälkeen osoittivat ekstravaskulaarisen jakautumisen olevan rajoitettua, vakaan tilan jakautumistilavuus oli 16,1 l. Kokonaispuhdistuma oli 23,7 l/h, terminaalinen puoliintumisaika oli 1,14 tuntia ja keskimääräinen jäännösaika oli 0,68 tuntia.
Erittymistä mittaavissa tutkimuksissa alle 5 % lanreotidista erittyi virtsaan ja alle 0,5 % muuttumattomana ulosteeseen, mikä viittaa vähäiseen sapen kautta erittymiseen.
Terveille vapaaehtoisille henkilöille syvälle ihon alle annetut 60, 90 ja 120 mg:n Somatuline Autogel -annokset tuottivat keskimääräiset 4,25, 8,39 ja 6,79 ng/ml:n maksimaaliset seerumipitoisuudet. Nämä Cmax-arvot saavutettiin ensimmäisenä päivänä 8, 12 ja 7 tunnin annostelun jälkeen (mediaaniarvot). Huippupitoisuuden jälkeen lanreotidipitoisuudet alenevat hitaasti ensimmäisen asteen kinetiikkaa noudattaen, puoliintumisaikojen ollessa 23,3, 27,4 ja 30,1 päivää ja neljän viikon kuluttua injektion annosta lanreotidin seerumipitoisuuksien keskiarvot olivat 0,9, 1,11 ja 1,69 ng/ml.
Absoluuttiset biologiset hyötyosuudet olivat 73,4, 69,0 ja 78,4 %.
Akromegaliapotilaille syvälle ihon alle annettujen Somatuline Autogel 60, 90 ja 120 mg:n injektioiden jälkeen lanreotidin maksimipitoisuuksien keskiarvot seerumissa kohosivat 1,6, 3,5 ja 3,1 ng/ml:aan. Nämä Cmax-arvot saavutettiin ensimmäisenä päivänä, 6 ja 6 ja 24 tunnin kuluttua injektiosta. Huippupitoisuuden jälkeen seerumin lanreotidipitoisuudet alenevat hitaasti ensimmäisen asteen kinetiikkaa noudattaen ja neljän viikon kuluttua injektion annon jälkeen lanreotidin pitoisuuksien keskiarvot olivat 0,7, 1,0 ja 1,4 ng/ml.
Lanreotidin vakaan tilan pitoisuudet seerumissa saavutettiin keskimäärin 4:n, 4:n viikon välein, annetun injektion jälkeen. Neljän viikon välein annettujen 60, 90 ja 120 mg:n injektioiden tuottamat vakaan tilan Cmax-pitoisuudet olivat 3,8, 5,7 ja 7,7 ng/ml ja Cmin-pitoisuudet olivat 1,8, 2,5 ja 3,8 ng/ml. Pitoisuuksien välinen vaihtelu oli kohtalaista, 81 %:sta 108 %:iin.
Akromegaliapotilaille annettujen syvien ihonalaisten Somatuline Autogel 60, 90 ja 120 mg:n injektioiden kinetiikka oli lineaarista.
290:stä Somatuline Autogel 120 mg -valmistetta saaneesta GEP-NET-potilaasta saaduista tiedoista tehdyn populaatiofarmakokineettisen analyysin mukaan lääkeaine vapautui aluksi nopeasti ja yhden injektion jälkeen keskimääräinen Cmax 7,49 ± 7,58 ng/ml saavutettiin injektion jälkeisenä päivänä. Kun potilaille annettiin Somatuline Autogel 120 mg ‑valmistetta joka 28. päivä, vakaan tilan pitoisuudet saavutettiin 5 injektion jälkeen, ja pitoisuudet pysyivät vakaina viimeiseen mittaukseen asti (pisimmillään 96 viikkoa ensimmäisestä injektiosta). Vakaassa tilassa Cmax -arvon keskiarvo 13,9 ± 7,44 ng/ml ja alimpien seerumista mitattujen pitoisuuksien keskiarvo oli 6,56 ± 1,99 ng/ml. Terminaalisen puoliintumisajan keskiarvo oli 49,8 ± 28,0 vuorokautta.
Munuais-/maksasairaudet
Vaikeassa munuaisten vajaatoiminnassa seerumin lanreotidin kokonaispuhdistuma alenee noin puoleen ja puoliintumisaika vastaavasti pitenee sekä AUC-arvot suurenevat. Kohtalaisessa tai vaikeassa maksan vajaatoiminnassa puhdistuman huomattiin alenneen (30 %). Jakaantumistilavuus ja keskimääräinen viipymäaika kudoksisssa lisääntyivät kaikissa maksan vajaatoiminnan asteissa.
165:sta lievää (106 potilasta) tai keskivaikeaa (59 potilasta) munuaisten vajaatoimintaa sairastavasta, Somatuline Autogel -hoitoa saavasta GEP-NET-potilaasta saaduista tiedoista tehdyssä populaatiofarmakokineettisessä analyysissa ei havaittu vaikutuksia lanreotidin puhdistumaan.
Vaikeaa munuaisten vajaatoimintaa sairastavia (Child-Pughin luokituksen mukaan) GEP-NET-potilaita ei tutkittu.
Aloitusannosta ei tarvitse muuttaa munuaisten tai maksan vajaatoiminnassa, koska lanreotidin pitoisuuksien oletetaan olevan tässä ryhmässä niiden pitoisuuksien rajoissa, jotka ovat hyvin siedettyjä terveillä henkilöillä.
Iäkkäät potilaat
Iäkkäillä puoliintumisaika pitenee ja viipymäaika kudoksissa on pidempi kuin terveillä nuorilla henkilöillä. Iäkkäillä ei tarvitse muuttaa aloitusannosta, koska lanreotidin pitoisuuksien oletetaan olevan tässä ryhmässä niiden pitoisuuksien rajoissa, jotka ovat hyvin siedettyjä terveillä henkilöillä. 122:sta iältään 65–85-vuotiaasta GEP-NET-potilaasta saaduista tiedoista tehdyn populaatiofarmakokineettisen analyysin perusteella ikä ei vaikuta lanreotidin puhdistumaan tai jakautumistilavuuteen.
Prekliiniset tiedot turvallisuudesta
Prekliinisissä tutkimuksissa havaittiin vaikutuksia vain altistustasoilla, joiden katsottiin olevan niin paljon ihmisen suurinta altistusta suurempia, että niillä ei ole vaikutusta kliiniseen käyttöön.
Rotilla ja hiirillä tehdyissä karsinogeenisuustutkimuksissa neoplastisia muutoksia ei todettu pitoisuuksilla, jotka olivat suurempia kuin ihmisillä saavutettavat terapeuttiset pitoisuudet. Injektiokohdissa todettiin lisääntynyttä ihonalaisten tuumoreiden esiintymistä, mikä luultavasti johtuu eläimille tiheästi (päivittäin) annetuista pistoksista. Tällä ei luultavasti ole kliinistä merkitystä, koska ihmisille injektio annetaan kerran kuukaudessa.
In vitro ja in vivo eläimillä suoritetut toksisuustutkimukset eivät ole osoittaneet genotoksisuutta.
Lanreotidi ei ollut teratogeeninen rotilla ja kaniineilla. Alkio-/sikiötoksisuutta todettiin rotilla (alkiokuolemien lisääntyminen ennen kiinnittymistä kohtuun) ja kaniineilla (alkiokuolemien lisääntyminen kohtuun kiinnittymisen jälkeen).
Lisääntymistutkimuksissa, joissa tiineille rotille annettiin 30 mg/kg injektiona ihon alle 2 viikon välein (viisi kertaa ihmiselle tarkoitettu annos kehon pinta-alaan perustuvan vertailun mukaan), alkioiden/sikiöiden eloonjääminen väheni. Tutkimuksissa, joissa tiineille kaniineille annettiin 0,45 mg/kg/vrk (kaksi kertaa ihmisen terapeuttinen altistus suositellulla enimmäisannoksella 120 mg suhteelliseen kehon pinta-alaan perustuvan vertailun mukaan), ilmeni sikiöiden eloonjäämisen vähenemistä ja luuston/pehmytkudoksen poikkeavuuksien lisääntymistä.
Farmaseuttiset tiedot
Apuaineet
Injektionesteisiin käytettävä vesi ja
väkevä etikkahappo (pH:n säätämistä varten).
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta.
Valmiste tulee käyttää välittömästi laminoidun suojapussin avaamisen jälkeen.
Säilytys
Säilytä jääkaapissa (2 °C – 8 °C) alkuperäispakkauksessa. Herkkä valolle.
Jääkaapista otettu valmiste voidaan panna takaisin jääkaappiin jatkosäilytystä ja myöhempää käyttöä varten edellyttäen, että sitä on säilytetty yhteensä enintään 72 tuntia alle 40 °C:n lämpötilassa ja että lämpötilapoikkeamia on enintään kolme.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
SOMATULINE AUTOGEL injektioneste, liuos, esitäytetty ruisku
60 mg (L:ei) 60 mg (451,87 €)
90 mg (L:ei) 90 mg (594,89 €)
120 mg (L:ei) 120 mg (742,62 €)
PF-selosteen tieto
Somatuline Autogel toimitetaan esitäytetyssä ruiskussa (polypropeeni), jossa on automaattinen turvajärjestelmä ja siinä männän pysäytin (bromobutyylikumia) sekä neula (ruostumatonta terästä), jonka päällä on muovisuojus.
Kukin käyttövalmis esitäytetty ruisku on muovisella alustalla, joka on pakattu laminoituun pussiin ja pahvilaatikkoon.
Somatuline Autogel 60 mg / 90 mg / 120 mg:
Laatikko, joka sisältää yhden esitäytetyn ruiskun, jossa on kiinteä neula.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Valkoinen tai haalean keltainen, viskoosi ja ylikyllästetty liuos.
Käyttö- ja käsittelyohjeet
Esitäytetyssä ruiskussa oleva injektioneste on käyttövalmis.
Käytettävä välittömästi ja yhdellä kertaa avaamisen jälkeen.
On tärkeää, että liuos injektoidaan tarkasti pakkausselosteessa olevien ohjeiden mukaan.
Ei tule käyttää, jos laminoitu pussi on vaurioitunut tai avautunut.
Käyttämätön valmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
SOMATULINE AUTOGEL injektioneste, liuos, esitäytetty ruisku
60 mg 60 mg
90 mg 90 mg
120 mg 120 mg
- Ylempi erityiskorvaus (100 %). Pahanlaatuiset kasvaimet, joita ei ole edellä erikseen mainittu (130).
- Peruskorvaus (40 %).
ATC-koodi
H01CB03
Valmisteyhteenvedon muuttamispäivämäärä
18.12.2023
Yhteystiedot
Kista Science Tower, Färögatan 33
SE-164 51 Kista
Sweden
+46 8 451 60 00
www.ipsen.com
info.se@ipsen.com
