SANDOSTATIN LAR injektiokuiva-aine ja liuotin, suspensiota varten 10 mg, 20 mg, 30 mg
Vaikuttavat aineet ja niiden määrät
Yksi injektiopullo sisältää oktreotidiasetaattia vastaten 10 mg oktreotidia
Yksi injektiopullo sisältää oktreotidiasetaattia vastaten 20 mg oktreotidia
Yksi injektiopullo sisältää oktreotidiasetaattia vastaten 30 mg oktreotidia
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektiokuiva-aine ja liuotin, suspensiota varten.
Kliiniset tiedot
Käyttöaiheet
Akromegalian hoito potilailla, joilla leikkaushoito ei ole asianmukaista tai se ei tehoa, tai väliaikaisena hoitona, kunnes sädehoidon täysi teho tulee esiin (ks. kohta Annostus ja antotapa).
Toiminnallisiin gastroenteropankreaattisiin endokriinisiin kasvaimiin liittyvien oireiden hoito potilailla, joilla on esim. karsinoidikasvain ja karsinoidioireyhtymän piirteitä (ks. kohta Farmakodynamiikka).
Pitkälle edenneiden neuroendokriinisten kasvainten hoito, jos kasvain on saanut alkunsa keskisuolesta tai sen primaarisijainti on tuntematon mutta keskisuolen ulkopuolinen primaarisijainti on suljettu pois.
Tyreotropiinia erittävien aivolisäkeadenoomien hoito:
- kun eritys ei ole normalisoitunut leikkauksen ja/tai sädehoidon jälkeen
- potilailla, joille leikkaus ei sovi
- sädehoitoa saavilla potilailla, kunnes sädehoidolla saavutetaan riittävä teho.
Annostus ja antotapa
Annostus
Akromegalia
On suositeltavaa aloittaa hoito antamalla 20 mg Sandostatin LAR ‑valmistetta 4 viikon välein 3 kuukauden ajan. Jos potilasta on hoidettu ihon alle annettavalla Sandostatin-valmisteella, Sandostatin LAR ‑hoito voidaan aloittaa viimeistä ihon alle annettavaa Sandostatin-annosta seuraavana päivänä. Myöhempien annosmuutosten on perustuttava kasvuhormonin (GH) ja insuliinin kaltaisen kasvutekijä I:n/somatomediini C:n (IGF-1) pitoisuuksiin seerumissa sekä kliinisiin oireisiin.
Jos potilaan kliinisiä oireita ja biokemiallisia parametreja (GH, IGF-1) ei saada täysin hallintaan tämän 3 kuukauden jakson aikana (GH-pitoisuus edelleen yli 2,5 mikrog/l), annosta voidaan suurentaa 30 milligrammaan 4 viikon välein. Mikäli GH- ja IGF-1-pitoisuuksia ja/tai oireita ei ole saatu riittävästi hallintaan, kun 30 mg:n annosta on käytetty 3 kuukauden ajan, annos voidaan suurentaa 40 milligrammaan 4 viikon välein.
Jos potilaan GH-pitoisuus on johdonmukaisesti alle 1 mikrog/l, seerumin IGF-1-pitoisuus on normalisoitunut ja suurin osa akromegalian korjautuvista oireista ja löydöksistä on hävinnyt, kun potilasta on hoidettu 3 kuukauden ajan 20 mg:n annoksella, hänelle voidaan antaa 10 mg Sandostatin LAR ‑valmistetta 4 viikon välein. Etenkin tässä potilasryhmässä on kuitenkin suositeltavaa seurata tarkoin, pysyvätkö seerumin GH- ja IGF-1-pitoisuudet sekä kliiniset oireet ja löydökset asianmukaisesti hallinnassa kyseisellä pienellä Sandostatin LAR ‑annoksella.
Jos potilas saa vakaa-annoksista Sandostatin LAR ‑hoitoa, GH- ja IGF-1-pitoisuudet on määritettävä 6 kuukauden välein.
Gastroenteropankreaattiset endokriiniset kasvaimet
Toiminnallisiin gastroenteropankreaattisiin neuroendokriinisiin kasvaimiin liittyvien oireiden hoito
On suositeltavaa aloittaa hoito antamalla 20 mg Sandostatin LAR ‑valmistetta 4 viikon välein. Jos potilasta on hoidettu ihon alle annettavalla Sandostatin-valmisteella, ihon alle annettavaa hoitoa jatketaan aiemmalla tehokkaalla annostuksella 2 viikon ajan ensimmäisen Sandostatin LAR ‑injektion jälkeen.
Jos potilaan oireet ja biomarkkeriarvot ovat hyvin hallinnassa 3 hoitokuukauden jälkeen, annosta voidaan pienentää 10 milligrammaan Sandostatin LAR ‑valmistetta 4 viikon välein.
Jos potilaan oireet ovat vain osittain hallinnassa 3 hoitokuukauden jälkeen, annosta voidaan suurentaa 30 milligrammaan Sandostatin LAR ‑valmistetta 4 viikon välein.
Päivinä, joina gastroenteropankreaattisiin kasvaimiin liittyvät oireet saattavat voimistua Sandostatin LAR ‑hoidon aikana, on suositeltavaa antaa lisäksi Sandostatin-valmistetta ihon alle ennen Sandostatin LAR ‑hoitoa käytetyllä annoksella. Ilmiötä voi esiintyä etenkin ensimmäisten 2 hoitokuukauden aikana, kunnes oktreotidin hoitopitoisuudet saavutetaan.
Pitkälle edenneiden neuroendokriinisten kasvainten hoito, jos kasvain on saanut alkunsa keskisuolesta tai sen primaarisijainti on tuntematon mutta keskisuolen ulkopuolinen primaarisijainti on suljettu pois
Suositeltava Sandostatin LAR ‑annos on 30 mg 4 viikon välein (ks. kohta Farmakodynamiikka). Kasvaimen kasvun hillitsemiseen käytettävää Sandostatin LAR ‑hoitoa on jatkettava, ellei kasvain ole edennyt.
Tyreotropiinia erittävien adenoomien hoito
Sandostatin LAR ‑hoito aloitetaan antamalla 20 mg:n annoksia 4 viikon välein 3 kuukauden ajan ennen kuin annosmuutoksia harkitaan. Tämän jälkeen annosta muutetaan tyreotropiini- ja kilpirauhashormonivasteen perusteella.
Käyttö munuaisten vajaatoimintapotilailla
Munuaisten vajaatoiminta ei vaikuttanut oktreotidin kokonaisaltistukseen (AUC) ihon alle annettavaa Sandostatin-valmistetta käytettäessä. Sandostatin LAR ‑annosta ei siis tarvitse muuttaa.
Käyttö maksan vajaatoimintapotilailla
Tutkimuksessa, jossa Sandostatin-valmistetta annettiin ihon alle ja laskimoon, todettiin, että lääkkeen eliminaatiokapasiteetti saattaa heikentyä maksakirroosipotilailla mutta ei rasvamaksapotilailla. Tietyissä tapauksissa annosmuutokset voivat olla tarpeen, jos potilaalla on maksan vajaatoiminta.
Käyttö iäkkäillä potilailla
Tutkimuksessa, jossa Sandostatin annettiin ihon alle, annosta ei tarvinnut muuttaa ≥ 65-vuotiailla tutkittavilla. Sandostatin LAR ‑annosta ei siis tarvitse muuttaa tässä potilasryhmässä.
Käyttö lapsilla
Sandostatin LAR ‑valmisteen käytöstä lapsilla on niukasti kokemusta.
Antotapa
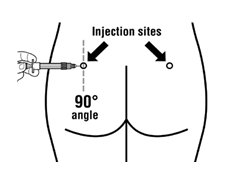
Sandostatin LAR voidaan antaa vain injektiona syvälle lihakseen. Toistuvat syvät injektiot on annettava vuorotellen vasempaan ja oikeaan pakaralihakseen (ks. kohta Käyttö- ja käsittelyohjeet).
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Yleistä
Kasvuhormonia erittävät aivolisäkekasvaimet voivat joskus laajentua ja aiheuttaa vakavia komplikaatioita (esim. näkökenttäpuutoksia). Kaikkien potilaiden vointia onkin ehdottomasti seurattava tarkoin. Jos potilaalla havaitaan näyttöä kasvaimen laajenemisesta, vaihtoehtoiset toimenpiteet voivat olla aiheellisia.
Kasvuhormonipitoisuuksien pienenemisen ja IGF-1-pitoisuuksien normalisoitumisen suotuisa terapeuttinen vaikutus voi johtaa akromegaliaa sairastavan naisen hedelmällisyyden palautumiseen. Naispotilaita, jotka voivat saada lapsia, on kehotettava käyttämään tarvittaessa riittävää ehkäisyä oktreotidihoidon aikana (ks. kohta Raskaus ja imetys).
Kilpirauhastoimintaa on seurattava pitkäaikaisen oktreotidihoidon yhteydessä.
Maksan toimintaa on seurattava oktreotidihoidon aikana.
Sydämeen ja verisuonistoon liittyvät tapahtumat
Bradykardiaa on ilmoitettu yleisesti. Esimerkiksi beetasalpaajien, kalsiumkanavan salpaajien ja neste- ja elektrolyyttitasapainoa säätelevien aineiden annosta on ehkä muutettava (ks. kohta Yhteisvaikutukset).
Sappirakko ja siihen liittyvät tapahtumat
Sappikivitauti on erittäin yleinen Sandostatin-hoitoa saavilla potilailla ja siihen saattaa liittyä sappirakkotulehdus sekä sappitiehyiden laajentuma (ks. kohta Haittavaikutukset). Markkinoille tulon jälkeen Sandostatin LAR -hoitoa saavilla potilailla on lisäksi raportoitu sappitietulehduksia sappikivitaudin komplikaationa. On suositeltavaa kaikukuvata sappirakko ennen Sandostatin LAR ‑hoitoa ja noin 6 kuukauden välein hoidon aikana.
Glukoosimetabolia
Sandostatin LAR estää kasvuhormonin, glukagonin ja insuliinin vapautumista ja voi siten vaikuttaa glukoosipitoisuuksien säätelyyn. Aterianjälkeinen glukoosinsieto voi heikentyä. Joillakin ihon alle annettavaa Sandostatin-hoitoa saaneilla potilailla on ilmoitettu, että lääkkeen pitkäaikainen käyttö voi aiheuttaa pitkittynyttä hyperglykemiaa. Myös hypoglykemiaa on ilmoitettu.
Tyypin 1 diabetespotilailla Sandostatin LAR vaikuttaa todennäköisesti glukoosipitoisuuksien säätelyyn ja insuliinin tarve saattaa vähentyä. Ei-diabeetikoilla ja tyypin 2 diabetespotilailla, joilla on osittain säilyneet insuliinireservit, Sandostatin-valmisteen anto ihon alle voi suurentaa aterianjälkeistä veren glukoosipitoisuutta. Glukoosinsiedon ja diabeteshoidon seuranta on siis suositeltavaa.
Insulinoomapotilailla oktreotidi voi syventää hypoglykemiaa ja pidentää sen kestoa. Tämä johtuu siitä, että oktreotidi estää kasvuhormonin ja glukagonin eritystä suhteessa voimakkaammin kuin insuliinieritystä ja sen insuliinieritystä estävä vaikutus on lyhytkestoisempi. Näiden potilaiden vointia on seurattava tarkoin.
Ravitsemus
Oktreotidi voi vaikuttaa joillakin potilailla ravinnon rasvojen imeytymiseen.
Joillakin oktreotidihoitoa saavilla potilailla on todettu B12-vitamiinipitoisuuksien pienenemistä ja poikkeavia tuloksia Schillingin kokeessa. B12-vitamiinipitoisuuksien seuranta Sandostatin LAR -hoidon aikana on suositeltavaa, jos potilaalla on aiemmin esiintynyt B12-vitamiinin puutosta.
Haiman toiminta
Joillakin potilailla, jotka saavat oktreotidia gastroenteropankreaattisiin neuroendokriinisiin kasvaimiin, on havaittu haiman eksokriinista vajaatoimintaa. Sen oireita voivat olla rasvaripuli, löysät ulosteet, vatsan turvotus ja painonlasku. Oireilevien potilaiden osalta tulee harkita seulontaa haiman eksokriinisen vajaatoiminnan varalta ja asianmukaista hoitoa kliinisten ohjeiden mukaisesti.
Natriumsisältö
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per injektiopullo eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Esimerkiksi beetasalpaajien, kalsiumkanavan salpaajien ja neste- ja elektrolyyttitasapainoa säätelevien aineiden annosta on ehkä muutettava, jos samanaikaisesti käytetään Sandostatin LAR ‑valmistetta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Insuliinin ja diabeteslääkkeiden annosta on ehkä muutettava, jos samanaikaisesti käytetään Sandostatin LAR ‑valmistetta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Oktreotidin on todettu vähentävän siklosporiinin imeytymistä suolesta ja hidastavan simetidiinin imeytymistä suolesta.
Oktreotidin ja bromokriptiinin samanaikainen anto suurentaa bromokriptiinin biologista hyötyosuutta.
Niukat julkaistut tiedot viittaavat siihen, että somatostatiinianalogit saattavat pienentää tunnetusti sytokromi P450 ‑entsyymivälitteisesti metaboloituvien aineiden metabolista puhdistumaa. Tämä voi johtua kasvuhormonierityksen suppressiosta. Mahdollisuutta, että oktreotidilla on tällainen vaikutus, ei voida sulkea pois. Varovaisuus on siis tarpeen, jos potilas käyttää muita lääkkeitä, jotka metaboloituvat lähinnä CYP3A4-välitteisesti ja joiden terapeuttinen leveys on pieni (esim. kinidiini, terfenadiini).
Samanaikainen radioaktiivisten somatostatiinien käyttö
Somatostatiini ja sen analogit kuten okreotidi sitoutuvat kilpailevasti somatostatiinireseptoreihin ja voivat vaikuttaa radioaktiivisten somatostatiinianalogien tehoon. Sandostatinin LAR -valmisteen antoa on vältettävä vähintään 4 viikkoa ennen radiofarmaseuttisen somatostatiinireseptoreihin sitoutuvan lutetium(177Lu)oksodotreotidin antoa. Tarpeen vaatiessa potilaita voidaan hoitaa lyhytvaikutteisilla somatostatiinianalogeilla siihen saakka, kunnes lutetium(177Lu)oksodotreotidin antoon on 24 tuntia.
Lutetium(177Lu)oksodotreotidin annon jälkeen Sandostatin LAR -hoitoa voidaan jatkaa 4–24 tunnin kuluttua. Hoito täytyy keskeyttää uudelleen 4 viikkoa ennen seuraavaa lutetium(177Lu)oksodotreotidin antoa.
Raskaus ja imetys
Raskaus
On vain vähän tietoja (alle 300 raskaudesta) oktreotidin käytöstä raskaana oleville naisille ja noin yhdessä kolmasosassa näistä raskaustapauksista lopputulos on tuntematon. Suurin osa saaduista raporteista koskee oktreotidin markkinoille tulon jälkeistä käyttöä, ja yli 50 % tiedossa olevista raskaudenaikaisista altistuksista koskee akromegaliapotilaita. Useimmissa tapauksissa oktreotidialtistus tapahtui ensimmäisen raskauskolmanneksen aikana, ja annos oli 100–1 200 mikrog/vrk Sandostatin-valmistetta ihon alle tai 10–40 mg Sandostatin LAR ‑valmistetta kuukaudessa. Synnynnäisiä kehityshäiriöitä raportoitiin noin 4 %:ssa raskauksista, joista lopputulos tiedetään. Syy-yhteyttä oktreotidiin ei ole epäilty näiden tapausten osalta.
Eläinkokeissa ei ole havaittu suoria tai epäsuoria lisääntymistoksisia vaikutuksia (ks. kohta Prekliiniset tiedot turvallisuudesta).
Varmuuden vuoksi Sandostatin LAR ‑valmisteen käyttöä on suositeltavaa välttää raskauden aikana (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Imetys
Ei tiedetä, erittyykö oktreotidi ihmisen rintamaitoon. Eläintutkimuksissa on havaittu oktreotidin erittyvän maitoon. Sandostatin LAR -hoidon aikana ei pidä imettää.
Hedelmällisyys
Ei tiedetä, vaikuttaako oktreotidi ihmisen hedelmällisyyteen. Kivesten myöhästynyttä laskeutumista havaittiin niillä urospuolisilla jälkeläisillä, joiden emoja oli lääkitty raskauden ja imetyksen aikana. Oktreotidi ei kuitenkaan heikentänyt uros- ja naarasrottien hedelmällisyyttä, kun annos oli enintään 1 mg/kg/vrk (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Sandostatin LAR ‑valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn. Potilaita on kehotettava noudattamaan varovaisuutta ajaessaan ja käyttäessään koneita, jos heillä on Sandostatin LAR ‑hoidon aikana huimausta, voimattomuutta/uupumusta tai päänsärkyä.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisimpiä oktreotidihoidon aikana ilmoitettuja haittavaikutuksia ovat ruoansulatuselimistön häiriöt, hermoston häiriöt, maksa- ja sappihäiriöt sekä aineenvaihdunta- ja ravitsemushäiriöt.
Kliinisissä oktreotiditutkimuksissa yleisimmin ilmoitettuja haittavaikutuksia olivat ripuli, vatsakipu, pahoinvointi, ilmavaivat, päänsärky, sappikivet, hyperglykemia ja ummetus. Muita yleisesti ilmoitettuja haittavaikutuksia olivat huimaus, paikallinen kipu, mikroskooppiset sappisaostumat, kilpirauhastoiminnan häiriöt (esim. tyreotropiinin, kokonaistyroksiinin ja vapaan tyroksiinin pitoisuuksien pieneneminen), ulosteiden löysyys, heikentynyt glukoosinsieto, oksentelu, voimattomuus ja hypoglykemia.
Haittavaikutustaulukko
Seuraavat taulukossa 1 lueteltavat haittavaikutukset on kerätty kliinisistä oktreotiditutkimuksista.
Haittavaikutukset (taulukko 1) on lueteltu yleisyysluokittain yleisimmistä alkaen seuraavia määritelmiä käyttäen: hyvin yleiset (≥ 1/10); yleiset (≥ 1/100, < 1/10); melko harvinaiset (≥ 1/1 000, < 1/100); harvinaiset (≥ 1/10 000, < 1/1 000); hyvin harvinaiset (< 1/10 000), mukaan lukien yksittäiset raportit. Kunkin yleisyysluokan haittavaikutukset on esitetty alenevassa järjestyksessä vakavimmasta alkaen.
Taulukko 1 Kliinisissä tutkimuksissa ilmoitetut haittavaikutukset
Ruoansulatuselimistö | |
Hyvin yleiset: | Ripuli, vatsakipu, pahoinvointi, ummetus, ilmavaivat. |
Yleiset: | Dyspepsia, oksentelu, vatsan pullotus, rasvaripuli, ulosteiden löysyys, ulosteiden värimuutokset. |
Hermosto | |
Hyvin yleiset: | Päänsärky. |
Yleiset: | Huimaus. |
Umpieritys | |
Yleiset: | Hypotyreoosi, kilpirauhastoiminnan häiriöt (esim. tyreotropiinin, kokonaistyroksiinin ja vapaan tyroksiinin pitoisuuksien pieneneminen). |
Maksa ja sappi | |
Hyvin yleiset: | Sappikivet. |
Yleiset: | Kolekystiitti, mikroskooppiset sappisaostumat, hyperbilirubinemia. |
Aineenvaihdunta ja ravitsemus | |
Hyvin yleiset: | Hyperglykemia. |
Yleiset: | Hypoglykemia, heikentynyt glukoosinsieto, ruokahaluttomuus. |
Melko harvinaiset: | Nestehukka. |
Yleisoireet ja antopaikassa todettavat haitat | |
Hyvin yleiset: | Pistoskohdan reaktiot. |
Yleiset: | Voimattomuus. |
Tutkimukset | |
Yleiset: | Suurentuneet transaminaasipitoisuudet. |
Iho ja ihonalainen kudos | |
Yleiset: | Kutina, ihottuma, hiustenlähtö. |
Hengityselimet, rintakehä ja välikarsina | |
Yleiset: | Hengenahdistus. |
Sydän | |
Yleiset: | Bradykardia. |
Melko harvinaiset: | Takykardia. |
Markkinoille tulon jälkeen
Spontaanisti ilmoitetut haittavaikutukset esitetään taulukossa 2. Haittavaikutusten ilmoittaminen on vapaaehtoista, eikä kyseisten haittojen yleisyyttä tai mahdollista syy-yhteyttä lääkealtistuksen kanssa pystytä välttämättä selvittämään luotettavasti.
Taulukko 2 Spontaaneissa ilmoituksissa mainitut haittavaikutukset
Veri ja imukudos |
Trombosytopenia. |
Immuunijärjestelmä |
Anafylaksia, allergia-/yliherkkyysreaktiot. |
Iho ja ihonalainen kudos |
Nokkosihottuma. |
Maksa ja sappi |
Akuutti haimatulehdus, akuutti maksatulehdus ilman kolestaasia, kolestaattinen hepatiitti, kolestaasi, ikterus, kolestaattinen ikterus. |
Sydän |
Rytmihäiriöt. |
Tutkimukset |
Suurentuneet alkalisen fosfataasin pitoisuudet, suurentuneet gammaglutamyylitransferaasipitoisuudet. |
Tiettyjen haittavaikutusten kuvaus
Sappirakko ja siihen liittyvät reaktiot
Somatostatiinianalogien on osoitettu estävän sappirakon supistuvuutta ja vähentävän sapen eritystä, mikä saattaa johtaa sappirakon poikkeavuuksiin tai sappilietteeseen. Sappikivien kehittymistä on ilmoitettu 15–30 %:lla potilaista, jotka ovat saaneet pitkään ihon alle annettavaa Sandostatin-hoitoa. Koko väestössä (40–60-vuotiaiden ikäryhmässä) niiden esiintyvyys on noin 5–20 %. Akromegaliaa tai gastroenteropankreaattisia kasvaimia sairastavista, pitkäaikaisesti Sandostatin LAR ‑valmisteelle altistuneista potilaista saadut tiedot viittaavat siihen, että Sandostatin LAR ei suurenna sappikiviriskiä verrattuna ihon alle annettavaan hoitoon. Jos sappikiviä esiintyy, ovat ne yleensä oireettomia. Oireiset sappikivet on hoidettava joko sappihapoilla toteutettavalla liuotushoidolla tai leikkauksella.
Ruoansulatuselimistön häiriöt
Harvinaisissa tapauksissa ruoansulatuselimistön haittavaikutukset voivat muistuttaa akuuttia suolitukosta, ja niihin voi liittyä etenevää vatsan pullotusta, vaikeaa epigastriumalueen kipua, vatsan arkuutta ja vatsanpeitteiden jännittymistä (défence).
Ruoansulatuselimistön haittatapahtumien esiintymistiheyden tiedetään pienenevän ajan mittaan, kun hoitoa jatketaan.
Yliherkkyys ja anafylaktiset reaktiot
Yliherkkyyttä ja allergisia reaktioita on raportoitu myyntiluvan myöntämisen jälkeen. Reaktiot ilmenevät yleensä ihossa, harvoin suussa ja hengitysteissä. Yksittäisiä anafylaktisia reaktioita on raportoitu.
Pistoskohdan reaktiot
Injektion antopaikassa esiintyviä reaktioita kuten kipua, punoitusta, verenvuotoa, kutinaa, turvotusta tai kovettumista on raportoitu yleisesti Sandostatin LAR -hoitoa saavilla potilailla; suurin osa tapauksista ei kuitenkaan ole vaatinut kliinistä hoitoa.
Aineenvaihdunnan ja ravitsemuksen häiriöt
Ulosteeseen erittyvä rasvamäärä voi suurentua. Toistaiseksi ei kuitenkaan ole näyttöä siitä, että pitkäaikainen oktreotidihoito olisi johtanut imeytymishäiriöstä johtuviin ravintoainepuutoksiin.
Haimaentsyymit
Hyvin harvinaisissa tapauksissa on ilmoitettu akuuttia haimatulehdusta ensimmäisten tuntien tai päivien kuluessa ihon alle annettavan Sandostatin-hoidon aloittamisesta. Se on korjautunut, kun lääkitys on lopetettu. Pitkäaikaista, ihon alle annettavaa Sandostatin-hoitoa saaneilla potilailla on ilmoitettu myös sappikivien aiheuttamaa haimatulehdusta.
Sydän
Bradykardia on somatostatiinianalogien yleinen haittavaikutus. Sekä akromegalia- että karsinoidioireyhtymäpotilailla on havaittu EKG-muutoksia, kuten QT-ajan pitenemistä, akselimuutoksia, varhaista repolarisaatiota, matalia EKG-heilahduksia, R/S-muutoksia, R-aallon varhaista korostumista ja epäspesifisiä ST-T-aaltomuutoksia. Kyseisten tapahtumien suhdetta oktreotidiasetaatin käyttöön ei ole osoitettu, sillä monilla näistä potilaista on jo ennestään sydäntauteja (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Trombosytopenia
Trombosytopeniaa on raportoitu myyntiluvan myöntämisen jälkeen erityisesti potilailla, jotka saivat Sandostatinia suonensisäisesti ja joilla oli maksakirroosi sekä potilailla, jotka saivat Sandostatin LAR-valmistetta. Trombosytopenia hävisi hoidon keskeyttämisen jälkeen.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Vahingossa tapahtuneita Sandostatin LAR ‑yliannostuksia on ilmoitettu niukasti. Sandostatin LAR ‑annos oli 100 mg – 163 mg/kk. Ainoana haittatapahtumana ilmoitettiin kuumia aaltoja.
Syöpäpotilaiden on ilmoitettu saaneen enintään 60 mg/kk Sandostatin LAR ‑annoksia ja enintään 90 mg:n annoksia 2 viikkoa kohti. Nämä annokset olivat yleensä hyvin siedettyjä, mutta seuraavia haittatapahtumia on ilmoitettu: tiheä virtsaamistarve, uupumus, masentuneisuus, ahdistuneisuus ja keskittymiskyvyn heikkeneminen.
Yliannostuksen hoito on oireenmukaista.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Somatostatiini ja sen analogit, ATC-koodi: H01CB02
Oktreotidi on luontaisen somatostatiinin synteettinen oktapeptidijohdos. Sen farmakologinen vaikutus vastaa somatostatiinia, mutta sen vaikutus kestää huomattavasti pitempään. Se estää patologisesti lisääntynyttä kasvuhormonin (GH) eritystä ja gastroenteropankreaattisen järjestelmän (GEP) erittämien peptidien ja serotoniinin patologisesti lisääntynyttä eritystä.
Eläimillä oktreotidi estää kasvuhormonin, glukagonin ja insuliinin eritystä voimakkaammin kuin somatostatiini, ja sillä on selektiivisempi kasvuhormoni- ja glukagonieritystä suppressoiva vaikutus.
Terveillä henkilöillä oktreotidin, kuten myös somatostatiinin, on osoitettu estävän
- arginiinin, fyysisen rasituksen ja insuliinin aiheuttaman hypoglykemian stimuloimaa kasvuhormonieritystä
- aterianjälkeistä insuliinin, glukagonin, gastriinin ja muiden endokriinisen GEP-järjestelmän peptidien vapautumista sekä arginiinin stimuloimaa insuliini- ja glukagonieritystä
- tyreoliberiinillä (TRH) stimuloitua tyreotropiinin vapautumista.
Toisin kuin somatostatiini, oktreotidi estää kasvuhormonieritystä tehokkaammin kuin insuliinieritystä eikä sen annon jälkeen esiinny hormonien rebound-liikaeritystä (eli akromegaliapotilailla liiallista kasvuhormonieritystä).
Akromegaliapotilailla Sandostatin LAR (oktreotidin lääkemuoto, joka voidaan antaa 4 viikon välein) tuottaa johdonmukaisen ja terapeuttisen oktreotidipitoisuuden seerumissa ja pienentää näin johdonmukaisesti kasvuhormonipitoisuutta sekä normalisoi seerumin IGF-1-pitoisuutta useimmilla potilailla. Useimmilla potilailla Sandostatin LAR vähentää huomattavasti taudin kliinisiä oireita kuten päänsärkyä, hikoilua, parestesiaa, uupumusta, luu- ja nivelkipua ja rannekanavaoireyhtymää. Kun Sandostatin LAR ‑hoitoa annettiin aiemmin hoitamattomille akromegaliapotilaille, joilla oli kasvuhormonia erittävä aivolisäkeadenooma, hoito pienensi kasvaimen tilavuutta yli 20 % merkittävällä osuudella potilaista (50 %).
Yksittäisillä potilailla, joilla oli kasvuhormonia erittävä aivolisäkeadenooma, Sandostatin LAR ‑hoidon ilmoitettiin johtaneen kasvaimen kutistumiseen (ennen leikkaushoitoa). Leikkausta ei kuitenkaan tule viivyttää.
Jos potilaalla on gastroenteropankreaattisen endokriinisen järjestelmän toiminnallinen kasvain, Sandostatin LAR ‑hoito pitää perussairauden oireet jatkuvasti hallinnassa. Oktreotidin vaikutukset gastroenteropankreaattisten kasvaimien eri tyyppeihin ovat seuraavat:
Karsinoidikasvaimet
Oktreotidin anto voi lievittää oireita, etenkin kuumia aaltoja ja ripulia. Monissa tapauksissa myös plasman serotoniinipitoisuus pienenee ja 5-hydroksi-indoli-etikkahapon erittyminen virtsaan vähenee.
VIPoomat
Näiden kasvainten biokemiallinen tunnusmerkki on vasoaktiivisen suolipeptidin (VIP) liikaeritys. Useimmissa tapauksissa oktreotidin anto vähentää taudille tyypillistä vaikeaa sekretorista ripulia, jolloin elämänlaatu paranee. Samalla tilaan liittyvät elektrolyyttihäiriöt kuten hypokalemia korjautuvat, ja enteraalinen ja parenteraalinen nestehoito ja elektrolyyttilisien anto voidaan lopettaa. Tietokonetomografiatutkimukset viittaavat siihen, että kasvaimen eteneminen voi joillakin potilailla hidastua tai pysähtyä ja kasvain saattaa jopa kutistua. Tämä koskee etenkin maksaetäpesäkkeitä. Kliinisen tilan paranemisen lisäksi plasman VIP-pitoisuus yleensä pienenee ja saattaa korjautua normaalialueelle.
Glukagonoomat
Oktreotidihoito lievittää useimmiten huomattavasti taudille tyypillistä nekrolyyttistä, migratorista ihottumaa. Oktreotidi ei vaikuta merkittävästi tautiin usein liittyvään lievään diabetekseen, eikä insuliinin eikä tablettimuotoisten diabeteslääkkeiden tarve yleensä vähene. Oktreotidi lievittää potilailla mahdollisesti esiintyvää ripulia, mikä johtaa kyseisten potilaiden painon nousuun. Oktreotidin anto pienentää usein välittömästi plasman glukagonipitoisuutta, mutta vaikutus ei yleensä säily pitkäaikaishoidon aikana, vaikka oireet vähenevät jatkuvasti.
Gastrinoomat / Zollinger–Ellisonin oireyhtymä
Hoito protonipumpun estäjillä tai H2-reseptorisalpaajilla pitää yleensä mahahapon liikaerityksen hallinnassa. Protonipumpun estäjät tai H2-reseptorisalpaajat eivät kuitenkaan välttämättä lievitä riittävästi ripulia, joka on myös merkittävä oire. Sandostatin LAR voi pienentää edelleen mahahapon liikaeritystä ja lievittää oireita, mm. ripulia, sillä se pienentää joillakin potilailla suurentuneita gastriinipitoisuuksia.
Insulinoomat
Oktreotidin anto pienentää immunoreaktiivisen insuliinin pitoisuutta verenkierrossa. Potilailla, joiden kasvaimia voidaan leikata, oktreotidi saattaa auttaa palauttamaan normoglykemian ja ylläpitämään sitä ennen leikkausta. Jos potilaalla on hyvän- tai pahanlaatuisia kasvaimia, joita ei voida leikata, glukoositasapaino saattaa parantua, vaikka verenkierron insuliinipitoisuus ei samalla pienenekään pitkäaikaisesti.
Pitkälle edenneet neuroendokriiniset kasvaimet, jos kasvain on saanut alkunsa keskisuolesta tai sen primaarisijainti on tuntematon mutta keskisuolen ulkopuolinen primaarisijainti on suljettu pois
Vaiheen III satunnaistettu, kaksoissokkoutettu, lumekontrolloitu tutkimus (PROMID) osoitti Sandostatin LAR ‑hoidon estävän kasvainten kasvua potilailla, joilla oli edenneitä keskisuolen neuroendokriinisiä kasvaimia.
Kyseisessä tutkimuksessa 85 potilasta satunnaistettiin saamaan joko 30 mg Sandostatin LAR ‑valmistetta 4 viikon välein (n = 42) tai lumelääkettä (n = 43) yhteensä 18 kuukauden ajan tai kunnes kasvain eteni tai potilas kuoli.
Tärkeimmät sisäänottokriteerit olivat seuraavat: ei aiempaa hoitoa; histologisesti varmistettu kasvain; paikallisesti leikkauskelvoton kasvain tai metastasoitunut ja hyvin erilaistunut kasvain; toiminnallisesti aktiivinen tai inaktiivinen neuroendokriininen kasvain/karsinooma; primaarikasvain keskisuolessa tai primaarikasvain tuntemattomassa paikassa mutta oletettavasti keskisuolen alueella, kun primaarisijainti haimassa, rintakehällä tai muualla elimistössä oli suljettu pois.
Ensisijainen päätetapahtuma oli aika kasvaimen etenemiseen tai kasvaimeen liittyvään kuolemaan (TTP).
Hoitoaikomusanalyysipopulaatiossa (ITT, kaikki satunnaistetut potilaat) tauti eteni tai potilas kuoli kasvaimeen liittyvistä syistä 26 tapauksessa Sandostatin LAR ‑ryhmässä ja 41 tapauksessa lumeryhmässä (riskisuhde [HR] 0,32; 95 %:n luottamusväli [lv] 0,19–0,55; p-arvo 0,000015).
Konservatiivisessa ITT-analyysipopulaatiossa (cITT), josta 3 potilasta poistettiin satunnaistamisen yhteydessä, tauti eteni tai potilas kuoli kasvaimeen liittyvistä syistä 26 tapauksessa Sandostatin LAR ‑ryhmässä ja 40 tapauksessa lumeryhmässä (HR 0,34; 95 %:n lv 0,20–0,59; p-arvo 0,000072; kuva 1). Mediaaniaika kasvaimen etenemiseen oli Sandostatin LAR ‑ryhmässä 14,3 kk (95 %:n lv 11,0–28,8 kk) ja lumeryhmässä 6,0 kk (95 %:n lv 3,7–9,4 kk).
Tutkimussuunnitelman mukaisessa analyysipopulaatiossa (PP), josta poistettiin muitakin potilaita tutkimushoidon päättymisajankohtana, tauti eteni tai potilas kuoli kasvaimeen liittyvistä syistä 19 tapauksessa Sandostatin LAR ‑ryhmässä ja 38 tapauksessa lumeryhmässä (HR 0,24; 95 %:n lv 0,13–0,45; p-arvo 0,0000036).
Kuva 1 TTP:n Kaplan–Meier-estimaatit Sandostatin LAR- ja lumeryhmissä (konservatiivinen ITT-populaatio)
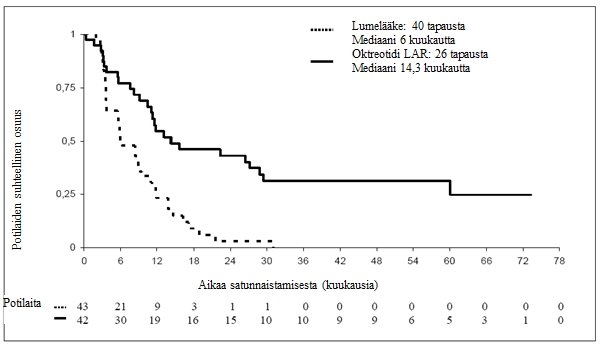
Toiminnallisen aktiivisuuden mukaan stratifioitu log-rank-testi: p=0.000072, HR= 0.34 [95%:n lv 0.20-0.59]
Taulukko 3 TTP-tulokset eri analyysipopulaatioissa
TTP-tapahtumia | TTP-ajan mediaani, kk [95 %:n lv] | HR [95 %:n lv] p-arvo* | |||
Sandostatin LAR | Lume | Sandostatin LAR | Lume | ||
ITT | 26 | 41 | Ei ilm. | Ei ilm. | 0,32 [95 %:n lv 0,19–0,55] p =0,000015 |
cITT | 26 | 40 | 14,3 [95 %:n lv 11,0–28,8] | 6,0 [95 %:n lv 3,7–9,4] | 0,34 [95 %:n lv 0,20–0,59] p =0,000072 |
PP | 19 | 38 | Ei ilm. | Ei ilm. | 0.24 [95 %:n lv 0,13–0,45] p =0,0000036 |
Ei ilm. = ei ilmoitettu; HR = riskitiheyksien suhde; TTP = aika kasvaimen etenemiseen; ITT = hoitoaikomuspopulaatio; cITT = konservatiivinen hoitoaikomuspopulaatio; PP = tutkimussuunnitelman mukainen populaatio * Toiminnallisen aktiivisuuden mukaan stratifioitu log-rank-testi | |||||
Hoitovaikutus oli samaa luokkaa riippumatta siitä, oliko potilaan kasvain toiminnallisesti aktiivinen (HR 0,23; 95 %:n lv 0,09–0,57) vai inaktiivinen (HR 0,25; 95 %:n lv 0,10–0,59).
6 hoitokuukauden jälkeen taudin eteneminen oli pysähtynyt 67 %:lla Sandostatin LAR ‑ryhmän potilaista ja 37 %:lla lumeryhmään kuuluneista.
Kun tämän etukäteen suunnitellun välianalyysin yhteydessä todettiin, että Sandostatin LAR ‑hoidosta oli merkittävää kliinistä hyötyä, niin tutkimuspotilaiden rekrytointi lopetettiin.
Tässä tutkimuksessa Sandostatin LAR ‑hoidon turvallisuus vastasi valmisteen tunnettua turvallisuusprofiilia.
Tyreotropiinia erittävien aivolisäkeadenoomien hoito
Sandostatin LAR ‑hoidon (yksi injektio lihakseen 4 viikon välein) on todettu pienentävän suurentuneita kilpirauhashormonipitoisuuksia, normalisoivan tyreotropiinipitoisuuksia ja lievittävän hypertyreoosin kliinisiä oireita ja löydöksiä potilailla, joilla on tyreotropiinia erittävä adenooma. Sandostatin LAR ‑hoidon hoitovaikutus saavutti tilastollisen merkitsevyyden lähtötilanteeseen nähden 28 päivän jälkeen, ja hoidon hyödyt jatkuivat enintään 6 kuukauteen asti.
Farmakokinetiikka
Lihakseen annetun Sandostatin LAR ‑kertainjektion jälkeen seerumin oktreotidipitoisuus saavuttaa lyhytkestoisen alkuhuipun 1 tunnin kuluessa valmisteen annosta. Tämän jälkeen oktreotidipitoisuus pienenee etenevästi ja laskee ei-havaittavalle tasolle 24 tunnin kuluessa. Tämän päivän 1 alkuhuipun jälkeen oktreotidipitoisuus pysyy useimmilla potilailla hoitotason alapuolella seuraavien 7 päivän ajan. Tämän jälkeen oktreotidipitoisuus suurenee jälleen, saavuttaa vakaan tilan noin päivänä 14 ja pysyy suhteellisen vakiona seuraavien 3–4 viikon ajan. Päivänä 1 saavutettava huippupitoisuus on pienempi kuin vakaan tilan vaiheen pitoisuudet, ja päivänä 1 vapautuu enintään 0,5 % koko vapautuvasta lääkemäärästä. Noin päivän 42 jälkeen oktreotidipitoisuus pienenee hitaasti valmisteen polymeerimatriisin lopullisen hajoamisvaiheen myötä.
Akromegaliapotilailla oktreotidin vakaan tilan pitoisuudet ovat 10 mg:n, 20 mg:n ja 30 mg:n Sandostatin LAR ‑kerta-annosten jälkeen 358 ng/l, 926 ng/l ja 1 710 ng/l. Kun Sandostatin LAR ‑injektioita annetaan 3 kertaa 4 viikon välein, näin saavutettava seerumin vakaan tilan oktreotidipitoisuus on noin 1,6–1,8 kertaa suurempi eli 1 557 ng/l toistuvien 20 mg:n injektioiden jälkeen ja 2 384 ng/l toistuvien 30 mg:n injektioiden jälkeen.
Kun potilaille, joilla oli karsinoidikasvaimia, annettiin toistuvia 10 mg:n, 20 mg:n tai 30 mg:n Sandostatin LAR ‑injektioita 4 viikon välein, seerumin vakaan tilan oktreotidipitoisuuksien keskiarvo (ja mediaani) suureni lineaarisesti suhteessa annokseen ja oli 10 mg:n annoksia käytettäessä 1 231 (894) ng/l, 20 mg:n annoksia käytettäessä 2 620 (2 270) ng/l ja 30 mg:n annoksia käytettäessä 3 928 (3 010) ng/l.
Kun Sandostatin LAR ‑injektioita annettiin kerran kuukaudessa enintään 28 antokerran ajan, oktreotidin ei todettu kumuloituvan enempää kuin mitä on odotettavissa vapautumisprofiilien päällekkäisyyden vuoksi.
Oktreotidin farmakokineettinen profiili Sandostatin LAR ‑injektion jälkeen kuvastaa sen vapautumisprofiilia polymeerimatriisista ja sen biologista hajoamista. Systeemiseen verenkiertoon vapautuva oktreotidi jakautuu tunnetun farmakokinetiikkansa mukaisesti ja ihon alle annettujen injektioiden jälkeen kuvattuun tapaan. Oktreotidin vakaan tilan jakautumistilavuus on 0,27 l/kg ja kokonaispuhdistuma 160 ml/min. 65 % lääkeaineesta sitoutuu plasman proteiineihin. Lääke ei sitoudu käytännössä lainkaan verisoluihin.
Kun hypotalaamisista syistä lihavilta 7–17-vuotiailta pediatrisilta potilailta, jotka saivat Sandostatin LAR 40 mg ‑injektion kerran kuukaudessa, otettiin rajoitetussa määrin verinäytteitä, farmakokinetiikan tiedot osoittivat, että plasmasta mitattujen oktreotidin jäännöspitoisuuksien keskiarvo oli 1 395 ng/l ensimmäisen injektion jälkeen ja 2 973 ng/l vakaassa tilassa. Pitoisuudet vaihtelivat suuresti eri potilailla.
Oktreotidin jäännöspitoisuudet vakaassa tilassa eivät korreloineet iän eivätkä painoindeksin kanssa, mutta ne korreloivat kohtalaisesti painon (52,3–133 kg) kanssa. Mies- ja naispotilailla mitatuissa pitoisuuksissa oli merkitsevä ero, sillä pitoisuudet olivat naisilla noin 17 % suuremmat.
Prekliiniset tiedot turvallisuudesta
Akuuttia ja toistuvan altistuksen aiheuttamaa toksisuutta, geenitoksisuutta, karsinogeenisuutta sekä lisääntymistoksisuutta koskevien eläintutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Eläimillä tehdyissä lisääntymistutkimuksissa ei saatu näyttöä teratogeenisuudesta, alkio-/sikiötoksisuudesta eikä muista lisääntymiseen kohdistuvista vaikutuksista, kun P-sukupolvelle annettiin enintään 1 mg/kg/vrk oktreotidiannoksia. Rotanpoikasten fysiologisen kasvun todettiin hidastuvan jossain määrin. Tämä oli ohimenevää ja liittyi todennäköisesti liiallisen farmakodynaamisen vaikutuksen aiheuttamaan kasvuhormonierityksen estoon (ks. kohta Raskaus ja imetys).
Nuorilla rotilla ei tehty spesifisiä tutkimuksia. Pre- ja postnataalista kehitystä koskevissa tutkimuksissa havaittiin kasvun ja kypsymisen heikentymistä F1-sukupolven poikasilla, joiden emoille oli annettu oktreotidia koko tiineys- ja imetyskauden ajan. F1-sukupolven urospoikasilla havaittiin kivesten myöhästynyttä laskeutumista, mutta niiden hedelmällisyys säilyi normaalina. Siten yllä mainitut löydökset olivat ohimeneviä, ja niiden arveltiin johtuvan kasvuhormonierityksen estosta.
Farmaseuttiset tiedot
Apuaineet
Kuiva-aine (injektiopullossa):
Poly(DL-laktidi-ko-glykolidi)
Mannitoli (E421)
Liuotin (esitäytetyssä ruiskussa):
Karmelloosinatrium
Mannitoli (E421)
Poloksameeri 188
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopimattomuustutkimuksia ei ole tehty, lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
3 vuotta.
Valmistetta ei saa säilyttää käyttökuntoon saattamisen jälkeen (käytettävä heti).
Säilytys
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Säilytä jääkaapissa (2 °C - 8 °C). Ei saa jäätyä.
Sandostatin LAR -valmistetta voidaan säilyttää alle 25 °C:n lämpötilassa injektiopäivänä. Käyttökuntoon saatetun lääkevalmisteen säilytys, katso kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
SANDOSTATIN LAR injektiokuiva-aine ja liuotin, suspensiota varten
10 mg (L:ei) 10 mg (turvaneula) (435,23 €)
20 mg (L:ei) 20 mg (turvaneula) (624,78 €)
30 mg (L:ei) 30 mg (turvaneula) (779,47 €)
PF-selosteen tieto
Yksikköpakkaus sisältää yhden lasisen, bromobutyylikumitulpallisen 6 ml:n injektiopullon, joka on sinetöity alumiinisella repäisysinetillä ja joka sisältää injektiokuiva-aineen suspensiota varten, sekä yhden värittömän, esitäytetyn, lasisen 3 ml:n ruiskun, joka sisältää 2 ml liuotinta ja on suljettu kahdella klorobutyylikumitulpalla (toinen ruiskun etuosassa ja toinen männän yhteydessä). Injektiopullon ja esitäytetyn ruiskun lisäksi pakkaus sisältää yhden injektiopulloadapterin sekä yhden turvainjektioneulan. Kaikki komponentit on pakattu sinetöityyn läpipainopakkaukseen.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kuiva-aine: valkoinen tai lähes valkoinen jauhe.
Liuotin: kirkas, väritön tai hieman kellertävä/ruskehtava neste.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Ohjeet Sandostatin LARin käyttökuntoon saattamista ja lihakseen pistämistä varten
AINOASTAAN SYVÄLLE LIHAKSEEN PISTETTÄVÄKSI
Pakkauksen sisältö:
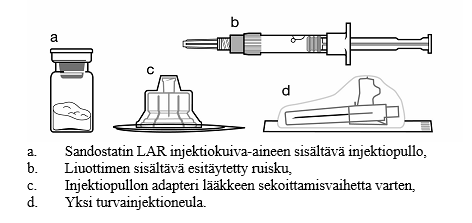
Noudata huolellisesti alla annettuja ohjeita varmistaaksesi Sandostatin LAR-valmisteen käyttökuntoon saattamisen oikealla tavalla ennen injektion antoa syvälle lihakseen.
Sandostatin LARin käyttökuntoon saattamisessa on kolme ratkaisevaa vaihetta. Niiden noudattamatta jättäminen voi johtaa lääkkeen annon epäonnistumiseen.
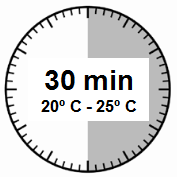
- Pakkauksen tulee lämmetä huoneenlämpöiseksi. Ota pakkaus jääkaapista ja anna sen olla huoneenlämmössä vähintään 30 minuuttia ennen käyttökuntoon saattamista, mutta älä ylitä 24 tuntia.
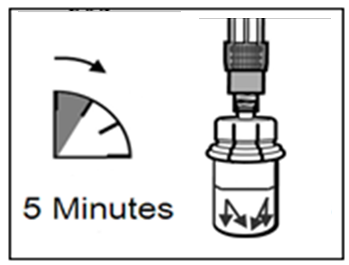
- Anna injektiopullon seistä 5 minuuttia liuottimen lisäämisen jälkeen varmistaaksesi, että kuiva-aine on kunnolla kostunut.
- Kostuttamisen jälkeen, ravista injektiopulloa maltillisesti vaakasuunnassa vähintään 30 sekuntia kunnes muodostuu tasainen suspensio. Sandostatin LAR -suspensio on valmistettava vasta juuri ennen käyttöä.
Sandostatin LAR -injektion saa antaa vain koulutettu terveydenhuollon ammattilainen.
Vaihe 1
HUOM: On tärkeää, että aloitat käyttökuntoon Huomaa, että pakkaus voidaan tarvittaessa laittaa takaisin |
|
Vaihe 2
| 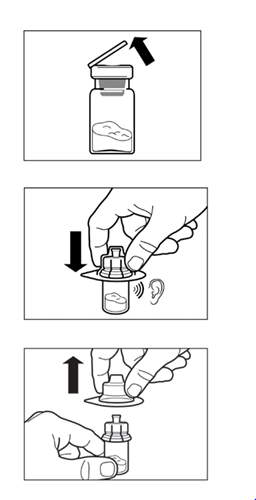 |
Vaihe 3
| 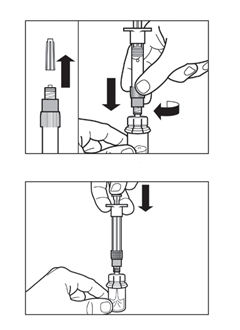 |
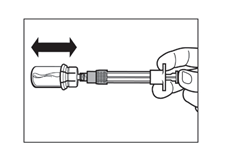
Vaihe 4 HUOM: On tärkeää, että annat injektiopullon seistä Huomaa, että on täysin normaalia, jos ruiskun mäntä lähtee
|
|
Vaihe 5
|  |
Vaihe 6
| 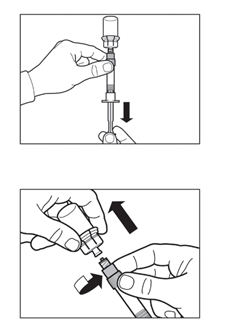 |
Vaihe 7
| 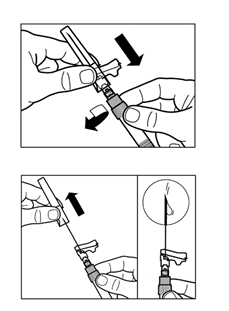 |
Vaihe 8
|  |
Vaihe 9
| 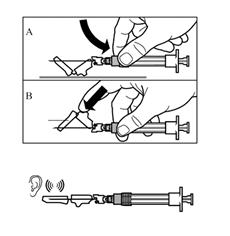 |
Korvattavuus
SANDOSTATIN LAR injektiokuiva-aine ja liuotin, suspensiota varten
10 mg 10 mg
20 mg 20 mg
30 mg 30 mg
- Ylempi erityiskorvaus (100 %). Pahanlaatuiset kasvaimet, joita ei ole edellä erikseen mainittu (130).
- Peruskorvaus (40 %).
ATC-koodi
H01CB02
Valmisteyhteenvedon muuttamispäivämäärä
16.06.2025
Yhteystiedot
 NOVARTIS FINLAND OY
NOVARTIS FINLAND OY Revontulenkuja 1
02100 Espoo
010 613 3200
www.novartis.fi
Lääkeinformaatiopalvelu 010 6133 210,
medinfo.nordics@novartis.com