PROCREN DEPOT PDS injektiokuiva-aine ja liuotin suspensiota varten, esitäytetty ruisku 3,75 mg, 11,25 mg, 30 mg
Vaikuttavat aineet ja niiden määrät
Leuproreliiniasetaatti 3,75 mg, 11,25 mg tai 30 mg
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektiokuiva-aine ja liuotin, suspensiota varten, esitäytetty ruisku.
Kliiniset tiedot
Käyttöaiheet
Miehet 3,75 mg, 11,25 mg ja 30 mg: Pitkälle edennyt eturauhassyöpä, kun orkiektomia ei ole indikoitu.
Naiset 3,75 mg ja 11,25 mg: Vaikean endometrioosin hoito. Rintasyövän hoito pre- ja perimenopausaalisilla naisilla, joilla hormonihoito on indikoitu. 3,75 mg: Kohdun myoomien pienentäminen (leiomyomata uteri).
Lapset 3,75 mg ja 11,25 mg: Ennenaikaisen keskushermostoperäisen puberteetin hoito (alle 9-vuotiaat tytöt, alle 10-vuotiaat pojat)
Annostus ja antotapa
Annostus
Eturauhassyöpä: Suositeltava annos on kerta-annos 3,75 mg subkutaanisesti 4 viikon välein, 11,25 mg 12 viikon välein tai 30 mg 6 kuukauden välein. Hoitoa ei pidä keskeyttää remission tai hoitovasteen paranemisen myötä.
Potilailla, joiden eturauhassyöpää hoidetaan GnRH-analogeilla, hoitoa jatketaan yleensä kastraatioresistentin eturauhassyövän kehittyessä ja viitaten asianmukaisiin ohjeistuksiin.
Endometrioosi: Suositeltava annos on kerta-annos 3,75 mg subkutaanisesti joka neljäs viikko tai 11,25 mg 12 viikon välein korkeintaan kuuden (6) kuukauden ajan.
Täydentävän hormonihoidon (5 mg noretisteroniasetaattia päivässä) lisäämisen Procren Depot PDS -valmisteella toteutettuun endometrioosin hoitoon on osoitettu vähentävän luukatoa ja vasomotorisia oireita. Jos täydentävää hormonihoitoa käytetään Procren Depot PDS -valmisteen kanssa, tulee kunkin hoidon hyödyt ja riskit erikseen huomioida. Tätä yhdistelmähoitoa voidaan jatkaa korkeintaan kuuden (6) kuukauden ajan.
Kohdun myoomat: Suositeltava annos on kerta-annos 3,75 mg subkutaanisesti joka neljäs viikko korkeintaan kolmen (3) kuukauden ajan.
Rintasyöpä: Suositeltava annos on kerta-annos 3,75 mg 4 viikon välein tai 11,25 mg 12 viikon välein.
Pediatriset potilaat
Lasten leuproreliiniasetaattihoidon on tapahduttava kokonaisuudessaan lastenendokrinologin valvonnassa.
Annostus on sovitettava yksilöllisesti.
Suositeltava aloitusannos riippuu painosta.
Lapset, jotka painavat ≥ 20 kg 1 ml (3,75 mg leuproreliiniasetaattia) suspensiota, joka sisältää 44,1 mg lääkeainetta hitaasti vapauttavia mikrokapseleita 1 ml:ssa vehikkeliliuosta, annetaan kerran kuukaudessa kertainjektiona ihon alle. 1 ml (11,25 mg leuproreliiniasetaattia) suspensiota, joka sisältää 130,0 mg lääkeainetta hitaasti vapauttavia mikrokapseleita 1 ml:ssa vehikkeliliuosta, annetaan 3 kuukauden välein kertainjektiona ihon alle.
Alle 20 kg painavat lapset
Näissä harvinaisissa tapauksissa käytetään seuraavaa annostusta ennenaikaisen keskushermostoperäisen puberteetin kliinisen aktiivisuuden mukaisesti:
0,5 ml (1,88 mg leuproreliiniasetaattia) annetaan kerran kuukaudessa kertainjektiona ihon alle tai
0,5 ml (5,625 mg leuproreliiniasetaattia) annetaan 3 kuukauden välein kertainjektiona ihon alle
Yli jäänyt suspensio on hävitettävä. Lapsen painonnousua tulee seurata.
Ennenaikaisen keskushermostoperäisen puberteetin kliinisestä aktiivisuudesta riippuen annoksen suurentaminen voi olla tarpeen, jos estovaikutus on riittämätön (kliininen näyttö esim. tiputteluvuoto tai riittämätön gonadotropiinin erityksen esto LHRH-kokeessa). Pienin tehokas kerran kuukaudessa tai 3 kuukauden välein annettava annos on tässä tapauksessa määritettävä LHRH-kokeella.
Injektiokohtaan kehittyi usein steriilejä absesseja, kun leuproreliiniasetaattia annettiin lihakseen suositeltua suurempina annoksina. Tästä syystä lääkevalmiste on annettava tällaisissa tapauksissa ihon alle (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Lapsille on suositeltavaa käyttää mahdollisimman pieniä injektiotilavuuksia lihakseen/ihon alle annosteltaessa injektioihin liittyvän epämukavuuden vähentämiseksi.
Hoidon kesto riippuu kliinisistä parametreista hoidon alussa tai hoidon aikana (lopullinen pituusennuste, kasvunopeus, luustoikä ja/tai luustoiän edistymisen nopeutuminen). Hoidon keston päättää hoitava lastenlääkäri yhdessä huoltajan ja, jos mahdollista, hoidettavan lapsen kanssa. Luustoikää tulee seurata hoidon aikana 6-12 kuukauden välein. Jos tytön luustoikä on yli 12 vuotta tai pojan yli 13 vuotta, hoidon lopettamista on harkittava kliiniset parametrit huomioon ottaen.
Tytöillä raskauden mahdollisuus tulee poissulkea ennen hoidon aloitusta. Hoidonaikaista raskautta ei voida yleisesti ottaen sulkea pois. Näissä tapauksissa on otettava yhteys lääkäriin.
Huom.
Procren Depot PDS 3,75 mg -valmistetta käytettäessä antovälin on oltava 30 ± 2 päivää ennenaikaisen puberteetin oireiden uusiutumisen ehkäisemiseksi.
Procren Depot PDS 11,25 mg -valmistetta käytettäessä antovälin on oltava 90 ± 2 päivää ennenaikaisen puberteetin oireiden uusiutumisen ehkäisemiseksi.
Antotapa
Ainoastaan asiaan perehtyneiden terveydenhuollon ammattilaisten tulee valmistella, saattaa käyttövalmiiksi ja antaa Procren Depot PDS -valmiste.
Vasta-aiheet
Yliherkkyys leuproreliiniasetaatille tai vastaaville nonapeptideille tai kohdassa Apuaineet mainituille apuaineille (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Leuproreliiniasetaatti on vasta-aiheinen naisille, jotka ovat raskaana tai voivat tulla raskaaksi hoidon aikana (ks. kohdat Raskaus ja imetys ja Prekliiniset tiedot turvallisuudesta).
Leuproreliioniasetaattia ei tule antaa naisille, joilla on diagnosoimaton emättimen verenvuoto.
Tytöillä, joilla on ennenaikainen keskushermostoperäinen puberteetti:
- Raskaus ja imetys
- Diagnosoimaton verenvuoto emättimestä
Varoitukset ja käyttöön liittyvät varotoimet
Kaikki potilasryhmät
Yksittäisiä anafylaksiatapauksia on raportoitu kuukausittain annosteltavaa leuproreliiniasetaattivalmistetta käytettäessä. Tästä syystä potilaiden tilaa on syytä tarkkailla injektion annon jälkeen mahdollisten yliherkkyysreaktioiden varalta. Jos anafylaktinen tai muu vakava allerginen reaktio ilmenee, tulee Procren Depot PDS ‑valmisteen käyttö keskeyttää välittömästi ja aloittaa asianmukainen hoito (ks. kohdat Vasta-aiheet ja Haittavaikutukset).
Hoidon alkuvaiheessa gonadotropiinien ja sukupuolisteroidien pitoisuudet kasvavat lähtötilanteen pitoisuuksia suuremmiksi, mikä johtuu lääkkeen luonnollisesta stimuloivasta vaikutuksesta. Tämän vuoksi voidaan havaita kliinisten löydösten ja oireiden lisääntymistä (ks. kohta Farmakodynamiikka). Oireiden paheneminen voi myötävaikuttaa halvauksen syntymiseen; siihen voi mahdollisesti liittyä kuolemaan johtavia komplikaatioita (ks. myös kohta Haittavaikutukset).
Potilailla, joita hoidetaan GnRH-agonisteilla, kuten leuproreliinilla, on olemassa suurentunut riski sairastua masennukseen (joka voi olla vakava). Potilaille pitää kertoa riskistä ja heidän tulee saada asianmukaista hoitoa, jos oireita ilmenee.
Luun mineraalitiheys
Luun mineraalitiheydessä voi esiintyä muutoksia minkä tahansa hypoestrogeenisen tilan aikana naisilla, ja kun valmistetta käytetään pitkään eturauhassyövän hoitoon miehillä. Ei ole tietoja siitä, palautuuko tilanne miehillä leuproreliiniasetaatin käytön lopettamisen jälkeen. Naisilla luun mineraalitiheyden pieneneminen voi olla palautuvaa leuproreliiniasetaatin käytön lopettamisen jälkeen.
Kouristukset
Markkinoilletulon jälkeen on raportoitu, että GnRH-agonistien (mukaan lukien leuproreliiniasetaatti) käytön yhteydessä on esiintynyt kouristuksia. Niitä on esiintynyt naisilla ja lapsilla sekä potilailla, joilla on ollut anamneesissa kouristuskohtauksia, epilepsia, aivoverenkierron häiriöitä, keskushermoston poikkeavuuksia tai kasvaimia, sekä potilailla, jotka ovat käyttäneet samanaikaisesti jotakin kouristuksille altistavaa lääkettä kuten bupropionia tai SSRI-lääkkeitä. Kouristuksia on raportoitu myös potilailla, joilla ei ole ollut mitään edellä luetelluista tekijöistä.
Idiopaattinen kallonsisäisen paineen kohoaminen
Leuproreliinia saavilla potilailla on ilmoitettu idiopaattista kallonsisäisen paineen kohoamista (pseudotumor cerebri). Potilaita on varoitettava idiopaattisen kallonsisäisen paineen kohoamisen oireista ja löydöksistä, mukaan lukien vaikea tai toistuva päänsärky, näköhäiriöt ja tinnitus. Jos potilaalla ilmenee idiopaattista kallonsisäisen paineen kohoamista, leuproreliinihoidon lopettamista on harkittava.
Vaikeat ihoon kohdistuvat haittavaikutukset
Leuproreliinihoidon yhteydessä on raportoitu vaikeita ihoon kohdistuvia haittavaikutuksia (SCAR), mukaan lukien Stevens-Johnsonin oireyhtymä (SJS) ja toksinen epidermaalinen nekrolyysi (TEN), jotka voivat olla hengenvaarallisia tai johtaa kuolemaan. Lääkkeen määräämisen yhteydessä potilaille on kerrottava näistä oireista, ja heitä on seurattava tarkasti vaikeiden ihoreaktioiden varalta. Jos tällaisiin reaktioihin viittaavia oireita ilmenee, leuproreliini on lopetettava välittömästi ja on harkittava muuta hoitovaihtoehtoa (tarpeen mukaan).
Miehet
”Flare-reaktio”
Ensimmäisen hoitoviikon aikana leuproreliiniasetaatti, kuten muutkin LHRH-agonistit, nostaa seerumin testosteronitasoja noin 50 % lähtötasosta. Ohimenevää oireiden pahenemista tai oireiden lisääntymistä voi ilmetä toisinaan hoidon ensimmäisinä viikkoina, mikä voidaan estää antamalla samanaikaisesti antiandrogeenia. Pieni määrä potilaita voi kokea luustokipujen väliaikaista lisääntymistä, jota voidaan hoitaa oireenmukaisesti. Kuten muillakin LHRH-analogeilla leuproreliiniasetaatilla on raportoitu yksittäisiä virtsatieobstruktiotapauksia sekä yksittäisiä selkäydinkanavan kompressioita, jotka ovat voineet johtaa paralyysiin. Tämän vuoksi potilaita, joilla on virtsatieobstruktio, sekä potilaita, joilla on etäpesäkkeitä selkärangassa, on seurattava tarkasti ensimmäisinä hoitoviikkoina.
Metaboliset muutokset
Androgeenideprivaatiohoidon, mukaan lukien GnRH-agonistien, käyttöön voi liittyä metabolisten muutosten, kuten hyperglykemian, diabeteksen, hyperlipidemian ja rasvamaksan, suurentunut riski. Hyperglykemia voi johtua diabeteksen puhkeamisesta tai diabeetikoilla hoitotasapainon huononemisesta. Suurentuneessa riskissä olevia potilaita on seurattavia metabolisen syndrooman merkkien ja oireiden varalta, mukaan lukien lipidiarvojen, verensokerin ja/tai HbA1c-arvojen seuranta, ja hoidettava ajantasaisten kliinisten käytäntöjen mukaisesti (ks. kohta Haittavaikutukset).
Kardiovaskulaariset sairaudet
Miehillä on ilmoitettu GnRH-agonistien käytön yhteydessä sydäninfarktin, sydänperäisen äkkikuoleman ja aivohalvauksen riskin suurenemista. Raportoitujen ristitulosuhteiden perusteella riski on ilmeisesti pieni, ja se ja sydän- ja verisuonitautien riskitekijät tulisi arvioida huolellisesti eturauhassyövän hoitoa valittaessa. GnRH-agonisteja saavia potilaita tulee seurata sydän- ja verisuonitautien puhkeamiseen viittaavien oireiden ja löydösten varalta. Hoidossa noudatetaan ajantasaisia kliinisiä käytäntöjä.
Androgeenideprivaatiohoito voi pidentää QT-aikaa
Potilailla, joilla on todettu QT-ajan pidentyminen tai sen riskitekijöitä, sekä potilailla, jotka saavat samanaikaisesti QT-aikaa mahdollisesti pidentäviä lääkkeitä (katso kohta Yhteisvaikutukset), lääkärien pitäisi arvioida hyöty-haittasuhde ottaen huomioon kääntyvien kärkien takykardian mahdollisuus ennen kuin Procren Depot PDS -hoito aloitetaan.
Laboratoriokokeet
Vastetta leuproreliiniasetaatille tulee seurata mittaamalla seerumin testosteronipitoisuuksia sekä prostataspesifistä antigeenia. Suurimmalla osalla potilaista testosteronipitoisuudet suurenivat lähtötilanteen pitoisuuksia suuremmiksi ensimmäisen viikon aikana ja pienenivät sen jälkeen lähtötilanteen pitoisuuksiin tai niitä pienemmiksi toisen hoitoviikon loppuun mennessä. Pitoisuudet pienenivät kastraattitasolle 2–4 viikon kuluessa, ja kun tämä pitoisuus oli saavutettu, se säilyi niin kauan kuin potilaat ottivat pistoksia aikataulun mukaisesti.
Tilapäistä hapanfosfataasientsyymiarvojen kohoamista voi esiintyä joillakin potilailla hoidon alkuvaiheessa, mutta yleensä arvot palautuvat normaaleiksi tai lähes normaaleiksi kuukauden kuluessa hoidon aloituksesta.
Kuuden kuukauden hoitojakson loppuvaiheessa olisi hyvä mitata testosteronitaso niiltä potilailta, joita ei aikaisemmin ole hoidettu LHRH- analogeilla.
Naiset
Procren Depot PDS nostaa hoidon alussa ohimenevästi estradiolipitoisuuksia muiden LHRH-analogien tapaan. Tähän saattaa liittyä joillakin potilailla oireita, jotka yleensä häviävät hoidon jatkuessa. Submukoosin leiomyoma uterin yhteydessä on raportoitu tapauksia, joissa voimakas vaginaalinen vuoto on tyrehtyäkseen vaatinut kirurgisen hoidon tai lääkehoidon.
Matalan estrogeenitason vuoksi luun tiheydessä voi tapahtua muutoksia, jotka voivat palautua leuproreliinihoidon lopettamisen jälkeen. Hoidettaessa endometrioosia Procren Depot PDS -valmisteella yksin tai yhdessä täydentävän hormonihoidon kanssa, tulee hoitojakson pituus rajoittaa kuuteen (6) kuukauteen. Koska leuproreliini voi edistää luukatoa, endometrioosin hoito tulisi uusia ainoastaan huolellisen harkinnan jälkeen.
Lapset
Idiopaattinen ja/tai neurogeeninen keskushermostoperäinen ennenaikainen puberteetti on diagnosoitava tarkasti ennen hoidon aloittamista.
Kyseessä on pitkäaikaishoito, joka sovitetaan yksilöllisesti. Procren Depot PDS 3,75 mg -valmistetta annetaan mahdollisimman tarkasti ja säännöllisesti kuukauden välein ja Procren Depot PDS 11,25 mg -valmistetta annetaan mahdollisimman tarkasti ja säännöllisesti 3 kuukauden välein. Injektiopäivän siirtyminen poikkeustapauksissa muutamalla päivällä (Procren Depot PDS 3,75 mg: 30 ± 2 päivää tai Procren Depot PDS 11,25 mg: 90 ± 2) ei vaikuta hoidon tuloksiin.
Jos injektiokohtaan kehittyy steriilejä absesseja (ilmoitetaan useimmiten lihakseen annettujen, suositusannostusta suurempien injektioiden jälkeen), leuproreliiniasetaatin imeytyminen depotvalmisteesta voi vähentyä. Tässä tapauksessa hormoniarvoja (testosteroni, estradioli) on seurattava 2 viikon välein (ks. kohta Annostus ja antotapa).
Jos lapsella on etenevä aivokasvain, hoito on aloitettava vasta huolellisen potilaskohtaisen riski-hyötyarvioinnin jälkeen.
Ensimmäisen injektion jälkeen tytöillä saattaa esiintyä verenvuotoa emättimestä, tiputteluvuotoa ja eritevuotoa, jotka ovat merkki hormonaalisen vaikutuksen loppumisesta. Jos verenvuotoa emättimestä esiintyy ensimmäisen/toisen hoitokuukauden jälkeen, syy on tutkittava.
Keskushermostoperäisen ennenaikaisen murrosiän hoitoon käytettävät GnRH-agonistit voivat aiheuttaa luuntiheyden pienenemistä. Hoidon loputtua luumassan kertyminen kuitenkin jatkuu, eikä hoito näytä vaikuttavan myöhäisnuoruusiän huippuluumassaan.
Reisiluun epifyysin siirtymää voi esiintyä GnRH-hoidon lopettamisen jälkeen. Syyksi on ehdotettu sitä, että GnRH-agonistihoidon aikaiset matalat estrogeenipitoisuudet heikentävät epifyysilevyä. Kasvunopeuden lisääntyminen hoidon lopettamisen jälkeen vähentää vääntövoimaa, jota tarvitaan epifyysin siirtymään.
Jos lääkettä ei käytetä hoito-ohjelman mukaisesti tai jos käytetään liian pieniä annoksia, murrosiän kehitysprosessi ei ehkä pysy riittävästi hallinnassa. Tällöin seurauksena ovat mm. murrosiän merkkien, kuten kuukautisten, rintojen kehittymisen ja kivesten kasvun, palaaminen. Riittämättömän sukupuolisteroidien erityksen säätelyn pitkäkestoisia seurauksia ei tunneta, mutta niitä voivat olla mm. aikuiskokoon kasvamisen vaarantuminen.
Laboratoriokokeet
Luuston iän mittaus kehityksen selvittämiseksi tulee tehdä 6–12 kuukauden välein.
Sukupuolisteroidien pitoisuudet saattavat suurentua tai kohota esipuberteetin pitoisuuksia suuremmiksi, jos annos ei ole riittävän suuri. Kun hoitoannos on varmistettu, gonadotropiinin ja sukupuolisteroidien pitoisuudet pienenevät esipuberteetin tasolle.
Yhteisvaikutukset
Yhteisvaikutustutkimuksia ei ole tehty. Koska leuproreliiniasetaatti on peptidi, hajoaa pääasiassa peptidaasin vaikutuksesta ja sitoutuu noin 46-prosenttisesti plasman proteiineihin, yhteisvaikutuksia muiden lääkeaineiden kanssa ei odoteta ilmenevän.
Eturauhassyöpä
Koska androgeenideprivaatiohoito voi pidentää QT-aikaa, Procren Depot PDS -valmisteen samanaikaista käyttöä lääkkeiden kanssa, jotka pidentävät QT-aikaa tai voivat aiheuttaa kääntyvien kärkien takykardiaa, kuten luokan IA (esim. kinidiini, disopyramidi) tai luokan III (esim. amiodaroni, sotaloli, dofetilidi, ibutilidi) rytmihäiriölääkkeet, metadoni, moksifloksasiini, antipsykootit, jne., pitäisi tarkoin arvioida (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet, Miehet, Androgeenideprivaatiohoito voi pidentää QT aikaa).
Naisilla leuproreliiniasetaatin depotmuodon antaminen aiheuttaa suppression aivolisäkkeessä. Toiminta palautuu ennalleen kolmen kuukauden kuluessa hoidon lopettamisen jälkeen. Tämän vuoksi aivolisäkkeen gonadotropinieritystä mittaavien testien tulokset ja hormonipitoisuudet voivat olla harhaanjohtavia vielä kolme kuukautta leuproreliiniasetaatin lopettamisen jälkeen.
Raskaus ja imetys
Raskaus
Procren Depot PDS -valmistetta ei tule käyttää raskauden tai imetyksen aikana (ks. kohta Vasta-aiheet).
Leuproreliiniasetaatin käytön turvallisuutta raskauden aikana ei ole osoitettu kliinisesti. Ennen leuproreliiniasetaattihoidon aloittamista raskauden mahdollisuus tulee sulkea pois. Leuproreliiniasetaatti ei ole ehkäisyvalmiste. Jos raskauden ehkäisyä tarvitaan, tulee käyttää ei-hormonaalista ehkäisymenetelmää.
Hedelmällisyys
Leuproreliiniasetaatilla ja muilla vastaavilla analogeilla tehdyissä tutkimuksissa on osoitettu fertiliteetin palautuvan normaaliksi lääkityksen loputtua jopa 24 kuukautta jatkuneen annostelun jälkeen.
Pediatriset potilaat:
Ks. kohta Vasta-aiheet.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Vaikutusta ajokykyyn tai koneiden käyttökykyyn ei ole havaittu.
Haittavaikutukset
Yleinen (≥1/100, <1/10)
Melko harvinainen (≥1/1000, <1/100)
Harvinainen (≥1/10000, <1/1000)
Hyvin harvinainen (< 1/10 000)
Yleisyys tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
| Yhteenveto lääkkeeseen liittyvistä haittavaikutuksista naisilla | ||
| Elinjärjestelmä | Esiintymistiheys | Haittavaikutus |
| Infektiot | Yleinen | Vaginiitti |
| Psyykkiset häiriöt | Yleinen | Depressio Alentunut libido |
| Sukuelimet ja rinnat | Yleinen | Rintojen kipu Rintojen arkuus Rintojen pienentyminen Vaginan kuivuminen |
| Harvinainen | Yhdyntäkipu | |
| Yleisoireet ja antopaikassa todettavat haitat | Harvinainen | Ärtyneisyys |
Vakavia tromboembolisia laskimo- ja valtimotapahtumia, mm. syviä laskimotrombooseja, keuhkoemboliaa, sydäninfarkteja, aivohalvauksia ja ohimeneviä aivoverenkiertohäiriöitä (TIA), on ilmoitettu. Joissakin tapauksissa tapahtuman ja hoidon välillä ilmoitettiin olleen ajallinen yhteys. Useimpien tapauksien arviointia vaikeuttavat kuitenkin sekoittavat riskitekijät tai muiden lääkkeiden samanaikainen käyttö. On epäselvää, onko GnRH-agonistien ja näiden tapahtumien välillä syy-yhteyttä.
Markkinoinnin jälkeisessä seurannassa on naisilla todettu vakava maksavaurio. Tämän esiintyvyydestä ei ole tietoa.
| Yhteenveto lääkkeeseen liittyvistä haittavaikutuksista miehillä | ||
| Elinjärjestelmä | Esiintymistiheys | Haittavaikutus |
| Psyykkiset häiriöt | Harvinainen | Alentunut libido |
| Maksa ja sappi | Tuntematon | Rasvamaksa |
| Sukuelimet ja rinnat | Yleinen | Kivesatrofia Erektiohäiriö |
| Harvinainen | Gynekomastia | |
| Tutkimukset | Tuntematon | QT-ajan pidentyminen (katso kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset) |
Markkinoinnin jälkeisessä seurannassa on miehillä todettu vakava maksavaurio. Tämän esiintyvyydestä ei ole tietoa.
| Yhteenveto lääkkeeseen liittyvistä haittavaikutuksista lapsilla | ||
| Elinjärjestelmä | Esiintymistiheys | Haittavaikutus |
| Immuunijärjestelmä | Hyvin harvinainen | Laajat allergiset reaktiot (kuume, ihottuma, esim. kutina, anafylaktiset reaktiot) |
| Psyykkiset häiriöt | Yleinen | Tunteiden ailahtelu |
| Hermosto | Yleinen | Päänsärky* |
| Ruoansulatuselimistö | Yleinen | Vatsakipu/vatsakrampit Pahoinvointi/oksentelu |
| Iho ja ihonalainen kudos | Yleinen | Akne |
| Sukupuolielimet ja rinnat | Yleinen | Verenvuoto emättimestä** Tiputteluvuoto Eritevuoto |
| Yleisoireet ja antopaikassa todetut haitat | Yleinen | Pistoskohdan reaktiot |
*Kuten muitakin tämän ryhmän lääkevalmisteita käytettäessä, pituitaarista apopleksiaa on ilmoitettu hyvin harvinaisina tapauksina aivolisäkkeen adenoomapotilailla ensimmäisen lääkkeenantokerran jälkeen.
**Huom. Yleisesti ottaen hoidon jatkuessa esiintyvää tiputteluvuotoa (jota on saattanut edeltää tyhjennysvuoto ensimmäisen hoitokuukauden aikana) on arvioitava mahdollisen aliannostuksen merkkinä. Tässä tapauksessa aivolisäkkeen suppressio on määritettävä LHRH-kokeella.
Hoidon aloitusvaiheessa sukupuolihormonipitoisuudet suurenevat lyhytaikaisesti, minkä jälkeen pitoisuudet pienenevät prepubertaaliselle tasolle. Tämän farmakologisen vaikutuksen takia haittatapahtumia saattaa esiintyä etenkin hoidon alussa.
Psykiatriset tapahtumat
GnRH-agonisteja käyttävillä potilailla on raportoitu psykiatrisia tapahtumia. Tämän lääkeaineryhmän markkinoilletulon jälkeen on raportoitu mielialan ailahteluun liittyviä oireita kuten itkemistä, ärtyvyyttä, kärsimättömyyttä, kiukkuisuutta sekä aggressiivisuutta. Varmaa syy-seuraussuhdetta GnRH-agonistihoidon sekä edellä mainittujen tapahtumien esiintyvyyden välillä ei ole voitu osoittaa. Psykiatristen oireiden kehitystä tai pahenemista leuproreliiniasetaattihoidon aikana tulee seurata.
| Yhteenveto lääkkeeseen liittyvistä haittavaikutuksista - Yleinen | ||
| Elinjärjestelmä | Esiintymistiheys | Haittavaikutus |
| Veren ja imukudos | Harvinainen | Leukopenia Tromposytopenia Anemia Verisolujen runsaus |
| Immuunijärjestelmä | Harvinainen | Anafylaktinen reaktio |
| Aineenvaihdunta ja ravitsemus | Harvinainen | Diabetes mellitus Hyperkalemia Anoreksia Syömishäiriö |
| Psyykkiset häiriöt | Yleinen | Mielialan vaihtelut, masennus (pitkäaikainen käyttö) |
| Melko harvinainen | Mielialan vaihtelut, masennus (lyhytaikainen käyttö)* | |
| Harvinainen | Unettomuus | |
| Hermosto | Yleinen | Päänsärky Huimaus |
| Harvinainen | Parestesia Muistin heikkeneminen Kouristukset | |
| Tuntematon | Idiopaattinen kallonsisäisen paineen kohoaminen (pseudotumor cerebri; ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) | |
| Silmät | Harvinainen | Näköhäiriöt |
| Kuulo ja tasapainoelin | Harvinainen | Kuulohäiriö Tinnitus |
| Sydän | Harvinainen | Angina pectoris Takykardia Rytmihäiriöt |
| Verisuonisto | Yleinen | Kuumat aallot |
| Harvinainen | Iskemia Hypertensio | |
| Hengityselimet, rintakehä ja välikarsina | Yleinen | Hengenahdistus |
| Harvinainen | Pneumonia | |
| Ei tiedossa | Interstitiaalinen keuhkosairaus | |
| Ruoansulatuselimistö | Yleinen | Oksentelu Pahoinvointi |
| Harvinainen | Ripuli Ummetus Stomatiitti Suun kuivuminen | |
| Maksa ja sappi | Harvinainen | Ikterus |
| Ihon ja ihonalainen kudos | Yleinen | Ihottuma Akne Voimakas hikoilu |
| Harvinainen | Dermatiitti Kutina Hirsutismi Alopesia Kynsien häiriöt | |
| Tuntematon | Stevens-Johnsonin oireyhtymä / toksinen epidermaalinen nekrolyysi (SJS/TEN) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Toksinen ihottuma Erythema multiforme Suurirakkulainen ihotulehdus Kesivä ihotulehdus | |
| Luusto, lihakset ja sidekudos | Yleinen | Myalgia Artropatia |
| Harvinainen | Muskuloskeletaarinen kipu Selkäkipu Luukipu Nivelkipu Lihasjäykkyys | |
| Munuaiset ja virtsatiet | Harvinainen | Verivirtsaisuus Tiheävirtsaisuus Virtsaamishäiriöt |
| Yleisoireet ja antopaikassa todettavat haitat | Yleinen | Kipu Turvotus Voimattomuus Väsymys Pistoskohdan kipu, hematooma, tulehdus, steriili abskessi, kovettuma ja pistoskohdan reaktio |
| Harvinainen | Paineen tunnetta rinnassa Kuume Vilunväreet Jano | |
| Tuntematon | Injektiokohdan nekroosi | |
| Tutkimukset | Harvinainen | EKG:n muutokset Maksan toimintakokeiden poikkeavuudet Suurentuneet transaminaasipitoisuudet Veren alkalisen fosfataasin (AFOS) nousu Suurentunut veren bilirubiinipitoisuus Suurentunut veren ureapitoisuus Suurentunut veren virtsahappopitoisuus Veren triglyseridien nousu Painonvaihtelu |
*: Esiintymistiheys voi olla suurempi tietyillä valmisteilla perustuen valmiste- ja indikaatiokohtaisiin kliinisiin tutkimuksiin.
Potilailla, joilla on aivolisäkeadenooma, on raportoitu erittäin harvoissa tapauksissa aivolisäkeinfarkteja ensimmäisen lääkeannostelun yhteydessä samoin kuin muiden tähän ryhmään kuuluvien lääkeaineiden yhteydessä.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraaville tahoille:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 Fimea
Yliannostus
Rotilla subkutaanisesti annetut noin 133 kertaa ihmisille suositeltua annosta suuremmat annokset suhteutettuna painoon aiheuttivat dyspneaa, vireystilan laskua ja paikallista ärsytystä injetiokohdassa. Tällä hetkellä ei ole todisteita siitä, että tämä pitäisi paikkansa myös ihmisten suhteen. Varhaisissa kliinisissä tutkimuksissa enimmillään kahden vuoden ajan päivittäin annetulla suurella subkutaanisella – jopa 20 mg/vrk – annoksella ei ollut poikkeavaa haittavaikutusprofiilia verrattuna 1 mg/vrk annokseen.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Endokrinologiset lääkeaineet, gonadotropiinia vapauttavan hormonin kaltaiset yhdisteet, ATC-koodi: L02A E02
Procren Depot PDS sisältää leuproreliiniasetaattia, joka on synteettinen nonapeptidi, luonnollisen gonadotropiineja vapauttavan hormonin, LHRH:n superanalogi. Leuproreliinin aktiivisuus on noin 70-kertainen luonnolliseen LHRH-hormoniin verrattuna. LHRH-analogit lisäävät aluksi FSH:n ja LH:n eritystä johtaen miehillä testosteroni- ja dihydrotestosteronitasojen nousuun ja vastaavasti premenopausaalisilla naisilla estroni- ja estradiolitasojen nousuun. Noin 2 viikon kuluttua eritys estyy, minkä seurauksena estrogeeni- ja testosteronituotanto heikkenee. Koska monet eturauhaskasvaimet ovat androgeeniriippuvaisia, tämä hoito yleensä estää kasvaimen kasvua ja aiheuttaa sukupuolielinten atrofiaa. Tämän seurauksena siittiöiden muodostus vähenee, mutta palautuu hoidon lopettamisen jälkeen.
Naisilla hyvälaatuisten gynekologisten tautien, endometrioosin ja kohdun myoomien, kasvu on estrogeenista riippuvaa ja estrogeenin tuotannon väheneminen johtaa tautimuutosten pienenemiseen ja oireiden vähenemiseen. Hoito johtaa kuukautisvuotojen poisjäämiseen useimmilla potilailla hoidon keston ajaksi.
Kliinisissä tutkimuksissa on havaittu metastasoivaa kastraatioresistenttiä eturauhassyöpää sairastavien potilaiden hyötyvän aineiden, kuten androgeenisen hormonivaikutuksen estäjien abirateroniasetaatin ja entsalutamidin, taksaanien dosetakselin ja kabatsitakselin sekä radiolääkkeen Ra-223:n yhdistämisestä GnRH-agonisteihin kuten leuproreliiniin.
Lapset
Palautuva (reversiibeli) aivolisäkkeen gonadotropiinierityksen esto, minkä seurauksena estradioli- (E2) tai testosteronipitoisuus pienenee puberteettia edeltävälle tasolle.
Alkuvaiheessa sukupuolirauhasstimulaatio (pitoisuuksien lyhytaikainen suureneminen) saattaa aiheuttaa verenvuotoa emättimestä, jos tytön kuukautiset ovat alkaneet jo ennen hoidon alkua. Tyhjennysvuoto saattaa tulla hoidon alussa. Vuoto loppuu yleensä hoidon jatkuessa.
Seuraavat hoitovaikutukset voidaan osoittaa:
- Basaalisten ja stimuloitujen gonadotropiinipitoisuuksien suppressio puberteettia edeltävälle tasolle
- Ennenaikaisesti suurentuneiden sukupuolihormonipitoisuuksien suppressio puberteettia edeltävälle tasolle ja ennenaikaisten kuukautisten keskeytyminen
- Somaattisen pubertaalisen kehityksen pysähtyminen/involuutio (Tannerin luokituksen vaiheet)
- Kronologisen iän ja luustoiän välisen suhteen paraneminen/normalisoituminen
- Luustoiän progressiivisen edistymisen nopeutumisen ehkäisy
- Kasvunopeuden hidastuminen ja normalisoituminen
- Lopullisen pituuden suureneminen.
Hoito saa aikaan patologisesti, ennenaikaisesti aktivoituneen hypotalamus-aivolisäke-sukurauhasakselin suppression, joka on prepubertaalisen iän mukainen.
Kun kliinisessä pitkäaikaistutkimuksessa lapsille annettiin enintään 15 mg leuproreliiniannoksia kuukausittain > 4 vuoden ajan, pubertaalinen eteneminen jatkui hoidon päätyttyä. Kun 20:tä naispuolista tutkittavaa seurattiin aikuisuuteen asti, 80 %:lla kuukautiskierto oli normaali ja 20 tutkittavasta 7:llä todettiin 12 raskautta, mukaan lukien monikkoraskaudet 4 tutkittavalla.
Farmakokinetiikka
Leuproreliiniasetaatin biologinen hyötyosuus on subkutaanisen annostelun jälkeen verrannollinen intramuskulaariseen annosteluun. Absoluuttinen hyötyosuus 7,5 mg annoksen jälkeen on arvioitu olevan 90 %.
Eturauhassyöpäpotilailla plasman leuproreliiniasetaattipitoisuudet olivat yhden kuukauden kuluttua 3,75 mg ja 7,5 mg subkutaanisista ja intramuskulaarisista kerta-annoksista 0,7 ng/ml ja 1,0 ng/ml. Lääkkeen kumuloitumisesta ei ollut viitteitä. Kastroiduilla miehillä tehdyssä tutkimuksessa depot-muodon (7,5 mg) intramuskulaarisen injektion jälkeen plasman leuproreliinipitoisuus pysyi yli kuukauden ajan.
Seerumin leuproreliiniasetaattipitoisuudet mitattiin 12 viikon aikana 3,75 mg annoksen jälkeen 11 premenopausaalisella rintasyöpäpotilaalla. Neljän viikon jälkeen pitoisuus oli yli 0,1 ng/ml ja se pysyi stabiilina uusintainjektion jälkeen 8 ja 12 viikon kohdalla. Lääkkeen kumuloitumisesta ei ollut viitteitä.
Leuproreliinin jakautumistilavuus suonensisäisen bolusinjektion jälkeen oli miespuolisilla terveillä vapaaehtoisilla 27 l vakaassa tilassa. In vitro sitoutuminen plasman proteiineihin vaihteli 43 %:sta 49 %iin.
Miespuolisilla terveillä vapaaehtoisilla tehdyssä tutkimuksessa suonensisäisesti annetun 1 mg bolusannoksen jälkeen puhdistuma oli 7,6 l/h ja terminaalinen puoliintumisaika oli noin kolme tuntia kaksitilamallissa.
Eläinkokeissa on osoitettu leuproreliiniasetaatin metaboloituvan pieniksi inaktiiveiksi peptideiksi – yhdeksi pentapeptidiksi (metaboliitti I), kahdeksi tripeptidiksi (metaboliitit II ja III) sekä yhdeksi dipeptidiksi (metaboliitti IV) – jotka metaboloituvat edelleen.
Suurimman metaboliitin (metaboliitti I) plasmapitoisuudet saavuttivat korkeimman pitoisuuden (noin 6 % alkuperäisen lääkkeen huippupitoisuuksista) kahdesta kuuteen tuntiin annoksen jälkeen mitattuna viideltä eturauhassyöpää sairastavalta potilaalta leuproreliiniasetaatin depotmuoden antamisen jälkeen. Viikon kuluttua annostelusta metaboliitti I:n pitoisuudet olivat noin 20 % leuproreliinin keskipitoisuuksista.
Kolmelle potilaalle annetusta 3,75 mg leuproreliiniasetaattiannoksesta vähemmän kuin 5 % erittyi 27 vuorokauden aikana virtsaan leuproreliiniasetaattina ja metaboliitti I:nä. Leuproreliiniasetaatin farmakokinetiikkaa ei ole tutkittu maksan tai munuaisten vajaatoimintaa sairastavilla potilailla.
Lapset
Kuvassa 1 on esitetty seerumin leuproreliinipitoisuudet ihon alle annetun kerta-annoksen jälkeen (depotmuotoinen leuproreliiniasetaatti, annostus 30 mikrog/kg). Seerumin huippupitoisuudet saavutetaan 60 minuutin kuluttua annosta (7,81 ± 3,59 ng/ml). AUC0-672-arvo on 105,78 ± 52,40 ng • h/ml.
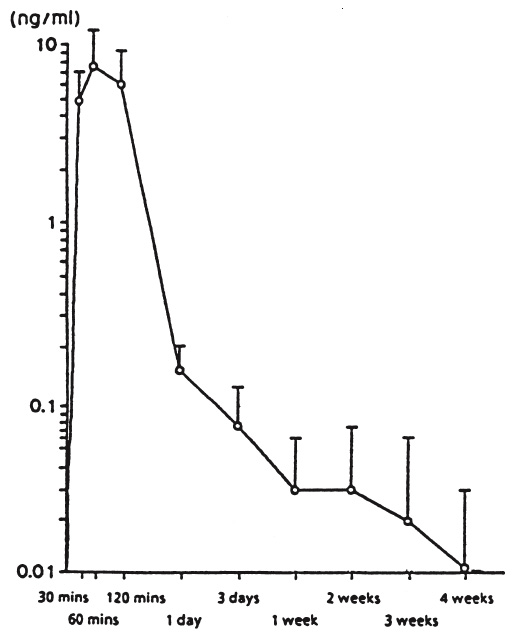
Kuva 1: Seerumin leuproreliinipitoisuudet ihon alle annetun depotmuotoisen leuproreliiniasetaatin kerta-annoksen jälkeen annostuksella 30 mikrog/kg (n = 6) (keskiarvo ± keskihajonta)
Kuvassa 2 on esitetty seerumin leuproreliinipitoisuudet lapsilla ensimmäisten 6 hoitokuukauden aikana, kun depotmuotoista leuproreliiniasetaattia annettiin ihon alle 3 kuukauden välein (2 injektiota).
Ensimmäisen injektion jälkeen seerumin leuproreliinipitoisuudet suurenevat ja seerumin maksimipitoisuudet saavutetaan kuukauden 4 kohdalla (294,79 ± 105,42 pg/ml). Pitoisuudet pienenevät lievästi kuukauteen 6 asti (229,02 ± 103,33 pg/ml).
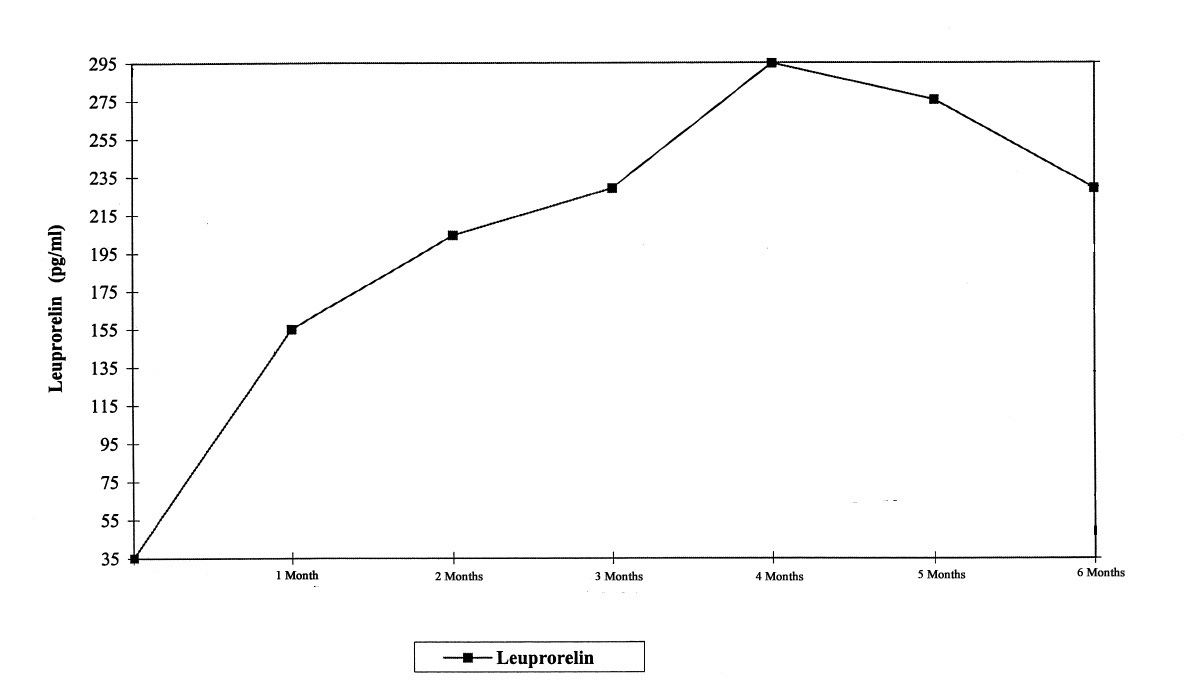
Kuva 2: Seerumin leuproreliinipitoisuudet ensimmäisten 6 hoitokuukauden aikana, kun depotmuotoista leuproreliiniasetaattia annettiin 3 kuukauden välein (kaksi injektiota ihon alle, n = 42–43)
Prekliiniset tiedot turvallisuudesta
Kaneilla tehdyssä tutkimuksessa raskauden kuudentena päivänä annettu kerran kuukaudessa annosteltava leuproreliiniasetaatti kerta-annoksena 0,00024, 0,0024 ja 0,024 mg/kg (1/300 – 1/3 osa korkeimmasta ihmisille käytetystä annoksesta) lisäsi annosriippuvaisesti merkittävimpiä sikiön kehityshäiriöitä. Vastaavissa tutkimuksissa rotilla ei voitu osoittaa sikiöiden epämuodostumien lisääntymistä. Sikiökuolleisuus lisääntyi ja sikiön paino pieneni, kun kahta suurempaa annosta annettiin kaneille ja kun suurinta annosta annettiin rotille. Vaikutukset sikiökuolleisuuteen ovat loogisia seurauksia lääkkeen aiheuttamasta hormonitasojen muutoksista. Tämän vuoksi sikiön kehityshäiriöt ja spontaani abortti ovat mahdollisia, mikäli lääkettä käytetään raskauden aikana.
Leuproreliini voi heikentää molempien sukupuolten hedelmällisyyttä. Leuproreliiniasetaatin anto uros- ja naarasrotille 0,024, 0,24 ja 2,4 mg/kg annoksina kuukausittain 3 kk ajan (vain 1/300 ihmisen arvioidusta kuukausiannoksesta) aiheutti sukuelinten atrofiaa ja lisääntymistoimintojen lamautumista.
Farmaseuttiset tiedot
Apuaineet
3,75 mg:
Injektiokuiva-aine: Poly(maitohappo-glykolihappo) sekapolymeeri, mannitoli ja liivate.
Liuotin: Karmelloosinatrium, mannitoli, polysorbaatti 80, etikkahappo, väkevä (pH:n säätöön) ja injektionesteisiin käytettävä vesi.
11,25 mg ja 30 mg:
Injektiokuiva-aine: Polymaitohappo ja mannitoli.
Liuotin: Karmelloosinatrium, mannitoli, polysorbaatti 80, etikkahappo, väkevä (pH:n säätöön) ja injektionesteisiin käytettävä vesi.
Yhteensopimattomuudet
Koska yhteensopimattomuustiedot tästä valmisteesta puuttuvat valmistetta ei tule sekoittaa toisiin aineisiin.
Kestoaika
3,75 mg: 3 vuotta. Käyttövalmis suspensio on käyttökelpoinen 24 tuntia.
11,25 mg: 3 vuotta. Käyttövalmis suspensio on käyttökelpoinen 12 tuntia.
30 mg: 3 vuotta. Käyttövalmis suspensio on käyttökelpoinen 24 tuntia.
Säilytys
Säilytä alle 25 °C. Älä säilytä kylmässä. Ei saa jäätyä.
Säilytä alkuperäispakkauksessa.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
PROCREN DEPOT PDS injektiokuiva-aine ja liuotin suspensiota varten, esitäytetty ruisku
3,75 mg (L:ei) 3,75 mg (136,43 €)
11,25 mg (L:ei) 11,25 mg (346,32 €)
30 mg (L:ei) 30 mg (576,32 €)
PF-selosteen tieto
Pakkaus sisältää:
1 kpl 2-kammioruisku (lasi, Ph. Eur tyyppi I) 3,75 mg 25-G:n neulalla ja 11,25 mg ja 30 mg 23-G:n neulalla (ruostumatonta terästä).
Tulppa on silikonoitua klooributyylikumia, mäntä on propyleenia. Männän kärki on varustettu vettä absorboivalla etyleenivinyyliasetaatti tai polyvinyylialkoholi tiivisteellä. 1 puhdistuslappu.
Valmisteen kuvaus:
Valmisteen kuvaus: valkoinen jauhe, liuotin: kirkas, väritön neste.
Käyttö- ja käsittelyohjeet
Procren Depot PDS käsittää yhden 2-kammioruiskun neulalla. Toinen kammio sisältää joko 3,75 mg, 11,25 mg tai 30 mg leuproliiniasetaattia jauheena ja toisessa kammiossa on 1 ml liuotinainetta. Injektioneste valmistetaan pitämällä ruiskua pystyasennossa. Kuiva-aineen ja liuoksen sekoitus tulee suorittaa rauhallisesti, jotta lääke liukenee tasaisesti liuokseen. Ruiskun kyljessä on liuottamista helpottava kohouma. Valmis lääke suositellaan pistettäväksi heti. Pakkauksessa käyttöohje.
Korvattavuus
PROCREN DEPOT PDS injektiokuiva-aine ja liuotin suspensiota varten, esitäytetty ruisku
30 mg 30 mg
- Ylempi erityiskorvaus (100 %). Eturauhassyöpä (116).
- Peruskorvaus (40 %).
PROCREN DEPOT PDS injektiokuiva-aine ja liuotin suspensiota varten, esitäytetty ruisku
3,75 mg 3,75 mg
11,25 mg 11,25 mg
- Ylempi erityiskorvaus (100 %). Rintasyöpä (115), Eturauhassyöpä (116).
- Peruskorvaus (40 %).
ATC-koodi
L02AE02
Valmisteyhteenvedon muuttamispäivämäärä
17.02.2025
Yhteystiedot
 ABBVIE OY
ABBVIE OY Veturitie 11 T 132
00520 Helsinki
010 2411 200
www.abbvie.fi
