VOTUBIA dispergoituva tabletti 2 mg, 3 mg
Vaikuttavat aineet ja niiden määrät
Votubia 1 mg dispergoituva tabletti
Yksi dispergoituva tabletti sisältää 1 mg everolimuusia.
Apuaine, jonka vaikutus tunnetaan
Yksi dispergoituva tabletti sisältää 0,98 mg laktoosia.
Votubia 2 mg dispergoituva tabletti
Yksi dispergoituva tabletti sisältää 2 mg everolimuusia.
Apuaine, jonka vaikutus tunnetaan
Yksi dispergoituva tabletti sisältää 1,96 mg laktoosia.
Votubia 3 mg dispergoituva tabletti
Yksi dispergoituva tabletti sisältää 3 mg everolimuusia.
Apuaine, jonka vaikutus tunnetaan
Yksi dispergoituva tabletti sisältää 2,94 mg laktoosia.
Votubia 5 mg dispergoituva tabletti
Yksi dispergoituva tabletti sisältää 5 mg everolimuusia.
Apuaine, jonka vaikutus tunnetaan
Yksi dispergoituva tabletti sisältää 4,90 mg laktoosia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Dispergoituva tabletti.
Kliiniset tiedot
Käyttöaiheet
Tuberoosiskleroosiin (TSC) liittyvät vaikeahoitoiset epilepsiakohtaukset
Votubia on tarkoitettu lisälääkehoidoksi vähintään 2‑vuotiaille potilaille, joilla on TSC:hen liittyviä vaikeahoitoisia paikallisalkuisia ja mahdollisesti toissijaisesti yleistyviä epilepsiakohtauksia.
TSC:hen liittyvä subependymaalinen jättisoluinen astrosytooma (SEGA)
Votubia on tarkoitettu TSC:hen liittyvän SEGA:n hoitoon aikuisille ja lapsille, jotka tarvitsevat terapeuttista toimenpidettä, mutta eivät ole soveltuvia leikkaukseen.
Näyttö perustuu analyyseissa havaittuihin muutoksiin SEGA:n tilavuudessa. Muuta kliinistä hyötyä, kuten tautiin liittyvien oireiden paranemista, ei ole osoitettu.
Ehto
Hoidon aloittavalla lääkärillä tulee olla kokemusta tuberoosiskleroosin (TSC) hoidon toteuttamisesta ja lääkeainepitoisuuksien seurannasta.
Annostus ja antotapa
Votubia‑hoidon aloittavalla lääkärillä tulee olla kokemusta tuberoosiskleroosin hoidon toteuttamisesta ja lääkeainepitoisuuksien seurannasta.
Annostus
Annoksen huolellinen titraus saattaa olla tarpeen parhaan mahdollisen tehon saavuttamiseksi. Siedetyt ja tehokkaat annokset vaihtelevat potilaasta toiseen. Samanaikaisesti käytetty epilepsialääkitys saattaa vaikuttaa everolimuusin metaboliaan ja voi osaltaan vaikuttaa tähän vaihteluun (ks. kohta Yhteisvaikutukset).
Annostus määritetään yksilöllisesti kehon pinta‑alan mukaan käyttämällä Dubois‑kaavaa, jossa paino (W) on kilogrammoina ja pituus (H) senttimetreinä:
Kehon pinta‑ala = (W0,425 x H0,725) x 0,007184
Aloitusannos ja minimipitoisuustavoitteet TSC:hen liittyvän SEGA:n hoidossa
Votubian suositeltu aloitusannos SEGA‑potilaiden hoitoon on 4,5 mg/m2. Farmakokineettisiin simulaatioihin perustuen 1–alle 3‑vuotiaille potilaille suositellaan suurempaa aloitusannosta, joka on 7 mg/m2 (ks. kohta Farmakokinetiikka). Dispergoituvien Votubia‑tablettien eri vahvuuksia voidaan yhdistää halutun annoksen saamiseksi.
SEGA:ta sairastavien lasten annossuositukset vastaavat aikuisten annossuosituksia, lukuun ottamatta 1–alle 3‑vuotiaita potilaita ja potilaita, joilla on maksan vajaatoiminta (ks. kohta ”Maksan vajaatoiminta” alla ja kohta Farmakokinetiikka).
Aloitusannos ja minimipitoisuustavoitteet TSC:hen liittyvien vaikeahoitoisten epilepsiakohtausten hoidossa
Epilepsiakohtauksia saavien potilaiden hoitoon suositeltava Votubia‑aloitusannos esitetään taulukossa 1. Dispergoituvien Votubia‑tablettien eri vahvuuksia voidaan yhdistellä halutun annoksen saavuttamiseksi.
Taulukko 1 Votubian aloitusannos TSC‑potilaille, joilla on vaikeahoitoisia epilepsiakohtauksia
Ikä | Aloitusannos, jos potilas ei käytä samanaikaisesti CYP3A4:n/P‑gp:n induktoria | Aloitusannos, jos potilas käyttää samanaikaisesti CYP3A4:n/P‑gp:n induktoria |
< 6 v | 6 mg/m2 | 9 mg/m2 |
≥ 6 v | 5 mg/m2 | 8 mg/m2 |
Annossuositukset pediatrisille potilaille, joilla on epilepsiakohtauksia, vastaavat aikuisten potilaiden annossuosituksia; poikkeuksena ovat 2–alle 6‑vuotiaat potilaat (ks. edellä Taulukko 1) ja maksan vajaatoimintapotilaat (ks. kohta ”Maksan vajaatoiminta” alla ja kohdassa Farmakokinetiikka).
Annoksen seuranta
Everolimuusin minimipitoisuudet kokoveressä on määritettävä ainakin viikon kuluttua hoidon aloittamisesta. Annosta titrataan siten, että saavutetaan minimipitoisuus 5–15 ng/ml. Parhaimman mahdollisen tehon saamiseksi annosta voidaan siedettävyyden salliessa suurentaa niin, että saavutetaan tavoitealueella oleva suurempi minimipitoisuus.
Titraus
Annostitraus toteutetaan yksilöllisesti suurentamalla annosta 1–4 mg kerrallaan, jotta optimaalisen kliinisen vasteen tuottava tavoiteminimipitoisuus saavutetaan. Annostitrauksen suunnittelussa on otettava huomioon teho, turvallisuus, samanaikaiset hoidot ja nykyinen minimipitoisuus. Yksilöllinen annostitraus voi pohjautua seuraavaan yksinkertaiseen kaavaan:
Uusi everolimuusiannos = nykyinen annos x (tavoitepitoisuus/nykyinen pitoisuus)
Oletetaan esimerkiksi, että potilaan nykyinen kehon pinta‑alaan perustuva annos on 4 mg ja vakaan tilan pitoisuus 4 ng/ml. Jotta saavutetaan Cmin‑pitoisuuden alarajan (5 ng/ml) ylittävä tavoitepitoisuus, esim. 8 ng/ml, uuden everolimuusiannoksen on oltava 8 mg (nykyistä vuorokausiannosta suurennetaan 4 mg).
Pitkäaikaisseuranta
TSC‑potilailla, joilla on SEGA, SEGA:n tilavuus pitää arvioida noin 3 kuukauden kuluttua Votubia‑hoidon aloittamisesta ja annosta muuttaa ottaen huomioon muutokset SEGA:n tilavuudessa, vastaavat minimipitoisuudet ja siedettävyys.
TSC‑potilailla, joilla on SEGA tai vaikeahoitoisia epilepsiakohtauksia, kun vakaa annos on saavutettu, pitoisuutta pitää seurata koko hoidon ajan 3‑6 kuukauden välein potilailla, joiden kehon pinta‑ala muuttuu, tai 6‑12 kuukauden välein potilailla, joiden kehon pinta‑ala on stabiili.
Hoitoa tulee jatkaa niin kauan kuin siitä on kliinistä hyötyä tai kunnes ilmenee sietämätöntä toksisuutta.
Jos annos jää väliin, potilaan ei pidä ottaa ylimääräistä annosta vaan ottaa seuraava annos tavanomaiseen tapaan lääkemääräyksen mukaan.
Annoksen muuttaminen haittavaikutusten vuoksi
Epäiltyjen vaikeiden ja/tai sietämättömien haittavaikutusten hoito saattaa edellyttää annoksen pienentämistä ja/tai Votubia‑hoidon väliaikaista keskeyttämistä. Jos haittavaikutuksen vaikeusaste on 1, annosmuutoksia ei yleensä tarvita. Jos annoksen pienentäminen on tarpeen, suositellaan annosta, joka on noin 50 % pienempi kuin aiemmin käytetty vuorokausiannos. Jos pienintä saatavilla olevaa vahvuutta pienemmät annokset ovat tarpeen, voidaan harkita valmisteen antoa joka toinen päivä.
Taulukossa 2 esitetään yhteenveto tiettyjen haittavaikutusten hoidossa käytettävistä suositeltavista annosmuutoksista (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet).
Taulukko 2Votubian annosmuutossuositukset
Haittavaikutus | Vaikeusaste1 | Votubia‑annosmuutos | ||
Ei‑infektioperäinen pneumoniitti | Vaikeusaste 2 | Harkitse hoidon keskeyttämistä väliaikaisesti, kunnes oireet lievittyvät vaikeusasteeseen ≤1. Aloita Votubia‑hoito uudelleen noin 50 % aiempaa vuorokausiannosta pienemmällä annoksella. Lopeta hoito, jos paranemista ei tapahdu neljän viikon kuluessa. | ||
Vaikeusaste 3 | Keskeytä Votubia‑hoito väliaikaisesti, kunnes oireet lievittyvät vaikeusasteeseen ≤1. Harkitse Votubia‑hoidon aloittamista uudelleen noin 50 % aiempaa vuorokausiannosta pienemmällä annoksella. Jos toksisuus uusiutuu vaikeusasteen 3 tasoisena, harkitse hoidon lopettamista. | |||
Vaikeusaste 4 | Lopeta Votubia‑hoito. | |||
Suutulehdus | Vaikeusaste 2 | Keskeytä annostelu väliaikaisesti, kunnes oireet paranevat vaikeusasteeseen ≤1. Aloita Votubia‑hoito samalla annoksella uudelleen. Jos vaikeusasteen 2 suutulehdus uusiutuu, keskeytä anto, kunnes oireet paranevat vaikeusasteeseen ≤1. Aloita Votubia‑hoito uudelleen noin 50 % aiempaa vuorokausiannosta pienemmällä annoksella. | ||
Vaikeusaste 3 | Keskeytä annostelu väliaikaisesti, kunnes oireet paranevat vaikeusasteeseen ≤1. Aloita Votubia‑hoito uudelleen noin 50 % aiempaa vuorokausiannosta pienemmällä annoksella. | |||
Vaikeusaste 4 | Lopeta Votubia‑hoito. | |||
Muu ei‑hematologinen toksisuus (pois lukien metaboliset tapahtumat) | Vaikeusaste 2 | Annoksen muuttaminen ei ole tarpeen, jos toksisuus on siedettävää. Jos toksisuus muuttuu sietämättömäksi, keskeytä anto väliaikaisesti, kunnes oireet lievittyvät vaikeusasteeseen ≤1. Aloita Votubia‑hoito samalla annoksella uudelleen. Jos toksisuus uusiutuu vaikeusasteen 2 tasoisena, keskeytä Votubia‑hoito, kunnes oireet lievittyvät vaikeusasteeseen ≤1. Aloita Votubia‑hoito uudelleen noin 50 % aiempaa vuorokausiannosta pienemmällä annoksella. | ||
Vaikeusaste 3 | Keskeytä annostelu väliaikaisesti, kunnes oireet paranevat vaikeusasteeseen ≤1. Harkitse Votubia‑hoidon aloittamista uudelleen noin 50 % aiempaa vuorokausiannosta pienemmällä annoksella. Jos toksisuus uusiutuu vaikeusasteen 3 tasoisena, harkitse hoidon lopettamista. | |||
Vaikeusaste 4 | Lopeta Votubia‑hoito. | |||
Metaboliset tapahtumat (esim. hyperglykemia, dyslipidemia) | Vaikeusaste 2 | Annoksen muuttaminen ei ole tarpeen. | ||
Vaikeusaste 3 | Väliaikainen annon keskeytys. Aloita Votubia‑hoito uudelleen noin 50 % aiempaa vuorokausiannosta pienemmällä annoksella. | |||
Vaikeusaste 4 | Lopeta Votubia‑hoito. | |||
Trombosytopenia | Vaikeusaste 2 (<75, ≥50x109/l) | Keskeytä annostelu väliaikaisesti, kunnes oireet lievittyvät vaikeusasteeseen ≤1 (≥75x109/l). Aloita Votubia‑hoito samalla annoksella uudelleen. | ||
Vaikeusaste 3 & 4 (<50x109/l) | Keskeytä annostelu väliaikaisesti, kunnes oireet lievittyvät vaikeusasteeseen ≤1 (≥75x109/l). Aloita Votubia‑hoito uudelleen noin 50 % aiempaa vuorokausiannosta pienemmällä annoksella. | |||
Neutropenia | Vaikeusaste 2 (≥1x109/l) | Annoksen muuttaminen ei ole tarpeen. | ||
Vaikeusaste 3 (< 1, ≥0,5x109/l) | Keskeytä annostelu väliaikaisesti, kunnes oireet lievittyvät vaikeusasteeseen ≤2 (≥1x109/l). Aloita Votubia‑hoito samalla annoksella uudelleen. | |||
Vaikeusaste 4 (<0,5x109/l) | Keskeytä annostelu väliaikaisesti, kunnes oireet lievittyvät vaikeusasteeseen ≤2 (≥1x109/l). Aloita Votubia‑hoito uudelleen noin 50 % aiempaa vuorokausiannosta pienemmällä annoksella. | |||
Kuumeinen neutropenia | Vaikeusaste 3 | Keskeytä annostelu väliaikaisesti, kunnes oireet lievittyvät vaikeusasteeseen ≤2 (≥1,25x109/l) ja potilaalla ei ole kuumetta. Aloita Votubia‑hoito uudelleen noin 50 % aiempaa vuorokausiannosta pienemmällä annoksella. | ||
Vaikeusaste 4 | Lopeta Votubia‑hoito. | |||
1 Vaikeusasteet perustuvat National Cancer Instituten (NCI:n) Common Terminology Criteria for Adverse Events ‑luokitukseen (CTCAE) v3.0 | ||||
Lääkeainepitoisuuksien seuranta
Everolimuusin pitoisuuksia veressä on seurattava validoitua määritysmenetelmää käyttäen. Minimipitoisuudet on määritettävä ainakin viikon kuluttua ensimmäisestä annoksesta, annos‑ tai lääkemuotomuutoksen jälkeen, samanaikaisesti annettavan CYP3A4‑estäjän aloittamisen tai annosmuutoksen jälkeen (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset) tai aina, kun maksan tila (Child‑Pugh‑luokka) muuttuu (ks. ”Maksan vajaatoiminta” alla ja kohta Farmakokinetiikka). Minimipitoisuudet on määritettävä 2–4 viikon kuluttua samanaikaisesti annettavan CYP3A4‑indusoijan aloittamisen tai annosmuutoksen jälkeen (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset), koska indusoitujen entsyymien luontainen hajoamisaika on otettava huomioon. Pitoisuuksien seurantaan on mahdollisuuksien mukaan käytettävä samaa määritysmenetelmää ja laboratoriota koko hoidon ajan.
Lääkemuodon vaihtaminen
Votubia on saatavana kahtena lääkemuotona: tabletteina ja dispergoituvina tabletteina. Votubia‑tabletit ja Votubia dispergoituvat tabletit eivät ole vaihtokelpoisia keskenään. Näitä kahta lääkemuotoa ei saa yhdistää halutun annoksen saamiseksi. Hoidossa on käytettävä johdonmukaisesti samaa lääkemuotoa hoidettavan käyttöaiheen mukaisesti.
Lääkemuotoa vaihdettaessa annos mukautetaan lähimpään uuden lääkemuodon milligrammavahvuuteen ja everolimuusin pitoisuus veressä pitää määrittää viimeistään viikon kuluttua (ks. kohta ”Lääkeainepitoisuuksien seuranta” ylhäällä).
Erityisryhmät
Iäkkäät
Annoksen muuttaminen ei ole tarpeen (ks. kohta Farmakokinetiikka).
Munuaisten vajaatoiminta
Annoksen muuttaminen ei ole tarpeen (ks. kohta Farmakokinetiikka).
Maksan vajaatoiminta
< 18‑vuotiaat potilaat:
Votubiaa ei suositella alle 18‑vuotiaille tuberoosiskleroosia sairastaville potilaille, joilla on SEGA tai vaikeahoitoisia epilepsiakohtauksia ja maksan vajaatoiminta.
≥18‑vuotiaat potilaat:
- lievä maksan vajaatoiminta (Child‑Pugh‑luokka A): 75 % suositellusta aloitusannoksesta laskettuna ihon pinta‑alan mukaan (pyöristettynä lähimpään vahvuuteen)
- keskivaikea maksan vajaatoiminta (Child‑Pugh‑luokka B): 50 % suositellusta aloitusannoksesta laskettuna ihon pinta‑alan mukaan (pyöristettynä lähimpään vahvuuteen)
- vaikea maksan vajaatoiminta (Child‑Pugh‑luokka C): Votubiaa suositellaan vain, jos hyöty on suurempi kuin riskit. Tässä tapauksessa annos ei saa ylittää 25% ihon pinta‑alan mukaan (pyöristettynä lähimpään vahvuuteen) lasketusta annoksesta.
Everolimuusin minimipitoisuudet kokoveressä pitää määrittää ainakin viikon kuluttua maksan tilan (Child‑Pugh‑luokan) muuttumisesta.
Pediatriset potilaat
Votubia‑valmisteen turvallisuutta, tehoa ja farmakokineettistä profiilia alle 1 vuoden ikäisten lasten, joilla on sekä tuberoosiskleroosi että SEGA, hoidossa ei ole varmistettu. Tietoja ei ole saatavilla (ks. kohdat Farmakodynamiikka ja Farmakokinetiikka).
Votubia‑valmisteen turvallisuutta, tehoa ja farmakokineettistä profiilia alle 2‑vuotiaiden lasten, joilla on TSC ja vaikeahoitoisia epilepsiakohtauksia, hoidossa ei ole varmistettu. Saatavissa olevan tiedon perusteella, joka on kuvattu kohdassa Farmakokinetiikka, ei voida antaa suosituksia annostuksesta.
Kliinisten tutkimusten tuloksissa ei havaittu Votubia‑valmisteen vaikutusta kasvuun ja murrosiän kehitykseen.
Antotapa
Votubia täytyy ottaa suun kautta kerran vuorokaudessa samaan aikaan joka päivä, säännönmukaisesti joko ruoan kanssa tai tyhjään mahaan (ks. kohta Farmakokinetiikka).
Dispergoituvat Votubia‑tabletit tulee ottaa ainoastaan suspensiona. Niitä ei saa niellä kokonaisina, pureskella eikä murskata. Suspensio voidaan valmistaa mittaruiskussa tai pienessä lasissa. On varmistettava, että koko annos tulee niellyksi.
Suspensio on annettava välittömästi valmistuksen jälkeen. Jos suspensiota ei ole käytetty 30 minuutin kuluessa valmistuksesta mittaruiskussa tai 60 minuutin kuluessa valmistuksesta pienessä lasissa, se on heitettävä pois ja valmistettava uusi suspensio (ks. kohta Kestoaika). Liuottimena on käytettävä vain vettä.
Lisätietoja, ks. kohta Käyttö- ja käsittelyohjeet.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle, muille rapamysiinijohdoksille tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Ei‑infektioperäinen pneumoniitti
Ei‑infektioperäinen pneumoniitti on rapamysiinijohdosten kuten everolimuusin luokkavaikutus. Ei‑infektioperäistä pneumoniittia (myös interstitiaalista keuhkosairautta) kuvattiin hyvin yleisesti everolimuusihoitoa saaneilla pitkälle edennyttä munuaissyöpää sairastaneilla potilailla (ks. kohta Haittavaikutukset). Jotkut tapaukset olivat vakavia, ja harvinaisissa tapauksissa tilanne johti kuolemaan. Ei‑infektioperäisen pneumoniitin mahdollisuus tulee ottaa huomioon, jos potilaalla on epäspesifisiä hengitystieoireita ja löydöksiä kuten hypoksiaa, pleuraeffuusiota, yskää tai hengenahdistusta ja jos infektion, kasvaimen ja muiden lääkehoitoon liittymättömien syiden mahdollisuus on suljettu pois asianmukaisten tutkimusten avulla. Opportunistiset infektiot kuten pneumocystis jiroveci (carinii)‑keuhkokuume (PJP, PCP) tulee sulkea pois ei‑infektioperäisen pneumoniitin erotusdiagnostiikassa (ks. kohta ”Infektiot” alla). Potilaita tulee kehottaa ilmoittamaan viipymättä kaikista uusista hengitystieoireista ja hengitystieoireiden pahenemisesta.
Jos potilaalle kehittyy ei‑infektioperäiseen pneumoniittiin viittaavia radiologisia muutoksia, mutta oireita on vähän tai ei lainkaan, hän voi jatkaa Votubia‑hoitoa ilman annosmuutoksia. Jos oireet ovat keskivaikeita, on harkittava hoidon keskeyttämistä, kunnes oireet lievittyvät. Kortikosteroidien käyttö voi olla aiheellista. Votubia‑hoito voidaan aloittaa uudelleen noin 50 % aiempaa pienemmällä vuorokausiannoksella.
Jos ei‑infektioperäisen pneumoniitin oireet ovat vaikeita, Votubia‑hoito tulee lopettaa ja kortikosteroidien käyttö voi olla aiheellista, kunnes kliiniset oireet lievittyvät. Votubia‑hoito voidaan aloittaa uudelleen noin 50 % aiempaa pienemmällä vuorokausiannoksella yksilöllisestä kliinisestä tilanteesta riippuen.
Potilaat, jotka tarvitsevat kortikosteroideja ei‑infektioperäiseen pneumoniitin hoitoon, saattavat tarvita pneumocystis jiroveci (carinii)‑keuhkokuumeen (PJP, PCP) estohoitoa.
Infektiot
Everolimuusilla on immunosuppressiivisia vaikutuksia, ja se saattaa altistaa potilaan bakteeri‑, sieni‑, virus‑ tai alkueläininfektioille, myös opportunisti‑infektioille (ks. kohta Haittavaikutukset). Everolimuusia käyttävillä potilailla on kuvattu paikallisia ja systeemisiä infektioita, kuten keuhkokuumetta, muita bakteeri‑infektioita, invasiivisia sieni‑infektioita, kuten aspergilloosia, kandidiaasia tai pneumocystis jiroveci (carinii)‑keuhkokuumetta (PJP, PCP) ja virusinfektioita kuten hepatiitti B‑viruksen uudelleen aktivoitumista. Jotkut näistä infektioista olivat vaikeita (esim. johtivat verenmyrkytykseen [mukaan lukien septinen shokki], hengitysvajaukseen tai maksan vajaatoimintaan) ja johtivat joissakin tapauksissa kuolemaan niin aikuisilla kuin pediatrisilla potilailla (ks. kohta Haittavaikutukset).
Lääkäreiden ja potilaiden tulee olla tietoisia infektioriskin suurenemisesta Votubia‑hoidon aikana. Potilaalla entuudestaan olevat infektiot tulee hoitaa asianmukaisesti ja saada hoidettua täysin ennen Votubia‑hoidon aloittamista. Votubia‑hoidon aikana tulee seurata tilannetta mahdollisten infektio‑oireiden ja löydösten varalta: jos infektiodiagnoosi tehdään, tulee asianmukainen hoito aloittaa viipymättä ja harkita Votubia‑hoidon keskeyttämistä tai lopettamista.
Jos potilaalla todetaan invasiivinen systeeminen sieni‑infektio, Votubia‑hoito tulee lopettaa heti ja pysyvästi, ja potilaalle tulee antaa asianmukaista antimykoottista hoitoa.
Pneumocystis jiroveci (carinii)‑keuhkokuumetapauksia (PJP, PCP), jotkut kuolemaan johtavia, on raportoitu everolimuusia saavilla potilailla. PJP/PCP‑tapauksiin voi liittyä yhdistelmäkäyttöä kortikosteroidihoitoon tai muuhun immunosuppressiiviseen hoitoon. PJP/PCP estohoitoa on harkittava, kun yhdistelmähoitoja kortikosteroidien tai muiden immunosuppressanttien kanssa on tarpeen käyttää.
Yliherkkyysoireet
Everolimuusin käytön yhteydessä on havaittu yliherkkyysreaktioita, jotka ilmenevät seuraavina oireina (mutta eivät rajoitu niihin): anafylaksia, hengenahdistus, punoitus, rintakipu tai angioödeema (esim. hengitysteiden tai kielen turvotus, johon saattaa liittyä hengitystoiminnan heikkenemistä) (ks. kohta Vasta-aiheet).
Samanaikainen angiotensiinikonvertaasin estäjien (ACE:n estäjien) käyttö
Samanaikaisesti ACE:n estäjähoitoa (esim. ramipriilia) saavien potilaiden riski angioedeemalle (esim. hengitysteiden tai kielen turvotukselle sekä siihen mahdollisesti liittyville hengitysvaikeuksille) voi olla tavallista suurempi (ks. kohta Yhteisvaikutukset).
Suutulehdus
Votubia‑hoitoa saavilla potilailla suutulehdus, mukaan lukien suun haavaumat ja suun limakalvotulehdus, on yleisimmin raportoitu haittavaikutus (ks. kohta Haittavaikutukset). Suutulehdus ilmenee useimmiten ensimmäisten 8 viikon aikana hoidon aloittamisesta. Yksihaaraisessa tutkimuksessa Afinitoria (everolimuusi) ja eksemestaania saaneilla postmenopausaalisilla rintasyöpäpotilailla havaittiin, että alkoholiton kortikosteroidia sisältävä oraaliliuos saattaa vähentää suutulehduksen esiintyvyyttä ja vaikeusastetta, kun sitä käytetään suuvetenä ensimmäisten 8 hoitoviikon aikana (ks. kohta Farmakodynamiikka). Suutulehduksen hoitoon voi siten kuulua paikallishoitojen, kuten alkoholittoman kortikosteroidia sisältävän oraaliliuoksen, profylaktinen (aikuisilla) ja/tai terapeuttinen käyttö. Alkoholia, vetyperoksidia, jodia ja timjamijohdannaisia sisältävien suuhuuhteiden käyttöä tulee kuitenkin välttää, sillä ne saattavat pahentaa tilannetta. Seurantaa sieni‑infektioiden varalta sekä niiden hoitoa suositellaan erityisesti potilailla, joita hoidetaan kortikosteroidipohjaisilla lääkevalmisteilla. Sienilääkkeitä ei tule käyttää, ellei potilaalla ole todettu sieni‑infektiota (ks. kohta Yhteisvaikutukset).
Verenvuodot
Vakavia verenvuototapauksia, joista jotkin ovat johtaneet potilaan kuolemaan, on raportoitu everolimuusia syövän hoitoon saaneilla potilailla. Yhtäkään vakavaa munuaisverenvuotoa ei ole raportoitu tuberoosiskleroosin hoidossa.
Varovaisuuteen on syytä hoidettaessa potilaita Votubialla, etenkin, jos samanaikaisesti käytetään sellaisia vaikuttavia aineita, joiden tiedetään vaikuttavan verihiutaleiden toimintaan tai jotka saattavat lisätä verenvuodon riskiä. Sama koskee potilaita, joilla on aiemmin ilmennyt verenvuotoon liittyviä häiriöitä. Hoitoalan ammattilaisten ja potilaiden on oltava valppaina mahdollisten verenvuotoon liittyvien merkkien ja oireiden varalta koko tämän lääkehoidon ajan ja etenkin tapauksissa, joissa käyttöön liittyy verenvuodolle altistavia riskitekijöitä.
Munuaisten vajaatoimintaan liittyvät tapahtumat
Votubia‑hoitoa saaneilla potilailla on todettu munuaisten vajaatoimintatapauksia (munuaisten äkillinen vajaatoiminta mukaan lukien), joista jotkut olivat kuolemaan johtavia (ks. kohta Haittavaikutukset). Potilaiden munuaistoimintaa on seurattava erityisesti, jos potilailla on muita riskitekijöitä, jotka saattavat vaikuttaa munuaisten toimintaan.
Laboratoriotutkimukset ja seuranta
Munuaistoiminta
Votubia‑valmisteella hoidetuilla potilailla on ilmoitettu seerumin kreatiniiniarvojen suurenemista, joka oli yleensä lievää, sekä proteinuriaa (ks. kohta Haittavaikutukset). Potilaan munuaistoiminnan seurantaa mm. veren ureatypen, virtsan proteiinin tai seerumin kreatiniinin mittauksin suositellaan ennen Votubia‑hoidon aloittamista ja säännöllisin välein hoidon aikana.
Veren glukoosiarvot
Votubia‑valmistetta käyttävillä potilailla on ilmoitettu hyperglykemiaa, (ks. kohta Haittavaikutukset). Potilaan paastoglukoosiarvojen seurantaa suositellaan ennen Votubia‑hoidon aloittamista ja säännöllisin välein sen jälkeen. Potilaita, jotka käyttävät Votubia‑valmisteen kanssa jotakin muuta hyperglykemiaa mahdollisesti aiheuttavaa lääkevalmistetta, suositellaan seurattavan useammin. Ennen Votubia‑hoidon aloittamista verensokeri tulee saada optimaaliseen hoitotasapainoon, mikäli mahdollista.
Veren lipidiarvot
Dyslipidemiaa (mukaan lukien hyperkolesterolemiaa ja hypertriglyseridemiaa) on ilmoitettu Votubia‑valmistetta käyttävillä potilailla. Veren kolesteroli‑ ja triglyseridiarvojen seurantaa suositellaan ennen Votubia‑hoidon aloittamista ja säännöllisin välein sen jälkeen.
Hematologiset määritykset
Votubia‑valmisteella hoidetuilla potilailla on ilmoitettu hemoglobiini‑, lymfosyytti‑, neutrofiili‑ ja verihiutalearvojen pienenemistä (ks. kohta Haittavaikutukset). Potilaan täydellisen verenkuvan seurantaa suositellaan ennen Votubia‑hoidon aloittamista ja säännöllisin välein hoidon aikana.
Yhteisvaikutukset
CYP3A4‑entsyymitoimintaa ja/tai monien lääkkeiden ulosvirtauspumppuna toimivan P‑glykoproteiinin (P‑gp) toimintaa estävien tai indusoivien aineiden samanaikaista käyttöä pitää välttää. Jos kohtalaisen voimakkaan CYP3A4‑ ja/tai P‑gp‑estäjän tai ‑induktorin samanaikainen käyttö on välttämätöntä, potilaan kliinistä tilaa on seurattava tarkasti. Everolimuusin minimipitoisuuksien seurantaa ja Votubia-annoksen muuttamista saatetaan tarvita (ks. kohta Yhteisvaikutukset).
Voimakkaiden CYP3A4/P-gp ‑estäjien samanaikainen käyttö suurentaa plasman everolimuusipitoisuuksia huomattavasti (ks. kohta Yhteisvaikutukset). Nykyiset tiedot eivät riitä kyseistä tilannetta koskevien annostussuositusten antamiseen. Näin ollen Votubian ja voimakkaiden estäjien samanaikainen käyttö ei ole suositeltavaa.
Mahdollisien yhteisvaikutuksien takia varovaisuutta on noudatettava, kun Votubia‑valmistetta otetaan samanaikaisesti suun kautta annosteltavien CYP3A4‑substraattien kanssa, joilla on kapea terapeuttinen indeksi. Jos Votubia‑valmistetta otetaan samanaikaisesti suun kautta annosteltavien CYP3A4‑substraattien kanssa, joilla on kapea terapeuttinen indeksi (esim. pimotsidi, terfenadiini, astemitsoli, sisapridi, kinidiini, ergotalkaloidijohdannaiset tai karbamatsepiini), potilasta tulee seurata suun kautta otettavan CYP3A4‑substraatin valmisteyhteenvedossa mainittujen haittavaikutusten varalta (ks. kohta Yhteisvaikutukset).
Maksan vajaatoiminta
Votubian käyttöä ei suositella:
- ≥18‑vuotiaille potilaille, joilla on SEGA tai vaikeahoitoisia epilepsiakohtauksia ja samanaikaisesti vaikea maksan vajaatoiminta (Child‑Pugh‑luokka C) ellei potentiaalinen hyöty ole suurempi kuin riskit (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka).
- <18‑vuotiaille potilaille, joilla on SEGA tai vaikeahoitoisia epilepsiakohtauksia ja samanaikaisesti maksan vajaatoiminta (Child‑Pugh‑luokka A, B ja C) (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka).
Rokotukset
Elävien rokotteiden käyttöä tulee välttää Votubia‑hoidon aikana (ks. kohta Yhteisvaikutukset). Jos potilas on lapsi eikä välitön hoito ole tarpeen, hänelle on hyvä antaa kaikki suositeltavaan lapsuusiän rokotusohjelmaan kuuluvat, eläviä viruksia sisältävät rokotteet ennen hoidon aloittamista paikallisten hoitosuositusten mukaisesti.
Haavojen paranemiseen liittyvät komplikaatiot
Haavojen huono paraneminen on rapamysiinijohdosten kuten Votubian luokkavaikutus. Votubian perioperatiivisessa käytössä tulee siis noudattaa varovaisuutta.
Laktoosi
Potilaiden, joilla on harvinainen perinnöllinen galaktoosi‑intoleranssi, täydellinen laktaasinpuutos tai glukoosi‑galaktoosi‑imeytymishäiriö, ei pidä käyttää tätä lääkettä.
Sädehoitoon liittyvät komplikaatiot
Vakavia ja vaikeita sädereaktioita (kuten säde-esofagiitti, sädepneumoniitti ja ihon sädevauriot), myös kuolemaan johtaneita tapauksia, on ilmoitettu käytettäessä everolimuusia sädehoidon aikana tai pian sen jälkeen. Sädehoidon toksisuutta voimistavan vaikutuksen vuoksi varovaisuutta on noudatettava hoidettaessa potilaita, jotka käyttävät everolimuusia lyhyen ajan sisällä sädehoidosta.
Sädereaktion uusiutumisoireyhtymää on myös ilmoitettu sädehoitoa aiemmin saaneilla everolimuusin käyttäjillä. Uusiutumisoireyhtymätapauksissa on harkittava everolimuusihoidon keskeyttämistä tai lopettamista.
Yhteisvaikutukset
Everolimuusi on CYP3A4:n substraatti ja myös P‑gp:n substraatti ja kohtalainen estäjä. CYP3A4‑ ja/tai P‑gp‑toimintaan vaikuttavat valmisteet saattavat siis vaikuttaa everolimuusin imeytymiseen ja eliminaatioon. Everolimuusi on kilpaileva CYP3A4‑estäjä ja palautuva CYP2D6‑estäjä in vitro.
Tunnettuja ja teoreettisia yhteisvaikutuksia joidenkin CYP3A4‑ tai P‑gp‑estäjien ja induktorien kanssa on lueteltu alla Taulukossa 3.
CYP3A4‑ ja P‑gp‑estäjät, jotka suurentavat everolimuusipitoisuuksia
CYP3A4‑ tai P‑gp‑estäjät voivat suurentaa everolimuusipitoisuutta veressä hidastamalla metaboliaa tai everolimuusin ulosvirtausta suoliston soluista.
CYP3A4‑ ja P‑gp‑induktorit, jotka pienentävät everolimuusipitoisuuksia
CYP3A4‑ tai P‑gp‑indusoijat voivat pienentää everolimuusipitoisuutta veressä voimistamalla metaboliaa tai everolimuusin ulosvirtausta suoliston soluista.
Taulukko 3Muiden lääkeaineiden vaikutukset everolimuusiin
Lääkeaine yhteisvaikutuskohtaisesti | Yhteisvaikutus – everolimuusin AUC‑/Cmax‑arvojen muutos Geometrinen keskiarvo (havaittu alue) | Suositukset yhteiskäytölle |
Voimakkaat CYP3A4/P‑gp‑estäjät | ||
Ketokonatsoli | AUC ↑15,3‑kertaiseksi (vaihteluväli 11,2‑22,5) Cmax ↑4,1‑kertaiseksi (vaihteluväli 2,6‑7,0) | Votubian ja voimakkaiden CYP3A4‑ tai P‑gp‑estäjien samanaikaista käyttöä ei suositella. |
Itrakonatsoli, posakonatsoli, vorikonatsoli | Ei tutkittu. Everolimuusipitoisuuden suuri nousu on odotettavissa. | |
Telitromysiini, klaritromysiini | ||
Nefatsodoni | ||
Ritonaviiri, atatsanaviiri, sakinaviiri, darunaviiri, indinaviiri, nelfinaviiri | ||
Kohtalaisen voimakkaat CYP3A4/P‑gp‑estäjät | ||
Erytromysiini | AUC ↑4,4‑kertaiseksi (vaihteluväli 2,0‑12,6) Cmax ↑2,0‑kertaiseksi (vaihteluväli 0,9‑3,5) | Jos kohtalaisen voimakkaiden CYP3A4‑estäjien tai P‑gp‑estäjien käyttö samanaikaisesti Votubian kanssa on välttämätöntä, siinä tulee noudattaa varovaisuutta. Jos potilas tarvitsee samanaikaisesti kohtalaisen voimakkaan CYP3A4‑estäjän tai P‑gp estäjän, vuorokausiannosta on pienennettävä noin 50 %:lla. Annosta saatetaan joutua pienentämään edelleen haittavaikutusten vuoksi (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet). Everolimuusin minimipitoisuudet pitää määrittää ainakin viikon kuluttua kohtalaisen voimakkaan CYP3A4‑ tai P‑gp‑estäjän aloittamisesta. Jos kohtalaisen voimakkaan estäjän käyttö lopetetaan, on harkittava vähintään 2 ‑ 3 päivän mittaista jaksoa (yleisimmin käytettyjen kohtalaisten estäjien keskimääräinen eliminaatioaika) ennen kuin Votubia‑annos palautetaan samanaikaista käyttöä edeltäneelle tasolle. Everolimuusin minimipitoisuudet pitää määrittää ainakin viikkoa myöhemmin (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet). |
Imatinibi | AUC ↑ 3,7‑kertaiseksi Cmax ↑ 2,2‑kertaiseksi | |
Verapamiili | AUC ↑3,5‑kertaiseksi (vaihteluväli 1,3‑6,3) Cmax ↑2,3‑kertaiseksi (vaihteluväli 1,3‑3,8) | |
Suun kautta otettava siklosporiini | AUC ↑2,7‑kertaiseksi (vaihteluväli 1,5‑4,7) Cmax ↑1,8‑kertaiseksi (vaihteluväli 1,3‑2,6) | |
Kannabidioli (P-gp-estäjä) | AUC ↑ 2,5-kertainen Cmax ↑ 2,5-kertainen | |
Flukonatsoli | Ei tutkittu. Korkeampi altistus odotettavissa. | |
Diltiatseemi | ||
Dronedaroni | Ei tutkittu. Korkeampi altistus odotettavissa. | |
Amprenaviiri, fosamprenaviiri | Ei tutkittu. Korkeampi altistus odotettavissa. | |
Greippimehu tai muut elintarvikkeet, jotka vaikuttavat CYP3A4/P‑gp‑toimintaan | Ei tutkittu. Korkeampi altistus odotettavissa (teho vaihtelee laajasti). | Yhteiskäyttöä tulee välttää. |
Voimakkaat ja kohtalaiset CYP3A4‑induktorit | ||
Rifampisiini | AUC ↓63 % (vaihteluväli 0‑80 %) Cmax ↓58 % (vaihteluväli 10‑70 %) | Voimakkaiden CYP3A4‑induktorien samanaikaista käyttöä tulee välttää. Jos SEGA‑potilas saa samanaikaisesti voimakasta CYP3A4‑induktoria, Votubia‑annosta saatetaan joutua suurentamaan, jotta altistus on sama kuin potilailla, jotka eivät käytä voimakkaita induktoreja. Annosta pitää säätää siten, että minimipitoisuus on 5‑15 ng/ml, alla kuvattavaan tapaan. Jos potilaalla on epilepsiakohtauksia ja hän saa samanaikaisesti voimakkaita CYP3A4‑induktoreja (esim. entsyymitoimintaa indusoivia epilepsialääkkeitä karbamatsepiinia, fenobarbitaalia tai fenytoiinia) everolimuusihoidon alussa, aloitusannosta on suurennettava, jotta 5–15 ng/ml:n tavoiteminimipitoisuudet saavutetaan (ks. taulukko 1). Jos potilas ei käytä everolimuusihoidon alussa samanaikaista voimakasta induktorilääkitystä, valmisteiden samanaikainen käyttö saattaa vaatia Votubia‑annoksen suurentamista. Jos pitoisuudet ovat alle 5 ng/ml, vuorokausiannosta voidaan suurentaa 1–4 mg kerrallaan seuraten minimipitoisuutta ja arvioiden siedettävyyttä ennen annoksen suurentamista. Toisen voimakkaan CYP3A4‑induktorin lisääminen potilaan samanaikaiseen hoitoon ei välttämättä edellytä uusia annosmuutoksia. Everolimuusin minimipitoisuudet arvioidaan 2 viikon kuluttua uuden induktorin käytön aloittamisesta. Annosta muutetaan 1–4 mg kerrallaan, jotta minimipitoisuudet pysyvät tavoitealueella. Jos potilas käyttää useita voimakkaita CYP3A4‑induktoreja, yhden induktorin käytön lopettaminen ei välttämättä edellytä uusia annosmuutoksia. Everolimuusin minimipitoisuudet arvioidaan 2 viikon kuluttua siitä, kun yksi voimakkaista CYP3A4‑induktoreista on lopetettu. Jos kaikkien voimakkaiden induktorien käyttö lopetetaan, on harkittava vähintään 3 ‑ 5 päivän mittaista jaksoa (kohtuullinen aika entsyymitoiminnan normalisoitumiseen) ennen kuin Votubia‑annos palautetaan samanaikaista käyttöä edeltäneelle tasolle. Everolimuusin minimipitoisuudet pitää määrittää 2–4 viikon kuluttua, koska indusoitujen entsyymien luontainen hajoamisaika on otettava huomioon (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet). |
Deksametasoni | Ei tutkittu. Matalampi altistus odotettavissa. | |
Epilepsialääkkeet (esim. karbamatsepiini, fenobarbitaali, fenytoiini) | Ei tutkittu. Matalampi altistus odotettavissa. | |
Efavirentsi, nevirapiini | Ei tutkittu. Matalampi altistus odotettavissa. | |
Mäkikuisma (Hypericum perforatum) | Ei tutkittu. Huomattavasti matalampi altistus odotettavissa. | Mäkikuismaa sisältäviä valmisteita ei pidä käyttää everolimuusihoidon aikana. |
Aineet, joiden pitoisuutta plasmassa everolimuusi saattaa muuttaa
In vitro ‑tulosten perusteella10 mg oraalisen vuorokausiannoksen jälkeiset systeemiset pitoisuudet ovat sitä luokkaa, että P‑gp:n, CYP3A4:n ja CYP2D6:n esto on epätodennäköinen. CYP3A4:n ja P gp:n estoa suolessa ei voida kuitenkaan poissulkea. Yhteisvaikutustutkimus terveillä tutkimushenkilöillä osoitti, että samanaikaisesti everolimuusin kanssa suun kautta otettu annos midatsolaamia, joka on herkkä CYP3A‑substraatin tunnistin, nosti midatsolaamin Cmax‑pitoisuutta 25 % ja midatsolaamin AUC(0‑inf)‑pitoisuutta 30 %. Tämä vaikutus johtuu todennäköisesti everolimuusin aiheuttamasta, suolistossa olevan CYP3A4:n estosta, joten everolimuusi saattaa vaikuttaa samanaikaisesti suun kautta annettavien CYP3A4‑substraattien hyötyosuuteen. Kliinisesti merkittävä vaikutus systeemisesti annettaville CYP3A4‑substraateille ei ole odotettavissa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
EXIST‑3‑tutkimuksessa (tutkimus CRAD001M2304) everolimuusi suurensi karbamatsepiini‑ ja klobatsaamiepilepsialääkkeiden ja klobatsaamin metaboliitin N‑desmetyyliklobatsaamin ennen lääkeannosta mitattuja pitoisuuksia noin 10 %. Näiden epilepsialääkkeiden annosta edeltävien pitoisuuksien suureneminen ei välttämättä ole kliinisesti merkittävää. Kapean terapeuttisen leveyden omaavien epilepsialääkkeiden kuten karbamatsepiinin kohdalla voidaan kuitenkin harkita annosmuutoksia. Everolimuusilla ei ollut vaikutusta niiden epilepsialääkkeiden annosta edeltäviin pitoisuuksiin, jotka ovat CYP3A4:n substraatteja (klonatsepaami, diatsepaami, felbamaatti ja tsonisamidi).
Samanaikainen ACE:n estäjien käyttö
Samanaikaisesti ACE:n estäjähoitoa (esim. ramipriilia) saavien potilaiden riski angioedeemalle voi olla tavallista suurempi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Samanaikainen ketogeeninen ruokavalio
Ketogeenisen ruokavalion vaikutus saattaa välittyä mTOR:n eston kautta. Kliinisiä tietoja ei ole, joten haittatapahtumiin kohdistuvan additiivisen vaikutuksen mahdollisuutta ei voida sulkea pois, kun everolimuusia käytetään yhdessä ketogeenisen ruokavalion kanssa.
Rokotukset
Rokotuksella aikaansaatava immuunivaste saattaa heikentyä, joten rokotusten teho voi olla tavanomaista huonompi Votubia‑hoidon aikana. Elävien rokotteiden käyttöä tulee välttää Votubia‑hoidon aikana. Eläviä rokotteita ovat esimerkiksi nenään annettava influenssarokote, tuhkarokko‑, sikotauti‑ ja vihurirokkorokotteet, peroraalinen poliorokote, BCG‑rokote (Bacillus Calmette‑Guérin) sekä keltakuume‑, vesirokko‑ ja TY21a‑lavantautirokotteet.
Sädehoito
Everolimuusia käyttävillä potilailla on raportoitu sädehoidon toksisuuden voimistumista (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset).
Raskaus ja imetys
Hedelmällisessä iässä olevat naiset / Ehkäisy miehille ja naisille
Hedelmällisessä iässä olevien naisten on käytettävä erittäin tehokasta ehkäisyä (esim. oraalinen, injisoitava tai implantoitu hormonaalinen ehkäisy ilman estrogeenia, progesteronipohjainen ehkäisy, hysterektomia, munatorviklipsit, täydellinen pidättyväisyys, estomenetelmät, kohdunsisäiset ehkäisyvälineet [IUD] ja/tai naisen/miehen sterilisaatio) everolimuusihoidon aikana ja 8 viikon ajan hoidon lopettamisesta.
Miespotilaita ei pidä kieltää yrittämästä lapsen hankkimista.
Raskaus
Ei ole olemassa riittävästi tietoja everolimuusin käytöstä raskaana oleville naisille. Eläinkokeissa on havaittu lisääntymistoksisuutta mukaan lukien alkio‑ ja sikiötoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Mahdollista ihmisille aiheutuvaa riskiä ei tunneta.
Everolimuusin käyttö ei ole suositeltavaa raskauden aikana eikä naisilla, jotka voivat saada lapsia mutta eivät käytä ehkäisyä.
Imetys
Ei tiedetä, erittyykö everolimuusi ihmisen rintamaitoon. Rotalla everolimuusi ja/tai sen metaboliitit erittyvät kuitenkin herkästi maitoon (ks. kohta Prekliiniset tiedot turvallisuudesta). Näin ollen everolimuusia käyttävien naisten ei pidä imettää hoidon aikana, eikä 2 viikon kuluessa viimeisestä otetusta annoksesta.
Hedelmällisyys
Ei tiedetä, onko everolimuusilla nais‑ ja miespuolisille potilaille hedelmättömyyttä aiheuttavia ominaisuuksia, mutta naispuolisilla potilailla on havaittu sekundaarista amenorreaa ja siihen liittyvää epätasapainoa luteinisoivan hormonin (LH) ja follikkelia stimuloivan hormonin (FSH) määrien suhteessa (ks. lisäksi kohta Prekliiniset tiedot turvallisuudesta, jossa kerrotaan prekliinisissä tutkimuksissa todetuista, urosten ja naaraiden lisääntymisjärjestelmiin liittyvistä havainnoista). Prekliinisten löydösten perusteella everolimuusihoito saattaa heikentää miesten sekä naisten hedelmällisyyttä (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Votubia‑valmisteella on vähäinen tai kohtalainen vaikutus ajokykyyn ja koneidenkäyttökykyyn. Potilaille tulee kertoa, että varovaisuutta on noudatettava ajaessa tai koneita käytettäessä, jos Votubia‑hoidon aikana esiintyy uupumusta.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Votubian turvallisuusprofiili perustuu kolmeen satunnaistettuun, kaksoissokkoutettuun, lumelääkekontrolloituun keskeiseen vaiheen III tutkimukseen, joihin kuului kaksoissokkoutettuja ja avoimia hoitojaksoja, ja yhteen satunnaistamattomaan, avoimeen, yksiryhmäiseen vaiheen II tutkimukseen (n = 612; mukana 409 iältään < 18‑vuotiasta potilasta; altistuksen mediaanikesto 36,8 kuukautta [vaihteluväli 0,5–83,2]).
- EXIST‑3 (CRAD001M2304): Kyseessä oli satunnaistettu, kaksoissokkoutettu, kontrolloitu vaiheen III tutkimus, jossa pienen ja suuren everolimuusialtistuksen käyttöä lisälääkehoitona (pienten minimipitoisuuksien ryhmä [low trough, LT], pitoisuuksien vaihteluväli 3‑7 ng/ml [n = 117], ja suurten minimipitoisuuksien ryhmä [high trough, HT], pitoisuuksien vaihteluväli 9‑15 ng/ml [n = 130]) verrattiin lumelääkkeeseen (n = 119) TSC‑potilailla, joilla oli vaikeahoitoisia paikallisalkuisia epilepsiakohtauksia ja jotka käyttivät 1–3 epilepsialääkettä. Kaksoissokkoutetun vaiheen mediaanikesto oli 18 viikkoa. Kumulatiivisen Votubia‑altistuksen (361 potilasta, jotka ottivat ainakin yhden everolimuusiannoksen) mediaanikesto oli 30,4 kuukautta (vaihteluväli 0,5–48,8).
- EXIST‑2 (CRAD001M2302): Tutkimus oli satunnaistettu, kaksoissokkoutettu, kontrolloitu, vaiheen III tutkimus, jossa everolimuusia (n = 79) verrattiin lumelääkkeeseen (n = 39) potilailla, joilla oli joko TSC ja munuaisten angiomyolipooma (n = 113) tai satunnaisesti esiintyvä lymfangioleiomyomatoosi (LAM) ja munuaisten angiomyolipooma (n = 5). Sokkoutetun tutkimuslääkityksen mediaanikesto Votubiaa saaneilla potilailla oli 48,1 viikkoa (vaihteluväli: 2 ‑ 115) ja lumelääkettä saaneilla potilailla 45,0 viikkoa (vaihteluväli: 9 ‑ 115). Kumulatiivisen Votubia‑altistuksen (112 potilasta, jotka ottivat ainakin yhden everolimuusiannoksen) mediaanikesto oli 46,9 kuukautta (vaihteluväli: 0,5–63,9).
- EXIST‑1 (CRAD001M2301): Tutkimus oli satunnaistettu, kaksoissokkoutettu, kontrolloitu, vaiheen III tutkimus, jossa everolimuusia (n = 78) verrattiin lumelääkkeeseen (n = 39) TSC:tä ja siihen liittyvää SEGA:ta sairastavilla potilailla, potilaiden iästä riippumatta. Sokkoutetun tutkimuslääkehoidon keston mediaani oli 52,2 viikkoa (vaihteluväli: 24 ‑ 89) Votubia‑valmistetta saaneilla ja 46,6 viikkoa (vaihteluväli: 14 ‑ 88) lumelääkettä saaneilla. Kumulatiivisen Votubia‑altistuksen (111 potilasta, jotka ottivat ainakin yhden everolimuusiannoksen) mediaanikesto oli 47,1 kuukautta (vaihteluväli: 1,9–58,3).
- CRAD001C2485: Kyseessä oli prospektiivinen, avoin, yksihaarainen vaiheen II everolimuusitutkimus SEGA:ta sairastavilla potilailla (n = 28). Altistuksen keston mediaani oli 67,8 kuukautta (vaihteluväli 4,7 ‑ 83,2).
Alla kuvataan haittatapahtumat, joiden katsotaan liittyneen Votubian käyttöön (haittavaikutukset). Tiedot perustuvat kaikkien edellä mainituissa tutkimuksissa ilmoitettujen haittatapahtumien läpikäyntiin ja lääketieteelliseen arviointiin.
Yleisimmin ilmoitetut haittavaikutukset (esiintyvyys ≥ 1/10) yhdistetyistä turvallisuustiedoista ovat (vähenevässä järjestyksessä): suutulehdus, kuume, nenänielutulehdus, ripuli, ylähengitysteiden tulehdus, oksentelu, yskä, ihottuma, päänsärky, amenorrea, akne, keuhkokuume, virtsatieinfektio, sinuiitti, kuukautisten epäsäännöllisyys, nielutulehdus, ruokahalun heikkeneminen, uupumus, hyperkolesterolemia ja kohonnut verenpaine.
Yleisimmin ilmoitettuja, vaikeusasteen 3‑4 haittavaikutuksia (esiintymistiheys ≥ 1 %) olivat keuhkokuume, suutulehdus, amenorrea, neutropenia, kuume, kuukautisten epäsäännöllisyys, hypofosfatemia, ripuli ja selluliitti. Vaikeusasteet on määritelty haittavaikutusten yleisten toksisuuskriteerien (CTCAE) versioiden 3.0 ja 4.03 mukaan.
Taulukkomuotoinen luettelo haittavaikutuksista
Taulukossa 4 kuvataan kolmessa TSC‑tutkimuksessa everolimuusia saaneista potilaista yhdistettyjen tietojen perusteella lasketut haittavaikutusten ilmaantuvuudet (mukaan lukien sekä kaksoissokkoutettu vaihe että avoin jatkotutkimusvaihe aina, kun mahdollista). Haittavaikutukset on luokiteltu MedDRA‑elinjärjestelmäluokituksen mukaisesti. Esiintymistiheydet on määritelty seuraavasti: hyvin yleinen (≥1/10), yleinen (≥1/100, <1/10), melko harvinainen (≥1/1 000, <1/100), harvinainen (≥1/10 000, <1/1 000), hyvin harvinainen (<1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin). Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 4 TSC‑tutkimuksissa ilmoitetut haittavaikutukset
Infektiot | |
Hyvin yleiset | Nenänielutulehdus, ylähengitysteiden tulehdus, keuhkokuume a, virtsatieinfektio, sinuiitti, nielutulehdus |
Yleiset | Välikorvatulehdus, ihonalaisen kudoksen tulehdus, streptokokkien aiheuttama nielutulehdus, virusgastroenteriitti, ientulehdus |
Melko harvinaiset | Vyöruusu, sepsis,virusbronkiitti |
Veri ja imukudos | |
Yleiset | Anemia, neutropenia, leukopenia, trombosytopenia, lymfopenia |
Immuunijärjestelmä | |
Yleiset | Yliherkkyys |
Aineenvaihdunta ja ravitsemus | |
Hyvin yleiset | Ruokahalun heikkeneminen, hyperkolesterolemia |
Yleiset | Hypertriglyseridemia, hyperlipidemia, hypofosfatemia, hyperglykemia |
Psyykkiset häiriöt | |
Yleiset | Unettomuus, vihamielisyys, ärtyneisyys |
Hermosto | |
Hyvin yleiset | Päänsärky |
Melko harvinaiset | Makuhäiriö |
Verisuonisto | |
Hyvin yleiset | Kohonnut verenpaine |
Yleiset | Lymfedeema |
Hengityselimet, rintakehä ja välikarsina | |
Hyvin yleiset | Yskä |
Yleiset | Nenäverenvuoto, pneumoniitti |
Ruoansulatuselimistö | |
Hyvin yleiset | Suutulehdus b, ripuli, oksentelu |
Yleiset | Ummetus, pahoinvointi, vatsakivut, ilmavaivat, suukipu, gastriitti |
Iho ja ihonalainen kudos | |
Hyvin yleiset | Ihottuma c, akne |
Yleiset | Ihon kuivuus, aknea muistuttava ihotulehdus, kutina, hiustenlähtö |
Melko harvinaiset | Angioedeema |
Luusto, lihakset ja sidekudos | |
Melko harvinaiset | Rabdomyolyysi |
Munuaiset ja virtsatiet | |
Yleiset | Proteinuria |
Sukupuolielimet ja rinnat | |
Hyvin yleiset | Amenorrea d, epäsäännölliset kuukautiset d |
Yleiset | Runsas kuukautisvuoto, munasarjakysta, emätinverenvuoto |
Melko harvinaiset | Kuukautisten viivästyminen d |
Yleisoireet ja antopaikassa todettavat haitat | |
Hyvin yleiset | Kuume, väsymys |
Tutkimukset | |
Yleiset | Veren laktaattidehydrogenaasiarvon suureneminen luteinisoivan hormonin määrän lisääntyminen, painon lasku |
Melko harvinainen | Veren follikkeleita stimuloivan hormonin määrän lisääntyminen |
Vammat, myrkytykset ja hoitokomplikaatiot | |
Tuntematone | Sädereaktion uusiutumisoireyhtymä, sädereaktion voimistuminen |
a Kattaa pneumocystis jiroveci (carinii)‑keuhkokuumetapaukset (PJP, PCP) b Kattaa (hyvin yleinen) suutulehduksen, suun haavautumisen, aftoosisen haavauman; (yleinen) kielen haavautumisen, huulen haavautumisen ja (melko harvinainen) ienkivun, kielitulehduksen c Kattaa (hyvin yleinen) ihottuman, (yleinen) punoittavan ihottuman, punoituksen ja (melko harvinainen) yleistyneen ihottuman, makulopapulaarisen ihottuman, makulaarisen ihottuman d Yleisyysluokittelu perustuu hoidon aikana 10‑55 –vuotiaista naisista saatuihin yhdistettyihin tietoihin e Haittavaikutus havaittu markkinoille tulon jälkeen. | |
Tiettyjen haittavaikutusten tarkemmat kuvaukset
Kliinisissä tutkimuksissa everolimuusin käyttöön on liittynyt vakavaa hepatiitti B‑viruksen uudelleenaktivoitumista, myös kuolemaan johtaneita tapauksia. Immunosuppression aikana infektion uudelleen aktivoituminen on odotettu reaktio.
Sekä kliinisissä tutkimuksissa että spontaaneissa haittatapahtumaraporteissa everolimuusi on yhdistetty munuaisten vajaatoimintatapauksiin (kuolemaan johtavia tapauksia mukaan lukien), proteinuriaan ja seerumin kreatiniiniarvojen suurentumiseen. Munuaistoiminnan seuraamista on suositeltavaa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Kliinisissä tutkimuksissa everolimuusiin on liittynyt verenvuototapahtumia. Harvoissa tapauksissa nämä ovat syöpäpotilaiden osalta johtaneet kuolemaan (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Vakavia munuaisten verenvuototapahtumia ei ole raportoitu TSC:n hoidossa.
Kliinisissä tutkimuksissa ja markkinoille tulon jälkeisissä spontaaneissa haittavaikutusraporteissa everolimuusin käyttöön on liittynyt pneumocystis jiroveci (carinii)‑keuhkokuumetta (PJP, PCP), jotkut kuolemaan johtavia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Muita merkityksellisiä onkologisissa kliinisissä tutkimuksissa ja spontaaneissa haittatapahtumaraporteissa todettuja haittavaikutuksia olivat sydämen vajaatoiminta, keuhkoembolia, syvä laskimotukos, heikentynyt haavan paraneminen ja hyperglykemia.
Kliinisissä tutkimuksissa ja markkinoille tulon jälkeen kertyneissä spontaaniraporteissa on ilmoitettu angioedeemaa sekä samanaikaisen ACE:n estäjien käytön yhteydessä että ilman näiden lääkkeiden samanaikaista käyttöä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
Pediatriset potilaat
Vaiheen II pivotaalitutkimukseen osallistuneista SEGA‑potilaista 22 potilasta 28:sta olivat alle 18‑vuotiaita. Vaiheen III pivotaalitutkimuksessa 101 SEGA‑potilasta 117:sta tutkitusta oli alle 18‑vuotiaita. TSC‑potilaiden vaikeahoitoisten epilepsiakohtausten hoitoa koskeneessa vaiheen III pivotaalitutkimuksessa 299 potilasta 366:sta oli alle 18‑vuotiaita. Kaiken kaikkiaan lapsilla ja nuorilla ilmaantuvien haittavaikutusreaktioiden laatu, frekvenssi ja vakavuusaste on yleensä vastannut aikuisilla todettua, lukuun ottamatta infektioita, joita raportoitiin useammin ja vakavuusasteeltaan vakavampia alle 6‑vuotiailla lapsilla. Alle 6‑vuotiaista potilaista kaiken kaikkiaan 49 potilaalla 137 potilaasta (36 %) raportoitiin vaikeusasteen 3‑4 infektioita. Vastaavasti 6‑<18‑vuotiaista potilaista 53 potilaalla 272 potilaasta (19 %) ja yli 18‑vuotiaista potilaista 27 potilaalla 203 potilaasta (13 %) raportoitiin vaikeusasteen 3‑4 infektioita. Kaksi kuolemaan johtanutta infektiota raportoitiin 409 potilaan joukossa alle 18‑vuotiaita everolimuusihoitoa saavia potilaita.
Iäkkäät
Onkologian yhdistettyjen turvallisuustietojen mukaan 37 % everolimuusilla hoidetuista potilaista oli ≥65‑vuotiaita. Niiden onkologiapotilaiden lukumäärä, jotka keskeyttivät everolimuusi‑hoidon haittavaikutusten vuoksi oli suurempi potilailla, jotka olivat ≥65‑vuotiaita (20 % vs. 13 %). Yleisimmät hoidon keskeytymiseen johtaneet haittavaikutukset olivat pneumoniitti (interstitiaalinen keuhkosairaus mukaan lukien), väsymys, hengitysvaikeudet, ja suutulehdus.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista kansallisen ilmoitusjärjestelmän kautta.
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Ihmisillä ilmoitettuja yliannostustapauksia on hyvin vähän. Aikuispopulaatiossa akuutti siedettävyys on ollut hyväksyttävää enintään 70 mg kerta‑annoksia annettaessa.
Kun epäillään yliannostusta, on tärkeää määrittää everolimuusin pitoisuus veressä. Kaikissa yliannostustapauksissa pitää ryhtyä tavanomaisiin tukitoimiin. Dialyysi ei poista everolimuusia merkityksellisessä märin (alle 10 % poistui 6 tuntia kestäneen hemodialyysin aikana).
Pediatriset potilaat
Pieni määrä lapsipotilaita on altistunut yli 10 mg/m2/vrk annoksille. Näissä tapauksissa ei ole ilmoitettu akuutin toksisuuden merkkejä.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Solunsalpaajat, proteiinikinaasin estäjät, ATC‑koodi: L01EG02
Vaikutusmekanismi
Everolimuusi on selektiivinen mTOR‑estäjä (nisäkkään rapamysiinin kohde). mTOR on solun toiminnan kannalta keskeinen seriini‑treoniini‑kinaasi, jonka toiminnan tiedetään olevan yliaktiivista monissa ihmisen syövissä. Everolimuusi sitoutuu solunsisäiseen FKBP‑12‑proteiiniin ja muodostaa mTOR 1:n toimintaa estävän kompleksin (mTORC1:n). mTORC1‑signalointireitin estyminen häiritsee translaatiota ja proteiinisynteesiä vähentämällä ribosomaalisen S6‑proteiinikinaasin (S6K1) ja eukaryoottien elongaatiotekijä 4E:tä sitovan proteiinin (4EBP‑1) toimintaa. Molemmat proteiinit säätelevät solusykliin, angiogeneesiin ja glykolyysiin osallistuvien proteiinien toimintaa. Everolimuusi voi pienentää verisuoniendoteelin kasvutekijän (VEGF) pitoisuuksia. Tuberoosiskleroosipotilailla everolimuusihoito suurentaa VEGF‑A‑pitoisuuksia ja pienentää VEGF‑D‑pitoisuuksia. Everolimuusi estää tehokkaasti kasvainsolujen, endoteelisolujen, fibroblastien ja verisuonten sileiden lihassolujen kasvua ja jakautumista, ja sen on osoitettu vähentävän kiinteissä kasvaimissa tapahtuvaa glykolyysiä in vitro ja in vivo.
Syöpäkasvaimia ehkäisevien kasvurajoitegeenien tuberiini‑skleroosikompleksit 1 ja 2 (TSC1, TSC2) ovat mTORC1:n signaloinnin kaksi keskeisintä säätelijää. TSC1:n tai TSC2:n toiminnan heikentyminen johtaa mTORC1‑kompleksin aktivoitumiseen vaikuttaviin Ras‑GTPaaseihin kuuluvan Rheb‑GTP:n pitoisuuden suurenemiseen. mTORC1:n aktivoituminen johtaa alavirran puoleisen signalointikaskadin aktivoitumiseen, mukaan lukien S6‑kinaasit. TSC‑oireyhtymässä TSC1‑ tai TSC2‑geenin inaktivoivat mutaatiot johtavat hamartoomien muodostumiseen kaikkialla kehossa. Aivokudoksen patologiset muutokset (kuten aivokuoren tubermuutokset) voivat aiheuttaa epilepsiakohtauksia. mTOR‑reitin katsotaan osallistuvan myös TSC‑potilaiden epilepsian patogeneesiin. mTOR säätelee proteiinisynteesiä ja useita alavirran puoleisia solujen toimintoja, jotka saattavat vaikuttaa neuronien ärsytyskynnykseen ja epileptogeneesiin. mTOR:n yliaktivaatio johtaa neuronien dysplasiaan, aksonogeneesin ja dendriittimuodostuksen poikkeavuuksiin, suurentuneisiin eksitatorisiin synapsivirtoihin, vähäisempään myelinaatioon ja kortikaalisen laminaarirakenteen häiriintymiseen, mikä aiheuttaa neuronien kehityksen ja toiminnan poikkeavuuksia. Aivojen mTOR‑dysregulaatiomallien prekliinisissä tutkimuksissa todettiin, että mTOR:n estäjähoito kuten everolimuusi voi pidentää elossaoloaikaa, vähentää epilepsiakohtauksia, estää uusien kohtausten puhkeamista ja estää ennenaikaisia kuolemia. Kokonaisuutena ajatellen everolimuusi on erittäin tehokas tässä TSC:n neuronaalisessa mallissa, ja sen hyödyt johtuvat oletettavasti mTORC1:n estoon kohdistuvista vaikutuksista. Tarkkaa vaikutusmekanismia, jolla lääke vähentää TSC:hen liittyviä epilepsiakohtauksia, ei kuitenkaan tunneta täysin.
Kliininen teho ja turvallisuus
Vaiheen III tutkimus TSC‑potilailla, joilla oli vaikeahoitoisia epilepsiakohtauksia
EXIST‑3 (CRAD001M2304‑tutkimus) oli satunnaistettu, kaksoissokkoutettu, kolmiryhmäinen, rinnakkaisryhmissä toteutettu vaiheen III monikeskustutkimus, jossa Votubia‑hoitoa verrattiin lumelääkkeeseen lisälääkehoitona TSC‑potilailla, joilla oli vaikeahoitoisia paikallisalkuisia epilepsiakohtauksia. Kyseisessä tutkimuksessa paikallisalkuiset kohtaukset määriteltiin kaikiksi elektroenkefalografialla (EEG) vahvistetuiksi sensorisiksi kohtauksiksi tai motorisiksi kohtauksiksi, joiden kohdalla aiemmassa EEG‑tutkimuksessa ei ollut todettu primaarista yleistymistä. Potilaat käyttivät ennen tutkimukseenottoa samanaikaisesti 1–3 epilepsialääkettä vakaina annoksina. Tutkimukseen kuului 3 vaihetta: 8 viikon havainnoiva lähtötasovaihe, 18 viikon kaksoissokkoutettu, lumelääkekontrolloitu päähoitovaihe (johon kuului titraus‑ ja ylläpito‑osat), vähintään 48 viikkoa kestävä jatkovaihe, jossa kaikki tutkittavat saivat Votubiaa ja korkeintaan 48 viikkoa kestävä jatkovaiheen jälkeinen vaihe, jossa kaikki tutkittavat saivat Votubiaa.
Tutkimuksessa testattiin toisistaan riippumatta kahta erilaista ensisijaista päätetapahtumaa: 1) vasteprosentti, kun vasteen määritelmänä oli paikallisalkuisten epilepsiakohtausten frekvenssin pieneneminen vähintään 50 % lähtötilanteesta tutkimuksen päähoitovaiheen ylläpito‑osassa, ja 2) paikallisalkuisten epilepsiakohtausten frekvenssin prosentuaalinen pienenemä lähtötilanteesta päähoitovaiheen ylläpito‑osassa.
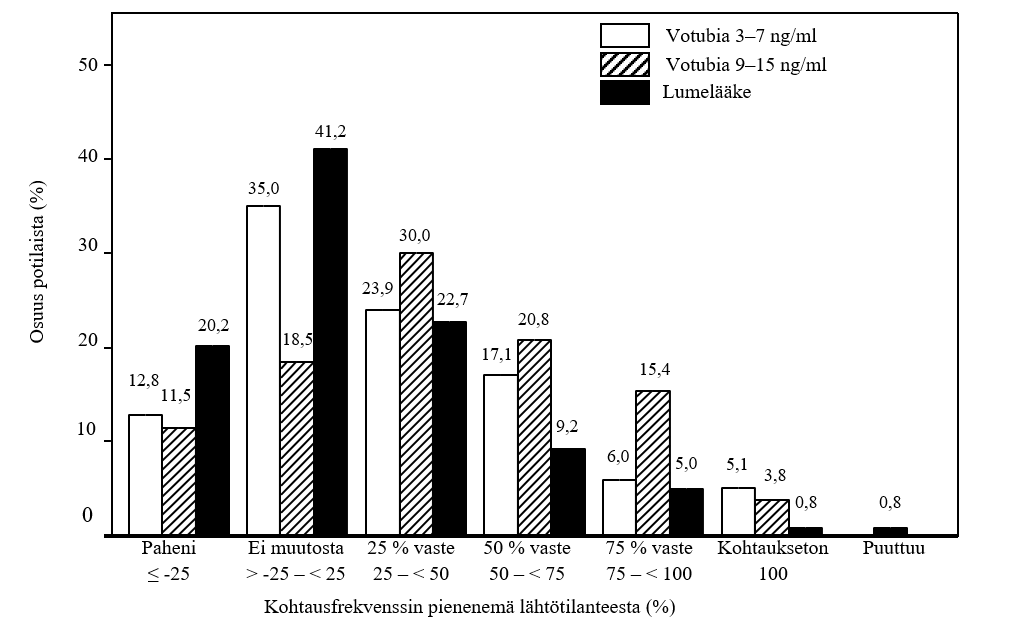
Toissijaisia päätetapahtumia olivat kohtauksettomuus, niiden potilaiden osuus, joilla kohtausfrekvenssi pieneni > 25 % lähtötilanteesta, lähtötilanteesta tapahtuneen kohtausfrekvenssin pienenemän jakauma (luokat: kohtausfrekvenssin pienenemä ≤ ‑25 %, > ‑25 % – < 25 %; ≥ 25 % – < 50 %; ≥ 50 % – < 75 %; ≥ 75 % – < 100 %; 100 %), kohtausfrekvenssin pitkäaikaisarviointi ja yleinen elämänlaatu.
Yhteensä 366 potilasta satunnaistettiin suhteessa 1:1,09:1 saamaan Votubia‑hoitoa pienin minimipitoisuuksin (LT; n = 117, vaihteluväli 3–7 ng/ml), Votubia‑hoitoa suurin minimipitoisuuksin (HT; n = 130, vaihteluväli 9–15 ng/ml) tai lumelääkehoitoa (n = 119). Koko populaation mediaani‑ikä oli 10,1 vuotta (vaihteluväli 2,2‑56,3; 28,4 % < 6–vuotiaita, 30,9 % 6 – < 12–vuotiaita, 22,4 % 12 – <18–vuotiaita ja 18,3 % > 18–vuotiaita). Päähoitovaiheessa hoidon mediaanikesto oli kaikissa kolmessa ryhmässä 18 viikkoa ja 90 viikkoa (21 kuukautta), kun otetaan huomioon pää‑ ja jatkohoitovaiheet.
Lähtötilanteessa 19,4 %:lla potilaista oli paikallisalkuisia epilepsiakohtauksia, joissa tajunta säilyi (sensorisia kohtauksia, jotka oli vahvistettu aiemmin EEG‑tutkimuksella, tai motorisia kohtauksia), 45,1 %:lla oli paikallisalkuisia epilepsiakohtauksia, joissa tajunta heikkeni (lähinnä ei‑motorisia kohtauksia), 69,1 %:lla oli paikallisalkuisia motorisia epilepsiakohtauksia (eli paikallisalkuisia motorisia kohtauksia, joissa tajunta häiriytyi, ja/tai toissijaisesti yleistyneitä epilepsiakohtauksia) ja 1,6 %:lla oli primaarisesti yleistyneitä epilepsiakohtauksia (jotka oli vahvistettu aiemmin EEG‑tutkimuksella). Kohtausfrekvenssin mediaani lähtötilanteessa oli Votubia LT‑ryhmässä 35 kohtausta, Votubia HT‑ryhmässä 38 kohtausta ja lumelääkeryhmässä 42 kohtausta 28 vuorokautta kohti. Useimmilla potilailla (67 %) vähintään 5 epilepsialääkehoitoa oli epäonnistunut ennen tutkimusta, ja 41,0 % käytti tutkimuksen aikana 2 epilepsialääkettä ja 47,8 % vähintään 3 epilepsialääkettä. Lähtötilanteen tiedot viittasivat siihen, että 6‑18‑vuotiailla potilailla oli lievää tai keskivaikeaa älyllistä kehitysvammaisuutta (60‑70 pistettä Adaptive Behavior ‑asteikon yhteispisteissä ja Communication‑, Daily Living Skills‑ ja Socialization‑osa‑alueilla).
Ensisijaisen päätetapahtuman tehotulosten yhteenveto esitetään taulukossa 5.
Taulukko 5 EXIST‑3 – Kohtausfrekvenssivasteen vasteprosentti (ensisijainen päätetapahtuma)
Votubia | Lumelääke | ||
LT, tavoitealue 3‑7 ng/ml | HT, tavoitealue 9‑15 ng/ml | ||
Tilastotieto | N = 117 | N = 130 | N = 119 |
Vasteen saavuttaneet – n (%) | 33 (28,2) | 52 (40,0) | 18 (15,1) |
Vasteprosentin 95 % lv a | 20,3; 37,3 | 31,5; 49,0 | 9,2; 22,8 |
Vetosuhde (vs. lumelääke) b | 2,21 | 3,93 | |
95 % lv | 1,16; 4,20 | 2,10; 7,32 | |
p‑arvo (vs. lumelääke) c | 0,008 | < 0,001 | |
Tilastollisesti merkitsevä Bonferroni–Holm‑menettelyllä arvioituna d | Kyllä | Kyllä | |
Ei vastetta – n (%) | 84 (71,8) | 78 (60,0) | 101 (84,9) |
a Eksakti 95 % lv Clopper–Pearson‑menetelmällä b Vetosuhde ja sen 95 % lv laskettiin logistisella regressiolla ikäryhmien mukaan stratifioituna. Vetosuhde > 1 tarkoittaa, että everolimuusiryhmän tulokset olivat paremmat. c p‑arvot laskettiin Cochran–Mantel–Haenszel‑testillä ikäryhmien mukaan stratifioituna d FWER (family‑wise error rate) 2,5 %, yksitahoinen | |||
Supportiivisessa analyysissä todettiin kohtausfrekvenssin (toinen ensisijainen päätetapahtuma) vähentyneen johdonmukaisesti lähtötilanteeseen nähden (mediaani, %): 29,3 % (95 % lv: 18,8; 41,9) Votubia LT ‑ryhmässä, 39,6 % (95 % lv: 35,0; 48,7) Votubia HT ‑ryhmässä ja 14,9 % (95 % lv: 0,1; 21,7) lumelääkeryhmässä. P‑arvot paremmuudelle lumelääkkeeseen nähden olivat 0,003 (LT) ja < 0,001 (HT).
Kohtauksettomuusosuus (niiden potilaiden osuus, jotka tulivat päähoitovaiheen ylläpito‑osan aikana kohtauksettomiksi) oli 5,1 % (95 % lv: 1,9; 10,8) Votubia LT ‑ryhmässä, 3,8 % (95 % lv: 1,3; 8,7) Votubia HT ‑ryhmässä ja 0,8 % (95 % lv: 0,0; 4,6) lumelääkeryhmässä.
Votubia LT‑ ja Votubia HT ‑ryhmissä vasteen saavuttaneiden osuus oli kaikissa vasteluokissa suurempi kuin lumelääkeryhmässä (kuva 1). Lisäksi kohtausten pahenemista todettiin lumelääkeryhmässä lähes kaksi kertaa niin usein kuin Votubia LT‑ ja Votubia HT ‑ryhmissä.
Kuva 1 EXIST‑3 – Kohtausfrekvenssin pienenemä lähtötilanteesta, jakauma
Everolimuusilla todettiin olevan homogeeninen, johdonmukainen vaikutus kaikissa ensisijaisten tehon päätetapahtumien suhteen arvioiduissa alaryhmissä, joiden määrittelyperusteena olivat ikäryhmä (taulukko 6), sukupuoli, rotu ja etninen tausta, kohtaustyypit, kohtausfrekvenssi lähtötilanteessa, samanaikaisten epilepsialääkitysten määrä ja nimet sekä TSC:n piirteet (angiomyolipooma, SEGA ja aivokuoren tubermuutokset). Everolimuusin vaikutusta infantiilispasmeihin / epileptisiin spasmeihin tai Lennox–Gastaut’n oireyhtymään liittyviin epilepsiakohtauksiin ei ole arvioitu, eikä lääkkeen vaikutusta ole vahvistettu primaarisesti yleistyneiden epilepsiakohtausten hoidossa eikä potilailla, joilla ei ole aivokuoren tubermuutoksia.
Taulukko 6 EXIST‑3 – Kohtausfrekvenssivasteen vasteprosentti ikäryhmittäin
Votubia | Lumelääke | ||
LT, tavoitealue 3‑7 ng/ml | HT, tavoitealue 9‑15 ng/ml | ||
Ikäryhmä | N = 117 | N = 130 | N = 119 |
< 6 v | n = 33 | n = 37 | n = 34 |
Vasteprosentti (95 % lv) a | 30,3 (15,6; 48,7) | 59,5 (42,1; 75,2) | 17,6 (6,8; 34,5) |
6 – < 12 v | n = 37 | n = 39 | n = 37 |
Vasteprosentti (95 % lv) a | 29,7 (15,9; 47,0) | 28,2 (15,0; 44,9) | 10,8 (3,0; 25,4) |
12 – < 18 v | n = 26 | n = 31 | n = 25 |
Vasteprosentti (95 % lv) a | 23,1 (9,0; 43,6) | 32,3 (16,7; 51,4) | 16,0 (4,5; 36,1) |
≥ 18 vb | n = 21 | n = 23 | n = 23 |
Vasteprosentti (95 % lv) a | 28,6 (11,3; 52,2) | 39,1 (19,7; 61,5) | 17,4 (5,0; 38,8) |
a Eksakti 95 % lv Clopper–Pearson‑menetelmällä b Iäkkäistä potilaista ei ole saatavilla tehotietoja | |||
Päähoitovaiheen lopussa 2 – < 11‑vuotiaiden potilaiden yleinen elämänlaatu (jonka mittarina toimi Childhood Epilepsy Questionnaire ‑kyselyn yleisen elämänlaadun kokonaispisteiden [QOLCE‑pisteiden] keskimuutos lähtötilanteesta) oli säilynyt sekä kussakin Votubia‑hoitoryhmässä että lumelääkeryhmässä.
Kohtausfrekvenssin pienenemä säilyi noin 2 vuoden arviointiajanjakson ajan. Herkkyysanalyysin perusteella, jossa otettiin huomioon potilaat, jotka lopettivat everolimuusihoidon ennenaikaisesti huonon vasteen vuoksi, vasteosuudet olivat vuoden everolimuusialtistuksen jälkeen 38,4 % (95 % lv: 33,4;43,7) ja kahden vuoden everolimuusialtistuksen jälkeen 44,4 % (95 % lv: 38,2;50,7).
Vaiheen III tutkimus SEGA‑potilailla
EXIST‑1 (tutkimus CRAD001M2301) oli satunnaistettu, kaksoissokkoutettu vaiheen III monikeskustutkimus, jossa Votubiaa ja lumelääkettä verrattiin. Siihen otettiin SEGA‑potilaita iästä riippumatta. Potilaat satunnaistettiin 2:1 suhteessa saamaan joko Votubiaa tai vastaavaa lumelääkettä. Tutkimukseen osallistumiseksi vaadittiin vähintään yksi magneettikuvauksessa havaittu, pisimmältä läpimitaltaan ≥1,0 cm oleva SEGA‑leesio (perustuen paikalliseen radiologiseen arviointiin). Lisäksi vaadittiin eri ajankohtina otettua radiologista näyttöä SEGA:n kasvusta, uuden pisimmältä läpimitaltaan ≥1,0 cm olevan SEGA‑leesion ilmaantumisesta tai hydrokefalian kehittymisestä tai pahenemisesta.
Primääri tehopäätetapahtuma oli SEGA‑vasteprosentti, joka perustui itsenäiseen keskitettyyn radiologiseen arviointiin. Analyysi stratifioitiin alaryhmiin sen mukaan, käyttikö potilas satunnaistamisvaiheessa entsyymejä indusoivia epilepsialääkkeitä (kyllä/ei).
Keskeisiä sekundääripäätetapahtumia olivat hierarkkisessa testausjärjestyksessä absoluuttinen muutos kaikkien 24 tunnin EEG:ssä havaittujen kouristustapahtumien esiintymistiheydessä lähtötasosta viikkoon 24 mennessä sekä aika SEGA‑leesion etenemiseen ja iholeesioiden vasteprosentti.
Kokonaisuudessaan satunnaistettiin 117 potilasta, joista 78 sai Votubiaa ja 39 lumelääkettä. Tutkimushaarat olivat yleisesti hyvin tasapainossa demografisten tietojen, lähtötason tautitietojen ja aiempien SEGA‑hoitojen suhteen. Koko potilaspopulaatiosta 57,3 % oli miespuolisia ja 93,2 % valkoihoisia. Mediaani‑ikä tutkimuspopulaatiossa oli 9,5 vuotta (Votubia‑haaran väli: 1,0‑23,9; lumelääkehaaran väli: 0,8‑26,6) 69,2 % potilaista oli 3‑<18 –vuotiaita tutkimukseenottohetkellä; 17,1 % oli <3‑vuotiaita tutkimukseenottohetkellä).
Tutkimukseen otetuista potilaista 79,5 %:lla oli molemminpuolinen SEGA, 42,7 %:lla oli ≥2 kohde‑SEGA‑leesiota, 25,6 %:lla kasvua aivokammion alapinnalle, 9,4 %:lla oli näyttöä syvästä parenkymaalisesta invaasiosta; 6,8 %:lla oli radiologista näyttöä hydrokefaliasta ja 6,8 %:lle oli tehty aiemmin SEGA:han liittyvä kirurginen toimenpide. 94,0 %:lla potilaista oli iholeesioita lähtö‑tilanteessa ja 37,6 %:lla oli munuaisissa kohdeangiomyolipoomaleesioita (vähintään yksi angiomyolipooma pisimmältä läpimitaltaan ≥1 cm).
Sokkoutetun hoidon mediaanipituus oli Votubia‑ryhmässä 9,6 kuukautta (väli: 5,5‑18,1) ja lumeryhmässä 8,3 kuukautta (väli: 3,2‑18,3).
Tulokset osoittivat, että Votubia oli parempi kuin lumelääke primääripäätetapahtuman eli parhaan SEGA‑kokonaisvasteen suhteen (p < 0,0001). Vasteprosentti oli Votubia‑ryhmässä 34,6 % (95 % luottamusväli [lv] 24,2; 46,2) ja lumeryhmässä 0 % (95 % lv 0,0; 9,0) (Taulukko 7). Lisäksi aivokammiotilavuus pieneni kaikilla Votubia‑ryhmän 8 potilaalla, joilla oli lähtötilanteessa radiologista näyttöä hydrokefaliasta.
Potilaat, jotka saivat aluksi lumevalmistetta, saivat vaihtaa everolimuusihoitoon, kun SEGA eteni ja kun todettiin, että everolimuusihoito oli parempi kuin lumevalmiste. Kaikkia vähintään yhden annoksen everolimuusia saaneita potilaita seurattiin, kunnes lääkevalmisteen käyttö lopetettiin tai potilaat olivat olleet mukana tutkimuksen loppuun. Lopullisen analyysin hetkellä kaikkien tällaisten potilaiden altistuksen keston mediaani oli 204,9 viikkoa (vaihteluväli 8,1 ‑ 253,7). Lopullisessa analyysissä paras SEGA‑kokonaisvaste oli suurentunut 57,7 %:iin (95 % lv: 47,9; 67,0).
Yksikään potilaista ei tarvinnut kirurgisia toimenpiteitä SEGA:n vuoksi koko tutkimuksen aikana.
Taulukko 7 EXIST‑1 – SEGA vaste
Primäärianalyysi3 | Lopullinen analyysi4 | |||
Votubia | Lume | p‑arvo | Votubia | |
n = 78 | n = 39 | n = 111 | ||
SEGA‑vasteprosentti1,2 ‑ (%) | 34,6 | 0 | < 0,0001 | 57,7 |
95 % luottamusväli | 24,2; 46,2 | 0,0; 9,0 | 47,9; 67,0 | |
Paras SEGA‑kokonaisvaste ‑ (%) | ||||
Vaste | 34,6 | 0 | 57,7 | |
Eteneminen pysähtynyt | 62,8 | 92,3 | 39,6 | |
Tauti eteni | 0 | 7,7 | 0 | |
Ei arvioitavissa | 2,6 | 0 | 2,7 | |
1 itsenäisen keskitetyn radiologisen arvioinnin mukaan 2 SEGA‑vaste vahvistettiin toistetuilla kuvauksilla. Vasteen määritelmä oli seuraava: ≥50 % pienenemä SEGA‑leesioiden yhteistilavuudessa suhteessa lähtötilanteeseen, ei yksiselitteistä pahenemista muissa kuin kohde‑SEGA‑leesioissa, ei uusia pisimmältä läpimitaltaan ≥1 cm kokoisia SEGA‑leesioita, ei hydrokefalian kehittymistä eikä pahenemista 3 Primäärianalyysi kaksoissokkoutetusta jaksosta 4 Lopullinen analyysi sisältää potilaat, jotka siirtyivät lumeryhmästä; everolimuusialtistuksen keston mediaani oli 204,9 viikkoa | ||||
Hoitovaikutukset olivat johdonmukaiset kaikissa arvioiduissa alaryhmissä (eli entsyymejä indusoiva epilepsialääke käytössä / ei käytössä, sukupuoli ja ikä) primäärianalyysin hetkellä.
Kaksoissokkoutetun jakson aikana SEGA:n tilavuuden pienentyminen oli ilmeistä ensimmäisten 12 viikon Votubia‑hoidon aikana: 29,7 %:lla (22/74) tilavuus pieneni ≥ 50 % ja 73,0 %:lla (54/74) potilaista tilavuus pieneni ≥30 %. Tilavuus pysyi pienentyneenä viikolle 24, jolloin 41,9 %:lla (31/74) potilaista tilavuus oli pienentynyt ≥ 50 % ja tilavuus oli pienentynyt ≥ 30 prosenttia 78,4 %:lla (58/74).
Tutkimuksessa everolimuusia saaneilla potilailla (n = 111), lumeryhmästä siirtyneet mukaan lukien, jo 12 viikkoa everolimuusihoidon aloittamisesta alkanut kasvainvaste oli säilynyt myöhempinä tarkasteluajankohtina. Niiden potilaiden osuus, joiden SEGA:n tilavuus oli pienentynyt vähintään 50 %, oli 45,9 % (45/98) 96 viikkoa ja 62,1 % (41/66) 192 viikkoa everolimuusihoidon aloittamisesta. Myös niiden potilaiden osuus, joiden SEGA:n tilavuus pieneni vähintään 30 %, oli 71,4 % (70/98) 96 viikkoa ja 77,3 % (51/66) 192 viikkoa everolimuusihoidon aloittamisesta.
Ensimmäisen keskeisen sekundääripäätetapahtuman eli kouristuskohtausten esiintymistiheyden muutoksen analyysistä ei voitu tehdä johtopäätöksiä. Seuraavista kahdesta sekundääripäätetapahtumasta (aika SEGA:n etenemiseen ja iholeesioiden vasteprosentti) saatiin positiiviset tulokset, mutta niitä ei tästä syystä pystytty muodollisesti luokittelemaan tilastollisesti merkitseviksi.
Mediaaniaikaa SEGA‑leesioiden etenemiseen itsenäisen keskitetyn radiologisen arvion mukaan ei saavutettu kummassakaan hoitoryhmässä. Etenemistä havaittiin ainoastaan lumeryhmässä (15,4 %; p = 0,0002). Etenemisvapaiden potilaiden arvioitu osuus oli 6 kuukauden kohdalla 100 % Votubia‑ryhmässä ja 85,7 % lumeryhmässä. Kestäviä vasteita todettiin everolimuusiryhmään satunnaistettujen ja lumeryhmään satunnaistettujen myöhemmin everolimuusiin siirtyneiden potilaiden pitkäaikaisseurannassa.
Primäärianalyysin hetkellä todettiin, että Votubia paransi kliinisesti merkitsevästi iholeesioiden vastetta (p = 0,0004). Vasteprosentti oli Votubia‑ryhmässä 41,7 % (95 % lv 30,2; 53,9) ja lumeryhmässä 10,5 % (95 % lv 2,9; 24,8). Lopullisessa analyysissä iholeesioiden vasteluku oli suurentunut 58,1 %:iin (95 % lv: 48,1; 67,7).
Vaiheen II tutkimus SEGA‑potilailla
Votubian turvallisuuden ja tehon arvioimiseksi SEGA‑potilailla toteutettiin prospektiivinen, avoin, yksihaarainen vaiheen II tutkimus (CRAD001C2485). Tutkimuksen mukaanottokriteerinä oli radiologisesti todennettu etenevä SEGA.
Keskitetysti riippumattoman radiologin arvioima muutos SEGA:n tilavuudessa 6 kuukauden varsinaisen hoitoajan kuluessa oli tutkimuksen ensisijainen vastemuuttuja. Kun tutkimuksen varsinainen hoitovaihe päättyi, potilaat voivat siirtyä tutkimuksen jatkovaiheeseen, jossa SEGA:n tilavuutta arvioitiin 6 kuukauden välein.
Yhteensä 28 potilasta sai Votubia‑hoitoa. Potilaiden mediaani‑ikä oli 11 vuotta (vaihteluväli 3‑34), potilaista 61 % oli miehiä ja 86 % oli valkoihoisia. Kolmellatoista potilaalla (46 %) oli sekundaarinen pienempi SEGA, joista 12 sijaitsi kontralateraalisessa aivokammiossa.
Primaarinen SEGA:n tilavuus pieneni 6 kuukauden kohdalla verrattuna lähtötasoon (p < 0,001 [ks. Taulukko 8]). Potilaille ei kehittynyt uusia leesiota, hydrokefalian pahentumista tai lisääntynyttä kallonsisäistä painetta eikä kukaan tarvinnut kirurgista resektiota tai muuta SEGA‑hoitoa.
Taulukko 8 Muutokset primaarisen SEGA:n tilavuudessa ajan kuluessa
SEGA‑tilavuus (cm3) | Itsenäinen keskitetty arvio | ||||||||
Lähtötilanne n = 28 | 6 kk n = 27 | 12 kk n = 26 | 24 kk n = 24 | 36 kk n = 23 | 48 kk n = 24 | 60 kk n = 23 | |||
Primäärikasvaintilavuus | |||||||||
Keskiarvo (keskihajonta) | 2,45 (2,813) | 1,33 (1,497) | 1,26 (1,526) | 1,19 (1,042) | 1,26 (1,298) | 1,16 (0,961) | 1,24 (0,959) | ||
Mediaani | 1,74 | 0,93 | 0,84 | 0,94 | 1,12 | 1,02 | 1,17 | ||
väli | 0,49 – 14,23 | 0,31 – 7,98 | 0,29 – 8,18 | 0,20 – 4,63 | 0,22 – 6,52 | 0,18 – 4,19 | 0,21 – 4,39 | ||
Pieneneminen lähtötilanteesta | |||||||||
Keskiarvo (keskihajonta) | 1,19 (1,433) | 1,07 (1,276) | 1,25 (1,994) | 1,41 (1,814) | 1,43 (2,267) | 1,44 (2,230) | |||
Mediaani | 0,83 | 0,85 | 0,71 | 0,71 | 0,83 | 0,50 | |||
väli | 0,06 – 6,25 | 0,02 – 6,05 | ‑0,55 – 9,60 | 0,15 – 7,71 | 0,00 – 10,96 | ‑0,74 – 9,84 | |||
Prosentuaalinen pieneneminen lähtötilanteesta, n (%) | |||||||||
≥ 50 % | 9 (33,3) | 9 (34,6) | 12 (50,0) | 10 (43,5) | 14 (58,3) | 12 (52,2) | |||
≥ 30 % | 21 (77,8) | 20 (76,9) | 19 (79,2) | 18 (78,3) | 19 (79,2) | 14 (60,9) | |||
> 0 % | 27 (100,0) | 26 (100,0) | 23 (95,8) | 23 (100,0) | 23 (95,8) | 21 (91,3) | |||
Ei muutosta | 0 | 0 | 0 | 0 | 1 (4,2) | 0 | |||
Kasvu | 0 | 0 | 1 (4,2) | 0 | 0 | 2 (8,7) | |||
Seuraavat seikat tukivat primaarianalyysin vahvuutta ja johdonmukaisuutta:
- muutos primaarin SEGA:n tilavuudessa paikallisen tutkijalääkärin arvion mukaan (p < 0,001); 75 %:lla potilaista kasvain pieneni ≥30 % ja 39,3 %:lla ≥50 %.
- muutos SEGA:n kokonaistilavuudessa keskitetyn riippumattoman arvioijan (p < 0,001) tai paikallisen tutkijalääkärin (p < 0,001) mukaan.
Yhden potilaan kohdalla saavutettiin ennalta määritelty hoidon onnistumisen kriteeri (SEGA:n tilavuuden pieneneminen >75 %) ja tutkimuslääkehoito keskeytettiin väliaikaisesti, mutta SEGA alkoi kasvaa uudelleen seuraavalla arvioinnilla 4,5 kuukauden kohdalla ja hoito aloitettiin uudelleen.
Pitkäaikaisseuranta, jonka mediaani oli 67,8 kk (väli: 4,7–83,2), osoitti tehon säilyvän pitkäaikaisesti.
Muut tutkimukset
Votubia‑hoitoa saavilla potilailla suutulehdus on yleisimmin raportoitu haittavaikutus (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset). Myyntiluvan myöntämisen jälkeisessä, yksihaaraisessa tutkimuksessa postmenopausaalisille, edennyttä rintasyöpää sairastaville potilaille (N=92) annettiin paikallishoitona alkoholitonta deksametasoni‑oraaliliuosta 0,5 mg/5 ml suuvetenä (4 kertaa päivässä ensimmäisten 8 hoitoviikon aikana) vähentämään suutulehduksen esiintyvyyttä ja vaikeusastetta. Samanaikaisesti potilaille aloitettiin Afinitor‑hoito (everolimuusi, 10 mg/vrk) yhdessä eksemestaanin (25 mg/vrk) kanssa. Vaikeusasteen ≥ 2 suutulehduksen esiintyvyys oli viikon 8 kohdalla 2,4 % (n=2/85 arvioitavista potilaista), joka on vähemmän kuin historiallisesti on raportoitu. Vaikeusasteen 1 suutulehduksen esiintyvyys oli 18,8 % (n=16/85), eikä vaikeusasteen 3 tai 4 suutulehduksia raportoitu. Kokonaisuudessaan tutkimuksen turvallisuusprofiili oli yhdenmukainen everolimuusin aikaisemmin havaitun turvallisuustiedon kanssa (ml. onkologiset ja tuberoosiskleroosiin liittyvät indikaatiot). Poikkeuksena oli suun kandidiaasi, jonka esiintyvyys oli hieman korkeampi ja jota raportoitiin 2,2 % (n=2/92) potilaista.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Votubia‑valmisteen käytöstä angiomyolipooman hoidossa kaikissa pediatrisissa potilasryhmissä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Myyntiluvan haltija on saanut päätökseen Votubian pediatrisen tutkimussuunnitelman TSC:hen liittyvissä vaikeahoitoisissa epilepsiakohtauksissa. Tähän valmisteyhteenvetoon on päivitetty näiden Votubia-tutkimusten tulokset pediatrisessa potilasryhmässä (ks. kohta Farmakokinetiikka).
Farmakokinetiikka
Imeytyminen
Potilailla, joilla oli pitkälle edenneitä kiinteitä kasvaimia, everolimuusin huippupitoisuuksien (Cmax) saavuttamiseen kulunut mediaaniaika oli 1 tunti, kun 5 mg tai 10 mg everolimuusiannos otettiin kerran vuorokaudessa joko tyhjään mahaan tai pienen rasvattoman välipalan yhteydessä. Cmax on suhteessa annokseen 5‑10 mg annoksia käytettäessä. Everolimuusi on P‑gp:n substraatti ja estää kohtalaisessa määrin P‑gp‑toimintaa.
Ruoan vaikutus
Terveillä henkilöillä runsasrasvaiset ateriat pienensivät 10 mg Votubia‑tableteilla saavutettua systeemistä altistusta (AUC‑arvoilla mitattuna) 22 %, ja veren huippupitoisuus (Cmax) pieneni 54 %. Vähärasvainen ateria pienensi AUC‑arvoa 32 % ja Cmax ‑arvoa 42 %.
Runsasrasvaiset ateriat pienensivät AUC‑arvoa 11,7 % ja huippupitoisuutta veressä (Cmax) 59,8 % terveillä henkilöillä, jotka saivat yksittäisen 9 mg (3 x 3 mg) annoksen Votubiaa dispergoituvien tablettien suspensiona. Vähärasvainen ateria pienensi AUC‑arvoa 29,5 % ja Cmax –arvoa 50,2 %.
Vaikuttaa kuitenkin siltä, että ruoka ei vaikuttanut elimistöön imeytyneen lääkkeen pitoisuus‑aikaprofiiliin 24 tuntia kummankaan valmistemuodon annoksen jälkeen.
Suhteellinen biologinen hyötyosuus/bioekvivalenssi
Suhteellisen biologisen hyötyosuuden tutkimuksessa viiden 1 mg everolimuusitabletin anto vesisuspensiona tuotti vastaavan AUC0‑inf‑arvon kuin viiden ehjän 1 mg everolimuusitabletin anto. Viiden suspensiona annetun 1 mg everolimuusitabletin tuottama C max‑arvo oli 72 % viiden ehjän 1 mg everolimuusitabletin tuottamasta Cmax‑arvosta.
Bioekvivalenssitutkimuksessa 5 mg dispergoituvan tabletin anto vesisuspensiona tuotti vastaavan AUC0‑inf‑arvon kuin viiden ehjän 1 mg everolimuusitabletin anto. Suspensiona annetun 5 mg dispergoituvan tabletin tuottama C max‑arvo oli 64 % viiden ehjän 1 mg everolimuusitabletin tuottamasta Cmax‑arvosta.
Jakautuminen
Veren ja plasman everolimuusipitoisuuksien suhde riippuu lääkkeen pitoisuuksista ja on 17–73 %, kun pitoisuus on 5–5 000 ng/ml. Syöpäpotilaat, jotka käyttävät 10 mg Votubia‑annoksia vuorokaudessa, noin 20 % elimistön everolimuusista on plasmassa. Sitoutuminen plasman proteiineihin on noin 74‑prosenttista sekä terveillä henkilöillä että potilailla, joilla on keskivaikea maksan vajaatoiminta. Potilailla, joilla oli pitkälle edenneitä kiinteitä kasvaimia, näennäisen sentraalisen tilan jakautumistilavuus (Vd) oli 191 l ja näennäisen perifeerisen tilan jakautumistilavuus 517 l.
Ei‑kliiniset rottatutkimukset viittaavat siihen, että:
- Everolimuusi kulkeutuu nopeasti aivoihin ja poistuu sitten hitaasti aivoista
- [3H]‑everolimuusin radioaktiiviset metaboliitit eivät läpäise veri‑aivoestettä merkitsevässä määrin
- Everolimuusin kulkeutuminen aivoihin on annosriippuvaista; tämä vastaa hypoteesia, että aivokapillaarien endoteelisolujen ulosvirtauspumpun toiminta saturoituu
- Siklosporiinin (P‑gp:n estäjä) samanaikainen anto suurentaa aivokuoren everolimuusialtistusta veri‑aivoesteen P‑gp‑toiminnan estymistä vastaavalla tavalla.
Everolimuusin jakautumisesta ihmisaivoihin ei ole kliinistä tietoa. Ei‑kliinisissä rottatutkimuksissa todettiin, että lääke jakautui aivoihin sekä laskimoon annettuna että peroraalisen annon jälkeen.
Biotransformaatio
Everolimuusi on CYP3A4:n ja P‑gp:n substraatti. Kun lääke otetaan suun kautta, tärkein ihmisen verenkierrossa havaittava komponentti on everolimuusi. Ihmisveressä on havaittu kuusi everolimuusin päämetaboliittia, joista kolme on monohydroksyloituneita metaboliitteja, kaksi taas rengasrakenteen hydrolyysin kautta muodostuvia metaboliitteja ja yksi everolimuusin fosfatidyylikoliinikonjugaatti. Näitä metaboliitteja havaittiin myös eläimillä tehdyissä toksisuustutkimuksissa, ja niiden aktiviteetti vaikutti olevan noin 100 kertaa pienempi kuin kanta‑aineen. Näin ollen everolimuusin katsotaan aikaansaavan valtaosan farmakologisesta kokonaisvaikutuksesta.
Eliminaatio
10 mg/vrk everolimuusiannosten oraalisen puhdistuman (Cl/F) keskiarvo oli 24,5 l/h potilailla, joilla oli pitkälle edenneitä kiinteitä kasvaimia. Everolimuusin eliminaation puoliintumisaika on keskimäärin noin 30 tuntia.
Syöpäpotilailla ei ole tehty spesifisiä eliminaatiotutkimuksia, mutta käytettävissä on elinsiirto‑potilailla tehdyistä tutkimuksista saatuja tietoja. Kun kerta‑annos radioaktiivisesti leimattua everolimuusia otettiin yhdessä siklosporiinin kanssa, 80 % radioaktiivisuudesta erittyi ulosteeseen ja 5 % virtsaan. Kanta‑ainetta ei havaittu sen paremmin virtsassa kuin ulosteessakaan.
Vakaan tilan farmakokinetiikka
Kun everolimuusia annettiin potilaille, joilla oli pitkälle edenneitä kiinteitä kasvaimia, vakaan tilan AUC0‑‑τ oli suhteessa annokseen 5–10 mg vuorokausiannoksia käytettäessä. Vakaa tila saavutettiin 2 viikossa. Cmax on suhteessa annokseen 5–10 mg annoksia käytettäessä. tmax on 1–2 tuntia annoksen jälkeen. Vakaassa tilassa AUC0‑‑τ‑arvon ja annosta edeltävien minimipitoisuuksien välillä oli merkitsevä korrelaatio.
Erityisryhmät
Maksan vajaatoiminta
Votubian turvallisuutta, siedettävyyttä ja farmakokinetiikkaa arvioitiin kahdessa tutkimuksessa, joissa 8 ja 34 aikuiselle tutkittavalle, jolla maksan toiminta oli heikentynyt, annettiin suun kautta kerta‑annos Votubia‑tabletteja ja heitä verrattiin potilaisiin, joiden maksan toiminta oli normaali.
Ensimmäisessä tutkimuksessa everolimuusin AUC‑keskiarvo 8 potilaalla, joilla oli keskivaikea maksan vajaatoiminta (Child–Pugh‑luokka B), oli kaksinkertainen verrattuna 8 potilaaseen, joiden maksan toiminta oli normaali.
Toiseen tutkimukseen osallistui 34 potilasta, joilla oli eriasteista maksan vajaatoimintaa. Normaaleihin henkilöihin verrattuna altistus (AUC0‑inf) suureni 1,6‑kertaiseksi, kun maksan vajaatoiminta oli lievää (Child‑Pugh‑luokka A), 3,3‑kertaiseksi, kun maksan vajaatoiminta oli keskivaikeaa (Child‑Pugh‑luokka B) ja 3,6‑kertaiseksi, kun maksan vajaatoiminta oli vaikeaa (Child‑Pugh‑luokka C).
Toistuvien annosten farmakokinetiikan simulaatiot tukevat Child–Pugh‑luokitukseen perustuvien annossuositusten käyttöä maksan vajaatoimintapotilailla.
Näiden kahden tutkimuksen tulosten perusteella annoksen muuttamista suositellaan potilaille, joilla on maksan vajaatoiminta (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Munuaisten vajaatoiminta
Kun populaatiofarmakokinetiikan analyysissä tutkittiin 170 potilasta, joilla oli pitkälle edenneitä kiinteitä kasvaimia, kreatiniinipuhdistuman (25–178 ml/min) ei havaittu vaikuttavan merkitsevässä määrin everolimuusin oraaliseen puhdistumaan. Elinsiirron jälkeinen munuaisten vajaatoiminta (kreatiniinipuhdistuman vaihteluväli 11–107 ml/min) ei vaikuttanut everolimuusin farmakokinetiikkaan elinsiirtopotilailla.
Pediatriset potilaat
SEGA‑potilailla, everolimuusin Cmin oli arviolta annosriippuvainen annosalueella 1,35–14,4 mg/m2.
SEGA‑potilailla Cmin‑arvojen mg/m2‑annokseen suhteutettu geometrinen keskiarvo oli alle 10‑vuotiailla potilailla 54 % ja 10‑18‑vuotiailla 40 % pienempi kuin (yli 18‑vuotiailla). Tämä viittaa siihen, että everolimuusin puhdistuma on nopeampaa nuorilla potilailla. Rajalliset tiedot alle 3‑vuotiaista potilaista (n=13) osoittavat, että potilailla, joiden kehon pinta‑ala on pieni (0,556 m2), kehon pinta‑alan mukaan normalisoitu puhdistuma on noin kaksi kertaa suurempi kuin aikuisilla potilailla. Tämän vuoksi oletetaan, että vakaa tila voidaan saavuttaa aikaisemmin alle 3‑vuotiailla potilailla (annossuositukset ‑ ks. kohta Annostus ja antotapa).
Everolimuusin farmakokinetiikkaa ei ole tutkittu alle 1‑vuotiailla potilailla. Kuitenkin CYP3A4‑entsyymiaktiivisuus on raportoitu olevan alhainen syntymähetkellä ja nousevan ensimmäisen elinvuoden aikana, mikä voi vaikuttaa everolimuusin puhdistumaan tässä potilasryhmässä.
Populaatiofarmakokineettisessä analyysissä arvioitiin 111 iältään 1,0‑27,4‑vuotiaan SEGA‑potilaan tietoja (mukaan lukien 18 iältään 1–alle 3‑vuotiasta potilasta, joiden kehon pinta‑ala oli 0,42 m2‑0,74 m2), jotka osoittivat, että kehon pinta‑alan mukaan normalisoitu puhdistuma on yleensä suurempi nuoremmilla potilailla. Populaatiofarmakokinetiikan mallisimulaatiot osoittivat, että 7 mg/m2 aloitusannos on tarpeen Cmin‑arvon 5‑15 ng/ml saavuttamiseksi alle 3‑vuotiailla potilailla. Näin ollen suurempaa 7 mg/m2 aloitusannosta suositellaan 1–alle 3‑vuotiaille SEGA‑potilaille (ks. kohta Annostus ja antotapa).
Kun dispergoituvia Votubia‑tabletteja annettiin TSC‑potilaille, joilla oli vaikeahoitoisia epilepsiakohtauksia, nuoremmilla potilailla havaittiin taipumus pienempiin Cmin‑pitoisuuksiin suhteessa annokseen (mg/m2). Cmin‑pitoisuuden mediaani suhteessa annokseen (mg/m2) oli nuoremmissa ikäryhmissä pienempi, mikä viittaa siihen, että everolimuusin puhdistuma suhteessa kehon pinta‑alaan oli nuoremmilla potilailla suurempi.
Votubia-pitoisuuksia tutkittiin yhdeksällä 1–< 2-vuotiaalla TSC-potilaalla, joilla oli vaikeahoitoisia epilepsiakohtauksia. Annetut annokset olivat suuruudeltaan 6 mg/m2 (absoluuttinen annosväli 1–5 mg) ja niiden aikaansaamat pienimmät pitoisuudet olivat välillä 2–10 ng/ml (mediaani 5 ng/ml; yhteensä > 50 mittausta). Tietoja alle 1-vuotiaista potilaista, joilla on TSC-kohtauksia, ei ole saatavilla.
Iäkkäät
Syöpäpotilailla tehdyssä populaatiofarmakokinetiikan analyysissä ei havaittu, että ikä (27–85 v) olisi vaikuttanut merkitsevässä määrin everolimuusin oraaliseen puhdistumaan.
Etninen tausta
Oraalinen puhdistuma (Cl/F) on samaa luokkaa japanilaisilla ja valkoihoisilla syöpäpotilailla, joiden maksan toiminta on samanlaista. Populaatiofarmakokineettisen analyysin perusteella Cl/F on mustilla elinsiirtopotilailla keskimäärin 20 % suurempi.
Farmakokineettiset/farmakodynaamiset suhteet
Tietoja TSC‑potilaista, joilla oli vaikeahoitoisia epilepsiakohtauksia, arvioitiin konditionaalisella logistisella regressioanalyysillä tutkimuksen CRAD001M2304 päähoitovaiheessa, jossa selvitettiin kohtausvasteen todennäköisyyttä suhteessa ajan suhteen normalisoituihin Cmin ‑pitoisuuksiin (Time Normalized (TN)‑Cmin). Tiedot stratifioitiin ikäryhmäkohtaisesti. Analyysin tulokset viittasivat siihen, että TN‑Cmin‑pitoisuuksien suurenemisella 2‑kertaisiksi oli yhteys 2,172‑kertaiseen suurenemaan (95 % lv: 1,339; 3,524) kohtausvasteen todennäköisyydessä tarkastellulla TN‑Cmin alueella 0,97–16,40 ng/ml. Lähtötilanteen kohtausfrekvenssi oli merkitsevä tekijä kohtausvasteessa (vetosuhde 0,978 [95 % lv: 0,959; 0,998]). Tämä lopputulos on yhdenmukainen tulosten kanssa, jotka saatiin, kun absoluuttisen kohtausfrekvenssin log‑arvoja päähoitovaiheen ylläpito‑osassa ennustettiin lineaarisella regressiomallilla. Nämä tulokset viittasivat siihen, että kun TN‑Cmin‑pitoisuudet suurenivat 2‑kertaisiksi, havaittiin tilastollisesti merkitsevä 28 % pienenemä (95 % lv: 12 %; 42 %) absoluuttisessa kohtausfrekvenssissä. Sekä lähtötilanteen kohtausfrekvenssi että TN‑Cmin ennustivat merkitsevästi (α = 0,05) absoluuttista kohtausfrekvenssiä kyseisessä lineaarisessa regressiomallissa.
Prekliiniset tiedot turvallisuudesta
Everolimuusin turvallisuusprofiilia arvioitiin ei‑kliinisesti hiirellä, rotalla, kääpiösialla, apinalla ja kanilla. Tärkeimmät kohde‑elimet olivat molempien sukupuolten sukuelimet (kivesten siementiehyiden degeneraatio, siittiöiden määrän väheneminen lisäkiveksissä ja kohdun atrofia) useilla lajeilla, keuhkot (alveolien makrofagimäärän suureneminen) rotalla ja hiirellä, haima (eksokriinisten solujen degranulaatio apinoilla ja vakuolisaatio miniporsailla ja saarekesolujen degeneroituminen apinoilla) ja silmät (mykiön etusauman sameus) ainoastaan rotalla. Vähäisiä munuaismuutoksia havaittiin rotalla (ikään liittyvän lipofuskiinikertymän paheneminen munuaistubulusten epiteelissä, hydronefroosin lisääntyminen) ja hiirellä (taustamuutosten paheneminen). Apinalla ja kääpiösialla ei havaittu viitteitä munuaistoksisuudesta.
Everolimuusi vaikutti pahentavan spontaanisti eläinten perussairauksia (krooninen myokardiitti rotalla, plasman ja sydämen coxsackievirusinfektiot apinalla, ruoansulatuskanavan kokkidi‑infektiot kääpiösialla, ihomuutokset hiirellä ja apinalla). Näitä löydöksiä havaittiin yleensä terapeuttisen altistuksen luokkaa olevilla tai sitä suuremmilla systeemisillä altistustasoilla. Rotalla havaitut löydökset todettiin kuitenkin terapeuttista altistusta pienempien pitoisuuksien yhteydessä, sillä aine jakautuu voimakkaasti kudoksiin.
Rotalla tehdyssä urosten hedelmällisyyttä koskeneessa tutkimuksessa kivesten morfologiassa esiintyi muutoksia vähintään 0,5 mg/kg pitoisuuksien yhteydessä, ja 5 mg/kg pitoisuuksien yhteydessä havaittiin siittiöiden liikkuvuuden ja määrän ja plasman testosteronipitoisuuksien pienenemistä. Nämä pitoisuudet olivat terapeuttisen altistusalueen puitteissa ja heikensivät urosten hedelmällisyyttä. Muutosten korjautuvuudesta saatiin näyttöä.
Eläimillä tehdyissä lisääntymistutkimuksissa valmiste ei vaikuttanut naaraiden hedelmällisyyteen. Kun naarasrotille annettiin suun kautta ≥ 0,1 mg/kg everolimuusiannoksia (noin 4 % AUC0‑24h‑arvosta potilailla, joiden vuorokausiannos on 10 mg), implantaatiota edeltävät alkiokuolemat kuitenkin lisääntyivät.
Everolimuusi läpäisi istukan ja oli toksista sikiölle. Rotalla everolimuusi aiheutti alkio‑/sikiötoksisuutta terapeuttista altistusta pienemmän systeemisen altistuksen yhteydessä. Seurauksina olivat kuolleisuuden lisääntyminen ja sikiöiden painon pieneneminen. Luustomuutosten ja epämuodostumien (esim. rintalastahalkioiden) esiintyvyys suureni 0,3 ja 0,9 mg/kg annoksilla. Kanilla havaittiin selvää alkiotoksisuutta, joka ilmeni myöhäisten resorptioiden yleistymisenä.
Nuorilla rotilla tehdyissä toksisuustutkimuksissa systeemisiä haittavaikutuksia olivat kehon painonnousun vähentyminen, ruoankulutuksen vähentyminen ja eräiden kehitysvaiheiden saavuttamisen viivästyminen. Tilanne palautui kokonaan tai osittain, kun lääkkeen anto lopetettiin. Vaikuttaa siltä, ettei aikuisiin eläimiin verrattuna ole merkittävää eroa nuorten eläinten herkkyydessä everolimuusin haittavaikutusreaktioille, lukuun ottamatta rottaspesifistä mykiölöydöstä (jolle nuoret eläimet näyttivät olevan alttiimpia). Nuorilla apinoilla tehdyssä toksisuustutkimuksessa ei todettu merkityksellistä toksisuutta.
Genotoksisuustutkimuksessa, joissa tarkasteltiin relevantteja genotoksisuuden päätetapahtumia, ei saatu näyttöä klastogeenisuudesta eikä mutageenisuudesta. Kun everolimuusia annettiin hiirelle ja rotalle enintään 2 vuoden ajan, ei havaittu mitään onkogeenisiä vaikutuksia edes suurimmilla annoksilla, jotka vastasivat 4,3 kertaa (hiiri) ja 0,2 kertaa (rotta) arvioitua kliinistä altistusta.
Farmaseuttiset tiedot
Apuaineet
Butyloitu hydroksitolueeni (E 321)
Magnesiumstearaatti
Laktoosimonohydraatti
Hypromelloosi
Krospovidoni (tyyppi A)
Mannitoli
Mikrokiteinen selluloosa
Vedetön kolloidinen piidioksidi
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
Votubia 1 mg dispergoituva tabletti
2 vuotta.
Votubia 2 mg dispergoituva tabletti
3 vuotta.
Votubia 3 mg dispergoituva tabletti
3 vuotta.
Votubia 5 mg dispergoituva tabletti
3 vuotta.
Käyttövalmiin suspension stabiilisuuden on osoitettu olevan 30 minuuttia mittaruiskussa ja 60 minuuttia pienessä lasissa. Suspensio on annettava välittömästi valmistuksen jälkeen. Jos suspensiota ei ole käytetty 30 minuutin kuluessa valmistuksesta mittaruiskussa tai 60 minuutin kuluessa valmistuksesta pienessä lasissa, se on heitettävä pois ja valmistettava uusi suspensio.
Säilytys
Tämä lääkevalmiste ei vaadi lämpötilan suhteen erityisiä säilytysolosuhteita.
Säilytä alkuperäispakkauksessa. Herkkä valolle. Herkkä kosteudelle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
VOTUBIA dispergoituva tabletti
2 mg (L:kyllä) 30 x 1 fol (1158,66 €)
3 mg (L:kyllä) 30 x 1 fol (1715,78 €)
PF-selosteen tieto
Perforoitu Al/polyamidi/Al/PVC‑kerta‑annosläpipainopakkaus, jossa 10 x 1 dispergoituvaa tablettia.
Votubia 1 mg dispergoituva tabletti
Pakkauksissa on 30 x 1 dispergoituvaa tablettia.
Votubia 2 mg dispergoituva tabletti
Pakkauksissa on 10 x 1, 30 x 1 tai 100 x 1 dispergoituvaa tablettia.
Votubia 3 mg dispergoituva tabletti
Pakkauksissa on 30 x 1 tai 100 x 1 dispergoituvaa tablettia.
Votubia 5 mg dispergoituva tabletti
Pakkauksissa on 30 x 1 tai 100 x 1 dispergoituvaa tablettia.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Votubia 1 mg dispergoituva tabletti
Valkoinen tai kellertävä, pyöreä, litteä tabletti, jonka halkaisija on noin 7,1 mm ja jossa viistetty reuna, ei jakouurretta, toisella puolella kaiverrus ”D1” ja toisella puolella ”NVR”.
Votubia 2 mg dispergoituva tabletti
Valkoinen tai kellertävä, pyöreä, litteä tabletti, jonka halkaisija on noin 9,1 mm ja jossa viistetty reuna, ei jakouurretta, toisella puolella kaiverrus ”D2” ja toisella puolella ”NVR”.
Votubia 3 mg dispergoituva tabletti
Valkoinen tai kellertävä, pyöreä, litteä tabletti, jonka halkaisija on noin 10,1 mm ja jossa viistetty reuna, ei jakouurretta, toisella puolella kaiverrus ”D3” ja toisella puolella ”NVR”.
Votubia 5 mg dispergoituva tabletti
Valkoinen tai kellertävä, pyöreä, litteä tabletti, jonka halkaisija on noin 12,1 mm ja jossa viistetty reuna, ei jakouurretta, toisella puolella kaiverrus ”D5” ja toisella puolella ”NVR”.
Käyttö- ja käsittelyohjeet
Käyttö‑ ja käsittelyohjeet
Mittaruiskun käyttö
Määrätty annos Votubia dispergoituvia tabletteja laitetaan 10 ml mittaruiskuun, jossa on merkkiviivat 1 ml välein. Yhteen mittaruiskuun ei saa laittaa enempää kuin 10 mg Votubia dispergoituvia tabletteja eikä enempää kuin 5 dispergoituvaa tablettia. Jos tarvitaan isompaa annosta tai tablettimäärää, valmistetaan toinen mittaruisku. Dispergoituvia tabletteja ei saa hajottaa tai murskata. Ruiskuun vedetään noin 5 ml vettä ja 4 ml ilmaa. Täytetty ruisku asetetaan säilytysastiaan (kärki ylöspäin) kolmen minuutin ajaksi, kunnes Votubia dispergoituvat tabletit ovat suspendoituneet. Ruiskua käännellään varovasti viisi kertaa ylösalaisin ja takaisin juuri ennen annostelua. Suspension annostelun jälkeen vedetään noin 5 ml vettä ja 4 ml ilmaa samaan ruiskuun ja pyöritellään sisältöä loppujen hiukkasten sekoittamiseksi veteen. Koko ruiskun sisältö annostellaan.
Pienen lasin käyttö
Määrätty annos Votubia dispergoituvia tabletteja laitetaan pieneen lasiin (koko enintään 100 ml), jossa on noin 25 ml vettä. Yhteen lasiin ei saa laittaa enempää kuin 10 mg Votubia dispergoituvia tabletteja eikä enempää kuin 5 dispergoituvaa tablettia. Jos tarvitaan isompaa annosta tai tablettimäärää, valmistetaan toinen lasillinen. Dispergoituvia tabletteja ei saa hajottaa tai murskata. Suspension annetaan valmistua kolmen minuutin ajan ja sitä sekoitetaan varovasti lusikalla juuri ennen suspension juomista. Suspension annostelun jälkeen lasiin lisätään noin 25 ml vettä ja sekoitetaan samalla lusikalla loppujen hiukkasten sekoittamiseksi veteen. Koko lasin sisältö annostellaan.
Täydelliset kuvitetut valmistusohjeet ovat pakkausselosteen lopussa kohdassa ”Käyttöohjeet”.
Tärkeää tietoa huoltajille
Paikallisen altistuksen yhteydessä imeytyvän everolimuusin määrää ei tunneta. Tämän vuoksi huoltajan on hyvä välttää suspension koskettamista. Kädet on pestävä huolellisesti ennen ja jälkeen suspension valmistuksen.
Hävittäminen
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
VOTUBIA dispergoituva tabletti
2 mg 30 x 1 fol
3 mg 30 x 1 fol
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Everolimuusi: Edenneen munuaissyövän, haiman neuroendokriinisten kasvainten ja pitkälle edenneen rintasyövän sekä tuberoosiskleroosiin liittyvän subependymaalisen jättisoluisen astrosytooman ja munuaisten angiomyolipooman hoito erityisin edellytyksin (340).
ATC-koodi
L01EG02
Valmisteyhteenvedon muuttamispäivämäärä
20.11.2025
Yhteystiedot
 NOVARTIS FINLAND OY
NOVARTIS FINLAND OY Revontulenkuja 1
02100 Espoo
010 613 3200
www.novartis.fi
Lääkeinformaatiopalvelu 010 6133 210,
medinfo.nordics@novartis.com
