RISPERDAL CONSTA injektiokuiva-aine ja liuotin, depotsuspensiota varten 25 mg, 37,5 mg, 50 mg
Vaikuttavat aineet ja niiden määrät
Yksi Risperdal Consta 25 mg injektiopullo sisältää 25 mg risperidonia. 1 ml käyttövalmiiksi saatettua suspensiota sisältää 12,5 mg risperidonia.
Yksi Risperdal Consta 37,5 mg injektiopullo sisältää 37,5 mg risperidonia. 1 ml käyttövalmiiksi saatettua suspensiota sisältää 18,75 mg risperidonia.
Yksi Risperdal Consta 50 mg injektiopullo sisältää 50 mg risperidonia. 1 ml käyttövalmiiksi saatettua suspensiota sisältää 25 mg risperidonia.
Apuaineet, joiden vaikutus tunnetaan: 1 ml käyttövalmiiksi saatettua suspensiota sisältää 3 mg natriumia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektiokuiva-aine ja liuotin, depotsuspensiota varten.
Kliiniset tiedot
Käyttöaiheet
Risperdal Consta on tarkoitettu skitsofrenian ylläpitohoitoon potilailla, joiden tila on vakautettu suun kautta otettavalla psykoosilääkkeellä.
Annostus ja antotapa
Annostus
Aikuiset
Aloitusannos
Useimmille potilaille suositusannos on 25 mg lihakseen kahden viikon välein. Samaa risperidoniannosta vähintään kahden viikon ajan saaneet potilaat tulee harkinnan mukaan siirtää Risperdal Consta -hoitoon seuraavasti. Potilaille, jotka ovat saaneet 4 mg tai vähemmän suun kautta otettavaa risperidonia, annetaan 25 mg Risperdal Consta -valmistetta ja potilaille, jotka ovat saaneet suurempia annoksia suun kautta otettavaa risperidonia, tulee harkita korkeampaa 37,5 mg Risperdal Consta -annosta.
Kun valitaan lihakseen annettavan injektion aloitusannosta potilaalle, jota ei parhaillaan hoideta suun kautta otettavalla risperidonilla, otetaan huomioon hänen ennen injektiohoidon aloittamista käyttämänsä suun kautta otettavan psykoosilääkityksen annostus. Risperdal Consta -valmisteen suositeltu aloitusannos on 25 mg lihakseen kahden viikon välein. Potilaille, jotka saavat suurempia annoksia suun kautta otettavaa psykoosilääkettä, tulee harkita suurempaa 37,5 mg:n Risperdal Consta -annosta.
Ensimmäistä Risperdal Consta -injektiota seuraavien kolmen viikon vaikutusviiveen aikana tulee varmistaa riittävä antipsykoottinen lääkitys joko suun kautta otettavalla risperidonilla tai aiemmin käytössä olleella psykoosilääkkeellä (ks. kohta Farmakokinetiikka).
Risperdal Consta -valmistetta ei tule käyttää skitsofrenian oireiden äkillisen pahenemisen hoitoon varmistamatta riittävää antipsykoottista lääkitystä joko suun kautta otettavalla risperidonilla tai aiemmin käytössä olleella psykoosilääkkeellä ensimmäistä Risperdal Consta -injektiota seuraavien kolmen viikon vaikutusviiveen aikana.
Ylläpitoannos
Useimmille potilaille suositusannos on 25 mg lihakseen kahden viikon välein. Jotkut potilaat saattavat hyötyä suuremmista, 37,5 mg:n tai 50 mg:n, annoksista. Annostuksen sovittamista suuremmaksi ei tulisi tehdä useammin kuin joka 4. viikko. Tällaisen annoksen sovittamisen vaikutusta voi odottaa vasta 3 viikkoa ensimmäisen suuremman annoksen injektoimisen jälkeen. Kliinisissä tutkimuksissa ei 75 mg:n annoksesta todettu lisähyötyä. Annostuksen suurentamista yli 50 mg:n annoksiin kahden viikon välein ei suositella.
Iäkkäät potilaat
Annoksen sovittaminen ei ole tarpeen. Suositusannos on 25 mg lihakseen kahden viikon välein. Jos potilaat eivät parhaillaan käytä suun kautta otettavaa risperidonia, Risperdal Consta -valmisteen suositusannos on 25 mg kahden viikon välein. Kiinteää risperidoniannosta vähintään kahden viikon ajan saaneet potilaat tulee harkinnan mukaan siirtää Risperdal Consta -hoitoon seuraavasti. Potilaille, jotka ovat saaneet 4 mg tai vähemmän suun kautta otettavaa risperidonia, annetaan 25 mg Risperdal Consta -valmistetta ja potilaille, jotka ovat saaneet suurempia annoksia suun kautta otettavaa risperidonia, tulee harkita korkeampaa 37,5 mg Risperdal Consta -annosta.
Riittävä antipsykoottinen lääkitys tulisi varmistaa ensimmäistä Risperdal Consta -injektiota seuraavien kolmen viikon vaikutusviiveen ajaksi (ks. kohta Farmakokinetiikka). Kliiniset tiedot Risperdal Consta -valmisteen käytöstä iäkkäillä potilailla ovat vähäiset. Risperdal Consta -valmisteen käytössä näillä potilailla tulee noudattaa varovaisuutta.
Maksa- ja munuaissairaudet
Risperdal Consta -valmistetta ei ole tutkittu maksan ja munuaisten vajaatoimintaa sairastavilla potilailla.
Jos maksan tai munuaisten vajaatoimintaa sairastava potilas tarvitsee Risperdal Consta -hoitoa, aloitusannokseksi suositellaan suun kautta otettavaa risperidonia 0,5 mg kahdesti päivässä ensimmäisen viikon ajan. Toisella viikolla voidaan antaa 1 mg kahdesti päivässä tai 2 mg kerran päivässä. Jos potilas sietää hyvin suun kautta otetun vähintään 2 mg:n vuorokausiannoksen, voidaan antaa 25 mg:n Risperdal Consta -injektio kahden viikon välein.
Riittävä antipsykoottinen lääkitys tulisi varmistaa ensimmäistä Risperdal Consta -injektiota seuraavien kolmen viikon vaikutusviiveen ajaksi (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Risperdal Consta -valmisteen turvallisuutta ja tehoa alle 18 vuoden ikäisten lasten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Antotapa
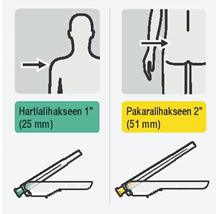
Risperdal Consta annetaan kahden viikon välein injektiona syvälle hartia- tai pakaralihakseen käyttäen tarkoituksenmukaista turvaneulaa. Hartialihakseen injektio annetaan käyttämällä yhden tuuman (25 mm) neulaa ja injektio annetaan vuorotellen kumpaankin olkavarteen. Pakaralihakseen injektio annetaan käyttämällä kahden tuuman (50 mm) neulaa, ja injektio annetaan vuorotellen kumpaankin pakaraan. Lääkettä ei saa antaa suonensisäisesti (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet sekä Erityiset varotoimet hävittämiselle ja muut käsittelyohjeet).
Ks. kohdasta Erityiset varotoimet hävittämiselle ja muut käsittelyohjeet ohjeet lääkevalmisteen saattamisesta käyttökuntoon ennen lääkkeen antoa.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Potilailla, joita ei aiemmin ole hoidettu risperidonilla, suositellaan siedettävyyden varmistamista suun kautta otettavalla risperidonivalmisteella ennen Risperdal Consta -hoidon aloittamista (ks. kohta Annostus ja antotapa).
Iäkkäät dementiapotilaat
Risperdal Consta -valmistetta ei ole tutkittu iäkkäillä dementiapotilailla ja siksi sitä ei tule käyttää tässä potilasryhmässä. Risperdal Consta -valmistetta ei ole hyväksytty dementiaan liittyvien käytöshäiriöiden hoitoon.
Iäkkäiden dementiapotilaiden lisääntynyt kuolleisuus
Atyyppisillä psykoosilääkkeillä (myös Risperdalilla) tehtyjen 17 kontrolloidun tutkimuksen meta-analyysissä todettiin, että atyyppisillä psykoosilääkkeillä hoidettujen iäkkäiden dementiapotilaiden kuolleisuus oli lisääntynyt verrattuna lumelääkettä saaneisiin potilaisiin. Tässä potilasväestössä tehdyissä lumelääkekontrolloiduissa Risperdal-tutkimuksissa kuolleisuuden esiintyvyys oli Risperdal-hoitoa saaneilla potilailla 4,0 % ja lumelääkettä saaneilla 3,1 %. Kerroinsuhde (luottamusväli 95 %) oli 1,21 (0,7; 2,1). Kuolleiden potilaiden keski-ikä oli 86 vuotta (vaihteluväli 67–100 vuotta). Tulokset kahdesta suuresta havainnoivasta tutkimuksesta osoittivat, että myös perinteisillä antipsykooteilla hoidettavilla iäkkäillä, dementiaa sairastavilla henkilöillä on hieman kohonnut kuolleisuusriski verrattuna niihin, joita ei hoideta. Tiedot eivät ole riittäviä riskin suuruuden tarkkaan arviointiin ja syy kohonneeseen riskiin on tuntematon. Ei tiedetä myöskään, missä määrin havainnoivissa tutkimuksissa todettu lisääntynyt kuolleisuus liittyy psykoosilääkkeiden käyttöön eikä potilaiden joihinkin ominaisuuksiin.
Furosemidin samanaikainen käyttö
Lumekontrolloiduissa iäkkäillä dementiapotilailla tehdyissä Risperdal-tutkimuksissa furosemidin ja risperidonin samanaikaiseen käyttöön liittyi suurempi kuolleisuus (7,3 %, keski-ikä 89 vuotta, vaihteluväli 75–97) verrattuna pelkkään risperidoniin (3,1 %, keski-ikä 84 vuotta, vaihteluväli 70–96) tai furosemidiin (4,1 %, keski-ikä 80 vuotta, vaihteluväli 67–90). Furosemidin ja risperidonin samanaikaiseen käyttöön liittynyt suurentunut kuolleisuus havaittiin kahdessa neljästä kliinisestä tutkimuksesta. Risperidonin ja muiden diureettien (lähinnä pieninä annoksina annettujen tiatsididiureettien) samanaikaiseen käyttöön ei liittynyt vastaavia löydöksiä.
Selittävää patofysiologista mekanismia ei ole löydetty eikä yhdenmukaista kuolinsyytä ole todettu. Tästä huolimatta käytettäessä furosemidia tai muita potentteja diureetteja samanaikaisesti risperidonin kanssa on noudatettava varovaisuutta ja lääkeyhdistelmän haittoja ja hyötyjä on punnittava ennen päätöstä sen käytöstä. Muita diureetteja samanaikaisesti risperidonin kanssa käyttäneiden potilaiden kuolleisuuden ei havaittu lisääntyneen. Lääkityksestä riippumatta kuivumistila oli kuolleisuuden yleinen riskitekijä ja sen vuoksi sitä tulisi tarkoin välttää iäkkäillä dementiapotilailla.
Aivoverenkiertoon liittyvät haittatapahtumat
Aivoverenkiertoon liittyvien haittatapahtumien vaaran on dementiapotilailla tehdyissä satunnaistetuissa lumelääkekontrolloiduissa kliinisissä lääketutkimuksissa havaittu suurentuneen noin kolminkertaiseksi joidenkin atyyppisten psykoosilääkkeiden käytön yhteydessä. Kuudesta lumekontrolloidusta pääosin iäkkäillä dementiapotilailla (> 65-vuotiailla) tehdystä Risperdal-tutkimuksesta saadut yhdistetyt tiedot osoittivat, että aivoverenkiertoon liittyviä haittatapahtumia (vakavat ja ei-vakavat yhteensä) esiintyi 3,3 prosentilla (33/1009) risperidonia saaneista potilaista ja 1,2 prosentilla (8/712) lumelääkettä saaneista potilaista. Kerroinsuhde (95 % luottamusväli) oli 2,96 (1,34; 7,50). Lisääntyneen riskin mekanismia ei tunneta. Lisääntynyttä riskiä ei myöskään voida sulkea pois muiden antipsykoottien tai muiden potilasryhmien osalta. Risperdal Consta -valmisteen käytössä on noudatettava varovaisuutta hoidettaessa potilaita, joilla on aivohalvauksen riskitekijöitä.
Ortostaattinen hypotensio
Risperidonin alfasalpausvaikutuksen vuoksi voi ilmetä (ortostaattista) hypotensiota etenkin hoidon alkuvaiheessa. Kliinisesti merkittävää hypotensiota on havaittu myyntiluvan saamisen jälkeen, kun risperidonia käytettiin samanaikaisesti verenpainetta alentavien lääkkeiden kanssa. Risperidonia pitää antaa varoen sydän- ja verisuonitautia (esim. sydämen vajaatoiminta, sydäninfarkti, johtumishäiriöt, kuivuminen, hypovolemia tai aivoverisuonisairaus) sairastaville.
Risperdal Consta -hoidon jatkamisen haitta/hyöty-suhdetta tulee arvioida, jos kliinisesti merkittävä ortostaattinen hypotensio jatkuu pitkään.
Leukopenia, neutropenia ja agranulosytoosi
Leukopeniaa, neutropeniaa ja agranulosytoosia on raportoitu psykoosilääkkeiden, myös Risperdal Consta -valmisteen, käytön yhteydessä. Agranulosytoosia on raportoitu hyvin harvoin (< 1/10 000 potilaalla) valmisteen markkinoille tulon jälkeisessä seurannassa.
Jos potilaalla on aiemmin ollut kliinisesti merkityksellisesti pieni veren valkosolumäärä tai lääkkeestä aiheutunut leukopenia/neutropenia, potilasta on seurattava muutamien ensimmäisten hoitokuukausien aikana ja Risperdal Consta -hoidon lopettamista on harkittava veren valkosolumäärän kliinisesti merkitykselliseen vähenemiseen viittaavien ensimmäisten oireiden ilmaantuessa, kun potilaalla ei ole muita tällaista aiheuttavia tekijöitä.
Jos potilaalla on kliinisesti merkityksellistä neutropeniaa, potilasta on seurattava kuumeen ja muiden infektion oireiden ja löydösten havaitsemiseksi ja hoidettava heti, jos tällaisia oireita tai löydöksiä ilmaantuu. Jos potilaalla on vaikea-asteinen neutropenia (absoluuttinen neutrofiilimäärä < 1 x 109/l), Risperdal Consta -hoito on lopetettava ja veren valkosolumäärää on seurattava potilaan toipumiseen saakka.
Tardiivi dyskinesia / ekstrapyramidaalioireet
Dopamiinireseptoreita salpaavien lääkkeiden käyttöön on liittynyt tardiivin dyskinesian kehittymistä. Tardiiville dyskinesialle on ominaista erityisesti kielen tai kasvojen seudun lihasten tahdosta riippumattomat rytmiset liikkeet. Ekstrapyramidaalioireiden ilmeneminen on tardiivin dyskinesian riskitekijä. Jos potilaalla ilmenee tardiivin dyskinesian oireita tai merkkejä, antipsykoottisen lääkehoidon lopettamista pitää harkita.
Varovaisuuteen on syytä hoidettaessa potilaita, jotka samanaikaisesti käyttävät sekä psykostimulantteja (esim. metyylifenidaattia) että risperidonia, sillä toisen tai molempien näiden lääkeaineiden annosmuutokset saattavat johtaa ekstrapyramidaalioireisiin. Stimulanttihoidon lopettamista asteittain suositellaan (ks. kohta Yhteisvaikutukset muiden lääkevalmisteiden kanssa sekä muut yhteisvaikutukset).
Maligni neuroleptioireyhtymä
Psykoosilääkkeiden käytön yhteydessä voi ilmetä maligni neuroleptioireyhtymä, jolle on ominaista kuume, voimakas lihasjäykkyys, autonomisen hermoston häiriöt, alentunut tajunnan taso ja kohonnut kreatiinikinaasin pitoisuus seerumissa. Muita merkkejä voivat olla myoglobinuria (rabdomyolyysi) ja äkillinen munuaisten vajaatoiminta. Malignin neuroleptioireyhtymän oireiden ilmetessä antipsykoottinen lääkitys (myös Risperdal Consta -hoito) on keskeytettävä.
Parkinsonin tauti ja Lewyn kappale -dementia
Lääkäreiden pitäisi punnita vaaroja hyötyihin nähden määrätessään antipsykoottista lääkitystä, myös Risperdal Consta -valmistetta, Parkinsonin tautia tai Lewyn kappale -dementiaa sairastaville. Parkinsonin tauti voi pahentua risperidonihoidon yhteydessä. Kummallakin potilasryhmällä malignin neuroleptioireyhtymän vaara saattaa olla suurentunut ja herkkyys psykoosilääkkeille saattaa olla lisääntynyt (kyseisiin ryhmiin kuuluvia potilaita ei otettu kliinisiin tutkimuksiin). Tällainen lisääntynyt herkkyys voi ilmetä sekavuutena, turtuneisuutena, kehon asennon epävakautena, mihin liittyy toistuvia kaatumisia, sekä ekstrapyramidaalioireina.
Yliherkkyysreaktiot
Risperidonin siedettävyys varmistetaan suun kautta otettavalla lääkemuodolla ennen Risperdal Consta -hoidon aloittamista, mutta valmisteen markkinoille tulon jälkeen on silti raportoitu harvinaisina tapauksina anafylaktisia reaktioita potilailla, jotka ovat aiemmin sietäneet suun kautta otettavan risperidonin (ks. kohdat Annostus ja antotapa sekä Haittavaikutukset).
Jos yliherkkyysreaktio ilmaantuu, lopeta Risperdal Consta -valmisteen käyttö, käynnistä kliinisesti tarkoituksenmukaiset tukitoimenpiteet ja seuraa potilasta, kunnes oireet ja löydökset häviävät (ks. kohdat Vasta-aiheet sekä Haittavaikutukset).
Hyperglykemia ja diabetes
Hyperglykemiaa, diabetesta ja aiemmin puhjenneen diabeteksen pahenemista on ilmoitettu Risperdal Consta -hoidon yhteydessä. Edeltävää painon nousua on raportoitu joissakin tapauksissa mahdollisesti altistavana tekijänä. Näihin on raportoitu liittyneen hyvin harvoin ketoasidoosia ja harvoin diabeettinen kooma. Asianmukaista kliinistä seurantaa suositellaan psykoosilääkkeiden käytöstä annettujen ohjeistojen mukaisesti. Atyyppisillä psykoosilääkkeillä, kuten Risperdal Consta -valmisteella, hoidettavia potilaita on seurattava hyperglykemian oireiden (kuten polydipsian, polyurian, polyfagian ja heikotuksen) havaitsemiseksi ja diabetesta sairastavan potilaan tilaa on seurattava säännöllisesti glukoositasapainon heikkenemisen havaitsemiseksi.
Painon nousu
Risperdal Consta -valmisteen käytön yhteydessä on raportoitu huomattavaa painon nousua. Painoa on seurattava säännöllisesti.
Hyperprolaktinemia
Hyperprolaktinemia on Risperdal Consta -hoidon yleinen haittavaikutus. Jos potilaalla on viitteitä mahdollisista prolaktiiniin liittyvistä haittavaikutuksista (esim. gynekomastiaa, kuukautishäiriöitä, anovulaatio, hedelmällisyyden häiriöitä, sukupuolista haluttomuutta, erektiohäiriöitä tai maidonvuotoa), plasman prolaktiinipitoisuus suositellaan määrittämään.
Kudosviljelytutkimukset viittaavat siihen, että prolaktiini saattaa kiihdyttää solujen kasvua ihmisen rintarauhaskasvaimissa. Vaikka selvää yhteyttä psykoosilääkkeiden käyttöön ei kliinisissä eikä epidemiologisissa tutkimuksissa ole toistaiseksi osoitettu, varovaisuutta pitää noudattaa potilailla, joilla on todettu tällaisia kasvaimia. Varovaisuutta on noudatettava Risperdal Consta -valmisteen käytössä potilaille, joilla on ennestään hyperprolaktinemia tai mahdollisesti prolaktiiniriippuvainen kasvain.
QT-ajan piteneminen
Myyntiluvan saamisen jälkeen QT-ajan pitenemisiä on raportoitu hyvin harvoin. Jos potilaalla on sydän- ja verisuonitauti, hänen suvussaan tiedetään esiintyneen aiemmin QT-ajan pitenemistä, bradykardiaa tai elektrolyyttitasapainon häiriöitä (hypokalemia, hypomagnesemia), risperidonia, kuten muitakin antipsykoottisia lääkkeitä, määrättäessä tulee noudattaa varovaisuutta, koska rytmihäiriöitä aiheuttavat vaikutukset voivat voimistua. Varovaisuutta on noudatettava myös silloin, kun risperidonia käytetään samanaikaisesti tunnetusti QT-aikaa pidentävien lääkkeiden kanssa.
Kouristuskohtaukset
Risperdal Consta -valmistetta pitää antaa varoen potilaille, joilla on aiemmin esiintynyt kouristuskohtauksia tai joilla on muu kouristuskynnystä mahdollisesti alentava tila.
Priapismi
Risperdal Consta -valmisteen alfasalpaajavaikutuksen vuoksi käytön yhteydessä voi esiintyä priapismia.
Kehon lämpötilan säätely
Psykoosilääkkeiden käyttöön on liittynyt häiriöitä elimistön kyvyssä alentaa kehon ydinlämpötilaa. Asianmukaista varovaisuutta suositellaan määrättäessä Risperdal Consta -valmistetta potilaalle, joka altistuu elimistön ydinlämpötilan nousua edistäville olosuhteille, joita ovat esim. raskas liikunta, altistuminen erittäin korkeille lämpötiloille, samanaikainen hoito antikolinergisesti vaikuttavilla lääkeaineilla tai altistuminen nestehukalle.
Laskimotromboosi
Laskimotukoksia (VTE) on raportoitu antipsykoottisten lääkkeiden käytön yhteydessä. Koska antipsykooteilla hoidettavilla potilailla usein on hankittuja laskimotukoksille altistavia riskitekijöitä, kaikki mahdolliset riskitekijät on tunnistettava ennen Risperdal Consta -hoidon aloittamista sekä hoidon aikana, ja ennaltaehkäisevät toimenpiteet on suoritettava.
IFIS-oireyhtymä
Alfa-1-adrenergisia reseptoreita salpaavilla lääkkeillä, Risperdal Consta mukaan lukien, hoitoa saaneilla potilailla on havaittu kaihileikkauksen aikana IFIS-oireyhtymää (intraoperative floppy iris syndrome eli pienen pupillin syndrooman variantti) (ks. kohta Haittavaikutukset).
IFIS saattaa lisätä silmäkomplikaatioriskiä leikkauksen aikana ja sen jälkeen. Alfa-1-adrenergisia reseptoreita salpaavien lääkkeiden käytöstä parhaillaan tai aiemmin on kerrottava silmäleikkauksen tekevälle kirurgille ennen leikkausta. Alfa-1-adrenergisia reseptoreita salpaavien lääkkeiden käytön lopettamisen mahdollista hyötyä ennen kaihileikkausta ei ole varmistettu ja se on siten arvioitava psykoosilääkkeen käytön lopettamisesta aiheutuviin riskeihin nähden.
Antiemeettinen vaikutus
Risperidonilla tehdyissä prekliinisissä tutkimuksissa havaittiin antiemeettinen vaikutus. Jos ihmisellä esiintyy tällainen vaikutus, se saattaa peittää tiettyjen lääkkeiden yliannoksen tai tiettyjen sairauksien, kuten suolitukoksen, Reyen oireyhtymän ja aivokasvaimen, oireet ja löydökset.
Munuais- ja maksasairaudet
Vaikka suun kautta otettavan risperidonin vaikutuksia onkin tutkittu, ei Risperdal Consta -valmistetta ole tutkittu potilailla, joilla on munuaisten tai maksan vajaatoiminta. Varovaisuutta on noudatettava määrättäessä Risperdal Consta -valmistetta näille potilaille (ks. kohta Annostus ja antotapa).
Antotapa
Tulee huolehtia siitä, ettei Risperdal Consta -valmistetta injisoida vahingossa verisuoneen.
Apuaineet
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) annosta kohden eli se on olennaisesti natriumiton.
Yhteisvaikutukset
Risperdal Consta -valmisteen ja muiden samanaikaisesti käytettyjen lääkkeiden yhteisvaikutuksia ei ole järjestelmällisesti tutkittu. Tässä kohdassa esitetyt tiedot lääkkeiden yhteisvaikutuksista perustuvat suun kautta otettavalla Risperdalilla tehtyihin tutkimuksiin.
Farmakodynamiikkaan liittyvät yhteisvaikutukset
QT-aikaa tunnetusti pidentävät lääkkeet
Kuten muidenkin psykoosilääkkeiden kohdalla, varovaisuutta on syytä noudattaa määrättäessä risperidonia samanaikaisesti QT-aikaa tunnetusti pidentävien lääkkeiden, kuten rytmihäiriölääkkeiden (esim. kinidiini, disopyramidi, prokaiiniamidi, propafenoni, amiodaroni, sotaloli), trisyklisten masennuslääkkeiden (esim. amitriptyliini), tetrasyklisten masennuslääkkeiden (esim. maprotiliini), joidenkin antihistamiinien, muiden psykoosilääkkeiden, joidenkin malarialääkkeiden (esim. kiniini ja meflokiini) ja elektrolyyttitasapainoon (hypokalemia, hypomagnesemia) vaikuttavien, bradykardiaa aiheuttavien lääkkeiden ja risperidonin maksassa tapahtuvaa metaboliaa estävien lääkkeiden kanssa. Luettelo on suuntaa-antava eikä se ole kattava.
Keskushermostoon vaikuttavat lääkkeet ja alkoholi
Lisääntyneen sedaatiovaaran vuoksi risperidonia on käytettävä varoen muiden keskushermostoon vaikuttavien aineiden (esim. alkoholi, opiaatit, antihistamiinit ja bentsodiatsepiinit) kanssa.
Levodopa ja dopamiiniagonistit
Risperdal Consta saattaa estää levodopan ja muiden dopamiiniagonistien vaikutusta. Jos näiden lääkkeiden samanaikainen käyttö on välttämätöntä erityisesti loppuvaiheen parkinsonismin hoidossa, potilaalle pitäisi määrätä molempien lääkkeiden osalta pienin tehoava annos.
Hypotensiivisesti vaikuttavat lääkkeet
Myyntiluvan saamisen jälkeen on havaittu kliinisesti merkittävää hypotensiota, kun risperidonia käytettiin samanaikaisesti verenpainetta alentavan lääkityksen kanssa.
Psykostimulantit
Psykostimulanttien (esim. metyylifenidaatin) ja risperidonin samanaikainen käyttö voi johtaa ekstrapyramidaalioireisiin, jos toisen tai molempien em. aineiden annostusta muutetaan (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Farmakokinetiikkaan liittyvät yhteisvaikutukset
Risperidoni metaboloituu pääasiassa CYP2D6:n välityksellä ja vähemmässä määrin CYP3A4:n välityksellä. Sekä risperidoni että sen aktiivinen metaboliitti 9-hydroksirisperidoni ovat P-glykoproteiinin (P-gp:n) substraatteja. CYP2D6:n aktiivisuutta muuttavat aineet tai CYP3A4:ää ja/tai P-gp:n aktiivisuutta voimakkaasti estävät tai indusoivat aineet saattavat vaikuttaa risperidonin aktiivisen antipsykoottisen fraktion farmakokinetiikkaan.
Voimakkaat CYP2D6:n estäjät
Risperdal Consta -valmisteen ja voimakkaan CYP2D6:n estäjän samanaikainen käyttö saattaa suurentaa plasman risperidonipitoisuutta, mutta aktiivisen antipsykoottisen fraktion pitoisuutta plasmassa se suurentaa vähemmän. Voimakas CYP2D6:n estäjä (esim. paroksetiini, ks. jäljempänä) saattaa suurina annoksina suurentaa risperidonin aktiivisen antipsykoottisen fraktion pitoisuuksia. Muut CYP2D6:n estäjät, kuten kinidiini, saattavat oletettavasti vaikuttaa samalla tavoin plasman risperidonipitoisuuksiin. Kun samanaikaisesti käytetyn paroksetiinin, kinidiinin tai muun voimakkaan CYP2D6:n estäjän käyttö etenkin suurina annoksina aloitetaan tai lopetetaan, lääkärin pitää arvioida Risperdal Consta -annos uudelleen.
CYP3A4:n tai P-gp:n estäjät
Risperdal Consta -valmisteen ja voimakkaan CYP3A4:n tai P-gp:n estäjän samanaikainen käyttö saattaa suurentaa risperidonin aktiivisen antipsykoottisen fraktion pitoisuutta plasmassa huomattavasti. Kun itrakonatsolin tai muun voimakkaan CYP3A4:n ja P-gp:n estäjän samanaikainen käyttö aloitetaan tai lopetetaan, lääkärin pitää arvioida Risperdal Consta -annos uudelleen.
CYP3A4:n tai P-gp:n indusorit
Risperdal Consta -valmisteen ja voimakkaan CYP3A4:n tai P-gp:n indusorin samanaikainen käyttö saattaa pienentää risperidonin aktiivisen antipsykoottisen fraktion pitoisuutta plasmassa. Kun karbamatsepiinin tai muun voimakkaan CYP3A4:n ja P-gp:n indusorin samanaikainen käyttö aloitetaan tai lopetetaan, lääkärin pitää arvioida Risperdal Consta -annos uudelleen. CYP3A4:n indusorien vaikutus on aikariippuvaista, ja maksimaalisen vaikutuksen saavuttaminen saattaa viedä vähintään 2 viikkoa hoidon aloittamisen jälkeen. Hoidon lopettamisen jälkeen CYP3A4:n induktion väheneminen saattaa vastaavasti viedä vähintään 2 viikkoa.
Proteiineihin voimakkaasti sitoutuvat lääkkeet
Kun Risperdal Consta -valmistetta käytetään yhdessä proteiineihin voimakkaasti sitoutuvien lääkkeiden kanssa, kumpikaan lääke ei syrjäydy kliinisesti oleellisesti plasman proteiineista.
Muita lääkkeitä samanaikaisesti käytettäessä on tarkistettava kyseisen lääkkeen metaboliareitti ja mahdollinen annoksen säätämisen tarve valmisteen tiedoista.
Pediatriset potilaat
Yhteisvaikutuksia on tutkittu vain aikuisille tehdyissä tutkimuksissa. Näiden tutkimusten tulosten merkitystä pediatrisille potilaille ei tiedetä.
Esimerkkejä
Seuraavassa luetellaan esimerkkejä lääkkeistä, joilla saattaa olla tai joiden osalta on osoitettu, ettei niillä ole, yhteisvaikutuksia risperidonin kanssa:
Muiden lääkevalmisteiden vaikutus risperidonin farmakokinetiikkaan
Bakteeri-infektiolääkkeet:
- Erytromysiini, kohtalainen CYP3A4:n estäjä ja P-gp:n estäjä, ei muuta risperidonin ja aktiivisen antipsykoottisen fraktion farmakokinetiikkaa.
- Rifampisiini, voimakas CYP3A4:n indusori ja P-gp:n indusori, pienensi aktiivisen antipsykoottisen fraktion pitoisuuksia plasmassa.
Antikoliiniesteraasit:
- Donepetsiilin ja galantamiinin, jotka ovat sekä CYP2D6:n että CYP3A4:n substraatteja, ei havaittu vaikuttavan kliinisesti oleellisesti risperidonin ja aktiivisen antipsykoottisen fraktion farmakokinetiikkaan.
Epilepsialääkkeet:
- Karbamatsepiinin, joka on voimakas CYP3A4:n indusori ja P-gp:n indusori, on osoitettu pienentävän risperidonin aktiivisen antipsykoottisen fraktion pitoisuuksia plasmassa. Samankaltaisia vaikutuksia saatetaan havaita käytettäessä esim. fenytoiinia tai fenobarbitaalia, jotka myös indusoivat CYP3A4-maksaentsyymiä ja P-glykoproteiinia.
- Topiramaatti vähensi risperidonin, mutta ei aktiivisen antipsykoottisen fraktion, hyötyosuutta hieman. Tällä yhteisvaikutuksella ei siksi todennäköisesti ole kliinistä merkitystä.
Sieni-infektiolääkkeet:
- Itrakonatsoli, joka on voimakas CYP3A4:n estäjä ja P-gp:n estäjä, suurensi annoksella 200 mg/vrk aktiivisen antipsykoottisen fraktion pitoisuuksia plasmassa noin 70 %, kun risperidoniannokset olivat 2–8 mg/vrk.
- Ketokonatsoli, joka on voimakas CYP3A4:n estäjä ja P-gp:n estäjä, suurensi annoksella 200 mg/vrk risperidonipitoisuuksia plasmassa ja pienensi 9-hydroksirisperidonin pitoisuuksia plasmassa.
Psykoosilääkkeet:
- Fentiatsiinit saattavat suurentaa risperidonipitoisuuksia plasmassa, mutta eivät suurenna aktiivisen antipsykoottisen fraktion pitoisuuksia plasmassa.
Virusinfektiolääkkeet:
- Proteaasin estäjät: Varsinaisia tutkimustietoja ei ole saatavilla, mutta koska ritonaviiri on voimakas CYP3A4:n estäjä ja heikko CYP2D6:n estäjä, ritonaviiri ja ritonaviirilla tehostetut proteaasin estäjät saattavat suurentaa risperidonin aktiivisen antipsykoottisen fraktion pitoisuuksia.
Beetasalpaajat:
- Jotkut beetasalpaajat saattavat suurentaa risperidonin, mutta eivät aktiivisen antipsykoottisen fraktion, pitoisuutta plasmassa.
Kalsiumkanavan salpaajat:
- Verapamiili, joka on kohtalainen CYP3A4:n estäjä ja P-gp:n estäjä, suurentaa risperidonin ja aktiivisen antipsykoottisen fraktion pitoisuuksia plasmassa.
Maha-suolikanavan lääkkeet:
- H2-reseptorin salpaajat: simetidiini ja ranitidiini, jotka ovat CYP2D6:n ja CYP3A4:n heikkoja estäjiä, lisäsivät risperidonin hyötyosuutta, mutta lisäsivät aktiivisen antipsykoottisen fraktion hyötyosuutta vain marginaalisesti.
SSRI-lääkkeet ja trisykliset masennuslääkkeet:
- Fluoksetiini, joka on voimakas CYP2D6:n estäjä, suurentaa risperidonin pitoisuutta plasmassa, mutta suurentaa aktiivisen antipsykoottisen fraktion pitoisuutta plasmassa vähemmän.
- Paroksetiini, joka on voimakas CYP2D6:n estäjä, suurentaa risperidonin pitoisuutta plasmassa, mutta suurentaa enintään annoksina 20 mg/vrk käytettynä aktiivisen antipsykoottisen fraktion pitoisuuksia vähemmän. Suuremmat paroksetiiniannokset saattavat kuitenkin suurentaa risperidonin aktiivisen antipsykoottisen fraktion pitoisuuksia.
- Trisykliset masennuslääkkeet saattavat suurentaa risperidonin, mutta eivät aktiivisen antipsykoottisen fraktion, pitoisuutta plasmassa. Amitriptyliini ei vaikuta risperidonin eikä aktiivisen antipsykoottisen fraktion farmakokinetiikkaan.
- Sertraliiniin, joka on CYP2D6:n heikko estäjä, ja fluvoksamiiniin, joka on CYP3A4:n heikko estäjä, ei enintään annoksina 100 mg/vrk käytettynä liittynyt kliinisesti merkityksellisiä risperidonin aktiivisen antipsykoottisen fraktion pitoisuuden muutoksia. Sertraliini tai fluvoksamiini saattavat kuitenkin annosta 100 mg/vrk suurempina annoksina käytettynä suurentaa risperidonin aktiivisen antipsykoottisen fraktion pitoisuuksia.
Risperidonin vaikutus muiden lääkevalmisteiden farmakokinetiikkaan
Epilepsialääkkeet:
- Risperidonilla ei ole kliinisesti merkityksellisiä vaikutuksia valproaatin tai topiramaatin farmakokinetiikkaan.
Psykoosilääkkeet:
- Aripipratsoli, CYP2D6:n ja CYP3A4:n substraatti: Risperidonitabletit tai -injektiot eivät vaikuttaneet aripipratsolin ja sen aktiivisen metaboliitin, dehydroaripipratsolin, yhteismäärän farmakokinetiikkaan.
Digitalisglykosidit:
- Risperidonin ei osoitettu vaikuttavan kliinisesti oleellisesti digoksiinin farmakokinetiikkaan.
Litium:
- Risperidonin ei osoitettu vaikuttavan kliinisesti oleellisesti litiumin farmakokinetiikkaan.
Risperidonin samanaikainen käyttö furosemidin kanssa
- Ks. kohdasta Varoitukset ja käyttöön liittyvät varotoimet tiedot furosemidia samanaikaisesti käyttäneiden iäkkäiden dementiapotilaiden lisääntyneestä kuolleisuudesta.
Raskaus ja imetys
Raskaus
Ei ole olemassa tarkkoja tietoja risperidonin käytöstä raskaana oleville naisille. Risperidonilla ei todettu tutkimuksissa teratogeenisia vaikutuksia, mutta muita lisääntymistoksisia vaikutuksia havaittiin (ks. kohta Prekliiniset tiedot turvallisuudesta). Mahdollista riskiä ihmisille ei tunneta.
Psykoosilääkkeille (myös Risperdal Consta -valmisteelle) kolmannen raskauskolmanneksen aikana altistuneilla vastasyntyneillä on ekstrapyramidaali- ja lääkevieroitusoireiden riski. Oireiden vaikeusaste ja kesto synnytyksen jälkeen voi vaihdella. Näitä vastasyntyneillä esiintyviä oireita voivat olla agitaatio, hypertonia, hypotonia, vapina, uneliaisuus, hengitysvaikeus tai syömishäiriöt. Siksi vastasyntyneiden vointia pitää seurata huolellisesti.
Risperdal Consta -valmistetta ei pitäisi käyttää raskauden aikana, mikäli käyttö ei ole selvästi välttämätöntä.
Imetys
Eläinkokeissa risperidonin ja 9-hydroksirisperidonin on todettu erittyvän maitoon. Risperidonin ja 9-hydroksirisperidonin on osoitettu erittyvän pieninä määrinä rintamaitoon myös ihmisellä. Mahdollisista haitoista imetettäville lapsille ei ole tietoja. Siksi imetyksen hyödyt on punnittava lapselle mahdollisesti koituviin riskeihin nähden.
Hedelmällisyys
Risperdal Consta suurentaa muiden dopamiini D2 -reseptorien antagonistien tavoin prolaktiinipitoisuutta. Hyperprolaktinemia saattaa vähentää GnRH:n vapautumista hypotalamuksesta, jolloin gonadotropiinin erittyminen aivolisäkkeestä vähenee. Tämä saattaa puolestaan estää lisääntymistoimintoja heikentämällä steroidien muodostumista sekä nais- että miespotilaiden sukupuolirauhasissa. Nonkliinisissä tutkimuksissa ei havaittu oleellisia vaikutuksia.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Risperdal Consta vaikuttaa hieman tai kohtalaisesti ajokykyyn ja kykyyn käyttää koneita, koska hermostoon ja näkökykyyn kohdistuvat vaikutukset ovat mahdollisia (ks. kohta Haittavaikutukset). Potilasta on siksi kehotettava välttämään ajamista ja koneiden käyttöä, kunnes hänen yksilöllinen herkkyytensä Risperdal Consta -valmisteelle tiedetään.
Haittavaikutukset
Yleisimmin ilmoitettuja (esiintyvyys ≥ 1/10) haittavaikutuksia olivat unettomuus, ahdistuneisuus, päänsärky, ylähengitystieinfektio, parkinsonismi ja masennus.
Haittavaikutuksia, jotka vaikuttivat esiintyneen suhteessa annokseen, olivat parkinsonismi ja akatisia. Myyntiluvan saamisen jälkeen on ilmoitettu vakavia antopaikan reaktioita, kuten pistoskohdan nekroosi, märkäpesäke, selluliitti, haavauma, verenpurkauma, kysta ja kyhmy. Haittavaikutusten esiintymistiheyttä ei tunneta (koska saatavissa oleva tieto ei riitä arviointiin). Yksittäisissä tapauksissa haittavaikutuksen hoitaminen on vaatinut kirurgisen toimenpiteen.
Seuraavassa on lueteltu kaikki kliinisissä tutkimuksissa ja myyntiluvan saamisen jälkeisen risperidonin käytön yhteydessä ilmoitetut haittavaikutukset Risperdal Consta -valmisteen kliinisten tutkimusten esiintyvyysluokkien mukaisesti arvioituna. Haittavaikutusten esiintymistiheys ilmoitetaan seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000) ja tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Elinjärjestelmä | Haittavaikutus | |||||
Esiintyvyys | ||||||
| Hyvin yleinen | Yleinen | Melko harvinainen | Harvinainen | Hyvin harvinainen | Tuntematon |
Infektiot | ylähengitystie-infektio | keuhkokuume, keuhkoputkitulehdus, sinuiitti, virtsatieinfektio, influenssa | hengitystieinfektio, kystiitti, korvatulehdus, silmätulehdus, tonsilliitti, kynsisilsa, selluliitti, infektio, paikallinen infektio, virusinfektio, punkin aiheuttama ihottuma, ihonalainen abskessi |
|
|
|
Veri ja imukudos |
| anemia | veren valkosolujen määrän lasku, trombosytopenia, pienentynyt hematokriitti | agranulosytoosic, neutropenia, eosinofiilien määrän nousu |
|
|
Immuunijärjestelmä |
|
| yliherkkyys | anapfylaktinen reaktioc |
|
|
Umpieritys |
| hyperprolaktinemiaa | glukoosin esiintyminen virtsassa | antidiureettisen hormonin epäasianmukainen eritys |
|
|
Aineenvaihdunta ja ravitsemus |
| hyperglykemia, painon nousu, ruokahalun lisääntyminen, painon lasku, ruokahalun heikkeneminen | diabetes mellitusb, ruokahaluttomuus, suurentunut veren triglyseridipitoisuus, suurentunut veren kolesterolipitoisuus | vesimyrkytysc, hypoglykmia, hyperinsulinemiac, polydipsia | diabeettinen ketoasidoosi |
|
Psyykkiset häiriöt | unettomuusd, masennus, ahdistuneisuus | unihäiriö, agitaatio, sukuvietin heikkeneminen | mania, sekavuustila, orgasmivaikeus, hermostuneisuus, painajaiset | katatonia, unissakävely, unen aikainen syömishäiriö, tunnetilojen latistuminen |
|
|
Hermosto | parkinsonismid, päänsärky | sedaatio/uneliaisuus, akatisiad, dystoniad, huimaus, dyskinesiad, vapina | tardiivi dyskinesia, aivoiskemia, tajunnanmenetys, kouristusd, pyörtyminen, psykomotorinen yliaktiivisuus, tasapainohäiriö, koordinaation poikkeavuus, asentohuimaus, tarkkaavuushäiriö, puhehäiriö, makuaistin häiriö, hypestesia, parestesiat | maligni neurolepti-oireyhtymä, aivoverisuoni-häiriö, reagoimattomuus ärsykkeisiin, tajunnantason aleneminen, diabeettinen kooma, pään vapina |
|
|
Silmät |
| näön sumeneminen | sidekalvotulehdus, kuivat silmät, kyynelnesteen erityksen lisääntyminen, silmän verekkyys | verkkokalvon valtimon tukos, silmänpainetauti, silmien liikehäiriö, silmien pyöritys, valonarkuus, silmäluomen reunan karstottuminen, IFIS-oireyhtymä (leikkauksen yhteydessä)c |
|
|
Kuulo ja tasapainoelin |
|
| kiertohuimaus, tinnitus, korvakipu |
|
|
|
Sydän |
| takykardia | eteisvärinä, eteis-kammiokatkos, johtumishäiriö, EKG:ssä havaittava QT-ajan piteneminen, bradykardia, EKG-poikkeamat, sydämentykytys | sinusperäinen rytmihäiriö |
|
|
Verisuonisto |
| matala verenpaine, korkea verenpaine | ortostaattinen hypotensio | keuhkoembolia, laskimotromboosi, punastelu |
|
|
Hengityselimet, rintakehä ja välikarsina |
| hengenahdistus, nielun ja kurkunpään kipu, yskä, nenän tukkoisuus | hyperventilaatio, hengitysteiden verentungos, hengityksen vinkuminen, nenäverenvuoto | uniapnea-oireyhtymä, aspiraatio-keuhkokuume, keuhkostaasi, keuhkojen rahinat, dysfonia, hengityshäiriö |
|
|
Ruoansulatus-elimistö |
| vatsakipu, epämukavat tuntemukset vatsassa, oksentelu, pahoinvointi, ummetus, gastroenteriitti, ripuli, ruoansulatusvaivat, suun kuivuminen, hammaskipu | ulosteenpidätys-kyvyttömyys, nielemishäiriö, ilmavaivat | haimatulehdus, suolitukos, kielen turpoaminen, fekalooma, huulitulehdus | ileus |
|
Iho ja ihonalainen kudos |
| ihottuma | kutina, hiustenlähtö, ekseema, kuiva iho, ihon punoitus, ihon värimuutos, akne, seborrooinen ihottuma | lääkeaineihottuma, urtikaria, hyperkeratoosi, hilse, ihotauti, iholeesio | angioödeema | Stevens-Johnsonin oireyhtymä / toksinen epidermaalinen nekrolyysic |
Luusto, lihakset ja sidekudos |
| lihasspasmit, luuston ja lihasten kipu, selkäkipu, nivelkipu | suurentunut veren kreatiinifosfokinaasi-pitoisuus, nivelten jäykkyys, nivelten turvotus, lihasten heikkous, niskakipu | rabdomyolyysi, poikkeava asento |
|
|
Munuaiset ja virtsatiet |
| virtsanpidätys-kyvyttömyys | tiheävirtsaisuus, virtsaumpi, virtsaamisvaivat |
|
|
|
Raskauteen, synnytykseen ja perinataalikauteen liittyvät haitat |
|
|
| Vastasyntyneen lääkeaine-vieroitus-oireyhtymäc |
|
|
Sukupuolielimet ja rinnat |
| erektiohäiriö, amenorrea, maidonvuoto | ejakulaatiohäiriö, kuukautisten viivästyminen, kuukautishäiriöd, gynekomastia, seksuaalinen toimintahäiriö, rintarauhaskipu, epämukavat tuntemukset rinnoissa, emätinerite | priapismic, rintojen turpoaminen, rintojen suureneminen, erite rinnoista |
|
|
Yleisoireet ja antopaikassa todettavat haitat |
| turvotusd, kuume, rintakipu, heikkous, väsymys, kipu, antopaikan reaktio | kasvojen turvotus, vilunväristykset, ruumiinlämmön kohoaminen, kävelyn häiriöt, jano, epämiellyttävä tunne rinnassa, huonovointisuus, epänormaali olo, kovettumac | hypotermia, ruumiinlämmön aleneminen, ääreisosien kylmyys, lääkehoidon vieroitus-oireyhtymä, epämukava olo |
|
|
Maksa ja sappi |
| suurentunut transaminaasi-pitoisuus, suurentunut gammaglutamyyli-transferaasipitoisuus | suurentunut maksaentsyymi-pitoisuus | ikterus |
|
|
Vammat ja myrkytykset |
| kaatumiset | toimenpiteeseen liittyvä kipu |
|
|
|
a Veren suuri prolaktiinipitoisuus saattaa joissakin tapauksissa aiheuttaa gynekomastiaa, kuukautishäiriöitä, amenorreaa, anovulaatiota, maidonvuotoa, hedelmällisyyden häiriöitä, sukupuolista haluttomuutta tai erektiohäiriöitä. bLumelääkekontrolloiduissa tutkimuksissa diabetesta raportoitiin 0,18 %:lla risperidonihoitoa saaneista potilaista verrattuna 0,11 %:n esiintyvyyteen lumelääkeryhmässä. Kokonaisesiintyvyys kaikissa kliinisissä tutkimuksissa risperidonia saaneilla potilailla oli 0,43 %. c Ei havaittu Risperdal Consta ‑valmisteella tehdyissä kliinisissä tutkimuksissa, mutta havaittiin risperidonin käytön yhteydessä myyntiluvan saamisen jälkeen. d Ekstrapyramidaalihäiriöitä voi esiintyä: parkinsonismi (runsas syljeneritys. luurankolihasten kankeus, parkinsonismi, kuolaaminen, hammasratasilmiö, bradykinesia, hypokinesia, kasvojen ilmeettömyys, lihaskireys, akinesia, niskajäykkyys, lihasjäykkyys, parkinsonistinen kävely, epänormaali glabella-heijaste, parkinsonistinen lepovapina), akatisia (akatisia, levottomuus, hyperkinesia, levottomat jalat –oireyhtymä), vapina, dyskinesia (dyskinesia, lihasnykäykset, koreoatetoosi, atetoosi ja myoklonus), dystonia. Dystonia kattaa seuraavat oireet: dystonia, hypertonia, torticollis, tahdosta riippumattomat lihassupistukset, lihaskontraktuura, luomikouristus, silmien kiertoliike (okulogyraatio), kielihalvaus, kasvojen spasmi, kurkunpään kouristus, myotonia, opistotonus, suunieluspasmi, pleurototonus, kielispasmi ja leukalukko. On huomattava, että luettelo sisältää laajan kirjon oireita, joiden syntymekanismi ei välttämättä ole ekstrapyramidaalinen. Unettomuus kattaa seuraavat: nukahtamisvaikeus, katkonainen uni. Kouristukset kattavat seuraavat: grand mal ‑kouristukset. Kuukautishäiriöt kattavat seuraavat: epäsäännölliset kuukautiset, harvat kuukautiset. Turvotus kattaa seuraavat: yleistynyt turvotus, raajojen turvotus, kuoppaturvotus. | ||||||
Paliperidonin lääkemuotojen käytön yhteydessä havaitut haittavaikutukset
Paliperidoni on risperidonin aktiivinen metaboliitti, joten näiden yhdisteiden (sekä suun kautta otettavien että injektiona annettavien lääkemuotojen) haittavaikutusprofiilit ovat toistensa kannalta oleelliset. Edellä mainittujen haittavaikutusten lisäksi paliperidonivalmisteiden käytön yhteydessä on havaittu seuraavia haittavaikutuksia ja niitä voidaan odottaa esiintyvän myös Risperdal Consta -valmisteen käytön yhteydessä.
Sydän
Pystyasennon provosoima takykardia.
Anafylaktiset reaktiot
Risperdal Consta -injektion annon jälkeen on valmisteen markkinoilletulon jälkeisenä aikana raportoitu harvinaisina tapauksina anafylaktisia reaktioita potilailla, jotka ovat aiemmin sietäneet suun kautta otettua risperidonia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Luokkavaikutukset
Kuten muidenkin psykoosilääkkeiden käytön yhteydessä, myös risperidonilla on myyntiluvan saamisen jälkeen raportoitu hyvin harvoin QT-ajan pidentymiä. Muita psykoosilääkkeillä raportoituja QT-aikaa pidentäviä sydänoireita voivat olla kammioperäinen rytmihäiriö, kammiovärinä, kammioperäinen takykardia, äkkikuolema, sydänpysähdys ja kääntyvien kärkien takykardia.
Laskimotromboosi
Antipsykoottisten lääkkeiden käytön yhteydessä on raportoitu esiintyneen laskimotukoksia, keuhkoemboliaa ja syviä laskimotukoksia (näiden yleisyys on tuntematon).
Painon nousu
Yhdessä 12 viikkoa kestäneessä kaksoissokkoutetussa lumekontrolloidussa tutkimuksessa 9 prosentilla Risperdal Consta -valmistetta saaneista potilaista todettiin ≥ 7 % painon nousu tutkimuksen päättyessä. Lumelääkettä saaneilla potilailla vastaava painon nousu todettiin 6 prosentilla potilaista. Vuoden kestäneessä avoimessa Risperdal Consta -tutkimuksessa painon muutokset olivat yleensä ± 7 % lähtötilanteeseen verrattuna ja 25 prosentilla potilaista painon nousu oli ≥ 7 %.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yliannostus on vähemmän todennäköistä parenteraalisesti annetun kuin suun kautta otetun lääkityksen yhteydessä. Tässä esitetyt yliannostustiedot liittyvät suun kautta otettuun risperidoniin.
Oireet
Raportoidut oireet ja löydökset ovat yleensä johtuneet risperidonin tunnettujen farmakologisten vaikutusten ylikorostumisesta. Oireita ovat olleet väsymys ja sedaatio, takykardia ja hypotensio sekä ekstrapyramidaalioireet. Yliannostuksen yhteydessä on raportoitu QT-ajan pitenemistä ja kouristuksia. Suun kautta otetun Risperdalin ja paroksetiinin samanaikaisen yliannostuksen yhteydessä on raportoitu kääntyvien kärkien takykardiaa.
Akuutin yliannostuksen yhteydessä on pidettävä mielessä mahdollisuus useiden lääkkeiden osallisuudesta.
Hoito
Hengitystiet tulee pitää vapaana ja taata riittävä hapen saanti. Sydämen toiminnan seuraaminen aloitetaan välittömästi ja EKG:tä seurataan jatkuvasti mahdollisten arytmioiden diagnosoimiseksi.
Risperidonille ei ole olemassa tunnettua vastavaikuttajaa. Siksi hoito Risperdalin yliannosten yhteydessä on elintoimintoja tukevaa. Hypotensiota ja mahdollista verenkierron sokkitilaa pitää hoitaa asianmukaisesti suonensisäisillä infuusioilla ja/tai sympatomimeettisillä lääkkeillä. Vaikeiden ekstrapyramidaalioireiden ilmetessä pitää antaa antikolinergista lääkettä. Huolellista seurantaa on jatkettava potilaan toipumiseen asti.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: muut psykoosilääkkeet: ATC-koodi: N05AX08
Vaikutusmekanismi
Risperidoni on selektiivinen monoamiinien vaikutuksia salpaava aine, jonka ominaisuudet poikkeavat perinteisistä neurolepteista. Risperidoni sitoutuu voimakkaasti serotonergisiin 5-HT2- ja dopaminergisiin D2-reseptoreihin. Risperidoni salpaa myös alfa-1-adrenergisia reseptoreita ja jonkin verran heikommin H1-histaminergisiä ja alfa-2-adrenergisia reseptoreita. Risperidoni ei sitoudu kolinergisiin reseptoreihin. Vaikka risperidoni onkin voimakas D2-reseptoriantagonisti, jonka vaikutuksen arvellaan lievittävän skitsofrenian positiivisia oireita, se aiheuttaa vähemmän katalepsiaa ja heikentää motorisia toimintoja vähemmän kuin perinteiset psykoosilääkkeet. Vallitseva sentraalinen serotoniiniantagonismi saattaa vähentää risperidonin alttiutta aiheuttaa ekstrapyramidaalisia haittavaikutuksia ja laajentaa sen terapeuttista aktiivisuutta skitsofrenian negatiivisiin ja affektiivisiin oireisiin.
Kliininen teho
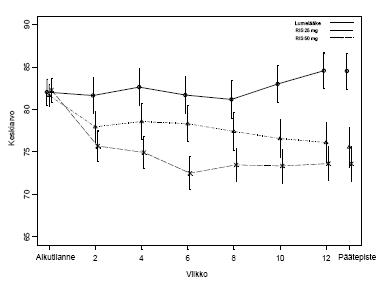
Risperdal Consta -valmisteen (25 mg ja 50 mg) tehoa psykoottisten sairauksien (skitsofrenia/skitsoaffektiivinen häiriö) oireiden hoidossa selvitettiin yhdessä 12 viikon pituisessa lumelääkekontrolloidussa tutkimuksessa psykoottisilla sairaala- ja avohoidossa olleilla aikuispotilailla, jotka täyttivät skitsofrenian DSM-IV-kriteerit.
Vakaassa vaiheessa olevilla skitsofreniapotilailla tehdyssä 12 viikon pituisessa vertailututkimuksessa Risperdal Consta -valmisteen osoitettiin olevan yhtä tehokas kuin suun kautta otettava tablettimuoto. Risperdal Consta -valmisteen pitkäaikaista (50 viikkoa) turvallisuutta ja tehoa arvioitiin myös avoimessa tutkimuksessa vakaassa vaiheessa sairaala- tai avohoidossa olleilla potilailla, jotka täyttivät skitsofrenian tai skitsoaffektiivisen sairauden DSM-IV-kriteerit. Risperdal Consta -valmisteen teho säilyi tutkitun ajanjakson ajan (Kuva 1).
Kuva 1. Keskimääräinen PANSS-kokonaispistemäärä ajan kuluessa (LOCF, last observation carried forward) skitsofreniapotilailla.
Farmakokinetiikka
Imeytyminen
Risperdal Consta -valmisteen sisältämä risperidoni imeytyy täydellisesti.
Lihakseen annetun Risperdal Consta -kertainjektion jälkeinen lääkeaineen vapautumisprofiili muodostuu vähäisestä lääkeaineen alkuvapautumisesta (< 1 % annoksesta), jota seuraa kolmen viikon viiveaika. Lääkeaineen varsinainen vapautuminen alkaa viikosta 3 eteenpäin, säilyy viikot 4–6 ja loppuu viikkoon 7 mennessä. Suun kautta otettavaa antipsykoottista lisälääkitystä tulisi siksi antaa Risperdal Consta -hoidon kolmen ensimmäisen viikon ajan (ks. kohta Annostus ja antotapa).
Lääkeaineen vapautumisprofiili ja annosteluohjelma (injektio lihakseen kahden viikon välein) saavat yhdessä aikaan vakaan terapeuttisen pitoisuuden plasmassa. Terapeuttinen pitoisuus säilyy plasmassa 4–6 viikkoa viimeisen Risperdal Consta -injektion jälkeen.
Toistuvien kahden viikon välein lihakseen annettujen Risperdal Consta 25 mg tai 50 mg -injektioiden jälkeen aktiivisen antipsykoottisen fraktion minimipitoisuuden mediaani vaihteli 9,9–19,2 ng/ml:n välillä ja huippupitoisuuden 17,9–45,5 ng/ml välillä. Risperidonin kertymistä ei ollut havaittavissa pitkäaikaisen käytön (12 kuukautta) aikana potilailla, jotka saivat pistoksena 25–50 mg kahden viikon välein.
Näissä tutkimuksissa injektiot annettiin pakaralihakseen. Hartia- ja pakaralihakseen annettavat samansuuruiset annokset ovat biologisesti samanarvoiset ja siksi keskenään vaihtokelpoiset.
Jakautuminen
Risperidoni jakaantuu nopeasti, jakaantumistilavuus on 1–2 l/kg. Risperidoni sitoutuu plasmassa albumiiniin ja happamaan alfa-1-glykoproteiiniin. Risperidonista plasman proteiineihin sitoutuu 90 % ja aktiivisesta metaboliitista 9-hydroksirisperidonista 77 %.
Biotransformaatio ja eliminaatio
Risperidoni metaboloituu CYP2D6-entsyymin välityksellä 9-hydroksirisperidoniksi, jolla on risperidonin kaltaiset farmakologiset vaikutukset. Risperidoni ja 9-hydroksirisperidoni tuottavat yhdessä aktiivisen antipsykoottisen vaikutuksen. CYP2D6-entsyymeissä ilmenee geneettistä polymorfiaa. Nopeilla CYP2D6-metaboloijilla risperidoni muuttuu nopeasti 9-hydroksirisperidoniksi, kun taas heikoilla metaboloijilla muuttuminen tapahtuu paljon hitaammin. Vaikkakin nopeilla metaboloijilla risperidonipitoisuus on pienempi ja 9-hydroksirisperidonipitoisuus suurempi kuin heikoilla metaboloijilla, aineiden yhdistetyt farmakokineettiset ominaisuudet (aktiivinen antipsykoottinen fraktio) kerta-annoksen ja toistuvien annosten jälkeen ovat samanlaiset nopeilla ja heikoilla metaboloijilla.
Toinen risperidonin metaboliareitti on N-dealkylaatio. Ihmisen maksan mikrosomeilla tehdyt in vitro -tutkimukset osoittivat, että kliinisesti merkitsevinä pitoisuuksina risperidoni ei olennaisesti estä sytokromi P450-isotsyymien, kuten CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4, ja CYP3A5, välityksellä metaboloituvien lääkeaineiden vaikutusta. Viikon kuluttua suun kautta otetusta risperidoniannoksesta 70 % annoksesta oli erittynyt virtsaan ja 14 % ulosteeseen. Virtsassa risperidonin ja 9-hydroksirisperidonin osuus suun kautta otetusta annoksesta oli 35–45 %. Loppu on inaktiivisia metaboliitteja. Risperidoni on kokonaan eliminoitunut noin 7–8 viikon kuluttua viimeisestä Risperdal Consta -injektiosta.
Lineaarisuus
Risperidonin farmakokinetiikka on lineaarinen annosvälillä 25–50 mg kahden viikon välein annetun injektion jälkeen.
Iäkkäät potilaat, maksan ja munuaisten vajaatoiminta
Suun kautta otettavalla risperidonilla tehdyssä farmakokineettisessä kerta-annostutkimuksessa risperidonin aktiivisen antipsykoottisen vaikutuksen omaavan fraktion pitoisuudet plasmassa olivat iäkkäillä potilailla keskimäärin 43 % normaalia korkeampia. Aktiivisen antipsykoottisen fraktion puoliintumisaika piteni 38 % ja puhdistuma pieneni iäkkäillä potilailla 30 %. Aktiivisen osan puhdistuma oli keskivaikeaa munuaissairautta sairastavilla aikuisilla noin 48 % nuorten terveiden aikuisten (25–35-vuotiaiden) puhdistumasta. Vaikeaa munuaissairautta sairastavilla aikuisilla aktiivisen osan puhdistuma oli noin 31 % nuorten terveiden aikuisten puhdistumasta. Aktiivisen osan puoliintumisaika oli nuorilla aikuisilla 16,7 h, keskivaikeaa munuaissairautta sairastavilla aikuisilla 24,9 h (eli noin 1,5 kertaa pidempi kuin nuorilla aikuisilla) ja vaikeaa munuaissairautta sairastavilla 28,8 h (eli noin 1,7 kertaa pidempi kuin nuorilla aikuisilla). Maksainsuffisienssipotilailla pitoisuudet plasmassa olivat normaaleja, mutta risperidonin keskimääräinen vapaa fraktio plasmassa lisääntyi 37,1 %. Suun kautta otetun risperidonin ja aktiivisen osan puhdistuma ja eliminaation puoliintumisaika eivät eronneet keskivaikeaa ja vaikeaa maksan vajaatoimintaa sairastavilla aikuisilla merkittävästi nuorten terveiden aikuisten parametreista.
Farmakokineettinen/farmakodynaaminen suhde
Yhdessäkään faasi 3:n tutkimuksessa, jossa tutkittiin risperidonin tehoa ja turvallisuutta, ei havaittu yhteyttä plasmassa mitatun aktiivisen antipsykoottisen fraktion pitoisuuden ja PANSS-asteikon (Positive And Negative Syndrome Scale) tai ESRS-asteikon (Extrapyramidal Symptom Rating Scale) kokonaispistemäärissä tutkimuksen aikana tapahtuneiden muutosten välillä.
Sukupuoli, rotu ja tupakointi
Populaatiofarmakokineettisessä analyysissa ei tullut esiin näyttöä sukupuoleen, rotuun tai tupakointiin liittyvistä eroista risperidonin farmakokinetiikassa tai aktiivisessa antipsykoottisessa fraktiossa.
Prekliiniset tiedot turvallisuudesta
Rotilla ja koirilla suun kautta otettavalla risperidonilla tehtyihin pitkäaikaistoksisuustutkimuksiin nähden yhdenmukaisesti Risperdal Consta -hoidonkin (enintään 12 kuukauden ajan lihakseen annettuna) pääasialliset vaikutukset olivat risperidonin farmakodynaamiseen aktiivisuuteen liittyvät prolaktiinivälitteinen maitorauhasen stimuloituminen, muutokset urosten ja naaraiden sukuelimissä sekä keskushermostovaikutukset. Nuorilla, risperidonia suun kautta saaneilla rotilla tehdyssä toksisuustutkimuksessa havaittiin lisääntynyttä poikaskuolleisuutta ja fyysisen kehityksen hidastumista. Nuorilla, risperidonia suun kautta saaneilla koirilla tehdyssä 40 viikkoa kestäneessä tutkimuksessa koirien sukupuolinen kypsyminen oli hidastunut. AUC-arvon perusteella 3,6 kertaa ihmisen suurin oraalinen altistus nuorille (1,5 mg/vrk) ei vaikuttanut koirien pitkien luiden kasvuun, mutta 15 kertaa ihmisen suurimman oraalisen altistuksen nuorille havaittiin vaikuttavan pitkiin luihin ja sukupuoliseen kypsymiseen.
Risperidoni ei ollut teratogeeninen rotalla eikä kaniinilla. Rotilla tehdyissä lisääntymistutkimuksissa risperidonin todettiin vaikuttavan kielteisesti vanhempien parittelukäyttäytymiseen ja jälkeläisten syntymäpainoon ja eloonjäämiseen. Rotilla risperidonille altistumiseen kohdussa liittyi kognitiivisia häiriöitä aikuisiässä. Tiineille eläimille annettujen muiden dopamiiniantagonistien on todettu heikentävän jälkeläisten oppimiskykyä ja motorista kehitystä.
Uros- ja naarasrotille 12 ja 24 kuukauden ajan annettu Risperdal Consta aiheutti osteodystrofiaa annostuksella 40 mg/kg/2 viikkoa. Rotilla osteodystrofiaa aiheuttava annos oli mg/m2-yksiköiden perusteella kahdeksankertainen ihmiselle suositeltuun enimmäisannokseen nähden, jolloin plasmaan kohdistuu kaksinkertainen altistus ihmiselle suositellulla enimmäisannoksella ennakoituun suurimpaan altistukseen nähden. Risperdal Consta -hoitoa annostuksella enintään 20 mg/kg/2 viikkoa 12 viikon ajan saaneilla koirilla ei havaittu osteodystrofiaa. Tällä annostuksella plasmaan kohdistuva altistus oli jopa 14-kertainen ihmiselle suositeltuun enimmäisannostukseen nähden.
Genotoksisista vaikutuksista ei ole näyttöä.
Voimakkaalle dopamiini-D2-antagonistille odotetusti rotilla ja hiirillä suun kautta otettavalla risperidonilla tehdyissä karsinogeenisuustutkimuksissa havaittiin aivolisäkeadenoomien lisääntymistä (hiirillä), endokriinisten haima-adenoomien lisääntymistä (rotilla) ja maitorauhasen adenoomien lisääntymistä (kummallakin lajilla).
Wistar (Hannover) -rotilla lihakseen annettavalla Risperdal Consta -valmisteella tehdyssä karsinogeenisuustutkimuksessa (annoksilla 5 mg/kg/2 viikkoa ja 40 mg/kg/2 viikkoa) havaittiin endokriinisen haimaneoplasian, aivolisäkkeen ja lisämunuaisytimen kasvainten sekä lisämunuaisten feokromosytooman esiintyvyyden lisäys annoksella 40 mg/kg, kun maitorauhasen kasvaimia esiintyi annoksilla 5 mg/kg ja 40 mg/kg. Nämä suun kautta ja lihakseen annetun lääkkeen käytön jälkeen havaitut kasvaimet saattavat liittyä pitkäaikaiseen dopamiini-D2-antagonismiin ja hyperprolaktinemiaan. Kudosviljelytutkimusten tulokset viittaavat siihen, että prolaktiini saattaa stimuloida ihmisen rintakasvainten solukasvua. Hyperkalsemiaa, jonka oletetaan lisäävän lisämunuaisytimen kasvainten esiintyvyyttä Risperdal Consta -valmistetta saaneilla rotilla, havaittiin kummassakin annosryhmässä. Siitä ei ole näyttöä, että hyperkalsemia aiheuttaisi feokromosytoomaa ihmiselle.
Munuaistiehyiden adenoomaa esiintyi Risperdal Consta -valmistetta saaneilla urosrotilla annoksilla 40 mg/kg/2 viikkoa. Munuaiskasvaimia ei esiintynyt pienillä annoksilla, 0,9 % natriumkloridia tai mikroraevehikkeliä saaneilla kontrolliryhmillä. Risperdal Consta -hoitoa saaneiden urospuolisten Wistar (Hannover) -rottien munuaiskasvainten taustalla olevaa mekanismia ei tunneta. Hoitoon liittyvää lisäystä munuaiskasvainten esiintymisessä ei esiintynyt Wistar (Wiga) -rotilla tehdyissä suun kautta annettavan lääkityksen karsinogeenisuustutkimuksissa eikä Swiss-hiirillä, kun niille annettiin risperidonia suun kautta. Alakantojen välisten kasvain-elinprofiiliin liittyvien erojen selvittämiseksi tehdyt tutkimukset viittaavat siihen, että karsinogeenisuustutkimuksissa käytetty Wistar (Hannover) -alakanta eroaa merkittävästi suun kautta annettavan lääkityksen karsinogeenisuustutkimuksessa käytetystä Wistar (Wiga) -kannasta spontaanien iästä riippuvaisten ei-neoplastisten munuaismuutosten, seerumin prolaktiinipitoisuuden nousun ja munuaisissa vasteena risperidonille ilmenneiden muutosten osalta. Siihen viittaavaa tietoa ei ole, että pitkäkestoisesti Risperdal Consta -valmistetta saaneilla koirilla esiintyisi munuaisiin liittyviä muutoksia.
Osteodystrofian, prolaktiinisidonnaisten kasvainten sekä rotilla alakantakohtaisiksi otaksuttujen munuaiskasvainten riskiä ihmiselle ei tiedetä.
Injektiokohdan paikallista ärsytystä havaittiin koirilla ja rotilla suurten Risperdal Consta -annosten annon jälkeen. Rotilla tehdyssä 24 kuukauden mittaisessa karsinogeenisuustutkimuksessa ei todettu injektiokohdan kasvainten esiintyvyyden lisääntymistä vehikkeliä tai vaikuttavaa lääkeainetta lihaksensisäisesti saaneissa ryhmissä.
Eläinmalleilla on osoitettu in vitro ja in vivo, että suuret risperidoniannokset saattavat aiheuttaa QT-ajan pitenemistä. QT-ajan piteneminen on yhdistetty kääntyvien kärkien takykardian teoreettisesti suurentuneeseen riskiin potilailla.
Farmaseuttiset tiedot
Apuaineet
Kuiva-aine: poly-(d,1-laktidi-koglykolidi)
Liuotin: polysorbaatti 20, karmelloosinatrium, dinatriumvetyfosfaattidihydraatti, vedetön sitruunahappo, natriumkloridi, natriumhydroksidi, injektionesteisiin käytettävä vesi.
Yhteensopimattomuudet
Tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa, lukuun ottamatta niitä, jotka mainitaan kohdassa Erityiset varotoimet hävittämiselle ja muut käsittelyohjeet.
Kestoaika
3 vuotta (2 °C – 8 °C).
Käyttövalmiiksi saattamisen jälkeen: 24 tunnin käytönaikainen kemiallinen ja fysikaalinen säilyvyys on osoitettu 25 ºC:ssa.
Mikrobiologiselta kannalta valmiste tulisi käyttää välittömästi. Ellei valmistetta käytetä heti, käytönaikaiset säilytysajat ja -olosuhteet ennen käyttöä ovat käyttäjän vastuulla eikä niiden tulisi tavallisesti ylittää 6 tuntia 25 ºC:ssa, ellei käyttövalmiiksi saattaminen ole tapahtunut kontrolloiduissa ja validoiduissa aseptisissa olosuhteissa.
Säilytys
Säilytä koko annospakkaus jääkaapissa (2 °C – 8 °C). Herkkä valolle.
Jos jääkaappisäilytys ei ole mahdollinen, Risperdal Consta voidaan säilyttää alle 25 ºC:een lämpötilassa korkeintaan 7 vuorokauden ajan ennen antoa. Säilytä alkuperäispakkauksessa.
Käyttökuntoon saatetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
RISPERDAL CONSTA injektiokuiva-aine ja liuotin, depotsuspensiota varten
25 mg (L:ei) 1 pakkaus (siirtokanyyli, 2 turvaneulaa) (66,40 €)
37,5 mg (L:ei) 1 pakkaus (siirtokanyyli, 2 turvaneulaa) (89,15 €)
50 mg (L:ei) 1 pakkaus (siirtokanyyli, 2 turvaneulaa) (112,98 €)
PF-selosteen tieto
Siirtokanyyli
- yksi injektiopullo injektiokuiva-ainetta
- yksi injektiopullon liitin käyttövalmiiksi saattamista varten
- yksi esitäytetty ruisku, joka sisältää liuotinta Risperdal Consta -valmistetta varten
- kaksi Terumo SurGuard®3 -neulaa lihakseen annettavaa injektiota varten (neulanpistosuojalla varustettu turvaneula 21 G UTW 1" (0,8 mm x 25 mm) hartialihakseen antoa varten ja neulanpistosuojalla varustettu 20 G TW 2” (0,9 mm x 51 mm) turvaneula pakaralihakseen antoa varten).
Risperdal Consta -valmistetta on saatavana yhden injektiopullon pakkauksina.
Valmisteen kuvaus:
Kuiva-aine injektiopullossa: Valkoinen tai luonnonvalkoinen irtonainen jauhe.
Liuotin esitäytetyssä ruiskussa valmiiksisaattamista varten: Kirkas, väritön vesipohjainen liuos.
Käyttö- ja käsittelyohjeet
Tärkeää tietoa
Risperdal Consta -injektion onnistumiseksi on tärkeää, että näitä käyttöohjeita noudatetaan huolellisesti.
Käytä pakkaukseen sisältyviä välineitä
Kerta-annospakkaukseen sisältyvät välineet on suunniteltu erityisesti käytettäväksi Risperdal Consta -valmisteen kanssa. Risperdal Consta -valmisteen saa sekoittaa ainoastaan kerta-annospakkaukseen sisältyvään liuottimeen.
Pakkauksessa olevia välineitä ei saa korvata muilla välineillä.
Älä varastoi liuosta käyttövalmiiksi saattamisen jälkeen
Anna annos mahdollisimman pian käyttövalmiiksi saattamisen jälkeen, jotta liuos ei sakkaudu.
Oikea annostelu
Oikean Risperdal Consta -annoksen varmistamiseksi on annettava injektiopullon koko sisältö.

Älä käytä uudelleen
Lääkinnälliset laitteet edellyttävät materiaalilta erityisiä ominaisuuksia, jotta ne toimivat tarkoitetulla tavalla. Nämä ominaisuudet on varmistettu vain yhtä käyttökertaa varten. Yritykset muuntaa laitetta käytettäväksi myöhemmin uudelleen saattavat vaikuttaa haitallisesti laitteen ominaisuuksiin tai heikentää sen toimintaa.
Pakkauksen sisältö
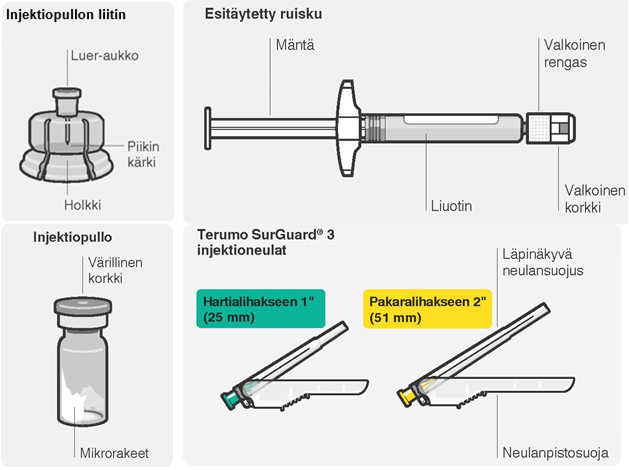

| Ota kerta-annospakkaus esiin | Kiinnitä injektiopullon liitin injektiopulloon | ||
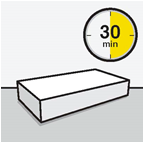 | 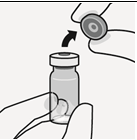 | 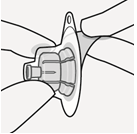 | 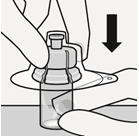 |
Odota 30 minuuttia Ota kerta-annospakkaus jääkaapista ja anna sen lämmetä noin 30 minuutin ajan huoneenlämmössä ennen käyttövalmiiksi saattamista. Älä lämmitä muulla tavoin. | Poista injektiopullon korkki Poista injektiopullosta värillinen korkki. Pyyhi harmaan kumitulpan pinta antiseptisella pyyhkeellä. | Valmistele injektiopullon liitin Pidä steriiliä muovikoteloa kuvan mukaisesti. Älä ota injektiopullon liitintä muovikotelosta. Älä koske piikin kärkeen missään vaiheessa, jotta se ei kontaminoidu. | Kiinnitä injektiopullon liitin injektiopulloon Aseta injektiopullo kovalle alustalle ja pidä kiinni pullon pohjasta. Aseta injektiopullon liitin harmaan kumitulpan keskelle. Paina injektiopullon liitintä kohtisuoraan injektiopulloon, kunnes se napsahtaa tiiviisti paikalleen. Älä paina injektiopullon liitintä vinoon, sillä liuotinta voi tällöin vuotaa siirron aikana injektiopullon ohi.
|
Kiinnitä esitäytetty ruisku injektiopullon liittimeen | |||
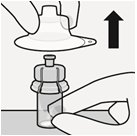 |  |  |  |
Poista steriili muovikotelo
Pidä injektiopullo pystysuorassa, jotta se ei vuoda. Älä ravista. Älä koske injektiopullon liittimen luer-aukkoon, jotta se ei kontaminoidu. | Käytä oikeaa otetta Pidä kiinni ruiskun kärjessä olevasta valkoisesta renkaasta. Älä pidä kiinni ruiskun lasisäiliöstä kokoamisen aikana.
| Poista korkki Pidä kiinni valkoisesta renkaasta ja napsauta valkoinen korkki irti. Älä kierrä äläkä leikkaa valkoista korkkia irti. Älä kosketa ruiskun kärkeen, jotta se ei kontaminoidu.
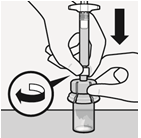
Irti napsautetun korkin voi hävittää. | Kiinnitä ruisku injektiopullon liittimeen Pidä kiinni holkista, jotta injektiopullon liitin pysyy paikallaan. Pidä kiinni ruiskun valkoisesta renkaasta ja paina ruiskun kärki injektiopullon liittimen luer-aukkoon. Älä pidä kiinni ruiskun lasisäiliöstä, jotta valkoinen rengas ei pääse löystymään eikä irtoamaan. Kiinnitä ruisku injektiopullon liittimeen kiertämällä sitänapakasti myötäpäivään Älä ylikiristä liitosta. Ylikiristäminen voi aiheuttaa ruiskun kärjen katkeamisen. |

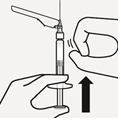
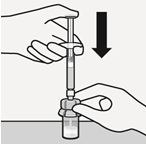 | 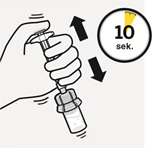 |  | 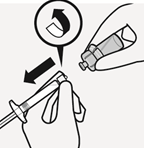 |
Injisoi liuotin Injisoi ruiskun koko sisältö injektiopulloon.
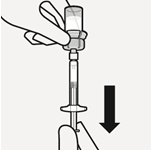
| Sekoita mikrorakeet liuottimeen Pidä mäntää painettuna alas ja ravista injektiopulloa voimakkaasti vähintään 10 sekunnin ajan, kuten kuvassa. Tarkista suspensio. Suspensio on asianmukaisesti sekoitettu, kun se on tasaisen paksua ja maitomaisen sameaa. Mikrorakeet näkyvät nesteessä. Jatka välittömästi seuraavaan vaiheeseen, jotta suspensio ei sakkaudu. | Siirrä suspensio ruiskuun Käännä injektiopullo kokonaan ylösalaisin. Vedä injektiopullon koko sisältö ruiskuun vetämällä mäntää hitaasti alaspäin. | Poista injektiopullon liitin Pidä kiinni ruiskun valkoisesta renkaasta ja kierrä ruisku irti injektiopullon liittimestä. Lääkkeen tunnistamisen varmistamiseksi revi rei’itetty osa injektiopullon etiketistä ja kiinnitä irrotettu osa ruiskuun. Hävitä sekä injektiopullo että injektiopullon liitin asianmukaisesti. |

 | 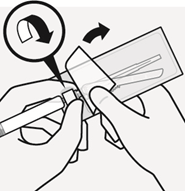 | 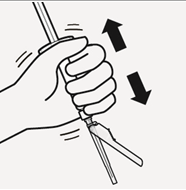 | |
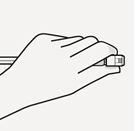
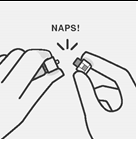
Valitse tarkoituksenmukainen neula Valitse neula injektiokohdan mukaan (pakara- tai hartialihas). | Kiinnitä neula Pidä kiinni ruiskun valkoisesta renkaasta ja kiinnitä ruisku luer-liittimeen kiertämällä sitänapakastimyötäpäivään, kunnes neula on kiinni tiukasti. Älä koske neulan luer-aukkoon, jotta se ei kontaminoidu. | Mikrorakeiden sekoittaminen uudelleen | |

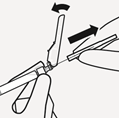 |  | 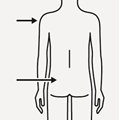 | 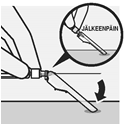 |  |
Poista neulan läpinäkyvä suojus | Poista ilmakuplat Pidä ruiskua kohtisuoraan ylös ja naputtele ruiskua varovasti saadaksesi ilmakuplat nousemaan pinnalle. Poista ilma ruiskusta painamalla mäntää sisään varovasti ja hitaasti. | Injisoi Pakaralihakseen injektio annetaan pakara-alueen ylä-ulkoneljännekseen. Ei saa antaa laskimoon. | Suojaa neula neulanpisto-suojalla Aseta neulanpistosuoja 45 asteen kulmaan kovalle tasaiselle alustalle yhdellä kädellä. Paina alaspäin nopeasti ja tiukasti, kunnes neula on kiinnittynyt neulanpistosuojaan.
Vältä neulanpisto-tapaturma: Älä käytä kahta kättä. Älä irrota neulanpistosuojaa tai käsittele sitä väärin tarkoituksellisesti. Älä yritä suoristaa neulaa tai kiinnittää neulanpistosuojaa, jos neula on vääntynyt tai vahingoittunut. | Hävitä neulat asianmukaisesti Tarkista, että neula on täysin kiinnittynyt neulanpistosuojaan. Hävitä myös pakkauksen toinen (käyttämätön) neula. |
Korvattavuus
RISPERDAL CONSTA injektiokuiva-aine ja liuotin, depotsuspensiota varten
25 mg 1 pakkaus
37,5 mg 1 pakkaus
50 mg 1 pakkaus
- Ylempi erityiskorvaus (100 %). Vaikeat psykoosit ja muut vaikeat mielenterveyden häiriöt (112), Älyllisesti kehitysvammaisilla esiintyvät käyttäytymisen häiriöt (113).
- Peruskorvaus (40 %).
ATC-koodi
N05AX08
Valmisteyhteenvedon muuttamispäivämäärä
11.11.2021
Yhteystiedot
 JANSSEN-CILAG OY
JANSSEN-CILAG OY PL 15
02621 Espoo
020 753 1300
innovativemedicine.jnj.com/finland
jacfi@its.jnj.com