OTEZLA tabletti, kalvopäällysteinen 10 mg+20 mg+30 mg, 30 mg
Vaikuttavat aineet ja niiden määrät
Otezla 10 mg tabletit, kalvopäällysteiset
Yksi kalvopäällysteinen tabletti sisältää 10 mg apremilastia.
Apuaine(et), joiden vaikutus tunnetaan:
Yksi kalvopäällysteinen tabletti sisältää laktoosimonohydraattia määrän, joka vastaa 57 mg laktoosia.
Otezla 20 mg tabletit, kalvopäällysteiset
Yksi kalvopäällysteinen tabletti sisältää 20 mg apremilastia.
Apuaine(et), joiden vaikutus tunnetaan:
Yksi kalvopäällysteinen tabletti sisältää laktoosimonohydraattia määrän, joka vastaa 114 mg laktoosia.
Otezla 30 mg tabletit, kalvopäällysteiset
Yksi kalvopäällysteinen tabletti sisältää 30 mg apremilastia.
Apuaine(et), joiden vaikutus tunnetaan:
Yksi kalvopäällysteinen tabletti sisältää laktoosimonohydraattia määrän, joka vastaa 171 mg laktoosia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Tabletti, kalvopäällysteinen (tabletti).
Kliiniset tiedot
Käyttöaiheet
Psoriaasiartriitti
Otezla yksinään tai yhdistelmänä tautiprosessia hidastavien reumalääkkeiden (DMARD-lääkkeiden) kanssa on tarkoitettu aikuispotilaiden aktiivisen psoriaasiartriitin (PsA:n) hoitoon, jos vaste aiempaan DMARD-hoitoon ei ole ollut riittävä tai jos potilas ei ole sietänyt aiempaa DMARD-hoitoa (ks. kohta Farmakodynamiikka).
Psoriaasi
Otezla on tarkoitettu keskivaikean tai vaikean kroonisen läiskäpsoriaasin (PSOR) hoitoon aikuisille potilaille, jotka eivät ole saaneet vastetta muihin systeemisiin hoitoihin, mukaan lukien siklosporiini, metotreksaatti tai psoraleenin ja ultravioletti-A-säteilyn yhdistelmä (PUVA), tai joille nämä hoidot ovat vasta-aiheisia, tai jotka eivät ole sietäneet tällaisia hoitoja.
Psoriaasi pediatrisilla potilailla
Otezla on tarkoitettu keskivaikean tai vaikean läiskäpsoriaasin hoitoon vähintään 6‑vuotiaille ja vähintään 20 kg:n painoisille lapsille ja nuorille, joille systeeminen hoito soveltuu.
Behçetin tauti
Otezla on tarkoitettu sellaisten aikuispotilaiden hoitoon, joilla on Behçetin tautiin (BD) liittyviä suun haavaumia ja jotka soveltuvat systeemiseen hoitoon.
Ehto
Valmisteen käyttöaiheissa mainittujen sairauksien diagnosointiin ja hoitoon perehtyneen erikoislääkärin on aloitettava hoito.
Annostus ja antotapa
Otezla-hoidon saa aloittaa erikoislääkäri, jolla on kokemusta psoriaasin, psoriaasiartriitin tai Behçetin taudin diagnosoinnista ja hoidosta.
Annostus
Aikuispotilaat, joilla on psoriaasiartriitti, psoriaasi tai Behçetin tauti
Suositeltava apremilastiannos aikuispotilaille on 30 mg suun kautta kaksi kertaa vuorokaudessa. Annos pitää hoidon alussa titrata seuraavan taulukon 1 mukaisesti.
Taulukko 1. Annostitrausaikataulu aikuispotilaille
| 1. päivä | 2. päivä | 3. päivä | 4. päivä | 5. päivä | 6. päivä ja sen jälkeen | |||||
| Aamu | Aamu | Ilta | Aamu | Ilta | Aamu | Ilta | Aamu | Ilta | Aamu | Ilta |
| 10 mg | 10 mg | 10 mg | 10 mg | 20 mg | 20 mg | 20 mg | 20 mg | 30 mg | 30 mg | 30 mg |
Pediatriset potilaat, joilla on keskivaikea tai vaikea läiskäpsoriaasi
Suositeltava apremilastiannos vähintään 6‑vuotiaille pediatrisille potilaille keskivaikean tai vaikean läiskäpsoriaasin hoitoon määräytyy potilaan painon mukaan. Suositeltava apremilastiannos vähintään 20 kg mutta alle 50 kg painaville pediatrisille potilaille on 20 mg suun kautta kaksi kertaa vuorokaudessa ja vähintään 50 kg painaville pediatrisille potilaille 30 mg suun kautta kaksi kertaa vuorokaudessa. Annos pitää hoidon alussa titrata seuraavan taulukon 2 mukaisesti.
Taulukko 2. Annostitrausaikataulu pediatrisille potilaille
| Paino | 1. päivä | 2. päivä | 3. päivä | 4. päivä | 5. päivä | 6. päivä ja sen jälkeen | |||||
| Aamu | Aamu | Ilta | Aamu | Ilta | Aamu | Ilta | Aamu | Ilta | Aamu | Ilta | |
| Vähintään 20 kg, alle 50 kg | 10 mg | 10 mg | 10 mg | 10 mg | 20 mg | 20 mg | 20 mg | 20 mg | 20 mg | 20 mg | 20 mg |
| Vähintään 50 kg | 10 mg | 10 mg | 10 mg | 10 mg | 20 mg | 20 mg | 20 mg | 20 mg | 30 mg | 30 mg | 30 mg |
Kaikki käyttöaiheet (psoriaasi aikuisilla ja lapsilla, psoriaasiartriitti ja Behçetin tauti)
Annosta ei tarvitse ensimmäisen titrauksen jälkeen titrata uudelleen.
Suositeltava apremilastiannos on otettava kaksi kertaa vuorokaudessa noin 12 tunnin välein (aamulla ja illalla) ilman ruokaan liittyviä rajoituksia.
Jos potilas unohtaa ottaa annoksen, annos pitää ottaa mahdollisimman pian. Jos seuraavan annoksen ottamiseen on vain vähän aikaa, unohtunutta annosta ei oteta ja seuraava annos otetaan tavalliseen aikaan.
Pivotaalitutkimuksissa suurimman paranemisen todettiin tapahtuvan 24 ensimmäisen hoitoviikon aikana psoriaasiartriitin ja psoriaasin kohdalla ja 12 ensimmäisen hoitoviikon aikana Behçetin taudin kohdalla. Jos hoidosta ei ole tämän ajanjakson jälkeen havaittu hyötyä, hoidon lopettamista pitää harkita. Potilaan hoitovastetta pitää arvioida säännöllisesti.
Erityispotilasryhmät
Iäkkäät potilaat
Annoksen säätäminen ei ole tässä potilasryhmässä tarpeen (ks. kohdat Haittavaikutukset ja Farmakokinetiikka).
Munuaisten vajaatoimintaa sairastavat potilaat
Aikuispotilaat, joilla on psoriaasiartriitti, psoriaasi tai Behçetin tauti
Annoksen säätäminen ei ole tarpeen, jos aikuispotilaalla on lievä tai keskivaikea munuaisten vajaatoiminta. Vaikeaa munuaisten vajaatoimintaa sairastavien aikuispotilaiden (kreatiniinipuhdistuma alle 30 ml/min Cockcroft-Gaultin kaavalla arvioituna) apremilastiannos pitää pienentää 30 mg:aan kerran vuorokaudessa. Apremilastiannoksen alkuvaiheen titrauksessa suositellaan tässä potilasryhmässä noudattamaan vain taulukossa 1 esitettyä aamuaikataulua ja ilta-annokset jätetään ottamatta (ks. kohta Farmakokinetiikka).
Pediatriset potilaat, joilla on keskivaikea tai vaikea psoriaasi
Annoksen säätäminen ei ole tarpeen, jos vähintään 6‑vuotiaalla pediatrisella potilaalla on lievä tai keskivaikea munuaisten vajaatoiminta. Vaikeaa munuaisten vajaatoimintaa sairastaville vähintään 6‑vuotiaille pediatrisille potilaille (kreatiniinipuhdistuma alle 30 ml/min Cockcroft-Gaultin kaavalla arvioituna) suositellaan annoksen säätämistä. Apremilastiannos pitää pienentää 30 mg:aan kerran vuorokaudessa vähintään 50 kg painavilla pediatrisilla potilailla ja 20 mg:aan kerran vuorokaudessa vähintään 20 kg mutta alle 50 kg painavilla pediatrisilla potilailla. Apremilastiannoksen alkuvaiheen titrauksessa suositellaan tässä potilasryhmässä noudattamaan vain edellä taulukossa 2 esitettyä potilaan painon mukaista aamuaikataulua ja ilta-annokset jätetään ottamatta.
Maksan vajaatoimintaa sairastavat potilaat
Annoksen säätäminen ei ole tarpeen, jos potilaalla on maksan vajaatoiminta (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Apremilastin turvallisuutta ja tehoa alle 6‑vuotiaiden tai alle 20 kg painavien lasten keskivaikean tai vaikean läiskäpsoriaasin tai muiden pediatristen käyttöaiheiden hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Antotapa
Suun kautta. Kalvopäällysteiset tabletit pitää niellä kokonaisina, ja ne voidaan ottaa joko ruoan kanssa tai tyhjään mahaan.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle (vaikuttaville aineille) tai kohdassa Apuaineet mainituille apuaineille.
Raskaus (ks. kohta Raskaus ja imetys).
Varoitukset ja käyttöön liittyvät varotoimet
Ripuli, pahoinvointi ja oksentelu
Apremilastin käytön yhteydessä on valmisteen myyntiintulon jälkeen raportoitu vaikeaa ripulia, pahoinvointia ja oksentelua. Useimmat tapahtumat ilmaantuivat ensimmäisten hoitoviikkojen aikana. Joissakin tapauksissa potilaat tarvitsivat sairaalahoitoa. Komplikaatioiden riski voi olla suurempi 65‑vuotiailla ja sitä vanhemmilla potilailla. Jos potilaalle kehittyy vaikea ripuli, pahoinvointia tai oksentelua, apremilastihoidon lopettaminen voi olla tarpeen.
Psyykkiset häiriöt
Apremilasti on yhdistetty psyykkisten häiriöiden, kuten unettomuuden ja masennuksen, lisääntyneeseen riskiin. Itsemurha-ajatuksia ja -käyttäytymistä, mukaan lukien itsemurhia, on havaittu sekä potilailla, joilla on aiemmin ollut masennusta, että potilailla, joilla sitä ei ole ollut (ks kohta Haittavaikutukset). Apremilastihoidon aloittamisen tai jatkamisen riskit ja hyödyt on arvioitava huolellisesti, jos potilaat raportoivat aiemmista tai nykyisistä psyykkisistä oireista tai jos aiotaan antaa samanaikaista hoitoa toisella lääkevalmisteella, joka todennäköisesti aiheuttaa psyykkisiä tapahtumia. Potilaita ja hoitajia on neuvottava ilmoittamaan lääkkeen määrääjälle mahdollisista muutoksista käyttäytymisessä tai mielialassa tai mahdollisista itsemurha-ajatuksista. Jos potilailla on uusia tai pahenevia psyykkisiä oireita tai itsemurha-ajatuksia tai havaitaan itsemurhayritys, apremilastihoidon lopettaminen on suositeltavaa.
Vaikea munuaisten vajaatoiminta
Vaikeaa munuaisten vajatoimintaa sairastavien aikuispotilaiden Otezla-annos pitää pienentää 30 mg:aan kerran vuorokaudessa (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka).
Vähintään 6‑vuotiaiden vaikeaa munuaisten vajaatoimintaa sairastavien pediatristen potilaiden annos pitää pienentää 30 mg:aan kerran vuorokaudessa vähintään 50 kg painavilla potilailla ja 20 mg:aan kerran vuorokaudessa vähintään 20 kg mutta alle 50 kg painavilla potilailla (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka).
Alipainoiset potilaat
Jos potilas on alipainoinen tai jos pediatrisen potilaan painoindeksi on alhaisen rajalla hoitoa aloitettaessa, hänen painoaan pitää tarkkailla säännöllisesti. Jos potilaan paino laskee selittämättömästi ja kliinisesti merkittävästi, lääkärin pitää tutkia potilas ja hoidon lopettamista pitää harkita.
Laktoosipitoisuus
Potilaiden, joilla on harvinainen perinnöllinen galaktoosi-intoleranssi, täydellinen laktaasinpuutos tai glukoosi-galaktoosi-imeytymishäiriö, ei pidä käyttää tätä lääkettä.
Yhteisvaikutukset
Sytokromi P450 3A4 (CYP3A4) ‑entsyymin voimakkaan indusoijan rifampisiinin samanaikainen antaminen vähensi systeemistä altistusta apremilastille, mikä saattaa johtaa apremilastin tehon häviämiseen. Voimakkaiden CYP3A4-entsyymin indusoijien (kuten rifampisiinin, fenobarbitaalin, karbamatsepiinin, fenytoiinin ja mäkikuisman) käyttöä samanaikaisesti apremilastin kanssa ei siksi suositella. Apremilastin antaminen samanaikaisesti useiden rifampisiiniannosten kanssa pienensi apremilastin AUC-arvoa (pitoisuus-aikakuvaajan alle jäävää pinta-alaa) noin 72 % ja Cmax-arvoa (huippupitoisuutta seerumissa) noin 43 %. Voimakkaiden CYP3A4:n indusoijien (esim. rifampisiinin) samanaikainen antaminen vähentää altistusta apremilastille ja saattaa heikentää kliinistä vastetta.
Apremilastia on annettu kliinisissä tutkimuksissa samanaikaisesti paikallishoitojen (kortikosteroidivalmisteiden, kivihiilitervasampoon ja päänahkaan käytettävien salisyylihappovalmisteiden) ja UVB-valohoidon kanssa.
Ketokonatsolin ja apremilastin välillä ei havaittu kliinisesti merkittäviä yhteisvaikutuksia. Apremilastia voidaan antaa samanaikaisesti voimakkaiden CYP3A4:n estäjien, kuten ketokonatsolin, kanssa.
Psoriaasiartriittia sairastavilla potilailla ei havaittu apremilastin ja metotreksaatin välillä farmakokineettisiä yhteisvaikutuksia. Apremilastia voidaan käyttää samanaikaisesti metotreksaatin kanssa.
Apremilastin ja etinyyliestradiolia ja norgestimaattia sisältävien suun kautta otettavien ehkäisyvalmisteiden välillä ei havaittu farmakokineettisiä yhteisvaikutuksia. Apremilastia voidaan käyttää samanaikaisesti suun kautta otettavien ehkäisyvalmisteiden kanssa.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi
Raskaus on suljettava pois ennen kuin hoito voidaan aloittaa. Naisten, jotka voivat tulla raskaaksi, pitää käyttää tehokasta ehkäisyä raskauden välttämiseksi hoidon aikana.
Raskaus
On vain vähän tietoja apremilastin käytöstä raskaana oleville naisille.
Apremilasti on vasta-aiheista raskauden aikana (ks. kohta Vasta-aiheet). Apremilastin vaikutuksia tiineyteen tällä hetkellä ihmiselle suositeltua enimmäisannosta suuremmilla annoksilla olivat keskenmeno alkio-/sikiövaiheessa hiirillä ja apinoilla sekä sikiön painon aleneminen ja viivästynyt luutuminen hiirillä. Tällaisia vaikutuksia ei havaittu silloin, kun eläinten altistus oli 1,3‑kertainen kliiniseen altistukseen verrattuna (ks. kohta Prekliiniset tiedot turvallisuudesta).
Imetys
Apremilastia havaittiin imettävien hiirten maidossa (ks. kohta Prekliiniset tiedot turvallisuudesta). Ei tiedetä, erittyvätkö apremilasti tai sen metaboliitit ihmisen rintamaitoon. Imeväiseen kohdistuvia riskejä ei voida poissulkea, minkä vuoksi apremilastia ei saa käyttää rintaruokinnan aikana.
Hedelmällisyys
Ihmisen hedelmällisyyttä koskevia tietoja ei ole saatavilla. Hiirillä tehdyissä eläinkokeissa ei havaittu haittavaikutuksia urosten hedelmällisyyteen, kun altistus oli kolminkertainen kliiniseen altistukseen nähden, eikä naaraiden hedelmällisyyteen, kun altistus vastasi kliinistä altistusta. Hedelmällisyyttä koskevat prekliiniset tiedot, ks. kohta Prekliiniset tiedot turvallisuudesta.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Apremilastilla ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Apremilastin yleisimmin raportoituja haittavaikutuksia psoriaasiartriitin ja psoriaasin hoidossa aikuisilla ovat maha-suolikanavan häiriöt, mukaan lukien ripuli (15,7 %) ja pahoinvointi (13,9 %). Muita yleisimmin raportoituja, vaikeusasteeltaan useimmiten lieviä tai keskivaikeita haittavaikutuksia ovat ylähengitystieinfektiot (8,4 %), päänsärky (7,9 %) ja jännityspäänsärky (7,2 %).
Apremilastin yleisimmin raportoituja haittavaikutuksia BD:n hoidossa aikuisilla ovat ripuli (41,3 %), pahoinvointi (19,2 %), päänsärky (14,4 %), ylähengitystieinfektio (11,5 %), ylävatsakipu (8,7 %), oksentelu (8,7 %) ja selkäkipu (7,7 %) ja ne ovat vaikeusasteeltaan enimmäkseen lieviä tai keskivaikeita.
Ruoansulatuskanavan haittavaikutukset ilmaantuivat yleensä hoidon 2 ensimmäisen viikon aikana ja ne hävisivät tavallisesti 4 viikon kuluessa.
Todetut yliherkkyysreaktiot ovat melko harvinaisia (ks. kohta Vasta-aiheet).
Haittavaikutustaulukko
Apremilastihoitoa saaneilla aikuispotilailla havaitut haittavaikutukset on esitetty seuraavassa taulukossa elinjärjestelmän ja haittavaikutuksen esiintymistiheyden mukaan. Haittavaikutukset on esitetty kussakin elinjärjestelmä- ja yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Haittavaikutukset perustuvat apremilastin kliinisen kehitysohjelman tietoihin ja markkinoilletulon jälkeisiin kokemuksiin aikuispotilaista. Haittavaikutusten esiintymistiheydet perustuvat neljän vaiheen III psoriaasiartriittitutkimuksen (n = 1 945) tai kahden vaiheen III psoriaasitutkimuksen (n = 1 184) ja vaiheen III BD-tutkimuksen (n = 207) apremilastiryhmissä raportoituihin esiintymistiheyksiin (tietueiden suurin esiintymistiheys on esitetty taulukossa 3).
Esiintymistiheydet on määritelty seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Taulukko 3. Yhteenveto haittavaikutuksista psoriaasiartriitissa, psoriaasissa ja Behçetin taudissa
| Elinjärjestelmä | Esiintymistiheys | Haittavaikutus |
| Infektiot | Hyvin yleinen | Ylähengitystieinfektioa |
| Yleinen | Keuhkoputkitulehdus | |
| Nasofaryngiitti* | ||
| Immuunijärjestelmä | Melko harvinainen | Yliherkkyys |
| Aineenvaihdunta ja ravitsemus | Yleinen | Ruokahalun heikkeneminen* |
| Psyykkiset häiriöt | Yleinen | Unettomuus |
| Masennus | ||
| Melko harvinainen | Itsemurha-ajatukset ja -käyttäytyminen | |
| Hermosto | Hyvin yleinen | Päänsärky*, a |
| Yleinen | Migreeni* | |
| Jännityspäänsärky* | ||
| Hengityselimet, rintakehä ja välikarsina | Yleinen | Yskä |
| Ruoansulatuselimistö | Hyvin yleinen | Ripuli* |
| Pahoinvointi* | ||
| Yleinen | Oksentelu* | |
| Dyspepsia | ||
| Tihentynyt ulostustarve | ||
| Ylävatsakipu* | ||
| Ruokatorven refluksitauti | ||
| Melko harvinainen | Maha-suolikanavan verenvuoto | |
| Iho ja ihonalainen kudos | Melko harvinainen | Ihottuma |
| Nokkosihottuma | ||
| Tuntematon | Angioedeema | |
| Luusto, lihakset ja sidekudos | Yleinen | Selkäkipu* |
| Yleisoireet ja antopaikassa todettavat haitat | Yleinen | Väsymys |
| Tutkimukset | Melko harvinainen | Painon lasku |
| * Vähintään yksi näistä raportoiduista haittavaikutuksista oli vakava a Esiintymistiheys raportoitu yleiseksi psoriaasiartriitissa ja psoriaasissa | ||
Valikoitujen haittavaikutusten kuvaus
Psyykkiset häiriöt
Kliinisissä tutkimuksissa ja myyntiintulon jälkeisessä käytössä on raportoitu melko harvinaisia itsemurha-ajatus- ja -käyttäytymistapauksia ja myyntiintulon jälkeen on raportoitu toteutuneesta itsemurhasta. Potilaita ja hoitajia on neuvottava ilmoittamaan lääkkeen määrääjälle mahdollisista itsemurha-ajatuksista (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Painon lasku
Potilaat punnittiin kliinisten tutkimusten aikana säännöllisesti. Apremilastihoitoa enintään 52 viikon ajan saaneiden aikuisten psoriaasiartriitti- ja psoriaasipotilaiden paino laski keskimäärin 1,99 kg. Paino laski yhteensä 14,3 prosentilla apremilastia saaneista potilaista 5–10 % ja 5,7 prosentilla yli 10 %. Painon laskulla ei ollut potilaille selkeitä kliinisiä seurauksia. Yhteensä 0,1 % apremilastihoitoa saaneista potilaista keskeytti hoidon haittavaikutukseksi katsottavan painon laskun vuoksi. Apremilastihoitoa 52 viikon ajan saaneiden aikuisten BD-potilaiden paino laski keskimäärin 0,52 kg. Paino laski yhteensä 11,8 prosentilla apremilastia saaneista potilaista 5–10 % ja 3,8 prosentilla yli 10 %. Painon laskulla ei ollut potilaille selkeitä kliinisiä seurauksia. Yksikään potilaista ei keskeyttänyt tutkimusta haittavaikutukseksi katsottavan painon laskun vuoksi.
Katso kohdasta Varoitukset ja käyttöön liittyvät varotoimet lisävaroitus, jos potilas on alipainoinen hoitoa aloitettaessa.
Erityispotilasryhmät
Iäkkäät potilaat
Valmisteen myyntiintulon jälkeisen kokemuksen perusteella ≥ 65‑vuotiaiden iäkkäiden potilaiden riski saada komplikaationa vaikea ripuli, pahoinvointia tai oksentelua voi olla suurentunut (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Maksan vajaatoimintaa sairastavat potilaat
Apremilastin turvallisuutta ei tutkittu maksan vajaatoimintaa sairastavilla psoriaasiartriitti-, psoriaasi- tai BD-potilailla.
Munuaisten vajaatoimintaa sairastavat potilaat
Lievää munuaisten vajaatoimintaa sairastavilla potilailla havaittu turvallisuusprofiili oli kliinisissä psoriaasiartriitti-, psoriaasi- tai BD-tutkimuksissa samankaltainen kuin potilailla, joiden munuaisten toiminta oli normaali. Apremilastin turvallisuutta ei tutkittu keskivaikeaa tai vaikeaa munuaisten vajaatoimintaa sairastavilla psoriaasiartriitti-, psoriaasi- tai BD-potilailla.
Pediatriset potilaat
Apremilastin turvallisuutta arvioitiin 52 viikon mittaisessa kliinisessä tutkimuksessa, johon osallistui keskivaikeaa tai vaikeaa läiskäpsoriaasia sairastavia 6–17‑vuotiaita potilaita (SPROUT‑tutkimus). Tutkimuksessa havaittu turvallisuusprofiili oli samankaltainen kuin aikaisemmissa tutkimuksissa havaittu apremilastin turvallisuusprofiili keskivaikeaa tai vaikeaa läiskäpsoriaasia sairastavilla aikuispotilailla.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista kansallisen ilmoitusjärjestelmän kautta: www.fimea.fi.
Yliannostus
Apremilastia tutkittiin terveillä tutkittavilla enintään 100 mg:n vuorokausiannoksilla (50 mg kaksi kertaa vuorokaudessa) 4,5 vuorokauden ajan eikä annosta rajoittavaa toksisuutta havaittu. Yliannostustapauksessa suositellaan potilaan tarkkailua haittavaikutusten oireiden tai löydösten havaitsemiseksi sekä sopivaa oireenmukaista hoitoa. Yliannostapauksessa potilaan oireita suositellaan hoitamaan ja elintoimintoja tukemaan.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Immunosuppressantit, selektiiviset immunosuppressantit, ATC‑koodi: L04AA32
Vaikutusmekanismi
Apremilasti on suun kautta otettava pienimolekyylinen fosfodiesteraasi 4:n (PDE4:n) estäjä, joka toimii solunsisäisesti muuntamalla tulehdusta edistävien ja estävien välittäjäaineiden verkostoa. PDE4 on sykliselle adenosiinimonofosfaatille (cAMP:lle) spesifinen fosfodiesteraasi ja dominoiva fosfodiesteraasi tulehdussoluissa. PDE4:n estäminen suurentaa cAMP-pitoisuutta solujen sisällä, mikä puolestaan hillitsee tulehdusvastetta muuntamalla TNF‑α:n, IL‑23:n ja IL‑17:n sekä muiden tulehdussytokiinien ilmenemistä. cAMP muuntaa myös tulehdusta estävien sytokiinien, kuten IL‑10:n, määrää. Nämä tulehdusta edistävät ja estävät välittäjäaineet ovat osallisina psoriaasiartriitissa ja psoriaasissa.
Farmakodynaamiset vaikutukset
Apremilasti muutti kliinisissä tutkimuksissa psoriaasiartriittia sairastavien potilaiden IL‑1α:n, IL‑6:n, IL‑8:n, MCP‑1:n, MIP‑1β:n, MMP‑3:n ja TNF‑α:n pitoisuutta plasman proteiineissa merkittävästi, muttei estänyt näitä täysin. Neljänkymmenen apremilastihoitoviikon jälkeen IL‑17- ja IL‑23-pitoisuudet plasman proteiineissa olivat pienentyneet ja IL‑10-pitoisuus oli suurentunut. Apremilasti vähensi kliinisissä tutkimuksissa psoriaasia sairastavien potilaiden vaurioituneen ihon epidermaalista paksuutta, tulehdussolujen infiltraatiota ja tulehdusta edistävien geenien ilmentymistä, indusoituva typpioksidisyntaasi (iNOS), IL‑12/IL‑23p40, IL‑17A, IL‑22 ja IL‑8 mukaan lukien. Kliinisissä tutkimuksissa, joissa potilaiden Behçetin tautia hoidettiin apremilastilla, plasman TNF‑alfan muutoksen ja kliinisen tehon välillä oli merkittävä positiivinen yhteys suun haavaumien määrän mukaan mitattuna.
Apremilasti ei enintään 50 mg:n annoksina kaksi kertaa vuorokaudessa käytettynä pidentänyt terveiden tutkittavien QT-aikaa.
Kliininen teho ja turvallisuus
Psoriaasiartriitti
Apremilastin turvallisuutta ja tehoa arvioitiin kolmessa koeasetelmaltaan samankaltaisessa satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa monikeskustutkimuksessa (PALACE 1, PALACE 2 ja PALACE 3) aikuisilla potilailla, joilla oli aktiivinen psoriaasiartriitti (≥ 3 turvonnutta niveltä ja ≥ 3 arkaa niveltä) aiemmasta pienimolekyylisillä tai biologisilla DMARD-lääkkeillä annetusta hoidosta huolimatta. Yhteensä 1 493 potilasta satunnaistettiin saamaan lumelääkettä, 20 mg apremilastia tai 30 mg apremilastia suun kautta kaksi kertaa vuorokaudessa.
Tutkimuksiin osallistuneiden potilaiden psoriaasiartriitti oli diagnosoitu vähintään 6 kuukautta aiemmin. PALACE 3 ‑tutkimukseen osallistuminen edellytti myös vähintään yhtä psoriaasiläiskää (läpimitta vähintään 2 cm). Apremilastia annettiin monoterapiana (34,8 %) tai yhdistelmänä pienimolekyylisten DMARD-lääkkeiden vakioannosten kanssa (65,2 %). Yhdistelmähoidossa potilaat saivat apremilastin lisäksi yhtä tai useampaa seuraavista: metotreksaatti (≤ 25 mg/viikko, 54,5 %), sulfasalatsiini (≤ 2 g/vrk, 9,0 %) ja leflunomidi (≤ 20 mg/vrk, 7,4 %). Samanaikaista hoitoa biologisten DMARD-lääkkeiden kanssa, TNF:n estäjät mukaan lukien, ei sallittu. Näihin kolmeen tutkimukseen otettiin mukaan psoriaasiartriitin eri alatyyppejä sairastavia potilaita. Alatyypit olivat symmetrinen polyartriitti (62,0 %), asymmetrinen oligoartriitti (26,9 %), distaalisten interfalangeaalinivelten (DIP‑nivelten) artriitti (6,2 %), mutiloiva artriitti (2,7 %) ja hallitseva spondyliitti (2,1 %). Tutkimuksiin otettiin mukaan myös potilaita, joilla oli ennestään entesopatia (63 %) tai daktyliitti (42 %). Potilaista yhteensä 76,4 % oli saanut aiemmin hoitoa pelkästään pienimolekyylisillä DMARD-lääkkeillä. Biologisia DMARD-lääkkeitä oli saanut aiemmin 22,4 % potilaista, ja heistä 7,8 %:lla hoito biologisella DMARD-lääkkeellä oli epäonnistunut. Psoriaasiartriitin kestoajan mediaani oli 5 vuotta.
Jos potilaan nivelarkuus ja -turvotus ei ollut vähentynyt vähintään 20 % viikolla 16, hänen katsottiin koeasetelman perusteella olevan hoitoon reagoimaton. Lumelääkettä saaneet potilaat, joiden katsottiin olevan hoitoon reagoimattomia, satunnaistettiin uudelleen suhteessa 1:1 saamaan sokkoutetusti joko 20 mg tai 30 mg apremilastia kaksi kertaa vuorokaudessa. Viikolla 24 myös kaikki loput lumelääkepotilaat satunnaistettiin siirtymään apremilastin käyttöön 20 mg:n tai 30 mg:n annoksina kaksi kertaa vuorokaudessa. 52 viikon hoidon jälkeen potilailla oli mahdollisuus jatkaa avoimella 20 mg:n tai 30 mg:n apremilastiannoksella PALACE 1-, PALACE 2- ja PALACE 3 -tutkimusten pitkäaikaisissa jatkotutkimuksissa yhteensä enintään 5 hoitovuoteen (viikolle 260) asti.
Ensisijainen päätetapahtuma oli niiden potilaiden prosenttiosuus, jotka olivat saavuttaneet American College of Rheumatology (ACR) 20 ‑vasteen viikolla 16.
Apremilastihoito vähensi psoriaasiartriitin oireita ja löydöksiä ACR 20 ‑vasteen kriteereillä arvioituna merkittävästi lumelääkkeeseen verrattuna viikolla 16. ACR 20/50/70 ‑vasteen viikolla 16 saavuttaneiden 30 mg apremilastia kahdesti vuorokaudessa saaneiden potilaiden osuudet (PALACE 1‑, PALACE 2- ja PALACE 3 -tutkimuksissa sekä PALACE 1-, PALACE 2- ja PALACE 3 ‑tutkimusten yhdistetyt tulokset) on esitetty taulukossa 4. ACR 20/50/70 ‑vasteet olivat säilyneet viikolla 24.
Potilailla, jotka oli tutkimuksen alussa satunnaistettu saamaan 30 mg apremilastia kahdesti vuorokaudessa, ACR 20/50/70 -vasteet olivat säilyneet PALACE 1-, PALACE 2- ja PALACE 3 ‑tutkimusten yhdistetyissä tuloksissa myös viikolla 52 (kuva 1).
Taulukko 4. ACR-vasteen saavuttaneiden potilaiden osuus PALACE 1-, PALACE 2- ja PALACE 3 ‑tutkimuksissa (erikseen ja yhteensä) viikolla 16
| PALACE 1 | PALACE 2 | PALACE 3 | YHTEENSÄ | |||||
| Na | Lume-lääke +/- DMARD N = 168 | Apremi-lasti 30 mg x2/vrk +/- DMARD N = 168 | Lume-lääke +/- DMARD N = 159 | Apremi-lasti 30 mg x2/vrk +/- DMARD N = 162 | Lume-lääke +/- DMARD N = 169 | Apremi-lasti 30 mg x2/vrk +/- DMARD N = 167 | Lume-lääke +/- DMARD N = 496 | Apremi-lasti 30 mg x2/vrk +/- DMARD N = 497 |
| ACR 20a | ||||||||
| Viikko 16 | 19,0 % | 38,1 %** | 18,9 % | 32,1 %* | 18,3 % | 40,7 %** | 18,8 % | 37,0 %** |
| ACR 50 | ||||||||
| Viikko 16 | 6,0 % | 16,1 %* | 5,0 % | 10,5 % | 8,3 % | 15,0 % | 6,5 % | 13,9 %** |
| ACR 70 | ||||||||
| Viikko 16 | 1,2 % | 4,2 % | 0,6 % | 1,2 % | 2,4 % | 3,6 % | 1,4 % | 3,0 % |
| *p ≤ 0,01 apremilasti vs. lumelääke **p ≤ 0,001 apremilasti vs. lumelääke a N = satunnaistettujen ja hoidettujen potilaiden lukumäärä | ||||||||
Kuva 1. ACR 20/50/70 ‑vasteen saavuttaneiden osuudet viikkoon 52 saakka PALACE 1-, PALACE 2- ja PALACE 3 ‑tutkimusten yhdistetyssä analyysissä (NRI*)
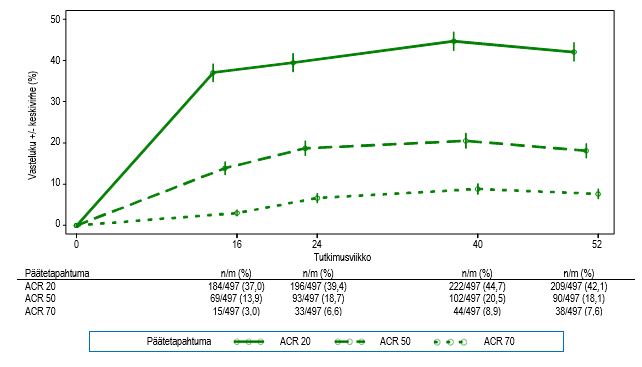
*NRI: Hoitoon reagoimattomien korvaamismenettely (None responder imputation). Tutkittavat, jotka vetäytyivät tutkimuksesta ennen vasteen määritysajankohtaa tai joiden tiedot eivät riittäneet vasteen varmaan määritykseen kyseisenä ajankohtana, katsottiin hoitoon reagoimattomiksi.
Tutkimuksen alussa 30 mg apremilastia kahdesti vuorokaudessa saamaan satunnaistetuista 497 potilaasta 375 (75 %) sai edelleen hoitoa viikolla 52. Näiden potilaiden ACR 20/50/70 ‑vasteet viikolla 52 olivat 57 % (ACR 20 ‑vaste), 25 % (ACR 50 ‑vaste) ja 11 % (ACR 70 ‑vaste). Tutkimuksen alussa 30 mg apremilastia kahdesti vuorokaudessa saamaan satunnaistetuista 497 potilaasta 375 (75 %) osallistui pitkäaikaisiin jatkotutkimuksiin, ja heistä 221 (59 %) sai edelleen tätä hoitoa viikolla 260. ACR-vasteet säilyivät ennallaan pitkäaikaisissa avoimissa jatkotutkimuksissa enintään 5 hoitovuoteen asti.
Apremilastiryhmässä havaitut vasteet olivat samankaltaisia riippumatta siitä, saiko potilas samanaikaisesti DMARD-lääkehoitoa, metotreksaatti mukaan lukien. Suurempi osa apremilastia saaneista potilaista, jotka olivat aiemmin saaneet hoitoa DMARD- tai biologisilla lääkkeillä, saavutti ACR 20 ‑vasteen viikolla 16 verrattuna lumelääkettä saaneisiin potilaisiin.
ACR-vasteiden havaittiin olevan psoriaasiartriitin eri alatyyppejä, DIP-nivelten artriitti mukaan lukien, sairastavilla potilailla samankaltaisia. Mutiloivaa artriittia ja hallitsevaa spondyliittiä sairastavien potilaiden lukumäärät olivat hyödyllistä arviointia varten liian pieniä.
PALACE 1-, PALACE 2- ja PALACE 3 ‑tutkimuksissa C‑reaktiivisen proteiinin avulla määritetyn DAS (Disease Activity Scale) 28 ‑indeksin (DAS28 (CRP)) pisteiden paraneminen ja muunnetun psoriaasiartriittivastekriteerin (PsARC) saavuttaneiden potilaiden osuus olivat viikolla 16 suuremmat apremilastiryhmässä verrattuna lumelääkkeeseen (nimellinen p-arvo ≤ 0,0004 [DAS-pisteiden paraneminen], p-arvo ≤ 0,0017 [PsARC-kriteerin saavuttaneet]), ja tällainen paraneminen oli säilynyt viikolla 24. Tutkimuksen alussa satunnaistettua apremilastihoitoa jatkaneiden potilaiden DAS28 (CRP) -pisteet ja PsARC-vaste olivat säilyneet myös viikolla 52.
Apremilastihoitoa saavilla potilailla havaittiin viikoilla 16 ja 24 paranemista psoriaasiartriitin perifeeristä aktiivisuutta osoittavissa muuttujissa (esim. turvonneiden nivelten lukumäärä, kipeiden/arkojen nivelten lukumäärä, daktyliitti ja entesiitti) sekä psoriaasin iho-oireissa. Tutkimuksen alussa satunnaistettua apremilastihoitoa jatkaneilla potilailla tällainen paraneminen oli säilynyt myös viikolla 52.
Kliiniset vasteet samojen perifeeristä aktiivisuutta osoittavien muuttujien ja psoriaasin iho-oireiden osalta säilyivät avoimissa jatkotutkimuksissa enintään 5 hoitovuoteen asti.
Fyysinen toimintakyky ja terveyteen liittyvä elämänlaatu
Apremilastihoitoa saaneiden potilaiden fyysisessä toimintakyvyssä todettiin PALACE 1-, PALACE 2- ja PALACE 3 ‑tutkimusten ja yhdistettyjen tutkimusten viikolla 16 terveydentilan arviointikyselyn toimintakyvyn heikkenemistä osoittavalla osiolla (HAQ‑DI) mitattuna tilastollisesti merkitsevää paranemista lähtötilanteesta verrattuna lumelääkkeeseen. HAQ‑DI-pisteiden paraneminen oli säilynyt viikolla 24.
Tutkimuksen alussa 30 mg apremilastia kahdesti vuorokaudessa saamaan satunnaistettujen potilaiden HAQ‑DI-pisteiden muutos lähtötilanteesta viikolla 52 PALACE 1-, PALACE 2- ja PALACE 3 ‑tutkimusten avoimen vaiheen yhteisanalyysissa oli 30 mg apremilastia kahdesti vuorokaudessa saaneessa ryhmässä ‑0,333.
Apremilastihoitoa PALACE 1-, PALACE 2- ja PALACE 3 -tutkimuksissa saaneilla potilailla todettiin viikoilla 16 ja 24 terveyteen liittyvän elämänlaadun merkittävää paranemista lähtötilanteesta lumelääkkeeseen verrattuna SF‑terveyskyselyn (Short Form Health Survey) version 2 fyysistä toimintakykyä koskevalla osiolla (SF-36v2) sekä krooniseen sairauteen liittyvän väsymyksen vaikutusta toimintakykyyn arvioivilla FACIT-F (Functional Assessment of Chronic Illness Therapy – Fatigue) -pisteillä mitattuna. Tutkimuksen alussa satunnaistettua apremilastihoitoa jatkaneiden potilaiden fyysisen toimintakyvyn ja FACIT-F-pisteiden paraneminen oli säilynyt viikolla 52.
Fyysisen toimintakyvyn paraneminen HAQ‑DI- ja SF‑36v2-osioilla sekä FACIT‑F-pisteillä mitattuna säilyi avoimissa jatkotutkimuksissa enintään 5 hoitovuoteen asti.
Psoriaasi aikuisilla
Apremilastin turvallisuutta ja tehoa arvioitiin kahdessa satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa monikeskustutkimuksessa (tutkimukset ESTEEM 1 ja ESTEEM 2), joihin otettiin mukaan yhteensä 1 257 potilasta. Potilaat sairastivat keskivaikeaa tai vaikeaa läiskäpsoriaasia, heidän ihottuman peitossa oleva ihoalueensa (body surface area, BSA) oli ≥ 10 %, potilaiden ihopsoriaasin laajuutta ja vaikeusastetta kuvaavan PASI-indeksin (Psoriasis Area and Severity Index) pisteet olivat ≥ 12 ja lääkärin kokonaisarvioon perustuvat sPGA (static Physician Global Assessment) -pisteet olivat ≥ 3 (keskivaikea tai vaikea), ja heille harkittiin valohoitoa tai systeemistä hoitoa.
Näiden tutkimusten koeasetelmat olivat samankaltaiset ensimmäisten 32 viikon aikana. Potilaat satunnaistettiin kummassakin tutkimuksessa suhteessa 2:1 saamaan ensin 16 viikon ajan joko 30 mg apremilastia kaksi kertaa vuorokaudessa tai lumelääkettä (lumekontrolloitu jakso), minkä jälkeen kaikki potilaat saivat 30 mg apremilastia kaksi kertaa vuorokaudessa viikkoina 16–32 (ylläpitojakso). Hoidon satunnaistetussa lopetusvaiheessa (viikot 32–52) potilaat, jotka oli tutkimuksen alussa satunnaistettu saamaan apremilastia ja joiden PASI-pisteet olivat pienentyneet vähintään 75 % (PASI‑75) (ESTEEM 1) tai 50 % (PASI‑50) (ESTEEM 2), satunnaistettiin uudelleen viikolla 32 saamaan joko lumelääkettä tai 30 mg apremilastia kaksi kertaa vuorokaudessa. Jos potilas satunnaistettiin uudelleen saamaan lumelääkettä ja potilas menetti PASI‑75‑vasteen (ESTEEM 1) tai 50 % viikolla 32 todetusta PASI-pisteiden paranemisesta lähtötilanteeseen nähden (ESTEEM 2), potilasta hoidettiin uudelleen 30 mg:n apremilastiannoksilla kaksi kertaa vuorokaudessa. Potilaat, jotka eivät saavuttaneet määritettyä PASI-vastetta viikkoon 32 mennessä tai jotka oli tutkimuksen alussa satunnaistettu saamaan lumelääkettä, saivat apremilastia viikkoon 52 saakka. Mietojen paikallisesti käytettävien kortikosteroidien käyttö kasvoille, kainaloihin ja nivusiin sekä kivihiilitervasampoon ja/tai päänahkaan käytettävien salisyylihappovalmisteiden käyttö oli sallittua koko tutkimusten ajan. Potilaat, jotka eivät olleet saavuttaneet PASI‑75-vastetta ESTEEM 1 ‑tutkimuksessa tai PASI‑50-vastetta ESTEEM 2 ‑tutkimuksessa viikolla 32, saivat lisäksi käyttää paikallisia psoriaasihoitoja ja/tai valohoitoa apremilastihoidon (30 mg kaksi kertaa vuorokaudessa) lisäksi.
52 viikon hoidon jälkeen potilailla oli mahdollisuus jatkaa avoimella 30 mg:n apremilastiannoksella ESTEEM 1- ja ESTEEM 2 ‑tutkimusten pitkäaikaisissa jatkotutkimuksissa yhteensä enintään 5 hoitovuoteen (viikolle 260) asti.
Kummankin tutkimuksen ensisijainen päätetapahtuma oli niiden potilaiden osuus, jotka saavuttivat PASI‑75-vasteen viikolla 16. Tärkein toissijainen päätetapahtuma oli niiden potilaiden osuus, jotka saavuttivat sPGA-pisteet 0 (terve) tai 1 (lähes terve) viikolla 16.
Lähtötilanteen keskimääräiset PASI-pisteet olivat 19,07 (mediaani 16,80), ja 70,0 % potilaista sai sPGA-pisteet 3 (keskivaikea) ja 29,8 % sPGA-pisteet 4 (vaikea). Psoriaasin peitossa oleva ihoalue (BSA) oli lähtötilanteessa keskimäärin 25,19 % (mediaani 21,0 %). Noin 30 % kaikista potilaista oli saanut psoriaasiin aiemmin valohoitoa ja 54 % tavanomaista systeemistä ja/tai biologista hoitoa (epäonnistuneet hoidot mukaan luettuna), ja näistä 37 % oli saanut tavanomaista systeemistä hoitoa ja 30 % biologista hoitoa. Noin kolmannes potilaista ei ollut saanut aiemmin valohoitoa, tavanomaista systeemistä hoitoa tai biologista hoitoa. Yhteensä 18 % potilaista oli sairastanut aiemmin psoriaasiartriittia.
PASI‑50/75/90-vasteen sekä sPGA-pisteet 0 (terve) tai 1 (lähes terve) saaneiden potilaiden osuudet esitetään seuraavassa taulukossa 5. PASI‑75-vasteen viikolla 16 saavuttaneiden potilaiden osuus osoitti apremilastihoidon parantavan keskivaikeaa ja vaikeaa läiskäpsoriaasia merkittävästi verrattuna lumelääkkeeseen. Viikolla 16 todettiin myös sPGA-pisteillä ja PASI‑50/90-vasteilla mitattavaa kliinistä paranemista. Apremilastihoidosta todettiin hyötyä lisäksi psoriaasin moniin ilmenemismuotoihin, kuten kutinaan, kynsioireisiin, päänahkaoireisiin ja elämänlaadun muuttujiin.
Taulukko 5. Kliininen vaste ESTEEM 1- ja ESTEEM 2 ‑tutkimuksissa viikolla 16 (FASa, LOCFb)
| ESTEEM 1 | ESTEEM 2 | |||
| Lumelääke | Apremilasti 30 mg x2/vrk* | Lumelääke | Apremilasti 30 mg x2/vrk* | |
| N | 282 | 562 | 137 | 274 |
| PASIc 75, n (%) | 15 (5,3) | 186 (33,1) | 8 (5,8) | 79 (28,8) |
| sPGAd-pisteet 0 (terve) tai 1 (lähes terve), n (%) | 11 (3,9) | 122 (21,7) | 6 (4,4) | 56 (20,4) |
| PASI 50, n (%) | 48 (17,0) | 330 (58,7) | 27 (19,7) | 152 (55,5) |
| PASI 90, n (%) | 1 (0,4) | 55 (9,8) | 2 (1,5) | 24 (8,8) |
BSA:n prosenttimuutose (%) keskiarvo ± keskihajonta | -6,9 ± 38,95 | -47,8 ± 38,48 | -6,1 ± 47,57 | -48,4 ± 40,78 |
| Kutinan VAS-arvion muutosf (mm), keskiarvo ± keskihajonta | -7,3 ± 27,08 | -31,5 ± 32,43 | -12,2 ± 30,94 | -33,5 ± 35,46 |
| DLQI-pisteiden muutosg, keskiarvo ± keskihajonta | -2,1 ± 5,69 | -6,6 ± 6,66 | -2,8 ± 7,22 | -6,7 ± 6,95 |
| SF-36 MCS -kyselyn muutos h, keskiarvo ± keskihajonta | -1,02 ± 9,161 | 2,39 ± 9,504 | 0,00 ± 10,498 | 2,58 ± 10,129 |
| * p < 0,0001 apremilasti vs. lumelääke, ESTEEM 2 ‑tutkimusta lukuun ottamatta, jossa PASI 90 ‑vasteen p = 0,0042 ja SF‑36 MCS ‑kyselyn muutoksen p = 0,0078. a FAS = Koko populaation analyysi (Full Analysis Set) b LOCF = Puuttuvat tiedot paikattu viimeisillä havainnoilla (Last Observation Carried Forward) c PASI = Psoriaasin laajuutta ja vaikeusastetta kuvaava indeksi (Psoriasis Area and Severity Index) d sPGA = Staattinen lääkärin kokonaisarvio (Static Physician Global Assessment) e BSA = Kehon pinta-ala (Body Surface Area) f VAS = Kipujana (Visual Analog Scale); 0 = paras, 100 = huonoin g DLQI = Ihon terveyteen liittyvää elämänlaatua mittaava kysely (Dermatology Life Quality Index); 0 = paras, 30 = huonoin h SF‑36 MCS = 36‑kohtaisen Medical Outcome Study SF -terveyskyselyn psyykkisen osion yhteenveto (Medical Outcome Study Short Form 36‑Item Health Survey, Mental Component Summary) | ||||
Apremilastin kliininen hyöty osoitettiin useissa lähtötilanteen demografisten tietojen ja lähtötilanteen kliinisten sairaustietojen (kuten psoriaasin sairastamisen keston ja aiemman psoriaasiartriitin) perusteella määritellyissä potilaiden osajoukoissa. Apremilastin kliininen hyöty osoitettiin myös riippumatta aiemmasta psoriaasilääkityksestä ja vasteesta aiempaan psoriaasihoitoon. Potilaiden vasteprosentit olivat samankaltaisia potilaan painosta riippumatta.
Vaste apremilastihoitoon oli nopea; psoriaasin oireet ja löydökset, mukaan lukien psoriaasin laajuus ja vaikeusaste (PASI) ja ihon epämiellyttävät tuntemukset/kipu ja kutina, olivat vähentyneet viikkoon 2 mennessä merkittävästi enemmän kuin lumelääkettä käytettäessä. PASI-vasteet saavutettiin yleensä viikkoon 16 mennessä ja ne säilyivät viikkoon 32 saakka.
PASI-pisteiden keskimääräinen prosenttimuutos lähtötilanteesta säilyi kummassakin tutkimuksessa vakaana hoidon satunnaistetun lopettamisvaiheen aikana, jos potilas satunnaistettiin uudelleen saamaan apremilastia viikolla 32 (taulukko 6).
Taulukko 6. Tehon säilyminen potilailla, jotka satunnaistettiin viikolla 0 saamaan APR 30 ‑hoitoa kaksi kertaa vuorokaudessa ja satunnaistettiin uudelleen jatkamaan APR 30 ‑hoitoa kaksi kertaa vuorokaudessa viikot 32–52
| Ajankohta | ESTEEM 1 | ESTEEM 2 | |
| PASI‑75-vasteen saavuttaneet potilaat viikolla 32 | PASI‑50-vasteen saavuttaneet potilaat viikolla 32 | ||
| PASI-pisteiden prosenttimuutos lähtötilanteesta, keskiarvo (%) ± keskihajontaa | Viikko 16 | -77,7 ± 20,30 | -69,7 ± 24,23 |
| Viikko 32 | -88 ± 8,30 | -76,7 ± 13,42 | |
| Viikko 52 | -80,5 ± 12,60 | -74,4 ± 18,91 | |
| DLQI-pisteiden muutos lähtötilanteesta, keskiarvo ± keskihajontaa | Viikko 16 | -8,3 ± 6,26 | -7,8 ± 6,41 |
| Viikko 32 | -8,9 ± 6,68 | -7,7 ± 5,92 | |
| Viikko 52 | -7,8 ± 5,75 | -7,5 ± 6,27 | |
| Potilaat, joilla lääkärin kokonaisarvio päänahan psoriaasista (ScPGA) 0 tai 1, n/N (%)b | Viikko 16 | 40/48 (83,3) | 21/37 (56,8) |
| Viikko 32 | 39/48 (81,3) | 27/37 (73,0) | |
| Viikko 52 | 35/48 (72,9) | 20/37 (54,1) | |
| a Sisältää potilaat, jotka satunnaistettiin uudelleen saamaan APR 30 ‑hoitoa kaksi kertaa vuorokaudessa viikolla 32 ja joista oli lähtötilanteen arvo sekä lähtötilanteen jälkeinen arvo arvioidulta tutkimusviikolta. b N = tutkittavat, joilla oli lähtötilanteessa keskivaikea tai sitä vaikeampiasteinen päänahan psoriaasi ja jotka satunnaistettiin uudelleen viikolla 32 saamaan APR 30 ‑hoitoa kaksi kertaa vuorokaudessa. Tutkittavat, joista puuttui tietoja, laskettiin hoitoon reagoimattomiksi. | |||
ESTEEM 1 ‑tutkimuksen viikolla 32 apremilastihoitoon uudelleen satunnaistetuista potilaista noin 61 % oli saavuttanut PASI‑75-vasteen viikolla 52. Niistä potilaista, jotka olivat saavuttaneet vähintään PASI‑75-vasteen ja jotka satunnaistettiin viikolla 32 uudelleen saamaan lumelääkettä hoidon satunnaistetussa lopettamisvaiheessa, 11,7 %:lla PASI‑75-vaste oli säilynyt viikolla 52. Lumehoitoon uudelleen satunnaistettujen potilaiden ajan mediaani PASI‑75-vasteen menettämiseen oli 5,1 viikkoa.
ESTEEM 2 ‑tutkimuksen viikolla 32 apremilastihoitoon uudelleen satunnaistetuista potilaista noin 80,3 % oli saavuttanut PASI‑50-vasteen viikolla 52. Niistä potilaista, jotka olivat saavuttaneet vähintään PASI‑50-vasteen ja jotka satunnaistettiin viikolla 32 uudelleen saamaan lumelääkettä, 24,2 %:lla PASI‑50-vaste oli säilynyt viikolla 52. Näiden potilaiden ajan mediaani viikolla 32 todettujen PASI-pisteiden 50 %:n huononemiseen oli 12,4 viikkoa.
Viikolla 32 alkaneen hoidon satunnaistetun lopettamisvaiheen aikana noin 70 % niistä ESTEEM 1 ‑tutkimuksen potilaista ja 65,6 % niistä ESTEEM 2 ‑tutkimuksen potilaista, joilla apremilastihoito aloitettiin uudelleen, saavutti jälleen PASI‑75-vasteen (ESTEEM 1) tai PASI‑50-vasteen (ESTEEM 2). Uudelleenhoidon kesto vaihteli koesetelman perusteella 2,6 viikosta 22,1 viikkoon.
Jos apremilastihoitoon ESTEEM 1 ‑tutkimuksen alussa satunnaistetut potilaat eivät olleet saavuttaneet PASI‑75-vastetta viikolla 32, he saivat käyttää samanaikaisesti paikallishoitoja ja/tai UVB-valohoitoa viikoilla 32–52. Näistä potilaista 12 % saavutti PASI‑75-vasteen viikolla 52, kun apremilastihoidon lisäksi käytössä oli paikallis- ja/tai valohoito.
ESTEEM 1- ja ESTEEM 2 ‑tutkimuksissa apremilastia saaneilla potilailla todettiin viikolla 16 kynsipsoriaasin merkittävää paranemista (vähenemistä) verrattuna lumelääkettä saaneisiin potilaisiin, mikä mitattiin NAPSI (Nail Psoriasis Severity Index) ‑pisteiden keskimääräisenä prosenttimuutoksena lähtötilanteesta (p < 0,0001 [ESTEEM 1] ja p = 0,0052 [ESTEEM 2]). Niillä potilailla, joiden apremilastihoito jatkui, havaittiin viikolla 32 kynsipsoriaasin paranemista edelleen.
ESTEEM 1‑ ja ESTEEM 2 ‑tutkimuksissa apremilastia saaneilla potilailla todettiin viikolla 16 vähintään keskivaikean päänahan psoriaasin (ScPGA-arvo ≥ 3) merkittävää paranemista verrattuna lumelääkettä saaneisiin potilaisiin, mikä mitattiin niiden potilaiden osuudella, jotka saivat viikolla 16 ScPGA-arvon 0 (terve) tai 1 (lähes terve) (p < 0,0001 kummassakin tutkimuksessa). Paraneminen säilyi yleensä, jos potilas satunnaistettiin uudelleen saamaan apremilastia viikot 32–52 (taulukko 6).
ESTEEM 1- ja ESTEEM 2 ‑tutkimuksissa apremilastia saaneiden potilaiden elämänlaadun todettiin DLQI- ja SF‑36v2 MCS ‑kyselyillä mitattuna parantuneen merkittävästi verrattuna lumelääkettä saaneisiin potilaisiin (taulukko 5). DLQI-pisteiden paraneminen oli säilynyt viikolla 52, jos tutkittava oli viikolla 32 satunnaistettu uudelleen saamaan apremilastia (taulukko 6). Lisäksi ESTEEM 1 ‑tutkimuksessa apremilastia saaneiden potilaiden työssä selviytymistä mittaavan WLQ‑25‑kyselyn (Work Limitations Questionnaire) tulokset paranivat merkittävästi verrattuna lumelääkettä saaneisiin potilaisiin.
Tutkimuksen alussa 30 mg apremilastia kahdesti vuorokaudessa saamaan satunnaistetuista 832 potilaasta 443 (53 %) osallistui ESTEEM 1- ja ESTEEM 2 -tutkimusten avoimiin jatkotutkimuksiin, ja heistä 115 (26 %) sai edelleen hoitoa viikolla 260. Potilailla, joilla apremilastihoito jatkui ESTEEM 1- ja ESTEEM 2 -tutkimusten avoimissa jatkotutkimuksissa, parantuminen PASI-pisteiden, psoriaasin peittämän ihoalueen, kutinan, kynsioireiden ja elämänlaadun muuttujien perusteella säilyi yleisesti ottaen enintään 5 hoitovuoteen asti.
Apremilastin pitkäaikaista turvallisuutta psoriaasiartriittia ja psoriaasia sairastaville potilaille kahdesti vuorokaudessa annettavalla 30 mg:n annoksella arvioitiin yhteensä 5 hoitovuoden ajan. Kokemukset pitkäaikaisissa avoimissa jatkotutkimuksissa vastasivat yleisesti ottaen kokemuksia 52‑viikkoisissa tutkimuksissa.
Psoriaasi pediatrisilla potilailla
Satunnaistettuun, kaksoissokkoutettuun, lumekontrolloituun monikeskustutkimukseen (SPROUT) osallistui 245 6–17‑vuotiasta pediatrista potilasta, joilla oli keskivaikea tai vaikea läiskäpsoriaasi ja joille harkittiin valohoitoa tai systeemistä hoitoa. Tutkimukseen otettujen tutkittavien sPGA‑pisteet olivat ≥ 3 (keskivaikea tai vaikea sairaus), ihottuman peitossa oleva ihoalue (body surface area, BSA) ≥ 10 % ja PASI-pisteet ≥ 12, psoriaasi ei ollut reagoinut riittävän hyvin paikallishoitoon tai oli muuten paikallishoitoon soveltumaton.
Tutkittavat satunnaistettiin suhteessa 2:1 saamaan joko apremilastia (n = 163) tai lumelääkettä (n = 82) 16 viikon ajan. Tutkittavat, jotka painoivat lähtötilanteessa vähintään 20 kg, mutta alle 50 kg, saivat joko lumelääkettä tai 20 mg apremilastia kaksi kertaa vuorokaudessa, ja tutkittavat, jotka painoivat lähtötilanteessa vähintään 50 kg, saivat joko lumelääkettä tai 30 mg apremilastia kaksi kertaa vuorokaudessa. Viikolla 16 lumelääkettä saaneelle ryhmälle alettiin antaa apremilastia (lähtötilanteen painon mukaisella annostuksella), ja apremilastia saanut ryhmä sai edelleen lääkettä (alkuperäisellä annostuksella) viikolle 52 saakka. Tutkittavat saivat käyttää mietoja paikallisesti käytettäviä kortikosteroideja kasvoilla, kainaloissa ja nivusissa sekä lääkkeettömiä kosteusvoiteita ainoastaan vartalon ihomuutoksiin.
Ensisijainen päätetapahtuma oli niiden tutkittavien osuus, jotka saavuttivat sPGA‑vasteen (pistemäärä 0 [terve] tai 1 [lähes terve], vähintään 2 pisteen vähenemä lähtötilanteesta) viikolla 16. Tärkein toissijainen päätetapahtuma oli niiden tutkittavien osuus, jotka saavuttivat PASI‑75-vasteen (PASI-pisteet pienentyneet vähintään 75 % lähtötilanteesta) viikolla 16. Muita viikon 16 päätetapahtumia olivat niiden tutkittavien osuudet, jotka saavuttivat PASI‑50-vasteen (PASI-pisteet pienentyneet vähintään 50 % lähtötilanteesta), PASI‑90-vasteen (PASI-pisteet pienentyneet vähintään 90 % lähtötilanteesta) tai lasten ihon terveyteen liittyvää elämänlaatua mittaavan kyselyn (CDLQI) vasteen (CDLQI-kokonaispisteet 0 tai 1), psoriaasin peitossa olevan ihoalueen prosenttimuutos lähtötilanteesta, PASI-pisteiden muutos lähtötilanteesta ja CDLQI-kokonaispisteiden muutos lähtötilanteesta.
Tutkimukseen otetut tutkittavat olivat 6–17‑vuotiaita (iän mediaani 13 vuotta), 41,2 % heistä oli 6–11‑vuotiaita ja 58,8 % oli 12–17‑vuotiaita. Psoriaasin peitossa oleva ihoalue (BSA) oli lähtötilanteessa keskimäärin 31,5 % (mediaani 26,0 %), ja lähtötilanteen keskimääräiset PASI-pisteet olivat 19,8 (mediaani 17,2). Tutkittavista 75,5 % sai lähtötilanteessa sPGA‑pisteet 3 (keskivaikea) ja 24,5 % sPGA‑pisteet 4 (vaikea). Tutkimukseen otetuista tutkittavista 82,9 % ei ollut aiemmin saanut tavanomaista systeemistä hoitoa, 82,4 % ei ollut aiemmin saanut valohoitoa, ja 94,3 % ei ollut aiemmin saanut biologista hoitoa.
Viikon 16 tehoon liittyvät tulokset on esitetty taulukossa 7.
Taulukko 7. Viikon 16 tehoon liittyvät tulokset keskivaikeaa tai vaikeaa läiskäpsoriaasia sairastavilla pediatrisilla potilailla (ITT-populaatio)
| SPROUT | ||
| Päätetapahtumaa | Lumelääke | Apremilasti |
| Satunnaistettujen tutkittavien määrä | N = 82 | N = 163 |
| sPGA-vasteb | 11,5 % | 33,1 % |
| PASI‑75-vasteb | 16,1 % | 45,4 % |
| PASI‑50-vasteb | 32,1 % | 70,5 % |
| PASI‑90-vasteb | 4,9 % | 25,2 % |
| Psoriaasin peitossa olevan ihoalueen (BSA) prosenttimuutos lähtötilanteestac | -21,82 ± 5,104 | -56,59 ± 3,558 |
| CDLQI‑pisteiden muutos lähtötilanteestac, d | -3,2 ± 0,45 | -5,1 ± 0,31 |
| Tutkittavat, joilla lähtötilanteen CDLQI-pisteet ≥ 2 | N = 76 | N = 148 |
| CDLQI-vasteb | 31,3 % | 35,4 % |
| BSA = kehon pinta-ala (Body Surface Area), CDLQI = lasten ihon terveyteen liittyvää elämänlaatua mittaava kysely (Children’s Dermatology Life Quality Index), ITT = hoitoaie (Intent To Treat), PASI = psoriaasin laajuutta ja vaikeusastetta kuvaava indeksi (Psoriasis Area and Severity Index), sPGA = staattinen lääkärin kokonaisarvio (Static Physician Global Assessment) a Apremilasti 20 tai 30 mg kahdesti vuorokaudessa vs. lumelääke viikolla 16, p‑arvo < 0,0001 sPGA‑vasteen ja PASI‑75-vasteen osalta, nimellinen p‑arvo < 0,01 kaikkien muiden päätetapahtumien paitsi CDLQI‑vasteen osalta (nimellinen p‑arvo 0,5616) b Vasteen saavuttaneiden tutkittavien osuus c Pienimmän neliösumman keskiarvo +/- keskivi d0 = parhaat pisteet, 30 = huonoimmat pisteet | ||
Apremilastia ja lumelääkettä saaneiden tutkittavien PASI-kokonaispistemäärän keskimääräinen prosenttimuutos lähtötilanteesta lumelääkekontrolloidussa vaiheessa on esitetty kuvassa 2.
Kuva 2. PASI-kokonaispisteiden prosenttimuutos lähtötilanteesta viikolle 16 asti (ITT-populaatio, MI)
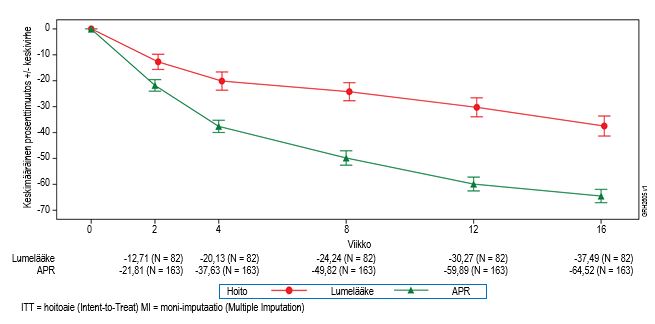
Alun perin apremilastiryhmään satunnaistetuilla potilailla sPGA‑vaste, PASI‑75-vaste ja muut viikolla 16 saavutetut päätetapahtumat olivat säilyneet aina viikolle 52.
Behçetin tauti
Apremilastin turvallisuutta ja tehoa arvioitiin vaiheen 3 satunnaistetussa lumelääkekontrolloidussa monikeskustutkimuksessa (RELIEF) aikuisilla potilailla, joilla on aktiivinen Behçetin tauti (BD) ja suun haavaumia. Potilaita oli aikaisemmin hoidettu vähintään yhdellä ei-biologisella BD-lääkkeellä suun haavaumien takia ja he soveltuivat systeemiseen hoitoon. BD:n samanaikaista hoitoa ei sallittu. Tutkimuspopulaatio täytti BD:n International Study Group (ISG) -kriteerit ja potilailla oli aikaisempia iholeesioita (98,6 %), sukupuolielinten haavaumia (90,3 %), muskuloskeletaalisia oireita (72,5 %), silmäoireita (17,4 %), keskushermosto-oireita (9,7 %), ruoansulatuskanavan oireita (9,2 %), lisäkivestulehdus (2,4 %) ja vaskulaarisia oireita (1,4 %). Tutkimuksesta suljettiin pois vakavasti sairaat BD-potilaat. Vakavasti sairaiksi määriteltiin potilaat, joilla oli aktiivinen tärkeimpien elinten vaurio (esimerkiksi meningoenkefaliitti tai keuhkovaltimon aneurysma).
Yhteensä 207 BD-potilasta satunnaistettiin suhteessa 1:1 saamaan joko apremilastia 30 mg kahdesti vuorokaudessa (n = 104) tai lumelääkettä (n = 103) 12 viikon ajan (lumelääkekontrolloitu vaihe) ja viikosta 12 viikkoon 64 kaikki potilaat saivat apremilastia 30 mg kahdesti vuorokaudessa (aktiivinen hoitovaihe). Potilaat olivat iältään 19–72-vuotiaita, iän keskiarvo oli 40 vuotta. BD:n keston keskiarvo oli 6,84 vuotta. Kaikilla potilailla oli esiintynyt toistuvasti suun haavaumia ja potilailla oli seulonnan yhteydessä ja satunnaistamisen aikana vähintään kaksi suun haavaumaa: lähtötilanteessa suun haavaumien määrän keskiarvo oli 4,2 apremilastiryhmässä ja 3,9 lumelääkeryhmässä.
Ensisijainen päätetapahtuma oli käyrän alapuolella oleva alue (AUC) suun haavaumien määrälle lähtötasosta viikolle 12. Toissijaiset päätetapahtumat sisälsivät muita suun haavaumien mittareita: suun haavauman kivun kipujana (VAS), sellaisten potilaiden osuus, joilla ei ole lainkaan suun haavaumia (täydellinen vaste), aika suun haavaumien parantumisen alkamiseen ja sellaisten potilaiden osuus, jotka saavuttavat suun haavaumien paranemisen viikolle 6 mennessä ja joilla ei ole suun haavaumia jokaisella käynnillä vähintään 6 lisäviikon ajan 12 viikon lumelääkekontrolloidussa hoitovaiheessa. Muut päätetapahtumat olivat Behçet’s Syndrome Activity Score (BSAS), BD Current Activity Form (BDCAF), mukaan lukien BD:n aktiivisuusindeksi (BDCAI), potilaan käsitys taudin aktiivisuudesta ja kliinikon yleiskäsitys taudin aktiivisuudesta, sekä BD Quality of Life -kysely (BD QoL).
Suun haavaumien mittarit
Apremilasti 30 mg kahdesti vuorokaudessa johti suun haavaumien merkitsevään paranemiseen, kuten suun haavaumien määrän AUC-arvo osoittaa, lähtötasosta viikolle 12 (p < 0,0001) verrattuna lumelääkkeeseen.
Merkittäviä parannuksia suun haavaumien muihin mittareihin havaittiin viikolla 12.
Taulukko 8. Suun haavaumien kliininen vaste viikolla 12 RELIEF-tutkimuksessa (ITT-populaatio)
| Päätetapahtumaa | Lumelääke N=103 | Apremilasti 30 mg x2/vrk N=104 |
| AUCb suun haavaumien määrälle lähtötasosta viikolle 12 (MI) | LS-keskiarvo 222,14 | LS-keskiarvo 129,54 |
| Muutos lähtötasosta suun haavaumien kivulle VAS-asteikolla mitattunac viikolla 12 (MMRM) | LS-keskiarvo -18,7 | LS-keskiarvo -42,7 |
| Sellaisten tutkittavien osuus, jotka saavuttavat suun haavaumien paranemisen (ilman suun haavaumia) viikolle 6 mennessä ja joilla ei ole suun haavaumia jokaisella käynnillä vähintään 6 lisäviikon ajan 12 viikon lumelääkekontrolloidussa hoitovaiheessa | 4,9 % | 29,8 % |
| Mediaaniaika (viikkoina) suun haavaumien paranemiseen lumelääkekontrolloidun hoitovaiheen aikana | 8,1 viikkoa | 2,1 viikkoa |
| Niiden tutkittavien osuus, joilla on täydellinen suun haavaumavaste viikolla 12 (NRI) | 22,3 % | 52,9 % |
| Niiden tutkittavien osuus, joilla on osittainen suun haavaumavastedviikolla 12 (NRI) | 47,6 % | 76,0 % |
| ITT = hoitoaie (intent to treat), LS = pienin neliösumma (least squares), MI = moni-imputaatio (multiple imputation), MMRM = sekavaikutusmalli toistuville mittauksille (mixed-effects model for repeated measures), NRI = Hoitoon reagoimattomien korvaamismenettely (non-responder imputation), x2/vrk=kahdesti vuorokaudessa. a kaikkien p‑arvo < 0,0001 apremilasti vs. lumelääke b AUC = käyrän alapuolella oleva alue (Area Under the Curve). c VAS=kipujana (Visual Analog Scale), 0 = ei kipua, 100 = pahin mahdollinen kipu. d Osittainen suun haavaumavaste = suun haavaumien määrä vähentynyt ≥ 50 % lähtötilanteen jälkeen (eksploratiivinen analyysi), nimellinen p‑arvo – < 0,0001 | ||
Niistä 104 potilaasta, jotka satunnaistettiin alun perin apremilastille 30 mg kahdesti vuorokaudessa, 75 potilasta (noin 72 %) sai edelleen tätä hoitoa viikolla 64. Suun haavaumien määrän (p ≤ 0,0015) ja suun haavaumakipujen (p ≤ 0,0035) keskiarvojen merkitsevä väheneminen havaittiin apremilasti 30 mg x2/vrk -hoitoryhmässä lumelääkeryhmään verrattuna jokaisella käynnillä jo viikolla 1 aina viikolle 12 asti. Potilailla, joita hoidettiin jatkuvasti apremilastilla ja jotka pysyivät tutkimuksessa, suun haavaumien paraneminen ja suun haavaumakivun väheneminen säilyivät aina viikolle 64 (kuvat 3 ja 4).
Niistä potilaista, jotka satunnaistettiin alun perin apremilastille 30 mg kahdesti vuorokaudessa, ja jotka pysyivät tutkimuksessa, suun haavaumien täydellisen vasteen saavuttaneiden potilaiden osuus ja suun haavaumien osittaisen vasteen saavuttaneiden potilaiden osuus säilyivät samalla tasolla (53,3 % ja 76,0 %) aina viikolle 64.
Kuva 3. Suun haavaumien määrän keskiarvo viikolle 64 asti (ITT-populaatio, DAO)
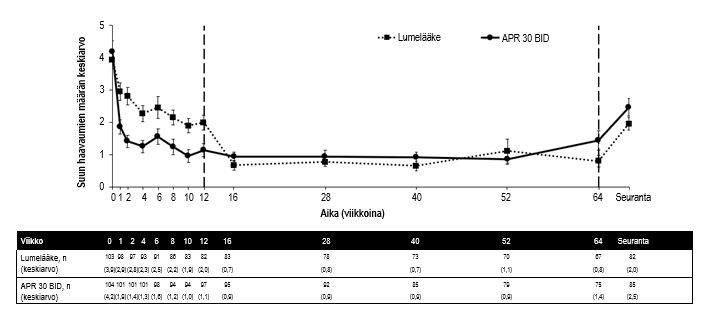
ITT = hoitoaie (Intent To Treat), DAO = tiedot kuten havaittu (Data As Observed).
APR 30 BID = apremilasti 30 mg kahdesti vuorokaudessa.
Huomautus: Lumelääke tai APR 30 mg BID osoittaa hoitoryhmän, johon potilaat satunnaistettiin. Lumelääkkeen hoitoryhmän potilaille vaihdettiin apremilasti 30 mg kahdesti vuorokaudessa viikolla 12.
Seuranta-ajankohta oli 4 viikkoa sen jälkeen kun potilaat olivat saavuttaneet viikon 64 tai 4 viikkoa sen jälkeen kun hoito oli lopetettu ennen viikkoa 64.
Kuva 4. Suun haavaumakipujen keskiarvon muutos lähtötasosta kipujanalla arvioituna viikolle 64 asti (ITT-populaatio, DAO)
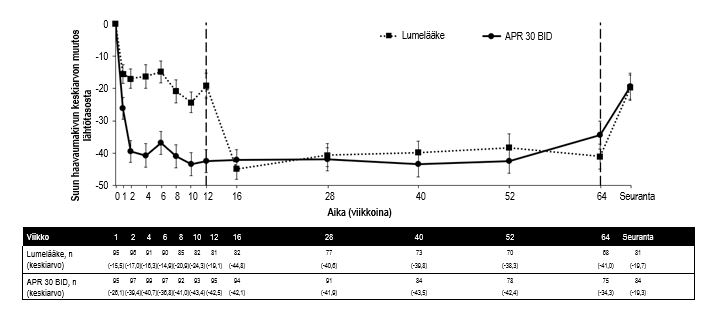
APR 30 BID = apremilasti kahdesti vuorokaudessa, ITT = hoitoaie (Intent To Treat), DAO = tiedot kuten havaittu (Data As Observed)
Huomautus: Lumelääke tai APR 30 mg BID osoittaa hoitoryhmän, johon potilaat satunnaistettiin. Lumelääkkeen hoitoryhmän potilaille vaihdettiin apremilasti 30 mg kahdesti vuorokaudessa viikolla 12.
Seuranta-ajankohta oli 4 viikkoa sen jälkeen kun potilaat olivat saavuttaneet viikon 64 tai 4 viikkoa sen jälkeen kun hoito oli lopetettu ennen viikkoa 64.
Parannukset Behçetin taudin kokonaisaktiivisuudessa
Apremilasti 30 mg kahdesti vuorokaudessa johti merkitsevään taudin kokonaisaktiivisuuden vähenemiseen, minkä osoitti BSAS:n (p < 0,0001) ja BDCAF:n (BDCAI, potilaan käsitys taudin aktiivisuudesta ja kliinikon yleiskäsitys taudin aktiivisuudesta; p‑arvojen ollessa ≤ 0,0335 kullekin kolmelle komponentille) keskiarvojen muutos lähtötasosta viikolla 12 lumelääkkeeseen verrattuna.
Niiden potilaiden, jotka satunnaistettiin alun perin saamaan apremilastia 30 mg kahdesti vuorokaudessa ja jotka pysyivät tutkimuksessa, parannukset (muutos lähtötasosta, keskiarvo) sekä BSAS:ssä että BDCAF:ssä säilyivät aina viikolle 64.
Elämänlaadun parantuminen
Apremilasti 30 mg kahdesti vuorokaudessa lumelääkkeeseen verrattuna johti huomattavasti suurempaan elämänlaadun (QoL) paranemiseen viikolla 12, kuten BD QoL Questionnaire (p = 0,0003) osoittaa.
Niiden potilaiden, jotka satunnaistettiin alun perin saamaan apremilastia 30 mg kahdesti vuorokaudessa ja jotka pysyivät tutkimuksessa, BD:n elämänlaadun parantuminen säilyi aina viikolle 64.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset apremilastin käytöstä Behçetin taudin ja psoriaasiartriitin hoidossa yhdessä tai useammassa pediatrisessa potilasryhmässä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Apremilasti imeytyy hyvin. Suun kautta annetun annoksen absoluuttinen biologinen hyötyosuus on noin 73 % ja ajan mediaani (tmax) huippupitoisuuteen plasmassa (Cmax) on noin 2,5 h. Apremilastin farmakokinetiikka on lineaarinen. Systeeminen altistus lisääntyy suhteessa annokseen annosalueella 10−100 mg/vrk. Kumuloituminen on minimaalista, kun apremilastia annetaan kerran vuorokaudessa, ja on noin 53 % terveillä tutkittavilla ja 68 % psoriaasia sairastavilla, kun apremilastia annetaan kaksi kertaa vuorokaudessa. Valmisteen ottaminen ruoan kanssa ei muuta biologista hyötyosuutta, joten apremilasti voidaan ottaa ruoan kanssa tai tyhjään mahaan.
Jakautuminen
Apremilastista sitoutuu ihmisen plasman proteiineihin noin 68 %. Näennäisen jakautumistilavuuden keskiarvo (Vd) on 87 l, mikä viittaa ekstravaskulaariseen jakautumiseen.
Biotransformaatio
Apremilasti metaboloituu voimakkaasti sekä CYP-välitteisten että muiden kuin CYP-välitteisten reittien kautta, oksidaatio, hydrolyysi ja konjugaatio mukaan lukien, mikä viittaa siihen, ettei yhden puhdistumareitin estyminen todennäköisesti aiheuta huomattavaa lääkeyhteisvaikutusta. Apremilastin oksidatiivinen metabolia on pääasiassa CYP3A4-välitteistä, mihin CYP1A2 ja CYP2A6 osallistuvat vähäisessä määrin. Apremilasti on suun kautta tapahtuneen annon jälkeen verenkierrossa oleva pääasiallinen komponentti. Apremilastin metaboloituminen on laajaa, ja vain 3 % annetusta kantayhdisteestä erittyy muuttumattomana virtsaan ja 7 % ulosteeseen. Verenkierrossa oleva pääasiallinen inaktiivinen metaboliitti on O‑demetyloidun apremilastin glukuronidikonjugaatti (M12). Altistus apremilastille vähenee, kun apremilastia annetaan samanaikaisesti voimakkaan CYP3A4:n indusorin rifampisiinin kanssa, mikä on odotettavissa, koska apremilasti on CYP3A4:n substraatti.
Apremilasti ei ole sytokromi P450 ‑entsyymien estäjä eikä indusori in vitro. Näin ollen apremilastin antaminen samanaikaisesti CYP-entsyymien substraattien kanssa ei todennäköisesti vaikuta CYP‑entsyymien välityksellä metaboloituvien vaikuttavien aineiden puhdistumaan ja altistukseen.
Apremilasti on P‑glykoproteiinin substraatti ja heikko estäjä (IC50 > 50 µm) in vitro. Kliinisesti oleellisia P‑glykoproteiinivälitteisiä lääkeyhteisvaikutuksia ei kuitenkaan oletettavasti esiinny.
Apremilastilla on in vitro vähäinen estävä vaikutus tai ei lainkaan estävää vaikutusta (IC50 > 10 µm) orgaanisiin anionin kuljettajiin 1 ja 3 (OAT1 ja OAT3), orgaaniseen kationin kuljettajaan 2 (OCT2), orgaanisiin anionin kuljettajapolypeptideihin 1B1 ja 1B3 (OATP1B1 ja OATP1B3) ja rintasyövän resistenssiproteiiniin (BCRP). Apremilasti ei myöskään ole näiden kuljettajien substraatti. Kliinisesti merkittävät lääkeyhteisvaikutukset ovat näin ollen epätodennäköisiä, kun apremilastia annetaan samanaikaisesti sellaisten lääkkeiden kanssa, jotka ovat näiden kuljettajien substraatteja tai estäjiä.
Eliminaatio
Apremilastin puhdistuma plasmasta on terveillä koehenkilöillä keskimäärin noin 10 l/h. Terminaalisen eliminaation puoliintumisaika on noin 9 tuntia. Radioaktiivisesti merkityn apremilastin annon jälkeen 58 % radioaktiivisuudesta erittyi virtsaan ja 39 % ulosteeseen. Radioaktiivisesta annoksesta 3 % erittyi apremilastina virtsaan ja 7 % ulosteeseen.
Iäkkäät potilaat
Apremilastia tutkittiin nuorilla ja iäkkäillä terveillä tutkittavilla. Altistus apremilastille oli iäkkäillä (65–85‑vuotiailla) tutkittavilla noin 13 % suurempi AUC-arvon osalta ja noin 6 % suurempi Cmax‑arvon osalta kuin nuorilla (18–55‑vuotiailla) tutkittavilla. Yli 75‑vuotiaita tutkittavia koskevia farmakokineettisiä tietoja kliinisistä tutkimuksista on vähän. Iäkkäiden potilaiden annoksen säätäminen ei ole tarpeen.
Pediatriset potilaat
Apremilastin farmakokinetiikkaa arvioitiin kliinisessä tutkimuksessa keskivaikeaa tai vaikeaa läiskäpsoriaasia sairastavilla 6–17‑vuotiailla tutkittavilla käyttäen suositeltua pediatrista annostusta (ks. kohta Farmakodynamiikka). Populaatiofarmakokineettisen analyysin perusteella pediatristen potilaiden vakaan tilan apremilastialtistus (AUC ja Cmax) pediatrista annostusta (painon mukaan joko 20 mg tai 30 mg kahdesti vuorokaudessa) käytettäessä vastasi aikuispotilaiden vakaan tilan altistusta annostuksella 30 mg kahdesti vuorokaudessa.
Munuaisten vajaatoiminta
Lievää tai keskivaikeaa munuaisten vajaatoimintaa sairastavien aikuisten tutkittavien ja kaltaistettujen terveiden tutkittavien farmakokinetiikassa ei ollut merkittävää eroa (kummankin N = 8). Tulokset puoltavat sitä, että jos potilaalla on lievä tai keskivaikea munuaisten vajaatoiminta, annoksen säätäminen ei ole tarpeen.
Kun kahdeksalle vaikeaa munuaisten vajaatoimintaa sairastavalle aikuiselle tutkittavalle annettiin 30 mg:n kerta-annos apremilastia, AUC-arvo suureni noin 89 % ja Cmax-arvo noin 42 %. Vaikeaa munuaisten vajaatoimintaa sairastavien aikuispotilaiden (eGFR < 30 ml/min/1,73 m2 tai kreatiniinipuhdistuma < 30 ml/min) apremilastiannos tulisi pienentää 30 mg:aan kerran vuorokaudessa.Vähintään 6‑vuotiaiden vaikeaa munuaisten vajaatoimintaa sairastavien pediatristen potilaiden apremilastiannos tulisi pienentää 30 mg:aan kerran vuorokaudessa vähintään 50 kg painavilla potilailla ja 20 mg:aan kerran vuorokaudessa vähintään 20 kg mutta alle 50 kg painavilla potilailla (ks. kohta Annostus ja antotapa).
Maksan vajaatoiminta
Keskivaikea tai vaikea maksan vajaatoiminta ei vaikuta apremilastin ja sen pääasiallisen metaboliitin M12:n farmakokinetiikkaan. Maksan vajaatoimintaa sairastavien potilaiden annoksen säätäminen ei ole tarpeen.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta ja toistuvan altistuksen aiheuttamaa toksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille. Mahdollisesta immunotoksisuudesta, ihoärsytyksestä tai valotoksisuudesta ei ole näyttöä.
Hedelmällisyys ja alkion varhaisvaiheen kehitys
Apremilastiannokset 1 mg/kg/vrk, 10 mg/kg/vrk, 25 mg/kg/vrk, ja 50 mg/kg/vrk eivät vaikuttaneet uroshiirillä tehdyssä hedelmällisyystutkimuksessa urosten hedelmällisyyteen. Urosten hedelmällisyyden suhteen haitaton annos (NOAEL) oli yli 50 mg/kg/vrk (yli 3 kertaa kliininen altistus).
Naarashiirillä tehdyssä yhdistetyssä hedelmällisyys- ja alkion/sikiön kehitystoksisuustutkimuksessa, jossa naaraille annettiin apremilastia suun kautta 10 mg/kg/vrk, 20 mg/kg/vrk, 40 mg/kg/vrk ja 80 mg/kg/vrk, kiimakierron ja parittelua edeltävän ajan havaittiin pidentyvän annoksella 20 mg/kg/vrk ja sitä suuremmilla annoksilla. Tästä huolimatta kaikki hiiret parittelivat ja tiineyksien määrä oli normaali. Naaraiden hedelmällisyyden suhteen vaikutukseton annos (NOEL) oli 10 mg/kg/vrk (1,0 kertaa kliininen altistus).
Alkion/sikiön kehitys
Naarashiirillä tehdyssä yhdistetyssä hedelmällisyys- ja alkion/sikiön kehitystoksisuustutkimuksessa, jossa naaraille annettiin apremilastia suun kautta 10 mg/kg/vrk, 20 mg/kg/vrk, 40 mg/kg/vrk ja 80 mg/kg/vrk, emojen sydämen absoluuttinen ja/tai suhteellinen paino kasvoi annoksilla 20 mg/kg/vrk, 40 mg/kg/vrk ja 80 mg/kg/vrk. Varhaisten resorptioiden lisääntymistä ja luutuneiden tarsaalien määrän vähentymistä havaittiin annoksilla 20 mg/kg/vrk, 40 mg/kg/vrk ja 80 mg/kg/vrk. Sikiöiden painon laskua ja kallon supraoksipitaalisen luun luutumisen hidastumista havaittiin annoksilla 40 mg/kg/vrk ja 80 mg/kg/vrk. Alkion/sikiön kehityksen ja emon suhteen vaikutukseton annos (NOEL) hiirillä oli 10 mg/kg/vrk (1,3 kertaa kliininen altistus).
Apinoilla tehdyssä alkion/sikiön kehitystoksisuustutkimuksessa, jossa emoille annettiin suun kautta annoksia 20 mg/kg/vrk, 50 mg/kg/vrk, 200 mg/kg/vrk ja 1 000 mg/kg/vrk, annokset 50 mg/kg/vrk ja sitä suuremmat annokset lisäsivät keskenmenojen määrää suhteessa annokseen. Annoksella 20 mg/kg/vrk (1,4 kertaa kliininen altistus) ei havaittu tutkimuslääkkeeseen liittyviä keskenmenoja.
Pre- ja postnataalinen kehitys
Hiirillä tehdyssä pre- ja postnataalisessa tutkimuksessa apremilastia annettiin suun kautta tiineille naaraille annoksina 10 mg/kg/vrk, 80 mg/kg/vrk ja 300 mg/kg/vrk 6. gestaatiopäivästä 20. imetyspäivään asti. Annoksella 300 mg/kg/vrk havaittiin emojen painon laskua ja painokehityksen heikentymistä sekä yksi synnytysvaikeuksiin liittynyt kuolema. Sekä annoksilla 80 mg/kg/vrk että 300 mg/kg/vrk yhdellä emolla havaittiin fyysisiä toksisuuden merkkejä synnytyksen yhteydessä. Annoksilla ≥ 80 mg/kg/vrk (≥ 4,0 kertaa kliininen altistus) havaittiin poikasten peri- ja postnataalisten kuolemien lisääntymistä sekä poikasten painon laskua ensimmäisellä imetysviikolla. Apremilastiin liittyneitä vaikutuksia tiineysajan pituuteen, tiineiden hiirten lukumäärään gestaatiovaiheen lopussa, poikueen synnyttäneiden hiirten lukumäärään tai poikasten kehitykseen 7. syntymänjälkeisen päivän jälkeen ei esiintynyt. Postnataalijakson ensimmäisen viikon aikana havaitut vaikutukset poikasten kehityksessä liittyivät todennäköisesti apremilastin aiheuttamaan poikastoksisuuteen (poikasten pienempi paino ja heikentynyt elinkelpoisuus) ja/tai puutteista emon antamassa hoidossa (maidon puuttuminen poikasten mahasta oli yleisempää). Kaikki vaikutukset kehitykseen havaittiin postnataalisen jakson ensimmäisen viikon aikana; apremilastiin liittyviä vaikutuksia ei todettu jäljellä olevana vieroitusta edeltävänä aikana tai vieroituksen jälkeisenä aikana, sukupuolisen kypsymisen, käyttäytymisen, parittelun, hedelmällisyyden ja kohdun parametrit mukaan lukien. Emoon tai F1‑sukupolveen vaikutukseton annos (NOEL) oli 10 mg/kg/vrk (1,3 kertaa kliininen AUC-arvo).
Karsinogeenisuustutkimukset
Hiirillä ja rotilla tehdyissä karsinogeenisuustutkimuksissa ei havaittu näyttöä apremilastihoitoon liittyvästä karsinogeenisuudesta.
Genotoksisuustutkimukset
Apremilasti ei ole genotoksinen. Apremilasti ei indusoinut mutaatioita Amesin testissä eikä kromosomipoikkeavuuksia viljellyissä ihmisen perifeerisen veren lymfosyyteissä metabolisen aktivaation läsnä ollessa tai puuttuessa. Apremilasti ei ollut annoksiin 2 000 mg/kg/vrk saakka klastogeeninen hiiren mikrotumatestissä in vivo.
Muut tutkimukset
Mahdollisesta immunotoksisuudesta, ihoärsytyksestä tai valotoksisuudesta ei ole näyttöä.
Farmaseuttiset tiedot
Apuaineet
Tabletin ydin
Mikrokiteinen selluloosa
Laktoosimonohydraatti
Kroskarmelloosinatrium
Magnesiumstearaatti
Kalvopäällyste
Polyvinyylialkoholi
Titaanidioksidi (E 171)
Makrogoli (3350)
Talkki
Punainen rautaoksidi (E 172)
20 mg:n tabletit sisältävät lisäksi keltaista rautaoksidia (E 172).
30 mg:n tabletit sisältävät lisäksi keltaista rautaoksidia (E 172) ja mustaa rautaoksidia (E 172).
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta.
Säilytys
Säilytä alle 30 ºC.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
OTEZLA tabletti, kalvopäällysteinen
10 mg+20 mg+30 mg (L:kyllä) 4+4+19 fol (aloituspakkaus) (377,97 €)
30 mg (L:kyllä) 56 fol (761,87 €)
PF-selosteen tieto
Otezla (hoidonaloituspakkaus)
PVC/alumiinifolioläpipainopakkauksissa on 27 kalvopäällysteistä tablettia (4 × 10 mg, 4 × 20 mg, 19 × 30 mg).
Otezla 30 mg pakkaus
PVC/alumiinifolioläpipainopakkauksissa on 14 kalvopäällysteistä tablettia. Pakkauskoko 56 tablettia.
Valmisteen kuvaus:
Otezla 10 mg tabletit, kalvopäällysteiset
Vaaleanpunainen, vinoneliön muotoinen 10 mg:n kalvopäällysteinen tabletti, jonka pituus on 8 mm. Tabletin toiselle puolelle on kaiverrettu ”APR” ja vastakkaiselle puolelle ”10”.
Otezla 20 mg tabletit, kalvopäällysteiset
Ruskea, vinoneliön muotoinen 20 mg:n kalvopäällysteinen tabletti, jonka pituus on 10 mm. Tabletin toiselle puolelle on kaiverrettu ”APR” ja vastakkaiselle puolelle ”20”.
Otezla 30 mg tabletit, kalvopäällysteiset
Beige, vinoneliön muotoinen 30 mg:n kalvopäällysteinen tabletti, jonka pituus on 12 mm. Tabletin toiselle puolelle on kaiverrettu ”APR” ja vastakkaiselle puolelle ”30”.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
OTEZLA tabletti, kalvopäällysteinen
10 mg+20 mg+30 mg 4+4+19 fol
30 mg 56 fol
- Alempi erityiskorvaus (65 %). Apremilasti: Aikuisten aktiivisen nivelpsoriaasin hoito erityisin edellytyksin (299).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Apremilasti ja dimetyylifumaraatti (psoriaasi): Läiskäpsoriaasin hoito erityisin edellytyksin / Apremilasti: Nivelpsoriaasin ja Behçetin taudin hoito erityisin edellytyksin (377).
ATC-koodi
L04AA32
Valmisteyhteenvedon muuttamispäivämäärä
21.10.2024
Yhteystiedot
Keilaranta 10, PL 86
02101 Espoo
09 5490 0500
