ONBREZ BREEZHALER inhalaatiojauhe, kapseli, kova 300 mikrog
Vaikuttavat aineet ja niiden määrät
Yksi kapseli sisältää indakaterolimaleaattia vastaten 300 mikrogrammaa indakaterolia.
Inhalaattorista saatava indakaterolimaleaattiannos vastaa 240 mikrogrammaa indakaterolia.
Apuaine, jonka vaikutus tunnetaan
Yksi kapseli sisältää 24,6 mg laktoosia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Inhalaatiojauhe, kapseli, kova
Kliiniset tiedot
Käyttöaiheet
Onbrez Breezhaler on tarkoitettu käytettäväksi hengitystieobstruktion bronkodilatoivaan ylläpitohoitoon keuhkoahtaumatautia (COPD) sairastavilla aikuispotilailla.
Annostus ja antotapa
Annostus
Suositusannos on yhden 150 mikrogramman kapselin sisältö inhaloituna kerran vuorokaudessa Onbrez Breezhaler ‑inhalaattorilla. Annosta tulee suurentaa vain lääkärin ohjeen mukaan.
Yhden 300 mikrogramman kapselin sisällön inhaloinnin kerran vuorokaudessa Onbrez Breezhaler ‑inhalaattorilla on osoitettu lievittävän hengenahdistusta edelleen ja tuottavan siten kliinistä lisähyötyä etenkin vaikeaa keuhkoahtaumatautia sairastavilla. Maksimiannos on 300 mikrogrammaa kerran vuorokaudessa.
Onbrez Breezhaler tulee ottaa aina samaan aikaan päivästä joka päivä.
Jos annos jää väliin, seuraava annos tulee ottaa tavanomaiseen aikaan seuraavana päivänä.
Erityisryhmät
Iäkkäät potilaat
Plasman huippupitoisuus ja systeeminen kokonaisaltistus suurenevat iän myötä, mutta iäkkäiden potilaiden annosta ei kuitenkaan tarvitse muuttaa.
Maksan vajaatoiminta
Annosta ei tarvitse muuttaa, jos potilaalla on lievä tai keskivaikea maksan vajaatoiminta. Tietoa Onbrez Breezhaler -valmisteen käytöstä vaikeaa maksan vajaatoimintaa sairastavien potilaiden hoidossa ei ole.
Munuaisten vajaatoiminta
Annosta ei tarvitse muuttaa, jos potilaalla on munuaisten vajaatoiminta.
Pediatriset potilaat
Ei ole asianmukaista käyttää Onbrez Breezhaler -valmistetta pediatrisille potilaille (alle 18‑vuotiaat).
Antotapa
Vain inhalaatioon. Onbrez Breezhaler-kapseleita ei saa niellä.
Kapselit saa poistaa läpipainopakkauksestaan vasta juuri ennen käyttöä.
Kapselit tulee aina ottaa Onbrez Breezhaler ‑inhalaattoria käyttäen (ks. kohta Käyttö- ja käsittelyohjeet). Annostelussa on aina käytettävä jokaisen uuden pakkauksen mukana toimitettavaa Onbrez Breezhaler -inhalaattoria.
Potilaita pitää neuvoa valmisteen oikeasta käyttötavasta. Jos potilaan hengittäminen ei helpotu, häneltä on varmistettava, ettei hän niele lääkettä inhaloinnin sijaan.
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet ennen lääkkeen antoa.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Astma
Onbrez Breezhaler -valmiste on pitkävaikutteinen beeta2-adrenerginen agonisti, jonka käyttöaihe on ainoastaan COPD:n hoito. Sitä ei pidä käyttää astman hoitoon, sillä pitkäaikaisesta käytöstä astmapotilailla ei ole tietoa.
Pitkävaikutteiset beeta2-adrenergiset agonistit saattavat lisätä astmaan liittyvien vakavien haittatapahtumien riskiä, mukaan lukien astmaan liittyvä kuolema, kun niitä käytetään astman hoitoon.
Yliherkkyys
Onbrez Breezhalerin annostelun jälkeisiä välittömiä yliherkkyysreaktioita on raportoitu. Jos allergiseen reaktioon viittaavia merkkejä ilmenee (etenkin hengitys- tai nielemisvaikeuksia; kielen, huulten tai kasvojen turpoamista; urtikariaa, ihottumaa), on Onbrez Breezhaler -valmisteen käyttö välittömästi lopetettava ja muu, vaihtoehtoinen lääkitys aloitettava.
Paradoksaalinen bronkospasmi
Kuten muidenkin inhalaatiovalmisteiden, myös Onbrez Breezhaler ‑valmisteen annostelun yhteydessä voi esiintyä paradoksaalista ja mahdollisesti hengenvaarallista bronkospasmia. Jos potilaalle kehittyy paradoksaalinen bronkospasmi, Onbrez Breezhaler ‑hoito tulee lopettaa heti ja sen sijasta on aloitettava jokin vaihtoehtoinen hoito.
Taudin paheneminen
Onbrez Breezhaler ei ole tarkoitettu akuuttien bronkospasmiepisodien hoitoon, ts. kohtauslääkkeeksi. Jos keuhkoahtaumatauti pahenee Onbrez Breezhaler ‑hoidon aikana, potilaan tilanne ja keuhkoahtaumataudin hoito tulisi arvioida uudelleen. Onbrez Breezhaler ‑vuorokausiannosta ei tule suurentaa 300 mikrogramman maksimiannosta suuremmaksi.
Systeemiset vaikutukset
Onbrez Breezhalerin käyttö suositelluilla annoksilla ei yleensä aiheuta kliinisesti relevantteja kardiovaskulaarivaikutuksia. Tästä huolimatta indakaterolin, kuten muidenkin beeta2-adrenergisten agonistien, käytössä tulee noudattaa varovaisuutta, jos potilaalla on jokin kardiovaskulaarisairaus (sepelvaltimotauti, akuutti sydäninfarkti, rytmihäiriöitä, hypertensio), jokin kouristuksia aiheuttava sairaus tai tyreotoksikoosi tai jos hän on epätavallisen herkkä beeta2-adrenergisten agonistien vaikutuksille.
Kardiovaskulaariset vaikutukset
Kuten muutkin beeta2-adrenergiset agonistit, myös indakateroli voi aiheuttaa joillekin potilaille kliinisesti merkittäviä kardiovaskulaarivaikutuksia, jotka ilmenevät syketaajuuden tihenemisenä, verenpaineen kohoamisena ja/tai muina oireina. Tällaisessa tilanteessa hoito saatetaan joutua lopettamaan. Beeta-agonistit ovat aiheuttaneet myös EKG-muutoksia kuten T-aallon madaltumista, QTc-ajan pitenemistä ja ST-laskua. Havaintojen kliinisestä merkityksestä ei kuitenkaan ole tietoa. Siksi pitkävaikutteisia beeta2-adrenerigisia agonisteja (LABA) tai LABA-valmistetta sisältäviä valmisteita kuten Onbrez Breezhaleria pitää käyttää varoen potilaille joilla tiedetään tai epäillään olevan pidentynyt QT-aika tai joita hoidetaan QT-ajan pitenemistä aiheuttavilla lääkevalmisteilla.
Hypokalemia
Joillekin potilaille beeta2-adrenergiset agonistit saattavat aiheuttaa merkittävää hypokalemiaa, joka altistaa kardiovaskulaarihaitoille. Seerumin kaliumpitoisuuden pieneneminen on yleensä ohimenevää eikä vaadi kaliumlisän käyttöä. Vaikeaa keuhkoahtaumatautia sairastavilla hypoksia ja muu samanaikainen hoito saattavat pahentaa hypokalemiaa (ks. kohta Yhteisvaikutukset), mikä voi suurentaa rytmihäiriöherkkyyttä.
Hyperglykemia
Suurten beeta2-adrenergisten agonistiannosten inhaloiminen saattaa suurentaa plasman glukoosipitoisuuksia. Diabeetikkojen plasman glukoosipitoisuuksia tulee seurata tavanomaista tarkemmin Onbrez Breezhaler ‑hoidon aloittamisen yhteydessä.
Kliinisissä tutkimuksissa olivat kliinisesti merkittävät verensokerimuutokset 1–2 % yleisempiä suositelluilla Onbrez Breezhaler ‑annoksilla kuin lumelääkkeellä. Onbrez Breezhaleria ei ole tutkittu potilailla, joilla on huonossa hoitotasapainossa oleva diabetes.
Apuaineet
Kapselit sisältävät laktoosia. Potilaiden, joilla on harvinainen perinnöllinen galaktoosi-intoleranssi, täydellinen laktaasinpuutos tai glukoosi-galaktoosi-imeytymishäiriö, ei pidä käyttää tätä lääkettä.
Yhteisvaikutukset
Sympatomimeettiset lääkevalmisteet
Muiden sympatomimeettisten lääkevalmisteiden samanaikainen käyttö (joko monoterapiana tai yhdistelmähoidon osana) saattaa voimistaa Onbrez Breezhaler ‑hoidon haittavaikutuksia.
Onbrez Breezhaleria ei pidä käyttää yhdessä muiden pitkävaikutteisten beeta2-adrenergisten agonistien tai pitkävaikutteista beeta2-adrenergista agonistia sisältävien valmisteiden kanssa.
Hypokalemiaa aiheuttavat hoidot
Samanaikainen hoito hypokalemiaa aiheuttavilla lääkkeillä (metyyliksantiinijohdokset, steroidit tai kaliumia säästämättömät diureetit) saattaa tehostaa beeta2-adrenergisten agonistien mahdollista hypokaleemista vaikutusta, joten varovaisuus on siksi tarpeen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Beetasalpaajat
Beetasalpaajat ja beeta2-adrenergiset agonistit saattavat heikentää tai estää toistensa vaikutusta samanaikaisesti käytettynä. Näin ollen indakaterolia ei pidä käyttää yhdessä beetasalpaajien (myöskään silmätippojen) kanssa, ellei niiden käyttöön ole painavaa syytä. Jos beetasalpaajan käyttö on tarpeen, tulee ensisijaisesti valita kardioselektiivinen beetasalpaaja, mutta niidenkin käytössä on noudatettava varovaisuutta.
Metaboliset ja kuljettajaproteiineihin liittyvät yhteisvaikutukset
Indakaterolipuhdistuman kannalta keskeisten tekijöiden eli CYP3A4:n ja P-glykoproteiinin (P-gp) toiminnan estyminen suurentaa systeemisen indakaterolialtistuksen jopa kaksinkertaiseksi. Yhteisvaikutuksista johtuvan altistuksen suurenemisen ei katsota aiheuttavan turvallisuusriskiä, sillä Onbrez Breezhaleria käytettiin kliinisissä tutkimuksissa enimmillään vuoden ajan jopa kaksi kertaa suositusannosten suuruisilla annoksilla.
Indakaterolin ei ole todettu aiheuttavan yhteisvaikutuksia samanaikaisesti käytettävien lääkevalmisteiden kanssa. In vitro ‑tutkimukset ovat viitanneet siihen, että indakaterolin potentiaali aiheuttaa metabolisia yhteisvaikutuksia muiden lääkevalmisteiden kanssa on kliinisessä käytössä saavutettavilla altistustasoilla erittäin vähäinen.
Raskaus ja imetys
Raskaus
Ei ole olemassa tietoja indakaterolin käytöstä raskaana oleville naisille. Eläinkokeissa ei ole havaittu suoria tai epäsuoria lisääntymistoksisia vaikutuksia kliinisesti relevanteilla altistuksilla (ks. kohta Prekliiniset tiedot turvallisuudesta). Kuten muutkin beeta2-adrenergiset agonistit, indakateroli saattaa vaikeuttaa synnytystä relaksoimalla kohdun sileää lihasta. Onbrez Breezhalerin käyttö raskauden aikana on suositeltavaa ainoastaan mikäli odotetut hyödyt on suuremmat kuin mahdolliset riskit.
Imetys
Ei tiedetä, erittyvätkö indakateroli/metaboliitit ihmisen rintamaitoon. Olemassa olevat farmakokineettiset/toksikologiset tiedot koe-eläimistä ovat osoittaneet indakaterolin/metaboliittien erittyvän rintamaitoon (ks. kohta Prekliiniset tiedot turvallisuudesta). Imetettävään lapseen kohdistuvia riskejä ei voida poissulkea. On päätettävä, lopetetaanko rintaruokinta vai lopetetaanko Onbrez Breezhaler -hoito ottaen huomioon rintaruokinnasta aiheutuvat hyödyt lapselle ja hoidosta koituvat hyödyt äidille.
Hedelmällisyys
Rotilla on todettu alentunut hedelmällisyysaste. Kuitenkin on epätodennäköistä, että inhalaationa käytettävä indakateroli vaikuttaisi ihmisen lisääntymiseen tai hedelmällisyyteen, kun sitä käytetään suositelluina enimmäisannoksina (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Onbrez Breezhalerilla ei ole haitallista vaikutusta tai on vain vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Yhteenveto turvallisusprofiilista
Suositusannoksilla yleisimpiä haittavaikutuksia olivat nenänielutulehdus (14,3 %), ylähengitystieinfektiot (14,2 %), yskä (8,2 %), päänsärky (3,7 %) ja lihasspasmit (3,5 %). Ne olivat useimmiten lieviä tai kohtalaisia, ja niiden esiintyvyys pieneni, kun hoitoa jatkettiin.
Suositusannoksilla käytettävän Onbrez Breezhalerin haittavaikutusprofiili keuhkoahtaumatautipotilailla sopii kliinisesti merkityksettömään systeemiseen beeta-2-stimulaatioon. Syketiheys muuttui keskimäärin alle yhden lyönnin minuutissa. Takykardia oli harvinaista, ja sitä raportoitiin yhtä usein kuin lumehoitoa käytettäessä. QTcF-ajan oleellista pitenemistä verrattuna lumehoitoon ei havaittu. Pidentynyttä QTcF-aikaa [ts. >450 ms (miehet) ja >470 ms (naiset)] ja hypokalemiaa havaittiin saman verran kuin lumehoidolla. Veren glukoosipitoisuuden keskimääräinen maksimimuutos oli samanlainen Onbrez Breezhaler- ja lumeryhmissä.
Haittavaikutusten yhteenvetotaulukko
Onbrez Breezhalerin vaiheen III kliiniseen tutkimusohjelmaan otettiin potilaita, joilla oli keskivaikea tai vaikea keuhkoahtaumatauti. 4 764 potilasta altistui indakaterolille enintään yhden vuoden ajan ja sai enintään kaksi kertaa suositellun enimmäisannoksen suuruisia annoksia. Näistä potilaista 2 611 sai 150 mikrogrammaa kerran vuorokaudessa ja 1 157 sai 300 mikrogrammaa kerran vuorokaudessa. Noin 41 %:lla potilaista oli vaikea keuhkoahtaumatauti. Potilaiden keski-ikä oli 64 vuotta ja 48 % oli vähintään 65-vuotiaita. Valtaosa (80 %) oli valkoihoisia.
Taulukossa 1 esitetyt haittavaikutukset on luokiteltu MedDRA-elinjärjestelmäluokituksen mukaisesti keuhkoahtaumatautipotilaiden turvallisuustietokantaan. Kunkin elinjärjestelmäluokan haittavaikutukset on järjestetty yleisyysjärjestykseen yleisimmästä alkaen käyttäen seuraavia määritelmiä: hyvin yleinen (≥1/10), yleinen (≥1/100, <1/10), melko harvinainen (≥1/1 000, <1/100), harvinainen (≥1/10 000, <1/1 000), hyvin harvinainen (<1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
Taulukko 1 Haittavaikutukset
Haittavaikutukset | Yleisyysluokka |
Infektiot | |
Nenänielutulehdus | Hyvin yleinen |
Ylähengitystieinfektiot | Hyvin yleinen |
Sinuiitti | Yleinen |
Immuunijärjestelmä | |
Yliherkkyysreaktiot1 | Melko harvinainen |
Aineenvaihdunta ja ravitsemus | |
Diabetes ja hyperglykemia | Yleinen |
Hermosto | |
Päänsärky | Yleinen |
Huimaus | Yleinen |
Parestesiat | Melko harvinainen |
Sydän | |
Iskeeminen sydänsairaus | Yleinen |
Sydämentykytys | Yleinen |
Eteisvärinä | Melko harvinainen |
Takykardia | Melko harvinainen |
Hengityselimet, rintakehä ja välikarsina | |
Yskä | Yleinen |
Suun ja nielun alueen kipu, mukaan lukien kurkun ärsytys | Yleinen |
Vetinen nuha | Yleinen |
Paradoksaalinen bronkospasmi | Melko harvinainen |
Iho ja ihonalainen kudos | |
Kutina/ihottuma | Yleinen |
Luusto, lihakset ja sidekudos | |
Lihasspasmit | Yleinen |
Muskuloskeletaaliset kivut | Yleinen |
Lihaskivut | Melko harvinainen |
Yleisoireet ja antopaikassa todettavat haitat | |
Rintakipu | Yleinen |
Perifeerinen turvotus | Yleinen |
1 Yliherkkyysreaktioita on raportoitu myyntiluvan myöntämisen jälkeisen Onbrez Breezhaler -lääkkeen käytön yhteydessä. Nämä raportit perustuvat vapaaehtoiseen ilmoittamismenettelyyn ja ne ovat peräisin tuntemattoman suuruisesta potilaspopulaatiosta, jolloin ei aina ole mahdollista esittää luotettavaa arviota kyseessä olevan haittavaikutuksen esiintyvyydestä tai sen mahdollisesta syy-seuraussuhteesta käytettyyn lääkevalmisteeseen nähden. Siksi esiintyvyys on laskettu kliinisistä tutkimuksista saadun kokemuksen perusteella.
Kun Onbrez Breezhaleria käytettiin 600 mikrogramman annoksin kerran vuorokaudessa, sen turvallisuusprofiili oli yleisesti ottaen samankaltainen kuin suositusannoksia käytettäessä. Uutena haittavaikutuksena esiintyi tällöin vapinaa (yleinen).
Tiettyjen haittavaikutusten kuvaus
Vaiheen III kliinisissä tutkimuksissa havaittiin vastaanottokäyntien yhteydessä, että keskimäärin 17–20 %:lla potilaista oli satunnaista yskää, joka alkoi yleensä 15 sekunnin kuluessa inhalaation ottamisesta ja kesti tyypillisesti 5 sekuntia (noin 10 sekuntia tupakoijilla). Sitä havaittiin naisilla useammin kuin miehillä ja tupakoijilla useammin kuin tupakoinnin lopettaneilla. Inhalaation jälkeinen yskä ei johtanut tutkimuksen keskeyttämiseen yhdenkään suositusannoksia käyttäneen potilaan kohdalla (yskä on keuhkoahtaumataudin oire, ja vain 8,2 % potilaista ilmoitti yskää haittatapahtumana). Ei ole viitteitä siitä, että inhalaation jälkeiseen yskään liittyisi bronkospasmia, pahenemisvaiheita, taudin vaikeutumista tai tehon heikkenemistä.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista kansallisen ilmoitusjärjestelmän kautta:
www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA.
Yliannostus
Keuhkoahtaumatautipotilailla 10 kertaa suositellun terapeuttisen enimmäisannoksen suuruisiin kerta-annoksiin liittyi kohtalaista syketaajuuden kiihtymistä, systolisen verenpaineen kohoamista ja QTc-ajan pitenemistä.
Indakaterolin yliannostus aiheuttaa todennäköisesti beeta2-adrenergisten agonistien tyyppivaikutusten korostumista, ts. takykardiaa, vapinaa, sydämentykytystä, päänsärkyä, pahoinvointia, oksentelua, uneliaisuutta, kammioarytmioita, metabolista asidoosia, hypokalemiaa ja hyperglykemiaa.
Elintoimintoja tukeva ja oireenmukainen hoito on aiheellista. Vaikeissa tapauksissa potilaat tulisi ottaa sairaalahoitoon. Kardioselektiivisten beetasalpaajien käyttöä voidaan harkita, mutta sen tulee aina tapahtua lääkärin valvonnassa ja äärimmäistä varovaisuutta noudattaen, sillä beetasalpaajien käyttö voi johtaa bronkospasmiin.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Obstruktiivisten hengitystiesairauksien lääkkeet, selektiiviset beeta-2-reseptoriagonistit, ATC-koodi: R03AC18
Vaikutusmekanismi
Beeta2-adrenergisten agonistien farmakologiset vaikutukset johtuvat ainakin osittain solunsisäisen adenylaattisyklaasientsyymin aktivoitumisesta. Kyseinen entsyymi katalysoi adenosiinitrifosfaatin (ATP) muuntumista sykliseksi 3’, 5’-adenosiinimonofosfaatiksi (cAMP). cAMP-pitoisuuksien suureneminen johtaa keuhkoputkien sileän lihaksen relaksoitumiseen. In vitro ‑tutkimukset ovat osoittaneet, että pitkävaikutteisen beeta2-adrenerginen agonisti indakaterolin beeta2-adrenergisten reseptorien kautta välittyvä agonistinen vaikutus on yli 24 kertaa voimakkaampi kuin sen beeta1-reseptorivaikutus ja 20 kertaa voimakkaampi kuin sen beeta3-adrenergisten reseptorien kautta välittyvä vaikutus.
Inhaloidulla indakaterolilla on keuhkoissa paikallinen bronkodilatoiva vaikutus. Indakateroli on ihmisen beeta2-adrenoreseptorin osittainen agonisti, jonka teho ilmenee jo nanomolaarisilla pitoisuuksilla. Eristetyissä ihmisen keuhkoputkissa indakaterolin vaikutus alkaa nopeasti ja kestää pitkään.
Vaikka beeta2-adrenoreseptorit ovat vallitsevia adrenoreseptoreja keuhkoputkien sileässä lihaksessa ja beeta1-adrenergiset reseptorit sydämessä, on ihmisen sydämessä silti myös beeta2-reseptoreja, joiden osuus kaikista adrenoreseptoreista on 10–50 %. Sydämen beeta2-adrenergisten reseptorien tarkkaa vaikutusta ei tunneta. Niiden olemassaolon vuoksi on kuitenkin mahdollista, että myös erittäin selektiivisillä beeta2-adrenergisilla agonisteilla saattaa olla sydänvaikutuksia.
Farmakodynaamiset vaikutukset
Kerran vuorokaudessa 150 tai 300 mikrogramman annoksina käytettävä Onbrez Breezhaler paransi tasaisesti ja kliinisesti merkittävässä määrin keuhkojen toimintaa (uloshengityksen sekuntikapasiteetti, FEV1) 24 tunnin ajan useissa kliinisissä farmakodynamiikkaa ja tehoa selvittävissä tutkimuksissa. Vaikutus alkoi nopeasti, 5 minuutin kuluessa inhalaation jälkeen FEV1-arvot olivat lähtötilanteeseen verrattuna 110–160 ml suuremmat, mikä on verrattavissa nopeavaikutteisen beeta2-adrenergisen agonisti salbutamolin vaikutukseen annoksella 200 mikrogrammaa ja tilastollisesti merkitsevästi nopeampaa kuin käytettäessä salmeterolin ja flutikasonin yhdistelmää annoksella 50/500 mikrogrammaa. Vakaan tilan FEV1- arvojen keskimääräinen maksimaalinen paraneminen oli 250–330 ml lähtötilanteeseen verrattuna.
Bronkodilatoiva vaikutus ei riippunut annosteluajankohdasta, aamu tai ilta.
Onbrez Breezhalerin todettiin vähentävän keuhkojen hyperinflaatiota, johtaen sisäänhengityskapasiteetin suurenemiseen sekä rasituksen yhteydessä että levossa, verrattuna lumehoitoon.
Vaikutukset sydämen elektrofysiologiaan
Kaksoissokkoutettussa, lume- ja aktiivi (moksifloksasiini) -kontrolloidussa, 2 viikkoa kestäneessä tutkimuksessa, johon osallistui 404 tervettä vapaaehtoista todettiin, että toistuvan annostelun yhteydessä QTcF-aika piteni keskimäärin enintään 2,66 millisekuntia (90 % luottamusväli 0,55–4,77) annoksella 150 mikrogrammaa, 2,98 millisekuntia (1,02–4,93) annoksella 300 mikrogramman ja 3,34 millisekuntia (0,86–5,82) annoksella 600 mikrogrammaa. Tutkituilla annoksilla ei havaittu yhteyttä QTc-ajan muutoksen ja lääkeainepitoisuuden välillä.
Arytmioiden kehittymisessä ei havaittu kliinisesti merkittävää eroa Onbrez Breezhaler ‑ryhmän ja lumehoitoa tai tiotropiumia saaneiden välillä 26 viikon pituisessa kaksoissokkoutetussa, lumekontrolloidussa vaiheen III tutkimuksessa, johon otettiin 605 keuhkoahtaumatautipotilasta, joita seurattiin 24 tunnin ajan lähtötilanteessa ja enintään kolmeen otteeseen 26 viikon hoitojakson aikana.
Kliininen teho ja turvallisuus
Kliiniseen tutkimusohjelmaan kuului yksi 12 viikon pituinen, kaksi 6 kk pituista (toista jatkettiin 1 vuoteen asti turvallisuuden ja siedettävyyden arvioimiseksi) ja yksi 1 vuoden pituinen satunnaistettu, kontrolloitu tutkimus potilailla, joilla oli kliinisesti todettu keuhkoahtaumatauti. Tutkimuksissa mitattiin keuhkojen toimintaa ja seurattiin erilaisia terveysmuuttujia, kuten hengenahdistusta, pahenemisvaiheita ja terveyteen liittyvää elämänlaatua.
Keuhkojen toiminta
Onbrez Breezhaler paransi keuhkojen toimintaa kliinisesti merkittävässä määrin, kun sitä otettiin kerran vuorokaudessa 150 mikrogramman tai 300 mikrogramman annoksina. 12 viikon kohdalla 150 mikrogramman annos paransi ensisijaista päätemuuttujaa (minimipitoisuuksilla 24 tunnin kuluttua mitattua FEV1-arvoa) 130–180 ml verrattuna lumehoitoon (p<0,001) ja 60 ml verrattuna salmeteroliin annoksella 50 mikrogrammaa kahdesti vuorokaudessa (p<0,001). 300 mikrogramman annos paransi kyseistä FEV1-arvoa 170–180 ml verrattuna lumehoitoon (p<0,001) ja 100 ml verrattuna formoteroliin annoksella 12 mikrogrammana kahdesti vuorokaudessa (p<0,001). Molemmat annokset paransivat kyseistä FEV1-arvoa 40–50 ml verrattuna avoimeen, kerran vuorokaudessa 18 mikrogramman annoksina otettuun tiotropiumhoitoon (150 mikrogrammaa, p = 0,004, 300 mikrogrammaa, p = 0,01). Onbrez Breezhalerin 24 tuntia kestävä bronkodilatoiva vaikutus säilyi ensimmäisen annoksen jälkeen koko 1 vuoden hoitojakson ajan, eikä viitteitä tehon heikkenemisestä (takyfylaksian kehittymisestä) havaittu.
Oireiden lievittyminen
Molemmat annokset lievittivät dyspneaindeksillä (Transitional Dyspnoea Index [TDI]) arvioituja hengenahdistusoireita ja paransivat St. George’s Respiratory Questionnaire ‑kyselyllä (SGRQ) mitattua terveydentilaa tilastollisesti merkitsevästi ja kliinisesti merkittävässä määrin verrattuna lumehoitoon. Vaste oli yleensä suurempi kuin aktiiviverrokkihoidon yhteydessä (taulukko 2). Onbrez Breezhaler ‑hoitoa saaneet potilaat tarvitsivat myös merkitsevästi vähemmän kohtauslääkettä, ja heillä oli enemmän kohtauslääkkeettömiä päiviä kuin lumeryhmässä. Myös niiden päivien prosentuaalinen osuus, jolloin potilailla ei ollut oireita päiväaikaan, suureni merkitsevästi.
Yhdistetty tehoanalyysi 6 kuukauden hoidon jälkeen osoitti, että keuhkoahtaumataudin pahenemisvaiheita esiintyi tilastollisesti merkitsevästi vähemmän kuin lumeryhmässä. Hoidon vertailu lumehoitoon osoitti, että 150 mikrogrammalla esintyvysssuhde oli 0,68 (95 % luottamusväli [0,47; 0,98]; p-arvo 0,036) ja 300 mikrogrammalla 0,74 (95 % luottamusväli [0,56; 0,96]; p-arvo 0,026).
Tietoa afrikkalaista syntyperää olevien hoidosta on rajallisesti.
Taulukko 2 Oireiden lievittyminen 6 kuukauden hoidolla
Hoito Annos (mikrog.) | Indakateroli 150 x 1 | Indakateroli 300 x 1 | Tiotropium 18 x 1 | Salmeteroli 50 x 2 | Formoteroli 12x 2 | Lumehoito |
Niiden potilaiden osuus (%), joiden dyspneaindeksissä (TDI) saavutettiin kliinisesti merkittävä paraneminen† | 57 a 62 b | 71 b 59 c | 57 b | 54 a | 54 c | 45 a 47 b 41 c |
Niiden potilaiden osuus (%), joiden terveydentilakyselyssä (SGRQ) saavutettiin kliinisesti merkittävä paraneminen† | 53 a 58 b | 53 b 55 c | 47 b | 49 a | 51 c | 38 a 46 b 40 c |
Vuorokaudessa käytettyjen kohtauslääkeannosten määrän väheneminen | 1,3 a 1,5 b | 1,6 b | 1,0 b | 1,2 a | ea | 0,3 a 0,4 b |
Niiden päivien osuus (%), jolloin kohtauslääkettä ei käytetty | 60 a 57 b | 58 b | 46 b | 55 a | ea | 42 a 42 b |
Tutkimusasetelma, a: indakateroli (150 mikrog), salmeteroli tai lumelääke, b: indakateroli (150 tai 300 mikrog), tiotropium tai lumelääke, c: indakateroli (300 mikrog), formoteroli tai lumelääke
† Pienin kliinisesti merkittävä muutos (MCID) on ≥1 pisteen muutos TDI:ssä, ja ≥4 pisteen muutos SGRQ:ssa
ea = ei arvioitu 6 kk kohdalla
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Onbrez Breezhaler -valmisteen käytöstä kaikkien pediatristen potilasryhmien hoidossa keuhkoahtaumataudissa (COPD) (ks. kohta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Indakateroli on kiraalinen molekyyli, jossa on R-konfiguraatio.
Farmakokineettiset tiedot saatiin useista terveillä vapaaehtoisilla ja keuhkoahtaumatautipotilailla tehdyistä kliinisistä tutkimuksista.
Imeytyminen
Indakaterolin huippupitoisuudet seerumissa saavutettiin noin 15 minuutin kuluttua kerta-annosten tai toistuvien annosten inhaloimisesta (mediaaniaika). Systeeminen indakaterolialtistus suureni annoksen myötä ja suhteessa annokseen annostasolla 150–600 mikrogrammaa. Inhaloidun indakaterolin absoluuttinen biologinen hyötyosuus oli keskimäärin 43–45 %. Systeeminen altistus muodostuu keuhkoista (noin 75 %) ja suolistosta (noin 25 %) tapahtuvan imeytymisen seurauksena.
Seerumin indakaterolipitoisuudet suurenivat, kun lääke otettiin toistuvasti kerran vuorokaudessa. Vakaa tila saavutettiin 12–14 päivässä. Kun 150–600 mikrogramman annoksia inhaloitiin kerran vuorokaudessa, indakaterolin keskimääräinen kumuloitumissuhde (24 tunnin AUC-arvo päivänä 14 verrattuna päivään 1) oli 2,9–3,5.
Jakautuminen
Laskimoinfuusion jälkeen indakaterolin jakautumistilavuus oli terminaalisessa eliminaatiovaiheessa 2557 litraa, mikä viittaa siihen, että lääke jakautuu voimakkaasti kudoksiin. In vitro ‑kokeissa 94,1–95,3 % lääkkeestä sitoutui ihmisen seerumin proteiineihin ja 95,1–96,2 % plasman proteiineihin.
Biotransformaatio
Kun radioaktiivisesti leimattua indakaterolia otettiin suun kautta ihmisellä tehdyssä imeytymis-, jakautumis-, metabolia- ja eliminaatiotutkimuksessa, seerumissa tavattiin lähinnä muuttumatonta indakaterolia, joka selitti noin kolmanneksen lääkkeen vuorokausialtistuksesta (24 tunnin AUC). Runsaimmin seerumissa tavattu metaboliitti oli indakaterolin hydroksyloitunut johdannainen. Muita runsaina esiintyneitä metaboliitteja olivat indakaterolin ja hydroksyloituneen indakaterolin fenoli-O-glukuronidit. Lisäksi tavattiin hydroksyloituneen metaboliitin diastereomeeriä, indakaterolin N-glukuronidia ja C- ja N-dealkylaation kautta muodostuneita metaboliitteja.
In vitro ‑tutkimukset viittasivat siihen, että ainoa indakaterolia fenoli-O-glukuronidiksi metaboloiva UGT-isoentsyymi on UGT1A1. Kun indakaterolia inkuboitiin rekombinanttien CYP1A1-, CYP2D6- ja CYP3A4-entsyymien kanssa, havaittiin oksidaatiotuotteita. CYP3A4:n todettiin olevan tärkein indakaterolia hydroksyloiva isoentsyymi. In vitro ‑tutkimukset viittasivat myös siihen, että indakateroli on P-gp-kuljettajaproteiinin substraatti. Sen P-gp-affiniteetti on kuitenkin pieni.
Eliminaatio
Kliinisissä tutkimuksissa, joissa virtsaa kerättiin talteen, todettiin, että yleensä alle 2 % annoksesta erittyi muuttumattomana indakaterolina virtsaan. Indakaterolin munuaispuhdistuma oli keskimäärin 0,46–1,20 l/h. Kun tätä verrataan indakaterolin puhdistumaan seerumista, joka on 23,3 l/h, on selvää, että munuaispuhdistumalla on vain vähäinen merkitys systeemiseen verenkiertoon päässeen indakaterolin eliminaation kannalta (noin 2–5 % systeemisestä puhdistumasta).
Ihmisen imeytymis-, jakautumis-, metabolia- ja eliminaatiotutkimuksessa, jossa indakaterolia annettiin suun kautta, lääkettä erittyi ulosteeseen enemmän kuin virtsaan. Indakateroli erittyi ihmisen ulosteeseen pääasiassa kanta-aineen muodossa (54 % annoksesta) ja vähäisemmässä määrin myös indakaterolin hydroksyloituneina metaboliitteina (23 % annoksesta). Massatasapaino oli täydellinen, ja ≥90 % annoksesta erittyi ulosteeseen.
Seerumin indakaterolipitoisuudet pienenivät monivaiheiseseti, ja terminaalinen puoliintumisaika oli keskimäärin 45,5–126 tuntia. Toistuvan indakateroliannostelun yhteydessä tapahtuvasta kumuloitumisesta laskettu efektiivinen puoliintumisaika oli 40–52 tuntia. Tämä on yhtäpitävää sen kanssa, että vakaan tilan saavuttamiseen kuluva aika on havaintojen mukaan noin 12–14 vrk.
Erityisryhmät
Populaatiofarmakokinetiikan analyysi osoitti, että iällä (enintään 88-vuotiaat aikuiset), sukupuolella, painolla (32–168 kg) tai rodulla ei ole kliinisesti merkittää vaikutusta indakaterolin farmakokinetiikkaan. Tutkimus ei viitannut siihen, että eri etnisten ryhmien välillä olisi ollut eroja.
Indakaterolin Cmax- ja AUC-arvoissa ei havaittu oleellisia muutoksia lievää tai keskivaikeaa maksan vajaatoimintaa sairastavilla potilailla, eivätkä nämä potilaat eronneet terveistä verrokeista myöskään proteiineihin sitoutumisen suhteen. Vaikeaa maksan vajaatoimintaa sairastavilla ei ole tehty tutkimuksia.
Munuaisten vajaatoimintapotilailla ei tehty tutkimuksia, koska vain hyvin pieni osa kokonaiseliminaatiosta tapahtuu munuaisteitse.
Prekliiniset tiedot turvallisuudesta
Indakaterolin beeta2-agonistisesta vaikutuksesta johtuvia kardiovaskulaarisia vaikutuksia olivat koirilla havaitut takykardia, rytmihäiriöt ja sydänlihasvauriot. Jyrsijöillä todettiin lievää nenäontelon ja kurkunpään ärsytystä. Kaikki nämä löydökset havaittiin altistuksilla, jotka olivat huomattavasti ihmisen odotettavissa olevaa altistusta suuremmat.
Vaikka indakateroli ei vaikuttanut rottien tavallisiin lisääntymistoimintoihin rotilla tehdyssä hedelmällisyystutkimuksessa, pieneni tiineeksi tulleiden F1 -jälkeläisten osuus tehdyssä peri- ja postnataalisessa rottatutkimuksessa, jossa altistus oli 14-kertainen verrattuna Onbrez Breezhalerilla hoidettuihin ihmisiin. Indakateroli ei ollut alkiotoksinen eikä teratogeeninen rotalla eikä kanilla.
Geenitoksisuustutkimuksissa ei havaittu mutageenisuutta eikä klastogeenisuutta. Karsinogeenisuutta arvioitiin kaksivuotisessa tutkimuksessa rotalla ja 6 kk pituisessa tutkimuksessa siirtogeenisellä hiirellä. Rotalla havaittiin munasarjojen hyvänlaatuisten leiomyoomien ja munasarjojen sileän lihaksen paikallisen hyperplasian yleistymistä. Tämä vastasi muilla beeta2-adrenergisilla agonisteilla tehtyjä samankaltaisia havaintoja. Hiirellä ei todettu viitteitä karsinogeenisuudesta. Systeemiset altistukset (AUC), jotka eivät aiheuttaneet mitään haittavaikutuksia (NOAEL-altistus), olivat rotalla vähintään 7 kertaa ja hiirellä vähintään 49 kertaa suuremmat kuin 300 mikrogramman Onbrez Breezhaler ‑annoksia kerran vuorokaudessa käyttävän ihmisen altistus.
Farmaseuttiset tiedot
Apuaineet
Kapselin sisältö
Laktoosimonohydraatti
Kapselin kuori
Liivate
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
30 kuukautta.
Säilytys
Säilytä alle 30 °C.
Säilytä kapselit läpipainopakkauksessaan, ja poista ne pakkauksestaan vasta juuri ennen käyttöä. Herkkä kosteudelle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
ONBREZ BREEZHALER inhalaatiojauhe, kapseli, kova
300 mikrog (L:kyllä) 30 fol (inhalaattori) (43,13 €), 3 x 30 fol (inhalaattori) (112,14 €)
PF-selosteen tieto
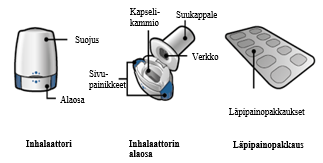
Onbrez Breezhaler on kerta-annosinhalaattori. Inhalaattorin runko-osa ja suojus on valmistettu akryylinitriilibutadieenistyreenistä (ABS). Painikkeet on valmistettu metyylimetakrylaatti-ABS:stä. Neulat ja jouset ovat ruostumatonta terästä.
PA/Al/PVC - Al-läpipainopakkaus, sisältäen 10 kovaa kapselia
Pahvipakkaus, jossa 10 kapselia ja yksi Onbrez Breezhaler ‑inhalaattori.
Pahvipakkaus, jossa 30 kapselia ja yksi Onbrez Breezhaler ‑inhalaattori.
Monipakkaus, jossa 2 pakkausta (à 30 kapselia ja 1 inhalaattori).
Monipakkaus, jossa 3 pakkausta (à 30 kapselia ja 1 inhalaattori).
Monipakkaus, jossa 30 pakkausta (à 10 kapselia ja 1 inhalaattori).
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Läpinäkyvä (väritön), valkoista jauhetta sisältävä kapseli, jossa on sininen vaakaviiva. Viivan yläpuolelle on painettu sinisellä “IDL 300”, ja sen alapuolella on sininen yrityksen logo (
).
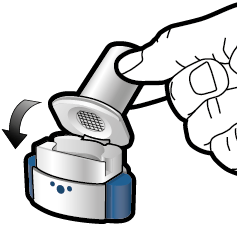
Käyttö- ja käsittelyohjeet
Inhalaattori on hävitettävä, kun kaikki kapselit on käytetty.
Käsittely- ja käyttöohjeet
Lue Käyttöohjeet kokonaan ennen kuin käytät Onbrez Breezhaler -valmistetta. | |||
|
|
|
|
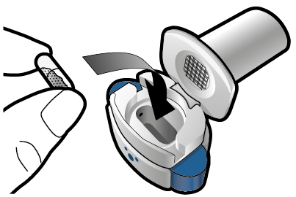
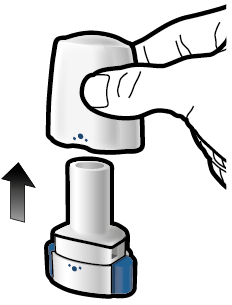
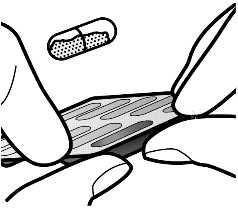
Aseta kapseli | Lävistä ja vapauta | Inhaloi syvään | Tarkista että kapseli on tyhjä |
1 ↓ | 2 ↓ | 3 ↓ | 4 ↓ |
Vaihe 1a: Vedä suojus pois |
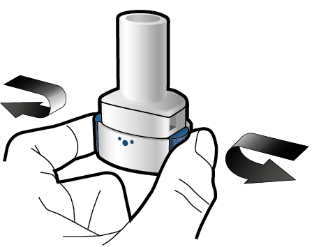
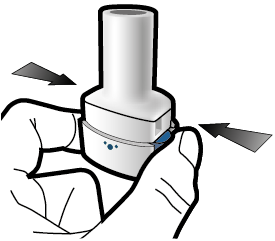
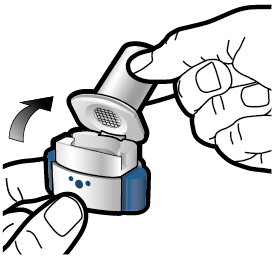
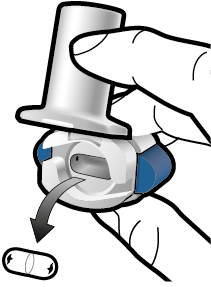
Vaihe 2a: Lävistä kapseli yhden kerran Pidä inhalaattoria pystyasennossa. Lävistä kapseli painamalla sivupainikkeita yhtä aikaa tukevasti toisiaan kohti. Kuulet naksahduksen, kun neula lävistää kapselin. Lävistä kapseli vain yhden kerran. |
Vaihe 3a: Hengitä kokonaan ulos Älä puhalla inhalaattoriin. |
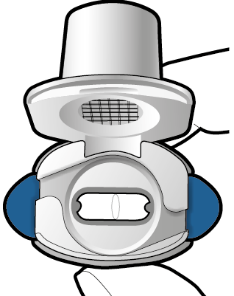
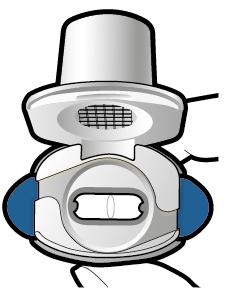
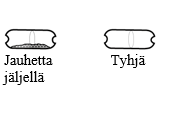
Tarkista että kapseli on tyhjä Avaa inhalaattori ja katso, onko kapseliin jäänyt vielä jauhetta. Jos kapselissa on vielä jauhetta:
|
Vaihe 1b: Avaa inhalaattori |
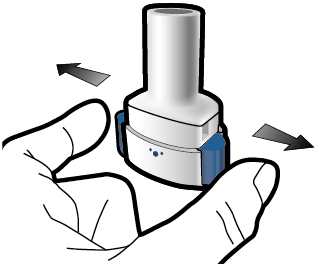
Vaihe 2b: Vapauta sivupainikkeet |
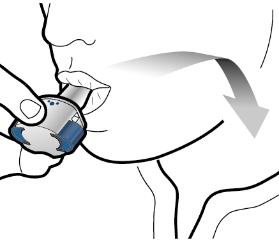
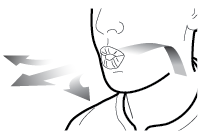
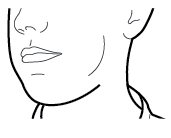
Vaihe 3b: Inhaloi lääke syvään Pitele inhalaattoria kuvan mukaisella tavalla. Aseta suukappale suuhusi ja sulje huulet tiukasti sen ympärille. Älä paina sivupainikkeita. Hengitä sisään niin nopeasti ja syvään kuin voit. Inhalaation aikana kuuluu suriseva ääni. Lääke saattaa maistua suussasi kun inhaloit sen. |
|
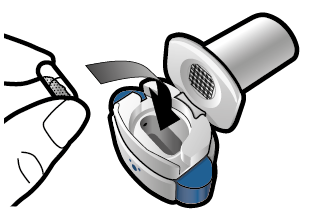
Vaihe 1c: Ota kapseli esiin Poista yksi kapseli läpipainopakkauksesta. Älä niele kapselia. |
|
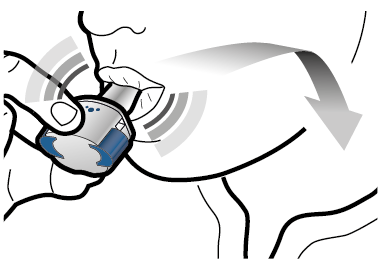
Vaihe 3c: Pidätä hengitystä Pidätä hengitystäsi enintään 5 sekunnin ajan. |
Poista tyhjä kapseli Laita tyhjä kapseli sekajätteeseen. Sulje inhalaattori ja aseta suojus takaisin paikoilleen. |
Vaihe 1d: Aseta kapseli inhalaattoriin Älä koskaan aseta kapselia suoraan suukappaleeseen. | Tärkeää tietoa
| ||
Vaihe 1e: Sulje inhalaattori | |||
Onbrez Breezhaler –pakkaus sisältää:
| Usein kysytyt kysymykset Miksi inhalaattorista ei kuulunut ääntä kun inhaloin? Kapseli on saattanut juuttua inhalaattorin kammioon. Jos näin tapahtuu, irrota kapseli varovasti koputtamalla inhalaattorin pohjaan. Inhaloi lääke uudelleen toistamalla vaiheet 3a–3c. Mitä teen jos kapselissa on jauhetta jäljellä? Et ole saanut tarpeeksi lääkettä. Sulje inhalaattori ja toista vaiheet 3a–3c. Yskin inhalaation jälkeen – haittaako se? Niin voi tapahtua. Kunhan kapseli on tyhjä, olet saanut tarpeeksi lääkettä. Tunsin kielelläni pieniä kapselinpaloja – haittaako se? Niin voi tapahtua. Siitä ei ole haittaa. Kapselin hajoaminen pieniin palasiin on todennäköisempää, jos se lävistetään useammin kuin kerran. | Inhalaattorin puhdistus Pyyhi suukappale sisä- ja ulkopuolelta puhtaalla, kuivalla, nukkaamattomalla kankaalla jauhejäämien poistamiseksi. Pidä inhalaattori kuivana. Älä koskaan pese inhalaattoria vedellä. |
Inhalaattorin hävittäminen käytön jälkeen Inhalaattori täytyy hävittää kun pakkauksen kapselit on käytetty. Kysy apteekkihenkilökunnalta tarpeettomiksi jääneiden lääkkeiden tai inhalaattorien hävittämisestä. |
Korvattavuus
ONBREZ BREEZHALER inhalaatiojauhe, kapseli, kova
300 mikrog 30 fol, 3 x 30 fol
- Alempi erityiskorvaus (65 %). Krooninen keuhkoastma ja sitä läheisesti muistuttavat krooniset obstruktiiviset keuhkosairaudet (203).
- Peruskorvaus (40 %).
ATC-koodi
R03AC18
Valmisteyhteenvedon muuttamispäivämäärä
21.11.2024
Yhteystiedot
 NOVARTIS FINLAND OY
NOVARTIS FINLAND OY Revontulenkuja 1
02100 Espoo
010 613 3200
www.novartis.fi
Lääkeinformaatiopalvelu 010 6133 210,
medinfo.nordics@novartis.com