NUWIQ injektiokuiva-aine ja liuotin, liuosta varten 250 IU, 500 IU, 1000 IU, 1500 IU, 2000 IU, 3000 IU
Vaikuttavat aineet ja niiden määrät
Nuwiq 250 IU injektiokuiva-aine ja liuotin, liuosta varten
Yksi injektiopullo sisältää nimellisesti 250 IU ihmisen veren hyytymistekijä VIII:aa (rDNA), simoktokogi alfaa.
Käyttökuntoon saatettuna Nuwiq 250 IU sisältää noin 100 IU/ml ihmisen veren hyytymistekijä VIII:aa (rDNA), simoktokogi alfaa.
Nuwiq 500 IU injektiokuiva-aine ja liuotin, liuosta varten
Yksi injektiopullo sisältää nimellisesti 500 IU ihmisen veren hyytymistekijä VIII:aa (rDNA), simoktokogi alfaa.
Käyttökuntoon saatettuna Nuwiq 500 IU sisältää noin 200 IU/ml ihmisen veren hyytymistekijä VIII:aa (rDNA), simoktokogi alfaa.
Nuwiq 1000 IU injektiokuiva-aine ja liuotin, liuosta varten
Yksi injektiopullo sisältää nimellisesti 1000 IU ihmisen veren hyytymistekijä VIII:aa (rDNA), simoktokogi alfaa.
Käyttökuntoon saatettuna Nuwiq 1000 IU sisältää noin 400 IU/ml ihmisen veren hyytymistekijä VIII:aa (rDNA), simoktokogi alfaa.
Nuwiq 1500 IU injektiokuiva-aine ja liuotin, liuosta varten
Yksi injektiopullo sisältää nimellisesti 1500 IU ihmisen veren hyytymistekijä VIII:aa (rDNA), simoktokogi alfaa. Käyttökuntoon saatettuna Nuwiq 1500 IU sisältää noin 600 IU/ml ihmisen veren hyytymistekijä VIII:aa (rDNA), simoktokogi alfaa.
Nuwiq 2000 IU injektiokuiva-aine ja liuotin, liuosta varten
Yksi injektiopullo sisältää nimellisesti 2000 IU ihmisen veren hyytymistekijä VIII:aa (rDNA), simoktokogi alfaa.
Käyttökuntoon saatettuna Nuwiq 2000 IU sisältää noin 800 IU/ml ihmisen veren hyytymistekijä VIII:aa (rDNA), simoktokogi alfaa.
Nuwiq 3000 IU injektiokuiva-aine ja liuotin, liuosta varten
Yksi injektiopullo sisältää nimellisesti 3000 IU ihmisen veren hyytymistekijä VIII:aa (rDNA), simoktokogi alfaa.
Käyttökuntoon saatettuna Nuwiq 3000 IU sisältää noin 1200 IU/ml ihmisen veren hyytymistekijä VIII:aa (rDNA), simoktokogi alfaa.
Potenssi (IU) määritetään Euroopan farmakopean mukaisella kromogeenisella menetelmällä. Nuwiq-valmisteen spesifinen aktiivisuus on noin 9500 IU/mg proteiinia.
Simoktokogi alfa (ihmisen veren hyytymistekijä VIII [rDNA]) on puhdistettu proteiini, jossa on 1440 aminohappoa. Aminohapposekvenssi vastaa ihmisen plasman tekijä VIII:n 90 + 80 kDA -muotoa (eli B-domeeni poistettu). Nuwiq valmistetaan yhdistelmä-DNA-tekniikalla geneettisesti muokatuissa ihmisalkion munuaisten (HEK) 293F-soluissa. Mitään eläin- tai ihmisperäistä ainetta ei lisätä valmistuksen aikana eikä valmiiseen lääkevalmisteeseen.
Apuaine, jonka vaikutus tunnetaan
Yksi ml käyttökuntoon saatettua liuosta sisältää 7,35 mg natriumia (18,4 mg natriumia injektiopulloa kohti).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektiokuiva-aine ja liuotin, liuosta varten.
Kliiniset tiedot
Käyttöaiheet
A-hemofiliaa (synnynnäinen hyytymistekijä VIII:n puutos) sairastavien potilaiden verenvuotojen hoito ja ennaltaehkäisy. Nuwiq-valmistetta voidaan käyttää kaikille ikäryhmille.
Ehto
Hoito tulee aloittaa hemofilian hoitoon perehtyneen lääkärin valvonnassa.
Annostus ja antotapa
Hoito tulee aloittaa ja toteuttaa hemofilian hoitoon perehtyneen lääkärin valvonnassa.
Hoidon seuranta
Hoidon aikana on hyytymistekijä VIII:n määrää seurattava asianmukaisesti oikean annoksen ja antovälin varmistamiseksi. Yksittäisten potilaiden vaste hyytymistekijä VIII:lle voi vaihdella, jolloin myös puoliintumisajat ja saanto vaihtelevat. Kehon painoon perustuvaa annosta voi ali- tai ylipainoisilla potilailla olla tarpeen muuttaa. Etenkin suurissa leikkauksissa korvaushoidon seuranta hyytymisanalyysin (plasman hyytymistekijä VIII -aktiivisuus) avulla on välttämätöntä.
Käytettäessä tromboplastiiniaikaan in vitro (aPTT) perustuvaa yksivaiheista hyytymistestiä hyytymistekijä VIII:n aktiivisuuden määrittämiseen potilaiden verinäytteistä, voi plasman hyytymistekijä VIII:n aktiivisuustuloksiin vaikuttaa merkittävästi sekä testissä käytetyn aPTT-reagenssin tyyppi että testissä käytetty referenssistandardi. Yksivaiheisella aPTT-pohjaisella hyytymistestillä ja Euroopan farmakopean mukaisella kromogeenisellä testillä saatujen tulosten välillä voi myös olla merkittäviä eroja. Tällä on merkitystä erityisesti, kun vaihdetaan testaamisessa käytettyä laboratoriota ja/tai reagensseja.
Annostus
Korvaushoidon annos ja kesto riippuvat hyytymistekijä VIII:n puutoksen vaikeusasteesta, vuotokohdasta ja vuodon laajuudesta sekä potilaan kliinisestä tilasta.
Annettavien tekijä VIII -yksikköjen määrä ilmoitetaan kansainvälisinä yksikköinä (IU), mikä on WHO:n tekijä VIII -valmisteiden tiivistestandardin mukainen ilmoitustapa. Hyytymistekijä VIII:n aktiivisuus plasmassa ilmaistaan joko prosentteina (suhteessa ihmisen normaaliin plasmaan) tai mieluummin kansainvälisinä yksikköinä (suhteessa plasman hyytymistekijä VIII:n kansainväliseen standardiin).
Yksi kansainvälinen yksikkö (IU) hyytymistekijä VIII -aktiivisuutta vastaa hyytymistekijä VIII:n määrää yhdessä millilitrassa ihmisen normaalia plasmaa.
Hoito tarvittaessa
Hyytymistekijä VIII:n tarvittavan annoksen laskeminen perustuu siihen empiiriseen havaintoon, että yksi kansainvälinen yksikkö (IU) tekijä VIII:aa painokiloa kohden nostaa plasman hyytymistekijä VIII -aktiivisuutta noin 2 prosenttia normaalista tasosta eli 2 IU/dl. Tarvittava annos lasketaan seuraavan kaavan avulla:
Tarvittava yksiköiden (IU) määrä = potilaan paino (kg) x haluttu hyytymistekijä VIII:n lisäys (%) (IU/dl) x 0,5 (IU/kg per IU/dl)
Odotettu hyytymistekijä VIII:n lisäys (prosenttia normaalitasosta) = 2 x annettu määrä IU / potilaan paino (kg)
Annettavalla määrällä ja antotiheydellä pyritään aina jokaisessa tapauksessa kliinisen tehon varmistamiseen.
Seuraavissa verenvuototapahtumissa hyytymistekijä VIII -aktiivisuus ei saa laskea alle plasman annetun aktiivisuustason (prosenttia normaalitasosta tai IU/dl) vastaavana ajanjaksona. Seuraavaa taulukkoa voidaan käyttää annostelun ohjeena verenvuodoissa ja leikkauksissa.
| Verenvuodon aste / kirurgisen toimenpiteen laatu | Tarvittava hyytymistekijä VIII -taso (%) (IU/dl) | Annosväli (tuntia) / hoidon kesto (vuorokautta) |
| Verenvuoto | ||
| Varhaisvaiheen nivelensisäinen, lihaksen tai suun verenvuoto | 20–40 | Toistetaan 12–24 tunnin välein. Vähintään vuorokauden ajan, kunnes tilanne on ohi (kipu hävinnyt, vuoto loppunut). |
| Suurehko nivelensisäinen vuoto, lihasverenvuoto tai verenpurkauma | 30–60 | Infuusio toistetaan 12–24 tunnin välein 3–4 vuorokauden ajan tai kauemmin, kunnes kipu ja akuutti haitta ovat helpottaneet. |
| Hengenvaaralliset verenvuodot | 60–100 | Infuusio toistetaan 8–24 tunnin välein, kunnes vaara on ohi. |
| Leikkaus | ||
| Pieni leikkaus, mukaan lukien hampaanpoisto | 30–60 | 24 tunnin välein vähintään vuorokauden ajan, kunnes potilas on toipunut. |
| Suuri leikkaus | 80–100 | Infuusio toistetaan 8–24 tunnin välein, kunnes haava on riittävästi parantunut. Tämän jälkeen hoitoa jatketaan vielä vähintään 7 vuorokautta, jotta tekijä VIII -aktiivisuus pysyy tasolla 30–60 % (IU/dl). |
Estohoito
Vaikeaa A-hemofiliaa sairastavien potilaiden pitkäaikaisessa verenvuodon ennaltaehkäisyssä tavalliset hyytymistekijä VIII -annokset ovat 20–40 IU hyytymistekijä VIII:aa painokiloa kohden 2–3 vuorokauden välein.
Joissakin tapauksissa, erityisesti nuorille potilaille, voivat lyhyemmät annosvälit tai suuremmat annokset olla tarpeen. Hoito-ohjelmaan voidaan tehdä muutoksia potilaan vasteen perusteella.
Pediatriset potilaat
Annostus on aikuisille ja lapsille ja nuorille sama. Lyhyemmät annosteluvälit tai suuremmat annokset voivat kuitenkin olla tarpeen lapsia ja nuoria hoidettaessa. Saatavissa olevat tiedot on kuvattu kohdissa Haittavaikutukset, Farmakodynamiikka ja Farmakokinetiikka.
Antotapa
Nuwiq annetaan laskimoon.
Suositeltavaa on, että infuusionopeus ei ylitä 4 ml/minuutti.
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen saattamisesta käyttökuntoon ennen lääkkeen antoa.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Yliherkkyys
Kuten kaikkien laskimoon annettavien proteiinivalmisteiden yhteydessä, allergiatyyppiset yliherkkyysreaktiot ovat mahdollisia. Nuwiq sisältää hyytymistekijä VIII:n lisäksi jäämiä muista ihmisen proteiineista. Potilaita on neuvottava lopettamaan valmisteen käyttö heti ja ottamaan yhteyttä lääkäriin, jos yliherkkyysoireita ilmenee. Potilaille on kerrottava yliherkkyysreaktioiden ensioireista, joita ovat nokkosihottuma, yleistynyt nokkosihottuma, puristava tunne rinnassa, vinkuva hengitys, matala verenpaine ja anafylaksia.
Sokkitapauksissa noudatetaan tavanomaista sokin hoitokäytäntöä.
Inhibiittorit
Tekijä VIII:aa neutraloivien vasta aineiden (inhibiittoreiden) muodostuminen on tunnettu komplikaatio hemofilia A -potilaiden hoidossa. Inhibiittorit ovat yleensä IgG-immunoglobuliineja, jotka estävät tekijä VIII -hyytymistoiminnan aktivoitumisen ja joiden määrä ilmaistaan Bethesda -yksikköinä (Bethesda Units, BU) millilitrassa plasmaa käyttämällä muunneltua määritystä. Inhibiittoreiden muodostumisen riski riippuu taudin vaikeusasteesta ja altistumisesta tekijä VIII:lle. Riski on suurin 50 ensimmäisen altistuspäivän aikana, mutta jatkuu läpi elämän, vaikkakin harvinaisena.
Inhibiittorien uudelleen muodostumista (alhainen titteri) on havaittu vaihdettaessa yhdestä tekijä VIII -valmisteesta toiseen. Tätä on havaittu aiemmin hoidetuilla potilailla, joilla on ollut yli 100 altistuspäivää ja joille on aiemmin muodostunut inhibiittoreita. Siksi on suositeltavaa seurata kaikkia potilaita huolellisesti inhibiittorien esiintymisen varalta valmisteen vaihdon jälkeen.
Inhibiittorien muodostumisen kliininen merkitys riippuu inhibiittorititteristä. Riittämättömän kliinisen vasteen riski on pienempi, jos potilaalle muodostuu ohimenevästi alhaisen titterin inhibiittoreita tai jos inhibiittorien titteri pysyy johdonmukaisesti alhaisena verrattuna tilanteeseen, jossa potilaalla on korkean titterin inhibiittoreita.
Hyytymistekijä VIII -valmisteilla hoidettavien potilaiden inhibiittoreiden esiintyvyyttä on seurattava tarkkaan asianmukaisin kliinisin havainnoin ja laboratoriokokein. Jos odotettuja tekijä VIII:n aktiivisuuden plasmapitoisuuksia ei saavuteta tai jos verenvuotoa ei saada hallintaan asianmukaisella annoksella, on potilaalta testattava tekijä VIII:n inhibiittorin esiintyminen. Jos potilaalla on korkea inhibiittoripitoisuus, tekijä VIII -hoito ei ehkä ole tehokasta ja on harkittava muita terapeuttisia vaihtoehtoja. Näiden potilaiden hoidon on tapahduttava sellaisten lääkäreiden valvonnassa, joilla on kokemusta hemofiliasta ja tekijä VIII:n inhibiittoreista.
Sydän- ja verisuonitapahtumat
Potilailla, joilla on ennestään kardiovaskulaarisia riskitekijöitä, korvaushoito hyytymistekijä VIII:lla voi suurentaa kardiovaskulaarista riskiä.
Katetreihin liittyvät komplikaatiot
Jos hoito edellyttää keskuslaskimokatetrin käyttöä, on otettava huomioon tähän liittyvien komplikaatioiden mahdollisuus. Niitä ovat mm. paikalliset infektiot, bakteremia ja katetrikohdan tromboosi.
Pediatriset potilaat
Luetellut varoitukset ja varotoimet koskevat sekä aikuisia, lapsia että nuoria.
Apuaineeseen liittyviä seikkoja (natriumpitoisuus)
Tämä lääkevalmiste sisältää 18,4 mg natriumia per injektiopullo, joka vastaa 0,92 % WHO:n suosittelemasta natriumin 2 g:n päivittäisestä enimmäissaannista aikuisille.
Yhteisvaikutukset
Yhteisvaikutustutkimuksia Nuwiq-valmisteella ei ole tehty.
Raskaus ja imetys
Tekijä VIII:lla ei ole tehty lisääntymistä koskevia tutkimuksia eläimillä.
Koska A-hemofilia on naisilla harvinainen, tekijä VIII:n käytöstä raskauden ja imetyksen aikana ei ole kokemusta. Siksi tekijä VIII -hoitoa pitää käyttää raskauden ja imetyksen aikana vain silloin, kun se on ehdottoman välttämätöntä. Tietoa vaikutuksesta hedelmällisyyteen ei ole.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Nuwiq-valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneiden käyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yliherkkyys- ja allergiareaktioita (esim. angioedeema, pistoskohdan polte ja kirvely, vilunväristykset, punoitus, päänsärky, nokkosihottuma, hypotensio, letargia, pahoinvointi, ihottuma, levottomuus, takykardia, puristava tunne rinnassa, kihelmöinti, nokkosihottuma, mukaan lukien yleistynyt nokkosihottuma, oksentelu, hengityksen vinkuminen) on tekijä VIII -valmisteiden käytön yhteydessä havaittu harvoin. Nämä voivat toisinaan johtaa vakavaan anafylaksiaan, myös sokkiin.
Neutraloivia vasta-aineita (inhibiittoreita) voi kehittyä hemofilia A -potilaille, jotka saavat tekijä VIII -hoitoa, kuten Nuwiq. Mikäli tällaisia inhibiittoreita ilmaantuu, se näkyy riittämättömänä kliinisenä vasteena hoidolle. Tällaisissa tapauksissa on suositeltavaa ottaa yhteyttä erikoistuneeseen hemofiliakeskukseen.
Taulukoitu haittavaikutusluettelo
Seuraava taulukko 1 on MedDRA-elinluokituksen mukainen (elinjärjestelmäluokka ja nimitys).
Yleisyydet perustuvat kliinisistä tutkimuksista saatuihin raportteihin yhteensä 355:sta vaikeaa A-hemofiliaa sairastavasta yksittäisestä tutkittavasta, joista 247 oli aiemmin hoitoa saaneita potilaita (PTP) ja 108 potilaita, jotka eivät aiemmin olleet saaneet hoitoa (PUP).
Haittavaikutusten yleisyys esitetään seuraavasti: hyvin yleinen (≥1/10), yleinen (≥1/100, <1/10), melko harvinainen (≥1/1 000, <1/100), harvinainen (≥1/10 000, <1/1 000), hyvin harvinainen (<1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 1. Haittavaikutusten esiintymistiheys kliinisissä tutkimuksissa
| Elinjärjestelmäluokka (MedDRA) | Haittavaikutus | Esiintymistiheys |
| Veri ja imukudos | Anemia | Melko harvinainen* Melko harvinainen (PTP)# Hyvin yleinen (PUP)# Melko harvinainen* |
| Immuunijärjestelmä | Yliherkkyys | Yleinen* |
| Hermosto | Heitehuimaus | Melko harvinainen* Melko harvinainen* Melko harvinainen* |
| Kuulo ja tasapainoelin | Huimaus | Melko harvinainen* |
| Hengityselimet, rintakehä ja välikarsina | Hengenahdistus | Melko harvinainen* |
| Ruoansulatuselimistö | Suun kuivuminen | Melko harvinainen* |
| Luusto, lihakset ja sidekudos | Selkäkipu | Melko harvinainen* |
| Yleisoireet ja antopaikassa todettavat haitat | Kuume Rintakipu Injektiokohdan tulehdus Injektiokohdan kipu Huonovointisuus | Yleinen* Melko harvinainen* Melko harvinainen* Melko harvinainen* Melko harvinainen* |
| Tutkimukset | Positiivinen ei-neutraloiva vasta-aine (PTP) | Melko harvinainen* |
| * Laskettuna haittavaikutuksen saaneina potilaina kaikkiaan 255 tutkittua potilasta kohti, joista 247 oli aiemmin hoitoa saaneita potilaita (PTP) ja 108 potilaita, jotka eivät aiemmin olleet saaneet hoitoa (PUP). # Yleisyys perustuu kaikilla hyytymistekijä VIII -valmisteilla tehtyihin tutkimuksiin, joihin osallistui vaikeaa hemofilia A:ta sairastavia potilaita. PTP = previously-treated patients, aiemmin hoidetut potilaat PUP = previously-untreated patients, aiemmin hoitamattomat potilaat | ||
Eräiden haittavaikutusten kuvaus
Yhdellä aikuispotilaalla todettiin ei-neutraloiva anti-tekijä-VIII-vasta-aine (katso taulukko 1). Näyte testattiin keskuslaboratoriossa kahdeksalla laimennuksella. Tulos oli positiivinen vain laimennuskertoimella 1 ja vasta-ainetitteri oli hyvin matala. Mukaillulla Bethesda-määrityksellä mitattuna potilaassa ei todettu inhibiittorivaikutusta. Nuwiq-valmisteen kliininen teho ja in vivo -saanto eivät heikentyneet tällä potilaalla.
Pediatriset potilaat
Haittavaikutusten esiintymistiheyden, laadun ja vakavuuden otaksutaan olevan lapsilla ja nuorilla sama kuin aikuisilla.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista kansallisen ilmoitusjärjestelmän kautta:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 Fimea
Yliannostus
Yliannostustapauksia ei ole raportoitu.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: veren hyytymistekijät, hyytymistekijä VIII, ATC-koodi: B02BD02.
Hyytymistekijä VIII / von Willebrandin tekijä -kompleksi koostuu kahdesta molekyylistä (hyytymistekijä VIII ja von Willebrandin tekijä), joilla on erilaiset fysiologiset toiminnot. Kun hyytymistekijä VIII:aa annetaan infuusiona hemofiliapotilaalle, se sitoutuu potilaan verenkierrossa olevaan von Willebrandin tekijään. Aktivoitunut hyytymistekijä VIII toimii aktivoituneen tekijä IX:n kofaktorina ja nopeuttaa tekijä X:n muuttumista aktivoituneeksi tekijä X:ksi. Aktivoitunut tekijä X muuttaa protrombiinin trombiiniksi. Sen jälkeen trombiini muuttaa fibrinogeenin fibriiniksi, jolloin hyytymä pääsee muodostumaan. A-hemofilia on sukupuoleen liittyvä perinnöllinen veren hyytymishäiriö, joka johtuu normaalia pienemmästä hyytymistekijä VIII:C -pitoisuudesta. Se aiheuttaa voimakkaita verenvuotoja niveliin, lihaksiin ja sisäelimiin joko itsestään tai vamman tai kirurgisen toimenpiteen seurauksena. Korvaushoidolla lisätään hyytymistekijä VIII:n pitoisuutta plasmassa, jolloin hyytymistekijä VIII:n puutos ja verenvuotoalttius pystytään väliaikaisesti korjaamaan.
12-65-vuotiaat aikuiset ja nuoret
Ennaltaehkäisevä hoito
Kliinisessä tutkimuksessa, johon osallistui 32 vaikeaa A-hemofiliaa sairastavaa aikuispotilasta, ennaltaehkäisyyn käytetyn Nuwiq-valmisteen keskikulutus oli 468,7 IU/kg/kk.
Verenvuodon hoitaminen
Läpäisyverenvuotokohtausten hoidossa keskiannos oli 33,0 IU/kg näille potilaille, jotka saivat ennaltaehkäisevää hoitoa. Toisessa kliinisessä tutkimuksessa 22:ta aikuispotilasta hoidettiin tarvittaessa. Yhteensä hoidettiin 986 verenvuotokohtausta keskiannoksen ollessa 30,9 IU/kg. Yleensä pieniin verenvuotoihin tarvittiin hieman pienempi annos ja vakavampiin vuotoihin keskiannokseen verrattuna jopa kolminkertainen annos.
Yksilöllinen ennaltaehkäisevä hoito
Yksilöllistä PK-perusteista ennaltaehkäisevää hoitoa arvioitiin 66 aiemmin hoitoa saaneella aikuisella potilaalla, jotka sairastivat vaikeaa A-hemofiliaa. Vakiomuotoisen 1–3 kuukauden mittaisen ennaltaehkäisevän hoitovaiheen jälkeen (annostus joka toinen päivä tai kolme kertaa viikossa) 44 (67 %) potilaista siirrettiin heidän PK-arvionsa perusteella hoito-ohjelmaan ja 40 sai 6 kuukautta ennaltaehkäisevää hoitoa heille määrättyä annosta ja annosteluaikataulua noudattaen. Näistä potilaista 34 (85 %) hoidettiin kahdesti viikossa tai harvemmin. 33 (82,5 %) potilasta ei saanut lainkaan verenvuotoja ja 36 (90,0 %) potilasta ei saanut spontaaneja verenvuotoja. Vuotuinen verenvuototapahtumien määrä ± keskihajonta oli 1,2 ± 3,9 ja keskimääräinen annos ± keskihajonta 52,2 ± 12,2 IU/kg injektiota kohti ja 99,7 ± 25,6 IU/kg viikkoa kohti.
On huomattava, että vuotuinen verenvuototapahtumien määrä (ABR) ei ole verrannollinen eri hyytymistekijätiivisteiden ja eri kliinisten tutkimusten välillä.
Pediatriset potilaat
Tietoja saatiin 29:stä aikaisemmin hoitoa saaneesta 2–5-vuotiaasta lapsesta, 31:stä 6–12-vuotiaasta lapsesta ja yhdestä 14-vuotiaasta nuoresta. Ennaltaehkäisevässä hoidossa keskiannos infuusiota kohti oli 37,8 IU/kg. Kahdenkymmenen potilaan keskiannos oli yli 45 IU/kg. Nuwiq-valmisteen keskikulutus kuukaudessa oli 521,9 IU/kg. Lasten verenvuotojen hoitoon tarvittiin suurempi Nuwiq-valmisteen keskiannos (43,9 IU/kg) kuin aikuisten (33,0 IU/kg), ja kohtalaisten ja voimakkaiden vuotojen hoitoon tarvittiin suurempi keskiannos (78,2 IU/kg) kuin lievien vuotojen hoitoon (41,7 IU/kg). Nuorempien lasten hoidossa tarvittiin yleensä suurempia keskiannoksia (6–12-vuotiaat: 43,9 IU/kg; 2–5-vuotiaat: 52,6 IU/kg). Näitä tietoja tukee pitkän aikavälin seuranta, jossa oli mukana 49 näistä lapsista. He saivat lisää hoitoa siten, että lisähoitojakson mediaanipituus oli noin 30 kuukautta (alue 9,5–52 kuukautta); tämän jakson aikana 45 % lapsista ei saanut spontaaneja verenvuotoja.
Tietoja 108:sta vaikeaa A-hemofiliaa (< 1 % FVIII:C) sairastavasta potilaasta, jotka eivät aiemmin ole saaneet hoitoa saatiin avoimesta prospektiivisesta kliinisestä tutkimuksesta. Suurimmalla osalla potilaista ennaltaehkäisevä hoito aloitettiin ensimmäisen hoitoa vaatineen verenvuotokohtauksen jälkeen.
Farmakokinetiikka
Aikuiset
Taulukko 2. Nuwiq-valmisteen farmakokineettiset parametrit (annos: 50 IU/kg) aikaisemmin hoidetuille aikuisille (18–65-vuotiaat) vaikeaa A-hemofiliaa sairastaville potilaille (n = 20)
| Farmakokineettinen parametri | Kromogeeninen määritys | |
| Keskiarvo ± Keskihajonta | Mediaani (vaihteluväli) | |
| AUC (h*IU/ml) | 22,6 ± 8,0 | 22,3 (8,4–38,1) |
| T1/2 (h) | 14,7 ± 10,4 | 12,5 (5,4–55,6) |
| IVR (%/IU/kg) | 2,5 ± 0,4 | 2,5 (1,7–3,2) |
| Cl (ml/h/kg) | 3,0 ± 1,2 | 2,7 (1,5–6,4) |
| AUC = käyrän alle jäävä alue (Area under the curve) (FVIII:C), T1/2 = terminaalinen puoliintumisaika, IVR = inkrementaalinen saanto (Incremental in vivo recovery), Cl = puhdistuma | ||
Taulukko 3. Nuwiq-valmisteen farmakokineettiset parametrit (annos: 50 IU/kg) aikaisemmin hoidetuille vaikeaa A-hemofiliaa sairastaville lapsille (6–12-vuotiaat) (n = 12)
| Farmakokineettinen parametri | Kromogeeninen määritys | |
| Keskiarvo ± Keskihajonta | Mediaani (vaihteluväli) | |
| AUC (h*IU/ml) | 13,2 ± 3,4 | 12,8 (7,8–19,1) |
| T1/2 (h) | 10,0 ± 1,9 | 9,9 (7,6–14,1) |
| IVR (%/IU/kg) | 1,9 ± 0,4 | 1,9 (1,2–2,6) |
| Cl (ml/h/kg) | 4,3 ± 1,2 | 4,2 (2,8–6,9) |
| AUC = käyrän alle jäävä alue (Area under the curve) (FVIII:C), T1/2 = terminaalinen puoliintumisaika, IVR = inkrementaalinen saanto (Incremental in vivo recovery), Cl = puhdistuma | ||
Taulukko 4. Nuwiq-valmisteen farmakokineettiset parametrit (annos: 50 IU/kg) aikaisemmin hoidetuille vaikeaa A-hemofiliaa sairastaville lapsille (2–5-vuotiaat) (n = 13)
| Farmakokineettinen parametri | Kromogeeninen määritys | |
| Keskiarvo ± Keskihajonta | Mediaani (vaihteluväli) | |
| AUC (h*IU/ml) | 11,7 ± 5,3 | 10,5 (4,9–23,8) |
| T1/2 (h) | 9,5 ± 3,3 | 8,2 (4,3–17,3) |
| IVR (%/IU/kg) | 1,9 ± 0,3 | 1,8 (1,5–2,4) |
| Cl (ml/h/kg) | 5,4 ± 2,4 | 5,1 ( 2,3–10,9) |
| AUC = käyrän alle jäävä alue (Area under the curve) (FVIII:C), T1/2 = terminaalinen puoliintumisaika, IVR = inkrementaalinen saanto (Incremental in vivo recovery), Cl = puhdistuma | ||
Pediatriset potilaat
Kuten kirjallisuuden perusteella ennestään tiedetään, saanto ja puoliintumisaika olivat nuorilla lapsilla pienemmät ja puhdistuma suurempi kuin aikuisilla. Tämä saattaa osittain johtua nuorempien potilaiden tiedetystä suuremmasta plasmatilavuudesta painokiloa kohti.
Painon mukaan muodostetut ryhmät
Taulukko 5. Nuwiq-valmisteen farmakokineettiset parametrit eri painoluokissa (annos: 50 IU/kg) aikaisemmin hoidetuille aikuisille (18–65-vuotiaat) vaikeaa A-hemofiliaa sairastaville potilaille (n = 20)
| Farmakokineettinen parametri | Kaikki (n = 20) | Normaali paino (n = 14) | Lievä ylipaino (n = 4) | Huomattava ylipaino (n = 2) |
| Kromogeenisen määrityksen keskiarvo ± keskihajonta | ||||
| AUC (h*IU/ml) | 22,6 ± 8,0 | 20,4 ± 6,9 | 24,9 ± 8,9 | 33,5 ± 6,5 |
| T1/2 (h) | 14,7 ± 10,4 | 14,7 ± 12,1 | 13,4 ± 5,9 | 17,2 ± 4,8 |
| IVR (%/IU/kg) | 2,5 ± 0,4 | 2,4 ± 0,4 | 2,7 ± 0,4 | 2,8 ± 0,3 |
| Cl (ml/h/kg) | 3,0 ± 1,2 | 3,2 ± 1,3 | 2,6 ± 1,0 | 1,8 ± 0,4 |
| Kromogeenisen määrityksen mediaani (vaihteluväli) | ||||
| AUC (h*IU/ml) | 22,3 (8,4–38,1) | 21,2 (8,4–32,6) | 23,3 (17,4–35,5) | 33,5 (28,9–38,1) |
| T1/2 (h) | 12,5 (5,4–55,6) | 12,3 (5,4–55,6) | 11,2 (9,3–22,0) | 17,2 (13,8–20,6) |
| IVR (%/IU/kg) | 2,5 (1,7–3,2) | 2,4 (1,7–3,1) | 2,8 (2,3–3,2) | 2,8 (2,6–3,0) |
| Cl (ml/h/kg) | 2,7 (1,5–6,4) | 2,8 (1,7–6,4) | 2,5 (1,6–3,7) | 1,8 (1,5–2,0) |
| Normaali paino: BMI 18,5–25 kg/m2, Lievä ylipaino: BMI 25–30 kg/m2, Huomattava ylipaino: BMI > 30 kg/m2 | ||||
Prekliiniset tiedot turvallisuudesta
Prekliinisissä tutkimuksissa Nuwiq-valmisteella saatiin turvallisesti ja tehokkaasti korjatuksi hemofiliaa sairastaneiden koirien hemostaasi. Toksikologisissa tutkimuksissa laboratorioeläimillä todettiin, että paikallinen laskimonsisäinen anto ja systeeminen altistus olivat laboratorioeläimillä hyvin siedettyjä (rotat ja Macaca fascicularis -apinat).
Nuwiq-valmisteella ei ole tehty erityisiä toksisuustutkimuksia toistuvalla pitkäaikaisella annolla (esimerkiksi lisääntymistoksisuus, krooninen toksisuus ja karsinogeenisuus) kaikilla nisäkäseläinlajeilla esiintyvän heterologisia proteiineja vastaan kohdistuvan immuunivasteen vuoksi.
Nuwiq-valmisteen mutageenista potentiaalia ei ole tutkittu.
Ex vivo -arvioinneissa, jotka tehtiin kaupallisella analyysivälineistöllä proteiinilääkkeisiin kohdistuvan T-soluvasteen kvantifioimiseksi, todettiin immunogeenisuuden riski pieneksi.
Farmaseuttiset tiedot
Apuaineet
Injektiokuiva-aine
Sakkaroosi
Natriumkloridi
Kalsiumklorididihydraatti
Arginiinihydrokloridi
Natriumsitraattidihydraatti
Poloksameeri 188
Liuotin
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Ainoastaan valmisteen kanssa toimitettuja infuusiovälineitä tulee käyttää, sillä ihmisen veren hyytymistekijä VIII voi adsorboitua joidenkin injektiovälineiden sisäpinnalle ja hoito voi tämän takia epäonnistua.
Kestoaika
Avaamaton injektiopullo
2 vuotta
Kestoajan aikana valmistetta voidaan säilyttää huoneenlämmössä (enintään 25 °C) yhtäjaksoisesti enintään 1 kuukausi. Kun lääkevalmiste on otettu pois jääkaapista, sitä ei saa enää laittaa sinne takaisin. Merkitse pakkaukseen päivämäärä, jolloin valmiste on siirretty huoneenlämpöön.
Käyttövalmiiksi saattamisen jälkeen
Käyttökuntoon saatetun valmisteen kemiallisen ja fysikaalisen säilyvyyden käytön aikana on osoitettu olevan 24 tuntia huoneenlämmössä.
Mikrobiologiselta kannalta valmiste on käytettävä välittömästi käyttökuntoon saattamisen jälkeen. Jos sitä ei käytetä heti, säilytysaika ja -olosuhteet ennen käyttöä ovat käyttäjän vastuulla.
Käyttökuntoon saatettu liuos on säilytettävä huoneenlämmössä. Älä säilytä kylmässä käyttökuntoon saattamisen jälkeen.
Säilytys
Säilytä jääkaapissa (2 °C – 8 °C).
Ei saa jäätyä.
Säilytä injektiopullo alkuperäispakkauksessa. Herkkä valolle.
Huoneenlämpösäilytys ja käyttökuntoon saatetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
NUWIQ injektiokuiva-aine ja liuotin, liuosta varten
250 IU (L:ei) 1 kpl (201,96 €)
500 IU (L:ei) 1 kpl (375,16 €)
1000 IU (L:ei) 1 kpl (717,79 €)
1500 IU (L:ei) 1 kpl (1051,38 €)
2000 IU (L:ei) 1 kpl (1384,44 €)
3000 IU (L:ei) 1 kpl (2041,77 €)
PF-selosteen tieto
Nuwiq liuottimella, toimitetaan esitäytetyssä ruiskussa
Jokainen pakkaus sisältää:
- 1 injektiokuiva-ainepullo, jossa on 250, 500, 1000, 1500, 2000, 2500, 3000 tai 4000 IU simoktokogi alfaa 1-tyypin lasisessa injektiopullossa, jossa on bromobutyylitulppa ja alumiininen repäisykorkki
- Liuotin: 1 esitäytetty boorilasiruisku, joka sisältää 2,5 ml injektionesteisiin käytettävää vettä
- 1 steriili injektiopullon adapteri käyttökuntoon saattamista varten sekä 1 perhosneula ja 2 alkoholilla kostutettua pyyhettä.
Nuwiq liuottimella, toimitetaan injektiopullossa
Jokainen pakkaus sisältää:
- 1 injektiokuiva-ainepullo, jossa on 250, 500, 1000, 1500, 2000, 2500, 3000 tai 4000 IU simoktokogi alfaa 1-tyypin lasisessa injektiopullossa, jossa on bromobutyylitulppa ja alumiininen repäisykorkki
- Liuotin: yksi 1-tyypin lasinen injektiopullo, joka sisältää 2,5 ml injektionesteisiin käytettävää vettä
- 1 siirtolaite käyttökuntoon saattamista varten, 1 kertakäyttöinen ruisku ja 1 perhosneula (infuusiolaitteisto) sekä 2 alkoholilla kostutettua pyyhettä.
Valmisteen kuvaus:
Injektiokuiva-aine: valkoinen tai luonnonvalkoinen hauras jauhe.
Liuotin: kirkas, väritön neste.
Käyttö- ja käsittelyohjeet
Nuwiq liuottimella, toimitetaan esitäytetyssä ruiskussa
Injektiokuiva-aineen käyttökuntoon saattamiseen saa käyttää ainoastaan valmisteen mukana toimitettuja liuotinta (2,5 ml injektionesteisiin käytettävää vettä) ja injektiovälineitä. Injektiopulloa pyöritetään varovasti, kunnes kaikki jauhe on liuennut. Käyttökuntoon saattamisen jälkeen liuos on vedettävä takaisin ruiskuun.
Käyttökuntoon saatettu lääkevalmiste on ennen sen antamista tarkastettava silmämääräisesti ja varmistettava, ettei siinä ole näkyviä hiukkasia eikä värinmuutoksia. Käyttökuntoon saatettu lääkevalmiste on kirkas, väritön liuos, jossa ei ole ylimääräisiä hiukkasia ja jonka pH on 6,5 - 7,5. Älä käytä liuosta, joka on samea tai jossa on saostumia.
Valmistus- ja anto-ohjeet
- Anna liuotinruiskun (injektionesteisiin käytettävä vesi) ja suljetussa injektiopullossa olevan injektiokuiva-aineen lämmetä huoneenlämpöisiksi. Voit tehdä sen pitämällä niitä käsissäsi niin kauan, että ne tuntuvat yhtä lämpimiltä kuin kätesi. Älä käytä mitään muuta keinoa injektiopullon ja esitäytetyn ruiskun lämmittämiseksi. Niiden tulee pysyä huoneenlämpöisinä käyttökuntoon saattamisen aikana.
-
Poista muovinen repäisykorkki injektiokuiva-ainepullosta, niin että kumitulpan keskiosa tulee näkyviin. Älä poista harmaata tulppaa äläkä metallirengasta injektiopullon yläosan ympäriltä.

- Pyyhi injektiopullon yläosa alkoholilla kostutetulla pyyhkeellä. Anna alkoholin kuivua.
-
Vedä injektiopullon adapterin pakkauksen paperinen suojapäällinen pois. Älä ota adapteria pois pakkauksesta.

-
Pane injektiokuiva-ainepullo tasaiselle alustalle ja pidä sitä paikoillaan. Ota adapteripakkaus ja aseta injektiopullon adapteri injektiokuiva-ainepullon kumisen tulpan keskikohdan päälle. Paina adapteripakkausta lujasti alaspäin, kunnes adapterin kärki puhkaisee kumitulpan. Adapteri napsahtaa kiinni injektiopulloon.

-
Vedä esitäytetyn ruiskun pakkauksen paperinen suojapäällinen pois. Pidä kiinni ruiskun männän päästä äläkä koske männän varteen. Kiinnitä ruiskun männän kierteinen pää liuotinruiskuun. Kierrä mäntää myötäpäivään, kunnes tunnet pienen vastuksen.

-
Katkaise liuotinruiskun suojattu muovipää korkin perforoinnin kohdalta. Älä koske korkin sisäpuoleen äläkä ruiskun päähän. Jos liuosta ei käytetä heti, sulje täytetty ruisku muovisella suojakärjellä säilytystä varten.

- Poista adapterin pakkaus ja heitä se pois.
-
Kiinnitä liuotinruisku lujasti injektiopullon adapteriin kiertämällä myötäpäivään, kunnes tunnet vastuksen.

-
Ruiskuta kaikki liuotin hitaasti injektiokuiva-ainepulloon painamalla ruiskun mäntä alas.

- Älä poista ruiskua. Liikuttele tai pyörittele injektiopulloa varovasti muutaman kerran niin, että injektiokuiva-aine liukenee. Ei saa ravistaa. Odota, kunnes injektiokuiva-aine on kokonaan liuennut.
- Ennen lääkkeen antamista tarkista silmämääräisesti, ettei liuoksessa ole näkyviä hiukkasia. Liuoksen on oltava kirkas ja väritön eikä siinä saa olla näkyviä hiukkasia. Älä käytä liuosta, joka on samea tai jossa on saostumia.
-
Käännä ruiskuun kiinnitetty injektiopullo ylösalaisin ja vedä valmis liuos hitaasti ruiskuun. Varmista, että kaikki injektiopullon sisältö siirtyy ruiskuun.

- Irrota täytetty ruisku injektiopullon adapterista vastapäivään kiertämällä ja heitä tyhjä injektiopullo pois.
- Liuos on nyt valmis käytettäväksi välittömästi. Älä säilytä kylmässä.
- Puhdista valittu injektiokohta alkoholilla kostutetulla pyyhkeellä, joka on pakkauksessa.
-
Liitä infuusiolaitteisto ruiskuun.
Työnnä infuusiolaitteiston neula valittuun laskimoon. Jos olet käyttänyt kiristyssidettä suonen löytämiseksi, poista kiristysside ennen kuin alat ruiskuttaa liuosta. Ruiskuun ei saa päästä verta, sillä tällöin on vaarana fibriinihyytymien muodostuminen. - Ruiskuta liuos hitaasti laskimoon, enintään 4 ml minuutissa.
Jos käytät useamman kuin yhden injektiokuiva-ainepullollisen hoitokerran aikana, voit käyttää samaa injektioneulaa. Injektiopullon adapteri ja ruisku ovat kertakäyttöisiä.
Nuwiq liuottimella, toimitetaan injektiopullossa
Injektiokuiva-aineen käyttökuntoon saattamiseen saa käyttää ainoastaan valmisteen mukana toimitettuja liuotinta (2,5 ml injektionesteisiin käytettävää vettä) ja siirtolaitetta. Siirtolaite on kiinnitettävä ensin liuotinpulloon ja sen jälkeen injektiokuiva-ainepulloon. Muuten tyhjiö häviää eikä liuottimen siirto injektiokuiva-ainepulloon ei onnistu. Jos liuotin ei siirry kokonaan injektiokuiva-ainepulloon tämän prosessin aikana, ota yhteyttä myyntiluvan haltijaan.
Injektiopulloa pyöritetään varovasti, kunnes kaikki jauhe on liuennut. Käyttökuntoon saattamisen jälkeen liuos on vedettävä takaisin ruiskuun.
Käyttökuntoon saatettu lääkevalmiste on ennen sen antamista tarkastettava silmämääräisesti ja varmistettava, ettei siinä ole näkyviä hiukkasia eikä värinmuutoksia. Käyttökuntoon saatettu lääkevalmiste on kirkas, väritön liuos, jossa ei ole ylimääräisiä hiukkasia ja jonka pH on 6,5 - 7,5. Älä käytä liuosta, joka on samea tai jossa on saostumia.
Valmistus- ja anto-ohjeet
-
Anna suljetussa injektiopullossa olevan liuottimen (injektionesteisiin käytettävä vesi) ja suljetussa injektiopullossa olevan injektiokuiva-aineen lämmetä huoneenlämpöisiksi. Voit tehdä sen pitämällä niitä käsissäsi niin kauan, että ne tuntuvat yhtä lämpimiltä kuin kätesi. Älä käytä mitään muuta keinoa injektiopullojen lämmittämiseksi. Niiden tulee pysyä huoneenlämpöisinä käyttökuntoon saattamisen aikana.
-
Poista muovinen repäisykorkki injektiokuiva-ainepullosta ja liuotinpullosta, niin että kumitulpan keskiosa tulee näkyviin. Älä poista harmaata tulppaa äläkä metallirengasta injektiopullon yläosan ympäriltä.

-
Pyyhi molempien injektiopullojen yläosat alkoholilla kostutetulla pyyhkeellä. Anna alkoholin kuivua. Älä koske kumisulkimiin, kun olet pyyhkinyt ne alkoholilla kostutetulla pyyhkeellä.
-
Vedä siirtolaitteen pakkauksen kansi pois. Älä ota siirtolaitetta pois pakkauksesta.

5. Pane liuotinpullo tasaiselle alustalle ja pidä sitä tiukasti paikoillaan. Älä poista siirtolaitetta pakkauksestaan. Aseta siirtolaitteen sininen osa liuotinpullon yläosaan ja paina suoraan alaspäin napakasti, kunnes se napsahtaa paikoilleen. Älä väännä, kun kiinnität siirtolaitetta.
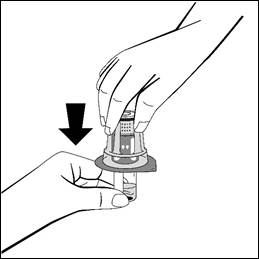
-
Pidä kiinni liuotinpullosta ja poista siirtolaitteen pakkaus niin, että siirtolaite pysyy tiukasti kiinni liuotinpullossa.

-
Aseta injektiokuiva-ainepullo tasaiselle alustalle ja pidä siitä kiinni. Käännä liuotinpullo ja siihen kiinnitetty siirtolaite nopeasti ylösalaisin. Aseta siirtolaitteen valkoinen osa injektiokuiva-ainepullon yläosaan ja paina napakasti alaspäin, kunnes se napsahtaa paikoilleen. Älä väännä, kun kiinnität siirtolaitetta. Liuotin virtaa automaattisesti injektiokuiva-ainepulloon.

-
Älä poista siirtolaitetta, johon on kiinnitetty liuotinpullo. Liikuttele tai pyörittele injektiopulloa varovasti muutaman kerran niin, että injektiokuiva-aine liukenee. Ei saa ravistaa. Odota, kunnes injektiokuiva-aine on kokonaan liuennut.
-
Irrota siirtolaitteen sininen osa ja heitä tyhjä liuotinpullo ja siirtolaitteen sininen osa pois.

-
Ennen lääkkeen antamista tarkista silmämääräisesti, ettei liuoksessa ole näkyviä hiukkasia. Liuoksen on oltava kirkas ja väritön eikä siinä saa olla näkyviä hiukkasia. Älä käytä liuosta, joka on samea tai, jossa on saostumia.
-
Kiinnitä kertakäyttöinen ruisku siirtolaitteen valkoiseen muoviosaan kääntämällä myötäpäivään.

-
Käännä ruiskuun kiinnitetty injektiopullo ylösalaisin ja vedä valmis liuos hitaasti ruiskuun. Varmista, että injektiopullon koko sisältö siirtyy ruiskuun.

-
Irrota täytetty ruisku siirtolaitteen valkoisesta osasta myötäpäivään kiertämällä ja heitä tyhjä injektiopullo sekä siirtolaitteen valkoinen osa pois.

-
Liuos on nyt valmis käytettäväksi välittömästi. Älä säilytä kylmässä.
-
Puhdista valittu injektiokohta alkoholilla kostutetulla pyyhkeellä, joka on pakkauksessa.
-
Liitä infuusiolaitteisto (perhosneula) ruiskuun.
Työnnä infuusiolaitteiston neula valittuun laskimoon. Jos olet käyttänyt kiristyssidettä suonen löytämiseksi, poista kiristysside ennen kuin alat ruiskuttaa liuosta.
Ruiskuun ei saa päästä verta, sillä tällöin on vaarana fibriinihyytymien muodostuminen.
-
Ruiskuta liuos hitaasti laskimoon, enintään 4 ml minuutissa.
Jos käytät useamman kuin yhden injektiokuiva-ainepullollisen hoitokerran aikana, voit käyttää samaa injektioneulaa. Siirtolaite ja ruisku ovat kertakäyttöisiä.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
NUWIQ injektiokuiva-aine ja liuotin, liuosta varten
250 IU 1 kpl
500 IU 1 kpl
1000 IU 1 kpl
1500 IU 1 kpl
2000 IU 1 kpl
3000 IU 1 kpl
- Ylempi erityiskorvaus (100 %). Krooniset hyytymishäiriöt (126).
- Peruskorvaus (40 %).
ATC-koodi
B02BD02
Valmisteyhteenvedon muuttamispäivämäärä
23.10.2025
Yhteystiedot
Rajatorpantie 41 C
01640 Vantaa
09 8520 2710
www.octapharma.fi
info@octapharma.fi
