HAEMATE injektio-/infuusiokuiva-aine ja liuotin, liuosta varten 250 IU FVIII/600 IU VWF, 500 IU FVIII/1200 IU VWF, 1000 IU FVIII/2400 IU VWF
Vaikuttavat aineet ja niiden määrät
Haemate 250 IU FVIII/600 IU VWF injektio-/infuusiokuiva-aine ja liuotin, liuosta varten:
Injektiopullo sisältää nimellisesti 250 IU ihmisen hyytymistekijää VIII (FVIII) ja 600 IU ihmisen von Willebrand –tekijää (vWF).
Kun valmiste on saatettu käyttökuntoon 5 ml:lla liuotinta, liuos sisältää 50 IU/ml ihmisen hyytymistekijää VIII ja 120 IU/ml ihmisen von Willebrand -tekijää.
Haemate 500 IU FVIII/1200 IU VWF injektio-/infuusiokuiva-aine ja liuotin, liuosta varten:
Injektiopullo sisältää nimellisesti 500 IU ihmisen hyytymistekijää VIII (FVIII) ja 1200 IU ihmisen von Willebrand –tekijää (vWF).
Kun valmiste on saatettu käyttökuntoon 10 ml:lla liuotinta, liuos sisältää 50 IU/ml ihmisen hyytymistekijää VIII ja 120 IU/ml ihmisen von Willebrand tekijää.
Haemate 1000 IU FVIII/ 2400 IU VWF injektio-/infuusiokuiva-aine ja liuotin, liuosta varten:
Injektiopullo sisältää nimellisesti 1000 IU ihmisen hyytymistekijää VIII (FVIII) ja 2400 IU ihmisen von Willebrand –tekijää (vWF).
Kun valmiste on saatettu käyttökuntoon 15 ml:lla liuotinta, liuos sisältää 66,6 IU/ml ihmisen hyytymistekijää VIII ja 160 IU/ml ihmisen von Willebrand -tekijää.
Hyytymistekijä VIII:n teho (IU) on määritetty Euroopan farmakopean kromogeenimäärityksellä. Haematen spesifinen FVIII -aktiivisuus on noin 2-6 IU FVIII/mg proteiinia.
Von Willebrand -tekijän teho mitataan glykoproteiini IbM:n sitoutumismäärityksellä (VWF:GPIbM) ja ilmoitetaan ristosetiinikofaktorin aktiivisuutta (VWF:RCo) kuvaavina kansainvälisinä yksikköinä (IU). Haematen spesifinen vWF-aktiivisuus on noin 5-17 IU vWF:RCo/mg proteiinia.
Haemate on valmistettu ihmisluovuttajien plasmasta.
Apuaineet, joiden vaikutus tunnetaan: Natrium
Haemate 250 IU FVIII/600 IU VWF sisältää natriumia noin 113 mmol/l (2,6 mg/ml).
Haemate 500 IU FVIII/1200 IU VWF sisältää natriumia noin 113 mmol/l (2,6 mg/ml).
Haemate 1000 IU FVIII/ 2400 IU VWF sisältää natriumia noin 150 mmol/l (3,5 mg/ml).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektio-/infuusiokuiva-aine ja liuotin, liuosta varten.
Kliiniset tiedot
Käyttöaiheet
Von Willebrandin tautia (VWD) sairastavien verenvuotojen hoito ja ehkäiseminen, kun desmopressiinihoito (DDAVP) ei ole riittävä tai se on vasta-aiheinen.
A-hemofiliaa sairastavien (perinnöllinen hyytymistekijä VIII:n puutos) verenvuotojen hoito ja ehkäiseminen.
Valmistetta voidaan käyttää hankinnaisen hyytymistekijä VIII:n puutoksen hoitoon.
Hyytymistekijä VIII -vasta-ainepotilaiden hoito.
Ehto
Von Willebrandin taudin (VWD) ja A-hemofilian hoito tulee aloittaa veren hyytymishäiriöihin perehtyneen lääkärin valvonnassa.
Annostus ja antotapa
Von Willebrandin taudin (VWD) ja A-hemofilian hoito tulee aloittaa veren hyytymishäiriöihin perehtyneen lääkärin valvonnassa.
Annostus
Von Willebrandin tauti:
Annoksen laskemisessa on tärkeää käyttää erityisesti VWF:RCo:lle määritettyä IU-määrää.
1 IU VWF:RCo:a kehon painokiloa kohden kohottaa plasman VWF:RCo:n aktiivisuutta 2 %:lla (0,02 IU/ml) normaaliin aktiivisuuteen verrattuna.
VWF:RCo:n tavoitepitoisuus on > 0,6 IU/ml (60 %) ja FVIII:C:n tavoitepitoisuus on > 0,4 IU/ml (40 %).
Hemostaasin saavuttamiseen suositellaan tavallisesti painoon suhteutettua annostusta 40–80 IU/kg von Willebrand -tekijää (VWF:RCo) ja 20–40 IU /kg hyytymistekijä VIII:aa (FVIII:C).
Von Willebrand -tekijähoitoa aloitettaessa voidaan tarvita annosta 80 IU/kg, etenkin tyypin 3 von Willebrandin tautia sairastavilla. Nämä potilaat voivat tarvita suurempia annoksia riittävän pitoisuuden ylläpitämiseksi kuin von Willebrandin taudin muita tyyppejä sairastavat.
Verenvuodon ennaltaehkäisy leikkausten ja vakavien vammojen yhteydessä:
Voimakkaan verenvuodon estämiseksi leikkausten yhteydessä tai niiden jälkeen, valmisteen anto on aloitettava 1-2 tuntia ennen kirurgista toimenpidettä.
Infuusio toistetaan riittävällä annostuksella 12-24 tunnin välein. Annos ja hoidon kesto riippuvat potilaan kliinisestä tilasta, verenvuodon tyypistä ja vaikeusasteesta sekä VWF:RCo- että FVIII:C-pitoisuuksista.
Pitkäkestoinen hoito hyytymistekijä VIII:aa sisältävällä von Willebrand -valmisteella voi johtaa FVIII:C-pitoisuuden liialliseen suurenemiseen. Kun hoito on kestänyt 24-48 tuntia, annoksen pienentämistä ja/tai antovälin pidentämistä on harkittava FVIII:C-pitoisuuden hallitsemattoman suurenemisen välttämiseksi.
Pediatriset potilaat
Lapsipotilaiden annostus määräytyy painon perusteella noudattaen yleisesti ottaen samoja perusperiaatteita kuin aikuisten annostus. Antotiheys tulee määrittää yksilöllisesti kliinisen vasteen mukaan.
A-hemofilia:
Hoidon seuranta
Hoidon aikana on aiheellista määrittää hyytymistekijä VIII:n pitoisuudet asianmukaisella tavalla ja hyödyntää tietoja annettavan annoksen ja toistettujen infuusioiden antotiheyden valinnassa. Potilaan vaste hyytymistekijä VIII ‑valmisteeseen saattaa vaihdella yksilöllisesti, joten in vivo saavutettavat saantopitoisuudet ja puoliintumisajat vaihtelevat. Painoon perustuvaa annosta on mahdollisesti muutettava ali- tai ylipainoisilla potilailla. Etenkin suurten kirurgisten toimenpiteiden yhteydessä on välttämätöntä seurata korvaushoitoa tarkoin hyytymistekijäanalyyseillä (plasman hyytymistekijä VIII ‑aktiivisuuden määrityksellä).
Potilaita on seurattava hyytymistekijä VIII:n vasta-aineiden muodostumisen varalta. Ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet.
Annostus ja korvaushoidon pituus riippuvat hyytymistekijä VIII:n puutoksen vaikeusasteesta, verenvuodon sijainnista ja voimakkuudesta sekä potilaan kliinisestä tilasta.
Annoksen laskemisessa on tärkeää käyttää erityisesti FVIII:C:lle määritettyä IU-määrää.
Annosteltavien tekijä VIII -yksiköiden määrä ilmoitetaan kansainvälisinä yksikköinä (IU), jotka ovat verrannollisia voimassa olevaan tekijä VIII -valmisteita koskevaan WHO:n konsentraattistandardiin. Tekijä VIII -aktiivisuus plasmassa ilmaistaan joko prosentteina (verrattuna normaaliin ihmisplasmaan) tai mieluiten kansainvälisinä yksikköinä (verrataan plasman tekijä VIII:n kansainväliseen standardiin).
Yksi IU hyytymistekijä VIII -aktiivisuutta vastaa hyytymistekijä VIII:n määrää 1 ml:ssa normaalia ihmisen plasmaa.
Tarvittaessa toteutettava hoito
Tarvittavan hyytymistekijä VIII -annoksen laskeminen perustuu kokemukseen, että 1 IU hyytymistekijä VIII:aa kehon painokiloa kohden lisää hyytymistekijä VIII -aktiivisuutta plasmassa noin 2 % (0,02 IU/ml) tavanomaiseen aktiivisuuteen nähden. Tarvittava annos määritellään seuraavan laskukaavan avulla:
Tarvittava yksikkömäärä = paino (kg) x hyytymistekijä VIII:n haluttu lisäys (IU/ml) x 50.
Annos ja antoväli tulee määritellä kussakin tapauksessa yksilöllisesti kliinisen vasteen perusteella.
Seuraavassa mainittujen verenvuotosairauksien yhteydessä plasman hyytymistekijä VIII -aktiivisuus ei saa pienentyä mainittua aktiivisuutta pienemmäksi (IU/ml) kyseisenä ajanjaksona. Seuraavaa taulukkoa voidaan pitää suuntaa-antavana ohjeena annostuksen määrittämisessä verenvuotojaksojen ja kirurgisten toimenpiteiden yhteydessä.
| Verenvuodon aste / kirurgisen toimenpiteen tyyppi | Tarvittava hyytymistekijä VIII -pitoisuus (IU/ml) | Antoväli (tuntia) / hoidon kesto (vrk) |
| Verenvuoto | ||
| Varhaisvaiheen hemartroosi, lihaksen tai suun verenvuoto | 0,20-0,40 | Toistetaan 12-24 tunnin välein vähintään vuorokauden ajan, kunnes verenvuoto on kivun perusteella lakannut tai vuotokohta on parantunut. |
| Vaikeampi hemartroosi, lihaksen verenvuoto tai hematooma | 0,30-0,60 | Toistetaan infuusio 12-24 tunnin välein 3-4 vuorokauden ajan tai pidempään, kunnes kipu ja äkillinen liikerajoitus ovat hävinneet. |
| Henkeä uhkaavat verenvuodot | 0,60-1,00 | Toistetaan infuusio 8-24 tunnin välein, kunnes hengenvaara on ohi. |
| Leikkaushoito | ||
| Pienemmät toimenpiteet, esim. hampaan poisto | 0,30-0,60 | Infuusio 24 tunnin välein vähintään vuorokauden ajan, kunnes haava on parantunut. |
| Suuremmat toimenpiteet | 0,80-1,00 (ennen leikkausta ja sen jälkeen) | Toistetaan infuusio 8-24 tunnin välein, kunnes haava paranee riittävästi, sen jälkeen hoitoa annetaan vielä vähintään 7 vuorokauden ajan, jotta hyytymistekijä VIII -aktiivisuus pysyy 30-60 %:ssa (0,30-0,60 IU/ml). |
Estohoito
Pitkäkestoisessa verenvuodon estohoidossa, vaikeaa A-hemofiliaa sairastaville potilaille tavanomainen annos on 20–40 IU:ä hyytymistekijä VIII:aa painokiloa kohden (IU/kg) 2-3 päivän välein. Tietyissä tapauksissa, etenkin nuorten potilaiden hoidossa, lyhyempi antoväli tai suurempi annos saattaa olla tarpeen.
Pediatriset potilaat
Haematen annostuksesta lapsille ei ole tehty kliinisiä tutkimuksia.
Antotapa
Laskimoon.
Valmista liuos, kuten kohdassa Käyttö- ja käsittelyohjeet kuvataan. Käyttövalmiiksi sekoitettu liuos lämmitetään huoneen- tai kehonlämpöiseksi ennen sen antamista. Liuos on käytettävä välittömästi ruiskuun vetämisen jälkeen. Liuos ruiskutetaan hitaasti laskimoon nopeudella, joka tuntuu potilaasta miellyttävältä.
Tarvittaessa suuria määriä valmistetta ne voidaan antaa potilaalle infuusiona. Useista injektiopulloista valmiiksi saatettu liuos siirretään tällöin sopivaan infuusiopussiin tai infuusiopumppuun.
INJEKTIO-/INFUUSIONOPEUS SAA OLLA ENINTÄÄN 4 ML MINUUTISSA. POTILAAN TILAA ON SEURATTAVA VÄLITTÖMÄSTI ILMENEVIEN REAKTIOIDEN VARALTA. JOS POTILAALLE ILMAANTUU MAHDOLLISESTI HAEMATEN ANTOON LIITTYVÄ REAKTIO, INFUUSIONOPEUTTA ON HIDASTETTAVA TAI INFUUSIO KESKEYTETTÄVÄ POTILAAN KLIINISEN TILAN MUKAAN (KS. MYÖS KOHTA Varoitukset ja käyttöön liittyvät varotoimet).
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Yliherkkyys
Allergistyyppiset yliherkkyysreaktiot ovat mahdollisia. Potilasta on neuvottava lopettamaan valmisteen käyttö heti ja ottamaan yhteyttä lääkäriin, jos tällaisia oireita ilmaantuu. Potilaalle on kerrottava yliherkkyysreaktion varhaisoireet, kuten nokkosihottuma, yleistynyt urtikaria, puristuksen tunne rinnassa, hengityksen vinkuminen, hypotensio ja anafylaksia.
Sokin kehittyessä on annettava sokin yhteydessä tavanomaisesti annettavaa perushoitoa.
Haemate 250 IU FVIII/600 IU VWF sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Haemate 500 IU FVIII/1200 IU VWF sisältää 26 mg natriumia per injektiopullo, joka vastaa 1,3 % WHO:n suosittelemasta natriumin 2 g:n päivittäisestä enimmäissaannista aikuisille.
Haemate 1000 IU FVIII/2400 IU VWF sisältää 52,5 mg natriumia per injektiopullo, joka vastaa 2,6 % WHO:n suosittelemasta natriumin 2 g:n päivittäisestä enimmäissaannista aikuisille.
Von Willebrandin tauti
Tromboembolisten tapahtumien riski, keuhkoembolia mukaan lukien, on olemassa etenkin jos potilaalla on kliinisesti tiedossa olevia tai laboratoriokokeiden tuloksissa ilmi tulleita riskitekijöitä (esim. perioperatiiviset jaksot ilman tromboosiprofylaksiaa, potilas ei nouse jalkeille pian leikkauksen jälkeen, huomattava ylipaino, yliannostus, syöpä). Riskiryhmään kuuluvien potilaiden vointia on siksi seurattava tromboosin varhaisten merkkien havaitsemiseksi. Laskimotromboembolian estohoito on aloitettava voimassaolevien hoitosuositusten mukaisesti.
VWF-valmisteilla pitkäkestoisesti annettu hoito voi aiheuttaa FVIII:C-pitoisuuden liiallista suurenemista. Jos potilas saa FVIII:a sisältäviä VWF-valmisteita, plasman FVIII:C-pitoisuutta on seurattava, jotta voidaan välttää pitkäaikaiset liian suuret pitoisuudet plasmassa, koska ne voivat suurentaa tromboosiriskiä. Tromboosia ehkäiseviä toimenpiteitä on harkittava.
Von Willebrandin tautia, etenkin tyyppi 3:a, sairastaville voi kehittyä von Willebrand -tekijää neutraloivia vasta-aineita. Jos odotettuja plasman VWF:RCo-pitoisuuksia ei saavuteta tai verenvuotoa ei saada hallintaan tavanomaisilla annoksilla, on tutkittava VWF-vasta-aineiden kehittyminen laboratoriokokein. Jos potilaalle on kehittynyt suuria määriä VWF-vasta-aineita, hoito ei ehkä tehoa ja on syytä harkita muita hoitovaihtoehtoja.
A-hemofilia
Inhibiittorit
Tekijä VIII:aa neutraloivien vasta‑aineiden (inhibiittoreiden) muodostuminen on tunnettu komplikaatio hemofilia A ‑potilaiden hoidossa. Inhibiittorit ovat yleensä IgG-immunoglobuliineja, jotka estävät tekijä VIII hyytymistoiminnan aktivoitumisen ja joiden määrä ilmaistaan Bethesda yksikköinä (Bethesda Units, BU) millilitrassa plasmaa käyttämällä muunneltua määritystä. Inhibiittoreiden muodostumisen riski riippuu taudin vaikeusasteesta ja altistumisesta tekijä VIII:lle. Riski on suurin 50 ensimmäisen altistuspäivän aikana, mutta säilyy koko elämän; riski on tosin melko harvinainen.
Inhibiittorien muodostumisen kliininen merkitys riippuu inhibiittori titteristä. Riittämättömän kliinisen vasteen riski on pienempi, jos inhibiittorien titteri on alhainen kuin jos potilaalla on korkean titterin inhibiittoreita.
Hyytymistekijä VIII ‑valmisteilla hoidettavien potilaiden inhibiittoreiden esiintyvyyttä on seurattava tarkkaan asianmukaisin kliinisin havainnoin ja laboratoriokokein. Jos odotettuja tekijä VIII:n aktiivisuuden plasmapitoisuuksia ei saavuteta tai jos verenvuotoa ei saada hallintaan asianmukaisella annoksella, on potilaalta testattava tekijä VIII:n inhibiittorin esiintyminen. Jos potilaalla on korkea inhibiittoripitoisuus, tekijä VIII -hoito ei ehkä ole tehokasta ja on harkittava muita terapeuttisia vaihtoehtoja. Näiden potilaiden hoidon on tapahduttava sellaisten lääkäreiden valvonnassa, joilla on kokemusta hemofiliasta ja tekijä VIII:n inhibiittoreista.
Kardiovaskulaaritapahtumat
Jos potilaalla on entuudestaan kardiovaskulaarisia riskitekijöitä, F VIII ‑korvaushoito saattaa suurentaa kardiovaskulaaririskiä.
Katetreihin liittyvät komplikaatiot
Jos keskuslaskimokatetri on tarpeen, on huomioitava keskuslaskimokatetriin liittyvien komplikaatioiden kuten paikallisten infektioiden, bakteremian ja katetrikohdan tromboosin riski.
Virusturvallisuus
Ihmisen verestä tai plasmasta valmistettujen lääkevalmisteiden yhteydessä noudatetaan vakioituja toimenpiteitä, kuten verenluovuttajien valinta, tiettyjen infektiomerkkiaineiden testaaminen jokaisesta luovutetusta veriyksiköstä ja plasmapoolista, tartuntojen siirtymisen estämiseksi. Valmistukseen kuuluu myös virusten inaktivointi/eliminointi osana valmistusprosessia. Tästä huolimatta tarttuvien tautien siirtymistä ei voida sulkea täysin pois, kun annetaan ihmisen verestä tai plasmasta valmistettua lääkevalmistetta. Tämä koskee myös uusia, tähän saakka tuntemattomia viruksia ja muita taudinaiheuttajia.
Käytössä olevien toimenpiteiden katsotaan tehoavan vaipallisiin viruksiin, kuten ihmisen immuunikatovirukseen (HIV), hepatiitti B -virukseen (HBV) ja hepatiitti C -virukseen (HCV) sekä vaipattomaan hepatiitti A -virukseen (HAV).
Toimenpiteet saattavat tehota vain rajoitetusti vaipattomiin viruksiin, kuten B19-parvovirukseen.
Parvovirus B19 -infektiot voivat olla vakavia raskaana oleville naisille (sikiön infektio) sekä immuunipuutosta sairastaville tai veren punasolujen liiallisen tuotannon (esim. hemolyyttisen anemian) yhteydessä.
Ihmisen plasmasta valmistettuja hyytymistekijä VIII-/vWF-valmisteita säännöllisesti/toistuvasti saavien potilaiden on harkittava asianmukaisten rokotusten (hepatiitti A:ta ja B:tä vastaan) ottamista.
Yhteisvaikutukset
VWF:n ja F-VIII:n yhteisvaikutuksia muiden lääkevalmisteiden kanssa ei ole tutkittu.
Raskaus ja imetys
Haemate-valmisteella ei ole tehty lisääntymistutkimuksia eläimillä.
Von Willebrandin tauti
Raskauden aikaisesta Von Willebrandin taudin hoidosta on kokemusta vain rajoitetusti. Kun lääkettä käytettiin hyväksyttyyn VWF-korvaushoidon indikaatioon ja hoidon seuranta oli suositusten mukaista, vahingollisia vaikutuksia raskautta tai sikiön/vastasyntyneen terveyttä kohtaan ei havaittu.
A-hemofilia
Koska A-hemofilia on harvinainen naisilla, tekijä VIII:n käytöstä raskauden ja imetyksen aikana ei ole kokemusta.
Haemate-hoitoa tulisi käyttää raskauden ja imetyksen aikana vain, jos se on ehdottoman välttämätöntä.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Haemate-valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneiden käyttökykyyn.
Haittavaikutukset
Seuraavat haittavaikutukset perustuvat myyntiluvan myöntämisen jälkeiseen käyttökokemukseen.
Turvallisuusprofiilin yhteenveto
Haemate-hoidon aikana aikuisilla ja nuorilla saattaa esiintyä seuraavia haittavaikutuksia:
yliherkkyys- tai allergiset reaktiot, tromboemboliset tapahtumat ja kuume. Potilaalle saattaa lisäksi kehittyä vasta-aineita hyytymistekijälle VIII ja von Willebrand -tekijälle.
Haittavaikutustaulukko
Seuraava taulukko on laadittu MedDRA-elinjärjestelmäluokituksen mukaisesti.
Esiintyvyydet esitetään seuraavan esitystavan mukaisesti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, <1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
| MedDRAn luokitus | Haittavaikutus | Esiintyvyysluokitus |
| Veri- ja imukudos | Hypervolemia | Tuntematon |
| Hemolyysi | Tuntematon | |
Tekijä vWF: n inhibitio | Hyvin harvinainen | |
Tekijä VIII:n inhibitio | Melko harvinainen (PTP)* Hyvin yleinen (PUP)* | |
Yleiset oireet ja antopaikassa todettavat haitat | Kuume | Harvinainen |
| Immuunijärjestelmä | Yliherkkyys (allergiset reaktiot) | Hyvin harvinainen |
| Verisuonisto | Tromboosi | Hyvin harvinainen |
Tromboemboliset tapahtumat | Hyvin harvinainen |
*Yleisyys perustuu kaikilla tekijä VIII -valmisteilla tehtyihin tutkimuksiin, joihin osallistui vaikeaa hemofilia A:ta sairastavia potilaita. PTP = aiemmin hoidetut potilaat, PUP = aiemmin hoitamattomat potilaat.
Joidenkin haittavaikutusten kuvaus
Veri ja imukudos
Tarvittaessa hyvin suuria annoksia tai tiheää antoa, jos potilaalla on vasta-aineita, tai annettaessa hoitoa ennen leikkausta tai sen jälkeen, potilaita on seurattava hypervolemian merkkien ilmaantumisen varalta. Veriryhmiin A, B ja AB kuuluvia potilaita on lisäksi seurattava intravasaalisen hemolyysin ja/tai pienenevien hematokriittiarvojen merkkien varalta.
Yleisoireet ja antopaikassa todettavat haitat
Harvinaisissa tapauksissa on havaittu kuumetta.
Immuunijärjestelmä
Yliherkkyysreaktioita tai allergisia reaktioita (joita voivat olla angioedeema, polttava tunne tai kirvely antopaikassa, vilunväreet, kasvojen tai kaulan punoitus, nokkosihottuma, yleistynyt nokkosihottuma, päänsärky, alhainen verenpaine, letargia, pahoinvointi, rauhattomuus, takykardia, painon tunne rinnassa, pistelyn tunne, oksentelu, hengityksen vinkuminen) on havaittu hyvin harvinaisina tapauksina ja tietyissä tilanteissa nämä reaktiot voivat kehittyä vakavaksi anafylaksiaksi (johon voi liittyä sokki).
Von Willebrandin tauti
Veri ja imukudos
Von Willebrandin tautia, etenkin tyyppi 3:a, sairastaville voi hyvin harvoin kehittyä von Willebrand -tekijää neutraloivia vasta-aineita. Vasta-aineiden muodostuminen voidaan havaita riittämättömästä kliinisestä vasteesta. Tällaiset vasta-aineet saostuvat ja voivat aiheuttaa samanaikaisia anafylaktisia reaktioita. Siksi potilailta, joilla ilmenee anafylaktinen reaktio, tulisi tutkia vasta-ainemuodostus.
Tällaisissa tapauksissa on otettava yhteys erikoistuneeseen hemofiliakeskukseen.
Verisuonisto
Potilaalla on hyvin harvoin tromboosien muodostumisen/tromboembolisten tapahtumien riski (keuhkoembolia mukaan lukien).
Plasman pitkäaikaiset liian suuret FVIII:C-pitoisuudet voivat aiheuttaa tromboosiriskin suurentumista VWF-valmisteita saavilla potilailla (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
A-hemofilia
Veri ja imukudos
Neutraloivia vasta-aineita (inhibiittoreita) voi kehittyä hemofilia A -potilaille, jotka saavat tekijä VIII -hoitoa, kuten Haemate. Mikäli tällaisia inhibiittoreita ilmaantuu, se saattaa näkyä riittämättömänä kliinisenä vasteena hoidolle. Tällaisissa tapauksissa on suositeltavaa ottaa yhteyttä erikoistuneeseen hemofiliakeskukseen.
Tiedot virusturvallisuudesta, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Pediatriset potilaat
Lapsilla esiintyvien haittavaikutusten esiintyvyys, luonne ja vaikeusaste ovat oletettavasti samanlaiset kuin aikuisilla.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista kansallisen
ilmoitusjärjestelmän kautta:
www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Ihmisen hyytymistekijä VIII:n tai von Willebrand -tekijän yliannostuksesta ei aiheudu tunnettuja oireita. Tromboosiriskiä ei voida kuitenkaan sulkea pois erittäin suuren annoksen yhteydessä, etenkin jos on käytetty VWF-valmistetta, jonka FVIII-pitoisuus on suuri.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Veren hyytymistekijät, von Willebrand -tekijän ja hyytymistekijä VIII:n yhdistelmävalmisteet.
ATC-koodi: B02BD06
Von Willebrand -tekijä
Haemate vaikuttaa samalla tavoin kuin luontaisesti esiintyvä von Willebrand -tekijä.
Von Willebrand -tekijä toimii paitsi hyytymistekijä VIII:n suojaproteiinina myös trombosyyttiadheesion välittäjäaineena verisuonivaurion alueella, mutta sen tärkein vaikutus kohdistuu trombosyyttiaggregaatioon.
VWF:n antaminen korjaa hemostaasin poikkeavuuksia VWF-puutosta sairastavilla potilailla kahdella tavalla:
- VWF palauttaa trombosyyttiadheesion verisuonen subendoteeliin verisuonen vaurioituneissa kohdissa (koska se sitoutuu sekä verisuonen subendoteeliin että trombosyyttikalvoon) ja saa aikaan primäärin hemostaasin, mikä voidaan havaita vuotoajan lyhenemisenä. Tämä vaikutus on välitön ja johtuu suurelta osin suurimolekyylisen VWF-multimeerin suuresta pitoisuudesta.
-
VWF saa aikaan VWF:ään liittyvän FVIII-puutoksen viivästyneen korjautumisen. Laskimoon annettu VWF sitoutuu endogeeniseen FVIII:aan (jota potilaassa tavallisesti muodostuu) ja tämän tekijän stabiloitumisen avulla vältetään sen nopea hajoaminen.
Tämän perusteella puhtaan VWF:n (VWF-valmiste, jossa pieni FVIII-pitoisuus) antaminen palauttaa FVIII:C-pitoisuuden normaaliksi toissijaisena vaikutuksena, joka ilmaantuu hieman viivästyneenä ensimmäisen infuusion jälkeen.
FVIII:C:tä sisältävän VWF-valmisteen antaminen sitä vastoin palauttaa FVIII:C-pitoisuuden normaaliksi heti ensimmäisen infuusion jälkeen.
Hyytymistekijä VIII
Haemate vaikuttaa samalla tavoin kuin luontaisesti esiintyvä FVIII.
Hyytymistekijä VIII/von Willebrand -tekijäkompleksi koostuu kahdesta molekyylistä (hyytymistekijä VIII:sta ja von Willebrand -tekijästä), joilla on erilaiset fysiologiset tehtävät.
Infuusioitaessa hemofiliapotilaalle, hyytymistekijä VIII sitoutuu potilaan verenkierrossa von Willebrand -tekijään.
Aktivoitu hyytymistekijä VIII vaikuttaa aktivoidun hyytymistekijä IX:n kofaktorina ja nopeuttaa tekijä X:n aktivoitumista. Aktivoitu tekijä X muuttaa protrombiinin trombiiniksi. Trombiini muuttaa sitten fibrinogeenin fibriiniksi, jolloin hyytymä voi muodostua.
A-hemofilia on sukupuoleen liittyvästi periytyvä hyytymisjärjestelmän sairaus, joka aiheutuu hyytymistekijä VIII:n pitoisuuden vajauksesta. Tämä johtaa voimakkaisiin verenvuotoihin nivelissä, lihaksissa tai sisäelimissä joko spontaanina verenvuotona tai vamman, kuten onnettomuuden, tai leikkauksen seurauksena. Korvaushoito suurentaa plasman hyytymistekijä VIII- pitoisuutta ja tekee hyytymistekijä VIII -puutoksen tilapäisen korjaamisen mahdolliseksi ja vähentää verenvuototaipumuksia.
On huomattava, että vuotuinen verenvuototapahtumien määrä (annualized bleeding rate, ABR) ei ole vertailukelpoinen eri faktorikonsentraattien ja eri kliinisten tutkimusten välillä.
Farmakokinetiikka
Von Willebrand -tekijä
Haematen farmakokinetiikkaa on tutkittu 28 VWD-potilaalla (tyyppi 1 n=10, tyyppi 2A n=10, tyyppi 2M n=1, tyyppi 3 n=7), kun verenvuotoja ei ilmennyt. VWF:RCo:n terminaalisen puoliintumisajan mediaani (kaksitilamalli) oli 9,9 tuntia (vaihteluväli: 2,8-51,1 tuntia). Initiaalisen puoliintumisajan mediaani oli 1,47 tuntia (vaihteluväli: 0,28-13,86 tuntia). VWF:RCo-aktiivisuuden in vivo -saannon mediaani oli 1,9 (IU/dl)/(IU/kg) [vaihteluväli: 0,6-4,5 (IU/dl)/(IU/kg)]. AUC-arvon mediaani oli 1664 IU/dl x tunti (vaihteluväli: 142-3846 IU/dl x tunti), keskiviipymän mediaani (median residence time, MRT) oli 13,7 tuntia (vaihteluväli: 3,0-44,6 tuntia) ja puhdistuman mediaani oli 4,81 ml/kg/tunti (vaihteluväli: 2,08-53,0 ml/kg/tunti).
Plasman VWF:n huippupitoisuus saavutettiin tavallisesti noin 50 minuuttia injektion jälkeen. FVIII:n huippupitoisuus saavutettiin 1-1,5 tuntia injektion jälkeen.
Hyytymistekijä VIII
Laskimoon annettuna tekijä VIII (FVIII:C) -aktiivisuus lisääntyy nopeasti. Sen jälkeen aktiivisuus vähenee ensin nopeasti ja väheneminen hidastuu myöhemmin. A-hemofiliaa sairastavilla tehdyt tutkimukset osoittivat, että puoliintumisaika on 12,6 tuntia (mediaani) ja vaihteluväli on 5,0-27,7 tuntia ja FVIII:n kokonaissaanto in vivo oli 1,73 IU/dl per IU/kg (0,5-4,13). Keskiviipymän mediaani oli 19,0 tuntia (vaihteluväli: 14,8-40,0 tuntia), AUC-arvon mediaani oli 36,1 (% x tunti)/(IU/kg) (vaihteluväli: 14,8-72,4 (% x tunti)/(IU/kg) ja puhdistuman mediaani oli 2,8 ml/kg/tunti (vaihteluväli: 1,4-6,7 ml/kg/tunti).
Pediatriset potilaat
Farmakokineettisiä tietoja ei ole saatavissa alle 12-vuotiaista potilaista.
Prekliiniset tiedot turvallisuudesta
Saatavissa olevat prekliiniset tiedot, akuutti kerta-annoksen jälkeinen toksisuus ja paikallisen siedettävyyden tutkimukset eivät viittaa erityisiin riskeihin ihmisellä niiden riskien lisäksi, jotka on jo mainittu muissa valmisteyhteenvedon osissa. Haematella ei ole tehty toistuvan annostelun toksisuutta koskevia tutkimuksia, sillä ihmisen heterologista proteiinia vastaan muodostuu vasta-aineita.
Farmaseuttiset tiedot
Apuaineet
Kuiva-aine: ihmisen albumiini, glysiini, natriumsitraatti, natriumkloridi, kloorivetyhappo tai natriumhydroksidi (pH-arvon säätöön).
Liuotin: injektionesteisiin käytettävä vesi 5 ml, 10 ml tai 15 ml.
Yhteensopimattomuudet
Lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden, laimentimien tai liuottimien kanssa, lukuun ottamatta niitä, jotka mainitaan kohdassa Apuaineet.
Kestoaika
3 vuotta.
Haematen käyttövalmiiksi sekoittamisen jälkeen kemialliseksi ja fysikaaliseksi säilyvyydeksi on osoitettu 3 tuntia enintään 25 °C:ssa.
Mikrobiologiselta kannalta ja koska valmiste ei sisällä säilytysainetta, käyttövalmiiksi sekoitettu liuos tulisi käyttää heti. Mikäli valmistetta ei käytetä välittömästi, säilytysaika ei saa ylittää 3:a tuntia 25 °C:ssa.
Liuos on käytettävä välittömästi ruiskuun vetämisen jälkeen.
Säilytys
Säilytä alle 25 °C. Ei saa jäätyä. Pidä pakkaus ulkopakkauksessa. Herkkä valolle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
HAEMATE injektio-/infuusiokuiva-aine ja liuotin, liuosta varten
250 IU FVIII/600 IU VWF (L:ei) 250/600 IU + 5 ml (50/120 IU/ml) (252,59 €)
500 IU FVIII/1200 IU VWF (L:ei) 500/1200 IU + 10 ml (50/120 IU/ml) (489,16 €)
1000 IU FVIII/2400 IU VWF (L:ei) 1000/2400 IU + 15 ml (67/160 IU/ml) (948,79 €)
PF-selosteen tieto
Kuiva-aine:
250 IU: Injektiopullo väritöntä lasia, tyyppi I, kumitulppa (lateksiton), alumiinisinetti ja muovikorkki (flip-off).
500 ja 1000 IU: Injektiopullo väritöntä lasia, tyyppi II, kumitulppa (lateksiton), alumiinisinetti ja muovikorkki (flip-off).
Liuotin:
Injektiopullo väritöntä lasia, tyyppi I, kumitulppa (lateksiton), alumiinisinetti ja muovikorkki (flip-off).
Pakkauskoko:
250 IU hyytymistekijä VIII:a / 600 IU von Willebrand -tekijää: 1 x (kuiva-aine ja 5 ml liuotinta)
500 IU hyytymistekijä VIII:a / 1200 IU von Willebrand –tekijää: 1 x (kuiva-aine ja 10 ml liuotinta)
1000 IU hyytymistekijä VIII:a / 2400 IU von Willebrand –tekijää: 1 x (kuiva-aine ja 15 ml liuotinta)
Rasian (250 IUFVIII / 600 IU VWF) sisältö:
- 1 injektiopullo, joka sisältää kuiva-ainetta
- 1 injektiopullo, joka sisältää liuotinta (5 ml)
- 1 siirtosetti, jossa suodatin 20/20
Annostelutarvikkeet (sisärasia):
- 1 kertakäyttöruisku, 5 ml
- 1 injektiosetti
- 2 alkoholipyyhettä
- 1 laastari
Rasian (500 IUFVIII / 1200 IU VWF) sisältö:
- 1 injektiopullo, joka sisältää kuiva-ainetta
- 1 injektiopullo, joka sisältää liuotinta (10 ml)
- 1 siirtosetti, jossa suodatin 20/20
Annostelutarvikkeet (sisärasia):
- 1 kertakäyttöruisku, 10 ml
- 1 injektiosetti
- 2 alkoholipyyhettä
- 1 laastari
Rasian (1000 IUFVIII / 2400 IU VWF) sisältö:
- 1 injektiopullo, joka sisältää kuiva-ainetta
- 1 injektiopullo, joka sisältää liuotinta (15 ml)
- 1 siirtosetti, jossa suodatin 20/20
Annostelutarvikkeet (sisärasia):
- 1 kertakäyttöruisku, 20 ml
- 1 injektiosetti
- 2 alkoholipyyhettä
- 1 laastari
Valmisteen kuvaus:
Kylmäkuivattu kuiva-aine on ulkonäöltään valkoista tai heikosti kellertävää jauhetta tai murenevaa kiinteää ainetta. Liuotin on väritöntä ja kirkasta.
Käyttö- ja käsittelyohjeet
Liuoksen on oltava kirkasta tai hieman opaalinhohtoista. Suodattamisen/ruiskuun vetämisen jälkeen (ks. alla), mutta ennen antoa, liuos on tarkistettava silmämääräisesti, ettei siinä ole havaittavissa hiukkasia eikä värjäytymiä. Vaikka käyttövalmiiksi sekoittamisessa seurattaisiin ohjeita tarkoin, liuokseen saattaa jäädä hiukkasia tai partikkeleita. Mix2Vial-laitteen suodatin poistaa kaikki nämä hiukkaset. Suodatus ei vaikuta annoksen laskemiseen. Älä käytä liuosta, jos se on edelleen sameaa tai siinä on hiukkasia tai partikkeleita nähtävissä vielä suodatuksen jälkeen.
Käyttövalmiiksi sekoittaminen ja ruiskuun vetäminen on tehtävä aseptisissa olosuhteissa.
Liuoksen sekoittaminen käyttövalmiiksi ja ruiskun täyttäminen
Lämmitä liuos huoneenlämpöiseksi. Poista muovikorkki sekä Haemate- että liuotinpullosta. Pyyhi kumitulppien pinnat antiseptisellä liuoksella ja anna niiden kuivua ennen Mix2Vial-pakkauksen avaamista.
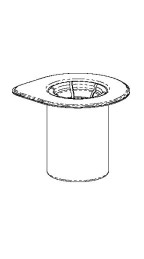
| 1. Avaa Mix2Vial-pakkaus vetämällä suljin auki. Älä poista Mix2Vial-laitetta läpipainopakkauksesta. |
| 2. Aseta liuotinpullo tasaiselle, puhtaalle alustalle ja ota pullosta tukeva ote. Ota Mix2Vial-läpipainopakkaus ja paina sinisen sovittimen kärki suoraan alas liuotinpullon korkin läpi. |
| 3. Poista varovasti Mix2Vial-laitteen läpipainopakkaus pitämällä kiinni reunasta ja vetämällä kohtisuoraan ylöspäin. Katso, että poistat vain läpipainopakkauksen etkä Mix2Vial-laitetta. |
| 4. Aseta Haemate-pullo tasaiselle ja kovalle alustalle. Käännä liuotinpullo ja siihen kiinnitetty Mix2Vial-laite ylösalaisin ja paina läpinäkyvän sovittimen kärki suoraan alas Haemate-pullon korkin läpi. Liuotin valuu automaattisesti Haemate-pulloon. |
| 5. Ota toisella kädellä ote Mix2Vial-laitteen osasta, johon Haemate-pullo on kiinnitetty, ja toisella kädellä kiinni Mix2Vial-laitteen osasta, johon liuotinpullo on kiinnitetty, ja kierrä laite varovasti irti kahteen osaan varoen vaahdon muodostumista. Hävitä liuotinpullo ja siinä kiinni oleva sininen Mix2Vial-osa. |
| 6. Pyöritä varovasti Haemate-pulloa, jossa on läpinäkyvä sovitin, kunnes kuiva-aine on liuennut täysin. Älä ravista pulloa. |
| 7. Vedä tyhjään steriiliin ruiskuun ilmaa. Ruisku kiinnitetään Mix2Vial-laitteeseen Luer Lock -liittimen avulla, kun Haemate-pullo on pystyasennossa. Ruiskuta ilma Haemate-pulloon. |
| 8. Kun ruiskun mäntä on sisään painettuna, käännä pullo (sekä laite että ruisku) ylösalaisin. Vedä liuosta ruiskuun vetämällä mäntää hitaasti ulospäin. |
| 9. Kun kaikki liuos on siirtynyt ruiskuun, ota ote ruiskusta (pidä ruiskua mäntä alaspäin) ja irrota läpinäkyvä Mix2Vial-sovitin ruiskusta. |
Anna liuos välittömästi (ks. kohta Annostus ja antotapa, Antotapa). Tarkista, ettei täyteen ruiskuun tule verta.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
HAEMATE injektio-/infuusiokuiva-aine ja liuotin, liuosta varten
250 IU FVIII/600 IU VWF 250/600 IU + 5 ml
500 IU FVIII/1200 IU VWF 500/1200 IU + 10 ml
1000 IU FVIII/2400 IU VWF 1000/2400 IU + 15 ml
- Ylempi erityiskorvaus (100 %). Hyytymistekijä VIII ja von Willebrand -tekijä: A-hemofiliaa sairastavien vasta-ainepositiivisten potilaiden siedätyshoito erityisin edellytyksin (172), Hyytymistekijä VIII ja von Willebrand -tekijä: von Willebrandin taudin hoito erityisin edellytyksin (194).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Hyytymistekijä VIII ja von Willebrand -tekijä: von Willebrandin taudin hoito erityisin edellytyksin (332), Hyytymistekijä VIII ja von Willebrand -tekijä: A-hemofiliaa sairastavien vasta-ainepositiivisten potilaiden siedätyshoito erityisin edellytyksin (375).
ATC-koodi
B02BD06
Valmisteyhteenvedon muuttamispäivämäärä
02.10.2023
Yhteystiedot
 CSL BEHRING AB
CSL BEHRING AB Box 712
182 17 Danderyd
Ruotsi
+46 (0) 8 544 966 70
www.cslbehring.fi
info@cslbehring.se

 1
1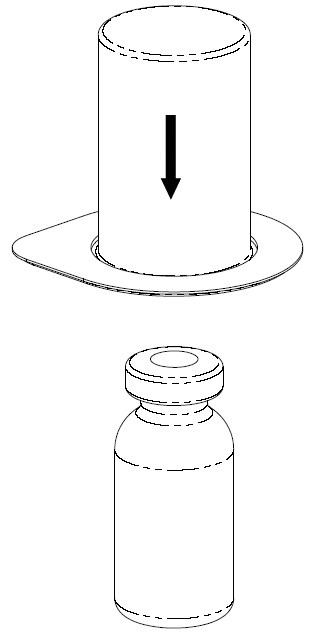 2
2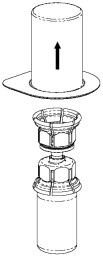 3
3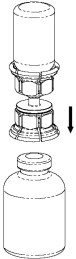 4
4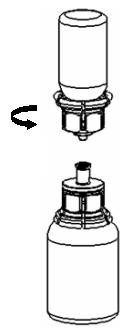 5
5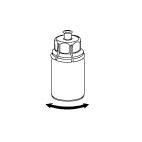 6
6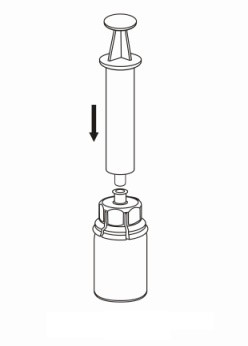 7
7