ELIGARD injektiokuiva-aine ja liuotin, liuosta varten 7,5 mg, 22,5 mg, 45 mg
Vaikuttavat aineet ja niiden määrät
7,5 mg: Esitäytetty ruisku, jossa injektiokuiva-ainetta liuosta varten, sisältää 7,5 mg leuproreliiniasetaattia vastaten 6,96 mg leuproreliinia.
22,5 mg: Esitäytetty ruisku, jossa injektiokuiva-ainetta liuosta varten, sisältää 22,5 mg leuproreliiniasetaattia vastaten 20,87 mg leuproreliinia.
45 mg: Esitäytetty ruisku, jossa injektiokuiva-ainetta liuosta varten, sisältää 45 mg leuproreliiniasetaattia vastaten 41,7 mg leuproreliinia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektiokuiva-aine ja liuotin, liuosta varten.
Kliiniset tiedot
Käyttöaiheet
Eligard on tarkoitettu hormoniriippuvaisen pitkälle edenneen eturauhassyövän hoitoon sekä suuririskisen, paikallisen ja paikallisesti levinneen hormoniriippuvaisen eturauhassyövän hoitoon yhdistettynä sädehoitoon.
Annostus ja antotapa
Annostus
Aikuiset miehet
Eligard tulee antaa terveydenhoitohenkilöstön valvonnassa, jolla on tarvittava asiantuntemus hoitovasteen seuraamiseen.
Eligard annetaan kerta-injektiona ihon alle kuukauden välein (7,5 mg), kolmen kuukauden välein (22,5 mg) tai kuuden kuukauden välein (45 mg). Injektoidusta liuoksesta muodostuu kiinteä depot-vaikutteinen lääkevalmiste, josta leuproreliiniasetaattia vapautuu kuukauden aikana (7,5 mg), kolmen kuukauden ajan (22,5 mg) tai kuuden kuukauden ajan (45 mg).
Yleensä pitkälle edenneen eturauhassyövän hoito Eligard-valmisteella merkitsee pitkää hoitoa, jota ei tule lopettaa remission eikä tilanteen korjaantumisen tapahtuessa.
Eligard-valmistetta voidaan käyttää neoadjuvantti- tai adjuvanttihoidossa yhdistettynä sädehoitoon suuririskisessä, paikallisessa ja paikallisesti levinneessä eturauhassyövässä.
Vastetta Eligard-valmisteelle tulee seurata kliinisten parametrien perusteella ja määrittämällä prostataspesifisen antigeenin (PSA) pitoisuus seerumissa. Kliinisissä lääketutkimuksissa on todettu, että testosteronipitoisuus kohoaa ensimmäisten kolmen päivän aikana suurimmalla osalla potilaista, joille ei ole tehty orkiektomiaa, ja laskee sitten alle kastraatiotason 3−4 viikon kuluessa. Kastraatiotaso säilyi niin kauan kuin lääkehoito jatkui (testosteronin kohoamista < 1 %:lla). Jos potilaan vaste näyttää suboptimaaliselta, on varmistettava, että testosteronipitoisuudessa päästään tai pysytään kastraatiotasolle. Koska virheellisestä valmistelusta, käyttövalmiiksi saattamisesta tai lääkkeen antamisesta voi aiheutua tehon puutetta, testosteronitasot on mitattava, mikäli epäillään tai todetaan käsittelyvirhe (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Metastaattista kastraatioresistenttiä eturauhassyöpää sairastavat potilaat, joita ei ole kirurgisesti kastroitu ja jotka saavat GnRH-agonistia, esim. leuproreliinia, ja joille voidaan antaa androgeenin biosynteesin estäjiä tai androgeenireseptorin estäjiä, voivat jatkaa GnRH-agonistihoitoa.
Pediatriset potilaat
Eligard-valmisteen turvallisuutta ja tehoa 0–18-vuotiaiden lasten hoidossa ei ole varmistettu (ks. myös kohta Vasta-aiheet).
Erityisryhmät
Kliinisiä lääketutkimuksia ei ole tehty potilailla, joilla on maksan tai munuaisten vajaatoiminta.
Antotapa
Ainoastaan asiaan perehtyneiden terveydenhuollon ammattilaisten tulee valmistella ja saattaa käyttövalmiiksi sekä antaa Eligard 7,5 mg, 22,5 mg ja 45 mg -valmiste. Valmisteen käyttövalmiiksi saattamista ja antoa koskevia ohjeita on noudatettava tarkasti (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Käyttö- ja käsittelyohjeet). Jos valmistetta ei ole saatettu käyttövalmiiksi asianmukaisesti, sitä ei pidä antaa potilaalle.
Kahden esitäytetyn steriilin ruiskun sisältö sekoitetaan juuri ennen kuin Eligard annetaan ihonalaisena injektiona.
Eläimistä saadun kokemuksen perusteella tahatonta antoa valtimoon tai laskimoon on ehdottomasti vältettävä.
Kuten muidenkin ihonalaisena injektiona annettavien lääkevalmisteiden kohdalla on pistoskohtaa jatkuvasti vaihdeltava.
Vasta-aiheet
Eligard on vasta-aiheinen naisilla ja lapsipotilailla.
Yliherkkyys leuproreliiniasetaatille, muille GnRH-agonisteille tai kohdassa Apuaineet mainituille apuaineille.
Potilaat, joille on aiemmin tehty orkiektomia (kuten muillakin GnRH-agonisteilla, Eligard ei alenna seerumin testosteronipitoisuutta enempää kirurgisen kastraation jälkeen).
Ainoana hoitona eturauhassyöpäpotilailla, joilla on selkäytimen pinnetila tai näyttöä selkäytimen metastaaseista (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet).
Varoitukset ja käyttöön liittyvät varotoimet
Asianmukainen valmistelu: Käsittelyvirheitä on raportoitu. Niitä voi esiintyä missä tahansa valmisteluvaiheessa, ja ne saattavat heikentää valmisteen tehoa. Valmisteen käyttövalmiiksi saattamista ja antoa koskevia ohjeita on noudatettava tarkasti (ks. kohta Käyttö- ja käsittelyohjeet). Jos käsittelyvirhe tapahtuu tai sitä epäillään, on potilasta seurattava asianmukaisesti (ks. kohta Annostus ja antotapa).
Androgeenideprivaatiohoito saattaa pidentää QT-aikaa:
Niiden potilaiden kohdalla, joilla on aiemmin todettu QT-ajan pidentymistä tai joilla on siihen liittyviä riskitekijöitä tai jotka käyttävät samanaikaisesti lääkkeitä, jotka saattavat pidentää QT-aikaa (ks. kohta Yhteisvaikutukset),lääkärin pitää arvioida riski-hyötysuhdetta sekä kääntyvien kärkien takykardian mahdollisuutta ennen Eligard 7,5 mg, 22,5 mg ja 45 mg -valmisteen käytön aloittamista.
Sydän- ja verisuonisairaudet: GnRH-agonistihoitoa saavilla miehillä on todettu suurentunut sydäninfarktin, äkillisen sydänkuoleman ja aivohalvauksen riski. Kerroinsuhteiden perusteella riski näyttää olevan vähäinen, ja sitä on arvioitava huolellisesti sydän- ja verisuonitautien riskitekijöiden ohella eturauhassyöpäpotilaan hoitoa määritettäessä. GnRH-agonisteja saavia potilaita on tarkkailtava sydän- ja verisuonisairauksiin viittaavien oireiden ja merkkien varalta ja hoidettava kliinisen hoitokäytännön mukaisesti.
Ohimenevä testosteronin kohoaminen: Muiden GnRH-agonistien tapaan leuproreliiniasetaatti aiheuttaa seerumin testosteronin, dihydrotestosteronin ja hapanfosfataasin pitoisuuksien ohimenevää kohoamista ensimmäisen hoitoviikon aikana. Potilailla voi esiintyä oireiden pahenemista tai ilmaantua uusia oireita kuten luukipua, neuropatiaa, hematuriaa tai virtsanjohtimen tai virtsarakon suun ahtautta (ks. kohta Haittavaikutukset). Nämä oireet häviävät yleensä hoidon jatkuessa.
Sopivan antiandrogeenin antamista lisäksi tulee harkita, aloittaen 3 päivää ennen leuproreliinihoidon aloittamista ja jatkaen hoidon ensimmäisten 2–3 viikon aikana. Tämän on todettu estävän alussa tapahtuvan testosteronin nousun jälkivaikutuksia.
Kirurgisen kastraation jälkeen Eligard 7,5 mg, 22,5 mg ja 45 mg ei alenna seerumin testosteronipitoisuutta enempää miespuolisilla potilailla.
Luun tiheys: Luun tiheyden alenemista on ilmoitettu lääketieteellisessä kirjallisuudessa miehillä, joille on tehty orkiektomia tai jotka ovat saaneet GnRH-agonistihoitoa (ks. kohta Haittavaikutukset).
Antiandrogeenihoito lisää merkitsevästi osteoporoosiin liittyvien luunmurtumien riskiä. Tästä on vain rajallisesti tietoa. Osteoporoosista johtuvia murtumia tavattiin 5 %:lla potilaista 22 kuukauden farmakologisen androgeenideprivaatiohoidon jälkeen ja 4 %:lla potilaista, joita oli hoidettu 5–10 vuotta. Osteoporoosista johtuvien luunmurtumien riski on yleensä suurempi kuin patologisten murtumien riski.
Pitkäaikaisen testosteronivajauksen lisäksi ikääntyminen, tupakointi ja alkoholi, lihavuus ja riittämätön liikunta voivat vaikuttaa osteoporoosin kehittymiseen.
Pituitaarinen apopleksia: Valmisteen markkinoille tulon jälkeen on harvinaisissa tapauksissa GnRH-agonistien annon jälkeen todettu pituitaarista apopleksiaa (aivolisäkkeen infarktiin liittyvä kliininen oire). Suurin osa näistä tapauksista on todettu 2 viikon aikana ensimmäisestä annoksesta ja jotkut ensimmäisen tunnin aikana. Pituitaarinen apopleksia ilmeni äkillisenä päänsärkynä, oksenteluna, näköhäiriöinä, oftalmoplegiana, mielentilan muutoksina ja joskus kardiovaskulaarisena kollapsina. Välitön lääkärinhoito on välttämätöntä.
Aineenvaihdunnan muutokset: GnRH-agonistihoitoa saavilla miehillä on todettu hyperglykemiaa ja suurentunut diabeteksen kehittymisen riski. Hyperglykemia saattaa ilmetä diabetes mellituksen kehittymisenä tai diabetespotilaiden huonontuneena glukoosikontrollina. GnRH-agonistihoitoa saavien potilaiden verensokeria ja/tai glykohemoglobiinia (HbA1C) tulee seurata määräajoin ja hoitaa hyperglykemiaa tai diabetesta koskevien hoitokäytäntöjen mukaisesti. GnRH-agonistiin liittyviin aineenvaihdunnan muutoksiin voi kuulua myös rasvamaksasairaus.
Kouristukset: Valmisteen markkinoille tulon jälkeen on todettu kouristuksia leuproreliiniasetaattia käyttävillä potilailla, joilla on tai ei ole ollut altistavia tekijöitä. Kouristuksia hoidetaan kliinisen hoitokäytännön mukaisesti.
Idiopaattinen kallonsisäisen paineen kohoaminen: Leuproreliinia saavilla potilailla on ilmoitettu idiopaattista kallonsisäisen paineen kohoamista (pseudotumor cerebri). Potilaita on varoitettava idiopaattisen kallonsisäisen paineen kohoamisen oireista ja löydöksistä, mukaan lukien vaikea tai toistuva päänsärky, näköhäiriöt ja tinnitus. Jos potilaalla ilmenee idiopaattista kallonsisäisen paineen kohoamista, leuproreliinihoidon lopettamista on harkittava.
Vaikeat ihoon kohdistuvat haittavaikutukset: Leuproreliinihoidon yhteydessä on raportoitu vaikeita ihoon kohdistuvia haittavaikutuksia (SCAR), mukaan lukien Stevens-Johnsonin oireyhtymä (SJS) ja toksinen epidermaalinen nekrolyysi (TEN), jotka voivat olla hengenvaarallisia tai johtaa kuolemaan. Lääkkeen määräämisen yhteydessä potilaille on kerrottava näiden oireista, ja heitä on seurattava tarkasti vaikeiden ihoreaktioiden varalta. Jos tällaisiin reaktioihin viittaavia oireita ilmenee, leuproreliini on lopetettava välittömästi ja on harkittava muuta hoitovaihtoehtoa (tarpeen mukaan).
Muita tapahtumia: Virtsanjohtimen ahtautta ja selkäytimen pinnettä, joka voi aiheuttaa paralyysin ja mahdollisesti hengenvaarallisia komplikaatioita, on ilmoitettu GnRH-agonistien käytön yhteydessä. Jos selkäytimen pinnetila tai munuaisten vajaatoiminta kehittyy, nämä komplikaatiot on hoidettava tavanomaiseen tapaan.
Potilaita, joilla on nikama- ja/tai aivometastaaseja, ja potilaita, joilla on virtsatieahtauma, tulee seurata tarkasti ensimmäisten hoitoviikkojen aikana.
Yhteisvaikutukset
Eligard-valmisteella ei ole tehty farmakokineettisiä lääkeinteraktiotutkimuksia. Leuproreliiniasetaatin yhteisvaikutuksista muiden lääkevalmisteiden kanssa ei ole ilmoituksia.
Koska androgeenideprivaatiohoito saattaa pidentää QT-aikaa, Eligard-valmisteen samanaikaista käyttöä sellaisten lääkkeiden kanssa, jotka saattavat pidentää QT-aikaa tai jotka voivat aikaansaada kääntyvien kärkien takykardiaa - esim. ryhmän IA (esim. kinidiini, disopyramidi) tai ryhmän III (esim. amiodaroni, sotaloli, dofetilidi, ibutilidi) rytmihäiriölääkkeet, metadoni, moksifloksasiini, psykoosilääkkeet yms. - on arvioitava huolellisesti (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Raskaus ja imetys
Ei oleellinen, sillä Eligard on vasta-aiheinen naisilla.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Tutkimuksia Eligard-valmisteen vaikutuksesta ajokykyyn ja koneiden käyttökykyyn ei ole tehty.
Hoidon aikana voi haittavaikutuksena tai perussairaudesta johtuen ilmetä väsymystä, heitehuimausta ja näköhäiriöitä, jotka saattavat heikentää ajokykyä tai kykyä käyttää koneita.
Haittavaikutukset
Eligard-hoidon yhteydessä tavattavat haittavaikutukset johtuvat lähinnä leuproreliiniasetaatin spesifisestä farmakologisesta vaikutuksesta eli tiettyjen hormonipitoisuuksien nousuista ja laskuista. Yleisimmin ilmoitettuja haittatapahtumia ovat kuumat aallot, pahoinvointi, huonovointisuus ja väsymys sekä ohimenevä paikallinen pistoskohdan ärsytys. Lievinä tai kohtalaisina kuumia aaltoja esiintyy n. 58 %:lla potilaista.
Haittavaikutustaulukko
Seuraavia haittatapahtumia ilmoitettiin Eligard-valmisteen kliinisissä lääketutkimuksissa potilailla, joilla oli pitkälle edennyt eturauhassyöpä. Haittavaikutusten esiintymistiheys luokitellaan seuraavasti: hyvin yleiset (≥ 1/10), yleiset (≥ 1/100, < 1/10), melko harvinaiset (≥ 1/1000, < 1/100), harvinaiset (≥ 1/10 000, < 1/1000) ja hyvin harvinaiset (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
| Taulukko 1: Eligard-valmisteella tehdyissä kliinisissä lääketutkimuksissa esiintyneet haittavaikutukset | |
| Infektiot | |
| yleinen | nasofaryngiitti |
| melko harvinainen | virtsatieinfektio, paikallinen ihotulehdus |
| Aineenvaihdunta ja ravitsemus | |
| melko harvinainen | diabeteksen paheneminen |
| Psyykkiset häiriöt | |
| melko harvinainen | unihäiriöt, depressio, libidon heikkeneminen |
| Hermosto | |
| melko harvinainen | huimaus, päänsärky, hypestesia, unettomuus, maku- ja hajuaistin häiriöt, huimaus |
| harvinainen | poikkeavat tahattomat liikkeet |
| tuntematon | idiopaattinen kallonsisäisen paineen kohoaminen (pseudotumor cerebri; ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) |
| Sydän | |
| tuntematon | QT-ajan pidentyminen (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset) |
| Verisuonisto | |
| hyvin yleinen | kuumat aallot |
| melko harvinainen | hypertensio, hypotensio |
| harvinainen | pyörtyminen |
| Hengityselimet, rintakehä ja välikarsina | |
| melko harvinainen | nenän vuotaminen, dyspnea |
| tuntematon | interstititaalinen keuhkosairaus |
| Ruoansulatuselimistö | |
| yleinen | pahoinvointi, ripuli, maha-suolitulehdus/koliitti |
| melko harvinainen | ummetus, suun kuivuus, ruoansulatushäiriö, oksentelu |
| harvinainen | ilmavaivat, röyhtäily |
| Iho ja ihonalainen kudos | |
| hyvin yleinen | ekkymoosit, ihon punoitus |
| yleinen | kutina, yöhikoilu |
| melko harvinainen | ihon nihkeys, lisääntynyt hikoilu |
| harvinainen | alopesia, äkilliset ihoreaktiot |
tuntematon | Stevens-Johnsonin oireyhtymä / toksinen epidermaalinen nekrolyysi (SJS/TEN) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), Toksinen ihottuma, Erythema multiforme |
| Luusto, lihakset ja sidekudos | |
| yleinen | artralgia, raajakipu, myalgia, jäykkyys, heikkous |
| melko harvinainen | selkäkipu, lihaskouristukset |
| Munuaiset ja virtsatiet | |
| yleinen | harventunut virtsaaminen, virtsaamisvaikeus, dysuria, nokturia, oliguria |
| melko harvinainen | virtsarakkospasmi, hematuria, tiheävirtsaisuuden paheneminen, virtsaretentio |
| Sukupuolielimet ja rinnat | |
| yleinen | rintojen aristus, kivesatrofia, kiveskipu, infertiliteetti, rintojen liikakasvu, erektiöhäiriöt, peniksen koon pieneneminen |
| melko harvinainen | gynekomastia, impotenssi, kiveshäiriö |
| harvinainen | kipu rinnoissa |
| Yleisoireet ja antopaikassa todettavat haitat | |
| hyvin yleinen | väsymys, pistoskohdan kirvely, pistoskohdan parestesiat |
| yleinen | huonovointisuus, pistoskohdan kipu, pistoskohdan mustelmanmuodostus ja -pistely |
| melko harvinainen | pistoskohdan kutina, pistoskohdan kovettuma, letargia, kipu, kuumeilu |
| harvinainen | injektiokohdan haava |
| hyvin harvinainen | injektiokohdan kuolio |
| Veri ja imukudos | |
| yleinen | hematologiset muutokset, anemia |
| Tutkimukset | |
| yleinen | veren kreatiinifosfokinaasin nousu, vuotoajan piteneminen |
| melko harvinainen | kohonnut alaniiniaminotransferaasi, kohonnut veren triglyseriditaso, protrombiiniajan piteneminen, painon nousu |
Muita leuproreliiniasetaattihoidon yhteydessä yleisesti ilmoitettuja haittatapahtumia ovat ääreisosien turvotus, keuhkoembolia, palpitaatiot, myalgia, lihasheikkous, ihotunnon muutokset, vilunväristykset, ihottuma, amnesia ja näköhäiriöt. Lihasatrofiaa on havaittu tämän luokan valmisteiden pitkäaikaiskäytössä. Hypofyysiadenooman infarktaatiota on harvoin todettu lyhyt- ja pitkäaikaisen GnRH-agonistikäytön yhteydessä. Harvinaisena on ilmoitettu trombosytopeniaa ja leukopeniaa. Muutoksista glukoositoleranssissa on raportoitu.
Kouristuksia on raportoitu GnRH-agonistien/analogien annon jälkeen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Eligard-injektion jälkeen ilmoitetut paikalliset haittatapahtumat vastaavat tyypillisesti samanlaisten ihon alle pistettävien valmisteiden yhteydessä esiintyviä.
Yleensä nämä ihonalaisen injektion jälkeiset paikalliset haittatapahtumat ovat lieviä ja kestoltaan lyhyiksi kuvattuja.
Anafylaktisia/anafylaktoideja reaktioita on joskus harvoin raportoitu GnRH-agonistien/analogien annon jälkeen.
Luuntiheyden muutokset
Luuntiheyden pienenemistä on ilmoitettu lääketieteellisessä kirjallisuudessa miehillä, joille on tehty orkiektomia tai joita on hoidettu GnRH-analogeilla. Voidaan odottaa, että pitkäaikaisessa leuproreliinihoidossa voi esiintyä osteoporoosin merkkien lisääntymistä. Osteoporoosista johtuva murtumariski: ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Taudin merkkien ja oireiden paheneminen
Leuproreliiniasetaattihoito voi aiheuttaa taudin merkkien ja oireiden pahenemista ensimmäisten viikkojen aikana. Jos nikamametastaasit ja/tai virtsatieahtaus tai hematuria pahenevat, voi ilmetä neurologisia oireita kuten alaraajojen heikkoutta ja/tai parestesioita tai virtsatieoireiden pahenemista.
Epäillyistä haittavaikutuksista ilmoittaminen.
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Eligard-valmisteen väärinkäyttö ja tahallinen yliannostus eivät ole todennäköisiä. Leuproreliiniasetaatin kliinisessä käytössä ei ole todettu väärinkäyttöä tai yliannostuksia. Yliannostapauksessa potilasta tulee tarkkailla ja antaa asianmukaista oireenmukaista hoitoa tarpeen mukaan.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: gonadotropiinia vapauttavan hormonin kaltaiset yhdisteet.
ATC-koodi: L02AE02.
Leuproreliiniasetaatti on luonnollisen gonadotropiinia vapauttavan hormonin (GnRH) synteettinen nonapeptidiagonisti, joka jatkuvasti annettuna estää aivolisäkkeen gonadotropiinituotantoa ja estää miehen steroidintuotantoa kiveksissä. Tämä vaikutus kumoutuu, kun lääkitys lopetetaan. Analogi on kuitenkin potentimpi kuin luonnollinen hormoni ja testosteronitasojen palautuminen saattaa vaihdella eri potilaiden välillä.
Leuproreliiniasetaatin anto aiheuttaa aluksi luteinisoivan hormonin (LH) ja follikkeleja stimuloivan hormonin (FSH) pitoisuuksien nousun veressä, mikä johtaa gonadosteroidien testosteronin ja dihydrotestosteronin pitoisuuksien ohimenevään kohoamiseen miehillä. Jatkuva leuproreliiniasetaatin anto saa aikaan LH- ja FSH-pitoisuuksien laskun. Miehellä testosteronipitoisuus laskee alle kastraatiotason (≤ 50 ng/dl). Nämä pitoisuuksien alenemiset tapahtuvat 3−4 viikon (45 mg), 3−5 viikon (22,5 mg) ja 5 viikon (7,5 mg) kuluessa hoidon aloittamisesta. Keskimääräinen testosteronitaso 6 kuukauden kohdalla on 10,4 (± 0,53) ng/dl (45 mg), 10,1 (± 0,7) ng/dl (22,5 mg) ja 6,1 (± 0,4) ng/dl (7,5 mg), joka on verrattavissa molemminpuolisen orkiektomian jälkeen mitattavaan tasoon. Kaikki kliiniseen avaintutkimukseen osallistuneet potilaat (45 mg:lla yhtä lukuun ottamatta) saavuttivat kastraatiotason 4 viikossa (45 mg), 5 viikossa (22,5 mg) tai 6 viikossa (7,5 mg); 99 % (22,5 mg) ja 94 % (7,5 mg) 28. päivään mennessä ja 98 % (7,5 mg) 35:nteen mennessä.
Huomattavalla enemmistöllä potilaista mitatut testosteronitasot olivat alle 20 ng/dl, vaikka alhaisista tasoista koituvaa hyötyä ei olekaan vielä vahvistettu. PSA-arvot laskivat 97 %:lla (45 mg), 98 %:lla (22,5 mg) tai 94 %:lla (7,5 mg) kuuden kuukauden aikana.
Pitkäaikaistutkimukset ovat osoittaneet, että hoidon jatkuessa testosteronipitoisuus pysyy alle kastraatiotason enimmillään seitsemän vuotta, luultavasti loputtomiin.
Kasvainten kokoa ei suoraan mitattu kliinisen tutkimuksen aikana, mutta epäsuora edullinen vaste kasvaimen kokoon todettiin 97 %:lla (45 mg), 98 %:lla (22,5 mg) ja 94 %:lla (7,5 mg), joilla PSA-keskiarvo laski Eligard-valmistetta käytettäessä.
Satunnaistetussa vaiheen III kliinisessä tutkimuksessa, johon osallistui 970 paikallisesti levinnyttä eturauhassyöpää sairastavaa potilasta - enimmäkseen T2c-T4 ja jonkin verran T1c-T2b potilaita, joilla oli patologinen paikallinen imusolmukesairaus (pathological regional nodal disease) - verrattiin kahden hoidon vertailukelpoisuuden (non-inferiority) osoittavassa analyysissä lyhytaikaista hoitoa pitkäaikaishoitoon, jonka yhteydessä annettiin adjuvantti hormonaalihoito GnRH-agonistilla (triptoreliini tai gosereliini). Potilaista 483:lle annettiin lyhytaikainen androgeenideprivaatiohoito (6 kuukautta) yhdistettynä sädehoitoon, ja 487 potilaalle annettiin pitkäaikaishoitoa (3 vuotta). Viiden vuoden hoidon jälkeen kokonaiskuolleisuus oli lyhytkestoista hoitoa saaneessa ryhmässä kaikkiaan 19,0 % ja pitkäkestoista hoitoa saaneessa ryhmässä 15,2 %. Havaittu riskisuhde (Hazard ratio) 1,42 (ylempi yksitahoinen 95,71 %:n luottamusväli = 1,79 ja kaksitahoinen 95,71 %:n luottamusväli = 1,09, 1,85, vertailukelpoisuuden (non-inferiority) p-arvo = 0,65) osoittaa, että sädehoidolla ja 6 kuukauden androgeenideprivaatiohoidolla selviytyminen oli heikompaa verrattuna sädehoitoon ja 3 vuoden androgeenideprivaatiohoitoon. Viiden vuoden elossaololuku oli 84,8 % pitkäaikaishoitoa saaneilla ja vastaavasti 81,0 % lyhytaikaishoitoa saaneilla potilailla. Yleinen elämänlaatu, käyttäen QLQ-C30-arvoa, ei eronnut merkittävästi eri ryhmien välillä (P = 0,37). Tuloksissa oli hallitsevana potilaspopulaatio, jolla oli paikallisesti levinnyt eturauhassyöpä.
Suuririskisen paikallisen eturauhassyövän indikaatiota koskeva näyttö perustuu sädehoidon ja GnRH-analogien, kuten leuproreliiniasetaatin, yhdistelmästä julkaistuihin tutkimuksiin. Kliiniset tiedot viidestä julkaistusta tutkimuksesta analysoitiin (EORTC 22863, RTOG 85-31, RTOG 92-02, RTOG 8610 ja D'Amico et al., JAMA, 2004), ja nämä tutkimukset osoittivat sädehoidon yhdistettynä GnRH-analogeihin olevan hyödyllinen. Julkaistuissa tutkimuksissa ei voitu tehdä selvää eroa tutkimusryhmien, paikallisesti edenneen eturauhassyövän ja suuririskisen paikallisen eturauhassyövän indikaatioiden välillä.
Kliiniset tiedot osoittavat, että sädehoito ja 3 vuoden androgeenideprivaatiohoito sädehoidon jälkeen on parempi vaihtoehto kuin sädehoito ja 6 kuukauden androgeenideprivaatiohoito. Lääketieteellisissä ohjeissa suositellaan sädehoitoa saavien T3-T4-potilaiden androgeenideprivaatiohoidon kestoksi 2−3 vuotta.
Farmakokinetiikka
Imeytyminen: Potilailla, joilla on pitkälle edennyt eturauhassyöpä, keskimääräiset leuproreliinipitoisuudet seerumissa kohoavat ensimmäisestä pistoksesta alkaen 25,3:een (22,5 mg: 127:ään, 45 mg: 82:een) ng/ml:ssa 4−8 tuntia (22,5 mg: 4,6 tuntia, 45 mg: 4,4 tuntia) (Cmax) injektion jälkeen. Jokaista pistosta seuranneen alun nousun jälkeen (tasannevaihe 2−28 päivää (7,5 mg), 3−84 päivää (22,5 mg) ja 3−168 päivää (45 mg) kunkin annoksen jälkeen) pitoisuudet seerumissa pysyvät suhteellisen vakioina (0,28−1,67 ng/ml (7,5 mg) ja 0,2−2 ng/ml (22,5 mg ja 45 mg)). Merkkejä kumuloitumisesta jatkuvassa annostelussa ei ole.
Jakautuminen: Laskimoon annetun bolusinjektion jälkeen leuproreliinin vakaan tilan jakautumistilavuuden keskiarvo terveillä vapaaehtoisilla miehillä oli 27 litraa. In vitro sitoutumisaste ihmisen plasmaproteiineihin oli 43 %−49 %.
Metaboloituminen: Terveillä vapaaehtoisilla miehillä laskimoon annettu 1 mg:n leuproreliiniasetaattibolus osoitti, että systeemisen puhdistuman keskiarvo oli 8,34 l/h, ja terminaalinen eliminaation puoliintumisaika noin 3 tuntia kaksitilamallin perusteella.
Erittymistä ei Eligard-valmisteella ole tutkittu.
Lääkeaineen metaboliatutkimuksia ei Eligard-valmisteella ole tehty.
Prekliiniset tiedot turvallisuudesta
Prekliinisissä tutkimuksissa leuproreliiniasetaatilla todettiin molempien sukupuolten lisääntymiselimiin kohdistuvia vaikutuksia, jotka olivat tunnettujen farmakologisten ominaisuuksien perusteella odotettavissa. Nämä vaikutukset näyttivät korjautuvan hoidon lopettamisen ja tietyn regeneraatioajan jälkeen. Leuproreliiniasetaatin ei todettu olevan teratogeeninen. Alkiotoksisuutta/kuolleisuutta havaittiin kaneilla. Tämä havainto on leuproreliiniasetaatin lisääntymiselimiin kohdistuvien farmakologisten vaikutusten mukainen.
Karsinogeenisuustutkimuksia tehtiin rotilla ja hiirillä 24 kuukauden ajan. Rotilla havaittiin annoksesta riippuvaa hypofyysiperäisten adenoomien lisääntymistä annostasolla 0,6−4 mg/kg/vrk ihon alle. Tällaista vaikutusta ei havaittu hiirillä.
Leuproreliiniasetaatin ja yhden kuukauden hoitoon tarkoitetun Eligard 7,5 mg -valmisteen ei todettu olevan mutageenisiä in vitro ja in vivo tutkimuksissa.
Farmaseuttiset tiedot
Apuaineet
Liuotin (ruisku A): Poly(DL-laktaattiglykolaatti) (50:50 (7,5 mg), 75:25 (22,5 mg) tai 85:15 (45 mg)), N-metyylipyrrolidoni
Kuiva-aine (ruisku B): −
Yhteensopimattomuudet
Ruiskussa B oleva leuproreliini on sekoitettava ainoastaan ruiskussa A olevan liuottimen kanssa eikä sitä saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
2 vuotta
Kun valmiste on otettu pois jääkaapista, sitä voidaan säilyttää alkuperäispakkauksessaan huoneenlämmössä (alle 25 °C) enintään 4 viikon ajan.
Alustan ensimmäisen avaamisen jälkeen on injektiokuiva-aine ja liuotin liuosta varten valmistettava heti käyttöön ja annettava potilaalle.
Käytettävä välittömästi käyttöön valmistamisen jälkeen, sillä liuoksen viskositeetti lisääntyy ajan myötä.
Säilytys
Säilytä jääkaapissa (2 °C−8 °C). Säilytä alkuperäispakkauksessa. Herkkä kosteudelle.
Valmisteen on oltava huoneenlämpöistä ennen pistämistä. Ota pois jääkaapista noin 30 minuuttia ennen käyttöä. Kun valmiste on otettu pois jääkaapista, sitä voidaan säilyttää alkuperäispakkauksessaan huoneenlämmössä (alle 25 °C) enintään 4 viikon ajan.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
ELIGARD injektiokuiva-aine ja liuotin, liuosta varten
7,5 mg (L:ei) 1 kpl (136,43 €)
22,5 mg (L:ei) 1 kpl (346,32 €)
45 mg (L:ei) 1 kpl (635,50 €)
PF-selosteen tieto
Esiliitetty ruiskujärjestelmä, joka koostuu seuraavista osista:
- yksi syklisestä olefiinikopolymeeristä valmistettu esitäytetty ruisku, joka sisältää kuiva-aineen (ruisku B)
- yksi polypropyleenistä valmistettu esitäytetty ruisku, joka sisältää liuottimen (ruisku A)
- liitin, jossa on lukituspainike ruiskuille A ja B.
Ruiskussa A on termoplastisesta kumista valmistettu männänkärki. Ruiskun B männänkärki on klorobutyylikumia.
Seuraavat pakkauskoot ovat saatavana:
7,5 mg ja 22,5mg:
- Pakkaus, jossa lämpömuovattu alusta ja steriili 20 G neula pahvikotelossa. Alusta sisältää yhden esiliitetyn ruiskujärjestelmän ja kuivikepussin.
- Monipakkaus, jossa on 3 esiliitettyä ruiskujärjestelmää sisältäviä settejä.
45mg:
- Pakkaus, jossa lämpömuovattu alusta ja steriili 18 G neula pahvikotelossa. Alusta sisältää yhden esiliitetyn ruiskujärjestelmän ja kuivikepussin.
-
Monipakkaus, jossa on 2 esiliitettyä ruiskujärjestelmää sisältäviä settejä.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Injektiokuiva-aine (ruisku B):
Esitäytetty ruisku, jossa valkoista tai melkein valkoista jauhetta.
Liuotin (ruisku A) (7,5 mg):
Esitäytetty ruisku, jossa kirkasta, väritöntä tai kellertävää/ruskehtavaa liuosta.
Liuotin (ruisku A) (22,5 mg ja 45 mg):
Esitäytetty ruisku, jossa kirkasta, väritöntä tai kellertävää liuosta.
Käyttö- ja käsittelyohjeet
Anna tuotteen lämmetä huoneenlämpöiseksi ennen käyttöä ottamalla se pois jääkaapista noin 30 minuuttia ennen käyttöä.
Valmistele potilas injektiota varten ennen valmisteen käyttövalmiiksi saattamista seuraavien ohjeiden mukaan. Jos valmistetta ei ole saatettu käyttövalmiiksi asianmukaista tekniikkaa käyttäen, sitä ei pidä antaa potilaalle, sillä valmisteen kliininen teho saattaa heikentyä, jos käyttövalmiiksi saattamista ei ole tehty oikein.
Vaihe 1
Ottaaksesi sisällön pois alustasta avaa alusta puhtaalla pinnalla repimällä folio irti kulmista. Hävitä kuivikepussi. Ota esiliitetty ruiskujärjestelmä (kuva 1.1) alustasta. Avaa turvaneulapakkaus (kuva 1.2) vetämällä suojapaperista. Huom. Ruiskujen A ja B ei pidä vielä olla kohdakkain.
| 7,5 mg ja 22,5 mg | 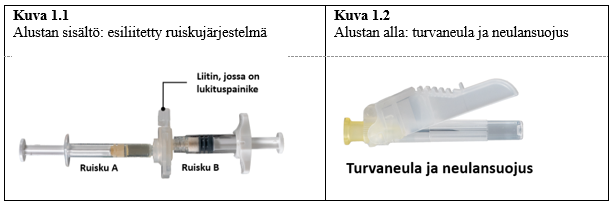 |
| 45 mg | 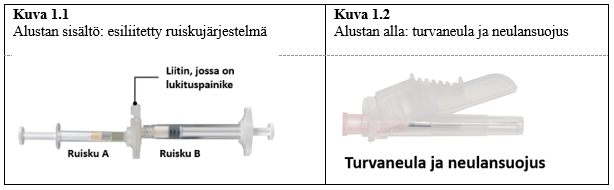 |
Vaihe 2
Ota peukalolla ja etusormella kiinni liittimessä sijaitsevasta lukituspainikkeesta ja paina sitä (kuva 2), kunnes kuulet napsahduksen. Ruiskut asettuvat kohdakkain. Ruiskujärjestelmää ei tarvitse pidellä tietynsuuntaisesti liittimen aktivoimiseksi. Älä taivuta ruiskujärjestelmää (huom. taivuttaminen voi aiheuttaa vuotoja, sillä ruiskut saattavat kiertyä osittain irti).
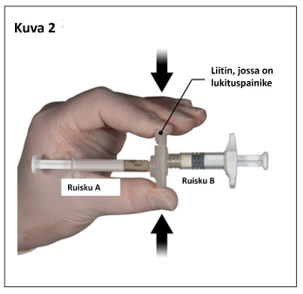 | 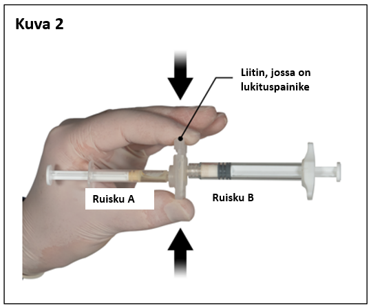 |
| 7,5 mg ja 22,5 mg | 45 mg |
Vaihe 3
Pitele ruiskuja vaakatasossa ja siirrä ruiskussa A oleva neste ruiskussa B olevaan leuproreliiniasetaatti-kuiva-aineeseen. Sekoita perusteellisesti mutta varovasti siirtämällä valmistetta edestakaisin ruiskusta toiseen 60 kierroksen verran (yksi kierros tarkoittaa ruiskun A männän yhtä painallusta ja ruiskun B männän yhtä painallusta) pitäen ruiskut vaaka-asennossa, jotta saat tasaisen, viskoosisen liuoksen (kuva 3). Älä taivuta ruiskujärjestelmää (huom. taivuttaminen voi aiheuttaa vuotoja, sillä ruiskut saattavat kiertyä osittain irti).
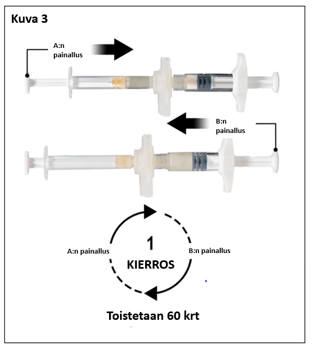 | 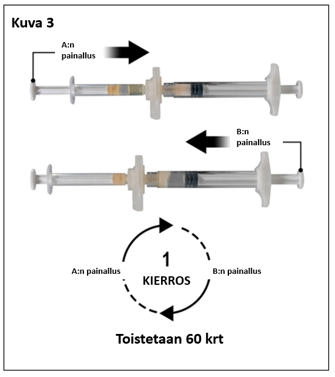 |
| 7,5 mg ja 22,5 mg | 45 mg |
7,5 mg: Huolellisen sekoittamisen jälkeen muodostuu viskoosinen, väriltään väritön, valkoinen tai ruskehtava liuos (häivähdys valkoisesta kellertävään).
22,5 mg ja 45 mg: Huolellisen sekoittamisen jälkeen muodostuu viskoosinen, väriltään väritön, valkoinen tai kellertävä liuos (häivähdys valkoisesta kellertävään).
Tärkeää: Etene seuraavaan vaiheeseen välittömästi sekoittamisen jälkeen, sillä valmisteen viskositeetti kasvaa ajan myötä. Älä laita sekoitettua valmistetta jääkaappiin.
Huom: Sekoittaminen on tehtävä ohjeiden mukaan. Ravistamalla valmiste EI sekoitu riittävästi.
Vaihe 4
Pidä sekoittamisen jälkeen ruiskut pystyasennossa siten, että ruisku B on alempana. Ruiskujen pitäisi pysyä tiukasti yhdessä. Vedä koko sisältö ruiskuun B (lyhyt, leveä ruisku) painamalla ruiskun A mäntää ja vetämällä kevyesti ruiskun B männästä (kuva 4).
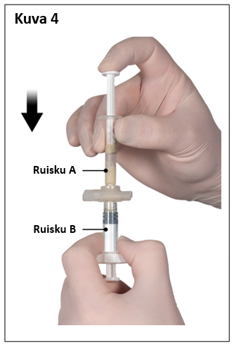 | 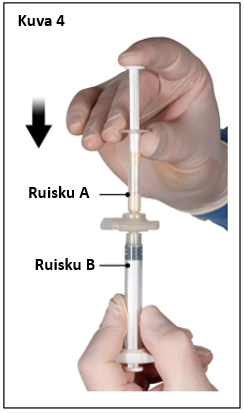 |
| 7,5 mg ja 22,5 mg | 45 mg |
Vaihe 5
Varmista, että ruiskun A mäntä on painettu pohjaan. Pidä kiinni liittimestä ja kierrä se irti ruiskusta B. Ruisku A on edelleen kiinni liittimessä (kuva 5). Varmista, ettei liuosta valu ulos, sillä neula ei tällöin kiinnity kunnolla.
Huom: Valmisteeseen saattaa jäädä yksi iso tai useita pieniä ilmakuplia; tämä on asiaankuuluvaa.
Älä poista ilmakuplia ruiskusta B tässä vaiheessa, sillä valmistetta saattaa joutua hukkaan.
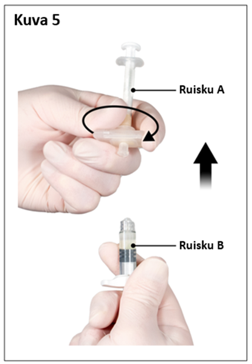 | 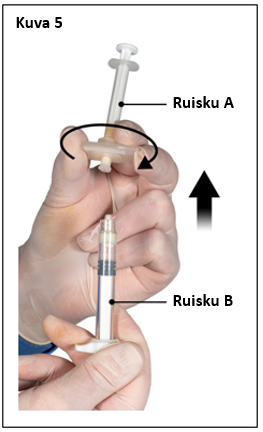 |
| 7,5 mg ja 22,5 mg | 45 mg |
Vaihe 6
- Pidä ruisku B pystyasennossa ja pidä valkoista mäntää vedettynä, jotta liuosta ei joudu hukkaan.
- Kiinnitä turvaneula ruiskuun B pitämällä ruiskua ja kääntämällä neulaa varovasti myötäpäivään noin kolme neljäsosakierrosta, kunnes neula on tukevasti kiinni (kuva 6).
Älä kierrä liian tiukalle, koska neulan kanta voi haljeta, minkä seurauksena liuosta voi vuotaa injektoinnin aikana. Myös turvasuojus voi vahingoittua, jos neula kierretään kiinni liikaa voimaa käyttäen.
Jos neulan kanta halkeaa, näyttää vaurioituneelta tai vuotaa, valmistetta ei saa käyttää. Vaurioitunutta neulaa ei saa korvata tai vaihtaa, eikä liuosta saa injektoida. Koko valmiste on hävitettävä turvallisesti.
Jos neulan kanta vaurioituu, koko valmiste on vaihdettava uuteen.
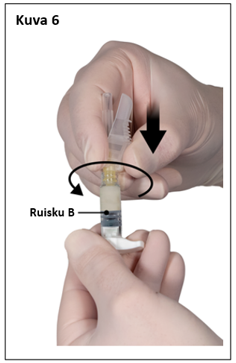 | 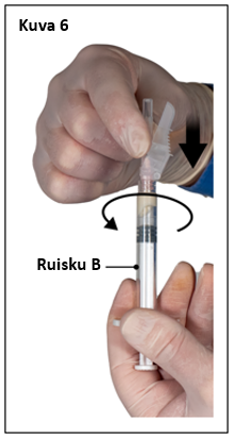 |
| 7,5 mg ja 22,5 mg | 45 mg |
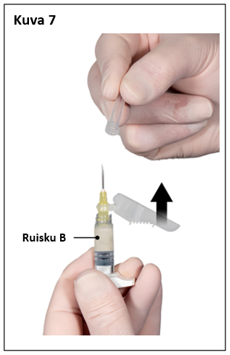
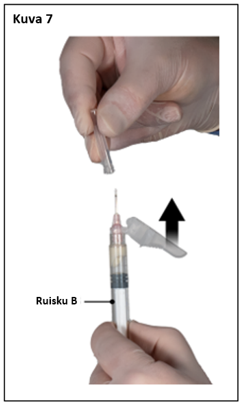
Vaihe 7
Poista neulan turvasuojus ja vedä pois neulansuojus juuri ennen valmisteen antamista (kuva 7).
Tärkeää: Älä koske turvaneulamekanismiin ennen valmisteen antamista. Jos neulan kanta näyttää vaurioituneelta tai vuotaa, valmistetta EI saa käyttää. Vaurioitunutta neulaa EI saa vaihtaa EIKÄ valmistetta pistää. Jos neulan kanta vaurioituu, käytä toista Eligard-settiä.
 |  |
| 7,5 mg ja 22,5 mg | 45 mg |
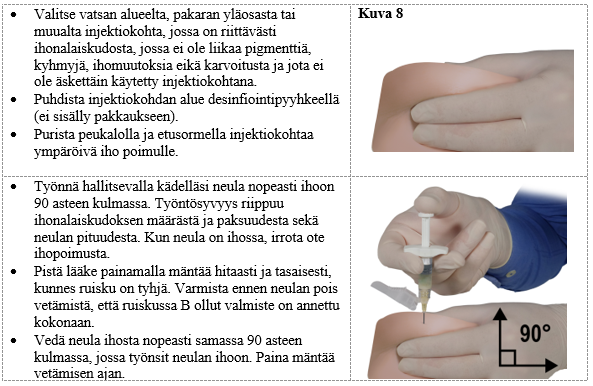
Vaihe 8
Ennen valmisteen antoa poista ruiskussa B mahdollisesti olevat isot ilmakuplat. Anna valmiste ihon alle, ja pidä samaan aikaan turvasuojus loitolla neulasta.
Valmisteen anto:
 |
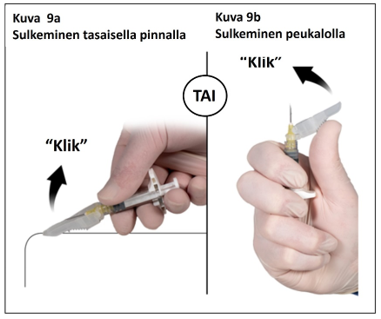
Vaihe 9
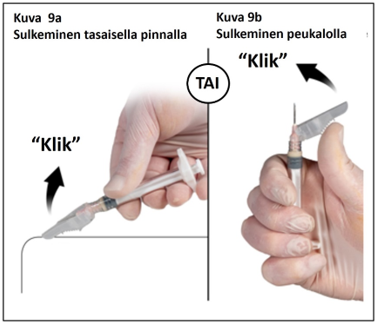
Injektion jälkeen lukitse neulan turvasuojus jommalla kummalla alla esitetyistä tavoista.
1. Sulkeminen tasaisella pinnalla
Paina turvasuojusta, vipupuoli alaspäin, tasaista pintaa vasten (kuva 9a) neulan peittämiseksi ja suojuksen lukitsemiseksi.
Varmista lukitus kuuntelemalla ja tunnustelemalla (lukituksesta kuuluu ”klik”). Turvaneula on lukittu, kun neulan kärki on kokonaan peitetty.
2. Sulkeminen peukalolla
Aseta peukalo turvasuojuksen alle (kuva 9b), peitä neulan kärki suojuksella, ja lukitse suojus.
Varmista lukitus kuuntelemalla ja tunnustelemalla (lukituksesta kuuluu ”klik”). Turvaneula on lukittu, kun neulan kärki on kokonaan peitetty.
 |  |
| 7,5 mg ja 22,5 mg | 45 mg |
Kun turvasuojus on lukittu, hävitä neula ja ruisku heti laittamalla ne niille kuuluviin säiliöihin.
Korvattavuus
ELIGARD injektiokuiva-aine ja liuotin, liuosta varten
7,5 mg 1 kpl
22,5 mg 1 kpl
45 mg 1 kpl
- Ylempi erityiskorvaus (100 %). Eturauhassyöpä (116).
- Peruskorvaus (40 %).
ATC-koodi
L02AE02
Valmisteyhteenvedon muuttamispäivämäärä
11.10.2024
Yhteystiedot
Berzelius väg 8
171 65 Solna
Sverige
+46 8 545 802 30
www.recordati.com
