TRULICITY injektioneste, liuos, esitäytetty kynä 0,75 mg, 1,5 mg, 3 mg, 4,5 mg
Vaikuttavat aineet ja niiden määrät
Trulicity 0,75 mg injektioneste, liuos, esitäytetty kynä
Yksi esitäytetty kynä sisältää 0,75 mg dulaglutidia* 0,5 millilitrassa liuosta.
Apuaine, jonka vaikutus tunnetaan:
Yksi millilitra liuosta sisältää 0,20 mg polysorbaatti 80:tä.
Trulicity 1,5 mg injektioneste, liuos, esitäytetty kynä
Yksi esitäytetty kynä sisältää 1,5 mg dulaglutidia* 0,5 millilitrassa liuosta.
Apuaine, jonka vaikutus tunnetaan:
Yksi millilitra liuosta sisältää 0,20 mg polysorbaatti 80:tä.
Trulicity 3 mg injektioneste, liuos, esitäytetty kynä
Yksi esitäytetty kynä sisältää 3 mg dulaglutidia* 0,5 millilitrassa liuosta.
Apuaine, jonka vaikutus tunnetaan:
Yksi millilitra liuosta sisältää 0,25 mg polysorbaatti 80:tä.
Trulicity 4,5 mg injektioneste, liuos, esitäytetty kynä
Yksi esitäytetty kynä sisältää 4,5 mg dulaglutidia* 0,5 millilitrassa liuosta.
Apuaine, jonka vaikutus tunnetaan:
Yksi millilitra liuosta sisältää 0,25 mg polysorbaatti 80:tä.
*valmistettu kiinanhamsterin munasarjasoluissa yhdistelmä-DNA-tekniikalla.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, liuos.
Kliiniset tiedot
Käyttöaiheet
Tyypin 2 diabetes
Trulicity on tarkoitettu vähintään 10 vuoden ikäisille potilaille riittämättömässä hoitotasapainossa olevan tyypin 2 diabeteksen hoitoon ruokavalion ja liikunnan lisänä
- monoterapiana, kun metformiinin käyttöä ei pidetä tarkoituksenmukaisena intoleranssin tai vasta-aiheiden vuoksi
- yhdistettynä muihin diabeteksen hoitoon käytettäviin lääkevalmisteisiin.
Tutkimustulokset eri yhdistelmähoidoista, vaikutuksista glukoositasapainoon ja sydän- ja verisuonitautitapahtumiin sekä tiedot tutkituista potilasryhmistä ovat luettavissa kohdista Varoitukset ja käyttöön liittyvät varotoimet, Yhteisvaikutukset ja Farmakodynamiikka.
Annostus ja antotapa
Annostus
Aikuiset
Monoterapia
Suositeltu annos on 0,75 mg kerran viikossa.
Yhdistelmähoito
Suositeltu annos on 1,5 mg kerran viikossa.
Tarvittaessa,
- 1,5 mg:n annos voidaan suurentaa aikaisintaan 4 viikon kuluttua 3 mg:aan kerran viikossa.
- 3 mg:n annos voidaan suurentaa aikaisintaan 4 viikon kuluttua 4,5 mg:aan kerran viikossa.
Enimmäisannos on 4,5 mg kerran viikossa.
Pediatriset potilaat
Aloitusannos vähintään 10 vuoden ikäisille pediatrisille potilaille on 0,75 mg kerran viikossa.
Tarvittaessa annos voidaan suurentaa aikaisintaan 4 viikon kuluttua 1,5 mg:aan kerran viikossa.
Enimmäisannos on 1,5 mg kerran viikossa.
Yhdistelmähoito
Kun Trulicity lisätään aiempaan metformiini- ja/tai pioglitatsonihoitoon, metformiinin ja/tai pioglitatsonin nykyisen annoksen käyttöä voidaan jatkaa. Kun Trulicity lisätään aiempaan metformiinihoitoon ja/tai natriumin- ja glukoosinkuljettajaproteiini 2:n (SGLT2:n) estäjähoitoon, metformiinin ja/tai SGLT2:n estäjän nykyisen annoksen käyttöä voidaan jatkaa. Kun se lisätään aiempaan sulfonyyliurea- tai insuliinihoitoon, sulfonyyliurea- tai insuliiniannoksen pienentämistä voidaan harkita hypoglykemiariskin pienentämiseksi (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset).
Trulicity-valmisteen käyttö ei edellytä verensokerin omaseurantaa. Verensokerin omaseuranta on välttämätöntä sulfonyyliurean tai insuliinin annoksen säätämistä varten, erityisesti kun Trulicity-hoito aloitetaan ja insuliiniannosta pienennetään. Insuliiniannoksen pienentämiseen suositellaan asteittaista lähestymistapaa.
Väliin jääneet annokset
Jos annos jää väliin, se tulee ottaa mahdollisimman pian, jos seuraavaan aikataulun mukaiseen annokseen on vähintään 3 päivää (72 tuntia). Jos seuraavaan aikataulun mukaiseen annokseen on alle 3 päivää (72 tuntia), väliin jäänyt annos jätetään pistämättä ja seuraava annos pistetään normaalin aikataulun mukaisena päivänä. Molemmissa tapauksissa potilas voi tämän jälkeen jatkaa lääkkeen käyttöä normaalisti kerran viikossa.
Erityisryhmät
Iäkkäät
Annosta ei tarvitse muuttaa iän perusteella (ks. kohta Farmakokinetiikka).
Munuaisten vajaatoiminta
Annosta ei tarvitse muuttaa, jos potilaalla on lievä, keskivaikea tai vaikea munuaisten vajaatoiminta (eGFR < 90 – ≥ 15 ml/min/1,73 m2).
Loppuvaiheen munuaisten vajaatoimintaa (< 15 ml/min/1,73 m2) sairastavista potilaista kokemusta on erittäin rajallisesti. Tästä syystä Trulicity-hoitoa ei voida suositella tässä potilasryhmässä (ks. kohdat Farmakodynamiikka ja Farmakokinetiikka).
Maksan vajaatoiminta
Annosta ei tarvitse muuttaa maksan vajaatoimintapotilailla.
Pediatriset potilaat
Dulaglutidin turvallisuutta ja tehoa alle 10 vuoden ikäisten lasten hoidossa ei ole varmistettu, eikä tietoja ole saatavilla (ks. kohdat Farmakodynamiikka ja Farmakokinetiikka).
Antotapa
Trulicity pistetään ihon alle vatsaan, reiteen tai olkavarteen. Sitä ei saa pistää laskimoon eikä lihakseen.
Annos voidaan pistää mihin vuorokauden aikaan tahansa riippumatta aterioista.
Lääkkeen antopäivää voidaan muuttaa tarvittaessa, kunhan edellisestä annoksesta on kulunut vähintään 3 päivää (72 tuntia).
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Tyypin 1 diabetes mellitus tai diabeettinen ketoasidoosi
Dulaglutidia ei saa käyttää tyypin 1 diabeetikoilla eikä diabeettisen ketoasidoosin hoidossa. Dulaglutidi ei korvaa insuliinia.
Diabeettista ketoasidoosia on ilmoitettu esiintyneen insuliinista riippuvaisilla potilailla insuliinin käytön nopean keskeyttämisen tai annoksen pienentämisen jälkeen (ks. kohta Annostus ja antotapa).
Vaikea maha-suolikanavan sairaus
Dulaglutidia ei ole tutkittu potilailla, joilla on vaikea maha-suolikanavan sairaus, esim. vaikea gastropareesi. Dulaglutidin käyttöä ei suositella tässä potilasryhmässä. Mahalaukun heikentyneeseen tyhjenemiseen liittyviä tapahtumia on ilmoitettu, mukaan lukien vaikea gastropareesi. Seuraa ja harkitse annoksen muuttamista tai hoidon lopettamista potilailla, joille kehittyy vaikeita maha-suolikanavan oireita hoidon aikana.
Aspiraatio yleisanestesian tai syvän sedaation yhteydessä
Aspiraatiopneumoniatapauksia on ilmoitettu anestesian tai syvän sedaation yhteydessä potilailla, jotka ovat
saaneet GLP-1-reseptoriagonisteja Siksi on otettava huomioon lisääntynyt riski mahaan jääneestä sisällöstä viivästyneen tyhjentymisen takia (ks. Haittavaikutukset) ennen yleisanestesian tai syvän sedaation aikana suoritettavia toimenpiteitä.
Kuivuminen
Kuivumista, joka voi joskus johtaa munuaisten äkilliseen vajaatoimintaan tai pahentaa munuaisten toimintahäiriötä, on ilmoitettu dulaglutidilla hoidetuilla potilailla, erityisesti hoidon alkuvaiheessa.
Monet ilmoitetuista munuaisiin kohdistuneista haittavaikutuksista ovat ilmenneet potilailla, joilla on ollut pahoinvointia, oksentelua, ripulia tai kuivumista. Dulaglutidi-valmisteella hoidettaville potilaille tulee kertoa mahdollisesta kuivumisriskistä, joka liittyy erityisesti maha-suolikanavaan kohdistuviin haittavaikutuksiin, sekä varotoimista nestevajauksen estämiseksi.
Akuutti haimatulehdus
GLP-1-reseptoriagonistien käyttöön on liitetty akuutin haimatulehduksen riski. Akuuttia haimatulehdusta on raportoitu dulaglutidin käytön yhteydessä kliinisissä tutkimuksissa (ks. kohta Haittavaikutukset).
Potilaalle on kerrottava akuutin haimatulehduksen tyypillisistä oireista. Jos haimatulehdusta epäillään, dulaglutidihoito on lopetettava. Jos haimatulehdus vahvistetaan, dulaglutidihoitoa ei pidä aloittaa uudestaan. Jos muita akuutin haimatulehduksen oireita ja löydöksiä ei havaita, pelkkä haimaentsyymiarvojen kohoaminen ei ennusta akuuttia haimatulehdusta (ks. kohta Haittavaikutukset).
Hypoglykemia
Dulaglutidia yhdessä sulfonyyliurean tai insuliinin kanssa käyttävillä potilailla saattaa olla suurentunut hypoglykemian riski. Hypoglykemian riskiä voidaan pienentää sulfonyyliurean tai insuliinin annosta pienentämällä (ks. kohdat Annostus ja antotapa ja Haittavaikutukset).
Natrium
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan "natriumiton".
Polysorbaatti
Trulicity 0,75 mg ja 1,5 mg, injektioneste, liuos, esitäytetty kynä
Tämä lääkevalmiste sisältää 0,1 mg polysorbaatti 80:tä jokaisessa 0,5 ml annoksessa, mikä vastaa 0,20 mg/ml.
Polysorbaatit voivat aiheuttaa allergisia reaktioita.
Trulicity 3 mg ja 4,5 mg, injektioneste, liuos, esitäytetty kynä
Tämä lääkevalmiste sisältää 0,125 mg polysorbaatti 80:tä jokaisessa 0,5 ml annoksessa, mikä vastaa 0,25 mg/ml.
Polysorbaatit voivat aiheuttaa allergisia reaktioita.
Yhteisvaikutukset
Dulaglutidi hidastaa mahalaukun tyhjenemistä ja voi vaikuttaa samanaikaisesti suun kautta annosteltujen lääkevalmisteiden imeytymisnopeuteen. Alla kuvatuissa kliinisissä farmakologisissa tutkimuksissa enintään 1,5 mg:n annoksina annettu dulaglutidi ei vaikuttanut suun kautta annosteltavien lääkevalmisteiden imeytymiseen kliinisesti merkitsevässä määrin. Fysiologiaan perustuvalla farmakokinetiikan mallilla tehdyn ennusteen mukaan 4,5 mg dulaglutidiannoksella ei ole kliinisesti merkittäviä keskeisiä yhteisvaikutuksia.
Lääkevalmisteelle altistuminen saattaa muuttua potilailla, jotka saavat dulaglutidia yhdessä suun kautta annosteltavien, nopeasti maha-suolikanavasta imeytyvien tai hitaasti lääkeainetta vapauttavien valmisteiden kanssa, etenkin dulaglutidihoidon aloittamisen yhteydessä.
Sitagliptiini
Sitagliptiinialtistus ei muuttunut, kun sitä annettiin yhdessä dulaglutidin 1,5 mg:n kerta-annoksen kanssa. Kun sitagliptiinia annettiin yhdessä kahden peräkkäisen 1,5 mg:n dulaglutidiannoksen kanssa, sitagliptiinin AUC(0-τ)-arvo pieneni noin 7,4 % ja Cmax-arvo noin 23,1 %. Sitagliptiinin tmax-aika viivästyi noin 0,5 tuntia dulaglutidin samanaikaisen annon jälkeen verrattuna pelkkään sitagliptiiniin.
Sitagliptiini voi estää DPP‑4-aktiivisuutta jopa 80-prosenttisesti 24 tunnin aikana. Dulaglutidin (1,5 mg) samanaikainen anto sitagliptiinin kanssa suurensi dulaglutidialtistusta noin 38 % ja Cmax-arvoa noin 27 %, ja tmax-ajan mediaani viivästyi noin 24 tuntia. Näin ollen dulaglutidi on hyvin suojattu DPP‑4-inaktivaatiolta (ks. kohta Farmakodynamiikka, vaikutusmekanismi). Suurentunut altistus saattaa voimistaa dulaglutidin vaikutuksia veren glukoosipitoisuuteen.
Parasetamoli
Ensimmäisen 1 mg:n dulaglutidiannoksen jälkeen parasetamolin Cmax-arvo pieneni 36 % ja ensimmäisen 3 mg:n dulaglutidiannoksen jälkeen 50 %, ja tmax-arvon mediaani viivästyi (1 mg: 3 h, 3 mg: 4 h). Kun enintään 3 mg dulaglutidia annettiin samanaikaisesti vakaassa tilassa, parasetamolin AUC(0-12)-, Cmax- ja tmax-arvoissa ei ollut tilastollisesti merkitseviä eroja. Parasetamolin annosta ei tarvitse muuttaa samanaikaisen dulaglutidihoidon yhteydessä.
Atorvastatiini
Kun 1,5 mg dulaglutidia annettiin yhdessä atorvastatiinin kanssa, atorvastatiinin ja sen tärkeimmän metaboliitin o-hydroksiatorvastatiinin Cmax-arvo pieneni enintään 70 % ja AUC(0-∞)-arvo enintään 21 %. Atorvastatiinin t1/2-keskiarvo suureni 17 % ja o-hydroksiatorvastatiinin 41 % dulaglutidin annon jälkeen. Havainnoilla ei ole kliinistä merkitystä. Atorvastatiinin annosta ei tarvitse muuttaa samanaikaisen dulaglutidihoidon yhteydessä.
Digoksiini
Kun digoksiinin vakaassa tilassa annettiin 2 peräkkäistä 1,5 mg:n dulaglutidiannosta, digoksiinin kokonaisaltistus (AUCτ) ja tmax-arvo pysyivät muuttumattomina ja Cmax-arvo pieneni enintään 22 %. Muutoksella ei todennäköisesti ole kliinisiä seurauksia. Digoksiinin annosta ei tarvitse muuttaa samanaikaisen dulaglutidihoidon yhteydessä.
Verenpainelääkkeet
Lisinopriilin AUC- tai Cmax-arvot eivät muuttuneet kliinisesti merkittävästi, kun useita 1,5 mg:n dulaglutidiannoksia annettiin vakaassa tilassa. Lisinopriilin tmax-ajan havaittiin viivästyvän tilastollisesti merkitsevästi (noin 1 h) tutkimuksen päivinä 3 ja 24. Kun kerta-annos 1,5 mg dulaglutidia ja metoprololia annettiin samanaikaisesti, metoprololin AUC-arvo suureni 19 % ja Cmax-arvo 32 %. Metoprololin tmax-aika viivästyi 1 tunnilla, mutta muutos ei ollut tilastollisesti merkitsevä. Muutokset eivät olleet kliinisesti merkittäviä, joten lisinopriilin tai metoprololin annosta ei tarvitse muuttaa dulaglutidin käytön yhteydessä.
Varfariini
S- ja R-varfariinin altistus ja R-varfariinin Cmax-arvo pysyivät muuttumattomina ja S-varfariinin Cmax-arvo pieneni 22 %, kun dulaglutidia (1,5 mg) annettiin varfariinin kanssa samanaikaisesti. AUCINR-arvo suureni 2 %, mikä ei todennäköisesti ole kliinisesti merkittävää. INRmax-vaste ei muuttunut. INR-vasteaika (tINRmax) viivästyi 6 tuntia, mikä on yhdenmukaista sen kanssa, että S-varfariinin tmax-arvo viivästyi noin 4 tuntia ja R-varfariinin noin 6 tuntia. Muutoksilla ei ole kliinistä merkitystä. Varfariinin annosta ei tarvitse muuttaa samanaikaisen dulaglutidihoidon yhteydessä.
Ehkäisytabletit
Dulaglutidin (1,5 mg) samanaikainen käyttö ehkäisytablettien (norgestimaatti 0,18 mg/etinyyliestradioli 0,025 mg) kanssa ei vaikuttanut norelgestromiinin eikä etinyyliestradiolin kokonaisaltistukseen. Norelgestromiinin Cmax-arvo pieneni tilastollisesti merkitsevästi 26 % ja etinyyliestradiolin 13 %. Norelgestromiinin tmax-aika viivästyi tilastollisesti merkitsevästi 2 tuntia ja etinyyliestradiolin 0,30 tuntia. Havainnoilla ei ole kliinistä merkitystä. Ehkäisytablettien annosta ei tarvitse muuttaa samanaikaisen dulaglutidihoidon yhteydessä.
Metformiini
Kun useita 1,5 mg:n annoksia dulaglutidia ja metformiinia (välittömästi vapautuva muoto, IR) annettiin metformiinin vakaassa tilassa, metformiinin AUCτ-arvo suureni enintään 15 % ja Cmax-arvo pieneni enintään 12 % tmax-arvo ei muuttunut. Muutokset ovat yhdenmukaisia dulaglutidista johtuvan mahalaukun tyhjenemisen hidastumisen kanssa ja metformiinin farmakokineettisen vaihtelun rajoissa, eivätkä täten ole kliinisesti merkittäviä. Välittömästi vapautuvan metformiinin annoksen muuttamista ei suositella samanaikaisen dulaglutidihoidon yhteydessä.
Raskaus ja imetys
Raskaus
Ei ole olemassa tietoja tai on vain vähän tietoja dulaglutidin käytöstä raskaana oleville naisille. Eläinkokeissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Tästä syystä dulaglutidin käyttöä ei suositella raskauden aikana.
Imetys
Ei tiedetä, erittyykö dulaglutidi ihmisen rintamaitoon. Vastasyntyneeseen/imeväiseen kohdistuvia riskejä ei voida poissulkea. Dulaglutidia ei pidä käyttää imetyksen aikana.
Hedelmällisyys
Dulaglutidin vaikutuksia ihmisen hedelmällisyyteen ei tunneta. Rotalla ei havaittu suoria vaikutuksia paritteluun eikä hedelmällisyyteen dulaglutidihoidon jälkeen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Trulicity-valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneiden käyttökykyyn. Jos sitä käytetään yhdessä sulfonyyliurean tai insuliinin kanssa, potilaita on neuvottava noudattamaan varotoimia hypoglykemian välttämiseksi ajaessaan autoa ja käyttäessään koneita (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Faasin 2 ja faasin 3 päättyneissä, 0,75 mg:n ja 1,5 mg:n dulaglutidivahvuuksien ensimmäistä myyntilupahakemusta tukeneissa tutkimuksissa 4 006 potilasta altistui pelkälle dulaglutidille tai dulaglutidin ja muiden glukoosipitoisuutta pienentävien lääkevalmisteiden yhdistelmälle. Kliinisissä tutkimuksissa yleisimmin ilmoitettuja haittavaikutuksia olivat maha-suolikanavan haitat mukaan lukien pahoinvointi, oksentelu ja ripuli. Yleisesti ottaen haittavaikutukset olivat vaikeusasteeltaan lieviä tai kohtalaisia ja luonteeltaan ohimeneviä. Tulokset pitkäaikaisesta sydän- ja verisuonivaikutusten päätetapahtumatutkimuksesta, jossa 4 949 potilasta satunnaistettiin dulaglutidille, olivat yhdenmukaisia näiden tulosten kanssa. Seuranta-ajan mediaani oli 5,4 vuotta.
Haittavaikutustaulukko
Seuraavat haittavaikutukset on havaittu faasin 2 ja faasin 3 kliinisten tutkimusten ja pitkäaikaisen sydän- ja verisuonivaikutusten päätetapahtumatutkimuksen aikana sekä markkinoille tulon jälkeisistä ilmoituksista. Haittavaikutukset on lueteltu taulukossa 1 MedDRA-elinjärjestelmäluokittain ilmaantuvuuden mukaan yleisimmästä alkaen (hyvin yleiset: ≥ 1/10, yleiset: ≥ 1/100, < 1/10, melko harvinaiset: ≥ 1/1000, < 1/100, harvinaiset: ≥ 1/10000, < 1/1000, hyvin harvinaiset: < 1/10000 ja yleisyys tuntematon (koska saatavissa oleva tieto ei riitä arviointiin). Haittavaikutukset on esitetty kussakin ilmaantuvuusluokassa haittavaikutuksen yleisyyden mukaan alenevassa järjestyksessä. Tapahtumien yleisyys on laskettu perustuen niiden ilmaantuvuuteen faasin 2 ja faasin 3 rekisteröintitutkimuksissa.
Taulukko 1. Dulaglutidin haittavaikutusten yleisyys
| Elinjärjestelmä | Hyvin yleiset | Yleiset | Melko harvinaiset | Harvinaiset | Tuntematon |
| Immuunijärjestelmä | Yliherkkyys | Anafylaktinen reaktio# | |||
| Aineenvaihdunta ja ravitsemus | Hypoglykemia* (kun samanaikaisesti käytettiin insuliinia, glimepiridia, metformiinia† tai metformiinia ja glimepiridia) | Hypoglykemia* (kun valmistetta käytettiin monoterapiana tai yhdessä metformiinin ja pioglitatsonin kanssa) | Kuivuminen | ||
| Hermosto | Makuhäiriöt | ||||
| Ruoansulatuselimistö | Pahoinvointi, ripuli, oksentelu†, vatsakipu† | Ruokahalun heikentyminen, dyspepsia, ummetus, ilmavaivat, vatsan pullotus, refluksitauti, röyhtäily | Akuutti haimatulehdus, viivästynyt mahalaukun tyhjeneminen | Muu kuin mekaaninen suolitukos | |
| Maksa ja sappi | Sappikivitauti, sappirakko- tulehdus | ||||
| Iho- ja ihonalainen kudos | Angioedeema# | ||||
| Yleisoireet ja antopaikassa todettavat haitat | Väsymys | Injektiokohdan reaktiot$ | |||
| Tutkimukset | Sinustakykardia, ensimmäisen asteen eteis-kammiokatkos (AVB) |
# Markkinoille tulon jälkeen ilmoitettu haittavaikutus
* Dokumentoitu, oireinen hypoglykemia, jossa verenglukoosi ≤ 3,9 mmol/l.
† 0,75 mg:n dulaglutidiannoksen kohdalla haittavaikutusten yleisyys oli sama kuin seuraavaksi alemmassa ilmaantuvuusluokassa.
$ Pediatrisessa tutkimuksessa havaittu esiintymistiheys oli yleinen; 3,9 % (2 potilasta) dulaglutidi 0,75 mg:n ryhmässä, 3,8 % (2 potilasta) dulaglutidi 1,5 mg:n ryhmässä ja 2 % (1 potilas) lumeryhmässä. Kaikki tapahtumat olivat vakavuudeltaan lieviä tai kohtalaisia.
Tiettyjen haittavaikutusten kuvaus
Hypoglykemia
Kun dulaglutidia 0,75 mg ja 1,5 mg käytettiin monoterapiana tai yhdistelmänä pelkän metformiinin tai metformiinin ja pioglitatsonin kanssa, dokumentoidun oireisen hypoglykemian ilmaantuvuus oli 5,9-10,9 % ja määrä 0,14-0,62 tapahtumaa/potilas/vuosi. Vaikeita hypoglykemiatapahtumia ei ilmoitettu.
Kun dulaglutidia 0,75 mg ja 1,5 mg käytettiin yhdessä sulfonyyliurean ja metformiinin kanssa, dokumentoidun oireisen hypoglykemian ilmaantuvuus oli 39,0 % ja 40,3 %, mainitussa järjestyksessä, ja määrät vastaavasti 1,67 ja 1,67 tapahtumaa/potilas/vuosi. Vaikeiden hypoglykemiatapahtumien ilmaantuvuus oli 0 % ja 0,7 % ja määrät vastaavasti 0,00 ja 0,01 tapahtumaa/potilas/vuosi annosta kohti. Kun dulaglutidia 1,5 mg käytettiin pelkästään sulfonyyliurean kanssa, dokumentoidun oireisen hypoglykemian ilmaantuvuus oli 11,3 % ja määrä oli 0,90 tapahtumaa/potilas/vuosi. Vaikeita hypoglykemiatapahtumia ei ilmoitettu.
Kun dulaglutidia 1,5 mg käytettiin yhdessä glargininsuliinin kanssa, dokumentoidun oireisen hypoglykemian ilmaantuvuus oli 35,3 % ja määrä oli 3,38 tapahtumaa/potilas/vuosi. Vaikeiden hypoglykemiatapahtumien ilmaantuvuus oli 0,7 % ja määrä 0,01 tapahtumaa/potilas/vuosi.
Kun 0,75 mg ja 1,5 mg dulaglutidia käytettiin yhdessä ateriainsuliinin kanssa, ilmaantuvuus oli 85,3 % ja 80,0 %, mainitussa järjestyksessä, ja määrät vastaavasti 35,66 ja 31,06 tapahtumaa/potilas/vuosi. Vaikeiden hypoglykemiatapahtumien ilmaantuvuus oli 2,4 % ja 3,4 % ja määrät olivat 0,05 ja 0,06 tapahtumaa/potilas/vuosi.
Faasin 3 tutkimuksessa, jossa dulaglutidia (1,5 mg, 3 mg tai 4,5 mg) käytettiin yhdessä metformiinin kanssa, dokumentoidun oireisen hypoglykemian ilmaantuvuudet viikkoon 52 mennessä olivat 3,1 % (1,5 mg), 2,4 % (3 mg) ja 3,1 % (4,5 mg) ja tapahtumamäärät olivat 0,07 tapahtumaa, 0,05 tapahtumaa ja 0,07 tapahtumaa potilasvuotta kohti. 1,5 mg:n ja 4,5 mg:n dulaglutidiryhmissä ilmoitettiin yksi vaikea hypoglykemiatapahtuma.
Maha-suolikanavan haittavaikutukset
Dulaglutidihoidon 0,75 mg ja 1,5 mg maha-suolikanavan tapahtumien kumulatiiviseen raporttiin (104 viikkoon asti) sisältyi mainitussa järjestyksessä mm. pahoinvointi (12,9 % ja 21,2 %), ripuli (10,7 % ja 13,7 %) ja oksentelu (6,9 % ja 11,5 %). Haitat olivat vaikeusasteeltaan yleensä lieviä tai keskivaikeita. Niiden ilmoitettiin nousseen huippuunsa ensimmäisten 2 hoitoviikon aikana ja vähenevän nopeasti seuraavien 4 viikon aikana, minkä jälkeen määrä pysyi suhteellisen muuttumattomana.
Faasin 3 tutkimuksessa, jossa dulaglutidia annettiin 1,5 mg:n, 3 mg:n ja 4,5 mg:n annoksina, ruoansulatuskanavan tapahtumina raportoitiin kumulatiivisesti viikkoon 52 mennessä pahoinvointia (14,2 %, 16,1 % ja 17,3 %), ripulia (7,7 %, 12,0 % ja 11,6 %) ja oksentelua (6,4 %, 9,1 % ja 10,1 %).
Enintään 6 viikkoa kestäneissä tyypin 2 diabetespotilailla tehdyissä kliinisissä farmakologisissa tutkimuksissa valtaosa maha-suolikanavan tapahtumista ilmoitettiin ensimmäisten 2-3 päivän aikana aloitusannoksen ottamisen jälkeen. Tapahtumat vähenivät seuraavien annosten myötä.
Akuutti haimatulehdus
Faasin 2 ja 3 myyntilupatutkimuksissa akuutin haimatulehduksen ilmaantuvuus oli 0,07 % dulaglutidihoidossa, 0,14 % lumehoidossa ja 0,19 % vertailuvalmistehoidossa. Tutkimuksissa saattoi olla mukana myös muita samanaikaisia diabeteslääkkeitä. Akuuttia haimatulehdusta ja haimatulehdusta on raportoitu myös markkinoille tulon jälkeen.
Haimaentsyymit
Dulaglutidihoidon yhteydessä haimaentsyymiarvot (lipaasi ja/tai haiman amylaasi) suurenivat lähtötilanteesta keskimäärin 11-21 % (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Jos muita akuutin haimatulehduksen oireita ja löydöksiä ei havaita, pelkkä haimaentsyymiarvojen kohoaminen ei ennusta akuuttia haimatulehdusta.
Sydämen tiheälyöntisyys
Dulaglutidihoidossa syketiheys nousi lievästi, keskimäärin 2-4 lyöntiä/min. Sinustakykardian ilmaantuvuuden havaittiin olevan 1,3 % (0,75 mg) ja 1,4 % (1,5 mg), ja syke nousi samanaikaisesti ≥ 15 lyöntiä/min lähtötilanteesta.
Faasin 3 tutkimuksessa, jossa dulaglutidia annettiin 1,5 mg:n, 3 mg:n ja 4,5 mg:n annoksina, sinustakykardian (eli tilanteen, jossa syketiheys suureni ≥ 15 lyöntiä/min verrattuna lähtötilanteeseen) ilmaantuvuudet olivat 2,6 % (1,5 mg), 1,9 % (3 mg) ja 2,6 % (4,5 mg). Syketiheys nopeutui keskimäärin 1–4 lyöntiä minuutissa.
Ensimmäisen asteen AV-katkos/PR-ajan piteneminen
Dulaglutidihoidossa PR-aika piteni hieman lähtötilanteesta, keskimäärin 2-3 msek, ja ensimmäisen asteen AV-katkoksen ilmaantuvuus oli 1,5 % (0,75 mg) ja 2,4 % (1,5 mg).
Faasin 3 tutkimuksessa, jossa dulaglutidia annettiin 1,5 mg:n, 3 mg:n ja 4,5 mg:n annoksina, ensimmäisen asteen AV-katkoksen ilmaantuvuus oli 1,2 % (1,5 mg), 3,8 % (3 mg) ja 1,7 % (4,5 mg). PR-aika piteni keskimäärin 3–5 msek lähtötilanteesta.
Immunogeenisyys
Myyntilupatutkimuksissa dulaglutidihoidon aikana ilmeni dulaglutidivasta-aineiden kehittymistä (ilmaantuvuus 1,6 %). Tämä osoittaa, että dulaglutidimolekyylin GLP-1- ja modifioitujen IgG4-osien rakenteellinen muokkaus ja suuri samanlaisuus natiivin GLP-1:n ja natiivin IgG4:n kanssa minimoivat immuunivasteen riskin dulaglutidille. Potilailla, joille kehittyi dulaglutidivasta-aineita, titterit olivat yleensä pieniä. Vaikka vasta-aineita kehittyi harvoille potilaille, faasin 3 tutkimustietojen perusteella dulaglutidivasta-aineiden ei havaittu vaikuttavan selvästi HbA1c-muutoksiin. Dulaglutidivasta-aineita ei kehittynyt yhdellekään potilaista, joilla esiintyi systeemistä yliherkkyyttä.
Yliherkkyys
Faasin 2 ja faasin 3 myyntilupatutkimuksissa systeemisiä yliherkkyystapahtumia (esim. nokkosihottumaa, turvotusta) ilmoitettiin 0,5 %:lla dulaglutidia saaneista potilaista. Tapauksia anafylaktisista reaktioista on ilmoitettu harvoin dulaglutidin markkinoille tulon jälkeen.
Injektiokohdan reaktiot
Injektiokohdan haittatapahtumia ilmoitettiin 1,9 %:lla dulaglutidia saaneista potilaista. Mahdollisesti immuunivälitteisiä injektiokohdan reaktioita (esim. ihottumaa, punoitusta) ilmoitettiin 0,7 %:lla potilaista. Reaktiot olivat yleensä lieviä.
Lopettaminen haittatapahtuman takia
26 viikkoa kestäneissä tutkimuksissa haittatapahtumien takia tutkimuksen lopetti dulaglutidia saaneista potilaista 2,6 % (0,75 mg) ja 6,1 % (1,5 mg) ja lumelääkettä saaneista potilaista 3,7 %. Koko tutkimuksen keston aikana (enintään 104 viikkoa) dulaglutidia saaneista potilaista 5,1 % (0,75 mg) ja 8,4 % (1,5 mg) lopetti tutkimuksen haittatapahtumien takia. Yleisimmin lopettamiseen johtaneita haittavaikutuksia olivat 0,75 mg:n ja 1,5 mg:n dulaglutidilla pahoinvointi (1,0 %, 1,9 %), ripuli (0,5 %, 0,6 %) ja oksentelu (0,4 %, 0,6 %), ja niitä ilmoitettiin yleensä ensimmäisten 4-6 viikon aikana.
Faasin 3 tutkimuksessa, jossa dulaglutidia annettiin 1,5 mg:n, 3 mg:n tai 4,5 mg:n annoksina, tutkimukseen osallistumisen lopetti haittatapahtumien vuoksi 6,0 % (1,5 mg), 7,0 % (3 mg) ja 8,5 % (4,5 mg) tutkittavista viikkoon 52 mennessä. Yleisimmät dulaglutidin (1,5 mg, 3 mg tai 4,5 mg) käytön lopettamiseen johtaneet haittavaikutukset olivat pahoinvointi (1,3 %, 1,3 %, 1,5 %), ripuli (0,2 %, 1,0 %, 1,0 %) ja oksentelu (0,0 %, 0,8 %, 1,3 %).
3 mg:n ja 4,5 mg:n dulaglutidiannokset
3 mg tai 4,5 mg dulaglutidia kerran viikossa saaneilla potilailla todettu turvallisuusprofiili vastaa edellä kuvattuja tietoja dulaglutidin turvallisuusprofiilista potilailla, jotka saivat 0,75 mg tai 1,5 mg dulaglutidia kerran viikossa.
Pediatriset potilaat
0,75 mg tai 1,5 mg dulaglutidia kerran viikossa saaneilla vähintään 10 vuoden ikäisillä pediatrisilla potilailla todettu turvallisuusprofiili vastaa edellä kuvattua aikuisten turvallisuusprofiilia.
Dulaglutidilla hoidettujen lapsipotilaiden immunogeenisuusprofiili on yhdenmukainen edellä aikuispotilailla kuvatun kanssa. Pediatrisessa tutkimuksessa 2,1 %:lle lumelääkettä ja 4,0 %:lle dulaglutidilla hoidetuista potilaista kehittyi dulaglutidivasta-aineita.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 Fimea
Yliannostus
Kliinisissä tutkimuksissa dulaglutidin yliannostuksen vaikutuksia ovat olleet maha-suolikanavan oireet ja hypoglykemia. Yliannostustapauksissa on aloitettava asianmukainen tukihoito potilaan kliinisten oireiden ja löydösten perusteella.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Diabeteslääkkeet, veren glukoosipitoisuutta pienentävät lääkkeet, lukuun ottamatta insuliineja, ATC-koodi: A10BJ05
Vaikutusmekanismi
Dulaglutidi on pitkävaikutteinen glukagonin kaltaisen peptidi 1:n (GLP-1) reseptoriagonisti. Molekyyli koostuu kahdesta identtisestä, disulfidisidoksin toisiinsa liittyneestä ketjusta, joista kumpikin sisältää modifioidun ihmisen GLP-1-analogisekvenssin, joka on liitetty kovalenttisesti modifioituun ihmisen immunoglobuliini G4:n (IgG4) raskasketjufragmenttiin (Fc) pienen peptidiketjun avulla. Dulaglutidin GLP-1-analogiosa on noin 90-prosenttisesti homologinen ihmisen natiivin GLP-1:n (7-37) kanssa. Natiivin GLP-1:n puoliintumisaika on 1,5-2 minuuttia, mikä johtuu DPP-4:n aiheuttamasta hajoamisesta ja munuaispuhdistumasta. Toisin kuin natiivia GLP-1:tä, DPP-4 ei pysty hajottamaan dulaglutidia, ja sen suuri koko hidastaa imeytymistä ja vähentää munuaispuhdistumaa. Näiden rakenteellisten muutosten ansiosta muodostuu liukeneva valmiste, jolla on pidentynyt puoliintumisaika (4,7 päivää), minkä takia se sopii annosteltavaksi ihon alle kerran viikossa. Lisäksi dulaglutidimolekyyli on suunniteltu estämään Fcγ-reseptoririippuvaista immuunivastetta ja vähentämään sen immunogeenistä potentiaalia.
Dulaglutidilla on useita GLP-1:n antihyperglykeemisiä vaikutuksia. Kun glukoosipitoisuudet ovat koholla, dulaglutidi lisää solunsisäisen syklisen adenosiinimonofosfaatin (cAMP) määrää haiman beetasoluissa, mikä johtaa insuliinin vapautumiseen. Dulaglutidi estää glukagonin eritystä, jonka tiedetään olevan normaalia suurempaa tyypin 2 diabetesta sairastavilla potilailla. Kun glukagonipitoisuudet pienenevät, maksan glukoosituotanto vähenee. Dulaglutidi myös hidastaa mahalaukun tyhjenemistä.
Farmakodynaamiset vaikutukset
Dulaglutidi parantaa glukoositasapainoa tyypin 2 diabetespotilailla pienentämällä pitkäkestoisesti paasto-, ateriaa edeltävää ja aterianjälkeistä glukoosipitoisuutta. Vaikutus alkaa dulaglutidin ensimmäisen antokerran jälkeen ja kestää läpi viikon annosteluvälin.
Farmakodynamiikkaan keskittyneessä dulaglutiditutkimuksessa tyypin 2 diabetespotilaiden ensimmäisen vaiheen insuliinieritys palautui tasolle, joka ylitti lumetta saavien terveiden tutkittavien arvot, ja toisen vaiheen insuliinieritys parani, kun laskimoon annettiin glukoosia boluksena. Samassa tutkimuksessa 1,5 mg:n kerta-annos dulaglutidia näytti lisäävän tyypin 2 diabetesta sairastavien potilaiden maksimaalista insuliinieritystä beetasoluissa ja parantavan beetasolujen toimintaa lumelääkkeeseen verrattuna.
Dulaglutidin farmakodynaaminen profiili soveltuu kerran viikossa annosteluun, mikä on yhdenmukaista farmakokineettisen profiilin kanssa (ks. kohta Farmakokinetiikka).
Kliininen teho ja turvallisuus
Glukoositasapaino
Dulaglutidin turvallisuutta ja tehoa arvioitiin kymmenessä satunnaistetussa, kontrolloidussa faasin 3 tutkimuksessa, joihin osallistui 8 035 tyypin 2 diabetespotilasta. Potilaista 1 644 oli ≥ 65-vuotiaita, ja heistä 174 oli ≥ 75-vuotiaita. Tutkimuksissa dulaglutidia sai 5 650 potilasta, joista 1 558 sai viikoittain Trulicity 0,75 mg -annoksen, 2 862 sai viikoittain Trulicity 1,5 mg -annoksen, 616 sai viikoittain Trulicity 3 mg -annoksen ja 614 sai viikoittain Trulicity 4,5 mg -annoksen. Dulaglutidi paransi glukoositasapainoa kliinisesti merkitsevästi kaikissa tutkimuksissa HbA1c-arvolla mitattuna.
Monoterapia
Dulaglutidia verrattiin 52 viikkoa kestäneessä aktiivikontrolloidussa monoterapiatutkimuksessa metformiiniin. Trulicity 1,5 mg- ja 0,75 mg -hoidot pienensivät HbA1c-arvoa enemmän kuin metformiini (1500-2000 mg/vrk), ja merkitsevästi suurempi osa potilaista saavutti HbA1c-tavoitearvot < 7,0 % ja ≤ 6,5 % Trulicity 1,5 mg- sekä 0,75 mg -hoidoilla verrattuna metformiiniin viikolla 26.
Taulukko 2. Tulokset 52 viikon aktiivikontrolloidusta monoterapiatutkimuksesta, jossa kahta dulaglutidiannosta verrattiin metformiiniin
| HbA1c-lähtöarvo | HbA1c-arvon keskimääräinen muutos | HbA1c-tavoitearvonsaavuttaneet potilaat | Paastoverensokerin muutos | Painon muutos | ||
| (%) | (%) | < 7,0 % (%)a | ≤ 6,5 % (%)b | (mmol/l) | (kg) | |
| 26 viikkoa | ||||||
| Dulaglutidi 1,5 mg kerran viikossa (n = 269) | 7,63 | -0,78†† | 61,5# | 46,0## | -1,61 | -2,29 |
| Dulaglutidi 0,75 mg kerran viikossa (n = 270) | 7,58 | -0,71†† | 62,6# | 40,0# | -1,46 | -1,36# |
| Metformiini 1500-2000 mg/vrk (n = 268) | 7,60 | -0,56 | 53,6 | 29,8 | -1,34 | -2,22 |
| 52 viikkoa | ||||||
| Dulaglutidi 1,5 mg kerran viikossa (n = 269) | 7,63 | -0,70†† | 60,0# | 42,3## | -1,56# | -1,93 |
| Dulaglutidi 0,75 mg kerran viikossa (n = 270) | 7,58 | -0,55† | 53,2 | 34,7 | -1,00 | -1,09# |
| Metformiini 1500-2000 mg/vrk (n = 268) | 7,60 | -0,51 | 48,3 | 28,3 | -1,15 | -2,20 |
† monivertailukorjattu yksitahoinen p-arvo < 0,025 koskien dulaglutidin vertailukelpoisuutta (non-inferiority) ; †† monivertailukorjattu yksitahoinen p-arvo < 0,025 koskien dulaglutidin paremmuutta verrattuna metformiiniin, arvioitu pelkästään HbA1c-arvon suhteen
# p < 0,05, ## p < 0,001, dulaglutidihoitoryhmä verrattuna metformiiniin
a HbA1c -arvo 7,0 % (DCCT) vastaa 53,0 mmol/mol (IFCC) (keskimääräinen verensokeri: 8,6 mmol/l)
b HbA1c -arvo 6,5 % (DCCT) vastaa 47,5 mmol/mol (IFCC) (keskimääräinen verensokeri: 7,8 mmol/l)
DCCT = Diabetes Control and Complications Trial; IFCC = International Federation of Clinical Chemistry and Laboratory Medicine
Dokumentoitujen oireisten hypoglykemioiden määrä oli 0,62 (dulaglutidi 1,5 mg), 0,15 (dulaglutidi 0,75 mg) ja 0,09 (metformiini) tapahtumaa/potilas/vuosi. Vaikeaa hypoglykemiaa ei havaittu.
Yhdistelmähoito metformiinin kanssa
Dulaglutidin turvallisuutta ja tehoa tutkittiin 104 viikkoa kestäneessä lume- ja aktiivikontrolloidussa (sitagliptiini 100 mg/vrk) tutkimuksessa. Kaikkia hoitoja annettiin yhdessä metformiinin kanssa. Trulicity-hoidot 1,5 mg ja 0,75 mg pienensivät HbA1c-arvoja enemmän kuin sitagliptiini 52 viikon kohdalla, ja lisäksi merkitsevästi suurempi osa potilaista saavutti HbA1c-tavoitearvot (< 7,0 % ja ≤ 6,5 %). Vaikutukset säilyivät tutkimuksen loppuun asti (104 viikkoa).
Taulukko 3. Tulokset 104 viikon lume- ja aktiivikontrolloidusta tutkimuksesta, jossa kahta dulaglutidiannosta verrattiin sitagliptiiniin
| HbA1c-lähtöarvo | HbA1c-arvon keskimääräinen muutos | HbA1c-tavoitearvon saavuttaneet potilaat | Paastoverensokerin muutos | Painon muutos | ||
| (%) | (%) | < 7,0 % (%)a | ≤ 6,5 % (%)b | (mmol/l) | (kg) | |
| 26 viikkoa | ||||||
| Dulaglutidi 1,5 mg kerran viikossa (n = 304) | 8,12 | -1,22‡‡,## | 60,9**,## | 46,7**,## | -2,38**,## | -3,18**,## |
| Dulaglutidi 0,75 mg kerran viikossa (n = 302) | 8,19 | -1,01‡‡,## | 55,2**,## | 31,0**,## | -1,97**,## | -2,63**,## |
| Lume (n = 177) | 8,10 | 0,03 | 21,0 | 12,5 | -0,49 | -1,47 |
| Sitagliptiini 100 mg kerran vuorokaudessa (n = 315) | 8,09 | -0,61 | 37,8 | 21,8 | -0,97 | -1,46 |
| 52 viikkoa | ||||||
| Dulaglutidi 1,5 mg kerran viikossa (n = 304) | 8,12 | -1,10†† | 57,6## | 41,7## | -2,38## | -3,03## |
| Dulaglutidi 0,75 mg kerran viikossa (n = 302) | 8,19 | -0,87†† | 48,8## | 29,0## | -1,63## | -2,60## |
| Sitagliptiini 100 mg kerran vuorokaudessa (n = 315) | 8,09 | -0,39 | 33,0 | 19,2 | -0,90 | -1,53 |
| 104 viikkoa | ||||||
| Dulaglutidi 1,5 mg kerran viikossa (n = 304) | 8,12 | -0,99†† | 54,3## | 39,1## | -1,99## | -2,88## |
| Dulaglutidi 0,75 mg kerran viikossa (n = 302) | 8,19 | -0,71†† | 44,8## | 24,2## | -1,39## | -2,39 |
| Sitagliptiini 100 mg kerran vuorokaudessa (n = 315) | 8,09 | -0,32 | 31,1 | 14,1 | -0,47 | -1,75 |
†† monivertailukorjattu yksitahoinen p-arvo < 0,025 koskien dulaglutidin paremmuutta verrattuna sitagliptiiniin, arvioitu pelkästään HbA1c-arvon suhteen viikoilla 52 ja 104
‡‡ monivertailukorjattu yksitahoinen p-arvo < 0,001 koskien dulaglutidin paremmuutta verrattuna lumeeseen, arvioitu pelkästään HbA1c-arvon suhteen
** p < 0,001, dulaglutidihoitoryhmä verrattuna lumeeseen
## p < 0,001, dulaglutidihoitoryhmä verrattuna sitagliptiiniin
a HbA1c -arvo 7,0 % (DCCT) vastaa 53,0 mmol/mol (IFCC) (keskimääräinen verensokeri: 8,6 mmol/l)
b HbA1c -arvo 6,5 % (DCCT) vastaa 47,5 mmol/mol (IFCC) (keskimääräinen verensokeri: 7,8 mmol/l)
Dokumentoitujen oireisten hypoglykemioiden määrä oli 0,19 (dulaglutidi 1,5 mg), 0,18 (dulaglutidi 0,75 mg) ja 0,17 (sitagliptiini) tapahtumaa/potilas/vuosi. Dulaglutidihoidon yhteydessä ei havaittu vaikeaa hypoglykemiaa.
Dulaglutidin turvallisuutta ja tehoa tutkittiin myös 26 viikkoa kestäneessä aktiivikontrolloidussa (liraglutidi 1,8 mg/vrk) tutkimuksessa. Molempia hoitoja annettiin yhdessä metformiinin kanssa.
Trulicity-hoidossa (1,5 mg) HbA1c-arvojen pieneneminen ja HbA1c-tavoitearvot (< 7,0 % ja ≤ 6,5 %) saavuttaneiden potilaiden määrä oli samaa luokkaa kuin liraglutidihoidossa.
Taulukko 4. Tulokset 26 viikon aktiivikontrolloidusta tutkimuksesta, jossa yhtä dulaglutidiannosta verrattiin liraglutidiin
| HbA1c-lähtöarvo | HbA1c-arvon keskimääräinen muutos | HbA1c-tavoitearvon saavuttaneet potilaat | Paastoverensokerin muutos | Painon muutos | ||
| (%) | (%) | < 7,0 % (%)a | ≤ 6,5 % (%)b | (mmol/l) | (kg) | |
| 26 viikkoa | ||||||
| Dulaglutidi 1,5 mg kerran viikossa (n = 299) | 8,06 | -1,42‡ | 68,3 | 54,6 | -1,93 | -2,90# |
| Liraglutidi+ 1,8 mg/vrk (n = 300) | 8,05 | -1,36 | 67,9 | 50,9 | -1,90 | -3,61 |
‡ Yksitahoinen p-arvo < 0,001 koskien dulaglutidin vertailukelpoisuutta (non-inferiority) verrattuna liraglutidiin, arvioitu pelkästään HbA1c-arvon suhteen
# p < 0,05, dulaglutidihoitoryhmä verrattuna liraglutidiin
+ Liraglutidihoitoon satunnaistettujen potilaiden aloitusannos oli 0,6 mg/vrk. Viikon 1 jälkeen potilaiden annos suurennettiin tasolle 1,2 mg/vrk ja viikolla 2 tasolle 1,8 mg/vrk
a HbA1c -arvo 7,0 % (DCCT) vastaa 53,0 mmol/mol (IFCC) (keskimääräinen verensokeri: 8,6 mmol/l)
b HbA1c -arvo 6,5 % (DCCT) vastaa 47,5 mmol/mol (IFCC) (keskimääräinen verensokeri: 7,8 mmol/l)
Dulaglutidi-ryhmässä (1,5 mg) dokumentoitujen oireisten hypoglykemioiden määrä oli 0,12 tapahtumaa/potilas/vuosi ja liraglutidiryhmässä 0,29 tapahtumaa/potilas/vuosi. Vaikeaa hypoglykemiaa ei havaittu.
Yhdistelmähoito metformiinin ja sulfonyyliurean kanssa
Aktiivikontrolloidussa 78 viikkoa kestäneessä tutkimuksessa dulaglutidihoitoa verrattiin glargininsuliiniin. Molempia hoitoja käytettiin metformiinin ja sulfonyyliurean lisänä. 52 viikon kohdalla Trulicity 1,5 mg pienensi HbA1c-arvoja tehokkaammin kuin glargininsuliini, ja vaikutus säilyi viikolle 78 asti. Trulicity 0,75 mg pienensi HbA1c-arvoja vähintään samanveroisesti kuin glargininsuliini. Trulicity 1,5 mg -ryhmässä merkitsevästi suurempi prosentuaalinen osuus potilaista saavutti HbA1c-tavoitearvon (< 7,0 % tai ≤ 6,5 %) viikoilla 52 ja 78 verrattuna glargininsuliiniin.
Taulukko 5. Tulokset 78 viikon aktiivikontrolloidusta tutkimuksesta, jossa kahta dulaglutidiannosta verrattiin glargininsuliiniin
| HbA1c-lähtöarvo | HbA1c-arvon keskimääräinen muutos | HbA1c-tavoitearvon saavuttaneet potilaat | Paastoverensokerin muutos | Painon muutos | ||
| (%) | (%) | < 7,0 % (%)a | ≤ 6,5 % (%)b | (mmol/l) | (kg) | |
| 52 viikkoa | ||||||
| Dulaglutidi 1,5 mg kerran viikossa (n = 273) | 8,18 | -1,08†† | 53,2## | 27,0## | -1,50 | -1,87## |
| Dulaglutidi 0,75 mg kerran viikossa (n = 272) | 8,13 | -0,76† | 37,1 | 22,5# | -0,87## | -1,33## |
| Glargininsuliini+ kerran vuorokaudessa (n = 262) | 8,10 | -0,63 | 30,9 | 13,5 | -1,76 | 1,44 |
| 78 viikkoa | ||||||
| Dulaglutidi 1,5 mg kerran viikossa (n = 273) | 8,18 | -0,90†† | 49,0## | 28,1## | -1,10# | -1,96## |
| Dulaglutidi 0,75 mg kerran viikossa (n = 272) | 8,13 | -0,62† | 34,1 | 22,1 | -0,58## | -1,54## |
| Glargininsuliini+ kerran vuorokaudessa (n = 262) | 8,10 | -0,59 | 30,5 | 16,6 | -1,58 | 1,28 |
† monivertailukorjattu yksitahoinen p-arvo < 0,025 koskien dulaglutidin vertailukelpoisuutta (non-inferiority); †† monivertailukorjattu yksitahoinen p-arvo < 0,025 koskien dulaglutidin paremmuutta verrattuna glargininsuliiniin, arvioitu pelkästään HbA1c-arvon suhteen
# p < 0,05, ## p < 0,001, dulaglutidihoitoryhmä verrattuna glargininsuliiniin
+ Glargininsuliiniannoksia muutettiin käyttämällä algoritmia, jossa plasman paastoglukoosin tavoitearvo oli < 5,6 mmol/l
a HbA1c -arvo 7,0 % (DCCT) vastaa 53,0 mmol/mol (IFCC) (keskimääräinen verensokeri: 8,6 mmol/l)
b HbA1c -arvo 6,5 % (DCCT) vastaa 47,5 mmol/mol (IFCC) (keskimääräinen verensokeri: 7,8 mmol/l)
Dokumentoitujen oireisten hypoglykemioiden määrä oli 1,67 (dulaglutidi 1,5 mg), 1,67 (dulaglutidi 0,75 mg) ja 3,02 (glargininsuliini) tapahtumaa/potilas/vuosi. Sekä Trulicity 1,5 mg -ryhmässä että glargininsuliiniryhmässä havaittiin kaksi vaikeaa hypoglykemiatapausta.
Yhdistelmähoito sulfonyyliurean kanssa
Dulaglutidin turvallisuutta ja tehoa yhdistettynä sulfonyyliureaan tutkittiin 24 viikkoa kestäneessä lumekontrolloidussa tutkimuksessa. Trulicity-hoito 1,5 mg yhdistettynä glimepiridiin pienensi tilastollisesti merkitsevästi HbA1c-arvoja enemmän kuin lumelääke yhdistettynä glimepiridiin 24 viikon kohdalla. Trulicity 1,5 mg -ryhmässä merkitsevästi suurempi prosentuaalinen osuus potilaista saavutti HbA1c-tavoitearvon < 7,0 % ja ≤ 6,5 % viikolla 24 verrattuna lumeryhmään.
Taulukko 6. Tulokset 24 viikon lumekontrolloidusta tutkimuksesta, jossa dulaglutidi lisättiin glimepiridiin
| HbA1c-lähtöarvo | HbA1c-arvon keskimääräinen muutos | HbA1c-tavoitearvon saavuttaneet potilaat | Paasto-verensokerin muutos | Painon muutos | ||||
| (%) | (%) | < 7,0 % (%)a | ≤ 6,5 % (%)b | (mmol/l) | (kg) | |||
| 24 viikkoa | ||||||||
| Dulaglutidi 1,5 mg kerran viikossa (n = 239) | 8,39 | -1,38‡‡ | 55,3‡‡ | 40,0** | -1,70‡‡ | -0,91 | ||
| Lume (n = 60) | 8,39 | -0,11 | 18,9 | 9,4 | 0,16 | -0,24 | ||
‡‡ p < 0,001 koskien dulaglutidin paremmuutta verrattuna lumeeseen, yleinen tyypin 1 virhe on kontrolloitu
** p < 0,001 dulaglutidihoitoryhmä verrattuna lumeeseen
a HbA1c -arvo 7,0 % (DCCT) vastaa 53,0 mmol/mol (IFCC) (keskimääräinen verensokeri: 8,6 mmol/l)
b HbA1c -arvo 6,5 % (DCCT) vastaa 47,5 mmol/mol (IFCC) (keskimääräinen verensokeri: 7,8 mmol/l)
Dokumentoitujen oireisten hypoglykemioiden määrä oli 0,90 (dulaglutidi 1,5 mg) ja 0,04 (lume) tapahtumaa/potilas/vuosi. Dulaglutidi- tai lumeryhmissä ei havaittu vaikeita hypoglykemiatapahtumia.
Yhdistelmähoito SGLT2:n estäjän ja mahdollisesti myös metformiinin kanssa
24 viikkoa kestäneessä lumekontrolloidussa tutkimuksessa arvioitiin dulaglutidin turvallisuutta ja tehoa, kun sitä käytettiin natriumin- ja glukoosinkuljettajaproteiini 2:n (SGLT2:n) estäjähoidon lisänä (96 %:ssa tapauksista metformiinin kanssa ja 4 %:ssa ilman metformiinia). Trulicity 0,75 mg- tai Trulicity 1,5 mg -hoidon käyttö yhdessä SGLT2:n estäjän kanssa pienensi HbA1c-arvoa tilastollisesti merkitsevästi verrattuna lumelääkkeen ja SGLT2:n estäjän yhdistelmään viikolla 24. HbA1c-tavoitearvot (< 7,0 % ja ≤ 6,5 %) viikolla 24 saavuttaneiden potilaiden prosenttiosuus oli sekä Trulicity 0,75 mg- että Trulicity 1,5 mg -ryhmässä merkitsevästi suurempi kuin lumeryhmässä.
Taulukko 7. Tulokset 24 viikon pituisessa lumekontrolloidussa tutkimuksessa, jossa dulaglutidia käytettiin SGLT2:n estäjähoidon lisänä
| HbA1c-lähtöarvo | HbA1c-arvon keskimuutos | HbA1c-tavoitearvon saavuttaneet potilaat | Paastoverensokerin muutos | Painon muutos | ||||
| (%) | (%) | < 7,0 %^ (%)a | ≤ 6,5 % (%)b | (mmol/l) | (kg) | |||
| 24 viikkoa | ||||||||
| Dulaglutidi 0,75 mg kerran viikossa (n = 141) | 8,05 | -1,19‡‡ | 58,8‡‡ | 38,9** | -1,44 | -2,6 | ||
| Dulaglutidi 1,5 mg kerran viikossa (n = 142) | 8,04 | -1,33‡‡ | 67,4‡‡ | 50,8** | -1,77 | -3,1 | ||
| Lume (n = 140) | 8,05 | -0,51 | 31,2 | 14,6 | -0,29 | -2,3 | ||
‡‡ p < 0,001 dulaglutidin paremmuudelle lumelääkkeeseen nähden, kun tyypin I kokonaisvirhe kontrolloitiin
** p < 0,001 dulaglutidihoitoryhmälle verrattuna lumelääkkeeseen
^ Potilaita, jotka lopettivat satunnaistetun hoidon ennen 24 viikkoa tarkasteltiin potilaina, jotka eivät saavuttaneet tavoitearvoa
a HbA1c -arvo 7,0 % (DCCT) vastaa 53,0 mmol/mol (IFCC) (keskimääräinen verensokeri: 8,6 mmol/l)
b HbA1c -arvo 6,5 % (DCCT) vastaa 47,5 mmol/mol (IFCC) (keskimääräinen verensokeri: 7,8 mmol/l)
Dulaglutidi 0,75 mg -hoidon yhteydessä raportoitiin 0,15 dokumentoitua oireista hypoglykemiatapausta/potilas/vuosi, dulaglutidi 1,5 mg -hoidon yhteydessä 0,16 tapausta/potilas/vuosi ja lumehoidon yhteydessä 0,12 tapausta/potilas/vuosi. Yksi potilas ilmoitti kokeneensa vaikeaa hypoglykemiaa dulaglutidi 0,75 mg -hoidon ja SGLT2:n estäjän yhdistelmää käyttäessään. Dulaglutidi 1,5 mg -ryhmässä ja lumeryhmässä ei ilmoitettu vaikeita hypoglykemioita.
Yhdistelmähoito metformiinin ja pioglitatsonin kanssa
Lume- ja aktiivikontrolloidussa (eksenatidi kahdesti vuorokaudessa) tutkimuksessa Trulicity 1,5 mg ja 0,75 mg pienensivät HbA1c-arvoja tehokkaammin kuin lume ja eksenatidi (molemmat yhdessä metformiinin ja pioglitatsonin kanssa), ja merkitsevästi suurempi osa potilaista saavutti HbA1c-tavoitearvot (< 7,0 % tai ≤ 6,5 %).
Taulukko 8. Tulokset 52 viikon aktiivikontrolloidusta tutkimuksesta, jossa kahta dulaglutidiannosta verrattiin eksenatidiin
| HbA1c-lähtöarvo | HbA1c-arvon keskimääräinen muutos | HbA1c-tavoitearvon saavuttaneet potilaat | Paastoverensokerin muutos | Painon muutos | ||||||||
| (%) | (%) | < 7,0 % (%)a | ≤ 6,5 % (%)b | (mmol/l) | (kg) | |||||||
| 26 viikkoa | ||||||||||||
| Dulaglutidi 1,5 mg kerran viikossa (n = 279) | 8,10 | -1,51‡‡,†† | 78,2**,## | 62,7**,## | -2,36**,## | -1,30** | ||||||
| Dulaglutidi 0,75 mg kerran viikossa (n = 280) | 8,05 | -1,30‡‡/†† | 65,8**/## | 53,2**/## | -1,90**/## | 0,20*/## | ||||||
| Lume (n = 141) | 8,06 | -0,46 | 42,9 | 24,4 | -0,26 | 1,24 | ||||||
| Eksenatidi+ 10 mikrog kahdesti vuorokaudessa (n = 276) | 8,07 | -0,99 | 52,3 | 38,0 | -1,35 | -1,07 | ||||||
| 52 viikkoa | ||||||||||||
| Dulaglutidi 1,5 mg kerran viikossa (n = 279) | 8,10 | -1,36†† | 70,8## | 57,2## | -2,04## | -1,10 | ||||||
| Dulaglutidi 0,75 mg kerran viikossa (n = 280) | 8,05 | -1,07†† | 59,1# | 48,3## | -1,58# | 0,44# | ||||||
| Eksenatidi+ 10 mikrog kahdesti vuorokaudessa (n = 276) | 8,07 | -0,80 | 49,2 | 34,6 | -1,03 | -0,80 | ||||||
†† monivertailukorjattu yksitahoinen p-arvo < 0,025 koskien dulaglutidin paremmuutta verrattuna eksenatidiin, arvioitu pelkästään HbA1c-arvon suhteen
‡‡ monivertailukorjattu yksitahoinen p-arvo < 0,001 koskien dulaglutidin paremmuutta verrattuna lumeeseen, arvioitu pelkästään HbA1c-arvon suhteen
* p < 0,05, ** p < 0,001, dulaglutidihoitoryhmä verrattuna lumeeseen
* p < 0,05, ## p < 0,001, dulaglutidihoitoryhmä verrattuna eksenatidiin
+ Ensimmäisten 4 viikon ajan eksenatidiannos oli 5 mikrog kahdesti vuorokaudessa ja sen jälkeen 10 mikrog kahdesti vuorokaudessa
a HbA1c -arvo 7,0 % (DCCT) vastaa 53,0 mmol/mol (IFCC) (keskimääräinen verensokeri: 8,6 mmol/l)
b HbA1c -arvo 6,5 % (DCCT) vastaa 47,5 mmol/mol (IFCC) (keskimääräinen verensokeri: 7,8 mmol/l)
Dokumentoitujen oireisten hypoglykemioiden määrä oli 0,19 (dulaglutidi 1,5 mg), 0,14 (dulaglutidi 0,75 mg) ja 0,75 (eksenatidi kahdesti vuorokaudessa) tapahtumaa/potilas/vuosi. Dulaglutidiryhmissä ei havaittu vaikeita hypoglykemiatapahtumia. Eksenatidia kahdesti vuorokaudessa saaneessa ryhmässä havaittiin kaksi vaikeaa hypoglykemiatapahtumaa.
Yhdistelmähoito perusinsuliinin kanssa metformiinilla tai ilman
28 viikon lumekontrolloidussa tutkimuksessa arvioitiin Trulicity-valmisteen (1,5 mg) ja lumelääkkeen vaikutusta glukoositasapainoon ja turvallisuuteen, kun ne oli lisätty glargin-perusinsuliiniin (88 %:lla oli metformiini ja 12 %:lla ei ollut). Glargininsuliinin annoksen optimoimiseksi molemmissa ryhmissä insuliiniannos titrattiin siten, että saavutettiin plasman paastoglukoosiarvo 5,6 mmol/l. Lumeryhmän potilaiden keskimääräinen glargininsuliinin lähtötaso oli 37 yksikköä/päivä ja Trulicity (1,5 mg) -ryhmän potilaiden 41 yksikköä/päivä. Alkuperäinen glargininsuliinin annos väheni 20 % potilailla, joiden HbA1c oli < 8,0 %. 28 viikon hoidon jälkeen annos oli lumeryhmässä 65 yksikköä/päivä ja Trulicity (1,5 mg) -ryhmässä 51 yksikköä/päivä. 28 viikon kohdalla hoito kerran viikossa annosteltavalla Trulicityllä 1,5 mg johti tilastollisesti merkitsevään HbA1c-arvon laskuun verrattuna lumeeseen ja merkitsevästi suurempi prosentuaalinen osuus potilaista saavutti HbA1c-tavoitearvon < 7,0 % ja ≤ 6,5 % (taulukko 9).
Taulukko 9. Tulokset 28 viikon tutkimuksesta, jossa dulaglutidia verrattiin lumeeseen, molemmat oli yhdistetty glargininsuliiniin
HbA1c-
| HbA1c- arvon keskimääräinen muutos | HbA1c- tavoitearvon saavuttaneet potilaat | Paastoverensokerin muutos | Painon muutos | ||||
| (%) | (%) | < 7,0 % (%)a | ≤ 6,5 % (%)b | (mmol/l) | (kg) | |||
| 28 viikkoa | ||||||||
| Dulaglutidi 1,5 mg kerran viikossa ja glargininsuliini (n = 150) | 8,41 | -1,44‡‡ | 66,7‡‡ | 50,0** | -2,48‡‡ | -1,91‡‡ | ||
| Lume kerran viikossa ja glargininsuliini (n = 150) | 8,32 | -0,67 | 33,3 | 16,7 | -1,55 | 0,50 | ||
‡‡ p < 0,001 koskien dulaglutidin paremmuutta verrattuna lumeeseen, yleinen tyypin 1 virhe on kontrolloitu
** p < 0,001 dulaglutidihoitoryhmä verrattuna lumeeseen
a HbA1c -arvo 7,0 % (DCCT) vastaa 53,0 mmol/mol (IFCC) (keskimääräinen verensokeri: 8,6 mmol/l)
b HbA1c -arvo 6,5 % (DCCT) vastaa 47,5 mmol/mol (IFCC) (keskimääräinen verensokeri: 7,8 mmol/l)
Dokumentoitujen oireisten hypoglykemioiden määrä dulaglutidi (1,5 mg) ja glarginryhmässä oli 3,38 tapahtumaa/potilas/vuosi verrattuna lume- ja glarginryhmään, jossa määrä oli 4,38 tapahtumaa/potilas/vuosi. Yksi potilas raportoi vaikean hypoglykemiatapahtuman dulaglutidi (1,5 mg) ja glarginyhdistelmäryhmässä, ja lumeryhmässä sellaisia ei havaittu.
Ateriainsuliinia sisältävä yhdistelmähoito metformiinin kanssa tai ilman
Tässä tutkimuksessa potilaat, joiden hoitoon kuului 1 tai 2 insuliinipistosta vuorokaudessa ennen tutkimukseen osallistumista, lopettivat tutkimusta edeltävän insuliinihoidon. Potilaat satunnaistettiin saamaan dulaglutidihoitoa kerran viikossa tai glargininsuliinia kerran vuorokaudessa yhdessä ateriainsuliinin (lisproinsuliini) kanssa (kolmesti vuorokaudessa) joko metformiinin kanssa tai ilman. Viikon 26 kohdalla Trulicity-hoidot (1,5 mg ja 0,75 mg) pienensivät HbA1c-arvoa tehokkaammin kuin glargininsuliini. Vaikutus säilyi viikolle 52 asti. Suurempi prosentuaalinen osuus potilaista saavutti HbA1c-tavoitearvot (< 7,0 % tai ≤ 6,5 %) viikon 26 kohdalla ja tavoitearvon < 7,0 % viikon 52 kohdalla verrattuna glargininsuliiniryhmään.
Taulukko 10. Tulokset 52 viikon aktiivikontrolloidusta tutkimuksesta, jossa kahta dulaglutidiannosta verrattiin glargininsuliiniin
| HbA1c-lähtöarvo | HbA1c-arvon keskimääräinen muutos | HbA1c-tavoitearvon saavuttaneet potilaat | Paastoverensokerin muutos | Painon muutos | |||
| (%) | (%) | < 7,0 % (%)a | ≤ 6,5 % (%)b | (mmol/l) | (kg) | ||
| 26 viikkoa | |||||||
| Dulaglutidi 1,5 mg kerran viikossa (n = 295) | 8,46 | -1,64†† | 67,6# | 48,0# | -0,27## | -0,87## | |
| Dulaglutidi 0,75 mg kerran viikossa (n = 293) | 8,40 | -1,59†† | 69,0# | 43,0 | 0,22## | 0,18## | |
| Glargininsuliini+ kerran vuorokaudessa (n = 296) | 8,53 | -1,41 | 56,8 | 37,5 | -1,58 | 2,33 | |
| 52 viikkoa | |||||||
| Dulaglutidi 1,5 mg kerran viikossa (n = 295) | 8,46 | -1,48†† | 58,5# | 36,7 | 0,08## | -0,35## | |
| Dulaglutidi 0,75 mg kerran viikossa (n = 293) | 8,40 | -1,42†† | 56,3 | 34,7 | 0,41## | 0,86## | |
| Glargininsuliini+ kerran vuorokaudessa (n = 296) | 8,53 | -1,23 | 49,3 | 30,4 | -1,01 | 2,89 | |
†† monivertailukorjattu yksitahoinen p-arvo < 0,025 koskien dulaglutidin paremmuutta verrattuna glargininsuliiniin, arvioitu pelkästään HbA1c-arvon suhteen
# p < 0,05, ## p < 0,001, dulaglutidihoitoryhmä verrattuna glargininsuliiniin
+ Glargininsuliiniannoksia muutettiin käyttämällä algoritmia, jossa plasman paastoglukoosin tavoitearvo oli < 5,6 mmol
a HbA1c -arvo 7,0 % (DCCT) vastaa 53,0 mmol/mol (IFCC) (keskimääräinen verensokeri: 8,6 mmol/l)
b HbA1c -arvo 6,5 % (DCCT) vastaa 47,5 mmol/mol (IFCC) (keskimääräinen verensokeri: 7,8 mmol/l)
Dokumentoitujen oireisten hypoglykemioiden määrä oli 31,06 (dulaglutidi 1,5 mg), 35,66 (dulaglutidi 0,75 mg) ja 40,95 (glargininsuliini) tapahtumaa/potilas/vuosi. Vaikeaa hypoglykemiaa ilmoitettiin dulaglutidi 1,5 mg -ryhmässä 10 potilaalla, dulaglutidi 0,75 mg -ryhmässä 7 potilaalla ja glargininsuliiniryhmässä 15 potilaalla.
Veren paastoglukoosi
Dulaglutidihoito pienensi veren paastoglukoosipitoisuutta merkitsevästi lähtötilanteesta. Valtaosa veren paastoglukoosipitoisuuteen kohdistuvasta vaikutuksesta ilmaantui viikkoon 2 mennessä. Paastoglukoosia parantava vaikutus säilyi pisimmän tutkimuksen keston ajan (104 viikkoa).
Aterianjälkeinen glukoosipitoisuus
Dulaglutidihoito pienensi merkitsevästi aterianjälkeistä keskimääräistä glukoosipitoisuutta lähtötilanteeseen verrattuna (muutokset lähtötilanteesta ensisijaiseen aikapisteeseen olivat -1,95 - -4,23 mmol/l).
Beetasolutoiminta
Kliiniset dulaglutiditutkimukset osoittavat beetasolutoiminnan paranevan, kun mittarina käytetään beetasolutoiminnan homeostaasimallia (HOMA2-%B). Beetasolutoimintaan kohdistuva vaikutus säilyi koko pisimmän tutkimuksen keston ajan (104 viikkoa).
Paino
Trulicity 1,5 mg -hoitoon liittyi pitkäkestoinen painonlasku, joka säilyi tutkimusten keston ajan (lähtötilanteesta viimeiseen ajankohtaan -0,35 - -2,90 kg). Trulicity 0,75 mg -hoidossa paino muuttui 0,86 - -2,63 kg. Painonlaskua havaittiin dulaglutidihoitoa saavilla potilailla riippumatta pahoinvoinnista, vaikkakin paino laski numeerisesti enemmän pahoinvointiryhmässä.
Potilaan ilmoittamat tulokset
Dulaglutidi paransi kokonaishoitotyytyväisyyttä merkitsevästi kahdesti vuorokaudessa annosteltuun eksenatidiin verrattuna. Lisäksi hyperglykemiaa ja hypoglykemiaa havaittiin merkitsevästi vähemmän kuin kahdesti vuorokaudessa annostellussa eksenatidihoidossa.
Verenpaine
Dulaglutidin vaikutusta verenpaineeseen arvioitiin tutkimuksessa ambulatorisen verenpaineseurannan avulla 755:llä tyypin 2 diabetespotilaalla. Dulaglutidihoito alensi systolista verenpainetta viikolla 16 (ero lumelääkkeeseen -2,8 mmHg). Diastolisessa verenpaineessa ei ollut eroa. Systolisen ja diastolisen verenpaineen suhteen saatiin samankaltaisia tuloksia tutkimuksen lopussa (viikolla 26).
Sydän- ja verisuonivaikutusten arviointi
Meta-analyysi faasin 2 ja 3 tutkimuksista
Faasin 2 ja 3 rekisteröintitutkimusten meta-analyysissä yhteensä 51 potilasta (dulaglutidi: 26 [N = 3885]; kaikki vertailuhoidot: 25 [N = 2125]) koki vähintään yhden sydän- ja verisuonitapahtuman (sydän- ja verisuonikuolema, ei-fataali sydäninfarkti tai ei-fataali aivoinfarkti tai sairaalahoito epästabiilin angina pectoriksen takia). Tulokset osoittivat, että dulaglutidi ei suurentanut sydän- ja verisuonitapahtuman riskiä kontrollihoitoihin verrattuna (riskisuhde: 0,57; lv: [0,30; 1,10]).
Sydän- ja verisuonivaikutusten päätetapahtumatutkimus
Trulicity-valmisteen pitkäaikainen sydän- ja verisuonivaikutusten päätetapahtumatutkimus oli lumelääkekontrolloitu, kaksoissokkoutettu kliininen tutkimus. Tyypin 2 diabetespotilaat saivat satunnaistetusti joko 1,5 mg Trulicity-valmistetta (4949) tai lumelääkettä (4952), molemmat tavanomaisen tyypin 2 diabeteksen hoidon lisäksi (0,75 mg annosta ei käytetty tässä tutkimuksessa). Seuranta-ajan mediaani oli 5,4 vuotta.
Tutkittavien keskimääräinen ikä oli 66,2 vuotta, keskimääräinen BMI 32,3 kg/m², ja potilaista 46,3 % oli naisia. 3114 (31,5 %) potilaalla oli todettu sydän- ja verisuonisairaus. HbA1c–arvon lähtotason mediaani oli 7,2 %. Trulicity-valmisteella hoidettuihin potilaisiin kuului ≥ 65 vuotiaita potilaita (n = 2619), ≥ 75 vuotiaita potilaita (n = 484) sekä potilaita, joilla oli lievä (n = 2435), kohtalainen (n = 1031) tai vaikea (n = 50) munuaisten vajaatoiminta.
Ensisijaisena päätetapahtumana oli aika satunnaistamisesta ensimmäiseen mihin tahansa vakavaan sydän- ja verisuonihaittatapahtumaan (major adverse cardiovascular events, MACE): sydän- ja verisuonikuolema, ei-fataali sydäninfarkti tai ei-fataali aivoinfarkti. Trulicity oli parempi verrattuna lumelääkkeeseen MACE-tapahtumien ennaltaehkäisyssä (kuva 1). Jokainen MACE-tapahtuman osatekijä vaikutti vakavien sydän- ja verisuonihaittatapahtumien vähenemiseen, kuten on esitetty kuvassa 2.
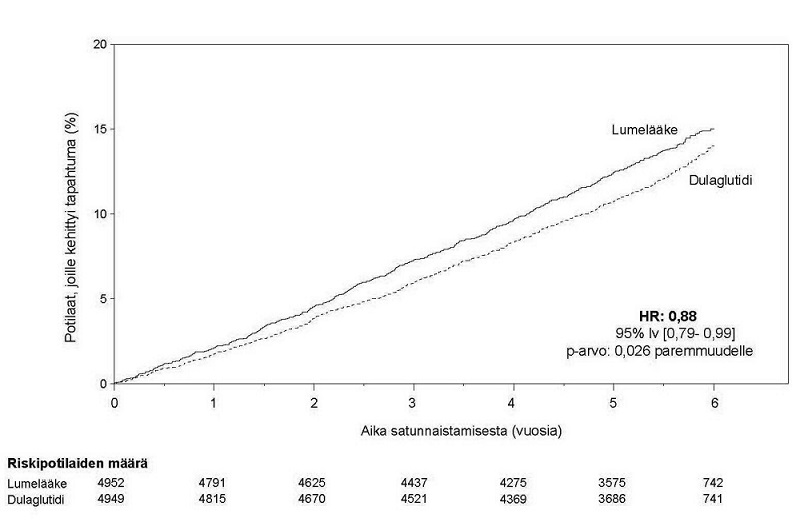
Kuva 1. Kaplan-Meier –kuvaaja, aika ensimmäiseen yhdistettyyn päätetapahtumaan: sydän- ja verisuonikuolema, ei-fataali sydäninfarkti tai ei-fataali aivoinfarkti, dulaglutidin pitkäaikaisessa sydän- ja verisuonivaikutusten päätetapahtumatutkimuksessa
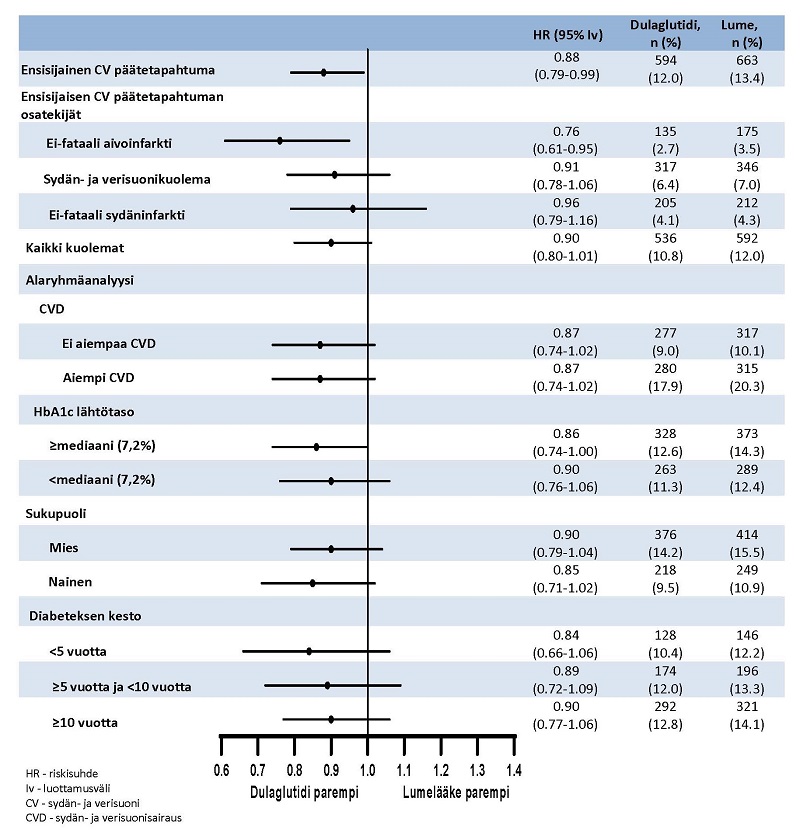
Kuva 2. Forest plot -analyysi yksittäisistä sydän- ja verisuonitapahtumatyypeistä, kokonaiskuolemista sekä yhdenmukaisesta vaikutuksesta eri alaryhmissä ensisijaisen päätetapahtuman suhteen.
Trulicity-valmisteella havaittiin HbA1c-tasojen merkitsevä ja pysyvä lasku lähtötilanteesta 60 kuukauteen asti verrattuna lumelääkkeeseen, lisättynä tavanomaiseen hoitoon (-0,29 % vs 0,22 %; hoitojen arvioitu ero ‑0,51 % [-0,57; -0,45]; p < 0,001). Trulicity-ryhmässä oli merkitsevästi vähemmän potilaita, jotka saivat glukoositasapainon ylläpitämiseen lisähoitoa verrattuna lumelääkeryhmään (Trulicity: 2086 [42,2 %]; lumelääke: 2825 [57,0 %]; p < 0,001).
Dulaglutidin (4,5 mg, 3 mg ja 1,5 mg) ja metformiinin yhdistelmähoito
Kerran viikossa annettujen 3 mg:n ja 4,5 mg:n dulaglutidiannosten turvallisuutta ja tehoa verrattiin kerran viikossa annettuihin 1,5 mg:n dulaglutidiannoksiin 52 viikon pituisessa tutkimuksessa, jossa dulaglutidia käytettiin metformiinin lisänä. Viikon 36 kohdalla Trulicity 3 mg ja Trulicity 4,5 mg laskivat HbA1c-arvoa ja painoa tehokkaammin kuin Trulicity 1,5 mg. Trulicity 3 mg- ja Trulicity 4,5 mg -ryhmissä suurempi prosenttiosuus potilaista saavutti HbA1c-tavoitearvon < 7,0 % tai ≤ 6,5 % viikolla 36. Niiden potilaiden osuus, joiden paino laski ≥ 5 % lähtötilanteesta, oli Trulicity 1,5 mg -ryhmässä 31 %, Trulicity 3 mg -ryhmässä 40 % ja Trulicity 4,5 mg -ryhmässä 49 %. Vaikutukset säilyivät viikolle 52 asti.
Taulukko 11. Tulokset aktiivikontrolloidussa tutkimuksessa, jossa verrattiin kolmea eri dulaglutidiannosta
| HbA1c-lähtöarvo | HbA1c-arvon keskimääräinen muutos | HbA1c-tavoitearvon saavuttaneet potilaat | Paastoverensokerin muutos | Painon muutos
| |||||||||
| (%) | (%) | < 7,0 % (%)a | ≤ 6,5 % (%)b | (mmol/l) | (kg) | ||||||||
| 36 viikkoa | |||||||||||||
| Dulaglutidi 1,5 mg kerran viikossa (n = 612) | 8,64 | -1,53 | 57,0 | 38,1 | -2,45 | -3,1
| |||||||
| Dulaglutidi 3 mg kerran viikossa (n = 616) | 8,63 | -1,71# | 64,7# | 48,4‡‡ | -2,66 | -4,0#
| |||||||
| Dulaglutidi 4,5 mg kerran viikossa (n = 614) | 8,64 | -1,87## | 71,5# | 51,7‡‡ | -2,90# | -4,7##
| |||||||
| 52 viikkoa | |||||||||||||
| Dulaglutidi 1,5 mg kerran viikossa (n = 612) | 8,64 | -1,52 | 58,6 | 40,4 | -2,39 | -3,5 | |||||||
| Dulaglutidi 3 mg kerran viikossa (n = 616) | 8,63 | -1,71‡ | 65,4‡ | 49,2‡ | -2,70‡ | -4,3‡ | |||||||
| Dulaglutidi 4,5 mg kerran viikossa (n = 614) | 8,64 | -1,83‡‡ | 71,7‡‡ | 51,3‡‡ | -2,92‡‡ | -5,0‡‡ | |||||||
# p < 0,05, ## p < 0,001 paremmuudelle verrattuna 1,5 mg:n dulaglutidiannokseen; p-arvot korjattu ja tyypin I kokonaisvirhe kontrolloitu
‡ p < 0,05, ‡‡ p < 0,001 verrattuna 1,5 mg:n dulaglutidiannokseen
a HbA1c -arvo 7,0 % (DCCT) vastaa 53,0 mmol/mol (IFCC) (keskimääräinen verensokeri: 8,6 mmol/l)
b HbA1c -arvo 6,5 % (DCCT) vastaa 47,5 mmol/mol (IFCC) (keskimääräinen verensokeri: 7,8 mmol/l)
Tulokset koskevat hoidonaikaista vaikutusta (analyysi perustuu toistomittausten sekamalliin tai longitudinaaliseen logistiseen regressioon).
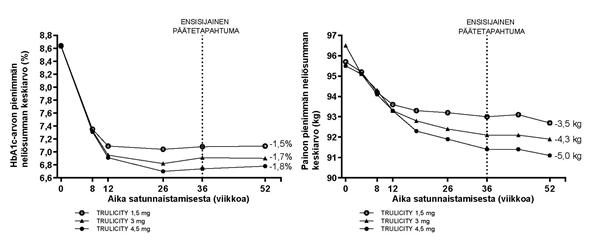
Kuva 3. HbA1c-arvon keskimuutos (%) ja painon keskimuutos (kg) lähtötilanteesta viikolle 52
Dulaglutidi 1,5 mg -hoidon yhteydessä raportoitiin 0,07 dokumentoitua oireista hypoglykemiatapausta/potilas/vuosi, dulaglutidi 3 mg -hoidon yhteydessä 0,05 tapausta/potilas/vuosi ja dulaglutidi 4,5 mg -hoidon yhteydessä 0,07 tapausta/potilas/vuosi. Vaikeaa hypoglykemiaa ilmoitettiin yhdellä potilaalla dulaglutidi 1,5 mg -ryhmässä, ei yhdelläkään potilaalla dulaglutidi 3 mg -ryhmässä ja yhdellä potilaalla dulaglutidi 4,5 mg -ryhmässä.
Erityisryhmät
Käyttö munuaisten vajaatoimintapotilailla
52 viikon pituisessa tutkimuksessa 1,5 mg:n ja 0,75 mg:n Trulicity-annoksia verrattiin titratun glargininsuliinin käyttöön aterioilla otetun lisproinsuliinin lisänä keskivaikeaa ja vaikeaa munuaisten vajaatoimintaa sairastavien potilaiden hoidossa (eGFR [CKD-EPI-kaava] < 60 ja ≥ 15 ml/min/1,73 m2), ja hoitojen vaikutusta glukoositasapainoon ja niiden turvallisuutta. Potilaat lopettivat aiemman insuliinihoitonsa satunnaistamisen yhteydessä. Lähtötilanteessa eGFR-arvon keskiarvo oli koko populaatiossa 38 ml/min/1,73 m2, ja 30 %:lla potilaista eGFR-arvo oli < 30 ml/min/1,73 m2.
26 viikon kohdalla todettiin, että sekä 1,5 mg:n että 0,75 mg:n Trulicity-annokset alensivat HbA1c-arvoa vähintään yhtä tehokkaasti kuin glargininsuliini. Vaikutus säilyi viikkoon 52 asti. HbA1c-tavoitearvon < 8,0 % viikoilla 26 ja 52 saavuttaneiden potilaiden prosenttiosuus oli samaa luokkaa sekä molempia dulaglutidiannoksia saaneilla että glargininsuliinia saaneilla potilailla.
Taulukko 12. Tulokset 52 viikon pituisessa aktiivikontrolloidussa tutkimuksessa, jossa kahta dulaglutidiannosta verrattiin glargininsuliiniin (keskivaikeaa tai vaikeaa kroonista munuaistautia sairastavilla potilailla)
| HbA1c-lähtöarvo | HbA1c-arvon keskimääräinen muutos | HbA1c-tavoitearvon saavuttaneet potilaat | Paasto-verensokerinmuutos | Painon muutos | ||||||
| (%) | (%) | < 8,0 % (%)a | (mmol/l) | (kg) | ||||||
| 26 viikkoa | ||||||||||
| Dulaglutidi 1,5 mg kerran viikossa (n = 192) | 8,60 | -1,19† | 78,3 | 1,28## | -2,81## | |||||
| Dulaglutidi 0,75 mg kerran viikossa (n = 190) | 8,58 | -1,12† | 72,6 | 0,98## | -2,02## | |||||
| Glargininsuliini+ kerran vuorokaudessa (n = 194) | 8,56 | -1,13 | 75,3 | -1,06 | 1,11 | |||||
| 52 viikkoa | ||||||||||
| Dulaglutidi 1,5 mg kerran viikossa (n = 192) | 8,60 | -1,10† | 69,1 | 1,57## | -2,66## | |||||
| Dulaglutidi 0,75 mg kerran viikossa (n = 190) | 8,58 | -1,10† | 69,5 | 1,15## | -1,71## | |||||
| Glargininsuliini+ kerran vuorokaudessa (n = 194) | 8,56 | -1,00 | 70,3 | -0,35 | 1,57 | |||||
† 1-tahoinen p-arvo < 0,025 dulaglutidin vertailukelpoisuus (non-inferiority) verrattuna glargininsuliiniin
## p < 0,001, kun dulaglutidihoitoryhmää verrattiin glargininsuliiniin
+ Glargininsuliiniannoksia muutettiin algoritmilla, jossa plasman paastoglukoosiarvon tavoitearvo oli ≤ 8,3 mmol/l
a HbA1c-arvo 8,0 % (DCCT) vastaa 63,9 mmol/mol (IFCC) (keskimääräinen verensokeri: 10,1 mmol/l)
Dulaglutidi 1,5 mg -hoidon yhteydessä dokumentoitiin 4,44 oireista hypoglykemiatapausta/potilas/vuosi, dulaglutidi 0,75 mg -hoidon yhteydessä 4,34 tapausta/potilas/vuosi ja glargininsuliinihoidon yhteydessä 9,62 tapausta/potilas/vuosi. Vaikeaa hypoglykemiaa ilmoitti dulaglutidi 1,5 mg -ryhmässä 0 potilasta, dulaglutidi 0,75 mg -ryhmässä 6 potilasta ja glargininsuliiniryhmässä 17 potilasta. Dulaglutidi-valmisteen turvallisuusprofiili munuaisten vajaatoimintapotilailla oli samanlainen kuin muissa Trulicity-tutkimuksissa.
Käyttö pediatrisilla potilailla
Dulaglutidin 0,75 mg ja 1,5 mg kerran viikossa annosten turvallisuutta ja tehoa vähintään 10-vuotiaille lapsille ja nuorille verrattiin lumelääkkeeseen pelkän ruokavalio- ja liikuntahoidon lisänä, metformiinin ja/tai perusinsuliinin kanssa tai ilman. Kaksoissokkoutettu lumekontrolloitu jakso kesti 26 viikkoa, minkä jälkeen lumelääkettä saaneet potilaat aloittivat 26 viikon avoimen hoidon dulaglutidilla 0,75 mg kerran viikossa ja potilaat, joille oli määrätty dulaglutidi, jatkoivat avoimesti dulaglutidia heille määrätyllä annoksella. Viikon 26 kohdalla dulaglutidi laski HbA1c-arvoa paremmin kuin lumelääke.
Taulukko 13. Glykeemiset tulokset vähintään 10-vuotiailla lapsipotilailla, joilla on tyypin 2 diabetes ja riittämätön hoitotasapaino ruokavaliosta ja liikunnasta huolimatta (metformiinin ja/tai perusinsuliinin kanssa tai ilman)
| HbA1c-lähtöarvo | HbA1c-arvon keskimääräinen muutos | HbA1c-tavoitearvon saavuttaneet potilaat | Paastoverensokerin keski-määräinen muutos | Painon keskimääräinen muutos | ||
| (%) | (%) | < 7,0 % (%)a | ≤ 6,5 % (%)b | (mmol/l) | (kg/m2) | |
| 26 viikkoa | ||||||
| Dulaglutidi (yhdistetty)c (n = 103) | 8,0 | -0,8## | 51,5## | 41,8‡‡ | -1,1## | -0,1 |
| Dulaglutidi 0,75 mg kerran viikossa (n = 51) | 7,9 | -0,6## | 54,9## | 43,1‡‡ | -0,7# | -0,2 |
| Dulaglutidi 1,5 mg kerran viikossa (n = 52) | 8,2 | -0,9## | 48,1## | 40,4‡‡ | -1,4## | -0,1 |
| Lume kerran viikossa (n = 51) | 8,1 | 0,6 | 13,7 | 9,8 | 1,0 | 0,0 |
| 52 viikkoad | ||||||
| Dulaglutidi (yhdistetty)c (n = 103) | 8,0 | -0,4 | 59,5 | 45,2 | -0,63 | 0,1 |
| Dulaglutidi 0,75 mg kerran viikossa (n = 51) | 7,9 | -0,2 | 65,0 | 55,0 | -0,21 | 0,0 |
| Dulaglutidi 1,5 mg kerran viikossa (n = 52) | 8,2 | -0,6 | 54,6 | 36,4 | -0,95 | 0,1 |
| Lume/dulaglutidi 0,75 mg kerran viikossae (n = 51) | 8,1 | -0,1 | 50,0 | 29,4 | 0,24 | -0,2 |
# p < 0,05, ## p < 0,001 paremmuudelle verrattuna lumelääkkeeseen; p-arvot korjattu ja tyypin I kokonaisvirhe kontrolloitu.
‡ p < 0,05, ‡‡ p < 0,001 paremmuudelle verrattuna lumelääkkeeseen.
a HbA1c -arvo 7,0 % (DCCT) vastaa 53,0 mmol/mol (IFCC) (keskimääräinen verensokeri: 8,6 mmol/l)
b HbA1c -arvo 6,5 % (DCCT) vastaa 47,5 mmol/mol (IFCC) (keskimääräinen verensokeri: 7,8 mmol/l)
c Yhdistetyt tulokset Trulicity 0,75 mg ja 1,5 mg. Kahden annoksen vertailu yhdessä ja erikseen lumelääkkeeseen, ennalta määritelty, tyypin I kokonaisvirhe kontrolloitu.
d Tehoarviot ensisijaisessa päätetapahtumassa (26 viikkoa) perustuvat hoito-arvioon, kun taas arviot avoimen jatko-ajan (52 viikkoa) lopussa perustuvat tehokkuusarvioon.
e Potilaat, jotka saivat lumelääkettä ensimmäisellä 26 viikon kaksoissokkojaksolla, aloittivat hoidon dulaglutidilla 0,75 mg kerran viikossa seuraavan 26 viikon avoimen jakson ajan.
Farmakokinetiikka
Imeytyminen
Kun tyypin 2 diabetespotilaille annetaan dulaglutidia ihon alle, huippupitoisuudet plasmassa saavutetaan 48 tunnin kuluessa. Keskimääräinen huippupitoisuus (Cmax) oli noin 114 ng/ml ja kokonaisaltistus (AUC) noin 14000 ngh/ml, kun useita 1,5 mg:n dulaglutidiannoksia oli annettu ihon alle tyypin 2 diabetespotilailla. Vakaan tilan pitoisuus plasmassa saavutettiin 2-4 viikon kuluessa, kun dulaglutidia (1,5 mg) annettiin kerran viikossa. Altistukset olivat samaa luokkaa, kun dulaglutidia annettiin kerta-annos (1,5 mg) ihon alle vatsaan, reiteen tai olkavarteen. Dulaglutidin absoluuttisen biologisen hyötyosuuden keskiarvot olivat 47 % (1,5 mg) ja 65 % (0,75 mg), kun dulaglutidia annettiin kerta-annos ihon alle. 3 mg:n ja 4,5 mg:n annosten absoluuttisten biologisten hyötyosuuksien arvioitiin olevan samankaltaisia kuin 1,5 mg:n annoksella, mutta niitä ei ole tutkittu spesifisesti. 0,75–4,5 milligramman annosalueella dulaglutidipitoisuus suurenee suunnilleen suhteessa annokseen.
Jakautuminen
Sentraalisen jakautumistilavuuden näennäinen keskiarvo populaatiossa oli 3,09 l ja perifeerisen jakautumistilavuuden näennäinen keskiarvo populaatiossa taas 5,98 l.
Biotransformaatio
Dulaglutidin oletetaan hajoavan aminohappokomponenteikseen yleisten proteiinikataboliareittien kautta.
Eliminaatio
Dulaglutidin puhdistuman näennäinen keskiarvo populaatiossa oli 0,142 l/h, ja eliminaation puoliintumisaika oli noin 5 vrk.
Erityisryhmät
Iäkkäät
Iällä ei ollut kliinisesti merkittävää vaikutusta dulaglutidin farmakokinetiikkaan eikä farmakodynamiikkaan.
Sukupuoli ja etninen tausta
Sukupuoli ja etninen tausta eivät vaikuttaneet kliinisesti merkittävästi dulaglutidin farmakokinetiikkaan.
Paino tai painoindeksi
Farmakokinetiikan analyysit ovat osoittaneet, että painolla tai painoindeksillä ja dulaglutidialtistuksella on tilastollisesti merkitsevä käänteinen suhde. Paino tai painoindeksi ei kuitenkaan vaikuttanut kliinisesti merkittävästi glukoositasapainoon.
Munuaisten vajaatoiminta
Dulaglutidin farmakokinetiikkaa arvioitiin kliinisen farmakologian tutkimuksessa. Farmakokinetiikka oli yleisesti ottaen samaa luokkaa terveillä tutkittavilla ja potilailla, joilla oli lievä, keskivaikea tai vaikea munuaisten vajaatoiminta (kreatiniinipuhdistuma < 30 ml/min), mukaan lukien (dialyysiä vaativa) loppuvaiheen munuaisten vajaatoiminta. Lisäksi 52 viikon pituisessa kliinisessä tutkimuksessa, johon osallistuneilla tyypin 2 diabetespotilailla oli keskivaikea tai vaikea munuaisten vajaatoiminta (eGFR [CKD-EPI-kaava] < 60 ja ≥ 15 ml/min/1,73 m2), kerran viikossa annettujen 0,75 mg:n ja 1,5 mg:n Trulicity-annosten farmakokineettinen profiili vastasi aiempien kliinisten tutkimusten tuloksia. Tähän kliiniseen tutkimukseen ei osallistunut potilaita, joilla oli loppuvaiheen munuaisten vajaatoiminta.
Maksan vajaatoiminta
Dulaglutidin farmakokinetiikkaa arvioitiin kliinisen farmakologian tutkimuksessa, jossa maksan vajaatoimintaa sairastavien tutkittavien dulaglutidialtistus pieneni tilastollisesti merkitsevästi (keskimääräinen Cmax-arvo enintään 30 % ja AUC-arvo enintään 33 %) verrattuna terveisiin verrokkeihin. Dulaglutidin tmax-aika piteni yleisesti maksan vajaatoiminnan lisääntyessä. Dulaglutidialtistuksessa ei kuitenkaan havaittu suuntauksia suhteessa maksan vajaatoiminnan asteeseen. Vaikutuksia ei pidetty kliinisesti merkittävinä.
Pediatriset potilaat
Dulaglutidille 0,75 mg ja 1,5 mg tehtiin populaatiofarmakokineettinen analyysi käyttäen tietoja 128:sta pediatrisesta potilaasta (10– alle 18-vuotiaat), joilla oli tyypin 2 diabetes. Pediatristen potilaiden AUC oli noin 37 % pienempi kuin aikuispotilailla. Tätä eroa ei kuitenkaan todettu kliinisesti merkittäväksi.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta ja toistuvan altistuksen aiheuttamaa toksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Siirtogeenisillä hiirillä ei todettu tuumorigeenistä vastetta 6 kuukauden mittaisessa karsinogeenisuustutkimuksessa. Dulaglutidi suurensi kilpirauhasen C-solukasvainten (adenoomat ja karsinoomat yhdistetty) ilmaantuvuutta tilastollisesti merkitsevästi ja annosriippuvaisesti kahden vuoden karsinogeenisuustutkimuksessa rotalla, kun altistus oli ≥ 3-kertainen verrattuna ihmisen kliiniseen altistukseen (4,5 mg dulaglutidia viikossa). Löydösten kliinistä merkitystä ei toistaiseksi tunneta.
Hedelmällisyystutkimusten aikana havaittiin keltarauhasten vähenemistä ja kiimakierron pidentymistä annostasoilla, joihin liittyi emon ruoansaannin vähenemistä ja painonnousua. Hedelmällisyys- ja hedelmöitysindekseihin tai alkiokehitykseen ei kuitenkaan havaittu vaikutuksia. Lisääntymistoksisuustutkimuksissa rotalla ja kanilla havaittiin luustovaikutuksia ja sikiön kasvun heikentymistä, kun dulaglutidialtistus oli 5-18-kertainen verrattuna kliiniseen käyttöön ehdotettuihin altistuksiin. Sikiön epämuodostumia ei kuitenkaan havaittu. Rotalla koko tiineyden ja imetyksen ajan kestänyt hoito aiheutti muistihäiriöitä naarasjälkeläisille, kun altistukset olivat 7-kertaisia verrattuna kliiniseen käyttöön ehdotettuihin altistuksiin. Dulaglutidin antaminen 38-kertaisella suurimmalla humaanialtistuksella nuorille uros- tai naarasrotille ei aiheuttanut näille muistihäiriöitä.
Farmaseuttiset tiedot
Apuaineet
Natriumsitraatti
Sitruunahappo
Mannitoli
Polysorbaatti 80
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
2 vuotta.
Säilytys
Säilytä jääkaapissa (2 °C - 8 °C).
Ei saa jäätyä.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Käytössä
Trulicity voidaan säilyttää huoneenlämmössä enintään 14 päivän ajan korkeintaan 30 °C:n lämpötilassa.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
TRULICITY injektioneste, liuos, esitäytetty kynä
0,75 mg (L:ei) 4 kpl (kertakäyttöinen) (108,23 €)
1,5 mg (L:ei) 4 kpl (kertakäyttöinen) (108,23 €)
PF-selosteen tieto
Lasiruisku (tyyppi I) kertakäyttöisen kynän sisällä.
Yksi esitäytetty kynä sisältää 0,5 ml liuosta.
Pakkaus, jossa 4 esitäytettyä kynää.
Valmisteen kuvaus:
Kirkas, väritön liuos.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Käyttöohjeet
Esitäytetty kynä on kertakäyttöinen.
Kynän pakkausselosteen ohessa olevia käyttöohjeita on noudatettava huolellisesti.
Trulicity-valmistetta ei saa käyttää, jos liuos on sameaa ja/tai siinä on hiukkasia tai värimuutoksia.
Jäätynyttä Trulicity-valmistetta ei saa käyttää.
Korvattavuus
TRULICITY injektioneste, liuos, esitäytetty kynä
1,5 mg 4 kpl
3 mg 4 kpl
4,5 mg 4 kpl
- Alempi erityiskorvaus (65 %). Dulaglutidi, liraglutidi ja semaglutidi (tyypin 2 diabetes, aikuiset): Vaikeahoitoisen tyypin 2 diabeteksen hoito erityisin edellytyksin (285).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Dulaglutidi, liraglutidi ja semaglutidi (tyypin 2 diabetes, aikuiset): Vaikeahoitoisen tyypin 2 diabeteksen hoito erityisin edellytyksin (346).
TRULICITY injektioneste, liuos, esitäytetty kynä
0,75 mg 4 kpl
- Ei korvausta.
ATC-koodi
A10BJ05
Valmisteyhteenvedon muuttamispäivämäärä
30.01.2026
Yhteystiedot
 OY ELI LILLY FINLAND AB
OY ELI LILLY FINLAND AB Mannerheimintie 117
00280 Helsinki
09 854 5250
www.lilly.com/fi
medinfo_finland@lilly.com
Lääketietopalvelu puh. 0800-140 240
