CONFIDEX injektiokuiva-aine ja liuotin, liuosta varten 500 IU, 1000 IU
Vaikuttavat aineet ja niiden määrät
Confidex on ihmisen protrombiinikompleksia sisältävä kuiva-aine ja liuotin, liuosta varten. Valmiste sisältää nimellisesti seuraavassa taulukossa esitetyt määrät (IU) ihmisen hyytymistekijöitä:
| Aineosan nimi | Sisältö käyttövalmiiksi sekoittamisen jälkeen (IU/ml) | Confidex 500 IU -valmistetta injektiopullossa (IU) | Confidex 1000 IU -valmistetta injektiopullossa (IU) | |
| Vaikuttavat aineet | ||||
| Ihmisen hyytymistekijä II | 20 – 48 | 400 – 960 | 800 – 1920 | |
| Ihmisen hyytymistekijä VII | 10 – 25 | 200 – 500 | 400 – 1000 | |
| Ihmisen hyytymistekijä IX | 20 – 31 | 400 – 620 | 800 – 1240 | |
| Ihmisen hyytymistekijä X | 22 – 60 | 440 – 1200 | 880 – 2400 | |
| Muut vaikuttavat aineet | ||||
| Proteiini C | 15 – 45 | 300 – 900 | 600 – 1800 | |
| Proteiini S | 12 – 38 | 240 – 760 | 480 – 1520 | |
Käyttövalmiiksi sekoitetun liuoksen kokonaisproteiinisisältö on 6 - 14 mg/ml.
Hyytymistekijä IX:n spesifinen aktiivisuus on 2,5 IU/kokonaisproteiinimäärä (mg).
Kaikkien hyytymistekijöiden sekä proteiinin C ja proteiinin S (antigeeni) aktiivisuus on tutkittu voimassaolevien kansainvälisten WHO-standardien mukaisesti.
Apuaineet, joiden vaikutus tunnetaan:
Natriumia enintään 343 mg (noin 15 mmol) per 100 ml liuosta.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektiokuiva-aine ja liuotin, liuosta varten.
Kliiniset tiedot
Käyttöaiheet
- Verenvuotojen hoito ja leikkauksiin liittyvien verenvuotojen estohoito hankinnaisen protrombiinikompleksihyytymistekijöiden puutoksen, kuten K-vitamiiniantagonistihoidosta aiheutuvan puutoksen, tai K vitamiiniantagonistien yliannostuksen yhteydessä, kun puutos on korjattava nopeasti.
- Verenvuotojen hoito ja leikkauksiin liittyvien verenvuotojen estohoito synnynnäisen K-vitamiinista riippuvaisen hyytymistekijän puutoksen yhteydessä, kun puhdistettua spesifistä hyytymistekijävalmistetta ei ole saatavilla.
Ehto
Hoito tulee aloittaa hyytymishäiriöihin perehtyneen lääkärin valvonnassa.
Annostus ja antotapa
Annostus
Seuraavassa on esitetty vain yleiset annostusohjeet. Hoito on aloitettava hyytymishäiriöiden hoitoon perehtyneen lääkärin valvonnassa. Annostus ja korvaushoidon kesto riippuvat käyttöaiheesta, sairauden vaikeusasteesta, verenvuodon sijainnista ja laajuudesta sekä potilaan kliinisestä tilasta.
Annettava määrä ja antotiheys on laskettava jokaiselle potilaalle yksilöllisesti. Annosväli on määritettävä protrombiinikompleksin sisältämien kunkin hyytymistekijän verenkierrossa havaittavien eripituisten puoliintumisaikojen mukaan (ks. kohta Farmakokinetiikka). Yksilölliset annostustarpeet voidaan todeta vain yksilöllisten plasman hyytymistekijäpitoisuuksien säännöllisellä määrittämisellä tai protrombiinikompleksipitoisuuden määrittämisellä yleistestien (INR, tromboplastiiniaika) avulla ja seuraamalla jatkuvasti potilaan kliinistä tilaa.
Suurten kirurgisten toimenpiteiden yhteydessä korvaushoidon tarkka seuranta hyytymistekijäpitoisuusmääritysten avulla on välttämätöntä (kunkin yksittäisen hyytymistekijän pitoisuusmääritykset ja/tai protrombiinikompleksipitoisuuden yleistestit).
- Verenvuodot ja leikkauksiin liittyvien verenvuotojen estohoito K-vitamiiniantagonistihoidon aikana.
Annostus riippuu hoitoa edeltävästä INR-arvosta ja tavoitteeksi asetetusta INR-arvosta. Hoitoa edeltävä INR-arvo on mitattava mahdollisimman lähellä antoajankohtaa, jotta asianmukainen Confidex-annos saadaan laskettua. Seuraavassa taulukossa esitetään hoidon alussa esiintyvien eri INR-arvojen normalisoimiseksi (esim. ≤ 1,3) tarvittava likimääräinen annos (käyttövalmiiksi sekoitettua valmistetta (ml) / painokiloa kohden (kg) sekä hyytymistekijää IX (IU) / painokiloa kohden (kg)).
| Hoitoa edeltävä INR-arvo | 2,0 – 3,9 | 4,0 – 6,0 | > 6,0 |
| Likimääräinen annos (ml) / painokilo (kg) | 1 | 1,4 | 2 |
| Likimääräinen annos hyytymistekijää IX (IU) / painokiloa kohden (kg) | 25 | 35 | 50 |
Annos perustuu potilaan painoon enintään 100 kg:aan asti. Yli 100 kg painaville potilaille suurin kerta-annos (IU hyytymistekijää IX) on 2 500 IU, jos INR-arvo on 2,0–3,9; 3 500 IU, jos INR-arvo on 4,0–6,0, ja 5 000 IU, jos INR-arvo on > 6,0.
K-vitamiiniantagonistihoidosta aiheutuva hemostaasin heikkeneminen korjautuu yleensä noin 30 minuutin kuluttua pistoksesta. Samanaikaista K-vitamiinin antamista Confidex-valmistetta saaville potilaille on harkittava K-vitamiiniantagonistihoidon vaikutuksen nopeaan kumoamiseen, koska K-vitamiinin vaikutukset ilmaantuvat yleensä 4-6 tunnin kuluessa. Kliiniset tutkimustulokset eivät tue Confidex-hoidon toistamista potilaille, jotka tarvitsevat K-vitamiiniantagonistihoidon vaikutuksen nopeaa kumoamista, eikä sitä siksi suositella.
Nämä suositukset perustuvat pienellä potilasmäärällä toteutetuista kliinisistä lääketutkimuksista saatuihin tietoihin. Potilaan tilan paraneminen ja valmisteen vaikutuksen kesto voivat vaihdella, joten INR arvojen seuranta on hoidon aikana siksi välttämätöntä.
- Verenvuodot ja leikkauksiin liittyvä verenvuotojen estohoito synnynnäisen K-vitamiinista riippuvaisen hyytymistekijän puutoksen yhteydessä, kun spesifistä hyytymistekijävalmistetta ei ole saatavilla.
Tarvittavan protrombiinikompleksikonsentraattiannoksen laskeminen perustuu kliinisistä lääketutkimuksista saatuihin tietoihin:
- 1 IU:n hyytymistekijä IX:ää potilaan painokiloa kohden (kg) voidaan odottaa suurentavan plasman hyytymistekijä IX -aktiivisuutta 1,3 % (0,013 IU/ml) normaaliin verrattuna
- 1 IU hyytymistekijä VII:ää potilaan painokiloa kohden (kg) suurentaa plasman hyytymistekijä VII -aktiivisuutta 1,7 % (0,017 IU/ml) normaaliin verrattuna
- 1 IU hyytymistekijä II:a potilaan painokiloa kohden (kg) suurentaa plasman hyytymistekijä II -aktiivisuutta 1,9 % (0,019 IU/ml) normaaliin verrattuna
- 1 IU hyytymistekijä X:ä potilaan painokiloa kohden (kg) suurentaa plasman hyytymistekijä X -aktiivisuutta 1,9 % (0,019 IU/ml) normaaliin verrattuna.
Annettava hyytymistekijäannos ilmaistaan kansainvälisinä yksikköinä (International Units, IU), mikä perustuu kunkin hyytymistekijän voimassa olevaan WHO-standardiin. Yksittäisen hyytymistekijän vaikutus plasmassa ilmaistaan joko prosentteina (suhteessa normaaliin plasmaan) tai kansainvälisinä yksikköinä (kyseisen hyytymistekijän kansainvälisen standardin perusteella).
Yksi kansainvälinen yksikkö (International Unit, IU) hyytymistekijäaktiivisuutta vastaa kyseisen hyytymistekijän määrää millilitrassa normaalia ihmisen plasmaa.
Esimerkiksi hyytymistekijä X:n tarvittavan annoksen laskeminen perustuu siihen löydökseen, että yksi kansainvälinen yksikkö (IU) hyytymistekijää X painokiloa (kg) kohden suurentaa plasman hyytymistekijä X -aktiivisuutta 0,019 IU/ml.
Tarvittava annos lasketaan seuraavalla laskukaavalla:
Tarvittava määrä yksikköinä = potilaan paino [kg] x haluttu hyytymistekijä X:n pitoisuuden suureneminen [IU/ml] x 53
jossa 53 (ml/kg) on arvioidun saannon käänteisluku.
Huomaa, että laskelma perustuu tuloksiin, jotka on saatu tutkimuksista K-vitamiiniantagonistihoitoa saavilla potilailla. Jos laskelma tehtäisiin terveiltä tutkimushenkilöiltä saatujen tulosten perusteella, arvio tarvittavasta annoksesta olisi pienempi.
Jos yksilöllinen saanto tiedetään, laskennassa on käytettävä tätä arvoa.
Valmistekohtaisia tietoja on saatavissa terveillä vapaaehtoisilla tutkimushenkilöillä (N=15) tehdyistä kliinisistä tutkimuksista, joissa tutkittiin K-vitamiiniantagonistihoidon vaikutuksen kumoamista akuutin vakavan verenvuodon tai perioperatiivisen verenvuodon estohoidon yhteydessä (N = 98, N = 43) (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Confidex-valmisteen turvallisuutta ja tehoa lasten ja nuorten hoidossa ei ole varmistettu kontrolloiduissa kliinisissä tutkimuksissa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Iäkkäät potilaat
Iäkkäiden (yli 65-vuotiaiden) potilaiden annostus ja antotapa ovat yleisten annossuositusten mukaiset.
Antotapa
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen saattamisesta käyttökuntoon ennen lääkkeen antoa. Käyttövalmiiksi sekoitettu liuos annetaan laskimoon (enintään 8 ml/minuutti*).
Liuos on kirkas tai hieman opalisoiva.
* Confidexin kliinisissä tutkimuksissa infuusio ohjeistettiin antamaan alle 70 kg painaville potilaille enintään nopeudella 0,12 ml/kg/min (enintään 8 ml/min)
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Jos potilaalla on DIC-oireyhtymä (disseminoitunut intravaskulaarinen koagulaatio), protrombiinikompleksivalmisteita saa antaa vasta, kun konsumptiotila on ohi.
Tiedossa oleva aiemmin esiintynyt tyypin II hepariinitrombopenia.
Varoitukset ja käyttöön liittyvät varotoimet
Hoito on annettava hyytymishäiriöiden hoitoon perehtyneen erikoislääkärin ohjauksessa.
Jos potilaalla on hankinnainen K-vitamiinista riippuvaisten hyytymistekijöiden puutos (esim. K-vitamiiniantagonistihoidon seurauksena), Confidex-valmistetta saa antaa vain protrombiinikompleksipitoisuuden nopeaan korjaamiseen, esimerkiksi voimakkaiden verenvuotojen tai hätäleikkauksen yhteydessä. Muissa tilanteissa K-vitamiiniantagonistiannoksen pienentäminen ja/tai K-vitamiinin antaminen on riittävä toimenpide.
K-vitamiinin antagonisteja saavilla potilailla saattaa olla taustalla ylikorostunut veren hyytymistaipumus, ja ihmisen protrombiinikompleksi-infuusio voi pahentaa sitä.
Jos potilaalla on jonkin K-vitamiinista riippuvaisen hyytymistekijän synnynnäinen puutos, hänelle annettava spesifistä hyytymistekijävalmistetta, jos sellaista on saatavana.
Jos potilaalla ilmenee allergisia tai anafylaktisia reaktioita, Confidex-valmisteen antaminen on lopetettava heti (esim. pistoksen antaminen on keskeytettävä) ja asianmukainen hoito on aloitettava. Hoitotoimenpiteet riippuvat haittavaikutuksen tyypistä ja vaikeusasteesta. Sokin hoidossa on noudatettava voimassa olevia hoitosuosituksia.
Jos synnynnäistä tai hankinnaista puutosta sairastaville annetaan hoitona ihmisen protrombiinikompleksia ja etenkin, jos sitä annetaan toistuvasti, siitä aiheutuu potilaalle tromboosin tai DIC-oireyhtymän vaara. Riski saattaa olla suurempi pelkän hyytymistekijä VII:n puutoksen hoidossa. Tämä johtuu siitä, että muut K-vitamiinista riippuvaiset hyytymistekijät, joiden puoliintumisaika on pidempi, saattavat kertyä elimistöön huomattavasti tavanomaista suuremmiksi pitoisuuksiksi. Ihmisen protrombiinikompleksia saavilla potilailla on seurattava tarkoin DIC-oireyhtymän tai tromboosin oireita tai merkkejä.
Potilaan tilaa on seurattava tarkoin tromboembolisten komplikaatioiden riskin vuoksi Confidex-valmistetta annettaessa, jos potilaalla on ollut aiemmin sepelvaltimotauti tai sydäninfarkti, maksasairaus, potilas on ollut leikkauksessa tai on menossa leikkaukseen, potilaalla on tromboembolisen tapahtuman tai DIC-oireyhtymän riski tai samanaikainen vasta-aineiden puutos, samoin kuin annettaessa valmistetta vastasyntyneille potilaille. Confidex-valmisteen mahdollisia hyötyjä on kaikissa näissä tilanteissa punnittava tällaisten komplikaatioiden mahdolliseen riskiin nähden.
Jos potilaalla on DIC-oireyhtymä, protrombiinikompleksin hyytymistekijöiden korvaaminen saattaa olla tietyissä tilanteissa tarpeen. Tällainen korvaushoito voidaan kuitenkin toteuttaa vain, kun konsumptiotila on hoidettu (esim. hoitamalla taustalla oleva syy, antitrombiini III:n pitoisuuden pitkäaikainen normalisoiminen).
K-vitamiiniantagonistihoidon vaikutusta kumottaessa potilas altistuu veritulppariskille, joka liittyy taustalla olevaan sairauteen. Antikoagulaatiohoidon aloittamista uudelleen on harkittava tarkoin mahdollisimman pian.
Haittavaikutuksena voi kehittyä hepariinin aiheuttama tyypin II trombosytopenia (tyypi II HIT). HIT:n merkkejä ovat verihiutaleiden määrän väheneminen yli 50 % ja/ tai uusien tai selittämättömien tromboembolisten komplikaatioiden esiintyminen hepariinihoidon aikana. HIT ilmaantuu yleensä 4-14 vuorokautta hepariinihoidon aloittamisen jälkeen, mutta se saattaa kehittyä myös 10 tunnin kuluessa sellaisille potilaille, jotka ovat äskettäin altistuneet hepariinille (edellisen 100 päivän aikana).
Nefroottista oireyhtymää on raportoitu yksittäisinä tapauksina, kun B-hemofiliaa sairastaville, joilla on hyytymistekijä IX:n vasta-aineita ja joille on aiemmin ilmaantunut allerginen reaktio, on yritetty saada aikaan immuunitoleranssi.
Confidex-valmisteen käytöstä vastasyntyneiden K-vitamiinin puutokseen liittyvän syntymänaikaisen verenvuodon yhteydessä ei ole tietoa.
Confidex sisältää enintään 343 mg natriumia (noin 15 mmol) 100 millilitraa kohden. Potilaiden, joilla on ruokavalion natriumrajoitus, tulee ottaa tämä huomioon.
Virusturvallisuus
Vakiintuneita toimenpiteitä ihmisen verestä tai plasmasta valmistetuista lääkevalmisteista aiheutuvien infektioiden estämiseksi ovat verenluovuttajien valinta, erityisten infektiomerkkiaineiden seulominen luovutetusta verestä ja plasmapooleista sekä valmistuksenaikaiset tehokkaat toimenpiteet virusten inaktivoimiseksi/poistamiseksi. Tästä huolimatta taudinaiheuttajien siirtymisen mahdollisuutta ei voida täysin sulkea pois, kun käytetään ihmisen verestä tai plasmasta valmistettuja lääkevalmisteita. Tämä koskee myös tuntemattomia tai uusia kehittymässä olevia viruksia ja muita taudinaiheuttajia.
Käytössä olevien toimenpiteiden katsotaan tehoavan hyvin vaipallisiin viruksiin, kuten ihmisen immuunikatoviruksen (HIV)-, hepatiitti B -virukseen (HBV) ja hepatiitti C -virukseen (HCV), sekä vaipattomaan hepatiitti A-virukseen ja parvovirus B19:ään..
Ihmisen plasmasta valmistettuja protrombiinikompleksivalmisteita säännöllisesti/toistuvasti saavien potilaiden on harkittava asianmukaisten rokotusten (hepatiitti A:ta ja B:tä vastaan) ottamista.
Valmisteen nimen ja eränumeron merkitsemistä muistiin aina Confidex-valmistetta annettaessa suositellaan, jotta potilas voidaan yhdistää annettuun valmiste-erään.
Yhteisvaikutukset
Ihmisen protrombiinikompleksivalmisteet neutralisoivat K-vitamiiniantagonistihoidon vaikutuksen, mutta yhteisvaikutuksia muiden lääkevalmisteiden kanssa ei tunneta.
Kun suurina annoksina ihmisen protrombiinikompleksia saaville potilaille tehdään hepariinille herkkiä hyytymiskokeita, on huomioitava, että annettu valmiste sisältää hepariinia.
Raskaus ja imetys
Raskaus ja imetys
Ihmisen protrombiinikompleksin turvallisuutta ihmisen raskauden ja imetyksen aikana ei ole varmistettu. Eläinkokeet eivät sovellu valmisteen raskauteen, alkion/sikiön kehitykseen, synnytyksen aikaiseen tai syntymän jälkeiseen kehitykseen liittyvän turvallisuuden arvioimiseen.
Ihmisen protrombiinikompleksia saa siksi käyttää raskauden ja imetyksen aikana vain, jos se on ehdottoman välttämätöntä.
Hedelmällisyys
Tietoja hedelmällisyystutkimuksista ei ole saatavilla.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Tutkimuksia valmisteen vaikutuksista ajokykyyn tai koneiden käyttökykyyn ei ole tehty.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Allergisia tai anafylaksian kaltaisia reaktioita on havaittu melko harvoin, mukaan lukien vaikeat anafylaktiset reaktiot (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Korvaushoito saattaa johtaa kiertävien vasta-aineiden muodostumiseen estäen yhtä tai useampaa ihmisen protrombiinikompleksihyytymistekijää. Jos tällaisia vasta-aineita ilmaantuu, tila ilmenee heikkona kliinisenä vasteena. Tällaisessa tapauksessa suositellaan ottamaan yhteyttä hemofilian hoitoon erikoistuneeseen hoitoyksikköön ohjeiden saamiseksi. Anafylaktisia reaktioita on havaittu potilailla, joilla esiintyy vasta-aineita Confidex-valmisteen sisältämille hyytymistekijöille.
Ruumiinlämmön kohoamista on havaittu yleisenä.
Ihmisen protrombiinikompleksin antamisesta seuraa tromboembolisten tapahtumien riski (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Haittavaikutusluettelo
Seuraavat haittavaikutustiedot perustuvat kliinisistä tutkimuksista saatuihin tietoihin, myyntiluvan saamisen jälkeiseen käyttökokemukseen sekä tieteelliseen kirjallisuuteen.
Alla olevassa taulukossa haittavaikutukset esitetään MedDRA-elinjärjestelmäluokituksen mukaisesti (SOC-luokat ja suositeltu termi). Esiintymistiheydet perustuvat kliinisistä tutkimuksista saatuihin tietoihin ja luokitellaan seuraavasti: hyvin yleinen (≥1/10); yleinen (≥1/100, <1/10); melko harvinainen (≥1/1 000, <1/100); harvinainen (≥1/10 000, <1/1 000); hyvin harvinainen (<1/10 000) tai tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
| MedDRA-elinjärjestelmäluokka | Haittavaikutus (suositeltu termi) | Esiintymistiheys |
| Verisuonisto ja muut SOC-luokat | Tromboemboliset tapahtumat* | yleinen |
| Veri ja imukudos | Disseminoitunut intravaskulaarinen koagulaatio | tuntematon |
| Immuunijärjestelmä | Yliherkkyys- tai allergiset reaktiot | melko harvinainen |
| Anafylaktiset reaktiot, anafylaktinen sokki mukaan lukien | tuntematon | |
| Vasta-aineiden kehittyminen | tuntematon | |
| Hermosto | Päänsärky | yleinen |
| Yleisoireet ja antopaikassa todettavat haitat | Ruumiinlämmön kohoaminen | yleinen |
*kuolemaan johtaneet tapaukset mukaan lukien
Turvallisuus tarttuvien taudinaiheuttajien suhteen, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Pediatriset potilaat
Confidex-valmisteen käytöstä lapsille ei ole tutkimustietoa.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haitta tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista kansallisen ilmoitusjärjestelmän kautta:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Potilaan hyytymisarvoja on seurattava hoidon aikana säännöllisesti yliannostuksen välttämiseksi, koska suuriin protrombiinikompleksikonsentraattiannoksiin (yliannos) on liittynyt sydäninfarkti-, DIC-oireyhtymä-, laskimotromboosi- ja keuhkoemboliatapauksia. Potilaan tromboembolisten komplikaatioiden tai DIC-oireyhtymän riski on suurentunut yliannostuksen yhteydessä, jos potilaalla on ennestään tällaisten komplikaatioiden riski.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: veren hyytymistekijät, hyytymistekijät IX, II, VII ja X yhdistelmävalmisteina
ATC-koodi: B02BD01
Maksassa K-vitamiinin avulla syntetisoituvia hyytymistekijöitä II, VII, IX ja X kutsutaan yleisesti protrombiinikompleksiksi. Confidex-valmiste sisältää hyytymistekijöiden lisäksi K-vitamiiniriippuvaisia hyytymistä estäviä proteiineja C ja S.
Hyytymistekijä VII on aktiivisen seriiniproteaasihyytymistekijä VIIa:n esiaste, joka käynnistää veren ulkoisen hyytymisjärjestelmän. Kudoksen tromboplastiinitekijä, hyytymistekijä VIIa-kompleksi, aktivoi hyytymistekijät IX ja X, jolloin hyytymistekijät IXa ja Xa muodostuvat. Hyytymisketjun aktivoitumisen jatkuessa edelleen protrombiini (hyytymistekijä II) aktivoituu ja muuttuu trombiiniksi. Fibrinogeeni muuntuu trombiinin vaikutuksesta fibriiniksi, mikä johtaa hyytymän muodostumiseen. Trombiinin normaali muodostuminen on erittäin tärkeää myös trombosyyttien toiminnan kannalta osana primaaria hemostaasia.
Yksinään esiintyvä hyytymistekijä VII:n vaikea puutos johtaa trombiinin muodostumisen vähenemiseen ja fibriinin muodostumisen heikkenemisestä ja siten myös primaarin hemostaasin heikkenemisestä johtuvaan vuototaipumukseen. Yksinään esiintyvä hyytymistekijä IX:n puutos on yksi klassisen hemofilian muoto (B-hemofilia). Yksinään esiintyvät hyytymistekijän II tai hyytymistekijän X puutokset ovat hyvin harvinaisia, mutta vaikeassa muodossa ne johtavat samankaltaiseen verenvuototaipumukseen kuin hemofilian klassinen muoto.
Valmisteen lisäksi sisältämät hyytymistä estävät proteiinit C ja S syntetisoituvat maksassa. Kofaktori proteiini S vahvistaa proteiini C:n biologista vaikutusta.
Aktivoitunut proteiini C estää hyytymistä inaktivoimalla hyytymistekijöitä Va ja VIIIa. Proteiini S tukee proteiini C:n kofaktorina hyytymisen inaktivoitumista. Proteiini C:n puutokseen liittyy suurentunut tromboosiriski.
K-vitamiiniantagonistihoidon aikana esiintyy K-vitamiinista riippuvaisten hyytymistekijöiden hankinnaista puutosta. Jos puutos kehittyy vaikeaksi, se johtaa vaikeaan vuototaipumukseen, joka ilmenee vatsakalvontakaisina (retroperitoneaalisina) vuotoina ja aivoverenvuotoina pikemminkin kuin lihasten ja nivelten verenvuotoina. Myös vaikea maksan vajaatoiminta johtaa K-vitamiinista riippuvaisten hyytymistekijöiden pitoisuuden huomattavaan pienenemiseen ja kliinisesti merkitsevään vuototaipumukseen. Tämä tila on kuitenkin usein samanaikaisesta heikosta suonensisäisestä hyytymisestä, alhaisista trombosyyttiarvoista, hyytymistekijöiden puutoksesta ja fibrinolyysin häiriintymisestä muodostuva kokonaisuus.
Ihmisen protrombiinikompleksin antaminen suurentaa K-vitamiinista riippuvaisten hyytymistekijöiden pitoisuutta plasmassa ja saattaa tilapäisesti korjata hyytymishäiriön potilaalla, jolla on yhden tai useamman näiden hyytymistekijöiden puutos.
Farmakokinetiikka
Farmakokineettiset tiedot ja tiedot lisäsaannosta (in-vivo recovery) saatiin tutkimuksesta, joka tehtiin terveillä vapaaehtoisilla tutkimushenkilöillä (N = 15), ja kahdesta tutkimuksesta, joissa selvitettiin K-vitamiiniantagonistihoidon vaikutuksen kumoamista akuutin vakavan verenvuodon yhteydessä tai perioperatiivisesti verenvuodon estohoidossa (N = 98, N =43).
Tutkimus terveillä vapaaehtoisilla:
Confidex-valmistetta annettiin 50 IU/painokilo 15 terveelle vapaaehtoiselle tutkimushenkilölle. Lisäsaanto on odotettavissa oleva plasman hyytymistekijäpitoisuuksien kasvu (IU/ml), kun hyytymistekijöitä annetaan infuusiona (IU/kg) Confidex-valmisteen muodossa. Tutkimuksessa määritettiin hyytymistekijöiden II, VII, IX ja X sekä proteiinien C ja S lisäsaannot. Kaikkien komponenttien huippupitoisuudet saavutettiin kolmen tunnin kuluessa. Keskimääräiset lisäsaannot vaihtelivat hyytymistekijä IX:n 0,016 IU/ml:sta proteiini C:n 0,028 IU/ml:aan. Puoliintumisaikojen mediaanit plasmassa ja inkrementaaliset lisäsaannot esitetään seuraavassa taulukossa:
| Parametri | Puoliintumisaikojen mediaani plasmassa (vaihteluväli) / h | Inkrementaalinen lisäsaanto (IU/ml per IU/painokilo) | |
| Geometrinen keskiarvo | 90 % CI† | ||
| Hyytymistekijä II | 60 (25-135) | 0,022 | (0,020-0,023) |
| Hyytymistekijä VII | 4 (2-9) | 0,024 | (0,023-0,026) |
| Hyytymistekijä IX | 17 (10-127)* | 0,016 | (0,014-0,018) |
| Hyytymistekijä X | 31 (17-44) | 0,021 | (0,020-0,023) |
| Proteiini C | 47 (9-122)* | 0,028 | (0,027-0,030) |
| Proteiini S | 49 (33-83)* | 0,020 | (0,018-0,021) |
† luottamusväli
*terminaalinen puoliintumisaika, kaksitilamalli
Confidex-valmiste jakautuu elimistöön ja metaboloituu samalla tavoin kuin endogeeniset hyytymistekijät II, VII, IX ja X.
Valmisteen antaminen laskimoon tarkoittaa, että valmiste on elimistön käytettävissä heti. Biologinen hyötyosuus on suhteessa annettuun annokseen.
Tutkimus K-vitamiiniantagonistihoidon vaikutuksen kumoamisesta akuutin vakavan verenvuodon yhteydessä:
Keskimääräinen lisäsaanto laskettiin 98 tutkimushenkilöltä, joille annettiin Confidex-valmistetta verenvuodon hoitoon K-vitamiiniantagonistihoidon aikana. Inkrementaaliset lisäsaannot vaihtelivat hyytymistekijä VII:n 0,016 IU/ml:sta proteiini C:n 0,019 IU/ml:aan.
Tutkimus K-vitamiiniantagonistihoidon vaikutuksen kumoamisesta akuutin vakavan verenvuodon yhteydessä tai perioperatiivisesti verenvuodon estohoidossa:
Keskimääräinen lisäsaanto laskettiin 43 tutkimushenkilöltä, joille annettiin Confidex-valmistetta verenvuodon hoitoon tai perioperatiivisesti verenvuodon estohoitoon K-vitamiiniantagonistihoidon aikana. Confidex-valmisteen anto laskimoon annoksella 1 IU/kg suurensi K-vitamiinista riippuvaisten hyytymistekijöiden pitoisuutta plasmassa 0,013–0,023 IU/ml.
Prekliiniset tiedot turvallisuudesta
Confidex sisältää vaikuttavana aineena protrombiinikompleksin hyytymistekijöitä (hyytymistekijät II, VII, IX ja X). Niitä saadaan ihmisen plasmasta ja ne vaikuttavat samalla tavoin kuin plasman endogeeniset aineosat.
Kerta-annostutkimukset ennalta pastöroidulla, mutta ei nanosuodatetulla, valmisteella viittasivat kohtalaiseen toksisuuteen hiirillä annoksen 200 IU/kg annon jälkeen, mikä oli suurin tutkittu annos. Laskimoon annettu kerta-annos pastöroitua ja nanosuodatettua valmistetta oli siedetty rotilla, kun annos oli enintään 100 IU/kg. Toistetuilla annoksilla tehtäviä prekliinisiä tutkimuksia (krooninen toksisuus, karsinogeenisuus ja reproduktiivinen toksisuus) ei voi toteuttaa järkevästi tavanomaisilla eläinmalleilla heterologisten ihmisen proteiinien annon jälkeen kehittyvien vasta-aineiden vuoksi.
Kaniineilla osoitettiin paikallisen toleranssin kehittymistä, kun Confidex valmistetta annettiin laskimoon. Kaniineilla tehty neoantigeenisuustutkimus ei viitannut pastörointiprosessista aiheutuvaan neoepitoopin muodostumiseen.
Farmaseuttiset tiedot
Apuaineet
Kuiva-aine: hepariini, ihmisen albumiini, ihmisen antitrombiini III, natriumkloridi, natriumsitraatti, vetykloridihappo tai natriumhydroksidi (pieniä määriä pH:n säätämiseen)
Liuotin: injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa, lukuun ottamatta niitä, jotka mainitaan kohdassa Käyttö -ja käsittelyohjeet.
Kestoaika
3 vuotta.
Käytönaikaisen kemiallisen ja fysikaalisen säilyvyyden on osoitettu olevan 24 tuntia huoneenlämmössä (enintään 25 °C). Mikrobiologiselta kannalta valmiste on kuitenkin käytettävä heti.
Säilytys
Säilytä alle 25 °C.
Ei saa jäätyä.
Pidä injektiopullo ulkopakkauksessa. Herkkä valolle.
Käyttökuntoon saatetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
CONFIDEX injektiokuiva-aine ja liuotin, liuosta varten
500 IU (L:ei) 500 IU + 20 ml (464,92 €)
1000 IU (L:ei) 1000 IU + 40 ml (902,46 €)
PF-selosteen tieto
Confidex 500 IU:
Kuiva-aine: Injektiopullo, väritöntä lasia (tyyppi II), joka on suljettu lateksittomalla infuusiotulpalla (bromobutyylikumia), alumiinisinetillä ja muovisella irti napsautettavalla flip-off-sulkimella.
Liuotin: 20 ml injektionesteisiin käytettävää vettä sisältävä värittömästä lasista (tyyppi I) valmistettu injektiopullo, joka on suljettu lateksittomalla infuusiotulpalla (klooributyyli- tai bromobutyylikumia), alumiinisinetillä ja muovisella irti napsautettavalla flip-off-sulkimella.
Injektiolaite: 1 suodattimella varustettu siirtolaite 20/20.
Confidex 1000 IU:
Kuiva-aine: Injektiopullo, väritöntä lasia (tyyppi II), joka on suljettu lateksittomalla infuusiotulpalla (bromobutyylikumia), alumiinisinetillä ja muovisella irti napsautettavalla flip-off-sulkimella.
Liuotin: 40 ml injektionesteisiin käytettävää vettä sisältävä värittömästä lasista (tyyppi I) valmistettu injektiopullo, joka on suljettu lateksittomalla infuusiotulpalla (klooributyyli- tai bromobutyylikumia), alumiinisinetillä ja muovisella irti napsautettavalla flip-off-sulkimella.
Injektiolaite: 1 suodattimella varustettu siirtolaite 20/20.
Valmisteen kuvaus:
Valkoinen tai vaaleanvärinen jauhe tai mureneva kiinteä aine.
Käyttö- ja käsittelyohjeet
Antotapa
Yleiset ohjeet
- Injektionesteen on oltava kirkasta tai hieman opaalinhohtoista. Kun käyttövalmiiksi sekoitettu valmiste on suodatettu/vedetty ruiskuun (ks. seuraavassa), valmiste on tarkistettava silmämääräisesti ennen antoa, ettei siinä ole havaittavissa hiukkasia eikä värimuutoksia.
- Älä käytä liuosta, jos se on sameaa tai siinä on sakkaa.
- Valmisteen käyttövalmiiksi sekoittaminen ja vetäminen ruiskuun on tehtävä aseptisissa olosuhteissa.
Käyttövalmiiksi sekoittaminen
Lämmitä liuotin huoneenlämpöiseksi. Varmista, että kuiva-aineen ja liuottimen sisältävien injektiopullojen irti napsautettavat flip-off-sulkimet on poistettu ja tulpat on käsitelty antiseptisella liuoksella. Tulpan on sen jälkeen annettava kuivua ennen Mix2Vial-pakkauksen avaamista.
| 1. Avaa Mix2Vial-pakkaus vetämällä suojakansi pois. Älä ota Mix2Vial-laitetta pois pakkauksesta! | |
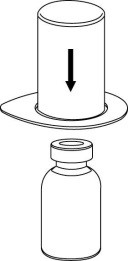 | 2. Aseta liuottimen sisältävä injektiopullo tasaiselle, puhtaalle alustalle ja ota injektiopullosta tukeva ote. Ota Mix2Vial sekä pakkaus ja paina sinisen sovittimen piikki suoraan liuotinpullon tulpan läpi. |
| 3. Poista pakkaus varovasti Mix2Vial-laitteesta siten, että pidät pakkauksen reunasta kiinni ja vedät kohtisuoraan ylöspäin. Varmista, että vedät pois vain pakkauksen etkä Mix2Vial-laitetta. | |
| 4. Aseta injektiopullo tasaiselle ja tukevalle alustalle. Käännä liuotinpullo ja siihen kiinnitetty Mix2Vial ylösalaisin, ja paina läpinäkyvän sovittimen piikki suoraan kuiva-aineinjektiopullon tulpan läpi. Liuotin siirtyy automaattisesti kuiva-aineen sisältävään injektiopulloon. | |
| 5. Ota toisella kädellä kiinni Mix2Vial-laitteen kuiva-aineen sisältävän injektiopullon puolelta ja toisella kädellä liuottimen sisältävän injektiopullon puolelta ja kierrä vastapäivään laite varovasti kahteen osaan. Hävitä liuotinpullo ja siihen kiinnitetty sininen Mix2Vial-sovitin. | |
| 6. Pyörittele kuiva-aineinjektiopulloa ja siihen kiinnitettyä läpinäkyvää sovitinta, kunnes kuiva-aine on liuennut täysin. Ei saa ravistaa. | |
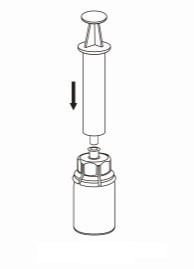 | 7. Vedä ilmaa tyhjään, steriiliin ruiskuun. Kun kuiva-aineen sisältävä injektiopullo on oikeinpäin, kiinnitä ruisku Mix2Vial-sovittimen Luer Lock-liittimeen kiertäen myötäpäivään. Ruiskuta ilma kuiva-aineen sisältävään injektiopulloon. |
Valmisteen vetäminen ruiskuun ja anto
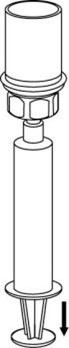 | 8. Kun ruiskun mäntä on alas painettuna, käännä laite ja injektiopullo ylösalaisin ja vedä liuos ruiskuun vetämällä mäntää hitaasti ulospäin. |
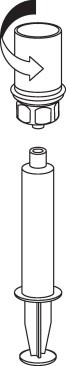 | 9. Kun liuos on nyt siirretty ruiskuun, ota tukeva ote ruiskun kammiosta (pitäen ruiskun mäntää samalla alaspäin) ja irrota Mix2Vial-sovitin kiertäen vastapäivään. |
Veren pääsyä valmisteella täytettyyn ruiskuun on varottava, koska tällöin on vaara, että veri hyytyy ruiskuun ja siten muodostunut fibriinihyytymä annetaan potilaalle.
Jos on tarpeen käyttää useampia Confidex-injektiopulloja, niiden sisältö voidaan yhdistää annettavaksi infuusiona infuusiolaitteistolla.
Confidex-liuosta ei saa laimentaa.
Käyttövalmiiksi sekoitettu liuos annetaan laskimoon (enintään 8 ml/min*).
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
* Confidexin kliinisissä tutkimuksissa infuusio ohjeistettiin antamaan alle 70 kg painaville potilaille enintään nopeudella 0,12 ml/kg/min (enintään 8 ml/min).
Korvattavuus
CONFIDEX injektiokuiva-aine ja liuotin, liuosta varten
500 IU 500 IU + 20 ml
1000 IU 1000 IU + 40 ml
- Ei korvausta.
ATC-koodi
B02BD01
Valmisteyhteenvedon muuttamispäivämäärä
24.09.2021
Yhteystiedot
 CSL BEHRING AB
CSL BEHRING AB Box 712
182 17 Danderyd
Ruotsi
+46 (0) 8 544 966 70
www.cslbehring.fi
info@cslbehring.se
