BOTOX injektiokuiva-aine, liuosta varten 50 Allergan-yksikköä, 100 Allergan-yksikköä, 200 Allergan-yksikköä
Vaikuttavat aineet ja niiden määrät
botuliinitoksiini* tyyppi A, 50 Allergan-yksikköä/injektiopullo
botuliinitoksiini* tyyppi A, 100 Allergan-yksikköä/injektiopullo
botuliinitoksiini* tyyppi A, 200 Allergan-yksikköä/injektiopullo
*Clostridium botulinum ‑bakteerista
Botuliinitoksiiniyksiköitä ei voi soveltaa muihin valmisteisiin.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektiokuiva-aine, liuosta varten.
Kliiniset tiedot
Käyttöaiheet
Neurologiset sairaudet:
Botox on tarkoitettu seuraavien tilojen oireenmukaiseen hoitoon:
- nilkan ja jalkaterän fokaalinen spastisuus pystyasennossa liikkuvalla vähintään 2-vuotiaalla CP-lapsella, kuntoutushoidon lisänä
- fokaalinen spastisuus, joka ilmenee aikuisilla aivohalvauksen jälkeen ranteessa ja kädessä
- fokaalinen spastisuus, joka ilmenee aikuisilla aivohalvauksen jälkeen nilkassa ja jalkaterässä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
- blefarospasmi, hemifasiaalinen spasmi sekä niihin liittyvät fokaaliset dystoniat
- servikaalinen dystonia (spastinen kierokaula)
- oireiden vähentäminen kroonisen migreenin kriteerit (päänsärkyä ≥ 15 päivänä kuukaudesta, joista vähintään 8 päivänä migreeni) täyttävillä aikuispotilailla, joiden vaste migreenin estolääkitykseen ei ole ollut riittävä tai joille estolääkitys ei ole sopinut (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Botox on tarkoitettu seuraavien sairauksien hoitoon:
Virtsarakon sairaudet:
- virtsankarkailu, äkillinen tarve tyhjentää rakko ja normaalia tiheämpi virtsaamistarve, joka johtuu idiopaattisesti yliaktiivisesta virtsarakosta aikusilla, joille antikolinerginen lääkitys ei sovi tai ei tuota riittävää vastetta
- virtsainkontinenssi aikuisilla, joilla on kaulan alapuolisen pysyvän selkäydinvamman tai multippeliskleroosin aiheuttama neurogeeninen yliaktiivinen rakkolihas.
Ihon ja ihon apuelinten sairaudet:
- jatkuva, vakava kainaloiden primaarinen hyperhidroosi, joka häiritsee potilaan päivittäisiä toimintoja eikä reagoi paikalliseen hoitoon.
Annostus ja antotapa
Annostus
Botuliinitoksiiniyksiköitä ei voi soveltaa muihin valmisteisiin. Allergan-yksiköissä suositellut annokset eroavat muista botuliinitoksiinivalmisteista.
Neurologin on diagnosoitava krooninen migreeni, ja Botox-hoidon saa antaa ainoastaan kroonisen migreenin hoitoon erikoistuneen neurologin valvonnassa.
Iäkkäät potilaat
Iäkkäille ei tarvita erityistä annoksen sovittamista. Hoito tulisi aloittaa pienimmällä kuhunkin käyttöaiheeseen suositellulla annoksella. Toistetuissa injektioissa suositellaan pienimmän tehokkaan annoksen käyttöä ja pisintä kliinisesti aiheellista aikaa injektioiden välillä. Iäkkäitä potilaita, joilla on merkitseviä aiempia sairauksia ja samanaikaisia lääkityksiä, on hoidettava varoen. Aivohalvauksen jälkeisen ylä- ja alaraajan spastisuuden Botox-hoidosta yli 65‑vuotiailla potilailla on vain vähän kliinisiä tietoja. Lisätiedot, ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet, Haittavaikutukset ja Farmakodynamiikka.
Pediatriset potilaat
Botox-valmisteen turvallisuutta ja tehoa muiden kuin kohdassa Käyttöaiheet kuvattujen pediatrisia potilaita koskevien käyttöaiheiden yhteydessä ei ole varmistettu. Suosituksia annostuksesta ei voida antaa muiden käyttöaiheiden kuin CP-vammaan liittyvän pediatrisen fokaalisen spastisuuden osalta. Tässä käyttöaiheessa BOTOX-valmistetta saavat antaa vain lääkärit, joilla on kokemusta pediatrisen fokaalisen spastisuuden arvioinnista ja hoidosta, osana strukturoitua kuntoutushoito-ohjelmaa.
Tällä hetkellä saatavillaa olevat tiedot pediatrisista potilaista on kuvattu kohdissa Annostus ja antotapa, Varoitukset ja käyttöön liittyvät varotoimet, Haittavaikutukset ja Farmakodynamiikka, kuten seuraavassa taulukossa esitetään.
| 12 vuotta (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset) |
| 12 vuotta (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset) |
| 2 vuotta (ks. kohdat Annostus ja antotapa, Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset) |
| 12 vuotta (12–17 vuoden ikäisten hoidosta on vähän kokemusta, ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet, Haittavaikutukset ja Farmakodynamiikka) |
| 5–17 vuotta (ks. kohdat Haittavaikutukset ja Farmakodynamiikka) |
| 12–17 vuotta (ks. kohdat Haittavaikutukset ja Farmakodynamiikka) |
Seuraavat tiedot on tärkeää huomioida:
Jos yhden injektiotoimenpiteen osana käytetään eri vahvuutta olevia Botox-injektiopulloja, oikean liuotinmäärän käytössä on oltava huolellinen saatettaessa käyttövalmiiksi tietty yksikkömäärä 0,1 ml:aa kohden. Käytettävä liuotinmäärä on erilainen, kun käytetään 50 Allergan-yksikköä, 100 Allergan-yksikköä tai 200 Allergan-yksikköä sisältävää Botox-valmistetta. Jokainen ruisku on merkittävä vastaavasti.
Botox-valmisteen saa saattaa käyttövalmiiksi vain käyttämällä steriiliä säilytysaineetonta 0,9 %:sta natriumkloridi-injektioneste, liuosta. Ruiskuun vedetään asianmukainen määrä liuotinta. Katso laimennustaulukot kohdasta Käyttö- ja käsittelyohjeet.
Tämä valmiste on vain yhtä käyttökertaa varten, ja käyttämättä jäävä liuos on hävitettävä.
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet injektiopullojen käyttöön, käsittelyyn ja hävittämiseen.
Antotapa
Ks. jäljempää kunkin käyttöaiheen mukaiset ohjeet.
Botox-hoitoa saavat antaa vain asianmukaisen pätevyyden omaavat lääkärit, joilla on kokemusta tällaisesta hoidosta ja vaadittavien tarvikkeiden käytöstä.
Yleispäteviä optimaalisia annostuksia tai lihaskohtaisten injektiokohtien määrää ei ole vahvistettu kaikkiin käyttöaiheisiin. Siksi lääkärin tulee tällaisissa tapauksissa laatia potilaalle yksilöllinen hoito-ohjelma. Optimaalinen annostus on määritettävä titraamalla eikä suositeltua enimmäisannosta saa ylittää.
NEUROLOGISET SAIRAUDET:
Pediatristen potilaiden alaraajan fokaalinen spastisuus
Suositeltu neula: Sopivan kokoinen steriili neula. Neulan pituus määritellään lihaksen sijainnin ja syvyyden perusteella.
Anto-ohjeet: Hoidettavien lihasten paikantaminen neulan elektromyografiaohjauksella (EMG), hermostimulaatiolla tai ultraäänellä on suositeltavaa. Paikallispuudutusta tai paikallispuudutuksen ja kevyen tai kohtalaisen sedaation yhdistelmää voidaan käyttää ennen injektiota paikallisen käytännön mukaan. Botox-valmisteen turvallisuutta ja tehoa pediatrisen spastisuuden hoidossa ei ole arvioitu yleisanestesian tai syvän sedaation/analgesian aikana.
Seuraava kaavio esittää pediatrisen alaraajaspastisuuden hoidossa käytettävät injektiokohdat:
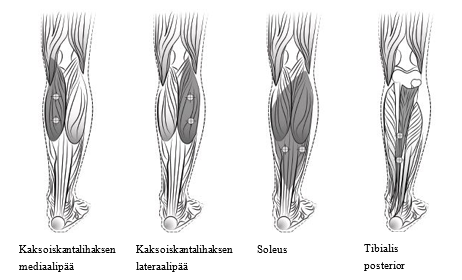
Suositeltu annos: Suositeltava annos pediatrisen alaraajaspastisuuden hoidossa on 4‑8 yksikköä/kg jaettuna spastisten lihasten kesken.
Botox-valmisteen annostus lihasta kohden pediatrisen alaraajaspastisuuden hoidossa
| Hoidettava lihas | Botox 4 yksikköä/kg* (yksiköiden enimmäismäärä lihasta kohden) | Botox 8 yksikköä/kg** (yksiköiden enimmäismäärä lihasta kohden) | Injektiokohtien lukumäärä |
Pakolliset nilkan lihakset Kaksoiskantalihaksen (m. gastrocnemius) mediaalipää | 1 yksikkö/kg (37,5 yksikköä) | 2 yksikköä/kg (75 yksikköä) | 2 |
| Kaksoiskantalihaksen (m. gastrocnemius) lateraalipää | 1 yksikkö/kg (37,5 yksikköä) | 2 yksikköä/kg (75 yksikköä) | 2 |
| Soleus | 1 yksikkö/kg (37,5 yksikköä) | 2 yksikköä/kg (75 yksikköä) | 2 |
| Tibialis posterior | 1 yksikkö/kg (37,5 yksikköä) | 2 yksikköä/kg (75 yksikköä) | 2 |
*ei ylittänyt 150 yksikön kokonaisannosta
**ei ylittänyt 300 yksikön kokonaisannosta
Suurin kokonaisannos: Alaraajaan yhdellä hoitokerralla annettava Botox-valmisteen kokonaisannos ei saa ylittää 8 yksikköä/kg tai 300 yksikköä sen mukaan, kumpi annos on pienempi. Potilaalle pitää harkita uuden injektion antamista, jos hoitava lääkäri arvioi sen asianmukaiseksi, kun edellisen injektion kliininen vaikutus on heikentynyt, aikaisintaan 12 viikon kuluttua edellisestä injektiosta. Kun hoidetaan molempia alaraajoja, kokonaisannos ei saa ylittää 12 viikon jaksolla annosta 10 yksikköä/kg tai 340 yksikköä sen mukaan, kumpi annos on pienempi.
Lisätietoja: Botox-hoidon tarkoituksena ei ole korvata tavanomaisen hoitokäytännön mukaista kuntoutushoito-ohjelmaa. Kliininen vaste ilmenee yleensä ensimmäisten kahden viikon kuluessa injektiosta. Uusintahoitoa annetaan, kun edellisen injektion kliininen vaikutus heikkenee, mutta ei useammin kuin kolmen kuukauden välein.
Aivohalvaukseen liittyvä yläraajan fokaalinen spastisuus aikuisilla
Suositeltu neula: Steriili 25, 27 tai 30 gaugen neula. Neulan pituus määritellään lihaksen sijainnin ja syvyyden perusteella.
Anto-ohjeet: Hoidettavan lihaksen paikallistaminen elektromyografiaohjauksessa tai hermostimulaatiolla tai ultraäänellä voi olla hyödyllistä. Monen injektointikohdan käyttäminen mahdollistaa sen, että Botox pääsee tasaisemmin kosketuksiin hermo-lihasliitosalueen kanssa. Monen injektointikohdan käyttämisestä on hyötyä etenkin suurempien lihasten yhteydessä.
Seuraava kaavio esittää aikuisen yläraajan spastisuuden hoidossa käytettävät injektiokohdat:
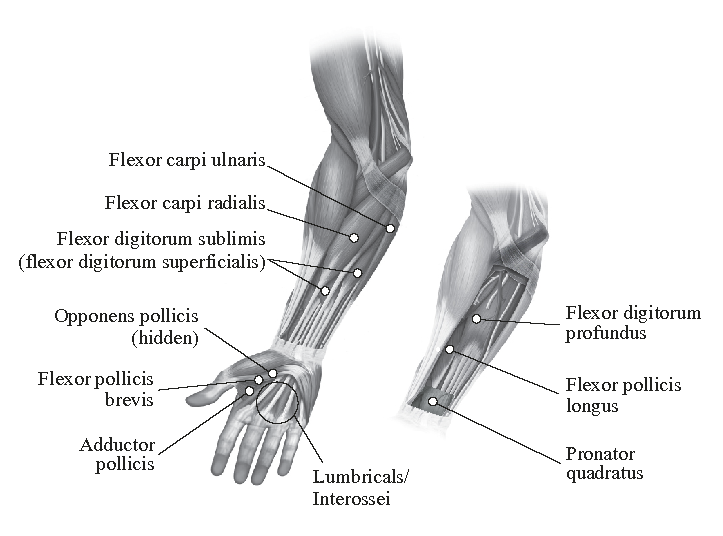
Suositeltu annos: Suositeltu annos aikuisen yläraajan spastisuuden hoitoon on enintään 240 yksikköä jaettuna spastisten lihasten kesken seuraavan taulukon mukaisesti. Enimmäisannos yhden hoitokerran aikana on 240 yksikköä.
Tarkka annostus ja injektointikohtien määrä on räätälöitävä lihasten kokoon, määrään ja sijaintiin sekä spastisuuden vakavuusasteeseen, mahdolliseen paikalliseen lihasheikkouteen ja potilaan aikaisempaan hoitovasteeseen.
| Lihas | Suositeltu annos; antokohtien lukumäärä |
Kyynärvarsi Pronator quadratus | 10–50 yksikköä; 1 antokohta |
Ranne Flexor carpi radialis Flexor carpi ulnaris |
10–50 yksikköä; 1–2 antokohtaa |
Sormet/käsi Flexor digitorum profundus Flexor digitorum sublimis/superficialis Lumbricales-lihakset* Interosseus-lihakset* |
15–50 yksikköä; 1–2 antokohtaa 5–10 yksikköä; 1 antokohta 5–10 yksikköä; 1 antokohta |
Peukalo Adductor pollicis Flexor pollicis longus Flexor pollicis brevis Opponens pollicis |
20 yksikköä; 1–2 antokohtaa 5–25 yksikköä; 1 antokohta 5–25 yksikköä; 1 antokohta |
*Injektoitaessa molempien puolten lumbricales-lihaksiin ja/tai interosseus-lihaksiin suositeltu enimmäisannos on 50 yksikköä kättä kohden.
Lisätietoja: Kontrolloiduissa kliinisissä tutkimuksissa potilaita seurattiin 12 viikon ajan yhden hoitokerran jälkeen. Lihastonus parani yleensä kahden viikon sisällä. Parhaimmillaan vaikutus oli yleensä 4–6 viikon sisällä. Avoimessa jatkotutkimuksessa useimmille potilaille annettiin uusi injektio 12–16 viikon kuluttua, kun vaikutus lihastonukseen oli vähentynyt. Nämä potilaat saivat enintään neljä injektiota. Suurin kumulatiivinen annos oli 960 yksikköä 54 viikon kuluessa. Kun injektion teho on alkanut vähentyä, voidaan antaa lisäannoksia, jos hoitava lääkäri näkee tämän aiheelliseksi, kuitenkin aikaisintaan 12 viikon kuluttua edellisestä injektiosta. Lihasspastisuuden aste ja jakauma uusintainjektion yhteydessä voi antaa aihetta muuttaa Botox-annoksia ja injektoitavia lihaksia. On pyrittävä käyttämään pienintä tehokasta annosta.
Aivohalvaukseen liittyvä alaraajan fokaalinen spastisuus aikuisilla
Suositeltu neula: Steriili 25, 27 tai 30 gaugen neula. Neulan pituus määritellään lihaksen sijainnin ja syvyyden perusteella.
Anto-ohjeet: Hoidettavan lihaksen paikallistaminen elektromyografiaohjauksessa tai hermostimulaatiolla voi olla hyödyllistä. Monen injektointikohdan käyttäminen mahdollistaa sen, että Botox pääsee tasaisemmin kosketuksiin hermo-lihasliitosalueen kanssa. Monen injektointikohdan käyttämisestä on hyötyä etenkin suurempien lihasten yhteydessä.
Seuraavassa kaaviossa esitetään aikuisen alaraajan spastisuuden yhteydessä käytettävät antokohdat:
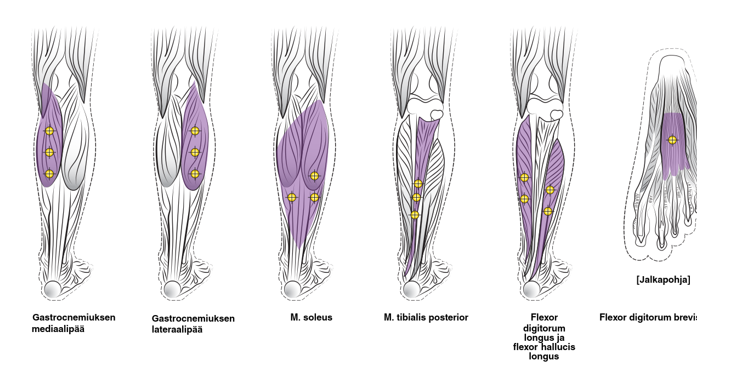
Suositeltu annos: Suositeltu annos aikuisen nilkkaan ja jalkaterään liittyvän alaraajan spastisuuden hoitoon on 300–400 yksikköä jaettuna enintään 6 lihakseen seuraavan taulukon mukaisesti. Suurin suositeltava annos yhden hoitokerran aikana on 400 yksikköä.
Botox-valmisteen annostelu eri lihaksiin aikuisen alaraajan spastisuuden hoidossa:
| Lihas | Suositeltu annos Kokonaisannos; antokohtien lukumäärä |
Kaksoiskantalihaksen (m. gastrocnemius) mediaalipää lateraalipää |
75 yksikköä; 3 antokohtaa |
| Soleus | 75 yksikköä; 3 antokohtaa |
| Tibialis posterior | 75 yksikköä; 3 antokohtaa |
| Flexor hallucis longus | 50 yksikköä, 2 antokohtaa |
| Flexor digitorum longus | 50 yksikköä, 2 antokohtaa |
| Flexor digitorum brevis | 25 yksikköä, 1 antokohta |
Lisätietoja: Kun injektion teho on alkanut vähentyä, voidaan antaa lisäannoksia, jos hoitava lääkäri näkee tämän aiheelliseksi, kuitenkin aikaisintaan 12 viikon kuluttua edellisestä injektiosta.
Blefarospasmi ja hemifasiaalinen spasmi
Suositeltu neula: Steriili 27–30 gaugen (0,40–0,30 mm:n) neula.
Anto-ohjeet: Elektromyografiaohjaus ei ole välttämätön.
Suositeltu annos: Suositeltu aloitusannos on 1,25–2,5 yksikköä yläluomen mediaaliseen ja lateraaliseen orbicularis oculiin sekä alaluomen lateraaliseen orbicularis oculiin. Injektioita voidaan antaa myös muihin kohtiin kulmakarvojen alueelle, lateraaliseen orbicularikseen ja kasvojen yläosaan, jos näiden alueiden lihaskouristukset häiritsevät näkemistä.
Suurin kokonaisannos: Ensimmäisellä hoitokerralla silmäkohtainen annos ei saa ylittää 25 yksikköä. Blefarospasmin hoidossa kokonaisannostus ei saa ylittää 100 yksikköä 12 viikon välein.
Lisätietoja: Hoidon komplikaationa mahdollisesti ilmenevän ptoosin riskiä voidaan pienentää välttämällä injektioita levator palpebrae superioriksen läheisyydessä, ja diplopian riskiä voidaan pienentää välttämällä mediaalisia alaluomi-injektioita ja vähentämällä näin diffuusiota alavinoon silmälihakseen. Seuraavissa kuvissa esitetään käytettävät injektiokohdat.
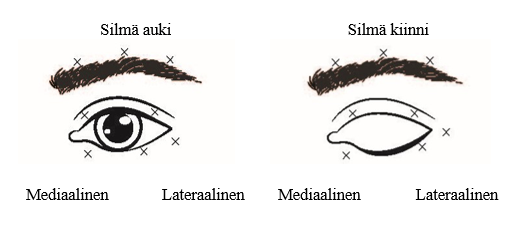
Vaikutus alkaa yleensä kolmen päivän kuluessa ja on huipussaan 1−2 viikon kuluttua hoidosta. Hoidon vaikutus kestää yleensä noin kolme kuukautta, minkä jälkeen hoito voidaan toistaa tarvittaessa. Uusilla hoitokerroilla annos voidaan enintään kaksinkertaistaa ensimmäisestä hoitokerrasta, jos ensimmäisen hoitokerran tuloksia pidetään riittämättöminä. Yli 5 yksikön injektoiminen yhteen injektiokohtaan ei kuitenkaan näytä parantavan hoitotulosta merkittävästi. Yleensä hoidon toistaminen useammin kuin 3 kuukauden välein ei tuota lisähyötyä.
Hemifasiaalisesta spasmista tai kasvohermon (VII aivohermo) häiriöistä kärsiviä potilaita hoidetaan kuten yksipuolisesta blefarospasmista kärsiviä potilaita. Muihin kasvolihaksiin (esim. zygomaticus major, orbicularis oris) annetaan injektioita tarpeen mukaan.
Servikaalinen dystonia
Suositeltu neula: Sopivan kokoinen neula (yleensä 25–30 gaugea / 0,50–0,30 mm).
Anto-ohjeet: Kliinisissä kokeissa servikaalisen dystonian hoidossa Botox-valmistetta on tyypillisesti injisoitu seuraaviin lihaksiin: sternocleidomastoideus, levator scapulae, scalenus, splenius capitis, semispinalis, longissimus ja/tai trapezius. Luettelo ei ole täydellinen, sillä mikä tahansa pään asentoon vaikuttava lihas voi liittyä tilaan ja siten vaatia hoitoa.
Sopivaa annosta valittaessa on huomioitava potilaan lihasmassa sekä hypertrofian tai atrofian aste. Lihasten aktivoituminen servikaalisessa dystoniassa saattaa muuttua spontaanisesti, muuttamatta kuitenkaan dystonian kliinistä kuvaa.
Jos yksittäisiä lihaksia on vaikea paikantaa, injektiot on annettava elektromyografian avulla.
Suositeltu annos: Ensimmäisellä hoitokerralla kokonaisannos ei saa ylittää 200 yksikköä. Myöhemmillä hoitokerroilla annosta muutetaan ensimmäisen hoitokerran vasteen perusteella.
Alustavissa kontrolloiduissa kliinisissä tutkimuksissa, joissa pyrittiin selvittämään valmisteen turvallisuutta ja tehoa servikaalisen dystonian hoidossa, käyttövalmiin Botox-valmisteen annokset olivat 140−280 yksikköä. Uudemmissa tutkimuksissa annokset ovat olleet 95–360 yksikköä (keskiarvo noin 240 yksikköä). Kuten aina lääkkeitä käytettäessä, uusien potilaiden hoito on aloitettava pienintä tehokasta annosta käyttäen. Yhteen kohtaan ei saa injektoida yli 50 yksikköä. Sternocleidomastoideukseen ei saa injektoida yli 100 yksikköä. Dysfagian riskin vähentämiseksi sternocleidomastoideukseen ei saa antaa bilateraalista injektiota.
Suurin kokonaisannos: Yhden hoitokäynnin kokonaisannos ei saa ylittää 300:aa yksikköä. Injektiokohtien optimaalinen lukumäärä riippuu lihaksen koosta. Alle 10 viikon hoitoväliä ei suositella.
Lisätietoja: Kliininen vaste ilmenee yleensä ensimmäisten kahden viikon kuluessa injektiosta. Suurin kliininen hyöty saavutetaan yleensä kuusi viikkoa injektion jälkeen. Hyötyvaikutuksen kesto vaihteli kliinisissä tutkimuksissa huomattavasti (2–33 viikkoa). Tyypillisessä tapauksessa vaikutus kesti noin 12 viikkoa.
Krooninen migreeni
Suositeltu neula: Steriili 30 gaugen, 0,5″ (13 mm:n) neula
Anto-ohjeet: Injektiot on jaettava pään/niskan seitsemälle erityiselle lihasalueelle seuraavan taulukon mukaisesti. Niskan alueelle saattaa olla tarpeen käyttää 1″ (25 mm:n) neulaa, jos potilaan niskalihakset ovat erityisen paksut. Injektio annetaan kaikkiin lihaksiin kummallekin puolelle siten, että puolet injektioista annetaan pään ja niskan vasemmalle puolelle ja puolet oikealle puolelle. Poikkeuksena tähän on procerus-lihas, johon injektio annetaan yhteen kohtaan (keskiviivaan). Jos potilaalla on erityisiä kipukohtia, näihin voidaan antaa lisäinjektiot joko toiselle tai kummallekin puolelle enintään kolmeen erityiseen lihasryhmään (occipitalis, temporalis ja trapezius) enintään seuraavassa taulukossa mainittuina enimmäisannoksina lihasta kohden.
Seuraavissa kuvissa esitetään injektiokohdat:
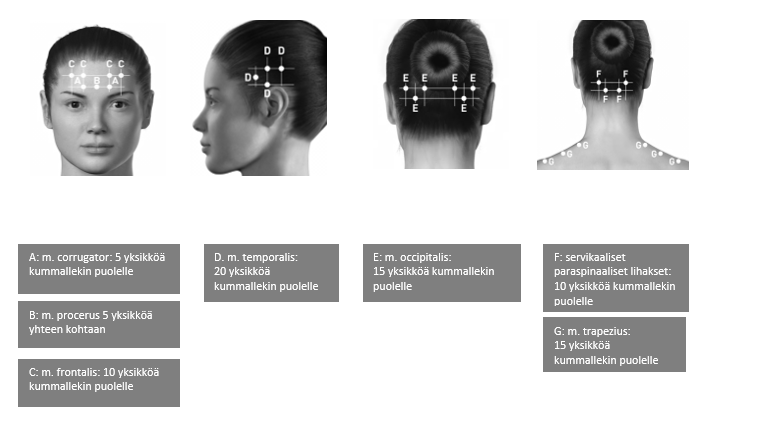
Seuraavissa kuvissa esitetään suositellut lihasryhmät mahdollisille lisäinjektioille:
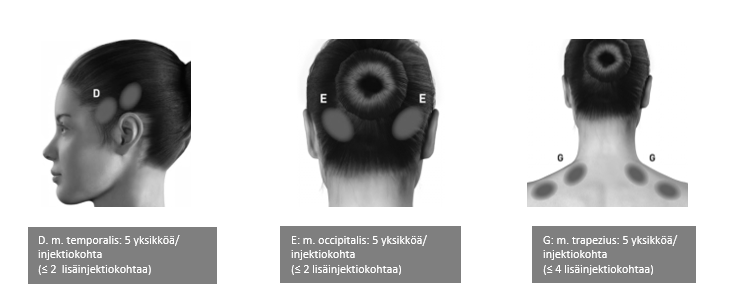
Suositeltu annos: 155−195 yksikköä lihakseen (i.m.) 0,1 ml:n (5 yksikön) injektioina 31−39 injektiokohtaan.
BOTOX-valmisteen annostelu eri lihaksiin kroonisen migreenin hoidossa:
| Suositusannos | |
| Pään/niskan alue | Kokonaisannos (injektiokohtien lukumäärä*) |
| m. corrugator** | 10 yksikköä (2 injektiokohtaa) |
| m. procerus | 5 yksikköä (1 injektiokohta) |
| m. frontalis** | 20 yksikköä (4 injektiokohtaa) |
| m. temporalis** | 40 yksikköä (8 injektiokohtaa), enintään 50 yksikköä (enintään 10 injektiokohtaa) |
| m. occipitalis** | 30 yksikköä (6 injektiokohtaa), enintään 40 yksikköä (enintään 8 injektiokohtaa) |
| Servikaalinen paraspinaalinen lihasryhmä** | 20 yksikköä (4 injektiokohtaa) |
| m. trapezius** | 30 yksikköä (6 injektiokohtaa), enintään 50 yksikköä (enintään 10 injektiokohtaa) |
| Kokonaisannosväli: | 155–195 yksikköä 31–39 injektiokohtaa |
*1 intramuskulaarinen injektiokohta= 0,1 ml = 5 yksikköä Botox-valmistetta
**Annos jaetaan kummallekin puolelle
Lisätietoja:Suositeltu uudelleenhoitoaikataulu on 12 viikon välein.
VIRTSARAKON SAIRAUDET:
Potilaalla ei saa olla virtsatieinfektiota hoitoajankohtana.
Antibioottiprofylaksia on annettava 1–3 päivän ajan ennen hoitoa, hoitopäivänä ja 1–3 päivän ajan hoidon jälkeen.
On suositeltavaa, että potilas lopettaa antitrombosyyttihoidon ainakin 3 päivää ennen injektiota. Jos potilas saa antikoagulanttihoitoa, verenvuotoriskin pienentämisestä on huolehdittava.
Virtsainkontinenssin hoidossa Botox-valmistetta saavat antaa vain lääkärit, joilla on kokemusta rakon toimintahäiriöiden arvioinnista ja hoidosta (esim. urologit, urogynekologit).
Yliaktiivinen virtsarakko
Suositeltu neula: Taipuisaa tai jäykkää kystoskooppia voidaan käyttää. Injektioneula on ennen injektioiden aloittamista täytettävä (valmistettava) noin 1 ml:lla (neulan pituudesta riippuen) käyttövalmiiksi saatettua Botox-valmistetta, jotta ilma poistuu neulasta.
Anto-ohjeet: Ennen injektiota voidaan paikallisesta käytännöstä riippuen käyttää joko rakonsisäistä tippapuudutusta laimennetulla anesteetilla (sedaation kanssa tai ilman) tai yleisanestesiaa. Jos potilaalle tehdään tippapuudutus, rakko on dreneerattava ja huuhdeltava steriilillä natriumkloridiliuoksella ennen seuraavia injektiotoimenpiteitä.
Käyttövalmiiksi saatettu Botox (100 yksikköä/10 ml) injektoidaan rakkolihakseen joustavan tai jäykän kystoskoopin kautta, virtsarakon kolmiota ja pohjaa välttäen. Virtsarakkoon on tiputettava sen verran natriumkloridiliuosta, että riittävä visualisointi saavutetaan, mutta liikaa venyttämistä on vältettävä.
Neula työnnetään noin 2 mm rakkolihaksen sisään, ja 0,5 ml:n injektiot [20 injektiota, (0,5 ml/injektio), yhteensä 10 ml] pistetään noin 1 cm:n päähän toisistaan (katso kuva alla). Viimeiseen injektioon on lisättävä 1 ml steriiliä 0,9 %:sta natriumkloridi-injektioneste, liuosta, jotta koko annos saadaan annettua. Kun injektiot on annettu, virtsarakon seinämän visualisointiin käytettyä natriumkloridiliuosta ei saa dreneerata, jotta potilaiden kyky tyhjentää virtsarakko voidaan osoittaa ennen potilaan lähtöä hoitoa antavasta yksiköstä. Potilasta on tarkkailtava ainakin 30 minuutin ajan injektioiden jälkeen, kunnes virtsarakko tyhjenee luonnostaan.
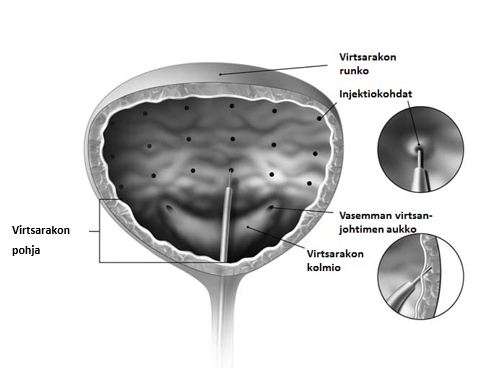
Suositeltu annos: Suositeltu annos on 100 yksikköä Botox-valmistetta 0,5 ml:n (5 yksikköä) injektioina rakkolihaksen 20 eri kohtaan.
Lisätietoja: Kliinistä paranemista ilmenee yleensä 2 viikon sisällä. Potilaan injektoimista uudelleen on harkittava, kun edellisten injektioiden kliininen vaikutus on heikentynyt (vasteen mediaanikesto vaiheen 3 kliinisissä tutkimuksissa oli 166 päivää [noin 24 viikkoa] perustuen potilaiden uudelleenhoitopyyntöihin), edellyttäen kuitenkin, että edellisistä virtsarakkoon annetuista injektioista on kulunut vähintään 3 kuukautta.
Neurogeenisesta rakkolihaksen yliaktiivisuudesta johtuva virtsainkontinenssi
Suositeltu neula: Taipuisaa tai jäykkää kystoskooppia voidaan käyttää. Injektioneula on ennen injektioiden aloittamista täytettävä (valmistettava) noin 1 ml:lla (neulan pituudesta riippuen), jotta ilma poistuu neulasta.
Anto-ohjeet: Ennen injektiota voidaan paikallisesta käytännöstä riippuen käyttää joko rakonsisäistä tippapuudutusta laimennetulla anesteetilla (sedaation kanssa tai ilman) tai yleisanestesiaa. Jos potilaalle tehdään tippapuudutus, rakko on dreneerattava ja huuhdeltava steriilillä natriumkloridiliuoksella ennen seuraavia injektiotoimenpiteitä.
Käyttövalmiiksi saatettu Botox (200 yksikköä/ 30 ml) injektoidaan rakkolihakseen joustavan tai jäykän kystoskoopin kautta, virtsarakon kolmiota ja pohjaa välttäen. Virtsarakkoon on tiputettava sen verran natriumkloridiliuosta, että riittävä visualisointi saavutetaan, mutta liikaa venyttämistä on vältettävä.
Neula työnnetään noin 2 mm rakkolihaksen sisään, ja 1 ml:n injektiot (30 injektiota, yhteensä 30 ml) pistetään noin 1 cm:n päähän toisistaan (katso kuva yllä). Viimeiseen injektioon on lisättävä 1 ml steriiliä 0,9 %:sta natriumkloridi-injektioneste, liuosta, jotta koko annos saadaan annettua. Kun injektiot on annettu, virtsarakon seinämän visualisointiin käytetty natriumkloridiliuos on dreneerattava. Potilasta on tarkkailtava ainakin 30 minuutin ajan injektioiden jälkeen.
Suositeltu annos: Suositeltu annos on 200 yksikköä Botox-valmistetta 1 ml:n injektioina (~ 6,7 yksikköä/injektio) rakkolihaksen 30 eri kohtaan.
Lisätietoja: Kliinistä paranemista ilmenee yleensä 2 viikon sisällä. Potilaan injektoimista uudelleen on harkittava, kun edellisten injektioiden kliininen vaikutus on heikentynyt (vasteen mediaanikesto 200 yksikön Botox-valmisteella vaiheen 3 kliinisissä tutkimuksissa oli 256–295 päivää, (~36–42 viikkoa) perustuen potilaan uudelleenhoitopyyntöihin), edellyttäen kuitenkin, että edellisistä injektioista on kulunut vähintään 3 kuukautta.
IHON JA IHON APUELINTEN SAIRAUDET:
Kainaloiden primaarinen hyperhidroosi
Suositeltu neula: Steriili 30 gaugen neula.
Anto-ohjeet: Hyperhidroottinen alue voidaan määrittää käyttämällä normaaleja värjäystekniikoita, esim. Minorin jodi-tärkkelystestiä.
Suositeltu annos: 50 yksikköä Botox-valmistetta injektoidaan ihonsisäisesti, tasaisesti jaettuna useampaan kohtaan, noin 12 cm välein, kummankin kainalon hyperhidroottiselle alueelle.
Suurin kokonaisannos: Muita annoksia kuin 50 yksikköä kainaloa kohden ei suositella. Injektioiden välisen ajan tulisi olla vähintään 16 viikkoa (ks. kohta Farmakodynamiikka).
Lisätietoja: Kliininen vaste ilmenee yleensä ensimmäisen viikon kuluessa injektiosta. Kun aiemman Botox-injektion kliininen teho on alkanut vähentyä, voidaan antaa uusia injektioita, jos hoitava lääkäri näkee tämän aiheelliseksi.
KAIKKI KÄYTTÖAIHEET:
Jos ensimmäinen hoitokerta ei tuota tulosta, eli jos merkittävää kliinistä vaikutusta ei lähtötasoon verrattuna ole havaittavissa yhden kuukauden kuluttua injektion annosta, on toimittava seuraavasti:
- Toksiinin vaikutus siihen lihakseen tai niihin lihaksiin, joihin injektio(t) on annettu, varmistetaan kliinisesti, esimerkiksi erikoislääkärin suorittamalla elektromyografialla.
- Syyt epäonnistumiseen selvitetään. Tällaisia syitä voivat olla esimerkiksi injektioiden antaminen väärin valittuihin lihaksiin, riittämätön annos, huono injektiotekniikka, pysyvän kontraktuuran ilmeneminen, liian heikot vastavaikuttajalihakset tai toksiinia neutraloivien vasta-aineiden muodostuminen.
- Botuliinitoksiini tyyppi A:n käytön sopivuus arvioidaan uudelleen.
- Jos ensimmäisen hoitokerran jälkeen ei ole ilmennyt haittavaikutuksia, seuraavalla hoitokerralla toimitaan seuraavasti: a) muutetaan annosta huomioiden aiemman hoidon epäonnistumista koskevan analyysin tulokset, b) käytetään elektromyografiaa ja c) pidetään näiden kahden hoitokerran välillä kolmen kuukauden tauko.
Jos hoito ei tuota tulosta tai jos vaikutus heikkenee uusintainjektioiden jälkeen, on käytettävä muita hoitomenetelmiä.
Aikuispotilaiden hoidossa, myös silloin kun käyttöaiheita on useita, suurin kumulatiivinen annos 12 viikon aikana ei saa ylittää 400:aa yksikköä.
Vasta-aiheet
Botox-valmiste on vasta-aiheinen:
- jos potilaan tiedetään olevan yliherkkä botuliinitoksiini tyyppi A:lle tai kohdassa Apuaineet mainituille apuaineille
- jos suunnitellussa injektiokohdassa on infektio.
Kun Botox-valmistetta käytetään virtsarakon sairauden hoitoon, valmiste on vasta-aiheinen myös:
- potilailla, joilla on hoitoajankohtana virtsatieinfektio,
- potilailla, joilla on hoitoajankohtana akuutti virtsaretentio ja jotka eivät katetroi säännöllisesti,
- potilailla, jotka eivät ole halukkaita ja/tai eivät pysty aloittamaan hoidon jälkeistä katetrointia, jos siihen syntyy tarvetta.
Varoitukset ja käyttöön liittyvät varotoimet
Suosituksia Botox-injektioiden antotiheydestä ja annostuksesta ei saa ylittää, koska tällöin on mahdollisen yliannoksen, voimistuneen lihasheikkouden, toksiinin siirtymisen kauas antokohdasta sekä neutraloivien vasta-aineiden kehittymisen vaara. Valmisteella aiemmin hoitamattomien potilaiden hoito on aloitettava kyseiseen käyttöaiheeseen suositellulla pienimmällä annoksella.
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per injektiopullo eli sen voidaan sanoa olevan ”natriumiton”.
Valmistetta määräävän lääkärin ja potilaan pitää olla tietoisia siitä, että haittavaikutuksia voi esiintyä, vaikka potilas olisi sietänyt aiemmat injektiot hyvin. Jokaisella antokerralla on siksi noudatettava varovaisuutta.
Haittavaikutuksia, jotka liittyvät toksiinin siirtymiseen kauas antokohdasta, on ilmoitettu (ks. kohta Haittavaikutukset) ja ne ovat johtaneet toisinaan kuolemaan, jolloin osaan tapauksista liittyi nielemishäiriöitä, keuhkokuumetta ja/tai huomattavaa heikkoutta. Oireet sopivat botuliinitoksiinin vaikutusmekanismiin ja niitä on raportoitu tunteja tai viikkoja injektion antamisen jälkeen. Oireiden riski on todennäköisesti suurin potilailla, joilla on muita tällaisille oireille altistavia perussairauksia ja samanaikaisia sairauksia, kuten spastisuuden vuoksi hoitoa saavilla lapsilla ja aikuisilla sekä potilailla, jotka saavat suuria annoksia.
Hoitoannoksia saavilla potilailla voi ilmetä myös liiallista lihasheikkoutta.
Kunkin potilaan riskejä ja hyötyjä on arvioitava ennen Botox-hoidon aloittamista.
Nielemishäiriöitä on myös raportoitu tapauksissa, joissa injektio on annettu muualle kuin servikaaliseen lihaksistoon (katso kohta Varoitukset ja käyttöön liittyvät varotoimet ”Servikaalinen dystonia”).
Jos potilaalla on subkliinisiä tai kliinisiä hermo-lihasjohtumissairauksien (esim. myasthenia gravis tai Lambert–Eatonin oireyhtymä) oireita ja potilaalla on perifeerinen motorinen neuropaattinen sairaus (esim. amyotrofinen lateraaliskleroosi eli ALS-tauti tai motorinen neuropatia) tai potilaalla on perussairautena neurologinen sairaus, Botox-hoidossa on oltava äärimmäisen varovainen ja potilaiden tilaa on tarkkailtava huolellisesti. Tällaisten potilaiden herkkyys Botox-valmisteen kaltaisille lääkeaineille saattaa olla terapeuttisina annoksinakin käytettäessä lisääntynyt, mikä saattaa johtaa liialliseen lihasheikkouteen, ja kliinisesti merkityksellisten systeemisten vaikutusten, kuten vaikea-asteisten nielemisvaikeuksien ja hengityksen heikentymisen, riski saattaa olla tavanomaista suurempi. Botuliinitoksiinia pitää käyttää tällaiseen hoitoon erikoistuneen lääkärin valvonnassa ja vain, jos hoidon hyötyjen katsotaan olevan sen riskejä suuremmat. Jos potilaalla on aiemmin esiintynyt nielemisvaikeuksia ja aspiraatiota, hoidossa on oltava äärimmäisen varovainen.
Potilaita ja heitä hoitavia henkilöitä on neuvottava hakeutumaan heti lääkäriin, jos potilaalla ilmenee nielemis-, puhe- tai hengityshäiriöitä.
Vähän liikkuvia potilaita on kehotettava lisäämään aktiivisuuttaan asteittain kuten aina käytettäessä sellaisia hoitoja, joiden ansiosta aiemmin vähän liikkuneet potilaat voivat päästä liikkeelle.
Anatomian tuntemus sekä tarkat tiedot mahdollisista kirurgisten toimenpiteiden aiheuttamista muutoksista ovat välttämättömiä Botox-injektioita annettaessa, ja injektion antamista anatomisesti herkkiin kohtiin on vältettävä.
Injektioon liittyvää ilmarintaa on raportoitu, kun Botox-valmistetta on annettu rintakehän alueelle. Erityistä varovaisuutta tarvitaan, jos injisoidaan keuhkojen lähelle (erityisesti kärkien alueelle) tai muihin anatomisesti herkkiin kohtiin.
Vakavia, myös kuolemaan johtavia haittoja on raportoitu potilailla, joille on ohjeiden vastaisesti annettu Botox-valmistetta suoraan sylkirauhasiin, suun, kielen ja nielun alueelle, ruokatorveen tai vatsaan. Joillakin potilailla oli aikaisempi nielemisvaikeus tai huomattava huonokuntoisuus.
Vakavia ja/tai välittömiä yliherkkyysreaktioita, kuten anafylaksiaa, seerumitautia, nokkosihottumaa, pehmytkudoksen turvotusta ja hengenahdistusta, on ilmoitettu harvinaisina tapauksina. Osa näistä tapauksista on esiintynyt Botox-injektion jälkeen, kun se on annettu joko yksinään tai yhdessä muiden valmisteiden kanssa, joiden käyttöön liittyy samankaltaisia reaktioita. Jos tällainen reaktio ilmaantuu, Botox-injektioiden antaminen on lopetettava ja asianmukainen hoito, kuten adrenaliinin antaminen, on aloitettava heti. Yksi anafylaksiatapaus on raportoitu, jossa potilas kuoli sen jälkeen, kun hän oli saanut virheellisesti 5 ml:aan 1-prosenttista lidokaiinia laimennetun Botox-injektion.
Kuten minkä tahansa injektion yhteydessä, toimenpiteeseen liittyviä vammoja voi ilmetä. Injektiosta voi aiheutua paikallinen infektio, kipua, tulehdus, tuntoharhoja, hypestesia, arkuutta, turvotusta, punoitusta ja/tai verenvuotoa/mustelmien muodostumista. Neulaan liittyvä kipu ja/tai pelkotila voi johtaa vasovagaalisiin reaktioihin, kuten pyörtymiseen, verenpaineen laskuun jne.
Varovaisuutta on noudatettava käytettäessä Botox-valmistetta silloin, kun valittu injektiokohta on tulehtunut tai jos injisoitava lihas on hyvin heikko tai surkastunut. Varovaisuus on tarpeen myös silloin, kun Botox-valmistetta annetaan potilaille, joilla on perifeerinen motoneuronisairaus (esim. amyotrofinen lateraaliskleroosi tai motorinen neuropatia).
Joissakin tapauksissa on Botox-injektion annon jälkeen ilmoitettu esiintyneen myös sydän- ja verenkiertojärjestelmään liittyviä haittoja (esimerkiksi rytmihäiriöitä ja sydäninfarkteja), joista osa on johtanut kuolemaan. Osalla näistä potilaista on ollut riskitekijöitä, mukaan lukien sydän- tai verisuonisairaus.
Kouristuskohtausten ilmaantumista tai uusiutumista on ilmoitettu, tyypillisesti aikuis- ja lapsipotilailla, joilla on taipumus tällaisiin kohtauksiin. Näiden haittojen yhteyttä botuliinitoksiini-injektioihin ei ole varmistettu. Lapsiin liittyvät ilmoitukset koskivat lähinnä CP-potilaita, joita hoidettiin spastisuuden takia.
Botuliinitoksiini tyyppi A:ta neutraloivien vasta-aineiden muodostuminen voi heikentää Botox-hoidon tehoa inaktivoimalla toksiinin biologista vaikutusta. Joidenkin tutkimusten tulokset viittaavat siihen, että Botox-injektioiden antaminen lyhyemmin väliajoin tai suurempina annoksina voi johtaa vasta-ainemuodostuksen suurempaan esiintyvyyteen. Vasta-aineiden mahdollisen muodostumisen vaaraa on pienennettävä antamalla mahdollisuuksien mukaan pienin tehokas annos siten, että injektioiden välillä on pisin kliinisesti aiheellinen väli.
Potilaan kliinisen tilan vaihtelu toistuvan Botox-hoidon (tai muun botuliinitoksiinihoidon) aikana saattaa johtua eroista valmisteen laimennuksessa tai injektioiden välisessä ajassa, eri lihasten tai injektiokohtien valinnasta sekä vasteen toteamiseen käytettyjen biologisten testimenetelmien virherajoista.
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Pediatriset potilaat
Botox-valmisteen turvallisuutta ja tehoa muissa kuin kohdassa Käyttöaiheet. kuvatuissa lapsipotilaiden indikaatioissa ei ole varmistettu. Markkinoille tulon jälkeen on hyvin harvoin ilmoitettu mahdollisesta toksiinin laajalle leviämisestä lapsilla, joilla on muita sairauksia, useimmiten CP-vamma. Yleensä näissä tapauksissa on käytetty annosta, joka oli suositeltua annosta suurempi (ks. kohta Haittavaikutukset).
Botuliinitoksiinihoidon jälkeen tapahtuneita kuolemantapauksia, joihin joskus on liittynyt aspiraatiopneumonia, on ilmoitettu harvinaisina lapsilla, joilla on ollut vakava CP-vamma. Näihin tapauksiin sisältyy myös indikaatioista poikkeava käyttö (esim. käyttö kaulan alueella). Lapsia, joilla on merkittävä neurologinen vamma, dysfagia, tai äskettäinen aspiraatiopneumonia tai keuhkosairaus, on hoidettava erittäin varoen. Hoitoa tulisi antaa huonokuntoisille potilaille vain, jos kyseiselle potilaalle mahdollisesti koituvan hyödyn arvioidaan olevan suurempi kuin hoitoon liittyvät vaarat.
NEUROLOGISET SAIRAUDET:
Nilkan ja jalkaterän fokaalinen spastisuus CP-lapsipotilailla sekä nilkan, jalkaterän, ranteen ja käden fokaalinen spastisuus aikuisilla aivohalvauspotilailla
Botox on fokaalisen spastisuuden hoitomuoto, jota on tutkittu ainoastaan tavallisten standardihoitojen yhteydessä, eikä sitä ole tarkoitettu näiden hoitotapojen korvaamiseen. On epätodennäköistä, että Botox parantaisi liikkuvuutta tehokkaasti nivelissä, joissa on pysyvä kontraktuura.
Botox-valmistetta ei saa käyttää aikuisten aivohalvauspotilaiden yläraajan (käden ja ranteen) ja alaraajan (nilkan ja jalkaterän) fokaalisen spastisuuden hoitoon, jos lihasjännityksen vähenemisen ei odoteta parantavan toimintaa (esimerkiksi kävelyä) tai oireita (esimerkiksi kipua) tai edistävän hoitoa. Alaraajan spastisuudessa aktiivisen toiminnan paraneminen voi olla rajallista, jos Botox-hoito aloitetaan yli 2 vuotta aivohalvauksen ilmenemisen jälkeen, tai potilailla, joilla on lievempi nilkan spastisuus (Modified Ashworth Scale (MAS) < 3).
Mahdollisesta lisääntyneestä kaatumisriskistä kärsivien aikuisten aivohalvauspotilaiden spastisuuden hoidon suhteen on noudatettava varovaisuutta.
- Botox-valmistetta on käytettävä varoen iäkkäiden aivohalvauspotilaiden yläraajan (ranteen ja käden) ja alaraajan (nilkan ja jalkaterän) fokaalisen spastisuuden hoitoon potilailla, joilla on samanaikaisia muita merkittäviä sairauksia. Hoito aloitetaan vain, jos hyödyt katsotaan mahdollisia riskejä suuremmiksi.
- Botox-valmistetta saa käyttää aivohalvauspotilaiden ylä- ja/tai alaraajan spastisuuden hoitoon ainoastaan kokeneen, aivohalvauspotilaiden kuntoutukseen erikoistuneen terveydenhuollon ammattilaisen arvion jälkeen.
Valmisteen markkinoille tulon jälkeen on ilmoitettu kuolemantapauksia (liittynyt toisinaan aspiraatiopneumoniaan) ja toksiinin mahdollista siirtymistä kauas antokohdasta lähinnä lapsilla, joilla on ollut muita samanaikaisia sairauksia (lähinnä CP-lapsipotilailla), kun he ovat saaneet botuliinitoksiinihoitoa. Ks. varoitukset kohdasta Varoitukset ja käyttöön liittyvät varotoimet, Pediatriset potilaat.
Blefarospasmi
Vähentynyt silmien räpytys orbicularis-lihakseen annetun botuliinitoksiini-injektion jälkeen voi aiheuttaa sarveiskalvon altistumista kuivumiselle, pysyvää epiteelin vaurioitumista ja sarveiskalvon haavautumista erityisesti, jos potilaalla on VII aivohermon sairaus. Aikaisemmin leikattujen silmien korneatunto on aina testattava huolellisesti. Alaluomen alueelle ei saa injektoida, jotta vältetään luomen reunan uloskääntymä. Mahdolliset epiteelivauriot on hoidettava tehokkaasti. Hoitomuotoja voivat olla suojaavat tipat, voiteet, terapeuttiset pehmeät piilolinssit tai silmän sulkeminen lapulla tai muulla keinolla.
Silmäluomen pehmytkudoksissa voi esiintyä mustelmia. Ne voidaan minimoida painamalla injektiokohtaa varovasti heti injektion jälkeen.
Botuliinitoksiinin antikolinergisen vaikutuksen vuoksi varovaisuus on tarpeen hoidettaessa potilaita, joilla on ahdaskulmaglaukoomariski tai ahdas kammiokulma.
Servikaalinen dystonia
Servikaalista dystoniaa sairastaville potilaille on kerrottava nielemishäiriöiden mahdollisuudesta. Nielemishäiriöt voivat olla hyvin lieviä, mutta myös vaikeita häiriöitä saattaa ilmetä. Nielemishäiriöt saattavat kestää kahdesta kolmeen viikkoa injektion annon jälkeen, mutta niiden on ilmoitettu joissakin tapauksissa kestäneen jopa viisi kuukautta injektion annon jälkeen. Nielemishäiriöiden seurauksena voi ilmetä aspiraatiota, hengenahdistusta ja joskus letkuruokinnan tarvetta. Harvinaisissa tapauksissa nielemishäiriöiden on ilmoitettu johtaneen aspiraatiokeuhkokuumeeseen ja kuolemaan.
Sternocleidomastoideukseen annettavan injektioannoksen rajoittaminen alle 100 yksikköön saattaa vähentää nielemishäiriöiden esiintyvyyttä. Nielemishäiriöiden riskin on ilmoitettu olevan suurempi potilailla, joiden kaulan lihasmassa on pieni tai jotka ovat saaneet molemminpuolisia injektioita sternocleidomastoideukseen. Nielemishäiriöt johtuvat yleensä toksiinin leviämisestä ruokatorven lihaksiin. Kohottajalihakseen (levator scapulae) annettuun injektioon saattaa liittyä ylempien hengitysteiden infektioiden ja nielemishäiriöiden vaaran lisääntymistä.
Nielemishäiriö voi vähentää ruoan ja nesteen saantia johtaen laihtumiseen ja elimistön kuivumiseen. Vähäoireista nielemishäiriötä sairastavilla vaikea-asteisemman nielemishäiriön ilmaantumisen vaara Botox-injektion jälkeen voi olla suurentunut.
Krooninen migreeni
Valmisteen turvallisuutta ja tehoa episodisen migreenin (päänsärkyä < 15 päivänä kuukaudessa) tai kroonisen lihasjännityspäänsäryn estohoidossa ei ole varmistettu. Botox-valmisteen turvallisuutta ja tehoa lääkeainepäänsäryn (sekundaarisen päänsäryn) hoidossa ei ole tutkittu.
VIRTSARAKON SAIRAUDET:
Kystoskopiaa suoritettaessa on noudatettava asiaankuuluvaa lääketieteellistä varovaisuutta.
Jos potilas ei katetroi, rakon tyhjennyksen jälkeinen jäännösvirtsamäärä on arvioitava hoidon jälkeisten 2 viikon sisällä sekä lääketieteellisesti sopivin väliajoin aina 12 viikkoon asti. Potilasta on neuvottava ottamaan yhteyttä lääkäriin, jos hänellä ilmenee virtsaamisvaikeuksia, sillä katetrointi voi olla tarpeen.
Yliaktiivinen rakko
Miehiä, joilla on yliaktiivinen rakko ja virtsatieahtauman oireita tai löydöksiä, ei saa hoitaa Botox-valmisteella.
Neurogeenisesta rakkolihaksen yliaktiivisuudesta johtuva virtsainkontinenssi
Toimenpiteeseen liittyvää autonomista dysrefleksiaa voi ilmetä, mikä voi vaatia pikaista lääkärinhoitoa.
IHON JA IHON APUELINTEN SAIRAUDET:
Kainaloiden primaarinen hyperhidroosi
Sairaushistoria, lääkärintarkastus sekä tarvittaessa erityistutkimukset ovat tarpeen, jotta mahdolliset sekundaarista hyperhidroosia aiheuttavat syyt (esim. hypertyreoosi, feokromosytooma) voitaisiin sulkea pois. Näin vältetään hyperhidroosin pelkkä oireenmukainen hoito ilman perussairauden diagnosointia ja/tai hoitoa.
Yhteisvaikutukset
Teoriassa on mahdollista, että aminoglykosidiantibiootit, spektinomysiini tai muut hermolihasjohtumiseen vaikuttavat lääkkeet (esimerkiksi hermolihasliitosta salpaavat aineet) tehostavat botuliinitoksiinin vaikutusta.
Botuliinineurotoksiinin eri serotyyppien samanaikaisen annon tai muutaman kuukauden väliajoin tapahtuvan annon vaikutusta ei tiedetä. Liiallinen neuromuskulaarinen heikkous voi pahentua, jos toista botuliinitoksiinia annetaan ennen aiemmin annetun botuliinitoksiinin vaikutusten häviämistä.
Yhteisvaikutustutkimuksia ei ole tehty. Kliinisesti merkittäviä yhteisvaikutuksia ei ole raportoitu.
Pediatriset potilaat
Yhteisvaikutuksia ei ole tutkittu lapsilla.
Raskaus ja imetys
Raskaus
Ei ole olemassa tarkkoja tietoja botuliinitoksiini tyyppi A:n käytöstä raskaana oleville naisille. Eläinkokeissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Mahdollista riskiä ihmisille ei tunneta. Botox-valmistetta ei pitäisi käyttää raskauden aikana eikä hedelmällisessä iässä oleville naisille, jotka eivät käytä raskaudenehkäisyä, mikäli käyttö ei ole selvästi välttämätöntä.
Imetys
Ei ole tiedossa, erittyykö Botox ihmisen rintamaitoon. Botox-valmisteen käyttö imetyksen aikana ei ole suositeltavaa.
Hedelmällisyys
Botuliinitoksiini tyyppi A:n käytön vaikutuksista hedelmällisessä iässä olevien naisten hedelmällisyyteen ei ole riittävästi tietoa. Uros- ja naarasrotilla tehdyt tutkimukset ovat viitanneet hedelmällisyyden heikkenemiseen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Tutkimuksia valmisteen vaikutuksesta ajokykyyn tai koneidenkäyttökykyyn ei ole tehty. Botox voi kuitenkin aiheuttaa voimattomuutta, lihasheikkoutta, huimausta ja näköhäiriöitä, jotka voivat vaikuttaa ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Yleistä
Kontrolloiduissa kliinisissä tutkimuksissa raportoitiin haittatapahtumia, joiden tutkijat arvioivat liittyvän Botox-hoitoon, 35 %:lla potilaista, joilla oli blefarospasmi, 28 %:lla potilaista, joilla oli servikaalinen dystonia, 8 %:lla pediatrisista potilaista, joilla oli spastisuutta, 11 %:lla potilaista, joilla oli kainaloiden primaarinen hyperhidroosi, 16 %:lla potilaista, joilla oli aivohalvaukseen liittyvää yläraajan fokaalista spastisuutta ja 15 %:lla potilaista, joilla oli aivohalvaukseen liittyvää alaraajan fokaalista spastisuutta. Yliaktiivista virtsarakon toimintaa koskevissa kliinisissä tutkimuksissa haittatapahtumia raportoitiin 26 %:lla ensimmäisen hoidon yhteydessä ja 22 %:lla toisen hoidon yhteydessä. Aikuisten neurogeenista rakkolihaksen yliaktiivisuutta koskevissa kliinisissä tutkimuksissa tämä osuus oli 32 % ensimmäisen hoidon ja 18 % toisen hoidon yhteydessä. Pediatrisilla potilailla neurogeenista rakkolihaksen yliaktiivisuutta koskevissa tutkimuksissa osuus oli 6,2 % ensimmäisen hoidon yhteydessä. Krooniseen migreeniin liittyneissä kliinisissä tutkimuksissa esiintyvyys oli 26 % ensimmäisen hoitokerran yhteydessä, mikä väheni 11 %:iin toisen hoitokerran yhteydessä.
Yleensä haittavaikutukset ilmenevät ensimmäisten parin päivän kuluessa injektion antamisesta ja ovat yleensä ohimeneviä, mutta ne voivat kestää myös useita kuukausia ja harvoissa tapauksissa jopa pidempään.
Paikallinen lihasheikkous on botuliinitoksiinin lihaskudokseen kohdistuvan farmakologisen vaikutuksen odotettavissa oleva ilmentymä. Kuitenkin on ilmoitettu injektiopaikan lähellä ja/tai siitä kaukana olevien lihasten heikkoutta.
Tämän kuten muidenkin valmisteiden injektoimiseen on liittynyt paikallista kipua, tulehdusta, tuntoharhoja, hypestesiaa, aristusta, turvotusta/edeemaa, eryteemaa, paikallista infektiota, verenvuotoa ja/tai mustelmia. Neulan aiheuttama kipu ja/tai ahdistus on johtanut vasovagaalisiin reaktioihin, mukaan lukien ohimenevä oireinen hypotonia ja pyörtyminen. Kuumetta ja flunssaoireita on myös raportoitu botuliinitoksiini-injektioiden jälkeen.
Haittavaikutukset luokitellaan niiden esiintyvyyden perusteella seuraavan luokituksen mukaisesti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000) tai tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Seuraavissa taulukoissa esitetään haittavaikutukset sen mukaan, mihin kohtaan kehoa Botox-injektio annetaan.
NEUROLOGISET SAIRAUDET:
Pediatristen potilaiden fokaalinen alaraajan spastisuus
Elinjärjestelmä | Preferred Term –termi | Esiintyvyys |
Iho ja ihonalainen kudos | Ihottuma | Yleinen |
Luusto, lihakset ja sidekudos | Lihasheikkous | Melko harvinainen |
Vammat, myrkytykset ja hoitokomplikaatiot | Nivelsiteen nyrjähdys, hiertymä ihossa | Yleinen |
Yleisoireet ja antopaikassa todettavat haitat | Kävelyhäiriö, injektiokohdan kipu | Yleinen |
Aivohalvaukseen liittyvä yläraajan fokaalinen spastisuus aikuisilla
Elinjärjestelmä | Preferred Term –termi | Esiintyvyys |
Ruoansulatuselimistö | Pahoinvointi | Yleinen |
Luusto, lihakset ja sidekudos | Raajojen kipu, lihasheikkous | Yleinen |
Yleisoireet ja antopaikassa todettavat haitat | Väsymys, perifeerinen edeema | Yleinen |
Toistuvan annostuksen ei havaittu vaikuttavan kokonaisturvallisuusprofiiliin.
Aivohalvaukseen liittyvä alaraajan fokaalinen spastisuus aikuisilla
Elinjärjestelmä | Preferred Term –termi | Esiintyvyys |
Iho ja ihonalaiskudos | Ihottuma | Yleinen |
Luusto, lihakset ja sidekudos | Nivelkipu, tuki- ja liikuntaelimistön jäykkyys, lihasheikkous | Yleinen |
Yleisoireet ja antopaikassa todettavat haitat | Perifeerinen edeema | Yleinen |
Vammat, myrkytykset ja hoitokomplikaatiot | Kaatuminen | Yleinen |
Toistuvan annostuksen ei havaittu vaikuttavan kokonaisturvallisuusprofiiliin.
Blefarospasmi, hemifasiaalinen spasmi ja näihin liittyvät dystoniat
Elinjärjestelmä | Preferred Term –termi | Esiintyvyys |
Hermosto | Huimaus, kasvohalvaus, kasvohermohalvaus | Melko harvinainen |
Silmät | Silmäluomen ptoosi | Hyvin yleinen |
Pisteinen sarveiskalvotulehdus, avoluomi, silmien kuivuminen, valonarkuus, silmä-ärsytys, lisääntynyt kyynelvuoto | Yleinen | |
Sarveiskalvotulehdus, luomenreunan uloskääntymä, kahtena näkeminen, luomenreunan sisäänkääntymä, näköhäiriöt ja näön sumeneminen | Melko harvinainen | |
Silmäluomen turvotus | Harvinainen | |
Ulseratiivinen keratiitti, sarveiskalvon epiteelin vaurio, sarveiskalvon perforaatio | Hyvin harvinainen | |
Iho ja ihonalainen kudos | Mustelma | Yleinen |
Ihottuma/ihotulehdus | Melko harvinainen | |
Yleisoireet ja antopaikassa todettavat haitat | Ärsytys, kasvojen turvotus | Yleinen |
Väsymys | Melko harvinainen |
Servikaalinen dystonia
Elinjärjestelmä | Preferred Term –termi | Esiintyvyys |
Infektiot | Nuha, ylempien hengitysteiden infektio | Yleinen |
Hermosto | Huimaus, hypertonia, hypestesia, uneliaisuus, päänsärky | Yleinen |
Silmät | Kaksoiskuvat, silmäluomen ptoosi | Melko harvinainen |
Hengityselimet, rintakehä ja välikarsina | Hengenahdistus, dysfonia | Melko harvinainen |
Ruoansulatuselimistö | Nielemishäiriö | Hyvin yleinen |
Suun kuivuminen, pahoinvointi | Yleinen | |
Luusto, lihakset ja sidekudos | Lihasten heikkous | Hyvin yleinen |
Tuki- ja liikuntaelimistön jäykkyys, arkuus | Yleinen | |
Yleisoireet ja antopaikassa todettavat haitat | Kipu | Hyvin yleinen |
Voimattomuus, influenssan kaltainen sairaus, huonovointisuus | Yleinen | |
Kuume | Melko harvinainen |
Krooninen migreeni
Elinjärjestelmä | Preferred Term –termi | Esiintyvyys |
Hermosto | Päänsärky, migreeni sekä migreenin paheneminen, kasvohalvaus | Yleinen |
Silmät | Silmäluomen ptoosi | Yleinen |
Iho ja ihonalainen kudos | Kutina, ihottuma | Yleinen |
Ihon kipu | Melko harvinainen | |
Luusto, lihakset ja sidekudos | Niskakipu, lihaskipu, tuki- ja liikuntaelimistön kipu, tuki- ja liikuntaelimistön jäykkyys, lihasspasmit, lihasten kireys, lihasheikkous | Yleinen |
Leukakipu | Melko harvinainen | |
Mefiston merkki (kulmakarvojen lateraalinen kohoaminen) | Tuntematon | |
Yleisoireet ja antopaikassa todettavat haitat | Injektiokohdan kipu | Yleinen |
Ruoansulatuselimistö | Nielemishäiriö | Melko harvinainen |
Näissä vaiheen 3 tutkimuksissa hoidon keskeytti haittavaikutusten vuoksi 3,8 % Botox-hoitoa saaneista potilaista verrattuna 1,2 %:iin lumelääkettä saaneista potilaista.
VIRTSARAKON SAIRAUDET:
Aikuisten yliaktiivinen virtsarakko
Elinjärjestelmä | Preferred Term –termi | Esiintyvyys |
Infektiot | Virtsatieinfektio | Hyvin yleinen |
Bakteeriuria | Yleinen | |
Munuaiset ja virtsatiet | Dysuria | Hyvin yleinen |
Virtsaretentio, pollakisuria, leukosyyttien esiintyminen virtsassa | Yleinen | |
Tutkimukset | Virtsajäänne* | Yleinen |
*rakon vajavaisen tyhjennyksen seurauksena oleva virtsajäänne, joka ei vaadi katetrin asetusta
Toimenpiteeseen liittyvät haittatapahtumat, joiden esiintyminen oli yleistä, olivat dysuria ja hematuria.
Puhdas ajoittain tehtävä katetrin käyttö aloitettiin 6,5 %:lla potilaista Botox-hoidon (100 yksikköä) jälkeen verrattuna 0,4 %:iin lumelääkeryhmässä.
Kliinisen lumekontrolloidun tutkimuksen 1 242 potilaasta oli 41,4 % (N = 514) iältään ≥ 65-vuotiaita ja 14,7 % (N = 182) ≥ 75-vuotiaita. Alle 65-vuotiaiden Botox-hoitoa saaneiden potilaiden turvallisuusprofiili ei eronnut merkittävästi ≥ 65-vuotiaiden Botox-hoitoa saaneiden potilaiden turvallisuusprofiilista. Poikkeuksena oli virtsatietulehdus, joka ilmeni useammin iäkkäillä potilailla sekä lumelääke- että Botox-ryhmässä verrattuna nuorempiin potilaisiin.
Toistuvien annostelujen turvallisuusprofiilissa ei havaittu muutosta.
Pediatristen potilaiden yliaktiivinen virtsarakko
Elinjärjestelmä | Preferred Term –termi | Esiintyvyys |
Infektiot | Virtsatieinfektio | Yleinen |
Munuaiset ja virtsatiet | Dysuria*, virtsaputken kipu* | Yleinen |
Ruoansulatuselimistö | Vatsakipu, alavatsakipu | Yleinen |
* toimenpiteeseen liittyvä haittavaikutus
Yhdessä kaksoissokkoutetussa, rinnakkaisryhmillä tehdyssä, satunnaistetussa kliinisessä monikeskustutkimuksessa, joka suoritettiin 55:llä iältään 12–17-vuotiaalla potilaalla, haittavaikutukset vastasivat yleisesti ottaen yliaktiivista virtsarakkoa sairastavilla aikuispotilailla todettua turvallisuusprofiilia. Tässä pediatrisilla potilailla tehdyssä, yliaktiivista virtsarakkoa koskeneessa pienessä tutkimuksessa havaittiin kuitenkin haittavaikutuksina myös virtsaputken kipua ja vatsakipua.
Ks. kohdat Annostus ja antotapa ja Farmakodynamiikka.
Aikuisten neurogeenisesta rakkolihaksen yliaktiivisuudesta johtuva virtsainkontinenssi
Elinjärjestelmä | Preferred Term –termi | Esiintyvyys |
Infektiot | Virtsatieinfektioa,b, bakteeriuriab | Hyvin yleinen |
Tutkimukset | Virtsajäänne**b | Hyvin yleinen |
Psyykkiset häiriöt | Unettomuusa | Yleinen |
Ruoansulatuselimistö | Ummetusa | Yleinen |
Luusto, lihakset ja sidekudos | Lihasheikkousa, lihasspasmita | Yleinen |
Munuaiset ja virtsatiet | Virtsaretentioa,b | Hyvin yleinen |
Hematuria*a,b, dysuria*a,b, virtsarakkodivertikkelia | Yleinen | |
Yleisoireet ja antopaikassa todettavat haitat | Väsymysa, kävelyhäiriöta | Yleinen |
Vammat, myrkytykset ja hoitokomplikaatiot | Autonominen dysrefleksia*a, kaatuminena | Yleinen |
* toimenpiteeseen liittyviä haittavaikutuksia
** rakon vajavaisen tyhjennyksen seurauksena oleva virtsajäänne, joka ei vaadi katetrin asetusta
a Vaiheen 2 kliinisissä tutkimuksissa ja vaiheen 3 avaintutkimuksissa ilmenneet haittavaikutukset
b Myyntiluvan myöntämisen jälkeisessä Botox 100 yksikköä -tutkimuksessa MS-potilailla, jotka eivät katetroineet lähtötilanteessa, ilmenneet haittavaikutukset
Kliinisissä tutkimuksissa raportoitiin virtsatieinfektioita 49,2 %:lla 200 yksikön Botox-valmisteella hoidetuista ja 35,7 %:lla lumelääkkeellä hoidetuista potilaista (53,0 %:lla 200 yksikön Botox-valmisteella ja 29,3 %:lla lumelääkkeellä hoidetuista multippeliskleroosipotilaista; 45,4 %:lla 200 yksikön Botox-valmisteella ja 41,7 %:lla lumelääkkeellä hoidetuista selkäydinvammapotilaista). Virtsaretentiota raportoitiin 17,2 %:lla 200 yksikön Botox-valmisteella hoidetuista ja 2,9 %:lla lumelääkkeellä hoidetuista potilaista (28,8 %:lla 200 yksikön Botox-valmisteella ja 4,5 %:lla lumelääkkeellä hoidetuista multippeliskleroosipotilaista; 5,4 %:lla 200 yksikön Botox-valmisteella ja 1,4 %:lla lumelääkkeellä hoidetuista selkäydinvammapotilaista).
Tämän tyyppisissä haittavaikutuksissa ei havaittu muutoksia toistetussa hoidossa.
Multippeliskleroosin (MS) vuosittaisessa pahenemisasteessa (MS:n pahenemistapahtumien määrä potilasvuotta kohden) ei havaittu eroa avaintutkimuksiin osallistuneilla MS-potilailla (Botox = 0,23, lumelääke = 0,20) eikä myyntiluvan myöntämisen jälkeen tehtyyn Botox 100 yksikköä -tutkimukseen osallistuneilla MS-potilailla, jotka eivät katetroineet lähtötilanteessa (Botox = 0, lumelääke = 0,07).
Avaintutkimuksissa potilaista, jotka eivät katetroineet lähtötilanteessa ennen hoitoa, 38,9 %:lla aloitettiin katetrointi 200 yksikön Botox-hoidon jälkeen ja 17,3 %:lla lumelääkehoidon jälkeen.
Myyntiluvan myöntämisen jälkeisessä Botox 100 yksikköä -tutkimuksessa MS-potilailla, jotka eivät katetroineet lähtötilanteessa, katetrointi aloitettiin 15,2 %:lla potilaista Botox 100 yksikköä ‑hoidon jälkeen ja 2,6 %:lla lumelääkkeellä hoidetuista (ks. kohta Farmakodynamiikka).
Pediatristen potilaiden neurogeeninen rakkolihaksen yliaktiivisuus
Elinjärjestelmä | Preferred Term –termi | Esiintyvyys |
Infektiot | Bakteeriuria | Hyvin yleinen |
Virtsatieinfektio, leukosyturia | Yleinen | |
Munuaiset ja virtsatiet | Hematuria, virtsarakon kipu* | Yleinen |
* toimenpiteeseen liittyvä haittavaikutus
Toistuvassa annossa ei havaittu muutosta haittavaikutusten tyypissä.
Ks. kohdat Annostus ja antotapa ja Farmakodynamiikka.
IHON JA IHON APUELINTEN SAIRAUDET:
Kainaloiden primaarinen hyperhidroosi
Elinjärjestelmä | Preferred Term –termi | Esiintyvyys |
Hermosto | Päänsärky, tuntoharhat | Yleinen |
Verisuonisto | Kuumat aallot | Yleinen |
Ruoansulatuselimistö | Pahoinvointi | Melko harvinainen |
Iho ja ihonalainen kudos | Liikahikoilu (hikoilu muualla kuin kainaloissa), epänormaali ihon haju, kutina, ihonalainen kyhmy ja alopecia | Yleinen |
Luusto, lihakset ja sidekudos | Raajojen kipu | Yleinen |
Lihasten heikkous, lihaskipu, nivelsairaus | Melko harvinainen | |
Yleisoireet ja antopaikassa todettavat haitat | Injektiokohdan kipu | Hyvin yleinen |
Kipu, injektiopaikan turvotus, injektiopaikan verenvuoto, injektiopaikan yliherkkyys, ärsytys injektiopaikassa, voimattomuus ja injektiopaikan reaktiot | Yleinen |
Kainaloiden primaarisen hyperhidroosin hoidossa liikahikoilun muualla kuin kainaloissa ilmoitettiin lisääntyneen 4,5 %:lla potilaista kuukauden kuluessa injektion antamisen jälkeen eikä se noudattanut tiettyä esiintymistä eri anatomisilla alueilla. Liikahikoilu hävisi noin 30 %:lla potilaista neljän kuukauden kuluessa.
Käsivarsien heikkoutta on myös ilmoitettu melko harvinaisina (0,7 %) tapauksina, ja se oli lievää, ohimenevää, ei vaatinut hoitoa eikä siitä aiheutunut jälkiseurauksia. Tämä haittavaikutus saattaa liittyä hoitoon, injektiotekniikkaan tai kumpaankin. Jos melko harvinaisina tapauksina ilmenevää lihasten heikkoutta esiintyy, tulisi harkita potilaan neurologista tutkimusta. Lisäksi injektiotekniikka tulisi arvioida uudelleen ennen seuraavien injektioiden antamista ja varmistaa, että injektiot annetaan ihon sisään.
Kontrolloimattomassa turvallisuustutkimuksessa, jossa annettiin Botox-valmistetta (50 yksikköä per kainalo) 12–17-vuotiaille lapsipotilaille (N = 144), useammalla kuin yhdellä potilaalla ilmenneitä haittavaikutuksia (kumpaakin ilmeni kahdella potilaalla) olivat injektiokohdan kipu ja liikahikoilu (hikoilu muualla kuin kainaloissa).
Lisätietoja
Seuraavia muita haittavaikutuksia tai muita lääketieteellisesti olennaisia haittavaikutuksia on ilmoitettu myyntiluvan saamisen jälkeen käyttöaiheesta riippumatta, mahdollisesti kohdassa Varoitukset ja käyttöön liittyvät varotoimet (Varoitukset ja käyttöön liittyvät varotoimet) ja kohdassa Haittavaikutukset (Haittavaikutukset) jo mainittujen lisäksi.
Elinjärjestelmä | Preferred Term –termi |
Immuunijärjestelmä | Anafylaksia, angioedeema, seerumitauti, nokkosihottuma |
Aineenvaihdunta ja ravitsemus | Ruokahaluttomuus |
Hermosto | Hartiapunoksen sairaus, dysfonia, dysartria, kasvohalvaus, hypestesia, lihasheikkous, myasthenia gravis, perifeerinen neuropatia, tuntoharhat, hermojuurivauriot, kouristuskohtaukset, pyörtyminen, kasvohermohalvaus |
Silmät | Ahdaskulmaglaukooma (blefarospasmin hoidossa), karsastus, näön hämärtyminen, näköhäiriö, kuivat silmät (periokulaaristen injektioiden yhteydessä), silmäluomen turvotus |
Kuulo ja tasapainoelin | Huonokuuloisuus, korvien soiminen, kiertohuimaus (vertigo) |
Sydän | Rytmihäiriöt, sydäninfarkti |
Hengityselimet, rintakehä ja välikarsina | Aspiraatiopneumonia (joka on toisinaan johtanut kuolemaan), hengenahdistus, hengityslama, hengityksen heikkeneminen |
Ruoansulatuselimistö | Vatsakipu, ripuli, ummetus, suun kuivuminen, nielemishäiriöt, pahoinvointi, oksentelu |
Iho ja ihonalainen kudos | Alopecia, psoriaasityyppinen ihotulehdus (dermatitis psoriasiformis), erythema multiforme, liikahikoilu, madaroosi, kutina, ihottuma |
Luusto, lihakset ja sidekudos | Lihasatrofia, lihaskipu, paikalliset lihasnykäykset/tahattomat lihassupistukset |
Yleisoireet ja antopaikassa todettavat haitat | Denervaatio, huonovointisuus, kuume |
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Botox-yliannos on suhteellinen käsite ja riippuu annoksesta, injektiokohdasta ja alla olevan kudoksen ominaisuuksista. Vahingossa tapahtuneesta Botox-injektiosta aiheutuvaa systeemistä toksisuutta ei ole havaittu. Liian suuret annokset voivat aiheuttaa paikallista tai kaukana antopaikasta esiintyvää, yleistynyttä ja huomattavaa neuromuskulaarista halvaantumista.
Botox-injektionesteen nielemistapauksia ei ole ilmoitettu.
Yliannoksen oireet ja merkit eivät ilmene heti injektoinnin jälkeen. Jos lääkettä pistetään tai niellään vahingossa tai yliannostusta epäillään, potilasta on seurattava jopa useiden viikkojen ajan paikallisten tai injektiokohdasta etäällä sijaitsevien lihasten heikkouteen liittyvien etenevien merkkien ja oireiden varalta. Tällaisia merkkejä ja oireita voivat olla silmäluomen roikkuminen, kahtena näkeminen, nielemis- ja puhehäiriöt, yleistynyt heikkous tai hengityslama. Jos tällaista ilmaantuu, lääkärin tekemiä lisätutkimuksia on harkittava ja asianmukainen lääketieteellinen hoito on aloitettava heti. Hoito voi edellyttää sairaalahoitoa.
Jos vaikutus kohdistuu suunielun ja ruokatorven lihaksiin, seurauksena voi olla aspiraatio, joka saattaa johtaa aspiraatiokeuhkokuumeen kehittymiseen. Jos hengityslihakset halvaantuvat tai heikkenevät riittävästi, potilas on intuboitava ja hengitystä autettava, kunnes potilas toipuu. Hoito voi vaatia trakeostomiaa ja pitkäkestoista mekaanista ventilaatiota muun yleisen tukihoidon lisäksi.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: muut perifeerisesti vaikuttavat lihasrelaksantit
ATC-koodi M03A X01
Vaikutusmekanismi
Botuliinitoksiini tyyppi A estää asetyylikoliinin perifeerisen vapautumisen presynaptisissa kolinergisissa hermopäätteissä pilkkomalla SNAP-25-proteiinia, joka vaikuttaa olennaisesti asetyylikoliinin varastoitumiseen hermopäätteissä oleviin rakkuloihin ja vapautumiseen niistä.
Farmakodynaamiset vaikutukset
Injektoinnin jälkeen toksiini sitoutuu aluksi nopeasti suurella affiniteetilla tiettyihin solujen pintareseptoreihin. Tämän jälkeen toksiini siirtyy solukalvon läpi reseptorivälitteisen endosytoosin avulla. Lopuksi toksiini vapautuu sytosoliin. Jälkimmäiseen prosessiin liittyy asetyylikoliinin vapautumisen progressiivinen esto: kliiniset merkit ilmenevät 2–3 päivän kuluessa ja vaikutus on huipussaan 5–6 viikon kuluessa injektoinnista. Kliinisen tuloksen perusteella näyttää siltä, että Botox vähentää kipua ja neurogeenista inflammaatiota ja nostaa ihon lämpökivun kynnystä kapsaisiinilla indusoidussa trigeminaalihermon herkistämismallissa.
Lihaksensisäisen injektion jälkeen palautuminen tapahtuu yleensä 12 viikon kuluessa injektion annosta, kun hermopäätteet kasvavat uudestaan ja yhdistyvät päätelevyihin. Ihonsisäisen injektion jälkeen, kun kohteena ovat ekkriiniset hikirauhaset, teho kestää ensimmäisen injektion jälkeen keskimäärin 7,5 kuukautta potilailla, joille on annettu 50 yksikköä kainaloa kohden. Kuitenkin 27,5 %:lla potilaista vaikutus kesti yhden vuoden tai sitä kauemmin. Hikirauhasia hermottavien sympaattisten hermopäätteiden paranemista ihonsisäisen Botox-injektion jälkeen ei ole tutkittu.
Rakkolihakseen injektoinnin jälkeen Botox vaikuttaa lihaksen efferentteihin hermoratoihin estämällä asetyylikoliinin vapautumista. Lisäksi Botox saattaa estää afferentteja välittäjäaineita ja sensorisia hermoratoja.
Kliininen teho ja turvallisuus
NEUROLOGISET SAIRAUDET
Pediatristen potilaiden yläraajan fokaalinen spastisuus
Botox-valmisteen tehoa ja turvallisuutta vähintään 2-vuotiaiden pediatristen potilaiden yläraajan spastisuuden hoidossa tutkittiin satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa monikeskustutkimuksessa. Tutkimuksessa satunnaistettiin 235 pediatrista potilasta (77 sai Botox-valmistetta 6 yksikköä/kg, 78 sai Botox-valmistetta 3 yksikköä/kg ja 80 sai lumelääkettä), joilla oli CP-vammasta (87 %) tai aivohalvauksesta (13 %) johtuvaa yläraajan spastisuutta ja joiden kyynärpään tai ranteen MAS-pistemäärä oli lähtötilanteessa vähintään 2. Lihakseen injisoitiin kokonaisannos 3 yksikköä/kg (enintään 100 yksikköä) tai 6 yksikköä/kg (enintään 200 yksikköä) tai lumelääkettä siten, että annos jaettiin kyynärpään tai ranteen ja sormien lihasten kesken. Kaikki potilaat saivat hoitokäytännön mukaista toimintaterapiaa. Injektiolla hoidettavien lihasten paikantamisen apuna oli käytettävä elektromyografiaohjaus-, hermostimulaatio- tai ultraäänitekniikkaa. Ensisijainen päätetapahtuma oli pääasiallisen lihasryhmän (kyynärpää tai ranne) MAS-pistemäärän keskimääräinen muutos lähtötilanteesta viikoilla 4 ja 6, ja keskeinen toissijainen päätetapahtuma oli Clinical Global Impression of Overall Change by Physician (CGI) -pistemäärän keskiarvo viikoilla 4 ja 6. Toissijaisina päätetapahtumina arvioitiin The Goal Attainment Scale (GAS) by Physician -pistemäärät aktiivisille ja passiivisille toiminnallisille tavoitteille viikolla 8 ja 12. Potilaita seurattiin 12 viikon ajan.
Soveltuvat potilaat saivat siirtyä avoimeen jatkotutkimukseen, jossa he saivat enintään viisi hoitokertaa korkeintaan annoksella 10 yksikköä/kg (enintään 340 yksikköä), kun myös alaraajaa hoidettiin samanaikaisesti yläraajan kanssa.
Botox-hoitoa annoksilla 3 ja 6 yksikköä/kg saaneilla potilailla osoitettiin tilastollisesti merkitsevä koheneminen ensisijaisessa päätetapahtumassa ja kaikissa aikapisteissä viikkoon 12 saakka. MAS-pistemäärä parani samankaltaisesti molemmissa Botox-hoitoryhmissä. MAS-pistemäärän ero lumehoitoon verrattuna ei kuitenkaan ollut missään aikapisteessä ≥ 1 pistettä. Katso alla oleva taulukko. Vasteanalyysissä hoitovaikutus vaihteli suunnilleen välillä 10–20 %.
Ensisijaista ja toissijaisia tehon päätetapahtumia koskevat tulokset (mITT-populaatio)
Botox 3 yksikköä/kg (N = 78) | Botox 6 yksikköä/kg (N = 77) | Lumelääke (N = 79) | |
| Pääasiallisen lihasryhmän (kyynärpää tai ranne) MAS-pistemäärän keskimääräinen muutos lähtötilanteestaa | |||
| Viikon 4 ja 6 keskiarvo | -1,92* | -1,87* | -1,21 |
| Keskimääräinen CGI-pistemääräb | |||
| Viikon 4 ja 6 keskiarvo | 1,88 | 1,87 | 1,66 |
| Keskimääräinen GAS-pistemääräc | |||
| Passiiviset tavoitteet viikolla 8 | 0,23 | 0,30 | 0,06 |
| Passiiviset tavoitteet viikolla 12 | 0,31 | 0,71* | 0,11 |
| Aktiiviset tavoitteet viikolla 8 | 0,12 | 0,11 | 0,21 |
| Aktiiviset tavoitteet viikolla 12 | 0,26 | 0,49 | 0,52 |
| FPS-pistemäärän keskimääräinen muutos lähtötilanteestad | N = 11 | N = 11 | N = 18 |
| Viikko 4 | -4,91 | -3,17 | -3,55 |
| Viikko 6 | -3,12 | -2,53 | -3,27 |
* Eroaa tilastollisesti merkitsevästi lumelääkkeestä (p < 0,05)
a MAS-asteikko on 6-portainen (0 [lihastonus ei ole suurentunut], 1, 1+, 2, 3 ja 4 [raaja on jäykkä koukistuksessa tai ojennuksessa]) ja mittaa raajan nivelen ympärillä liikuttamiseen tarvittavaa voimaa. Pistemäärän vähenemä osoittaa spastisuuden vähentyneen.
b CGI-pisteytys arvioi 9-portaisella asteikolla hoitovastetta potilaan elämän sujumisen kannalta (-4 = hyvin huomattava heikentyminen – +4 = hyvin huomattava koheneminen).
c GAS-asteikko on 6-portainen (-3 [heikompi kuin alussa], -2 [sama kuin alussa], -1 [oletettua heikompi], 0 [oletettu tavoite], +1 [oletettua parempi], +2 [paljon oletettua parempi]).
d Kipu arvioitiin Faces Pain Scale -asteikolla (FPS: 0 = ei kipua – 10 = hyvin paljon kipua) vähintään 4-vuotiailta tutkimukseen osallistuneilta, joilla kipupistemäärä oli lähtötilanteessa > 0.
mITT = modifioitu hoitoaie: sisälsi kaikki satunnaistetut osallistujat, joilla oli validit MAS-lähtöpisteet pääasiallisesta lihasryhmästä ja vähintään yksi lähtötilanteen jälkeinen päälihasryhmän MAS-pistemittaus viikolla 2, 4 tai 6 ja lääkärin tekemä CGI. mITT-populaatio analysoitiin satunnaistamistehtävän mukaan tosiasiallisesti saadusta hoidosta riippumatta.
Pediatristen potilaiden alaraajan fokaalinen spastisuus
Botox-valmisteen tehoa ja turvallisuutta vähintään 2-vuotiaiden pediatristen potilaiden alaraajan spastisuuden hoidossa tutkittiin satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa monikeskustutkimuksessa. Tutkimuksessa satunnaistettiin 384 pediatrista potilasta (128 sai Botox-valmistetta 8 yksikköä/kg, 126 sai Botox-valmistetta 4 yksikköä/kg ja 130 sai lumelääkettä), joilla oli CP-vammasta johtuvaa alaraajan spastisuutta ja joiden nilkan pistemäärä oli vähintään 2. Lihakseen injisoitiin kokonaisannos 4 yksikköä/kg (enintään 150 yksikköä) tai 8 yksikköä/kg (enintään 300 yksikköä) tai lumelääkettä siten, että annos jaettiin kaksoiskantalihaksen, soleus-lihaksen ja tibialis posterior -lihaksen kesken. Kaikki potilaat saivat hoitokäytännön mukaista fysikaalista hoitoa. Injektiolla hoidettavien lihasten paikantamisen apuna oli käytettävä elektromyografiaohjaus-, hermostimulaatio- tai ultraäänitekniikkaa. Ensisijainen päätetapahtuma oli nilkan MAS-pistemäärän keskimääräinen muutos lähtötilanteesta viikoilla 4 ja 6, ja keskeinen toissijainen päätetapahtuma oli CGI-pistemäärän keskiarvo viikoilla 4 ja 6. Toissijaisena päätetapahtumana arvioitiin GAS by Physician -pistemäärä aktiivisille ja passiivisille toiminnallisille tavoitteille viikolla 8 ja 12. Kävely arvioitiin osalta potilaista Edinburg Visual Gait (EVG) -asteikolla viikoilla 8 ja 12. Potilaita seurattiin 12 viikon ajan.
Soveltuvat potilaat saivat siirtyä avoimeen jatkotutkimukseen, jossa he saivat enintään viisi hoitokertaa korkeintaan annoksella 10 yksikköä/kg (enintään 340 yksikköä), jos hoidettavia raajoja oli enemmän kuin yksi.
Botox-hoitoa annoksilla 4 ja 8 yksikköä/kg saaneilla potilailla osoitettiin tilastollisesti merkitsevä koheneminen ensisijaisessa päätetapahtumassa ja useimmissa aikapisteissä viikkoon 12 saakka. MAS-pistemäärä parani samankaltaisesti molemmissa Botox-hoitoryhmissä. MAS-pistemäärän ero lumehoitoon verrattuna ei kuitenkaan ollut missään aikapisteessä ≥ 1 pistettä. Katso alla oleva taulukko. Vasteanalyysissä hoitovaikutus oli alle 15 % kaikissa aikapisteissä.
Ensisijaista ja toissijaisia tehon päätetapahtumia koskevat tulokset (mITT-populaatio)
Botox 4 yksikköä/kg (N = 125) | Botox 8 yksikköä/kg (N = 127) | Lumelääke (N = 129) | |
| Plantaarifleksorien MAS-pistemäärän keskimääräinen muutos lähtötilanteestaa | |||
| Viikon 4 ja 6 keskiarvo | -1,01* | -1,06* | -0,80 |
| Keskimääräinen CGI-pistemääräb | |||
| Viikon 4 ja 6 keskiarvo | 1,49 | 1,65* | 1,36 |
| Keskimääräinen GAS-pistemääräc | |||
| Passiiviset tavoitteet viikolla 8 | 0,18* | 0,19* | -0,26 |
| Passiiviset tavoitteet viikolla 12 | 0,27 | 0,40* | 0,00 |
| Aktiiviset tavoitteet viikolla 8 | -0,03* | 0,10* | -0,31 |
| Aktiiviset tavoitteet viikolla 12 | 0,09 | 0,37* | -0,12 |
| EVG-pistemäärän keskimääräinen muutos lähtötilanteestad | |||
| Viikko 8 | -2,11 | -3,12* | -0,86 |
| Viikko 12 | -2,07 | -2,57 | -1,68 |
* Eroaa tilastollisesti merkitsevästi lumelääkkeestä (p < 0,05)
a MAS-asteikko on 6-portainen (0 [lihastonus ei ole suurentunut], 1, 1+, 2, 3 ja 4 [raaja on jäykkä koukistuksessa tai ojennuksessa]) ja mittaa raajan nivelen ympärillä liikuttamiseen tarvittavaa voimaa. Pistemäärän vähenemä osoittaa spastisuuden vähentyneen.
b CGI-pisteytys arvioi 9-portaisella asteikolla hoitovastetta potilaan elämän sujumisen kannalta (-4 = hyvin huomattava heikentyminen – +4 = hyvin huomattava koheneminen).
c GAS-asteikko on 6-portainen (-3 [heikompi kuin alussa], -2 [sama kuin alussa], -1 [oletettua heikompi], 0 [oletettu tavoite], +1 [oletettua parempi], +2 [paljon oletettua parempi]).
d EVG-asteikko on 11-portainen, ja sillä arvioidaan kävelyä jalan asennon (5 kohtaa), polven asennon (2 kohtaa), jalan heilautuksen (2 kohtaa) ja polven heilautuksen (2 kohtaa) perusteella 3-pisteisellä järjestysasteikolla (0 [normaali], 1 [koukistus 1 tai ojennus 1] ja 2 [koukistus 2 tai ojennus 2] kussakin kohdassa).
mITT = modifioitu hoitoaie: sisälsi kaikki satunnaistetut osallistujat, joilla oli validit nilkan MAS-lähtöpisteet polvi ojennettuna ja ≥ 1 lähtötilanteen jälkeinen nilkan MAS-pisteiden mittaus polvi ojennettuna viikolla 2, 4 tai 6 ja lääkärin tekemä CGI. mITT-populaatio analysoitiin satunnaistamistehtävän mukaan tosiasiallisesti saadusta hoidosta riippumatta.
Yhteen vaiheen 3 tutkimukseen ja avoimeen jatkotutkimukseen osallistuneista pediatrisista potilaista, joilla oli alaraajan spastisuutta ja joiden näytteet analysoitiin, neutraloivia vasta-aineita kehittyi kahdelle (0,8 %) 264:stä Botox-hoitoa enintään viisi hoitojaksoa saaneelle potilaalle. Molemmille potilaille oli edelleen kliinistä hyötyä myöhemmistä Botox-hoidoista.
Aivohalvaukseen liittyvä yläraajan fokaalinen spastisuus aikuisilla
Botox-hoidon tehoa ja turvallisuutta aikuisten yläraajan spastisuuden hoidossa arvioitiin satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa monikeskustutkimuksessa.
Tutkimuksessa satunnaistettiin 126 aikuispotilasta (64 sai Botox-valmistetta, 62 lumelääkettä), joilla esiintyi yläraajan spastisuutta (ranteen koukistajan tonuksen Ashworth-pisteet vähintään 3 ja sormen koukistajan tonuksen Ashworth-pisteet vähintään 2) ja joiden aivohalvauksesta oli kulunut vähintään 6 kuukautta. Botox-valmistetta (kokonaisannos 200–240 yksikköä) tai lumelääkettä annosteltiin seuraaviin lihaksiin: flexor digitorum profundus, flexor digitorum sublimis, flexor carpi radialis, flexor carpi ulnaris, sekä tarvittaessa adductor pollicis ja flexor pollicis longus. Injektiolla hoidettavien lihasten paikantamisen avuksi suositeltiin elektromyografiaa/hermostimulaatiota. Potilaita seurattiin 12 viikon ajan.
Ensisijainen tehoa mittaava päätetapahtuma oli ranteen koukistajien lihastonus viikolla 6 Ashworth-pisteinä mitattuna. Pääasiallisia toissijaisia päätetapahtumia olivat lääkärin yleisarvio (Physician Global Assessment), sormen koukistajien lihastonus sekä peukalon koukistajien tonus viikolla 6. Tutkimuksen 1 ensisijaista päätetapahtumaa ja pääasiallisia toissijaisia päätetapahtumia koskevat tulokset esitetään alla olevassa taulukossa.
Ensisijaista ja toissijaisia tehon päätetapahtumia koskevat tulokset viikolla 6
| Botox 200–240 yksikköä (N = 64) | Lumelääke (N = 62) | |
| Ranteen koukistajan lihastonuksen keskimääräinen muutos lähtötilanteesta Ashworth-asteikollaa | -1,7* | -0,5 |
| Keskimääräinen lääkärin yleisarvio hoitovasteestab | 1,8* | 0,6 |
| Sormen koukistajan lihastonuksen keskimääräinen muutos lähtötilanteesta Ashworth-asteikollaa | -1,3* | -0,5 |
| Peukalon koukistajan lihastonuksen keskimääräinen muutos lähtötilanteesta Ashworth-asteikollaa | -1,66* | -0,48 |
* Merkitsevä ero lumelääkkeeseen verrattuna (p < 0,05)
a Ashworth-asteikko on 5-portainen (0 [lihastonus ei ole suurentunut], 1, 2, 3 ja 4 [raaja on jäykkä koukistuksessa tai ojennuksessa]) ja mittaa raajan nivelen ympärillä liikuttamiseen tarvittavaa voimaa. Pistemäärän vähenemä osoittaa spastisuuden vähentyneen.
b Lääkärin yleisarvio arvioi hoitovastetta potilaan elämän sujumisen kannalta asteikolla -4 = hyvin huomattava heikentyminen – +4 = hyvin huomattava koheneminen.
Aivohalvaukseen liittyvä alaraajan fokaalinen spastisuus aikuisilla
Botox‑hoidon tehoa ja turvallisuutta alaraajojen spastisuuden hoidossa arvioitiin satunnaistetussa, kaksoisokkoutetussa, lumekontrolloidussa monikeskustutkimuksessa. Tutkimuksessa satunnaistettiin 468 aivohalvauspotilasta (233 sai Botox-valmistetta, 235 lumelääkettä), joilla esiintyi nilkan spastisuutta (nilkan MAS‑pisteet vähintään 3, MAS = Modified Ashworth Scale) ja joiden aivohalvauksesta oli kulunut vähintään 3 kuukautta. Botox-valmistetta (300–400 yksikköä) tai lumelääkettä annosteltiin lihakseen; pakolliset lihakset olivat gastrocnemius, soleus ja tibialis posterior, valinnasiin lihaksiin kuuluivat flexor hallucis longus, flexor digitorum longus, flexor digitorum brevis, extensor hallucis ja rectus femoris.
Ensisijainen päätetapahtuma oli nilkan MAS‑pisteiden keskimääräinen muutos lähtötilanteesta viikoilla 4 ja 6. Pääasiallinen toissijainen päätetapahtuma oli CGI‑pisteiden (Clinical Global Impression) keskiarvo viikoilla 4 ja 6. Ryhmien välillä osoitetut tilastollisesti ja kliinisesti merkitsevät erot ensisijaisten tehoa mittaavien päätetapahtumien eli MAS‑pisteiden osalta sekä pääasiallisen toissijaisen päätetapahtuman eli CGI‑pisteiden osalta Botox-valmisteen eduksi lumelääkkeeseen verrattuna esitetään seuraavassa taulukossa. Ensisijaisen päätetapahtuman eli keskimääräisten nilkan MAS‑pisteiden osalta viikoilla 4 ja 6 ei havaittu paranemista lähtötilanteesta vähintään 65‑vuotiailla Botox-valmisteella hoidetuilla potilailla verrattuna lumelääkettä saaneisiin potilaisiin, mikä johtuu todennäköisesti potilaiden pienestä lukumäärästä.
Ensisijaiset ja pääasialliset toissijaiset tehon päätetapahtumat (ITT-populaatio)
Botox® 300–400 yksikköä (lähtöryhmien mukainen) (N = 233) | Lumelääke (N = 235) | |
| Nilkan plantaarifleksoreiden MAS‑pisteiden keskimääräinen muutos lähtötilanteesta | ||
| Viikot 4 ja 6 (keskiarvo) | -0,8* | -0,6 |
| Keskimääräiset CGI‑pisteet (tutkijan arvio) | ||
| Viikot 4 ja 6 (keskiarvo) | 0,9* | 0,7 |
| Varpaiden fleksoreiden MAS‑pisteiden keskimääräinen muutos lähtötilanteesta | ||
| FHaL: Viikot 4 ja 6 (keskiarvo) | -1,02* | -0,6 |
| FDL: Viikot 4 ja 6 (keskiarvo) | -0,88 | - 0,77 |
| Nilkan plantaarifleksoreiden MAS‑pisteiden keskimääräinen muutos lähtötilanteesta potilailla | ≥ 65 vuotta N = 60 | ≥ 65 vuotta N = 64 |
| Viikot 4 ja 6 (keskiarvo) | -0,7 | -0,7 |
*Merkitsevä ero lumelääkkeeseen verrattuna (p < 0,05)
ITT = hoitoaie
Aivohalvaukseen liittyvästä nilkan spastisuudesta kärsivillä aikuispotilailla suoritettiin toinen kaksoissokkoutettu, lumekontrolloitu, satunnaistettu, vaiheen 3 kliininen monikeskustutkimus. Tutkimuksessa yhteensä 120 potilasta satunnaistettiin joko Botox- (N = 58) (kokonaisannos 300 yksikköä) tai lumelääkeryhmään (N = 62). Tutkimus tehtiin vain japanilaisilla potilailla, joiden Modified Ashford Scale‑ pisteet (MAS-pisteet) olivat ≥ 3 ja joiden aivohalvauksesta oli kulunut keskimäärin 6,5 vuotta.
Ensisijaisessa päätepisteessä havaittiin, että nilkan MAS-pisteiden kokonaismuutos lähtötilanteesta viikkoon 12 mennessä oli merkittävästi parempi verrattuna lumelääkkeeseen. Muutos laskettiin käyttäen käyrän alapuolista aluetta (AUC). Nilkan MAS-pisteiden keskimääräinen muutos lähtötilanteesta oli myös merkittävästi parempi lumelääkkeeseen verrattuna potilaiden henkilökohtaisilla käynneillä hoidon jälkeisillä viikoilla 4, 6 ja 8. Näillä käynneillä myös vasteellisten potilaiden osuus (potilaat, joiden tila parani vähintään 1 luokan verran), oli merkittävästi suurempi kuin lumelääkkeellä hoidettujen ryhmässä.
Botox-hoitoon liittyi myös merkittävä funktionaalisen toimintakyvyn paraneminen tutkijoiden tekemissä (Clinical Global Impression, CGI) arvioissa (toissijainen päätepiste, ei kertaluvun tarkistusta) lumelääkkeeseen verrattuna. Physician’s Rating Scale (PRS) -arviointiasteikolla ja askellusnopeudella mitattuna toiminta ei parantunut kliinisesti merkittävästi.
Vaiheen 3 kliinisen tutkimuksen tulokset esitetään alla.
Ensisijainen ja pääasialliset toissijaiset tehon päätepisteet
| Botox (N = 58) | Lumelääke (N = 62) | p-arvo | |
| MAS-pisteiden keskimääräinen AUC | |||
| AUC (päivä 0 – viikko 12) | -8,5 | -5,1 | 0,006 |
| MAS-pisteiden keskimääräinen muutos lähtötasolta | |||
| Lähtötaso | 3,28 | 3,24 | |
| Viikko 1 | -0,61 | -0,52 | 0,222 |
| Viikko 4 | -0,88 | -0,43 | < 0,001 |
| Viikko 6 | -0,91 | -0,47 | < 0,001 |
| Viikko 8 | -0,82 | -0,43 | < 0,001 |
| Viikko 12 | -0,56 | -0,40 | 0,240 |
| Vasteellisten potilaiden prosenttiosuus* | |||
| Viikko 1 | 52,6 % | 38,7 % | 0,128 |
| Viikko 4 | 67,9 % | 30,6 % | < 0,001 |
| Viikko 6 | 68,4 % | 36,1 % | < 0,001 |
| Viikko 8 | 66,7 % | 32,8 % | < 0,001 |
| Viikko 12 | 44,4 % | 34,4 % | 0,272 |
*Potilaat, joiden MAS-pisteet paranivat lähtötasolta vähintään 1 pisteen verran
Uusintahoidon yhteydessä havaittiin yhdenmukainen vaste.
Krooninen migreeni
Botox estää kivun syntyyn liittyvien välittäjäaineiden vapautumisen hermostossa. Botox-valmisteen vaikutusmekanismia kroonisen migreenin oireiden vähentämisessä ei ole täysin varmistettu. Prekliiniset ja kliiniset farmakodynaamiset tutkimukset viittaavat siihen, että Botox estää perifeeristä herkistymistä ja estää siten mahdollisesti myös sentraalisen herkistymisen.
Seuraavassa taulukossa esitetään kahdessa vaiheen 3 kliinisessä tutkimuksessa kroonista migreeniä sairastaville potilaille 12 viikon välein annettujen kahden Botox-hoitokerran yhdistetyistä tehon analyyseistä saadut keskeiset tulokset. Tutkimuksessa mukana olleilla potilailla oli hoidon aloittamista edeltäneinä 28 päivänä vähintään 4 päänsärkykohtausta ja ≥ 15 päänsärkypäivää (jolloin jatkuvaa päänsärkyä esiintyi vähintään 4 tunnin ajan), joista vähintään 50 % oli migreenipäiviä/todennäköisiä migreenipäiviä:
| Keskimääräinen muutos lähtötilanteesta viikolla 24 | BOTOX N = 688 | Lumelääke N = 696 | p-arvo |
| Päänsäryn esiintyvyys, päivää | -8,4 | -6,6 | p < 0,001 |
| Keskivaikean/vaikean päänsäryn esiintyvyys, päivää | -7,7 | -5,8 | p < 0,001 |
| Migreenin/todennäköisen migreenin esiintyvyys, päivää | -8,2 | -6,2 | p < 0,001 |
| Osuus potilaista (%), joiden päänsärkypäivien lukumäärä väheni 50 % | 47 % | 35 % | p < 0,001 |
| Päänsäryn kumulatiivinen kokonaistuntimäärä päänsärkypäivinä | -120 | -80 | p < 0,001 |
| Päänsärkykohtausten esiintyvyys | -5,2 | -4,9 | p = 0,009 |
| Päänsäryn vaikutusta selvittävän testin (Headache Impact Test, HIT-6) kokonaispisteet | -4,8 | -2,4 | p < 0,001 |
Vaikka tutkimuksissa ei pystytty osoittamaan eroja alaryhmien välillä, hoidon teho vaikutti olevan heikompi miespotilaiden (N = 188) ja muiden kuin valkoihoisten (N = 137) tutkimuspotilaiden alaryhmissä verrattuna koko tutkimuspopulaatioon.
VIRTSARAKON SAIRAUDET
Aikuisten yliaktiivinen virtsarakko
Yliaktiivisen virtsarakon aiheuttamista inkontinenssioireista sekä äkillisestä ja tiheästä virtsaamisen tarpeesta kärsivillä potilailla suoritettiin kaksi kaksoissokkoutettua, lumekontrolloitua, satunnaistettua, vaiheen 3 kliinistä monikeskustutkimusta, jotka kestivät 24 viikkoa. Tutkimuksiin otettiin yhteensä 1105 potilasta, jotka eivät olleet saaneet riittävää vastetta vähintään yhdellä antikolinergisella lääkehoidolla (riittämätön vaste tai haittavaikutusten aiheuttama hoidon keskeytys). Potilaat satunnaistettiin saamaan joko 100 yksikköä Botox-valmistetta (N = 557) tai lumelääkettä (N = 548).
Molemmissa tutkimuksissa todettiin 12 viikon ensisijaisella päätehetkellä lähtökohtaan nähden merkittävä paraneminen Botox-ryhmässä (100 yksikköä) päivittäisten inkontinenssitapahtumien esiintymistiheydessä lumelääkeryhmään verrattuna (lähtötaso oli Botox-ryhmässä 5,49 ja lumelääkeryhmässä 5,39) mukaan lukien kuivat potilaat. Hoitovastetta mittaavalla Treatment Benefit -mittarilla positiivisen hoitovasteen (yleistila erittäin paljon tai paljon parempi) raportoivien potilaiden määrä oli merkittävästi suurempi Botox-ryhmässä verrattuna lumelääkeryhmään. Päivittäiset virtsaamispakko- ja yövirtsaamistapahtumat ja virtsaamiskertojen lukumäärä vähenivät merkittävästi. Virtsaamispakon yhteydessä päästetty virtsamäärä oli myös suurempi. Viikosta 2 eteenpäin havaittiin merkittävä parannus kaikissa yliaktiiviseen virtsarakkoon liittyvissä oireissa.
Terveyteen liittyvä elämänlaatu parani merkittävästi Botox-ryhmässä verrattuna lumelääkeryhmään mitattuna Incontinence Quality of Life (I-QOL) -kyselyllä (mukaan lukien välttelevä ja rajoitettu käyttäytyminen, psykososiaalinen vaikutus ja sosiaalinen häpeä) sekä King’s Health Questionnaire (KHQ) -kyselyllä (mukaan lukien inkontinenssin aiheuttama vaikutus, roolien rajoittuvuus, sosiaalinen rajoittuneisuus, fyysinen rajoittuneisuus, henkilökohtaiset suhteet, emootiot, uni/energia ja vakavuus/selviytymiskeinot).
Botox-hoidon tehokkuus ei eronnut merkittävästi ≥ 65-vuotiaiden potilaiden kohdalla verrattuna alle 65-vuotiaisiin.
Avaintutkimusten yhdistetyt tulokset on esitetty alla:
Ensisijaiset ja toissijaiset tehon päätetapahtumat lähtötasolla sekä muutos lähtötasolta yhdistetyissä avaintutkimuksissa:
BOTOX 100 yksikköä (N = 557) | Lumelääke (N = 548) | p-arvo | |
| Virtsainkontinenssiepisodien päivittäinen määrä* | |||
| Keskimäärin lähtötasolla | 5,49 | 5,39 | |
| Keskim. muutos viikon 2 kohdalla | -2,85 | -1,21 | < 0,001 |
| Keskim. muutos viikon 6 kohdalla | -3,11 | -1,22 | < 0,001 |
| Keskim. muutos viikon 12 kohdallaa | -2,80 | -0,95 | < 0,001 |
| Positiivisen hoitovasteen saaneiden osuus mitattuna Treatment Benefit -mittarilla (%) | |||
| Viikko 2 | 64,4 | 34,7 | < 0,001 |
| Viikko 6 | 68,1 | 32,8 | < 0,001 |
| Viikko 12a | 61,8 | 28,0 | < 0,001 |
| Päivittäisten pakkovirtsaamistapahtumien määrä | |||
| Keskimäärin lähtötasolla | 11,99 | 11,48 | |
| Keskim. muutos viikon 2 kohdalla | -1,53 | -0,78 | < 0,001 |
| Keskim. muutos viikon 6 kohdalla | -2,18 | -0,97 | < 0,001 |
| Keskim. muutos viikon 12 kohdallab | -2,35 | -0,87 | < 0,001 |
| Päivittäisten äkillisen virtsaamispakon ilmenemiskertojen määrä | |||
| Keskimäärin lähtötasolla | 8,82 | 8,31 | |
| Keskim. muutos viikon 2 kohdalla | -2,89 | -1,35 | < 0,001 |
| Keskim. muutos viikon 6 kohdalla | -3,56 | -1,40 | < 0,001 |
| Keskim. muutos viikon 12 kohdallab | -3,30 | -1,23 | < 0,001 |
| Incontinence Quality of Life ‑kokonaispisteytys | |||
| Keskimäärin lähtötasolla | 34,1 | 34,7 | |
Keskim. muutos viikon 12 kohdallabc | +22,5 | +6,6 | < 0,001 |
| King’s Health Questionnaire: rooliosan rajoittuneisuus | |||
| Keskimäärin lähtötasolla | 65,4 | 61,2 | |
| Keskim. muutos viikon 12 kohdallabc | -25,4 | -3,7 | < 0,001 |
| King’s Health Questionnaire: sosiaalinen rajoittuneisuus | |||
| Keskimäärin lähtötasolla | 44,8 | 42,4 | |
| Keskim. muutosviikon 12 kohdallabc | -16,8 | -2,5 | < 0,001 |
*Kuivien (ei inkontinenssia) potilaiden osuus viikon 12 loppuun mennessä oli 27,1 % Botox-ryhmässä ja 8,4 % lumelääkeryhmässä. Niiden potilaiden osuudet, joiden inkontinenssiepisodit vähenivät vähintään 75 %:lla ja 50 %:lla lähtötasosta, olivat 46,0 % ja 60,5 % Botox-ryhmässä ja vastaavasti 17,7 % ja 31,0 % lumelääkeryhmässä.
a Ensisijaiset päätetapahtumat
b Toissijaiset päätetapahtumat
c I-QOL-pisteiden etukäteen määritetty pienin merkittävä muutos lähtötasosta oli +10 pistettä ja KHQ-asteikolla ‑5 pistettä.
Vasteen mediaanikesto, joka perustui potilaiden uudelleenhoitopyyntöihin, oli 166 päivää (noin 24 viikkoa) Botox-valmistetta saavilla. Vasteen mediaanikesto, joka perustui potilaiden uudelleenhoitopyyntöihin, oli 212 päivää (~ 30 viikkoa) potilailla, jotka jatkoivat tutkimuksen avoimessa vaiheessa ja saivat hoidoksi vain 100 yksikköä Botox-valmistetta (N = 438).
Vaikka kahdessa faasi 3:n kliinisessä tutkimuksessa oli vain rajallinen määrä alle 40-vuotiaita (N = 88, 8,0 %), ei-valkoihoisia (N = 101, 9,1 %) ja miehiä (N = 135, 12,2 %), näistä alaryhmistä saatu tieto viittaa siihen, että hoidosta on hyötyä. Miehillä virtsaretentio, jäännösvirtsan määrä ja tiheävirtsaisuus olivat yleisempiä haittavaikutuksia kuin naisilla. Tulokset ensisijaisista päätetapahtumista miehillä on esitetty alla.
Ensisijaiset tehon päätetapahtumat lähtötasolla ja muutos lähtötasolta miehillä (yhdistetty avaintutkimuksista):
| Botox 100 yksikköä (N = 61) | Lumelääke (N = 74) | p-arvo | |
| Virtsainkontinenssiepisodien päivittäinen määrä | |||
| Keskimäärin lähtötasolla | 5,61 | 4,33 | |
| Keskim muutos viikon 12 kohdalla | -1,86 | -1,23 | 0,612 |
| Hoidosta hyötyneiden osuus (Treatment Benefit Scale (%)) | |||
| Viikko 12 | 40,7 | 25,4 | 0,060 |
Yhteensä 839 potilasta arvioitiin avoimessa pitkäaikaisessa jatkotutkimuksessa (N = 758 naista, N = 81 miestä). Uudelleenhoidossa potilaiden vasteet olivat yhdenmukaisia kaikkien tehoa koskevien päätetapahtumien osalta. Alaryhmässä, jossa oli 345 kolmannen hoitosyklin viikolle 12 jatkanutta potilasta (N = 316 naista, N = 29 miestä), päivittäisten inkontinenssikertojen määrä väheni niin, että viikolla 12 inkontinenssikertoja oli ensimmäisen Botox 100 yksikköä ‑valmisteella annetun hoitokerran jälkeen -3,07, toisen hoitokerran jälkeen -3,49 ja kolmannen hoitokerran jälkeen -3,49. Vastaavasti hyvän hoitotuloksen saavuttaneiden potilaiden osuus (Treatment Benefit Scale) oli ensimmäisen hoitokerran jälkeen 63,6 %, toisen hoitokerran jälkeen 76,9 % ja kolmannen hoitokerran jälkeen 77,3 %.
Avaintutkimuksissa 615 potilaasta, joiden näytteet analysoitiin, ei yksikään kehittänyt neutraloivia vasta-aineita. Avaintutkimusten vaiheen 3 ja avoimen jatkotutkimuksen aikana analysoiduista potilaista kenellekään (0/954 eli 0,0 %) ei kehittynyt neutraloivia vasta-aineita käytettäessä annosta 100 yksikköä, kun taas vasta-aineita kehittyi kolmelle potilaalle niistä 260:stä (1,2 %), jotka saivat vähintään yhden 150 yksikön annoksen. Yhdellä näistä kolmesta potilaasta hoidon hyöty säilyi. Verrattuna kaikkiin Botox-valmisteella hoidettuihin, niillä potilailla, joille kehittyi neutralovia vasta-aineita, oli yleensä lyhyempi vasteen kesto ja vastaavasti he saivat hoitoja muita useammin (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Pediatristen potilaiden yliaktiivinen virtsarakko
Rajallisia tehoon liittyviä tietoja on saatavilla yhdestä kaksoissokkoutetusta, rinnakkaisryhmillä tehdystä, satunnaistetusta kliinisestä monikeskustutkimuksesta (191622-137), johon osallistuneilla 12–17-vuotiailla potilailla oli yliaktiivisen virtsarakon aiheuttamia inkontinenssioireita. Tutkimukseen otettiin yhteensä 55 potilasta (aiotuista 108:sta), jotka eivät olleet saaneet riittävää vastetta yhdellä antikolinergisella lääkkeellä tai jotka eivät sietäneet tällaista hoitoa. Näin ollen otoskoko ei ollut riittävä tehon varmistamiseen tässä potilasryhmässä. Potilaat satunnaistettiin saamaan 25 yksikköä, 50 yksikköä tai 100 yksikköä ylittämättä kuitenkaan annosta 6 yksikköä/kg: Botox 25 yksikköä N = 18, Botox 50 yksikköä N = 17 ja Botox 100 yksikköä N = 20. Valmiste annettiin potilaille paikallisen käytännön mukaan anestesiassa. Kaikille potilaille annettiin yleisanestesia tai kohtalainen sedaatio.
Ensisijaiset ja toissijaiset päätetapahtumat lähtötasolla sekä muutos lähtötasolta kaksoissokkoutetussa, rinnakkaisryhmillä toteutetussa kliinisessä tutkimuksessa:
BOTOX 100 yksikköä (N = 20) | BOTOX 50 yksikköä (N = 17) | BOTOX 25 yksikköä (N = 18) | p-arvo BOTOX | p-arvo BOTOX | |
Päiväaikaisten virtsainkontinenssiepisodien päivittäinen määrä a Keskimäärin lähtötasolla Keskim. muutos* viikon 12 kohdalla** (95 %:n luottamusväli) | 3,6
| 3,5 -1,0 (-2,6; 0,7) | 5,3 -1,4 (-3,0; 0,2) | 0,3802 | 0,7330 |
Niiden potilaiden prosenttiosuus, joiden päiväaikaisten virtsainkontinenssiepisodien päivittäinen määrä pieneni vähintään 50 %:lla lähtötasostab (%) Viikko 12c (95 %:n luottamusväli) | 80,0 (56,3; 94,3) | 47,1 (23,0; 72,2) | 50,0 (26,0; 74,0) | 0,0472 | 0,9924 |
Positiivinen hoitovaste (”paljon parempi tai parempi”)b (%) Viikko 12c (95 %:n luottamusväli) | 68,4 (43,5; 87,4) | 70,6 (44,0; 89,7) | 52,9 (27,8; 77,0) | 0,6092 | 0,4824 |
Päivittäisten päiväaikaisten pakkovirtsaamistapahtumien määrä b Keskimäärin lähtötasolla | 8,1 | 8,5 | 11,2 | 0,5743 | 0,1451 |
| Keskim. muutos* viikon 12 kohdalla** (95 %:n luottamusväli) | -1,0 (-3,0; 1,0) | 0,3 (-1,7; 2,4) | -1,8 (-3,9; 0,2) | ||
Päivittäisten päiväaikaisten äkillisten tapahtumien määräb Keskimäärin lähtötasolla | 4,4 | 5,4 | 7,5 | 0,8206 | 0,9604 |
| Keskim. muutos* viikon 12 kohdalla** (95 %:n luottamusväli) | -2,2 (-4,1; -0,3) | -1,8 (-3,8; 0,2) | -1,9 (-3,9; 0,2) |
*Pienimmän neliösumman keskiarvon muutos lähtötasosta, hoitoero, 95 %:n luottamusväli sekä p-arvo perustuvat kovarianssianalyysimalliin (ANCOVA), jossa lähtötason arvo on kovariaatti ja hoitoryhmä on tekijä. Viimeisiä havaintoarvoja (LOCF) käytettiin ensisijaisen tehomuuttujan analysoinnissa.
** Ensisijainen aikapiste
a Ensisijainen muuttuja.
b Toissijainen muuttuja.
c P-arvot saatiin Cochran-Mantel-Haenzelin testillä, jossa stratifiointi tehtiin lähtötason päiväaikaisten pakkoinkontinenssiepisodien (≤ 6 tai > 6) mukaan. Eksakti (Clopper-Pearson) 95 %:n luottamusväli määritettiin binomijakaumaa käyttämällä.
Niistä 55 pediatrisesta potilaasta, joilla oli lähtötasolla negatiivinen tulos sitovista vasta-aineista tai neutraloivista vasta-aineista ja joilla oli lähtötason jälkeen vähintään yksi arvioitavissa ollut arvo yhdestä satunnaistetusta kaksoissokkoutetusta tutkimuksesta, kenellekään ei kehittynyt neutraloivia vasta-aineita Botox-valmisteen saamisen jälkeen annoksella 25–100 yksikköä.
Aikuisten neurogeenisesta rakkolihaksen yliaktiivisuudesta johtuva virtsainkontinenssi
Vaiheen 3 kliiniset avaintutkimukset
Neurogeenisesta rakkolihaksen yliaktiivisuudesta johtuvaa virtsainkontinenssia potevilla potilailla, jotka joko virtsasivat spontaanisti tai käyttivät katetrointia, tehtiin kaksi kaksoissokkoutettua, lumekontrolloitua, satunnaistettua, vaiheen 3 kliinistä monikeskustutkimusta. Tutkimuksiin otettiin yhteensä 691 selkäydinvamma- tai MS-potilasta, jotka eivät olleet saaneet riittävää vastetta vähintään yhdellä antikolinergilla. Potilaat satunnaistettiin saamaan joko 200 yksikköä Botox-valmistetta (N = 227), 300 yksikköä Botox-valmistetta (N = 223) tai lumelääkettä (N = 241).
Molemmissa vaiheen 3 tutkimuksissa Botox-valmisteella (200 ja 300 yksikköä) todettiin ensisijaisena tehoajankohtana 6 viikon kohdalla lumelääkkeeseen nähden merkittävää paranemista ensisijaisessa tehomuuttujassa eli inkontinenssiepisodien viikoittaisen määrän muutoksessa lähtötasolta, täysin inkontinenssittomien potilaiden osuus mukaan lukien. Urodynaamisissa parametreissa, jotka olivat maksimaalisen kystometriakapasiteetin suurentuminen ja ensimmäisen tahattoman rakkolihaksen supistuksen aikainen lihaksen enimmäispaine, todettiin merkittävää paranemista. Lumelääkkeeseen nähden merkittävää paranemista todettiin myös potilaiden omaan arvioon perustuvissa inkontinenssi-spesifisen terveydellisen elämänlaadun pisteissä, jotka mitattiin I-QOL -kyselyn avulla (kysely kattoi välttelevän/rajoittavan käytöksen, psykososiaaliset vaikutukset ja sosiaalisen kiusallisuuden). Hoitotulos 300 yksikön Botox-valmisteella ei ollut parempi kuin 200 yksikön Botox-valmisteella, ja 200 yksikön Botox-valmisteella todettiin olevan suotuisampi turvallisuusprofiili.
Avaintutkimusten yhdistetyt tulokset on esitetty alla:
Ensisijaiset ja toissijaiset päätetapahtumat lähtötasolla sekä muutos lähtötasolta yhdistetyissä avaintutkimuksissa:
Botox 200 yksikköä (N = 227) | Lumelääke (N = 241) | p-arvot | |
Virtsainkontinenssiepisodien viikoittainen määrä* Keskimäärin lähtötasolla Keskim. muutos viikon 2 kohdalla Keskim. muutos viikon 6 kohdallaa Keskim. muutos viikon 12 kohdalla | 32,4 -17,7 -21,3 -20,6 | 31,5 -9,0 -10,5 -9,9 | p < 0,001 p < 0,001 p < 0,001 |
Maksim. kystometriakapasiteetti (ml) Keskimäärin lähtötasolla Keskim. muutos viikon 6 kohdallab | 250,2 +153,6 | 253,5 +11,9 | p < 0,001 |
1. tahattoman rakkolihaksen supistuksen aikainen lihaksen enimmäispaine (cmH20) Keskimäärin lähtötasolla Keskim. muutos viikon 6 kohdallab | 51,5 -32,4 | 47,3 +1,1 | p < 0,001 |
I-QOL-kyselyn yhteispisteetc,d Keskimäärin lähtötasolla Keskim. muutos viikon 6 kohdallab Keskim. muutos viikon 12 kohdalla | 35,37 +25,89 +28,89 | 35,32 +11,15 +8,86 | p < 0,001 p < 0,001 |
* Inkontinenssittomien potilaiden osuudet viikon 6 loppuun mennessä olivat 37 % 200 yksikön Botox-valmisteella ja 9 % lumelääkkeellä. Niiden potilaiden osuudet, joiden inkontinenssiepisodit vähenivät vähintään 75 %:lla lähtötasosta, olivat vastaavasti 63 % ja 24 %, ja niiden potilaiden, joiden inkontinenssiepisodit vähenivät vähintään 50 %:lla lähtötasosta, 76 % ja 39 %.
a Ensisijainen päätetapahtuma
b Toissijaiset päätetapahtumat
c I-QOL-yhteispisteiden vaihtelualue asteikolla 0 (eniten ongelmia) – 100 (ei yhtään ongelmia).
d Avaintutkimuksissa etukäteen määritetty pienin merkittävä ero (MID) I-QOL-yhteispisteille oli 8 pistettä, mikä perustuu 4–11 pisteen MID-arvioihin, joita on raportoitu potilailla, joilla on neurogeenista rakkolihaksen yliaktiivisuutta.
Vasteen mediaanikesto, joka perustui potilaiden uudelleenhoitopyyntöihin, oli kahdessa avaintutkimuksessa 256–295 päivää (36–42 viikkoa) 200 yksikön Botox-valmistetta saavilla ja 92 päivää (13 viikkoa) lumelääkettä saavilla. Vasteen mediaanikesto, joka perustui potilaiden uudelleenhoitopyyntöihin, oli 253 päivää (~ 36 viikkoa) potilailla, jotka jatkoivat tutkimuksen avoimessa vaiheessa ja saivat hoidoksi vain Botox 200 yksikköä -valmistetta (N = 174).
Uudelleenhoidossa potilaiden vasteet olivat yhdenmukaisia kaikkien tehoa koskevien päätetapahtumien osalta.
Kellään avaintutkimusten 475 potilaasta, jolla oli neurogeeninen yliaktiivinen rakkolihas ja jolta otettiin näytteet analysoitavaksi, ei kehittynyt neutraloivia vasta-aineita. Lääkkeen kehitysohjelman aikana (mukaan lukien avoin jatkotutkimus) analysoiduista potilaista neutraloivia vasta-aineita kehittyi kolmelle 300 potilaasta (1,0 %) käytettäessä vain annoksia Botox 200 yksikköä, ja viidelle potilaalle niistä 258:sta (1,9 %), jotka saivat vähintään yhden 300 yksikön annoksen. Neljällä näistä kahdeksasta potilaasta hoidon hyöty säilyi. Kaikkiin Botox-valmisteella hoidettuihin verrattuna niillä potilailla, joille kehittyi neutraloivia vasta-aineita, oli yleensä lyhyempi vasteen kesto ja vastaavasti he saivat hoitoja muita useammin (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Myyntiluvan hyväksymisen jälkeen suoritettu tutkimus
Lumekontrolloidussa kaksoissokkoutetussa myyntiluvan myöntämisen jälkeen tehdyssä tutkimuksessa oli multippeliskleroosia (MS) sairastavia potilaita, joilla oli neurogeenisesta rakkolihaksen yliaktiivisuudesta johtuvaa virtsankarkailua, jota ei ollut saatu tyydyttävästi hoidetuksi vähintään yhdellä antikolinergilla, ja jotka eivät katetroineet lähtötilanteessa. Potilaat satunnaistettiin saamaan joko 100 yksikköä Botox-valmistetta (N = 66) tai lumelääkettä (N = 78).
Ensisijaisessa päätetapahtumassa, päivittäisten inkontinenssiepisodien määrän muutoksessa lähtötilanteesta, havaittiin lähtötasolta mitattuna Botox (100 yksikköä) -valmisteella hoidetuilla merkitsevää paranemista lumelääkkeeseen verrattuna ensisijaisena tehoajankohtana viikolla 6, mukaan lukien kuivien potilaiden prosentuaalinen osuus. Merkitsevää paranemista havaittiin myös urodynaamisissa parametreissa sekä inkontinenssin vaikutusta elämänlaatua mittaavan kyselyn (Incontinence Quality of Life questionnaire, I-QOL) tuloksissa, mukaan lukien inkontinenssin käyttäytymistä rajoittava vaikutus, psykososiaalinen vaikutus ja kiusalliset sosiaaliset tilanteet.
Myyntiluvan hyväksymisen jälkeen suoritetun tutkimuksen tulokset ovat seuraavat:
Ensisijaiset ja toissijaiset päätetapahtumat lähtötasolla ja muutos lähtötasosta myyntiluvan saamisen jälkeen Botox 100 yksikköä -valmisteella tehdyssä tutkimuksessa MS-potilailla, jotka eivät katetroineet lähtötasolla:
Botox 100 yksikköä (N = 66) | Lumelääke (N = 78) | p-arvot | |
Virtsainkontinenssiepisodien päivittäinen määrä* Keskimäärin lähtötasolla Keskim. muutos viikon 2 kohdalla Keskim. muutos viikon 6 kohdallaa Keskim. muutos viikon 12 kohdalla | 4,2 -2,9 -3,3 -2,8 | 4,3 -1,2 -1,1 -1,1 | p < 0,001 p < 0,001 p < 0,001 |
Maksim. kystometriakapasiteetti (ml) Keskimäärin lähtötasolla Keskim. muutos viikon 6 kohdallab | 246,4 +127,2 | 245,7 -1,8 | p < 0,001 |
Ensimmäisen tahattoman rakkolihaksen supistuksen aikainen lihaksen enimmäispaine (cmH2O) Keskimäärin lähtötasolla Keskim. muutos viikon 6kohdallab | 35,9 -19,6 | 36,1 +3,7 | p = 0,007 |
I-QOL-kyselyn yhteispisteetc,d Keskimäärin lähtötasolla Keskim. muutos viikon 6kohdallab Keskim. muutos viikon 12 kohdalla | 32,4 +40,4 +38,8 | 34,2 +9,9 +7,6 | p < 0,001 p < 0,001 |
* Kuivien potilaiden prosentuaalinen osuus (ei inkontinenssia) viikon 6 loppuun mennessä oli 53,0 % (Botox 100 yksikköä -ryhmässä) ja 10,3 % (lumelääke)
a Ensisijainen päätetapahtuma
b Toissijainen päätetapahtuma
c I-QOL -yhteispisteiden vaihtelualue on asteikolla 0 (eniten ongelmia) – 100 (ei yhtään ongelmia).
d Ennen tutkimuksen alkua määritely pienin tärkeä ero (minimally important difference, MID) I‑QOL-yhteispisteille oli 11 pistettä, mikä perustuu neurogeenista rakkolihaksen yliaktiivisuutta sairastavien potilaiden ilmoittamiin 4–11 pisteen MID-arvioihin.
Vasteen mediaanikesto, joka perustui potilaiden uudelleenhoitopyyntöihin, oli tässä tutkimuksessa 362 päivää (~ 52 viikkoa) Botox 100 yksikköä -valmisteella hoidetuilla verrattuna 88 päivään (~ 13 viikkoa) lumelääkkeellä hoidetuilla.
Pediatristen potilaiden neurogeeninen rakkolihaksen yliaktiivisuus
Neurologiseen sairauteen liittyvästä rakkolihaksen yliaktiivisuudesta johtuvaa virtsainkontinenssia potevilla iältään 5–17-vuotiailla potilailla, joilla oli käytössä puhdas toistokatetrointi, tehtiin yksi kaksoissokkoutettu, rinnakkaisryhmillä toteutettu, satunnaistettu kliininen monikeskustutkimus (191622-120). Mukana oli yhteensä 113 potilasta (joista 99:llä oli selkäytimen dysrafismi, kuten selkärankahalkio, 13:sta selkäydinvaurio ja 1:llä selkäytimen poikittaistulehdus), jotka eivät olleet saaneet riittävää vastetta yhdellä antikolinergilla tai jotka eivät sietäneet tällaista hoitoa. Nämä potilaat satunnaistettiin saamaan valmistetta joko 50 yksikköä, 100 yksikköä tai 200 yksikköä ylittämättä kuitenkaan annosta 6 yksikköä/kg. Potilaat, jotka saivat satunnaistettua annosta pienemmän annoksen, koska enimmäisannos oli 6 yksikköä/kg, sijoitettiin analyysia varten tarkoitettuun lähimpään annosryhmään: Botox 50 yksikköä N = 38, Botox 100 yksikköä N = 45 ja Botox 200 yksikköä N = 30. Valmiste annettiin potilaille iän ja paikallisen käytännön mukaan anestesiassa. Sadalleyhdeksälle potilaalle (97,3 %) annettiin yleisanestesia tai kohtalainen sedaatio (tarvittiin < 12-vuotiaille potilaille), ja kolme potilasta (2,7 %) sai paikallispuudutuksen (sallittu vain ≥ 12-vuotiaille potilaille).
Virtsainkontinenssiepisodien päivittäinen päiväaikainen tiheys, virtsatilavuus aamun ensimmäisellä katetrointikerralla ja rakkolihaksen maksimipaine varastoitumisvaiheessa (cmH2O) kaksoissokkoutetun, rinnakkaisryhmillä toteutetun kliinisen tutkimuksen lähtötilanteessa sekä muutos lähtötilanteesta
Botox 200 yksikköä (N = 30) | Botox 100 yksikköä (N = 45) | Botox 50 yksikköä (N = 38) | p-arvo* Botox 200 vs. 50 yksikköä | p-arvo* Botox 100 vs. 50 yksikköä | |
| Virtsainkontinenssiepisodien päivittäinen päiväaikainen tiheysa | |||||
| Keskimäärin lähtötasolla (keskihajonta) | 3,7 (5,06) | 3,0 (1,07) | 2,8 (1,04) | ||
| Keskim. muutos* viikon 2 kohdalla | ‑1,1 | ‑1,0 | ‑1,2 | ||
| Keskim. muutos* viikon 6 kohdalla** (95 %:n luottamusväli) | ‑1,3 (‑1,8; ‑0,9) | ‑1,3 (‑1,7; ‑0,9) | ‑1,3 (‑1,7; ‑0,9) | 0,9123 | 0,9949 |
| Keskim. muutos* viikon 12 kohdalla | ‑0,9 | ‑1,4 | ‑1,2 | ||
| Virtsatilavuus aamun ensimmäisellä katetrointikerralla (ml)b | |||||
| Keskimäärin lähtötasolla (keskihajonta) | 187,7 (135,70)
| 164,2 (114,48)
| 203,5 (167,48)
| ||
| Keskim. muutos* viikon 2 kohdalla | 63,2 | 29,4 | 31,6 | ||
| Keskim. muutos* viikon 6 kohdalla** (95 %:n luottamusväli) | 87,5 (52,1; 122,8)
| 34,9 (7,9; 61,9)
| 21,9 (‑7,2; 51,1)
| 0,0055 | 0,5117 |
| Keskim. muutos* viikon 12 kohdalla | 45,2 | 55,8 | 12,9 | ||
| Rakkolihaksen maksimipaine varastoitumisvaiheessa (cmH2O)b | |||||
| Keskimäärin lähtötasolla (keskihajonta) | 56,7 (33,89) | 56,5 (26,86) | 58,2 (29,45) | ||
| Keskim. muutos* viikon 6 kohdalla** (95 %:n luottamusväli) | ‑27,3 (‑36,4; ‑18,2) | ‑20,1 (‑27,3; ‑12,8) | ‑12,9 (‑20,4; ‑5,3) | 0,0157 | 0,1737 |
*Pienimmän neliösumnan keskiarvon muutos ja 95 %:n luottamusväli sekä p-arvot perustuvat kovarianssianalyysimalliin (ANCOVA), jossa lähtötason arvo on kovariaatti ja hoitoryhmä, ikä (< 12 vuotta tai ≥ 12 vuotta), päiväaikaisten virtsainkontinenssiepisodien lähtötaso (≤ 6 tai > 6) ja antikolinergihoito (kyllä/ei) lähtötasolla ovat tekijöitä (factors).
** Ensisijainen aikapiste
a Ensisijainen päätetapahtuma
b Toissijainen päätetapahtuma
Vasteen mediaanikesto, joka perustui potilaiden uudelleenhoitopyyntöihin, oli tässä tutkimuksessa 214,0 päivää (31 viikkoa) Botox 50 yksikköä ‑valmisteella hoidetuilla, 169,0 päivää (24 viikkoa) Botox 100 yksikköä ‑valmisteella hoidetuilla ja 207 päivää (30 viikkoa) Botox 200 yksikköä ‑valmisteella hoidetuilla.
Niistä 99 pediatrisesta potilaasta, joilla oli lähtötasolla negatiivinen tulos sitovista vasta-aineista tai neutraloivista vasta-aineista ja joista oli lähtötason jälkeen vähintään yksi arvioitavissa ollut arvo yhdestä satunnaistetusta kaksoissokkoutetusta tutkimuksesta ja yhdestä kaksoissokkoutetusta jatkotutkimuksesta, kenellekään ei kehittynyt neutraloivia vasta-aineita 50–200 yksikköä Botox-valmisteen saamisen jälkeen.
IHON JA IHON APUELINTEN SAIRAUDET
Kainaloiden primaarinen hyperhidroosi
Kaksoissokko- ja monikeskusperiaatteella tehdyssä kliinisessä tutkimuksessa tutkittiin potilaita, jotka kärsivät jatkuvasta molemminpuolisesta kainaloiden primaarista hyperhidroosista, joka määriteltiin seuraavasti: kummankin kainalon lähtötason spontaani gravimetrisesti mitattu hieneritys vähintään 50 mg, 5 minuutin aikana levossa huoneenlämmössä. Yhteensä satunnaistettiin 320 potilasta saamaan joko 50 yksikköä Botox-valmistetta (N = 242) tai lumelääkettä (N = 78). Hoitoon reagoineina pidettiin niitä, joiden kainaloiden hieneritys oli vähentynyt lähtötasosta vähintään 50 %. Päävastemuuttujaksi valittiin 4. viikko injektion jälkeen, jolloin hoidon vaste Botox-ryhmässä oli 93,8 % ja lumelääkeryhmässä 35,9 % (p 0,001). Hoitoon reagoivien määrä jatkui huomattavasti suurempana Botox-valmistetta saaneiden ryhmässä kuin lumelääkeryhmässä (p 0,001) kaikissa hoidon jälkeisissä, tietyin aikavälein tehdyissä mittauksissa, joita tehtiin 16 viikon ajan.
Avoimeen seurantatutkimukseen valittiin 207 tutkimukseen soveltuvaa potilasta, joille annettiin Botox-hoitoa enintään 3 kertaa. Yhteensä 174 potilasta pysyi mukana kummankin tutkimuksen kokonaisajan eli 16 kuukautta (4 kuukauden kaksoissokkoutettu aika ja 12 kuukauden avoin jatko-osa). Kliininen vaste 16. viikolla ensimmäisen hoitokerran (N = 287) jälkeen oli 85,0 %, toisen hoitokerran (N = 123) jälkeen 86,2 % ja kolmannen hoitokerran (N = 30) jälkeen 80 %. Kerta-annostutkimuksen ja avoimen jatkotutkimuksen tulosten mukaan vaikutuksen keskimääräinen kesto ensimmäisen hoitokerran jälkeen oli 7,5 kuukautta, mutta 27,5 %:lla potilaista vaikutus kesti yhden vuoden tai sitä kauemmin.
Kliinisiä tutkimustuloksia Botox-valmisteen käytöstä kainaloiden primaarin hyperhidroosin hoitoon 12–18-vuotiailla lapsilla on vain vähän. USA:ssa on tehty yksi kontrolloimaton, vuoden pituinen turvallisuustutkimus toistuvilla annoksilla kainaloiden vaikeasta primaarista hyperhidroosista kärsivillä 12–17-vuotiailla lapsipotilailla (n = 144). Suurin osa potilaista oli naispuolisia (86,1 %) ja valkoihoisia (82,6 %). Annos oli 50 yksikköä kainaloa kohden eli yhden potilaan kokonaisannos oli 100 yksikköä/hoitokerta. Annoksen määrittämistä koskevia tutkimuksia nuorilla ei kuitenkaan ole tehty, joten annossuosituksia ei voida antaa. Botox-valmisteen tehoa ja turvallisuutta tässä ikäryhmässä ei ole täysin osoitettu.
Farmakokinetiikka
Vaikuttavan aineen yleiset ominaisuudet
Rotilla tehdyt jakautumistutkimukset ovat osoittaneet 125I-botuliini neurotoksiini A -kompleksin leviävän injektion jälkeen hitaasti kaksoiskantalihakseen, mitä seuraa nopea systeeminen metabolia ja erittyminen virtsaan. Lihaksessa olevan radioaktiivisella aineella merkityn materiaalin määrä väheni siten, että puoliintumisaika oli noin 10 tuntia. Injektiokohdassa radioaktiivisuus sitoutui suuriin proteiinimolekyyleihin ja plasmassa pieniin molekyyleihin, mikä viittaa siihen, että substraatin systeeminen metabolia on nopeaa. Kun injektion annosta oli kulunut 24 tuntia, 60 % radioaktiivisuudesta oli erittynyt virtsaan. Toksiini hajoaa todennäköisesti proteaasien vaikutuksesta, ja molekyylikomponentit käsitellään normaalien metaboliareittien kautta.
Valmisteen luonteen vuoksi tavanomaisia imeytymis-, jakautumis-, biotransformaatio- ja eliminaatiotutkimuksia vaikuttavalla aineella ei ole tehty.
Ominaisuudet potilaassa
Terapeuttisten Botox-annosten uskotaan jakautuvan elimistöön vain vähäisessä määrin. Kliinisissä tutkimuksissa, joissa on käytetty yksittäiskuituelektromyografiamenetelmiä, on havaittu elektrofysiologisen hermo-lihastoiminnan lisääntymistä injektiokohdasta etäällä olevissa lihaksissa. Toiminnan lisääntymiseen ei ole liittynyt kliinisiä merkkejä eikä oireita.
Prekliiniset tiedot turvallisuudesta
Lisääntymistutkimukset
Kun tiineille hiirille, rotille ja kanineille annettiin Botox-injektioita lihakseen organogeneesin aikana, NOAEL-arvot (taso, jolla ei havaittu haittavaikutuksia eli ”No Observed Adverse Effect Level”) olivat hiirillä 4 yksikkö/kg, rotilla 1 yksikkö/kg ja kaniineilla 0,125 yksikköä/kg. Suuremmat annokset aiheuttivat sikiön painon pienenemistä ja/tai viivästynyttä luutumista. Kaniineilla havaittiin lisäksi keskenmenoja.
Hedelmällisyys ja lisääntyminen
Lisääntymisen kannalta vaikutukseton (NOAEL) Botox-annos lihakseen oli urosrotille 4 yksikköä/kg ja naarasrotille 8 yksikköä/kg. Suurempiin annoksiin liittyi annosriippuvaista hedelmällisyyden heikkenemistä. Jos hedelmöittyminen tapahtui, valmistetta saaneiden urosrottien siittämien tai valmistetta saaneiden naarasrottien hedelmöittyneiden alkioiden lukumäärään tai elinkykyyn ei kohdistunut haittavaikutuksia.
Muut tutkimukset
Lisääntymistoksikologisten tutkimusten lisäksi Botox-valmisteella on tehty seuraaviin seikkoihin liittyviä prekliinisiä turvallisuustutkimuksia: akuutti toksisuus, toistuvien injektioiden aiheuttama toksisuus, paikallinen siedettävyys, mutageenisuus, antigeenisuus ja yhteensopivuus ihmisen veren kanssa. Näissä tutkimuksissa ei ole todettu vaaraa ihmiselle käytettäessä kliinisesti asianmukaista annostusta.
Tutkimuksessa, jossa nuorille rotille annettiin lihakseen Botox-injektio (annos 8, 16 tai 24 yksikköä/kg) joka toinen viikko kolmen kuukauden ajan syntymän jälkeisestä päivästä 21 alkaen, havaittiin muutoksia luiden koossa/geometriassa, johon liittyi luun tiheyden ja luumassan vähenemistä raajan käyttämättömyyden seurauksena, lihassupistusten puuttumista ja kehon painon lisääntymisen hidastumista. Nämä muutokset olivat lievempiä pienimmällä käytetyllä annoksella ja kaikilla annostasoilla havaittiin merkkejä muutosten palautuvuudesta. Nuorilla eläimillä haittavaikutusten kannalta vaikutukseton annostaso (8 yksikköä/kg) on samankaltainen kuin aikuisten enimmäisannos (400 yksikköä) ja pienempi kuin pediatrinen enimmäisannos (340 yksikköä) kehon painoon (kg) suhteutettuna.
Rotilla ei todettu systeemistä toksisuutta yhden rakkolihakseen annetun < 50 yksikön/kg injektion jälkeen. Vahinkoinjektion simuloimiseksi apinoille annettiin yksi Botox-annos eturauhasen virtsaputkeen ja peräsuolen proksimaaliseen osaan tai rakkularauhaseen ja virtsarakon seinämään (~ 7 yksikköä/kg) tai kohtuun (~ 3 yksikköä/kg). Injektiot eivät aiheuttaneet kliinisiä haittavaikutuksia. Yhdeksän kuukautta kestäneessä tutkimuksessa, jossa rakkolihakseen annettiin toistuvia annoksia (4 injektiota), havaittiin ptoosia 24 yksikön/kg annoksilla sekä kuolleisuutta ≥ 24 yksikön/kg annoksilla. Eläimillä, joiden annos oli ≥ 24 yksikköä/kg, havaittiin myös luustolihasten lihassyiden degeneraatiota/regeneraatiota. Näiden myopaattisten muutosten arvioitiin olevan systeemisestä altistuksesta johtuvia sekundaarisia vaikutuksia. Lihassyiden degeneraatiota todettiin myös yhdellä eläimellä, jonka annos oli 12 yksikköä/kg. Kyseisen eläimen leesio oli vakavuusasteeltaan minimaalinen, eikä sen uskottu liittyvän kliinisiin oireisiin. Mahdollista yhteyttä Botox-hoitoon ei pystytty selvittämään varmuudella. Annos 12 yksikköä/kg vastaa kolme kertaa suurempaa Botox-valmisteelle altistusta kuin neurogeenisesta rakkolihaksen yliaktiivisuudesta johtuvan virtsainkontinenssin hoitoon suositellun 200 yksikön kliinisen annoksen aiheuttama altistus (50 kg:n painoinen potilas).
Farmaseuttiset tiedot
Apuaineet
Ihmisen albumiini
Natriumkloridi
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
3 vuotta.
Tehoa mittaavat tutkimukset ovat osoittaneet, että valmistetta voidaan säilyttää käyttövalmiiksi saattamisen jälkeen enintään 5 vuorokautta 2–8 °C:n lämpötilassa.
Mikrobiologiselta kannalta katsoen valmiste pitäisi käyttää välittömästi. Jos sitä ei käytetä välittömästi, käytönaikaiset säilytysajat ja ‑olosuhteet ovat käyttäjän vastuulla eivätkä saisi tavallisesti ylittää 24 :ää tuntia 28 °C:n lämpötilassa, paitsi jos käyttövalmiiksi saattaminen/laimentaminen (jne.) on tapahtunut kontrolloiduissa ja validoiduissa aseptisissa olosuhteissa.
Säilytys
Säilytä jääkaapissa (2 °C−8 °C) tai säilytä pakastettuna (-5 °C − -20 °C).
Käyttökuntoon saatetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
BOTOX injektiokuiva-aine, liuosta varten
50 Allergan-yksikköä (L:ei) 50 U (165,10 €)
100 Allergan-yksikköä (L:ei) 100 U (237,22 €)
200 Allergan-yksikköä (L:ei) 200 U (404,43 €)
PF-selosteen tieto
Botox 50 Allergan-yksikköä
Väritön lasinen injektiopullo (tyyppi I), jossa on klooributyylikumitulppa ja alumiininen turvasuljin. Injektiopullon nimellistilavuus on 5 ml.
Botox 100 Allergan-yksikköä ja Botox 200 Allergan-yksikköä
Väritön lasinen injektiopullo (tyyppi I), jossa on klooributyylikumitulppa ja alumiininen turvasuljin. Injektiopullon nimellistilavuus on 10 ml.
Yksi pakkaus sisältää 1, 2, 3, 6 tai 10 injektiopulloa.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Valkoinen jauhe.
Botox-valmiste on ohut valkoinen kerros, jota voi olla vaikea erottaa injektiopullon pohjalta.
Käyttö- ja käsittelyohjeet
Kuiva-aineen liuottaminen ja ruiskun valmistelu on hyvä tehdä muovitettujen paperipyyhkeiden päällä mahdollisten roiskeiden varalta.
Botox-valmisteen saa laimentaa vain steriiliin säilytysaineettomaan 0,9 %:een natriumkloridi-injektionesteeseen. Ruiskuun vedetään asianmukainen määrä liuotinta. Ks. laimennusohjeet alla.
Botox 50, 100 ja 200 Allergan-yksikköä sisältävien injektiopullojen laimennustaulukko kaikkiin indikaatioihin virtsarakon sairauksia lukuun ottamatta:
| 50 yksikköä sisältävä injektiopullo | 100 yksikköä sisältävä injektiopullo | 200 yksikköä sisältävä injektiopullo | |
Lopullinen annos (yksikköä 0,1 ml:aa kohden) | Liuotinmäärä*, joka lisätään 50 yksikköä sisältävään injektiopulloon | Liuotinmäärä*, joka lisätään 100 yksikköä sisältävään injektiopulloon | Liuotinmäärä*, joka lisätään 200 yksikköä sisältävään injektiopulloon |
| 20 yksikköä | 0,25 ml | 0,5 ml | 1 ml |
| 10 yksikköä | 0,5 ml | 1 ml | 2 ml |
| 5 yksikköä | 1 ml | 2 ml | 4 ml |
| 2,5 yksikköä | 2 ml | 4 ml | 8 ml |
| 1,25 yksikköä | 4 ml | 8 ml | Ei oleellinen |
*steriili säilytysaineeton 0,9 % natriumkloridi-injektioneste, liuos
Yliaktiivinen virtsarakko:
Laimennuksen helpottamiseksi yhden 100 yksikköä sisältävän tai kahden 50 yksikköä sisältävän injektiopullon käyttö on suositeltavaa.
| Laimennusohjeet, kun käytetään kaksi 50 yksikköä sisältävää injektiopulloa |
|
| Laimennusohjeet, kun käytetään yksi 100 yksikköä sisältävä injektiopullo |
|
| Laimennusohjeet, kun käytetään yksi 200 yksikköä sisältävä injektiopullo |
|
Näin saadaan yksi 10 ml:n ruisku, jossa on yhteensä 100 yksikköä laimennettua Botox-valmistetta. Käytä ruiskuun laimennettu liuos heti. Hävitä käyttämättä jäänyt natriumkloridiliuos.
Tämä valmiste on tarkoitettu vain kertakäyttöön ja käyttämättä jäänyt käyttökuntoon saatettu valmiste on hävitettävä.
Neurogeenisesta rakkolihaksen yliaktiivisuudesta johtuva virtsainkontinenssi:
Laimennuksen helpottamiseksi yhden 200 yksikköä sisältävän tai kahden 100 yksikköä sisältävän injektiopullon käyttö on suositeltavaa.
| Laimennusohjeet, kun käytetään neljä 50 yksikköä sisältävää injektiopulloa |
|
| Laimennusohjeet, kun käytetään kaksi 100 yksikköä sisältävää injektiopulloa |
|
| Laimennusohjeet, kun käytetään yksi 200 yksikköä sisältävä injektiopullo |
|
Näin saadaan kolme 10 ml:n ruiskua, joissa on yhteensä 200 yksikköä laimennettua Botox-valmistetta. Käytä ruiskuun laimennettu liuos heti. Hävitä käyttämättä jäänyt natriumkloridiliuos.
Jos yhden injektiotoimenpiteen osana käytetään käytetään eri vahvuutta olevia Botox-injektiopulloja, oikean liuotinmäärän käytössä on oltava huolellinen saatettaessa käyttövalmiiksi tietty yksikkömäärä 0,1 ml:aa kohden. Käytettävä liuotinmäärä on erilainen, kun käytetään 50 Allergan-yksikköä, 100 Allergan-yksikköä tai 200 Allergan-yksikköä sisältävää Botox-valmistetta. Jokainen ruisku on merkittävä vastaavasti.
Koska Botox denaturoituu kuplimalla tai voimakkaan ravistamisen vuoksi, liuotin on ruiskutettava injektiopulloon varovasti. Injektiopullo on hävitettävä, jos pullossa oleva alipaine ei vedä liuotinta pulloon. Käyttövalmis Botox on kirkas, väritön tai hieman kellertävä liuos, joka ei sisällä hiukkasia. Ennen käyttöä on varmistettava silmämääräisesti, että valmis liuos on kirkasta ja että siinä ei ole hiukkasia. Käyttövalmista Botox-valmistetta voidaan säilyttää injektiopullossa jääkaapissa (2–8 °C) korkeintaan 24 tuntia. Jos Botox-valmistetta jatkolaimennetaan ruiskussa rakkolihaksensisäistä käyttöä varten, laimennos on käytettävä välittömästi. Valmis liuos on käytettävä yhteen hoitoon, ja mahdollisesti yli jäävä liuos on hävitettävä.
Turvallisen hävittämisen varmistamiseksi käyttämättömät injektiopullot on hävitettävä lisäämällä niihin hieman vettä, minkä jälkeen injektiopullot autoklavoidaan. Kaikki tyhjät injektiopullot, ruiskut sekä esineet, joihin liuosta on roiskunut, autoklavoidaan tai niissä oleva Botox-valmiste inaktivoidaan lisäämällä niihin laimennettua hypokloriittiliuosta (0,5 %) ja antamalla sen vaikuttaa 5 minuutin ajan.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
BOTOX injektiokuiva-aine, liuosta varten
100 Allergan-yksikköä 100 U
200 Allergan-yksikköä 200 U
- Peruskorvaus (40 %).
- Ei korvausta hammaslääkärin määräämästä lääkkeestä.
BOTOX injektiokuiva-aine, liuosta varten
50 Allergan-yksikköä 50 U
- Ei korvausta.
ATC-koodi
M03AX01
Valmisteyhteenvedon muuttamispäivämäärä
23.04.2025
Yhteystiedot
 ABBVIE OY
ABBVIE OY Veturitie 11 T 132
00520 Helsinki
010 2411 200
www.abbvie.fi
