ADVATE injektiokuiva-aine ja liuotin, liuosta varten 250 IU, 1000 IU, 1500 IU, 2000 IU, 3000 IU
Vaikuttavat aineet ja niiden määrät
ADVATE 250 IU/5 ml injektiokuiva‑aine ja liuotin, liuosta varten
Injektiopullossa on nimellisesti 250 IU ihmisen hyytymistekijä VIII:aa (yhdistelmä‑DNA‑tekniikalla valmistettua), oktokogi alfaa. ADVATE sisältää noin 50 IU/ml ihmisen hyytymistekijä VIII:aa (yhdistelmä-DNA-tekniikalla valmistettua), oktokogi alfaa, liuottamisen 5 ml:aan liuotinta jälkeen.
ADVATE 500 IU/5 ml injektiokuiva‑aine ja liuotin, liuosta varten
Injektiopullossa on nimellisesti 500 IU ihmisen hyytymistekijä VIII:aa (yhdistelmä‑DNA‑tekniikalla valmistettua), oktokogi alfaa. ADVATE sisältää noin 100 IU/ml ihmisen hyytymistekijä VIII:aa (yhdistelmä-DNA-tekniikalla valmistettua), oktokogi alfaa, liuottamisen 5 ml:aan liuotinta jälkeen.
ADVATE 1 000 IU/5 ml injektiokuiva‑aine ja liuotin, liuosta varten
Injektiopullossa on nimellisesti 1 000 IU ihmisen hyytymistekijä VIII:aa (yhdistelmä‑DNA‑tekniikalla valmistettua), oktokogi alfaa. ADVATE sisältää noin 200 IU/ml ihmisen hyytymistekijä VIII:aa (yhdistelmä-DNA-tekniikalla valmistettua), oktokogi alfaa, liuottamisen 5 ml:aan liuotinta jälkeen.
ADVATE 1 500 IU/5 ml injektiokuiva‑aine ja liuotin, liuosta varten
Injektiopullossa on nimellisesti 1 500 IU ihmisen hyytymistekijä VIII:aa (yhdistelmä‑DNA‑tekniikalla valmistettua), oktokogi alfaa. ADVATE sisältää noin 300 IU/ml ihmisen hyytymistekijä VIII:aa (yhdistelmä-DNA-tekniikalla valmistettua), oktokogi alfaa, liuottamisen 5 ml:aan liuotinta jälkeen.
ADVATE 2 000 IU/5 ml injektiokuiva‑aine ja liuotin, liuosta varten
Injektiopullossa on nimellisesti 2 000 IU ihmisen hyytymistekijä VIII:aa (yhdistelmä‑DNA‑tekniikalla valmistettua), oktokogi alfaa. ADVATE sisältää noin 400 IU/ml ihmisen hyytymistekijä VIII:aa (yhdistelmä-DNA-tekniikalla valmistettua), oktokogi alfaa, liuottamisen 5 ml:aan liuotinta jälkeen.
ADVATE 3 000 IU/5 ml injektiokuiva‑aine ja liuotin, liuosta varten
Injektiopullossa on nimellisesti 3 000 IU ihmisen hyytymistekijä VIII:aa (yhdistelmä‑DNA‑tekniikalla valmistettua), oktokogi alfaa. ADVATE sisältää noin 600 IU/ml ihmisen hyytymistekijä VIII:aa (yhdistelmä-DNA-tekniikalla valmistettua), oktokogi alfaa, liuottamisen 5 ml:aan liuotinta jälkeen.
Pitoisuus (IU, kansainvälinen yksikkö) määritetään Euroopan farmakopean kromogeenisella menetelmällä. ADVATE-valmisteen ominainen aktiivisuus on noin 4 520‑11 300 IU/mg proteiinia.
Oktokogi alfa (ihmisen hyytymistekijä VIII [yhdistelmä-DNA-tekniikalla valmistettu]) on puhdistettu proteiini, jossa on 2 332 aminohappoa. Se valmistetaan yhdistelmä‑DNA‑tekniikalla kiinanhamsterin munasarjan soluissa (CHO) siten, että solunviljelyprosessissa, puhdistamisessa tai lopullisessa valmisteessa ei ole käytetty lainkaan (ulkopuolista) ihmisestä tai eläimistä peräisin olevaa proteiinia.
Apuaine(et), joiden vaikutus tunnetaan
Tämä lääkevalmiste sisältää 0,45 mmol (10 mg) natriumia ja 0,5 mg polysorbaatti 80:aa per injektiopullo.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektiokuiva‑aine ja liuotin, liuosta varten.
Kliiniset tiedot
Käyttöaiheet
Hemofilia A ‑potilaiden verenvuodon hoito ja ennaltaehkäisy (hemofilia A on synnynnäinen tekijä VIII:n puutos). ADVATE on tarkoitettu kaikille ikäryhmille.
Ehto
Hoito tulee aloittaa hemofilian hoitoon perehtyneen lääkärin valvonnassa.
Annostus ja antotapa
Hoito tulee aloittaa hemofilian hoitoon perehtyneen lääkärin valvonnassa niin, että elvytystukea on välittömästi saatavilla anafylaksiatapauksiin.
Hoidon seuranta
Hoidon aikana on suositeltavaa säätää annettavaa annosta ja toistuvien infuusioiden antotiheyttä asianmukaisen tekijä VIII:n pitoisuuksien määrityksen avulla. Yksittäisten potilaiden vaste tekijä VIII:lle voi vaihdella, joten puoliintumisajassa ja saannossa voi olla eroja . Painoon perustuvaa annosta voi olla tarpeen muuttaa alipainoisille tai ylipainoisille potilaille. Erityisesti suurten leikkausten yhteydessä korvaushoitoa on tarkkaan seurattava koagulaatiomäärityksellä (plasman tekijä VIII -aktiivisuus).
Annostus
Korvaushoidon kesto ja annos riippuvat siitä, kuinka vaikea tekijä VIII:n puutos on, verenvuodon määrästä ja vuotokohdasta sekä potilaan kliinisestä tilasta.
Annettava tekijä VIII ‑yksikköjen määrä ilmoitetaan kansainvälisinä yksikköinä (International Unit, IU), joka on tämänhetkisen WHO:n tekijä VIII ‑valmisteiden konsentraattistandardin mukainen. Tekijä VIII:n aktiivisuus plasmassa ilmaistaan joko prosentteina (suhteessa ihmiseen normaaliin plasmaan) tai mieluummin kansainvälisinä yksikköinä (suhteessa plasman tekijä VIII:aa koskevaan kansainväliseen standardiin).
Yksi kansainvälinen yksikkö (IU) tekijä VIII:n aktiivisuutta vastaa tekijä VIII:n määrää millilitrassa ihmisen normaalia plasmaa.
Hoito tarvittaessa
Tarvittavan annoksen laskeminen perustuu siihen empiiriseen havaintoon, että yksi IU tekijä VIII:aa painokiloa kohden nostaa plasman tekijä VIII:n aktiivisuutta 2 IU/dl. Seuraava kaava auttaa tarvittavan annoksen laskemisessa:
Tarvittava tekijä VIII:n määrä (IU) = painokilo (kg) x haluttu tekijä VIII:n lisäys (%) x 0,5.
Annettavan määrän ja antotiheyden lähtökohtana on aina oltava kliininen vaikuttavuus kyseisessä yksittäistapauksessa. Tietyissä tapauksissa (esim. alhaisen titterin inhibiittorin esiintyessä) saattavat kaavan mukaan laskettuja annoksia suuremmat annokset olla tarpeen.
Seuraavissa verenvuototapauksissa tekijä VIII:n aktiivisuus ei saa pudota alle annetun plasman aktiivisuustason (prosenttia normaalista tasosta tai IU/dl) vastaavana aikana. Alla oleva taulukko (taulukko 1) on ohjeellinen verenvuototapauksiin ja leikkauksiin:
Taulukko 1. Ohjeelliset annokset verenvuototapauksissa ja leikkauksissa
Verenvuodon määrä/ kirurgisen toimenpiteen laatu | Tekijä VIII:n tarvittava määrä (% tai IU/dl) | Annosten väli (tunteja)/ hoidon kesto (vuorokausia) |
| Verenvuoto | ||
| Alkava nivelensisäinen vuoto, lihas‑ tai suuverenvuoto. | 20–40 | Toista injektiot 12–24 tunnin välein (8–24 tunnin välein alle 6‑vuotiailla potilailla) vähintään 1 vuorokauden ajan, kunnes kivulias verenvuoto on loppunut tai parantunut. |
| Suurehko nivelensisäinen vuoto, lihasverenvuoto tai verenpurkauma. | 30–60 | Toista injektiot 12–24 tunnin välein (8–24 tunnin välein alle 6‑vuotiailla potilailla) vähintään 3–4 vuorokauden ajan, kunnes kipu on hävinnyt ja akuutisti hävinnyt liikuntakyky on palautunut. |
| Hengenvaaralliset verenvuodot. | 60–100 | Toista injektiot 8–24 tunnin välein (6–12 tunnin välein alle 6‑vuotiailla potilailla), kunnes kriittinen tilanne on ohi. |
| Kirurgia | ||
Pieni toimenpide mukaan lukien hampaan poistaminen. | 30–60 | Joka 24. tunti (12–24 tunnin välein alle 6‑vuotiailla potilailla) ainakin 1 vuorokauden ajan, kunnes potilas paranee. |
| Suurehko leikkaus | 80–100 (ennen leikkausta ja sen jälkeen) | Toista injektiot 8–24 tunnin välein (6–24 tunnin välein alle 6‑vuotiailla potilailla), kunnes haavat ovat kunnolla parantuneet. Sen jälkeen hoitoa jatketaan vielä vähintään 7 päivää, jotta tekijä VIII:n aktiivisuus pysyy tasolla 30–60 % (IU/dl). |
Profylaksia
Vaikeaa hemofilia A:ta sairastavien potilaiden verenvuodon pitkäaikaisessa ennaltaehkäisyssä tavalliset tekijä VIII ‑annokset ovat 20–40 IU painokiloa kohden 2–3 vuorokauden välein.
Joissakin tapauksissa, etenkin nuoremmilla potilailla, lyhyemmät antovälit tai suuremmat annokset voivat olla tarpeen.
Pediatriset potilaat
Tarpeen mukaisen hoidon annostus pediatrisille potilaille (0–18-vuotiaille) ei poikkea aikuispotilaiden annostuksesta. Alle 6‑vuotiaille potilaille suositeltu tekijä VIII:n ennaltaehkäisevä annos on 20–50 IU painokiloa kohden 3–4 kertaa viikossa.
Antotapa
Laskimoon. Jos terveydenhuollon ammattihenkilö ei anna valmistetta, tarvitaan asianmukaista opastusta.
Antonopeus määrätään sellaiseksi, mikä tuntuu potilaasta mukavalta, eikä antonopeus saa ylittää 10 ml/min.
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen saattamisesta käyttökuntoon ennen lääkkeen antoa.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Todettu allerginen reaktio hiiren tai hamsterin proteiinille.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Yliherkkyys
Allergiatyyppisiä yliherkkyysreaktioita, mukaan lukien anafylaksia, on raportoitu ADVATE‑valmisteen yhteydessä. Valmisteessa on hiiren ja hamsterin proteiinien jäämiä. Jos yliherkkyysoireita ilmaantuu, valmisteen käyttö on lopetettava heti ja otettava yhteys lääkäriin. Potilaille on kerrottava yliherkkyysreaktioiden varhaisista merkeistä, kuten nokkosihottumasta, kutinasta, rinnan kiristyksestä, hengityksen vinkumisesta, matalasta verenpaineesta ja anafylaksiasta.
Jos potilas saa sokin, on noudatettava tavallisia sokin hoito‑ohjeita.
Inhibiittorit
Tekijä VIII:aa neutraloivien vasta‑aineiden (inhibiittoreiden) muodostuminen on tunnettu komplikaatio hemofilia A ‑potilaiden hoidossa. Inhibiittorit ovat yleensä IgG-immunoglobuliineja, jotka estävät tekijä VIII:n hyytymistoiminnan aktivoitumisen ja joiden määrä ilmaistaan Bethesda yksikköinä (Bethesda Units, BU) millilitrassa plasmaa käyttämällä muunneltua määritystä. Inhibiittoreiden muodostumisen riski riippuu taudin vaikeusasteesta ja altistumisesta tekijä VIII:lle. Riski on suurin 50 ensimmäisen altistuspäivän aikana mutta jatkuu koko elämän, joskin riski on melko harvinainen.
Inhibiittorien muodostumisen kliininen merkitys riippuu inhibiittorin titteristä. Riittämättömän kliinisen vasteen riski on pienempi, jos potilaalle muodostuu alhaisen titterin inhibiittoreita, verrattuna tilanteeseen, jossa potilaalla on korkean titterin inhibiittoreita.
Hyytymistekijä VIII ‑valmisteilla hoidettavien potilaiden inhibiittoreiden esiintyvyyttä on seurattava tarkkaan asianmukaisin kliinisin havainnoin ja laboratoriokokein. Jos odotettuja tekijä VIII:n aktiivisuuden plasmapitoisuuksia ei saavuteta tai jos verenvuotoa ei saada hallintaan asianmukaisella annoksella, on potilaalta testattava tekijä VIII:n inhibiittorin esiintyminen. Jos potilaalla on korkea inhibiittoripitoisuus, tekijä VIII -hoito ei ehkä ole tehokasta ja on harkittava muita terapeuttisia vaihtoehtoja. Näiden potilaiden hoidon on tapahduttava sellaisten lääkäreiden valvonnassa, joilla on kokemusta hemofiliasta ja tekijä VIII:n inhibiittoreista.
Kardiovaskulaariset tapahtumat
Potilailla, joilla on kardiovaskulaarisia riskitekijöitä, tekijä VIII:lla toteutettu korvaushoito voi suurentaa kardiovaskulaarista riskiä.
Katetriin liittyvät komplikaatiot
Jos keskuslaskimokatetri tarvitaan, siihen liittyvien komplikaatioiden, kuten paikallisten infektioiden, bakteremian ja katetripaikan tromboosin, mahdollisuus on otettava huomioon.
Apuaineeseen liittyviä seikkoja
Natrium
Tämä lääkevalmiste sisältää 10 mg natriumia per injektiopullo, joka vastaa 0,5 %:a WHO:n suosittelemasta natriumin 2 g:n päivittäisestä enimmäissaannista aikuisille.
On erittäin suositeltavaa, että aina kun ADVATE-valmistetta annetaan potilaalle, valmisteen nimi ja eränumero kirjataan muistiin, jotta potilaan ja lääkevalmiste-erän välille jää linkitys.
Pediatriset potilaat
Luetellut varoitukset ja varotoimet koskevat sekä aikuisia että lapsia.
Yhteisvaikutukset
Ihmisen hyytymistekijä VIII -valmisteiden (yhdistelmä‑DNA‑tekniikalla valmistettujen) osalta ei ole raportoitu yhteisvaikutuksia muiden lääkevalmisteiden kanssa.
Raskaus ja imetys
Eläimillä ei ole tutkittu tekijä VIII:n vaikutusta lisääntymiseen. Koska hemofilia A ‑sairautta esiintyy naisilla vain erittäin harvoin, kokemuksia tekijä VIII:n käytön vaikutuksista raskauteen ja imetykseen ei ole. Tämän vuoksi tekijä VIII:aa tulee käyttää raskauden ja imetyksen aikana vain, kun valmisteen käyttö on selvästi tarpeellista.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
ADVATE‑valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Yhteenveto turvallisuusprofiilista
ADVATE‑valmisteen kliinisiin tutkimuksiin osallistui 418 tutkimushenkilöä, joilla oli ainakin yksi ADVATE-käyttökerta ja jotka ilmoittivat yhteensä 93 haittavaikutuksesta. Yleisimpiä raportoituja haittavaikutuksia olivat tekijä VIII:n neutraloivat vasta-aineet (inhibiittorit), päänsärky ja kuume.
Yliherkkyysreaktioita tai allergisia reaktioita (joita voivat olla angioedeema, polttelu ja pistely infuusiokohdassa, vilunväristykset, punoitus, päänsärky, nokkosihottuma, matala verenpaine, uneliaisuus, pahoinvointi, levottomuus, takykardia, rinnan kiristys, pistely, oksentelu, hengityksen vinkuminen) on havaittu harvoin ja ne voivat joissakin tapauksissa edetä vaikeaksi anafylaksiaksi (mukaan lukien sokiksi).
Hiiren ja/tai hamsterin proteiinin vasta-aineiden kehittymistä ja siihen liittyviä yliherkkyysreaktioita saattaa ilmetä.
Neutraloivia vasta-aineita (inhibiittoreita) voi kehittyä hemofilia A ‑potilaille, jotka saavat tekijä VIII ‑hoitoa, kuten ADVATE-valmistetta (ks. kohta Farmakodynamiikka). Mikäli tällaisia inhibiittoreita ilmaantuu, se näkyy riittämättömänä kliinisenä vasteena hoidolle. Tällaisissa tapauksissa on suositeltavaa ottaa yhteyttä erikoistuneeseen hemofiliakeskukseen.
Taulukkomuotoinen yhteenveto haittavaikutuksista
Taulukossa 2 on haittavaikutuksien esiintyvyys kliinisissä tutkimuksissa ja spontaaneissa raporteissa MedDRA-elinjärjestelmäluokituksen mukaisesti (elinjärjestelmäluokka ja nimitys).
Esiintyvyys on arvioitu seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000) ja hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin). Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 2. Haittavaikutusten esiintyvyys kliinisissä kokeissa ja spontaaneissa raporteissa
| MedDRA:n vakio elinluokitus | Haittavaikutus | Haittavaikutuksen esiintyvyysa |
| Infektiot | Influenssa | Melko harvinainen |
| Kurkunpääntulehdus | Melko harvinainen | |
| Veri ja imukudos | Tekijä VIII:n inhibitio | Melko harvinainen (PTP)b Hyvin yleinen (PUP)b |
| Imusuonitulehdus | Melko harvinainen | |
| Immuunijärjestelmä | Anafylaktinen reaktio* | Tuntematon |
| Yliherkkyysc* | Tuntematon | |
| Hermosto | Päänsärky | Yleinen |
| Huimaus | Melko harvinainen | |
| Muistihäiriö | Melko harvinainen | |
| Pyörtyminen | Melko harvinainen | |
| Vapina | Melko harvinainen | |
| Migreeni | Melko harvinainen | |
| Makuhäiriö | Melko harvinainen | |
| Silmät | Silmätulehdus | Melko harvinainen |
| Sydän | Sydämentykytykset | Melko harvinainen |
| Verisuonisto | Hematooma | Melko harvinainen |
| Kuumat aallot | Melko harvinainen | |
| Kalpeus | Melko harvinainen | |
| Hengityselimet, rintakehä, ja välikarsina | Hengenahdistus | Melko harvinainen |
| Ruoansulatuselimistö | Ripuli | Melko harvinainen |
| Ylävatsakipu | Melko harvinainen | |
| Pahoinvointi | Melko harvinainen | |
| Oksentelu | Melko harvinainen | |
| Iho ja ihonalainen kudos | Kutina | Melko harvinainen |
| Ihottuma | Melko harvinainen | |
| Lisääntynyt hikoilu | Melko harvinainen | |
| Nokkosihottuma | Melko harvinainen | |
| Yleisoireet ja antopaikassa todettavat haitat | Kuume | Yleinen |
| Raajojen turvotus | Melko harvinainen | |
| Rintakipu | Melko harvinainen | |
| Epämukava tunne rinnassa | Melko harvinainen | |
| Vilunväreet | Melko harvinainen | |
| Epänormaali olo | Melko harvinainen | |
| Verisuonen pistokohdan hematooma | Melko harvinainen | |
| Väsymys* | Tuntematon | |
| Injektiokohdan reaktio* | Tuntematon | |
| Huonovointisuus* | Tuntematon | |
| Tutkimukset | Monosyyttimäärä suurentunut | Melko harvinainen |
| Vähentynyt hyytymistekijä VIIId | Melko harvinainen | |
| Vähentynyt hematokriitti | Melko harvinainen | |
| Laboratorioarvojen poikkeavuus | Melko harvinainen | |
| Vammat ja myrkytykset | Toimenpiteen jälkeinen komplikaatio | Melko harvinainen |
| Toimenpiteen jälkeinen verenvuoto | Melko harvinainen | |
| Toimenpidekohdan reaktio | Melko harvinainen |
a) Laskettu niiden potilaiden kokonaismäärästä (418), jotka saivat ADVATE-valmistetta kliinisissä tutkimuksissa, pois lukien markkinoilletulon jälkeisessä seurannassa tunnistetut haittavaikutukset, jotka on merkitty *.
b) Esiintyvyys perustuu kaikilla tekijä VIII -valmisteilla tehtyihin tutkimuksiin, joihin osallistui vaikeaa hemofilia A:ta sairastavia potilaita. PTP = aiemmin hoidetut potilaat, PUP = aiemmin hoitamattomat potilaat.
c) Haittavaikutus selitetty jäljempänä.
d) Yhdellä potilaalla hyytymistekijä VIII:n pitoisuudet laskivat odottamattoman alhaisiksi, kun ADVATE‑valmistetta annettiin jatkuvana infuusiona leikkauksen jälkeen (leikkauksen jälkeiset päivät 10–14). Verenvuoto pystyttiin hallitsemaan koko tämän ajan, ja sekä plasman tekijä VIII:n määrä että puhdistuma palasivat sopivalle tasolle 15. päivänä leikkauksen jälkeen. Tekijä VIII:n inhibiittorit mitattiin sekä jatkuvan infuusion että tutkimuksen päättymisen jälkeen, ja testitulokset olivat negatiivisia.
Kuvaus valikoiduista haittavaikutuksista
Valmistusprosessista jääneiden jäämien aiheuttamat haittavaikutukset
Hoidetuista 229 potilaasta, joilta tutkittiin kultahamsterin munasarjasolujen (CHO) proteiinin vasta‑aineet, 3 potilaalla todettiin tilastollisesti merkitsevä titterin nouseva trendi, 4 potilaalla todettiin jatkuvia kohonneita pitoisuuksia tai väliaikaisia pitoisuuspiikkejä ja yhdellä potilaalla oli molempia, mutta ei kliinisiä oireita. Hoidetuista 229 potilaasta, joilta tutkittiin hiiren IgG:n vasta‑aineet, 10 potilaalla todettiin tilastollisesti merkitsevä nouseva trendi, 2 potilaalla todettiin jatkuvia kohonneita pitoisuuksia tai väliaikainen pitoisuuspiikki ja yhdellä potilaalla oli molempia. Neljällä näistä potilaista raportoitiin yksittäisiä nokkosihottuma‑, kutina‑ ja ihottumatapauksia sekä hiukan kohonneita eosinofiilimääriä, kun heidät altistettiin toistuvasti tutkimusvalmisteelle.
Yliherkkyys
Allergistyyppisiä reaktioita ovat anafylaksi, jonka oireita ovat olleet pyörrytys, parestesia, ihottuma, punoitus, kasvojen turvotus, nokkosihottuma ja kutina.
Pediatriset potilaat
Haittavaikutusten esiintyvyyden, tyypin ja vaikeusasteen odotetaan olevan lapsilla samanlaisia kuin aikuisilla.
Lukuun ottamatta inhibiittorien kehittymistä aiemmin hoitamattomille lapsipotilaille (PUP) ja katetriin liittyviä komplikaatioita, mitään ikäspesifisiä eroja haittavaikutuksissa ei huomattu kliinisissä tutkimuksissa.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yhdistelmä‑DNA‑tekniikalla valmistetun hyytymistekijä VIII:n käytön yhteydessä ei ole raportoitu yliannostusoireista.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: veren hyytymistekijät, hyytymistekijä VIII. ATC‑koodi: B02BD02.
Vaikutusmekanismi
ADVATE sisältää yhdistelmä‑DNA‑tekniikalla valmistettua hyytymistekijä VIII:aa (oktokogi alfa). Se on glykoproteiini, joka on biologisesti samanarvoinen ihmisen plasman tekijä VIII -glykoproteiinin kanssa. Oktokogi alfa on 2 332 aminohaposta koostuva glykoproteiini, jonka molekyylimassa on noin 280 kD.
Tekijä VIII / von Willebrand ‑tekijän kompleksi koostuu kahdesta molekyylistä (tekijä VIII ja von Willebrandin tekijä). Näillä molekyyleillä on erilaiset fysiologiset toiminnot. Kun tekijä VIII:aa infusoidaan hemofiiliselle potilaalle, se sitoutuu endogeeniseen von Willebrand ‑tekijään potilaan verenkierrossa. Aktivoitu tekijä VIII toimii aktivoidun tekijä IX:n kofaktorina kiihdyttäen tekijä X:n muuttumista aktivoiduksi tekijä X:ksi. Aktivoitu tekijä X muuttaa protrombiinin trombiiniksi, joka puolestaan muuttaa fibrinogeenin fibriiniksi, ja hyytymä voi muodostua. Hemofilia A on sukupuoleen kytkeytynyt perinnöllinen verenhyytymishäiriö, joka johtuu alentuneesta tekijä VIII:C:n pitoisuudesta ja joka johtaa veren runsaaseen vuotamiseen niveliin, lihaksiin tai sisäelimiin joko itsestään tai onnettomuuden tai kirurgisen trauman seurauksena. Korvaushoidolla tekijä VIII:n pitoisuudet plasmassa suurenevat, ja näin tekijän puute voidaan tilapäisesti korjata ja verenvuotoalttiutta hillitä.
On huomattava, että vuotuinen verenvuotojen määrä (annualized bleeding rate, ABR) ei ole vertailukelpoinen eri tekijäkonsentraattien ja eri kliinisten tutkimusten välillä.
Kliininen teho ja turvallisuus
Tietoja inhibiittoripotilaiden immuunitoleranssin induktiosta (ITI) on kerätty. PUP‑tutkimuksen 060103 alitutkimuksessa kirjattiin 11 aiemmin hoitamattoman potilaan ITI‑hoidot. 30 ITI‑hoidetun pediatrisen tutkimushenkilön potilastietoja tarkasteltiin retrospektiivisesti (tutkimuksessa 060703). Ei-interventionaalisessa prospektiivisessa rekisterissä (PASS-INT-004) ITI dokumentoitiin 44 pediatrisella ja aikuisella tutkimushenkilöllä, joista 36 suoritti ITI-hoidon loppuun. Tiedot osoittavat, että immuunitoleranssi saatetaan saavuttaa.
Tutkimuksessa 060201 kahta pitkäkestoista profylaktista hoitomallia verrattiin toisiinsa 53 aiemmin hoidetulla potilaalla: yksilöllinen farmakokineettisesti ohjattu annostusohjelma (20–80 IU:ta tekijää VIII/painokilo 72 ± 6 tunnin välein, n = 23) verrattuna tavalliseen profylaktiseen annostusohjelmaan (20–40 IU/kg joka 48. ± 6 tunnin välein, n = 30). Farmakokineettisesti ohjattu annostusohjelma (tietyn kaavan mukaan) kohdistettiin tekijä VIII:n minimipitoisuuksien ylläpitämiseksi ≥ 1 %:ssa annosten välisenä 72 tunnin aikana. Tämän tutkimuksen tiedot osoittavat, että nämä kaksi profylaktista annosohjelmaa ovat samanveroisia verenvuotojen määrän vähentämisen osalta.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset ADVATE-valmisteen käytöstä kaikkien pediatristen potilasryhmien hemofilia A:n (synnynnäisen tekijä VIII:n puutoksen) hoidossa käyttöaiheissa ”immuunitoleranssin induktio potilailla, joilla on hemofilia A (synnynnäinen tekijä VIII:n puutos) ja joilla on kehittynyt inhibiittoreita tekijälle VIII” sekä ”hemofilia A:ta (synnynnäistä tekijä VIII:n puutosta) sairastavien verenvuotopotilaiden hoito ja ennaltaehkäisy” (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Kaikki ADVATE‑valmisteella tehdyt farmakokineettiset tutkimukset on tehty sellaisilla aiemmin hoidetuilla potilailla, joilla on vaikea tai kohtalaisen vaikea hemofilia A (tekijä VIII ≤ 2 %). Plasmanäytteet analysoitiin keskuslaboratoriossa käyttäen yksivaiheista hyytymiskoetta.
Farmakokineettiset parametrit saatiin yhteensä 195 tutkimushenkilöltä, jotka sairastavat vaikeaa hemofilia A:ta (lähtötilanteen tekijä VIII < 1 %). Nämä tiedot sisällytettiin tutkimussuunnitelman mukaiseen farmakokinetiikka‑analyysisarjaan. Näiden analyysien luokat vauvoista (1 kuukausi – < 2 vuotta), lapsista (2–< 5 vuotta), vanhemmista lapsista (5–< 12 vuotta), nuorista (12–< 18 vuotta) ja aikuisista (18 vuotta ja sitä vanhemmat) olivat farmakokineettisten parametrien yhteenvedon perusteena. Tässä mainittu ikä oli ikä infuusion antohetkellä.
Taulukko 3. Yhteenveto ADVATE‑valmisteen farmakokineettisistä parametreista ikäryhmittäin vaikeaa hemofilia A:ta sairastavien potilaiden hoidossa (lähtötilanteessa tekijä VIII < 1 %)
| Parametri (keskiarvo ± keskihajonta) | Vauvat (n = 5) | Lapset (n = 30) | Vanhemmat lapset (n = 18) | Nuoret (n = 33) | Aikuiset (n = 109) |
| AUC yhteensä (IU*h/dl) | 1 362,1 ± 311,8 | 1 180,0 ± 432,7 | 1 506,6 ± 530,0 | 1 317,1 ± 438,6 | 1 538,5 ± 519,1 |
| Korjattu inkrementaalinen saanto Cmax:n aikana (IU/dl per IU/kg)a | 2,2 ± 0,6 | 1,8 ± 0,4 | 2,0 ± 0,5 | 2,1 ± 0,6 | 2,2 ± 0,6 |
| Puoliintumisaika (h) | 9,0 ± 1,5 | 9,6 ± 1,7 | 11,8 ± 3,8 | 12,1 ± 3,2 | 12,9 ± 4,3 |
| Plasman enimmäispitoisuus infuusion jälkeen (IU/dl) | 110,5 ± 30,2 | 90,8 ± 19,1 | 100,5 ± 25,6 | 107,6 ± 27,6 | 111,3 ± 27,1 |
| Keskimääräinen viipymä elimistössä (h) | 11,0 ± 2,8 | 12,0 ± 2,7 | 15,1 ± 4,7 | 15,0 ± 5,0 | 16,2 ± 6,1 |
| Jakaantumistilavuus vakaassa tilassa (dl/kg) | 0,4 ± 0,1 | 0,5 ± 0,1 | 0,5 ± 0,2 | 0,6 ± 0,2 | 0,5 ± 0,2 |
| Puhdistuma (ml/kg*h) | 3,9 ± 0,9 | 4,8 ± 1,5 | 3,8 ± 1,5 | 4,1 ± 1,0 | 3,6 ± 1,2 |
a) Laskettuna (Cmax – lähtötilanteen tekijä VIII) jaettuna annoksella IU/kg‑yksikössä, missä Cmax on suurin infuusion jälkeinen tekijä VIII:n arvo.
Pediatriset potilaat
ADVATE‑valmisteen turvallisuus ja hemostaattinen teho pediatrisessa populaatiossa on samanlainen kuin aikuisten. Korjattu saanto ja terminaalinen puoliintumisaika (t ½) ovat pikkulapsilla (alle 6-vuotiailla) arviolta 20 % pienemmät kuin aikuisilla. Tämä voi johtua osittain siitä, että nuoremmilla potilailla tiedetään olevan enemmän plasmaa painokiloa kohti.
Farmakokineettisiä tietoja ei ole aiemmin hoitamattomista potilaista.
Prekliiniset tiedot turvallisuudesta
Ei‑kliinisissä tutkimuksissa, joita on tehty turvallisuudesta, äkillisestä toksisuudesta, toistuvien annosten toksisuudesta, paikallisesta toksisuudesta ja genotoksisuudesta, ei ole havaittu erityistä vaaraa ihmiselle.
Farmaseuttiset tiedot
Apuaineet
Injektiokuiva‑aine
Mannitoli (E421)
Tatriumkloridi
Tistidiini
Trehaloosi
Kalsiumkloridi (E509)
Trometamoli
Polysorbaatti 80 (E433)
Glutationi (pelkistetty)
Liuotin
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
Avaamaton injektiopullo
2 vuotta.
Kestoajan puitteissa valmistetta voidaan säilyttää huoneenlämmössä (alle 25 °C) yhtäjaksoisesti enintään 6 kuukautta. Merkitse pakkaukseen päivämäärä, milloin valmistetta on säilytetty huoneenlämmössä 6 kuukautta. Tämän ajanjakson lopussa valmiste on käytettävä tai hävitettävä. Valmistetta ei enää saa säilyttää jääkaapissa.
Liuottamisen jälkeen
Mikrobiologiselta kannalta valmiste on käytettävä heti liuottamisen jälkeen. Kemiallinen ja fysikaalinen säilyvyys käytön aikana on kuitenkin 3 tuntia alle 25 °C:ssa.
Säilytys
Säilytä jääkaapissa (2 °C – 8 °C).
Ei saa jäätyä.
ADVATE ja BAXJECT II ‑laite: säilytä valmisteen injektiopullo ulkopakkauksessa valolta suojattuna.
ADVATE BAXJECT III ‑järjestelmässä: säilytä suljettu läpipainopakkaus ulkopakkauksessa valolta suojattuna.
Liuotetun valmisteen säilytys ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
ADVATE injektiokuiva-aine ja liuotin, liuosta varten
2000 IU (L:ei) 2000 IU+5 ml (400 IU/ml) (1404,85 €)
3000 IU (L:ei) 3000 IU+5 ml (600 IU/ml) (2070,12 €)
PF-selosteen tieto
Sekä injektiokuiva-ainepullo että 5 ml liuotinta sisältävä injektiopullo ovat tyypin I lasia ja molemmat on suljettu klorobutyyli- tai bromobutyylikumitulpilla. Valmistetta on saatavana seuraavanlaisina kokoonpanoina:
- ADVATE ja BAXJECT II ‑laite: pakkauksessa on injektiokuiva‑ainepullo ja 5 ml:n liuotininjektiopullo sekä siirtolaite liuottamista varten (BAXJECT II).
- ADVATE BAXJECT III ‑järjestelmässä: pakkauksessa on käyttövalmis BAXJECT III ‑järjestelmä suljetussa läpipainopakkauksessa (injektiokuiva-ainepullo ja 5 ml liuotinta sisältävä injektiopullo on esikoottu liuotusjärjestelmän kanssa).
Valmisteen kuvaus:
Injektiokuiva-aine: valkoinen tai luonnonvalkoinen hauras jauhe.
Liuotin: kirkas ja väritön liuos.
Käyttö- ja käsittelyohjeet
Valmiste annetaan laskimoon sen jälkeen, kun kuiva‑aine on liuotettu.
Liuotettu lääkevalmiste on tarkastettava silmämääräisesti ennen antoa hiukkasten ja värimuutosten varalta. Liuoksen tulee olla kirkas ja väritön, eikä siinä saa olla vieraita hiukkasia. Sameita tai hiukkasia sisältäviä liuoksia ei saa käyttää.
- Valmisteen antamiseen tarvitaan ruisku, jossa on luer‑liitin.
- Käytä kolmen tunnin kuluessa liuottamisesta.
- Älä säilytä liuotettua valmistetta jääkaapissa.
- Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Liuottaminen BAXJECT II ‑laitteen avulla
- Käytä liuottamisessa vain pakkauksessa mukana olevaa steriiliä injektionesteisiin käytettävää vettä ja siirtolaitetta liuottamista varten.
- Älä käytä, jos BAXJECT II ‑siirtolaite, sen steriili suojajärjestelmä tai pakkaus on vahingoittunut tai viallinen.
- Aseptista tekniikkaa noudatettava.
1. Jos valmiste on yhä jääkaapissa, ota molemmat injektiopullot, ADVATE‑injektiokuiva‑aine ja liuotin, jääkaapista ja anna niiden lämmetä huoneenlämpöisiksi (15 °C–25 °C).
2. Pese kädet huolellisesti saippualla ja lämpimällä vedellä.
3. Poista injektiokuiva‑aine‑ ja liuotinpullon suojahatut.
4. Puhdista tulpat alkoholia sisältävillä pyyhkeillä. Aseta pullot puhtaalle, tasaiselle alustalle.
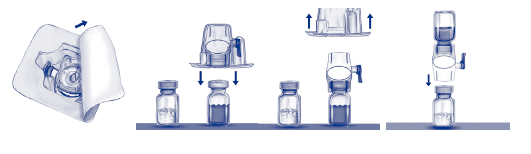
5. Avaa BAXJECT II –‑pakkaus vetämällä repäisykansi pois koskematta pakkauksen sisäpuolelle (kuva a). Älä poista BAXJECT II ‑siirtolaitetta pakkauksesta. Älä käytä, jos BAXJECT II ‑siirtolaite, sen steriili suojajärjestelmä tai pakkaus on vahingoittunut tai viallinen.
6. Käännä pakkaus ylösalaisin ja lävistä liuotinpullon kumikorkki BAXJECT II ‑siirtolaitteen kirkkaalla päällä. Tartu BAXJECT II ‑pakkauksen kulmaan ja vedä pakkaus irti BAXJECT II ‑siirtolaitteesta (kuva b). Älä poista BAXJECT II ‑siirtolaitteen sinistä suojusta.
7. Liuottamiseen saa käyttää vain pakkauksessa olevaa injektionesteisiin käytettävää steriiliä vettä ja siirtolaitetta. Käännä liuotinpullo ja siinä kiinni oleva BAXJECT II ‑siirtolaite ylösalaisin niin, että liuotinpullo on ylimpänä laitteen päällä. Lävistä injektiokuiva‑ainepullon tulppa siirtolaitteen valkoisella päällä. Injektiokuiva‑ainepullossa oleva tyhjiö imaisee liuottimen injektiokuiva‑ainepulloon (kuva c).
8. Pyörittele pulloa varovasti, kunnes injektiokuiva‑aine on kokonaan liuennut. Tarkista, että injektiokuiva‑aine on täysin liuennut, sillä muuten kaikki liuotettu vaikuttava aine ei pääse siirtolaitteen suodattimen läpi. Valmiste liukenee nopeasti (yleensä alle minuutissa). Liuottamisen jälkeen liuoksen tulee olla kirkas ja väritön, eikä siinä saa olla vieraita hiukkasia.
Kuva a Kuva b Kuva c
Liuottaminen BAXJECT III ‑järjestelmän avulla
- Ei saa käyttää, jos läpipainopakkauksen kantta ei ole suljettu tiiviisti.
1. Jos valmistetta säilytetään vielä jääkaapissa, ota suljettu läpipainopakkaus (sisältää injektiokuiva-aine- ja liuotinpullot esikoottuna liuottamiseen tarkoitetun järjestelmän kanssa) jääkaapista ja anna sen lämmetä huoneenlämpöiseksi (välille 15–25 °C).
2. Pese kätesi huolellisesti saippualla ja lämpimällä vedellä.
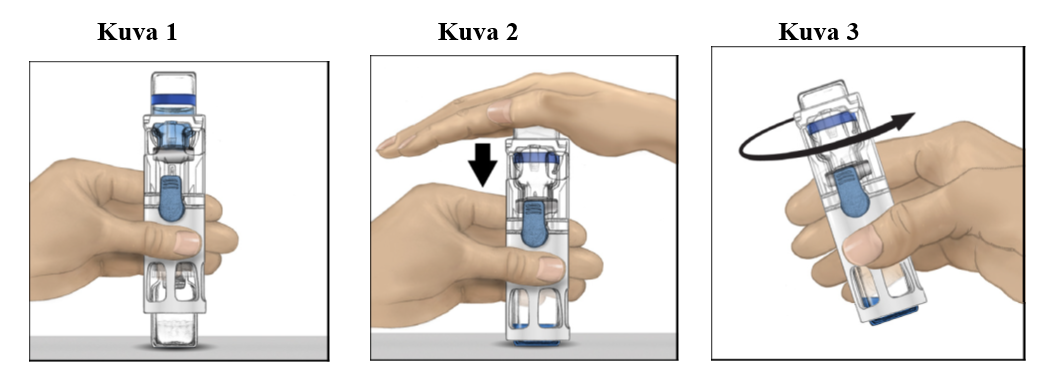
3. Avaa ADVATE-pakkaus poistamalla kansi. Poista BAXJECT III ‑järjestelmä läpipainopakkauksesta.
4. Aseta ADVATE tasaiselle pinnalle niin, että liuotinpullo on ylimpänä (kuva 1). Liuotinpullossa on sininen raita. Älä poista sinistä suojusta, ennen kuin myöhemmässä vaiheessa niin neuvotaan.
5. Pitele ADVATE-valmistetta toisella kädellä BAXJECT III ‑järjestelmässä ja paina liuotinpulloa tasaisesti alaspäin toisella kädellä, kunnes järjestelmä on painunut kokonaan kasaan ja liuotin virtaa ADVATE-injektiopulloon (kuva 2). Älä kallista järjestelmää, ennen kuin siirto on valmis.
6. Tarkista, että liuottimen siirto on valmis. Pyöritä varovasti, kunnes kaikki materiaali on liuennut (kuva 3). Varmista, että ADVATE-injektiokuiva-aine on kokonaan liuennut. Muuten kaikki liuotettu liuos ei kulkeudu laitteen suodattimen läpi. Valmiste liukenee nopeasti (tavallisesti alle minuutissa). Liuottamisen jälkeen liuos on myös kirkasta ja väritöntä eikä siinä näy vieraita hiukkasia.
Antaminen
- Noudata aseptista tekniikkaa.
Ennen antoa parenteraalisesti annettavat lääkevalmisteet pitää tarkistaa vieraiden hiukkasten varalta, milloin mahdollista liuoksen ja pakkauksen puolesta.Vain kirkasta ja väritöntä liuosta saa käyttää.
1. Poista BAXJECT II ‑siirtolaitteen / BAXJECT III ‑järjestelmän sininen suojus. Älä päästä ilmaa ruiskuun. Kiinnitä ruisku BAXJECT II ‑siirtolaitteeseen / BAXJECT III ‑järjestelmään.
2. Käännä järjestelmä ylösalaisin (injektiopullon, jossa liuotettu valmiste, oltava ylinnä). Vedä liuotettu valmiste ruiskuun vetämällä hitaasti ruiskun mäntää.
3. Irrota ruisku.
4. Kiinnitä perhosneula ruiskuun ja injektoi valmiste laskimoon. Valmiste annetaan hitaasti sellaisella antonopeudella, mikä on potilaasta mukavaa, eikä antonopeus saa ylittää 10 ml minuutissa. Pulssi mitataan ennen ADVATE‑valmisteen antoa sekä antamisen aikana. Jos pulssi nousee huomattavasti, antonopeutta on hidastettava tai valmisteen antaminen on tilapäisesti keskeytettävä, jolloin oireet yleensä häviävät nopeasti (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset).
Korvattavuus
ADVATE injektiokuiva-aine ja liuotin, liuosta varten
2000 IU 2000 IU+5 ml
3000 IU 3000 IU+5 ml
- Ylempi erityiskorvaus (100 %). Krooniset hyytymishäiriöt (126).
- Peruskorvaus (40 %).
ATC-koodi
B02BD02
Valmisteyhteenvedon muuttamispäivämäärä
21.05.2025
Yhteystiedot
 TAKEDA OY
TAKEDA OY PL 1406, Ilmalankuja 3
00101 Helsinki
0800 774 051
www.takeda.fi
etunimi.sukunimi@takeda.com
