ACTILYSE injektio-/infuusiokuiva-aine ja liuotin, liuosta varten 20 mg, 50 mg
Vaikuttavat aineet ja niiden määrät
1 injektiopullo, jossa on kuiva-ainetta sisältää:
10 mg (vastaa 5 800 000 IU:ta) alteplaasia tai
20 mg (vastaa 11 600 000 IU:ta) alteplaasia tai
50 mg (vastaa 29 000 000 IU:ta) alteplaasia
Alteplaasi tuotetaan yhdistelmä-DNA-tekniikalla käyttäen kiinanhamsterin munasarjasolulinjaa. WHO:n toisen kansainvälisen t-PA-standardin mukaan määritetyn valmistajan alteplaasireferenssin spesifinen aktiivisuus on 580 000 IU/mg. Alteplaasierien spesifinen aktiivisuus vaihtelee välillä 522 000‑696 000 IU/mg.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektio-/infuusiokuiva-aine ja liuotin, liuosta varten
Kliiniset tiedot
Käyttöaiheet
Akuutin sydäninfarktin trombolyyttinen hoito
- 90 minuutin (nopeutettu) anto (ks. kohta Annostus ja antotapa): potilaille, joiden hoito voidaan aloittaa 6 tunnin kuluessa oireiden alkamisesta.
- 3 tunnin anto (ks. kohta Annostus ja antotapa): potilaille, joiden hoito voidaan aloittaa 6–12 tunnin kuluessa oireiden alkamisesta - edellyttäen, että diagnoosi on selvästi varmistettu.
Akuutin sydäninfarktin saaneilla potilailla Actilyse-hoidon on osoitettu vähentävän 30 päivän kuolleisuutta.
Akuutin massiivisen keuhkoembolian ja siihen liittyvän hemodynaamisen häiriön trombolyyttinen hoito
Diagnoosi pitää varmistaa objektiivisin menetelmin kuten keuhkoangiografialla tai ei-invasiivisin menetelmin kuten keuhkokartoituksella aina kun se on mahdollista. Keuhkoemboliassa valmisteella ei ole havaittu olevan myönteisiä vaikutuksia kuolleisuuteen eikä myöhäissairastuvuuteen.
Akuutin iskeemisen aivohalvauksen trombolyyttinen hoito
Hoito on aloitettava niin pian kuin mahdollista 4,5 tunnin kuluessa aivohalvauksen oireiden alkamisesta ja ennen hoitoa on varmistuttava asianmukaisin kuvantamistutkimuksin, että potilaalla ei ole kallonsisäistä verenvuotoa (esim. kallonsisäinen tietokonetomografia tai muu diagnostinen kuvantamismenetelmä, jolla havaitaan herkästi verenvuoto). Koska hoidon teho on aikariippuvaista, aikainen hoidon aloitus lisää suotuisan hoitotuloksen todennäköisyyttä.
Ehto
Hoidon saa aloittaa indikaatiolla "akuutti iskeeminen aivohalvaus" ainoastaan neurologiseen hoitoon erikoistunut lääkäri.
Annostus ja antotapa
Actilyse-valmiste pitää antaa niin aikaisin kuin mahdollista oireiden alkamisen jälkeen. Annostuksessa noudatetaan seuraavia ohjeita.
Akuutti sydäninfarkti
Annostus
a) 90 minuutin (nopeutettu) anto potilaille, joilla on akuutti sydäninfarkti ja joiden hoito voidaan aloittaa 6 tunnin kuluessa oireiden alkamisesta.
Potilaat, joiden paino ≥ 65 kg:
Annostelumäärä alteplaasipitoisuuden mukaan | ||
1 mg/ml | 2 mg/ml | |
15 mg i.v. boluksena, jonka jälkeen välittömästi | 15 ml | 7,5 ml |
50 mg i.v. infuusiona tasaisella nopeudella ensimmäisen 30 minuutin aikana, jonka jälkeen välittömästi | 50 ml | 25 ml |
35 mg i.v. infuusiona tasaisella nopeudella 60 minuutin aikana, kunnes kokonaismaksimiannos 100 mg on annettu | 35 ml | 17,5 ml |
Potilaille, joiden paino < 65 kg kokonaisannos määritetään painon mukaan seuraavan taulukon mukaisesti:
Annostelumäärä alteplaasipitoisuuden mukaan | ||
| 1 mg/ml | 2 mg/ml | |
15 mg i.v. boluksena, jonka jälkeen välittömästi | 15 ml | 7,5 ml |
0,75 mg/painokilo i.v. infuusiona tasaisella nopeudella ensimmäisen 30 minuutin aikana, jonka jälkeen välittömästi | 0,75 ml/painokilo | 0,375 ml/painokilo |
0,5 mg/painokilo i.v. infuusiona tasaisella nopeudella 60 minuutin aikana | 0,5 ml/painokilo | 0,25 ml/painokilo |
b) 3 tunnin anto potilaille, joilla on akuutti sydäninfarki ja joiden hoito voidaan aloittaa 6 - 12 tunnin kuluessa oireiden alkamisesta.
Potilaat, joiden paino ≥ 65 kg:
| Annostelumäärä alteplaasipitoisuuden mukaan | ||
| 1 mg/ml | 2 mg/ml | |
10 mg i.v. boluksena, jonka jälkeen välittömästi | 10 ml | 5 ml |
50 mg i.v. infuusiona tasaisella nopeudella ensimmäisen tunnin aikana, jonka jälkeen välittömästi | 50 ml | 25 ml |
40 mg i.v. infuusiona tasaisella nopeudella seuraavien 2 tunnin aikana, kunnes kokonaismaksimiannos 100 mg on annettu | 40 ml | 20 ml |
Potilaat, joiden paino < 65 kg:
| Annostelumäärä alteplaasipitoisuuden mukaan | ||
| 1 mg/ml | 2 mg/ml | |
| 10 mg i.v. boluksena, jonka jälkeen välittömästi | 10 ml | 5 ml |
| i.v. infuusiona tasaisella nopeudella seuraavien 3 tunnin aikana kokonaismaksimiannokseen 1,5 mg/painokilo | 1,5 ml/painokilo | 0,75 ml/painokilo |
Lisähoito: Antitromboottista lisälääkitystä suositellaan nykyisten kansainvälisten hoitosuositusten mukaisesti ST-nousuinfarktipotilaille.
Antotapa
Käyttökuntoon saatettu liuos annostellaan laskimoon ja on tarkoitettu välittömästi käytettäväksi.
2 mg:n alteplaasipulloja ei ole tarkoitettu tähän käyttöaiheeseen. Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet käyttökuntoon saattamisesta/ annostelusta.
Akuutti massiivinen keuhkoembolia
Annostus
Potilaat, joiden paino ≥ 65 kg:
Kokonaisannos on 100 mg alteplaasia annettuna 2 tunnin aikana. Kliinistä kokemusta on eniten seuraavasta annostuksesta:
Annostelumäärä alteplaasipitoisuuden mukaan | ||
1 mg/ml | 2 mg/ml | |
10 mg i.v. boluksena 1–2 minuutin aikana, jonka jälkeen välittömästi | 10 ml | 5 ml |
90 mg i.v. infuusiona tasaisella nopeudella seuraavien 2 tunnin aikana, kunnes kokonaismaksimiannos 100 mg on annettu | 90 ml | 45 ml |
Potilaat, joiden paino < 65 kg:
| Annostelumäärä alteplaasipitoisuuden mukaan | |
1 mg/ml | 2 mg/ml | |
10 mg i.v. boluksena 1-2 minuutin aikana, jonka jälkeen välittömästi | 10 ml | 5 ml |
i.v. infuusiona tasaisella nopeudella seuraavien 2 tunnin aikana kokonaismaksimiannokseen 1,5 mg/painokilo | 1,5 ml/painokilo | 0,75 ml/painokilo |
Lisähoito: Alteplaasihoidon jälkeen hepariinihoito tulisi aloittaa (tai sitä tulisi jatkaa), kun APTT -arvot ovat alle kaksinkertaisia normaaliarvojen ylärajaan nähden. Infuusio tulisi säätää siten, että APTT-arvot ovat välillä 50–70 s (1,5 - 2,5 -kertaisia viitearvoihin nähden).
Antotapa
Käyttökuntoon saatettu liuos annetaan laskimoon ja on tarkoitettu välittömästi käytettäväksi.
2 mg:n alteplaasipulloja ei ole tarkoitettu tähän käyttöaiheeseen. Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet käyttökuntoon saattamisesta / annostelusta.
Akuutti iskeeminen aivohalvaus
Hoidon voi toteuttaa ainoastaan sellaisten lääkäreiden vastuulla ja seurannassa, joilla on koulutusta ja kokemusta neurovaskulaarisesta hoidosta (ks. kohdat Vasta-aiheet ja Varoitukset ja käyttöön liittyvät varotoimet). Lääkärin on oltava vastuussa hoidosta ja sen seurannasta.
Actilyse-hoito on aloitettava niin aikaisin kuin mahdollista 4,5 tunnin kuluessa oireiden alkamisesta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Jos Actilyse-hoito aloitetaan yli 4,5 tuntia aivohalvausoireiden alkamisen jälkeen, Actilysen antoon liittyy negatiivinen hyöty-riskisuhde, joten hoitoa ei pidä aloittaa (ks.kohta Farmakodynamiikka). |
Annostus
Suositeltava kokonaisannos on 0,9 mg alteplaasia painokiloa kohti (enintään 90 mg). Hoito aloitetaan 10 % kokonaisannoksesta sisältävällä laskimonsisäisellä boluksella, jonka jälkeen välittömästi annetaan jäljellä oleva määrä kokonaisannoksesta laskimonsisäisenä infuusiona 60 minuutin aikana.
ANNOSTELUTAULUKKO AKUUTISSA ISKEEMISESSÄ AIVOHALVAUKSESSA | |||
Käyttämällä suositeltua standardipitoisuutta 1 mg/ml, annettava määrä millilitroina vastaa suositeltua annosta milligrammoina | |||
Paino (kg) | Kokonaisannos (mg) | Bolusannos (mg) | Infuusioannos* (mg) |
40 | 36,0 | 3,6 | 32,4 |
42 | 37,8 | 3,8 | 34,0 |
44 | 39,6 | 4,0 | 35,6 |
46 | 41,4 | 4,1 | 37,3 |
48 | 43,2 | 4,3 | 38,9 |
50 | 45,0 | 4,5 | 40,5 |
52 | 46,8 | 4,7 | 42,1 |
54 | 48,6 | 4,9 | 43,7 |
56 | 50,4 | 5,0 | 45,4 |
58 | 52,2 | 5,2 | 47,0 |
60 | 54,0 | 5,4 | 48,6 |
62 | 55,8 | 5,6 | 50,2 |
64 | 57,6 | 5,8 | 51,8 |
66 | 59,4 | 5,9 | 53,5 |
68 | 61,2 | 6,1 | 55,1 |
70 | 63,0 | 6,3 | 56,7 |
72 | 64,8 | 6,5 | 58,3 |
74 | 66,6 | 6,7 | 59,9 |
76 | 68,4 | 6,8 | 61,6 |
78 | 70,2 | 7,0 | 63,2 |
80 | 72,0 | 7,2 | 64,8 |
82 | 73,8 | 7,4 | 66,4 |
84 | 75,6 | 7,6 | 68,0 |
86 | 77,4 | 7,7 | 69,7 |
88 | 79,2 | 7,9 | 71,3 |
90 | 81,0 | 8,1 | 72,9 |
92 | 82,8 | 8,3 | 74,5 |
94 | 84,6 | 8,5 | 76,1 |
96 | 86,4 | 8,6 | 77,8 |
98 | 88,2 | 8,8 | 79,4 |
100+ | 90,0 | 9,0 | 81,0 |
*annettuna pitoisuudella 1 mg/ml 60 minuutin aikana tasaisen nopeuden infuusiona
Lisähoito: Tämän hoidon turvallisuutta ja tehokkuutta ei ole riittävästi tutkittu annettaessa hepariinia tai verihiutaleiden estäjiä, kuten asetyylisalisyylihappoa, samanaikaisesti ensimmäisen 24 tunnin aikana oireiden alkamisesta. Tämän vuoksi laskimonsisäisen hepariinin tai verihiutaleiden estäjien, kuten asetyylisalisyylihapon, käyttöä pitää välttää ensimmäisen 24 tunnin aikana Actilyse-hoidon jälkeen lisääntyneen verenvuotoriskin takia. Jos hepariinia tarvitaan muiden käyttöaiheiden vuoksi (kuten syvän laskimotromboosin ehkäisyyn) annos ei saa ylittää ihon alle annettuna 10000 kansainvälistä yksikköä vuorokaudessa.
Antotapa
Käyttökuntoon saatettu liuos annetaan laskimoon ja on tarkoitettu välittömästi käytettäväksi.
2 mg:n alteplaasipulloja ei ole tarkoitettu tähän käyttöaiheeseen. Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet käyttökuntoon saattamisesta / annostelusta.
Pediatriset potilaat
Actilyse-valmisteen käytöstä lapsille ja nuorille on vain vähän tietoa. Actilyse-valmisteen käyttö on vasta-aiheista lasten ja alle 16-vuotiaiden nuorten akuutin iskeemisen aivohalvauksen hoidossa (ks. kohta Vasta-aiheet). Annos 16–17-vuotiaille nuorille on sama kuin aikuisille (katso suositukset ennen hoitoa käytettävistä kuvantamistekniikoista kohdasta Varoitukset ja käyttöön liittyvät varotoimet).
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituillle apuaineille.
Vasta-aiheena akuutissa sydäninfarktissa, akuutissa massiivisessa keuhkoemboliassa ja akuutissa iskeemisessä aivohalvauksessa:
Actilyse-valmiste on vasta-aiheinen, kun hoitoon liittyy suuri verenvuotoriski kuten seuraavissa tapauksissa:
- merkittävä vuotohäiriö samanaikaisesti tai viimeisen 6 kuukauden aikana
- verenvuototaipumus
- tehokasta oraalista antikoagulanttihoitoa (esim. varfariini, INR > 1,3) saavat potilaat (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
- ilmeinen tai äskettäin ollut vakava tai vaarallinen vuoto
- aikaisemmin havaittu tai epäilty kallonsisäinen verenvuoto
- epäilty lukinkalvonalainen verenvuoto tai aneurysmasta johtuvan lukinkalvonalaisen verenvuodon jälkitila
- keskushermostovaurio (esim. kasvain, aneurysma, intrakraniaalinen tai spinaalinen operaatio)
- äskettäinen (10 vrk:n sisällä) traumaattinen ulkoinen sydänhieronta, synnytys tai äskettäin tehty punktio suureen suoneen, johon ei voida laittaa kiristyssidettä (esim. v.subclavia tai v.jugularis)
- vaikea kontrolloimaton arteriaalinen hypertensio
- bakteeriendokardiitti, perikardiitti
- akuutti pankreatiitti
- 3 kuukauden sisällä todettu haavainen maha-suolikanavan sairaus, ruokatorven laskimonlaajentumat, valtimonpullistuma, valtimon/laskimon epämuodostuma
- kasvain, johon liittyy lisääntynyt vuotoriski
- vakava maksasairaus, mukaanlukien maksan vajaatoiminta, kirroosi, portaalinen hypertensio (ruokatorven laskimonlaajentumat) ja aktiivinen hepatiitti
- suurehko leikkaus tai vakava trauma viimeisten 3 kuukauden aikana.
Lisäksi vasta-aiheena akuutissa sydäninfarktissa on:
- aiempi aivohalvaus, johon on liittynyt verenvuotoa tai aivohalvaus, jonka syntyä ei tunneta
- aiempi iskeeminen aivohalvaus tai ohimenevä iskeeminen kohtaus (TIA) viimeisen 6 kuukauden aikana, paitsi akuutti iskeeminen aivohalvaus 4,5 tunnin sisällä
Lisäksi vasta-aiheena akuutissa massiivisessa keuhkoemboliassa on:
- aiempi aivohalvaus, johon on liittynyt verenvuotoa tai aivohalvaus, jonka syntyä ei tunneta
- aiempi iskeeminen aivohalvaus tai ohimenevä iskeeminen kohtaus (TIA) viimeisen 6 kuukauden aikana, paitsi akuutti iskeeminen aivohalvaus 4,5 tunnin sisällä
Lisäksi vasta-aiheina akuutissa iskeemisessä aivohalvauksessa ovat:
- yli 4,5 tuntia ennen infuusion aloittamista alkaneet iskeemisen kohtauksen oireet tai oireet, joiden alkamisen ajankohta ei ole tiedossa ja jotka ovat mahdollisesti alkaneet yli 4,5 tuntia aiemmin (ks. kohta Farmakodynamiikka).
- lievät neurologiset puutosoireet tai oireet, jotka helpottuvat nopeasti ennen infuusion aloittamista
- vakava aivohalvaus, joka on vahvistettu kliinisesti (esim. NIHSS > 25) ja/tai asianmukaisilla kuvantamistutkimuksilla
- kouristelu aivohalvauksen alkaessa
- kallonsisäiseen verenvuotoon viittaava löydös tietokonetomografiakuvassa
- lukinkalvonalaiseen verenvuotoon viittaavat oireet, vaikka tietokonetomografiakuva on normaali
- viimeisen 48 tunnin sisällä annettu hepariinihoito ja tromboplastiiniaika, joka ylittää normaalin laboratorioarvon ylärajan
- aiempi aivohalvaus ja samanaikainen diabetes
- aiempi aivohalvaus viimeisen 3 kuukauden aikana
- verihiutaleiden määrä alle 100 000/mm3
- systolinen verenpaine > 185 mmHg tai diastolinen verenpaine > 110 mmHg tai jos verenpaineen alentamiseksi näihin rajoihin tarvitaan aggressiivista hoitoa (laskimonsisäinen lääkehoito)
- veren glukoosipitoisuus < 50 mg/dl tai > 400 mg/dl (< 2,8 mM tai > 22,2 mM).
Käyttö lapsilla ja nuorilla
Actilyse-valmistetta ei pidä käyttää akuutin iskeemisen aivohalvauksen hoitoon alle 16-vuotiaille lapsille (16-vuotiaat ja sitä vanhemmat nuoret ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Käytettävän alteplaasivalmisteen pakkauskoko tulee valita huolellisesti käyttöaiheen mukaisesti. 2 mg:n alteplaasi-injektiopulloa ei ole tarkoitettu käytettäväksi akuutin sydäninfarktin, akuutin massiivisen keuhkoembolian tai akuutin iskeemisen aivohalvauksen hoitoon (suuresta aliannostuksen riskistä johtuen). Ainoastaan 10 mg, 20 mg tai 50 mg injektiopullot on tarkoitettu näihin käyttöaiheisiin.
Trombolyyttinen/fibrinolyyttinen hoito vaatii riittävää seurantaa. Actilyse-hoidon voi toteuttaa ainoastaan sellaisten lääkäreiden vastuulla ja seurannassa, joilla on koulutusta ja kokemusta trombolyyttisistä hoidoista ja mahdollisuus hoidon seurantaan. Actilyse-valmistetta annettaessa suositellaan kaikissa tilanteissa normaalin ensiapuvälineistön ja –lääkityksen saatavilla oloa.
Yliherkkyys
Immuunivälitteiset yliherkkyysreaktiot Actilyse-valmisteen annon yhteydessä voivat johtua vaikuttavasta aineesta alteplaasista tai mistä tahansa apuaineesta. Hoidon jälkeen ei ole havaittu pysyvää vasta-aineiden muodostumista rekombinantille ihmisen kudostyypin plasminogeeniaktivaattorimolekyylille. Actilyse-valmisteen toistuvasta annostelusta ei ole systemaattista kokemusta.
Myös ei-immunologisen mekanismin kautta välittyvien yliherkkyysreaktioiden riski on olemassa.
Angioedeema on yleisin Actilyse-valmisteen käytön yhteydessä raportoitu yliherkkyysreaktio. Tämä riski voi olla suurentunut käyttöaiheessa akuutti iskeeminen aivohalvaus ja/tai samanaikaisen ACE-estäjähoidon yhteydessä (ks. kohta Yhteisvaikutukset). Minkä tahansa hyväksytyn käyttöaiheen vuoksi hoidettavia potilaita on seurattava angioedeeman varalta infuusion aikana ja 24 tunnin ajan sen jälkeen.
Jos potilas saa vaikean yliherkkyysreaktion (esim. angioedeeman), infuusio on lopetettava ja asianmukainen hoito aloitettava heti. Tähän voi sisältyä intubaatio.
Verenvuodot
Yleisin komplikaatio Actilyse-hoidon aikana on verenvuoto. Muiden veren hyytymiseen tai verihiutaleiden toimintaan vaikuttavien aktiivisten aineiden samanaikainen käyttö voi edistää verenvuodon ilmaantumista. Fibriini hajotetaan Actilyse-hoidon aikana, minkä vuoksi verenvuotoa voi ilmaantua äskettäisissä pistoskohdissa. Tämän vuoksi trombolyyttinen hoito vaatii kaikkien mahdollisten vuotopaikkojen (ml. katetrien laittopaikat, valtimo- ja laskimopistospaikkojen sekä neulanpistojen) huolellista seurantaa. Jäykkiä katetreja, lihaksensisäisiä pistoja ja potilaan tarpeetonta käsittelyä on vältettävä Actilyse-hoidon aikana.
Vakavan verenvuodon, erityisesti aivoverenvuodon ilmaantuessa fibrinolyyttinen hoito on keskeytettävä ja samanaikainen hepariinin anto on lopetettava välittömästi. Hyytymistekijöiden korvaaminen ei kuitenkaan yleensä ole tarpeen, koska alteplaasin puoliintumisaika on lyhyt ja sen vaikutus veren hyytymistekijöihin vähäinen. Suurin osa potilaista, joilla verenvuotoa esiintyy, voidaan hoitaa keskeyttämällä trombolyyttinen ja antikoagulanttihoito, korvaamalla plasmavoluumin vajaus ja painamalla suonta. Protamiinisulfaatin antoa pitää harkita, jos hepariinia on annettu 4 tunnin sisällä vuodon alkamisesta. Niille harvoille potilaille, joilla em. konservatiivisella hoidolla ei saada aikaan hoitovastetta, voidaan harkita verensiirtovalmisteiden kuten kryopresipitaatin, tuorepakastetun plasman (jääplasma) ja verihiutaleiden antamista ja jokaisen annon jälkeen tilanne pitää aina arvioida uudelleen kliinisen tilan ja laboratorioarvojen perusteella. Fibrinogeenitaso, johon kryopresipitaatti-infuusiolla pyritään, on 1 g/l. Viimeisenä vaihtoehtona voidaan käyttää synteettisiä antifibrinolyyttisiä aineita.
Iäkkäillä potilailla kallonsisäisen verenvuodon riski on lisääntynyt, siksi näillä potilailla hyöty-riskisuhde pitää arvioida tarkkaan.
Kuten kaikkia trombolyyttisiä aineita myös alteplaasia käytettäessä pitää hyöty-riskiarviointi tehdä huolellisesti erityisesti potilaille, joilla on
- pieniä, äskettäisiä traumoja kuten esim. biopsiat, punktiot suuriin suoniin, i.m.-injektiot, sydämen elvytyshieronta
- muita kohdassa Vasta-aiheet mainitsemattomia sairauksia, joihin liittyy lisääntynyt verenvuototaipumus.
Oraalista antikoagulaatiohoitoa saavat potilaat:
Actilyse-valmisteen käyttöä voidaan harkita, kun annostus tai viimeksi otetusta antikoagulanttiannoksesta kulunut aika viittaavat jäännöstehon epätodennäköisyyteen, mikä on vahvistettu asianmukaisilla kyseisten valmisteiden antikoagulanttiaktiivisuutta mittaavilla kokeilla, jotka poissulkevat kliinisesti merkittävän vaikutuksen koagulaatiojärjestelmään (esim. K-vitamiiniantagonistilla INR ≤ 1,3 tai muille oraalisille antikoagulanteille tarkoitettujen kokeiden tulokset ovat normaaliarvojen ylärajoilla).
Pediatriset potilaat
Actilyse-valmisteen käytöstä lapsille ja nuorille on toistaiseksi vain vähän kokemuksia.
Kun Actilyse-valmistetta harkitaan akuutin iskeemisen aivohalvauksen hoitoon tarkoin valikoiduille 16 vuotta täyttäneille nuorille, hoidon hyötyjä ja riskejä on punnittava huolellisesti yksilökohtaisesti. Niistä on myös keskusteltava potilaan ja vanhemman/huoltajan kanssa kuten asianmukaista. 16 vuotta täyttäneitä nuoria hoidetaan aikuisia koskevien valmisteyhteenvedon ohjeiden mukaisesti, kun asianmukaisella kuvantamistekniikalla on suljettu pois aivohalvausta muistuttavat tilat ja neurologista puutosoiretta vastaava valtimotukos on vahvistettu (ks. kohta Farmakodynamiikka).
Akuutin sydäninfarktin ja akuutin massiivisen keuhkoembolian hoitoon liittyvät lisävaroitukset ja varotoimet:
Alteplaasin 100 mg:n maksimiannosta ei saa ylittää, koska siihen liittyy lisääntynyt kallonsisäisen verenvuodon vaara. Erityistä huomiota täytyy kiinnittää siihen, että infusoidun alteplaasiannoksen varmistetaan olevan se, mitä kohdassa Annostus ja antotapa on kuvattu.
Odotettavissa oleva terapeuttinen hyöty on punnittava erityisen huolellisesti suhteessa mahdollisiin riskeihin etenkin potilaille, joilla systolinen verenpaine on > 160 mmHg (ks. kohta Vasta-aiheet) ja iäkkäille, koska heillä on suurentunut riski saada kallonsisäinen verenvuoto. Koska terapeuttinen hyöty on positiivinen myös iäkkäillä potilailla, riski-hyötyarviointi on tehtävä huolellisesti.
GPIIb/IIIa antagonistit:
Samanaikainen GPIIb- ja IIIa-antagonistien käyttö lisää vuotoriskiä.
Akuutin sydäninfarktin hoitoon liittyvät lisävaroitukset ja varotoimet
Rytmihäiriöt:
Sepelvaltimoiden trombolyysi voi johtaa reperfuusioarytmiaan.
Reperfuusioarytmiat voivat johtaa sydämenpysähdykseen, voivat olla henkeä uhkaavia ja voivat vaatia konventionaalisten rytmihäiriöhoitojen käyttöä.
Tromboembolia:
Trombolyyttien käyttö voi suurentaa tromboembolisten tapahtumien riskiä potilailla, joilla on sydämen vasemman puolen trombeja, esim. mitraalistenoosi tai eteisvärinä.
Akuutin iskeemisen aivohalvauksen hoitoon liittyvät lisävaroitukset ja varotoimet:
Käyttöön liittyvät varotoimet:
Hoidon voi toteuttaa ainoastaan sellaisten lääkäreiden vastuulla ja seurannassa, joilla on koulutusta ja kokemusta neurovaskulaarisesta hoidosta. Käyttöaiheen varmistamiseksi voidaan tarpeen mukaan käyttää etädiagnostisia menetelmiä (ks. kohta Käyttöaiheet).
Erityisvaroitukset / tilanteet, joissa hyöty-riskisuhde on alentunut:
Kallonsisäinen verenvuoto on merkittävin haittavaikutus akuutin iskeemisen aivohalvauksen hoidossa (jopa 15 % potilaista, ilman että se lisäsi kokonaiskuolleisuutta tai yhdistettyä kokonaiskuolleisuutta ja vakavaa vammautumista, modified Rankin scale -asteikolla (mRS) pisteet 5 tai 6). Actilyse-valmisteella hoidettavilla akuuttia iskeemistä aivohalvausta sairastavilla potilailla on huomattavasti kohonnut kallonsisäisten verenvuotojen riski muihin käyttöaiheisiin verrattuna, koska vuoto tapahtuu pääasiassa infarktialueelle. Tätä esiintyy erityisesti seuraavissa tilanteissa:
- kaikki kohdassa Vasta-aiheet mainitut tilanteet ja yleensäkin kaikki tilanteet, joihin liittyy suuri verenvuotoriski
- pidempi aika aivohalvausoireiden alkamisen ja hoidon aloittamisen välillä pienentää kliinistä kokonaishyötyä. Tämän vuoksi Actilyse-valmisteen antoa ei saa viivästyttää.
- niillä potilailla, jotka ovat saaneet asetyylisalisyylihappoa (ASA), saattaa olla suurempi aivojensisäisen verenvuodon riski, etenkin jos Actilyse-hoito viivästyy.
- Iäkkäillä (yli 80-vuotiailla) potilailla hoitotulokset voivat olla hoidosta riippumatta jossain määrin huonommat kuin nuoremmilla potilailla. Heillä voi myös todennäköisemmin olla vaikeampia aivohalvauksia, joiden yhteydessä kallonsisäisen verenvuodon absoluuttinen riski on trombolyyttistä hoitoa käytettäessä suurempi kuin lievemmissä aivahalvauksissa trombolyyttistä hoitoa käytettäessä tai ilman trombolyyttistä hoitoa. Vaikka saatavilla olevat tiedot viittaavat siihen, että Actilyse-hoidon kokonaishyöty on yli 80-vuotiailla potilailla pienempi kuin nuoremmilla, Actilyse-hoitoa voidaan antaa yli 80-vuotiaille potilaille potilaskohtaisen hyöty-riskiarvion perusteella (ks. kohta Farmakodynamiikka). Iäkkäiden potilaiden kohdalla potilasvalinta on toteutettava hyvin huolellisesti, ja siinä on otettava huomioon sekä potilaan yleisvointi että neurologinen tila.
- Terapeuttinen hyöty on alentunut potilailla, joilla on aiemmin ollut aivohalvaus (ks. myös kohta Vasta-aiheet) tai joilla tiedetään olevan huonossa hoitotasapainossa oleva diabetes, joten hyöty-riskisuhteen katsotaan olevan alentunut, mutta kuitenkin vielä positiivinen.
- Potilailla, joilla on hyvin lievä aivohalvaus, riskit ovat suuremmat kuin odotettavissa oleva hyöty (ks. kohta Vasta-aiheet).
- Potilailla, joilla on hyvin vaikea aivohalvaus, on suurempi kallonsisäisen verenvuodon ja kuoleman riski, eikä heitä pitäisi hoitaa (ks. kohta Vasta-aiheet).
- Potilailla, joilla on laaja-alainen infarkti, on suurempi riski huonoon hoitotulokseen ja vaikeisiin verenvuotoihin ja kuolemaan. Näillä potilailla hyöty-riskisuhde pitää arvioida huolellisesti.
- Aivohalvauspotilailla hyvien hoitotulosten todennäköisyys pienenee mitä pidempi aika kuuluu hoidon aloittamiseen oireiden alkamisesta, iän myötä, aivohalvauksen vaikeusasteen kasvaessa ja tulohetkellä mitatun veren glukoosipitoisuuden suurenemisen myötä. Tällöin vaikean vammautumisen ja kuoleman tai oireisten kallonsisäisten verenvuotojen todennäköisyys kasvaa hoidosta huolimatta.
Hoitoa ei saa aloittaa, jos on kulunut enemmän kuin 4,5 tuntia oireiden alkamisesta, sillä hyöty-riskisuhde on epäsuotuisa perustuen pääasiassa seuraaviin:
- hoidon positiiviset vaikutukset vähenevät ajan kuluessa
- erityisesti aiemmin asetyylisalisyylihappoa saaneiden potilaiden kuolleisuus kasvaa
- oireisen verenvuodon riski kasvaa
Verenpaineen seuranta
Verenpaineen seuranta hoidon aikana sekä 24 tuntia hoidon jälkeen on perusteltua, myös suonensisäistä verenpainelääkitystä suositellaan, jos systolinen verenpaine on > 180 mmHg tai diastolinen verenpaine > 105 mmHg.
Muut erityisvaroitukset:
Iskeemisen alueen läpivirtauksen palautuminen saattaa aiheuttaa aivoedeemaa infarktoituneella alueella. Lisääntyneen verenvuotoriskin vuoksi verihiutaleiden aggregaatiota estävien aineiden käyttöä ei saa aloittaa 24 tunnin sisällä Actilyse-hoidon jälkeen.
Yhteisvaikutukset
Varsinaisia yhteisvaikutustutkimuksia Actilyse-valmisteen ja akuutin sydäninfarktin hoidossa yleisesti käytettyjen lääkkeiden kanssa ei ole tehty.
Veren hyytymiseen/verihiutaleiden toimintaan vaikuttavat lääkevalmisteet
Kumariinijohdosten, oraalisten antikoagulanttien, verihiutaleiden aggregaatiota estävien aineiden, fraktioimattoman hepariinin tai pienimolekyylisen hepariinin tai hyytymiseen vaikuttavien lääkeaineiden käyttö (ennen Actilyse-hoitoa, hoidon aikana tai 24 tuntia hoidon jälkeen) lisää verenvuotoriskiä (ks. kohdat Annostus ja antotapa ja Vasta-aiheet).
ACE-estäjät
ACE-estäjien samanaikainen käyttö voi lisätä yliherkkyysreaktioiden esiintymisriskiä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Samanaikainen GPIIb- ja IIIa-antagonistien käyttö lisää vuotoriskiä.
Raskaus ja imetys
Raskaus
On vain vähän tietoja alteplaasin käytöstä raskaana oleville naisille. Ei-kliinisissä kokeissa alteplaasilla havaittiin lääkkeen tunnetun farmakologisen vaikutuksen lisäksi sikiön epäkypsyyttä ja/tai alkiotoksisuutta, kun sitä annosteltiin ihmisille annettavia annoksia suuremmilla annoksilla. Alteplaasia ei pidetä teratogeenisena (ks. kohta Prekliiniset tiedot turvallisuudesta).
Akuuteissa, henkeäuhkaavissa tilanteissa mahdollinen hyöty ja riski pitää punnita tarkkaan.
Imetys
Ei tiedetä, erittyykö alteplaasi ihmisen rintamaitoon. Ei ole riittävästi tietoa alteplaasin erittymisestä koe-eläinten rintamaitoon.
Varovaisuutta on noudatettava käytettäessä Actilyse-valmistetta imettävälle äidille. On päätettävä, tauotetaanko imetys 24 tunnin ajaksi Actilyse-valmisteen käytön jälkeen.
Hedelmällisyys
Actilyse-valmisteen vaikutuksesta hedelmällisyyteen ei ole saatavissa kliinisiä tietoja. Alteplaasilla tehdyt ei-kliiniset tutkimukset eivät osoittaneet hedelmällisyyteen liittyviä haittavaikutuksia (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Ei merkityksellinen
Haittavaikutukset
Yleisin Actilyse-valmisteeseen liitetty haittavaikutus on erityyppiset verenvuodot, jotka aiheuttavat hematokriitti- ja/tai hemoglobiiniarvojen laskua.
Alla luetellut haittavaikutukset on luokiteltu esiintymistiheyden ja elinjärjestelmän mukaisesti. Yleisyydet on määritelty käyttäen seuraavaa tapaa: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1000, < 1/100), harvinainen (≥ 1/10000, < 1/1000), hyvin harvinainen (< 1/10000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Lukuun ottamatta kallonsisäistä verenvuotoa aivohalvausindikaation haittavaikutuksena sekä reperfuusiosta johtuvia arytmioita akuutissa sydäninfarkti-indikaatiossa ei ole lääketieteellistä syytä olettaa, että Actilyse-valmisteen kvalitatiivinen ja kvantitatiivinen haittavaikutusprofiili olisi indikaatioilla akuutti massiivinen keuhkoembolia ja akuutti iskeeminen aivohalvaus erilainen kuin indikaatiolla akuutti sydäninfarkti.
Taulukko 1 Haittavaikutukset akuutin sydäninfarktin, akuutin massiivisen keuhkoembolian ja akuutin iskeemisen aivohalvauksen hoidossa
Elinjärjestelmä | Haittavaikutus |
Verenvuoto | |
Hyvin yleinen | Kallonsisäinen verenvuoto on merkittävin haittavaikutus akuutin iskeemisen aivohalvauksen hoidossa Kaikki verenvuodot ml. tässä taulukossa mainitut, esim. kallonsisäiset ja ei-kallonsisäiset verenvuodot |
Yleinen | Kallonsisäinen verenvuoto (kuten aivoverenvuoto, verenpurkauma aivoissa, aivohalvaus johon liittyy verenvuoto, kallonsisäinen verenpurkauma, subaraknoidaalinen verenvuoto) akuutin sydäninfarktin ja akuutin massiivisen keuhkoembolian hoidossa Nieluverenvuoto Mahasuolikanavan verenvuoto (kuten mahaverenvuoto, mahahaavaverenvuoto, verenvuoto peräsuolesta, verioksennus, veriripuli, suuverenvuoto, ienverenvuoto) Mustelmat Verenvuoto virtsa- ja sukupuolielimiin (kuten verivirtsaisuus, virtsatieverenvuoto) Verenvuoto injektiokohdassa (verenvuoto pistoskohdassa, verenpurkauma katetrin paikassa, verenvuoto katetrin paikassa) |
Melko harvinainen | Keuhkoverenvuoto (veriyskä, veririnta, hengitysteiden verenvuoto) Nenäverenvuoto Korvaverenvuoto |
Harvinainen | Silmäverenvuoto Sydänpussin verenvuoto Vatsakalvontakainen verenvuoto (kuten vatsakalvontakainen verenpurkauma) |
Tuntematon*** | Verenvuoto parenkyymielimiin (kuten maksaverenvuoto) |
Immuunijärjestelmä | |
Harvinainen | Yliherkkyysreaktiot (esim. ihottuma, nokkosrokko, keuhkoputkien supistuminen, angioedeema, hypotensio, shokki)* |
Hyvin harvinainen | Vakava anafylaksia |
Hermosto | |
Hyvin harvinainen | Hermojärjestelmään liittyvät tapahtumat (esim. epileptinen kohtaus, kouristelu, afasia, puhehäiriö, sekavuustila, akuutti aivo-oireyhtymä, agitaatio, sekavuus, masennus, psykoosi) usein yhdessä samanaikaisten iskeemisten tai hemorragisten serebrovaskulaaristen tapahtumien kanssa |
Sydän** | |
Hyvin yleinen | Toistuva iskemia / angina pectoris, hypotensio ja sydämen vajaatoiminta / keuhkoedeema |
Yleinen | Kardiogeeninen shokki, sydänpysähdys ja uusintainfarkti |
Melko harvinainen | Reperfuusioarytmiat (kuten rytmihäiriö, lisälyönnit, eteis-kammiokatkos (ensimmäisen asteen katkoksesta täydelliseen katkokseen), eteisvärinä/lepatus, bradykardia, takykardia, kammioarytmia, kammiotakykardia/värinä, elektromekaaninen dissosiaatio (EMD)) Hiippaläpän vuoto, keuhkoembolia, muu systeeminen embolia/aivoembolia, kammioväliseinän aukko |
Verisuonisto | |
Harvinainen | Embolisaatio, joka voi johtaa vastaaviin seurauksiin kohde-elimissä |
Ruoansulatuselimistö | |
Harvinainen | Pahoinvointi |
Tuntematon*** | Oksentelu |
Tutkimukset | |
Melko harvinainen | Verenpaineen lasku |
Tuntematon*** | Lämmönnousu |
Vammat ja myrkytykset | |
Tuntematon*** | Rasvaembolisaatio (kolesterolikide-embolisaatio), joka voi johtaa vastaaviin seurauksiin kohde-elimissä |
Kirurgiset ja lääketieteelliset toimenpiteet | |
Tuntematon*** | Verensiirron tarve |
* Ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset.
**Sydän
Kuten muidenkin trombolyyttisten aineiden kohdalla, yllä kuvattuja tapahtumia on raportoitu sydäninfarktin ja / tai trombolyysihoidon seurauksena. Nämä sydämeen liittyvät tapahtumat voivat olla henkeä uhkaavia ja voivat johtaa kuolemaan.
***Esiintymistiheyden laskenta
Tämä haittavaikutus on havaittu valmisteen markkinoille tulon jälkeen. 95 % todennäköisyydellä sen esiintymistiheysluokka ei ole korkeampi kuin ”harvinainen”, vaan saattaa olla matalampi. Tarkka esiintymistiheyden määrittäminen ei ole mahdollista, sillä haittavaikutusta ei esiintynyt 8299 potilaan tiedoista koostuvassa kliinisten tutkimusten tietokannassa.
Kuolemia ja pysyvää vammautumista on raportoitu potilailla, joilla on ollut aivohalvaus (mukaan lukien kallonsisäinen verenvuoto) ja joku muu vakava vuototapahtuma.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Oireet
Jos suurin suositeltu annostus ylitetään, kallonsisäisen verenvuodon riski suurenee.
Alteplaasin suhteellisesta fibriiniselektiivisyydestä huolimatta yliannostus voi johtaa kliinisesti merkittävään fibrinogeenin ja muiden hyytymistekijöiden vähenemiseen.
Hoito
Useimmissa tapauksissa riittää, että hoidon keskeyttämisen jälkeen odotetaan hyytymistekijöiden fysiologista palautumista. Jos kuitenkin vakava verenvuoto ilmenee, suositellaan tuorepakastetun plasman (jääplasma) antoa ja jos välttämätöntä myös synteettisiä antifibrinolyyttejä voidaan käyttää.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Antitromboottiset lääkeaineet, ATC-koodi: B01AD02
Vaikutusmekanismi
Actilyse-infuusionesteen vaikuttava aine alteplaasi, rekombinantti ihmisen kudostyypin plasminogeeniaktivaattori, on glykoproteiini, joka aktivoi plasminogeenin suoraan plasmiiniksi. Laskimoon annon jälkeen alteplaasi pysyy suhteellisen inaktiivina verenkierrossa, kunnes se sitoutuu fibriiniin. Sitouduttuaan fibriiniin alteplaasi aktivoituu ja muuttaa plasminogeenin plasmiiniksi, joka liuottaa fibriinihyytymän.
Farmakodynaamiset vaikutukset
Annoksella 100 mg verenkierron fibrinogeenitasot laskevat alteplaasin suhteellisesta fibriiniselektiivisyydestä johtuen 4 tunnissa noin 60 prosenttiin alkutasosta ja palautuvat tavallisesti yli 80 prosenttiin 24 tunnin kuluttua. Plasminogeeni vähenee noin 20 prosenttiin ja α-2-antiplasmiini noin 35 prosenttiin alkuarvoista 4 tunnissa ja arvot palautuvat taas yli 80 prosenttiin 24 tunnissa. Vain muutamilla potilailla on havaittu verenkierron fibrinogeenitason merkittävää ja pitkäaikaisempaa laskua.
Kliininen teho ja turvallisuus
GUSTO-tutkimuksessa, johon osallistui yli 40 000 akuuttiin sydäninfarktiin sairastunutta potilasta, todettiin 30 päivän kuolleisuuden olevan pienemmän alteplaasiryhmässä (6,3 %) kuin streptokinaasiryhmässä (7,3 %). Tutkimuksessa käytettiin seuraavia hoitoannoksia: alteplaasi 100 mg/90 min + suonensisäinen hepariini-infuusio; streptokinaasi 1,5 milj.U/60 min + ihonalainen tai suonensisäinen hepariini. Actilyse-valmisteella hoidetuilla potilailla havaittiin 60 ja 90 minuuttia trombolyysin jälkeen korkeampi verisuonten aukioloaste kuin streptokinaasilla hoidetuilla potilailla. Aukioloasteessa ei ollut eroja, kun trombolyysistä oli kulunut 180 minuuttia tai enemmän.
30 päivän kuolleisuus on alhaisempi verrattuna potilaisiin, jotka eivät saa trombolyyttistä hoitoa.
α-hydroksibutyraattidehydrogenaasin (HBDH) vapautuminen vähenee. Sydämen kammiotoiminta kokonaisuudessaan samoin kuin alueellinen seinämän liike heikkenee trombolyysipotilailla vähemmän kuin potilailla, jotka eivät ole saaneet trombolyyttistä hoitoa.
Akuutti sydäninfarkti
Plasebokontrolloidussa kaksoissokkotutkimuksessa, jossa potilaille aloitettiin Actilyse-hoito (100 mg/3 tuntia; LATE-tutkimus) 6 - 12 tunnin kuluessa oireiden alkamisesta, todettiin 30 päivän kuolleisuudessa selvä väheneminen verrattuna plaseboa saaneisiin potilaisiin. Jos potilaalla on selvät sydäninfarktin oireet, saattaa hoito vielä olla hyödyllistä, kun se aloitetaan 24 tuntia oireiden alkamisesta.
Akuutti massiivinen keuhkoembolia
Akuutin massiivisen keuhkoembolian ja siihen liittyvän hemodynaamisen instabiliteetin trombolyyttinen hoito Actilyse-infuusionesteellä johtaa trombin koon nopeaan pienenemiseen ja keuhkovaltimopaineen laskuun. Tiedot vaikutuksesta kuolleisuuteen puuttuvat.
Potilaat, joilla akuutti iskeeminen aivohalvaus
Kahdessa USA:ssa tehdyssä tutkimuksessa (NINDS A/B) merkitsevästi suuremmalla osalla potilaista saatiin suotuisia hoitotuloksia alteplaasilla lumelääkkeeseen verrattuna (ei ollenkaan tai vain vähän vammautumista). Nämä tutkimustulokset vahvistettiin ECASS-III –tutkimuksessa (ks. alla oleva kappale) sen jälkeen, kun kahdessa eurooppalaisessa ja USA:ssa tehdyssä lisätutkimuksessa ei oltu saatu vastaavia tuloksia. Tutkimusasetelmat näissä tutkimuksissa eivät olleet linjassa nykyisen EU-tuotetiedon kanssa.
ECASS-tutkimus oli Euroopassa tehty lumelääkekontrolloitu kaksoissokkoutettu tutkimus, johon osallistui akuutin aivohalvauksen saaneita potilaita 3‑4,5 tunnin aikaikkunassa. ECASS III –tutkimuksessa hoito annettiin Actilyse-valmisteen eurooppalaisessa valmisteyhteenvedossa olevien aivohalvausindikaatiota koskevien ohjeiden mukaisesti. Ainoastaan hoidon myöhäisin aloitusajankohta (4,5 tuntia) poikkesi valmisteyhteenvedosta. Ensisijainen päätetapahtuma oli vammautuminen 90 vuorokauden kohdalla. Tulokset jaettiin kahtia suotuisiin (mRS-asteikolla 0-1) ja epäsuotuisiin (mRS-asteikolla 2-6). Yhteensä satunnaistettiin 821 potilasta (418 alteplaasi/403 lumelääke). Alteplaasiryhmässä suurempi osa potilaista (52,4 %) saavutti suotuisan lopputuloksen kuin lumelääkeryhmässä (45,2 %), kerroinsuhde [OR], 1,34; 95 % luottamusväli 1,02‑1,76; P=0,038). Minkä tahansa kallonsisäisen verenvuodon/ oireisen kallonsisäisen verenvuodon ilmaantuvuus oli korkeampi alteplaasiryhmässä kuin lumelääkeryhmässä (mikä tahansa kallonsisäinen verenvuoto 27,0 % vs 17,6%, p=0,0012; spontaani kallonsisäinen verenvuoto ECASS III -tutkimuksen määritelmän mukaan 2,4 % vs 0,2 %, p=0,008). Kuolleisuus oli alhainen eikä eronnut merkitsevästi alteplaasiryhmän (7,7 %) ja lumelääkeryhmän (8,4 %; P=0,681) välillä. ECASS III –tutkimuksen alaryhmien tulokset vahvistivat, että myöhäisempään hoidon aloittamiseen liittyy suurempi kuolleisuuden ja oireisen kallonsisäisen verenvuodon riski. ECASS III –tutkimuksen tulokset osoittavat Actilyse-valmisteen posiitivisen kliinisen kokonaishyödyn 3-4,5 tunnin aikaikkunassa, kun taas yhdistetyt tiedot viittaavat siihen, että alteplaasin kliininen kokonaishyöty ei ole enää suotuisa yli 4,5 tunnin aikaikkunassa.
Actilyse-valmisteen turvallisuutta ja tehoa akuutin aivohalvauksen hoidossa 4,5 tunnin kuluessa oireiden alkamisesta hoidon aloittamiseen on arvioitu meneillään olevan rekisteritutkimuksen avulla (SITS-ISTR: The Safe Implementation of Thrombolysis in Stroke registry). Tässä havainnoivassa tutkimuksessa vertailtiin turvallisuustietoja Actilyse-valmistetta 0-3 tunnin aikaikkunassa saaneilla potilailla (21 566 potilasta) ja potilailla, jotka saivat Actilyse-valmistetta 3-4,5 tunnin kuluessa akuutin iskeemisen aivohalvauksen alkamisesta (2 376 potilasta). Oireisen kallonsisäisen aivoverenvuodon ilmaantuvuus (SITS-MOST -tutkimuksen määritelmän mukaan) oli suurempaa 3-4,5 tunnin aikaikkunassa (2,2 %) verrattuna 0-3 tunnin aikaikkunaan (1,7 %). Kuolleisuuden ilmaantuvuus kolmen kuukauden kohdalla oli yhtä suurta 3-4,5 tunnin aikaikkunassa (12,0 %) kuin 0-3 tunnin aikaikkunassa (12,3 %) kun OR-suhdetta ei-mukautettu (OR 0,97 [95% luottamusväli: 0,84-1,13, p=0,70]) ja kun OR-suhde mukautettiin (OR 1,26 [95% luottamusväli: 1,07-1,49, p=0,005]). Kokeellisen SITS-tutkimuksen tulokset vahvistavat kliinisten tutkimusten tuloksia siitä, että oireiden alkamisen ja hoidon aloittamisen välinen aika (OTT) on tärkeä ennustetekijä alteplaasilla hoidetun akuutin aivohalvauksen hoidossa.
Iäkkäät potilaat (ikä > 80 vuotta)
Alteplaasin hyöty-riskisuhdetta potilailla, mukaan lukien > 80 vuoden ikäiset, arvioitiin yksittäisten potilaiden tietojen suhteen korjatuissa meta-analyyseissä. Niihin otettiin 6 756 potilaan tiedot yhdeksästä satunnaistetusta tutkimuksesta, joissa alteplaasia verrattiin lumehoitoon tai avoimeen vertailuhoitoon. Aivohalvauksen hyvän hoitotuloksen (mRS 0–1 päivänä 90/180) todennäköisyys suureni ja se yhdistettiin kaikissa ikäryhmissä suurempaan hyötyyn, kun hoito annettiin aikaisemmin (yhteisvaikutuksen p-arvo 0,0203). Hyvän hoitotuloksen todennäköisyys ei riippunut iästä.
Alteplaasihoidon vaikutus oli samankaltainen 80-vuotiailla tai sitä nuoremmilla potilailla [keskimääräinen hoitoviive 4,1 tuntia: 990/2512 (39 %) alteplaasilla hoidetuista potilaista vs 853/2515 (34 %) verrokkiryhmästä saavutettiin hyvä hoitotulos päivänä 90/180; OR 1,25, 95 % luottamusväli 1,10–1,42] ja yli 80-vuotiailla [keskimääräinen hoitoviive 3,7 tuntia: 155/879 (18 %) alteplaasilla hoidetuista potilaista vs 112/850 (13 %) verrokkiryhmästä saavutettiin hyvä hoitotulos; OR 1,56, 95 % luottamusväli 1,17–2,08].
Yli 80-vuotiailla potilailla, joita hoidettiin alteplaasilla 0–3 tunnin kuluessa, hyvä hoitotulos saavutettiin 55/302 (18,2 %) vs 30/264 (11,4 %) verrokkiryhmästä (OR 1,86, 95 % luottamusväli 1,11–3,13). Niillä yli 80-vuotiailla potilailla, joita hoidettiin alteplaasilla 3–4,5 tunnin kuluessa hyvä hoitotulos saavutettiin 58/342 (17,0 %) vs 50/364 (13,7 %) verrokkiryhmästä (OR 1,36, 95 % luottamusväli 0,87–2,14).
Tyypin 2 parenkyymiverenvuoto 7 päivän kuluessa ilmeni 231 (6,8 %) 3 391 potilaasta, joille oli määrätty alteplaasia versus 44 (1,3 %) 3 365 verrokkiryhmän potilaasta (OR 5,55, 95 % luottamusväli 4,01–7,70).
Kuolemaan johtanut tyypin 2 parenkyymiverenvuoto 7 päivän kuluessa ilmeni 91 (2,7 %) potilaalla, joille oli määrätty alteplaasia versus 13 (0,4 %) verrokkiryhmän potilaalle (OR 7,14, 95 % luottamusväli 3,98–12,79).
Alteplaasilla hoidetuilla yli 80-vuotiailla potilailla 7 päivän kuluessa tapahtunut kuolemaan johtanut kallonsisäinen verenvuoto ilmeni 32/879 (3,6 %) vs 4/850 (0,5 %) verrokkiryhmästä (OR 7,95 %, 95 % luottamusväli 2,79–22,60).
SITS-ISTR-rekisterissä yhteensä 8 658 potilaan potilasjoukosta, jossa potilaiden ikä oli > 80 vuotta ja hoito annettiin < 4,5 tunnin kuluessa aivohalvauksen alkamisesta, verrattiin kahta potilasryhmää: 2 157 potilasta, joiden hoito annettiin > 3 tunnin – 4,5 tunnin kuluttua aivohalvauksen alkamisesta, ja 6 501 potilasta, joiden hoito annettiin < 3 tunnin kuluessa.
Kolmen kuukauden kohdalla toiminnallisesti omatoimisia (mRS-pisteet 0–2) oli 36 % vs. 37 % ryhmien potilaista (korjattu OR 0,79; 95 % luottamusväli 0,68–0,92), kuolleisuus oli 29,0 % vs. 29,6 % (korjattu OR 1,10; 95 % luottamusväli 0,95–1,28) ja oireisia (SITS-MOST-tutkimuksen määritelmän mukaisia) kallonsisäisiä verenvuotoja esiintyi 2,7 %:lla vs. 1,6 %:lla (korjattu OR 1,62; 95 % luottamusväli 1,12–2,34).
Pediatriset potilaat
Riippumattomasta, kansainvälisestä SITS-ISTR-rekisteristä (Safe Implementation of Treatments in Stroke - International Stroke Thrombolysis Register) kerättiin havainnoivaa, satunnaistamatonta ja ei-vertailevaa tietoa 16–17-vuotiaista aivohalvauspotilaista, jotka olivat vahvistetusti saaneet alteplaasihoitoa. SITS-rekisteriin oli kerätty vuodesta 2003 vuoden 2017 loppuun yhteensä 25 pediatrista potilasta (ikäryhmä 16–17-vuotiaat), joilla alteplaasin käyttö oli vahvistettu. Tässä ikäryhmässä käytetyn alteplaasin mediaaniannos oli 0,9 mg/kg (vaihteluväli: 0,83–0,99 mg/kg). 25 potilaasta 23:lle aloitettiin hoito 4,5 tunnin kuluessa aivohalvausoireiden alkamisesta (19:lle 3 tunnin kuluessa; 4:lle 3–4,5 tunnin kuluessa; 1:lle 5–5,5 tunnin kuluessa, 1 tapauksessa ei raportoitu). Paino vaihteli välillä 56–90 kg. Useimmilla potilailla oli keskivaikea tai keskivaikea–vaikea aivohalvaus; NIHSS-mediaani oli lähtötilanteessa 9,0 (vaihteluväli 1–30).
Päivän 90 mRS-pisteet olivat saatavana 21 potilaalta 25:stä. Päivän 90 kohdalla mRS-pisteet olivat 14 potilaalla 21:sta 0–1 (ei oireita tai ei merkittävää toiminnanvajausta) ja 5 potilaalla mRS oli 2 (lievä toiminnanvajaus). Näin ollen 19 potilaalla 21:stä (yli 90 %) lopputulos oli suotuisa päivän 90 kohdalla mRS-pisteillä arvioituna. Lopuilla 2 potilaalla ilmoitettu lopputulos oli joko keskivaikea–vaikea toiminnanvajaus (mRS = 4; n = 1) tai kuolema (mRS = 6) 7 vrk kuluessa (n = 1).
Neljällä potilaalla päivän 90 mRS-pisteitä ei ollut ilmoitettu. Viimeisimmän saatavana olevan tiedon mukaan 2 potilaalla 4:stä mRS-pistemäärä oli 2 päivän 7 kohdalla, ja 2 potilaalla 4:stä ilmoitettiin tilan selvää yleistä kohenemista päivän 7 kohdalla.
Rekisterissä oli saatavana myös turvallisuustietoa verenvuoto- ja edeemahaittatapahtumista. Ikäryhmän 16–17-vuotiaat 25 potilaasta yhdelläkään ei ollut oireista kallonsisäistä aivoverenvuotoa (sICH, kallonsisäisten verenvuotojen tyyppi PH2). 5 tapauksessa alteplaasihoidon jälkeen kehittyi aivoedeemaa. 4 aivoedeemapotilaalla 5:stä ilmoitettiin joko päivän 90 mRS-pistemäärä 0–2 tai tilan yleinen kohentuminen päivänä 7 hoidon jälkeen. Yhdellä potilaalla ilmoitettiin mRS = 4 (keskivaikea–vaikea toiminnanvajaus) päivän 90 kohdalla. Mitkään näistä tapauksista eivät johtaneet kuolemaan.
Yhteenvetona SITS-rekisterissä oli 25 raporttia 16–17-vuotiaista potilaista, jotka olivat saaneet alteplaasia akuutin iskeemisen aivohalvauksen hoitoon aikuisia koskevien suositusten mukaisesti. Vaikkakin pieni otoskoko estää tilastollisen analyysin, kokonaistuloksissa havaitaan myönteinen suuntaus vastaavan aikuisten annoksen käytöstä näillä potilailla. Tietojen perusteella oireisen kallonsisäisen aivoverenvuodon tai edeeman riski ei vaikuta olevan suurempi kuin aikuispotilailla.
Farmakokinetiikka
Alteplaasi metaboloituu pääosin maksassa ja poistuu nopeasti verenkierrosta (plasmapuhdistuma 550–680 ml/min). Fysiologisissa olosuhteissa suurin osa verenkierrossa olevasta alteplaasista sitoutuu estäjään. Muut proteiinit, mukaan lukien alteplaasin estäjät, eivät estä alteplaasin maksapuhdistumaa. Alteplaasin ja sen estäjän muodostamat kompleksit poistuvat vapaana alteplaasina. Puoliintumisaika plasmassa t½α on 4–5 minuuttia, joten pitoisuus plasmassa putoaa alle 10 prosenttiin lähtöarvosta 20 minuutissa. Ääreistilassa jäljellä olevalle alteplaasille laskettu puoliintumisaika t½ß on 40 minuuttia.
Prekliiniset tiedot turvallisuudesta
Rotilla ja silkkiapinoilla tehdyissä subkroonisissa toksisuustutkimuksissa ei havaittu odottamattomia haittavaikutuksia. Mutageenisuustutkimuksissa alteplaasilla ei havaittu mutageenisia ominaisuuksia.
Tiineillä eläimillä tehdyissä tutkimuksissa alteplaasilla ei havaittu olevan teratogeenisia vaikutuksia annettaessa sitä suonensisäisenä infuusiona farmakologisesti tehokkaina annoksina. Kaneille alteplaasi oli embryotoksinen (sikiökuolleisuus, kasvun hidastuminen) annoksina > 3 mg/kg/päivä. Rotissa ei havaittu vaikutusta peri-postnataaliseen kehitykseen eikä lisääntymisparametreihin annoksen ollessa ≤ 10 mg/kg/päivä.
Farmaseuttiset tiedot
Apuaineet
Kuiva-aine:
Arginiini
Fosforihappo (pH:n säätämiseen)
Polysorbaatti 80
Liuotin:
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Käyttökuntoon saatettu liuos voidaan laimentaa steriilillä injektionesteisiin käytettävällä natriumkloridiliuoksella 9 mg/ml (0,9 %) siten, että pitoisuus on vähintään 0,2 mg/ml.
Lisälaimentamista tai injektionesteisiin käytettävän veden käyttöä laimentamiseen tai yleisesti hiilihydraattipitoisten infuusioliuosten kuten esim. glukoosiliuoksen käyttöä ei suositella käyttökuntoon saatetun liuoksen lisääntyneen samentumisen vuoksi.
Actilyse-infuusionestettä ei saa sekoittaa muiden lääkevalmisteiden kanssa samaan infuusiopulloon eikä samaan katetriin (ei edes hepariinin kanssa).
Kestoaika
Avaamattomat injektiopullot
Actilyse 10 mg injektio-/infuusiokuiva-aine ja liuotin, liuosta varten: 2 vuotta
Actilyse 20 mg ja 50 mg injektio-/infuusiokuiva-aine ja liuotin, liuosta varten: 3 vuotta.
Käyttökuntoon saatettu liuos
Käyttökuntoon saatetun liuoksen on osoitettu säilyvän enimmillään 24 tunnin ajan 2–8 °C:ssa ja 8 tunnin ajan 25 °C: ssa.
Mikrobiologiselta kannalta valmiste pitää käyttää heti käyttökuntoon saattamisen jälkeen. Ellei sitä käytetä heti, käytönaikainen säilytysaika ja käyttöä edeltävät olosuhteet ovat käyttäjän vastuulla, ja aika ei yleensä ole yli 24 tuntia 2–8°C:ssa.
Säilytys
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Säilytä alle 25 °C.
Käyttökuntoon saatetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
ACTILYSE injektio-/infuusiokuiva-aine ja liuotin, liuosta varten
20 mg (L:ei) 20 mg (siirtokanyyli) (583,02 €)
50 mg (L:ei) 50 mg (siirtokanyyli) (1060,08 €)
PF-selosteen tieto
Kuiva-aine:
10, 20 tai 50 ml:n steriloitu lasinen injektiopullo, joka on sinetöity steriilillä silikonipäällysteisellä harmaalla butyylityyppisellä tulpalla ja alumiini/muovi-repäisykapselilla.
Liuotin:
10, 20 ja 50 mg:n pakkauksissa injektionesteisiin käytettävä vesi on pakattu 10 ml, 20 ml tai 50 ml injektiopulloihin pakkauskoosta riippuen. Injektiopullot on sinetöity kumitulpilla sekä alumiini/muovi-repäisykapseleilla.
Siirtokanyyli (ainoastaan Actilyse 20 mg:n ja 50 mg:n pakkauksissa)
Pakkauskoot:
10 mg:
1 injektiopullo, jossa on 467 mg injektio-/infuusiokuiva-ainetta liuosta varten
1 10 ml:n injektiopullo injektionesteisiin käytettävää vettä
20 mg:
1 injektiopullo, jossa on 933 mg injektio-/infuusiokuiva-ainetta liuosta varten
1 20 ml:n injektiopullo injektionesteisiin käytettävää vettä
1 siirtokanyyli
50 mg:
1 injektiopullo, jossa on 2333 mg injektio-/infuusiokuiva-ainetta liuosta varten
1 50 ml:n injektiopullo injektionesteisiin käytettävää vettä
1 siirtokanyyli
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Väritön tai vaaleankeltainen lyofilisoitu jauhekakku. Käyttökuntoon saatettu liuos on kirkas ja väritön tai vaaleankeltainen.
Käyttö- ja käsittelyohjeet
Haluttaessa käyttökuntoon saatettu liuos, jonka alteplaasipitoisuus on 1 mg/ml, koko liuotinmäärä siirretään Actilyse kuiva-ainepulloon. Tähän tarkoitukseen pitää käyttää siirtokanyylia, joka on mukana Actilyse 20 mg:n ja 50 mg:n pakkauksissa. Actilyse 10 mg:n injektiopulloissa käytetään ruiskua.
Haluttaessa käyttökuntoon saatettu liuos, jonka alteplaasipitoisuus on 2 mg/ml, vain puolet liuotinmäärästä käytetään (alla olevan taulukon mukaisesti). Näissä tapauksissa tarvittava määrä liuotinta siirretään aina ruiskulla Actilyse kuiva-ainepulloon.
Actilyse-injektiopullon sisältö (10 mg, 20 mg tai 50 mg) liuotetaan aseptisesti injektionesteisiin käytettävään veteen seuraavan taulukon mukaan niin, että liuoksen alteplaasipitoisuudeksi saadaan joko 1 mg/ml tai 2 mg/ml:
| Actilyse-kuiva-aine | 10 mg | 20 mg | 50 mg |
| (a) Kuiva-aineeseen lisättävän steriilin injektionesteisiin käytettävän veden määrä | 10 ml | 20 ml | 50 ml |
| Lopullinen pitoisuus | alteplaasi 1 mg/ml | alteplaasi 1 mg/ml | alteplaasi 1 mg/ml |
| (a) Kuiva-aineeseen lisättävän steriilin injektionesteisiin käytettävän veden määrä | 5 ml | 10 ml | 25 ml |
| Lopullinen pitoisuus | alteplaasi 2 mg/ml | alteplaasi 2 mg/ml | alteplaasi 2 mg/ml |
Käyttökuntoon saatettu Actilyse-infuusioneste annetaan laskimoon. Käyttökuntoon saatettu liuos, jonka pitoisuus on 1 mg/mlvoidaan edelleen laimentaa steriilillä injektionesteisiin käytettävällä natriumkloridiliuoksella 9 mg/ml (0,9 %) siten, että pitoisuus on vähintään 0,2 mg/ml, koska käyttökuntoon saatetun liuoksen samentumista ei voida poissulkea. Käyttökuntoon saatetun liuoksen, jonka pitoisuus on 1 mg/ml edelleen laimentamista steriilillä injektionesteisiin käytettävällä vedellä tai hiilihydraattipitoisten infuusioliuosten, kuten esim. glukoosiliuoksen, käyttöä ei suositella, koska käyttökuntoon saatetun liuoksen sameus lisääntyy. Actilyse-infuusionestettä ei saa sekoittaa muiden lääkevalmisteiden kanssa samaan infuusiopulloon (ei edes hepariinin kanssa).
Yhteensopimattomuudet, ks. kohta Yhteensopimattomuudet.
Käyttökuntoon saatettu liuos on tarkoitettu kertakäyttöön. Käyttämätön liuos tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Ohjeet Actilyse-valmisteen käyttökuntoon saattamiseen
| 1 | Saata käyttökuntoon juuri ennen lääkkeen antamista. |  |
| 2 | Poista muovinen repäisysuojus molemmista injektiopulloista, joista toinen sisältää liuotinta (steriiliä vettä) ja toinen Actilyse -kuiva-ainetta. Suojus poistetaan kääntämällä sitä ylöspäin peukalon avulla. | 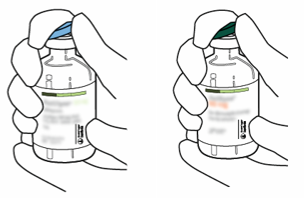 |
| 3 | Pyyhi kummankin injektiopullon kumitulpan pinta alkoholipyyhkeellä. | 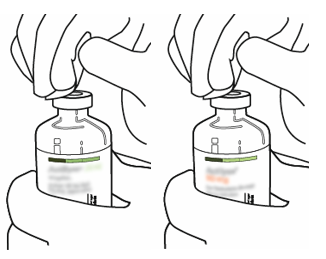 |
| 4 | Poista siirtokanyyli* pakkauksestaan. Älä desinfioi tai steriloi siirtokanyylia; se on steriili. Irrota toinen suojuksista. | 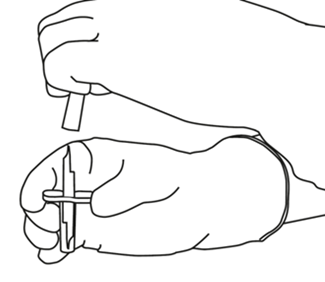 |
| 5 | Aseta liuotinta sisältävä injektiopullo pystyasennossa vakaalle alustalle. Lävistä pullon kumitulppa siirtokanyylilla suoraan ylhäältä kohtisuorassa kulmassa keskeltä tulppaa. Paina kevyesti mutta vakaasti, älä kierrä. | 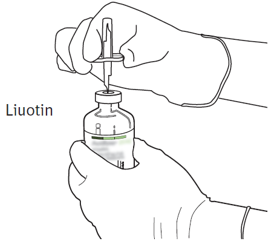 |
| 6 | Pidä liuotinta sisältävä injektiopullo ja siirtokanyyli paikoillaan yhdellä kädellä käyttäen apuna siirtokanyylin kahta siivekettä.
Irrota toinenkin siirtokanyylin päällä oleva suojus. | 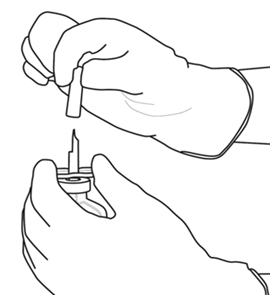 |
| 7 | Pidä liuotinta sisältävä injektiopullo ja siirtokanyyli paikoillaan yhdellä kädellä käyttäen apuna kahta siivekettä.
Pidä Actilyse-kuiva-ainetta sisältävä injektiopullo kohtisuorassa siirtokanyylin yläpuolella ja aseta siirtokanyylin kärki aivan kumitulpan keskelle.
Paina kuiva-ainetta sisältävä injektiopullo alas siirtokanyylin päälle kohtisuorassa kulmassa ylhäältä päin niin, että siirtokanyyli lävistää kumitulpan. Paina kevyesti mutta vakaasti, älä kierrä.
| 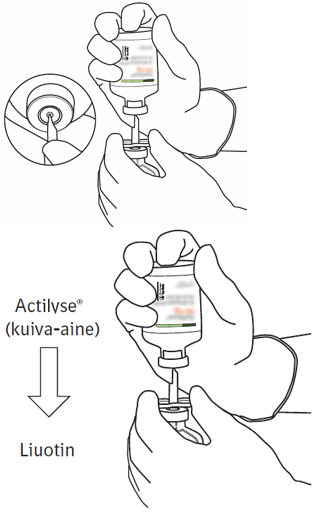 |
| 8 | Käännä injektiopullot ylösalaisin ja anna liuottimen valua kokonaan kuiva-aineen sekaan. | 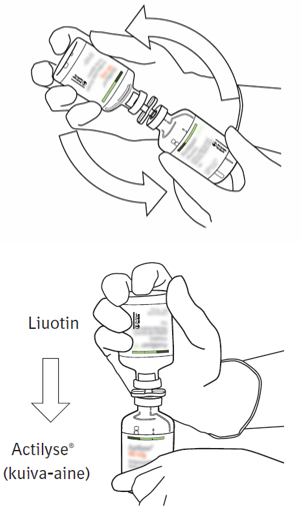 |
| 9 | Irrota tyhjä liuotinpullo yhdessä siirtokanyylin kanssa.
Ne voidaan hävittää. | 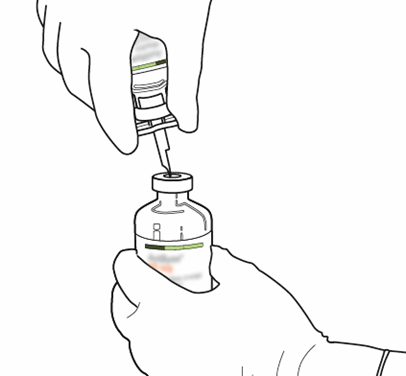 |
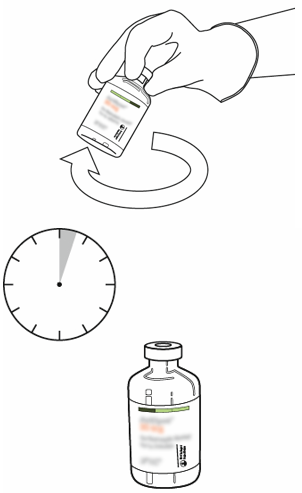
| 10 | Ota käyttökuntoon saatettua Actilyse-infuusionestettä sisältävä injektiopullo ja pyörittele sitä kevyesti, jotta kaikki kuiva-aine liukenee. Älä ravista, jotta liuos ei vaahtoudu.
Jos liuoksessa on kuplia, anna sen olla paikoillaan muutaman minuutin ajan, jotta kuplat katoavat.
|  |
| 11 | Käyttökuntoon saatettu liuos sisältää 1 mg/ml alteplaasia. Liuoksen tulee olla kirkasta ja väritöntä tai vaaleankeltaista, eikä se saa sisältää minkäänlaisia partikkeleita. | |
| 12 | Ota tarvittava määrä liuosta käyttämällä vain neulaa ja ruiskua. Älä käytä siirtokanyylin tekemää lävistyskohtaa vuotamisen välttämiseksi. | 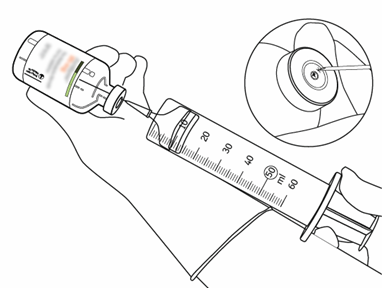 |
| 13 | Käytä välittömästi. Hävitä käyttämätön liuos. | |
(*jos siirtokanyyli kuuluu pakkaukseen. Käyttökuntoon saattamisen voi suorittaa myös neulaa ja ruiskua käyttäen.)
Korvattavuus
ACTILYSE injektio-/infuusiokuiva-aine ja liuotin, liuosta varten
20 mg 20 mg
50 mg 50 mg
- Ei korvausta.
ATC-koodi
B01AD02
Valmisteyhteenvedon muuttamispäivämäärä
13.02.2024
Yhteystiedot
 BOEHRINGER INGELHEIM FINLAND KY
BOEHRINGER INGELHEIM FINLAND KY Tammasaarenkatu 5
00180 Helsinki
010 310 2800
www.boehringer-ingelheim.fi
medinfo.finland@boehringer-ingelheim.com
