COSENTYX injektioneste, liuos, esitäytetty kynä 150 mg, 300 mg, injektioneste, liuos, esitäytetty ruisku 150 mg
Vaikuttavat aineet ja niiden määrät
Cosentyx 150 mg injektioneste, liuos, esitäytetty ruisku
Yksi esitäytetty ruisku sisältää 150 mg sekukinumabia 1 ml:ssa.
Cosentyx 300 mg injektioneste, liuos, esitäytetty ruisku
Yksi esitäytetty ruisku sisältää 300 mg sekukinumabia 2 ml:ssa.
Cosentyx 150 mg injektioneste, liuos, esitäytetty kynä
Yksi esitäytetty kynä sisältää 150 mg sekukinumabia 1 ml:ssa.
Cosentyx 300 mg injektioneste, liuos, esitäytetty kynä
Yksi esitäytetty kynä sisältää 300 mg sekukinumabia 2 ml:ssa.
Sekukinumabi on yhdistelmä-DNA-tekniikalla valmistettu ihmisen monoklonaalinen vasta-aine, joka on tuotettu kiinanhamsterin munasarjasoluissa (CHO).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, liuos (injektioneste)
Kliiniset tiedot
Käyttöaiheet
Läiskäpsoriaasi aikuisilla
Cosentyx on tarkoitettu keskivaikean tai vaikean läiskäpsoriaasin hoitoon aikuisille, joille harkitaan systeemistä hoitoa.
Läiskäpsoriaasi pediatrisilla potilailla
Cosentyx on tarkoitettu keskivaikean tai vaikean läiskäpsoriaasin hoitoon vähintään 6-vuotiaille lapsille ja nuorille, joille harkitaan systeemistä hoitoa.
Hidradenitis suppurativa (HS‑tauti)
Cosentyx on tarkoitettu keskivaikean tai vaikean aktiivisen hidradenitis suppurativan (märkivän hikirauhastulehduksen, taiveaknen) hoitoon aikuisille, jotka eivät ole saaneet riittävää vastetta tavanomaiselle systeemiselle HS‑hoidolle (ks. kohta Farmakodynamiikka).
Nivelpsoriaasi
Cosentyx on tarkoitettu yksinään tai yhdistelmänä metotreksaatin kanssa aktiivisen nivelpsoriaasin hoitoon aikuispotilaille, jotka eivät ole saaneet riittävää vastetta aiemmalle hoidolle sairauden kulkua muuttavalla reumalääkkeellä (DMARD) (ks. kohta Farmakodynamiikka).
Aksiaalinen spondylartriitti (axSpA)
Selkärankareuma (AS, radiografinen aksiaalinen spondylartriitti)
Cosentyx on tarkoitettu aktiivisen selkärankareuman hoitoon aikuisille, jotka eivät ole saaneet riittävää vastetta tavanomaiselle hoidolle.
Non-radiografinen aksiaalinen spondylartriitti (nr-axSpA)
Cosentyx on tarkoitettu aktiivisen non-radiografisen aksiaalisen spondylartriitin hoitoon aikuisilla, joilla on objektiivisia tulehduksen merkkejä eli kohonnut C‑reaktiivisen proteiinin (CRP) pitoisuus ja/tai magneettikuvauksessa todettavaa näyttöä tulehduksesta ja joille tulehduskipulääkkeillä ei ole saatu riittävää vastetta.
Juveniili idiopaattinen artriitti (JIA)
Entesiitteihin liittyvä artriitti (ERA)
Cosentyx on tarkoitettu käytettäväksi yksinään tai yhdessä metotreksaatin kanssa aktiivisen entesiitteihin liittyvän artriitin hoitoon vähintään 6-vuotiaille potilaille, joilla tavanomainen hoito on tuottanut riittämättömän vasteen tai ollut huonosti siedetty (ks. kohta Farmakodynamiikka).
Juveniili nivelpsoriaasi (JPsA)
Cosentyx on tarkoitettu käytettäväksi yksinään tai yhdessä metotreksaatin kanssa aktiivisen juveniilin nivelpsoriaasin hoitoon vähintään 6-vuotiaille potilaille, joilla tavanomainen hoito on tuottanut riittämättömän vasteen tai ollut huonosti siedetty (ks. kohta Farmakodynamiikka).
Ehto
Valmiste on tarkoitettu käytettäväksi käyttöaiheessa mainitun sairauden diagnosointiin ja hoitoon perehtyneen lääkärin ohjauksessa ja seurannassa.
Annostus ja antotapa
Cosentyx on tarkoitettu käytettäväksi käyttöaiheidensa mukaisten sairauksien diagnosointiin ja hoitoon perehtyneen lääkärin ohjauksessa ja seurannassa.
Annostus
Läiskäpsoriaasi aikuisilla
Suositeltu annos on 300 mg sekukinumabia injektiona ihon alle aluksi viikoilla 0, 1, 2, 3 ja 4. Tämän jälkeen injektio annetaan kerran kuukaudessa ylläpitohoitona. Kliinisen vasteen perusteella 300 mg:n ylläpitoannos 2 viikon välein voi tuottaa lisähyötyä 90 kg ja sitä painavammille potilaille. Kukin 300 mg:n annos annetaan yhtenä 300 mg:n injektiona ihon alle tai kahtena 150 mg:n injektiona ihon alle.
Läiskäpsoriaasi pediatrisilla potilailla (vähintään 6-vuotiaat lapset ja nuoret)
Suositeltu annos perustuu painoon (taulukko 1) ja annetaan injektiona ihon alle aluksi viikoilla 0, 1, 2, 3 ja 4. Tämän jälkeen injektio annetaan kerran kuukaudessa ylläpitohoitona. Kukin 75 mg:n annos annetaan yhtenä 75 mg:n injektiona ihon alle. Kukin 150 mg:n annos annetaan yhtenä 150 mg:n injektiona ihon alle. Kukin 300 mg:n annos annetaan yhtenä 300 mg:n injektiona ihon alle tai kahtena 150 mg:n injektiona ihon alle.
Taulukko 1 Suositeltu annos pediatristen potilaiden läiskäpsoriaasin hoitoon
Paino annosteluajankohtana | Suositeltu annos |
< 25 kg | 75 mg |
25 – < 50 kg | 75 mg |
≥ 50 kg | 150 mg (*voidaan suurentaa 300 mg:aan) |
*Osa potilaista voi saada lisähyötyä suuremmasta annoksesta.
150 mg ja 300 mg injektioneste, liuos, esitäytetty ruisku ‑valmistetta ja esitäytetty kynä -valmistetta ei ole tarkoitettu annettavaksi < 50 kg painaville pediatrisille potilaille. Cosentyx voi olla saatavilla eri vahvuuksina ja/tai lääkemuotoina yksilöllisestä hoitotarkoituksesta riippuen.
Hidradenitis suppurativa (HS‑tauti)
Suositeltu annos on 300 mg sekukinumabia injektiona ihon alle aluksi viikoilla 0, 1, 2, 3 ja 4. Tämän jälkeen injektio annetaan kerran kuukaudessa ylläpitohoitona. Kliinisen vasteen perusteella ylläpitoannos voidaan nostaa 300 milligrammaan 2 viikon välein. Kukin 300 mg:n annos annetaan yhtenä 300 mg:n injektiona ihon alle tai kahtena 150 mg:n injektiona ihon alle.
Nivelpsoriaasi
Jos potilaalla on samanaikaisesti keskivaikea tai vaikea läiskäpsoriaasi, ks. aikuisten läiskäpsoriaasia koskeva suositus.
Suositeltu annos potilaille, jotka eivät ole saaneet riittävää vastetta TNFα-salpaajahoitoon, on 300 mg injektiona ihon alle aluksi viikoilla 0, 1, 2, 3 ja 4. Tämän jälkeen injektio annetaan kerran kuukaudessa ylläpitohoitona. Kukin 300 mg:n annos annetaan yhtenä 300 mg:n injektiona ihon alle tai kahtena 150 mg:n injektiona ihon alle.
Muille potilaille suositeltu annos on 150 mg injektiona ihon alle aluksi viikoilla 0, 1, 2, 3 ja 4. Tämän jälkeen injektio annetaan kerran kuukaudessa ylläpitohoitona. Kliinisestä vasteesta riippuen annos voidaan nostaa 300 mg:aan.
Aksiaalinen spondylartriitti (axSpA)
Selkärankareuma (AS, radiografinen aksiaalinen spondylartriitti)
Suositeltu annos on 150 mg injektiona ihon alle aluksi viikoilla 0, 1, 2, 3 ja 4. Tämän jälkeen injektio annetaan kerran kuukaudessa ylläpitohoitona. Kliinisestä vasteesta riippuen annos voidaan nostaa 300 mg:aan. Jokainen 300 mg:n annos annetaan yhtenä 300 mg:n injektiona ihon alle tai kahtena 150 mg:n injektiona ihon alle.
Non-radiografinen aksiaalinen spondylartriitti (nr-axSpA)
Suositeltu annos on 150 mg injektiona ihon alle aluksi viikoilla 0, 1, 2, 3 ja 4. Tämän jälkeen injektio annetaan kerran kuukaudessa ylläpitohoitona.
Juveniili idiopaattinen artriitti (JIA)
Entesiitteihin liittyvä artriitti (ERA) ja juveniili nivelpsoriaasi (JPsA)
Suositeltu annos perustuu painoon (taulukko 2) ja annetaan injektiona ihon alle viikoilla 0, 1, 2, 3 ja 4. Tämän jälkeen injektio annetaan kerran kuukaudessa ylläpitohoitona. Kukin 75 mg:n annos annetaan yhtenä 75 mg:n injektiona ihon alle. Kukin 150 mg:n annos annetaan yhtenä 150 mg:n injektiona ihon alle.
Taulukko 2 Suositeltu annos idiopaattisen juveniilin artriitin hoitoon
Paino annosteluajankohtana | Suositeltu annos |
< 50 kg | 75 mg |
≥ 50 kg | 150 mg |
150 mg ja 300 mg injektioneste, liuos, esitäytetty ruisku ‑valmistetta ja esitäytetty kynä -valmistetta ei ole tarkoitettu annettavaksi < 50 kg painaville pediatrisille potilaille. Cosentyx voi olla saatavilla eri vahvuuksina ja/tai lääkemuotoina yksilöllisestä hoitotarkoituksesta riippuen.
Kaikkien edellä mainittujen käyttöaiheiden kohdalla saatavilla olevat tiedot viittaavat siihen, että kliininen vaste saavutetaan tavallisesti 16 viikon kuluessa hoidon aloittamisesta. Hoidon lopettamista on harkittava, jos potilas ei ole saanut vastetta 16 viikon hoidon aikana. Osalla potilaista aluksi saatu osittainen vaste saattaa myöhemmin parantua, kun hoitoa jatketaan yli 16 viikon ajan.
Erityisryhmät
Iäkkäät potilaat (vähintään 65-vuotiaat)
Annoksen muuttaminen ei ole tarpeen (ks. kohta Farmakokinetiikka).
Munuaisten/maksan vajaatoiminta
Cosentyx-valmistetta ei ole tutkittu näissä potilasryhmissä. Annossuosituksia ei voida tehdä.
Pediatriset potilaat
Cosentyx-valmisteen turvallisuutta ja tehoa alle 6 vuoden ikäisten lasten läiskäpsoriaasin ja juveniilin idiopaattisen artriitin (alatyypit ”entesiitteihin liittyvä artriitti” ja ”juveniili nivelpsoriaasi”) hoidossa ei ole varmistettu.
Cosentyx-valmisteen turvallisuutta ja tehoa alle 18 vuoden ikäisten lasten muiden käyttöaiheiden hoidossa ei ole vielä varmistettu. Tietoja ei ole saatavilla.
Antotapa
Cosentyx annetaan injektiona ihon alle. Jos mahdollista, pistoskohdaksi ei tule valita ihoaluetta, jossa on psoriaasia. Esitäytettyä ruiskua tai kynää ei saa ravistaa.
Jos lääkäri katsoo sen asianmukaiseksi, potilas itse tai huoltaja voi pistää Cosentyx-annoksen, kun häntä on neuvottu oikeasta ihon alle pistämisen tekniikasta. Lääkärin tulee kuitenkin varmistaa potilaan asianmukainen seuranta. Potilaita tai huoltajia on neuvottava pistämään koko Cosentyx-injektionestemäärä pakkausselosteen ohjeiden mukaisesti. Tarkat ohjeet valmisteen antoon on kerrottu pakkausselosteessa.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Kliinisesti merkittävä aktiivinen infektio, esim. aktiivinen tuberkuloosi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Infektiot
Sekukinumabi saattaa lisätä infektioiden riskiä. Markkinoille tulon jälkeen sekukinumabia saaneilla potilailla on todettu vakavia infektioita. Varovaisuutta on noudatettava, kun harkitaan sekukinumabin käyttöä potilaille, joilla on krooninen infektio tai joilla on ollut toistuvia infektioita.
Potilaita on neuvottava hakeutumaan lääkärin hoitoon, jos infektion oireita tai merkkejä ilmenee. Jos potilaalle kehittyy vakava infektio, häntä on seurattava huolellisesti eikä sekukinumabia saa antaa ennen kuin infektio on parantunut.
Kliinisissä tutkimuksissa sekukinumabia saaneilla potilailla on havaittu infektioita (ks. kohta Haittavaikutukset). Useimmat infektiot olivat lieviä tai keskivaikeita ylähengitystieinfektioita, kuten nenän ja nielun tulehduksia, eivätkä ne vaatineet hoidon keskeyttämistä.
Kliinisissä psoriaasitutkimuksissa sekukinumabin vaikutusmekanismiin liittyviä ei-vakavia mukokutaanisia kandidiaasi-infektioita ilmoitettiin useammin sekukinumabiryhmässä (3,55 infektiota 100 potilasvuotta kohti 300 mg sekukinumabia saaneilla) kuin lumelääkeryhmässä (1,00 infektiota 100 potilasvuotta kohti) (ks. kohta Haittavaikutukset).
Tuberkuloosi
Tuberkuloosia (aktiivista infektiota ja/tai latenttia uudelleen aktivoitumista) on ilmoitettu sekukinumabilla hoidettavilla potilailla. Potilaat on tutkittava tuberkuloosi-infektion varalta ennen sekukinumabihoidon aloittamista. Sekukinumabia ei saa antaa potilaille, joilla on aktiivinen tuberkuloosi (ks. kohta Vasta-aiheet). Potilaille, joilla on latentti tuberkuloosi, on harkittava tuberkuloosilääkitystä hoitosuositusten mukaisesti ennen sekukinumabin aloittamista. Sekukinumabia saavia potilaita on seurattava aktiivisen tuberkuloosin oireiden ja löydösten varalta.
Tulehdukselliset suolistosairaudet (mukaan lukien Crohnin tauti ja haavainen paksusuolitulehdus)
Tulehduksellisten suolistosairauksien puhkeamista tai pahenemista on raportoitu sekukinumabihoidon aikana (ks. kohta Haittavaikutukset). Sekukinumabia ei suositella potilaille, joilla on tulehduksellisia suolistosairauksia. Jos potilaalla ilmenee tulehduksellisen suolistosairauden oireita tai merkkejä tai havaitaan olemassa olevan tulehduksellisen suolistosairauden pahenemista, tulee sekukinumabihoito lopettaa ja aloittaa asianmukainen lääkehoito.
Yliherkkyysreaktiot
Sekukinumabia saaneilla potilailla on todettu harvinaisina tapauksina anafylaktisia reaktioita ja angioedemaa. Jos potilaalla ilmenee anafylaktinen reaktio, angioedeema tai muita vakavia allergisia reaktioita, sekukinumabin antaminen on keskeytettävä välittömästi ja on aloitettava asianmukainen hoito.
Lateksille herkät henkilöt – koskee vain Cosentyx 150 mg injektionestettä esitäytetyssä ruiskussa ja 150 mg injektionestettä esitäytetyssä kynässä
Esitäytetyn Cosentyx 150 mg ruiskun ja kynän irrotettava neulansuojus sisältää luonnonkumin (lateksin) johdannaista. Irrotettavassa neulansuojuksessa ei ole toistaiseksi havaittu luonnonkumia (lateksia). Esitäytetyn Cosentyx 150 mg ruiskun ja kynän käyttöä lateksille herkille henkilöille ei ole tutkittu ja tästä syystä mahdollisten yliherkkyysreaktioiden riskiä ei voida täysin sulkea pois.
Rokotukset
Eläviä rokotteita ei saa antaa sekukinumabi-hoidon aikana.
Sekukinumabia saaville potilaille voidaan antaa inaktivoituja tai muita kuin eläviä rokotteita. Kun terveille vapaehtoisille annettiin tutkimuksessa meningokokki- ja inaktivoitu influenssarokotus, sekukinumabia 150 mg saaneiden ryhmässä ja lumelääkeryhmässä niiden koehenkilöiden osuus, joille kehittyi riittävä immuunivaste, oli samansuuruinen. Riittävä immuunivaste meningokokki- ja influenssarokotteelle määriteltiin vasta-ainetiitterien suurenemiseksi vähintään nelinkertaisiksi. Tiedot viittaavat siihen, että sekukinumabi ei heikennä humoraalista immuunivastetta meningokokki- ja influenssarokotteille.
On suositeltavaa, että pediatriset potilaat saavat kaikki iänmukaiset, ajankohtaisten rokotussuositusten mukaiset rokotukset ennen Cosentyx-hoidon aloittamista.
Samanaikainen immunosuppressiivinen hoito
Psoriaasitutkimuksissa ei ole arvioitu sekukinumabin turvallisuutta ja tehoa, kun sitä käytetään samanaikaisesti immunosuppressiivisten lääkkeiden, kuten biologisten lääkkeiden, tai valohoidon kanssa. Artriittitutkimuksissa (joihin osallistui myös psoriaasiartriittia ja selkärankareumaa sairastavia potilaita) sekukinumabia on annettu samanaikaisesti metotreksaatin (MTX), sulfasalatsiinin ja/tai kortikosteroidien kanssa. Varovaisuutta on noudatettava harkittaessa muiden immunosuppressiivisten lääkkeiden ja sekukinumabin samanaikaista käyttöä (ks. myös kohta Yhteisvaikutukset).
Hepatiitti B:n uudelleenaktivoituminen
Hepatiitti B -virus (HBV) saattaa uudelleenaktivoitua sekukinumabihoitoa saavilla potilailla. Immunosuppressantteja koskevien hoitosuositusten mukaisesti potilaiden testaamista HBV-infektion varalta on harkittava ennen sekukinumabihoidon aloittamista. Potilaita, joilla on positiivinen HBV-serologiatulos, on seurattava HBV:n uudelleenaktivoitumisen kliinisten ja laboratoriolöydösten ilmaantumisen varalta sekukinumabihoidon aikana. Jos HBV aktivoituu uudelleen sekukinumabihoidon aikana, hoidon lopettamista on harkittava ja potilaille on annettava hoitosuositusten mukaista hoitoa.
Yhteisvaikutukset
Eläviä rokotteita ei saa antaa sekukinumabi-hoidon aikana (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet).
Yhteisvaikutuksia ei havaittu sekukinumabilla ja midatsolaamilla (CYP3A4-substraatti) tutkimuksessa, jossa aikuispotilailla oli läiskäpsoriaasi.
Niveltulehdusta koskevissa tutkimuksissa (joihin osallistui nivelpsoriaasia ja aksiaalista spondylartriittia sairastavia potilaita) ei todettu yhteisvaikutuksia, kun sekukinumabia annettiin samanaikaisesti metotreksaatin ja/tai kortikosteroidien kanssa.
Raskaus ja imetys
Hedelmällisessä iässä olevat naiset
Naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä hoidon aikana ja vähintään 20 viikkoa hoidon päättymisen jälkeen.
Raskaus
Ei ole riittävästi tietoa sekukinumabin käytöstä raskaana oleville naisille.
Eläinkokeissa ei ole havaittu suoria tai epäsuoria lisääntymistoksisia vaikutuksia (ks. kohta Prekliiniset tiedot turvallisuudesta). Varmuuden vuoksi sekukinumabin käyttöä on suositeltavaa välttää raskauden aikana.
Imetys
Ei tiedetä, erittyykö sekukinumabi ihmisen rintamaitoon. Immunoglobuliinit erittyvät ihmisen rintamaitoon eikä ole tiedossa imeytyykö sekukinumabi systeemisesti rintaruokinnassa. Koska sekukinumabi saattaa aiheuttaa haittavaikutuksia imetettävälle lapselle, on päätettävä lopetetaanko rintaruokinta hoidon ajaksi ja vähintään 20 viikon ajaksi hoidon päättymisen jälkeen vai lopetetaanko Cosentyx-hoito ottaen huomioon rintaruokinnasta aiheutuvat hyödyt lapselle ja hoidosta koituvat hyödyt äidille.
Hedelmällisyys
Sekukinumabin mahdollista vaikutusta ihmisen hedelmällisyyteen ei ole tutkittu. Eläinkokeissa ei ole havaittu suoria tai epäsuoria haitallisia vaikutuksia hedelmällisyyteen.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Cosentyx-valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisimmin ilmoitettuja haittavaikutuksia ovat ylähengitystieinfektiot (17,1 %) (yleisimmin nenän ja nielun tulehdus ja nuha).
Haittavaikutustaulukko
Kliinisissä tutkimuksissa ja markkinoille tulon jälkeen raportoidut haittavaikutukset (taulukko 3) on lueteltu MedDRA-elinjärjestelmäluokituksen mukaisesti. Kunkin elinjärjestelmäluokan haittavaikutukset on järjestetty yleisyysjärjestykseen yleisimmästä alkaen. Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä. Lisäksi haittavaikutukset on luokiteltu esiintymistiheyden mukaan seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000) ja hyvin harvinainen (< 1/10 000); ja tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Eri käyttöaiheita (läiskäpsoriaasi, nivelpsoriaasi, aksiaalinen spondylartriitti, hidradenitis suppurativa [HS‑tauti] ja muut autoimmuunisairaudet) koskevissa sokkoutetuissa ja avoimissa kliinisissä tutkimuksissa sekukinumabi-hoitoa on saanut yli 20 000 potilasta, mikä vastaa 34 908 potilasvuoden altistusta. Näistä potilaista yli 14 000 sai sekukinumabi-hoitoa vähintään yhden vuoden ajan. Sekukinumabin turvallisuusprofiili on yhdenmukainen kaikissa indikaatioissa.
Taulukko 3 Luettelo kliinisissä tutkimuksissa ja markkinoille tulon jälkeen todetuista haittavaikutuksista1)
| Elinjärjestelmä | Esiintymistiheys | Haittavaikutus |
| Infektiot | Hyvin yleinen | Ylähengitystieinfektiot |
| Yleinen | Huuliherpes | |
| Melko harvinainen | Suun kandidiaasi | |
| Korvakäytävätulehdus | ||
| Alahengitysteiden infektiot | ||
| Jalkasilsa | ||
| Tuntematon | Limakalvojen ja ihon kandidiaasi (mukaan lukien ruokatorven kandidiaasi) | |
| Veri ja imukudos | Melko harvinainen | Neutropenia |
| Immuunijärjestelmä | Harvinainen | Anafylaktiset reaktiot |
| Angioedeema | ||
| Hermosto | Yleinen | Päänsärky |
| Silmät | Melko harvinainen | Sidekalvotulehdus |
| Hengityselimet, rintakehä ja välikarsina | Yleinen | Vetinen nuha |
| Ruoansulatuselimistö | Yleinen | Ripuli |
| Pahoinvointi | ||
| Melko harvinainen | Tulehduksellinen suolistosairaus (IBD) | |
| Iho ja ihonalainen kudos | Yleinen | Ekseema |
| Melko harvinainen | Urtikaria | |
| Dyshidroottinen ekseema | ||
| Harvinainen | Kesivä ihottuma2) | |
| Allerginen verisuonitulehdus | ||
| Tuntematon | Haavautuva ihotulehdus (pyoderma gangraenosum) | |
| Yleisoireet ja antopaikassa todettavat haitat | Yleinen | Väsymys |
1) Lumelääkekontrolloidut kliiniset tutkimukset (vaihe III) läiskäpsoriaasi‑, nivelpsoriaasi-, selkärankareuma-, nr-axSpA- ja hidradenitis suppurativa ‑potilailla, jotka saivat 300 mg:n, 150 mg:n tai 75 mg:n annosta tai lumelääkettä enintään 12 viikkoa jatkuneen (psoriaasin) hoidon ajan tai 16 viikkoa jatkuneen (nivelpsoriaasin, selkärankareuman, non-radiografisen aksiaalisen spondylartriitin tai hidradenitis suppurativan) hoidon ajan 2) Tapauksia on raportoitu psoriaasipotilailla | ||
Valikoitujen haittavaikutusten kuvaus
Infektiot
Läiskäpsoriaasipotilailla tehtyjen kliinisten tutkimusten lumelääkekontrolloidussa vaiheessa (yhteensä 1 382 potilasta, jotka saivat sekukinumabi-hoitoa, ja 694 potilasta, jotka saivat lumelääkettä, enintään 12 viikon ajan) infektioita ilmoitettiin 28,7 %:lla sekukinumabi-hoitoa saaneista ja 18,9 %:lla lumelääkettä saaneista potilaista. Useimmat infektiot olivat ei-vakavia ja vaikeusasteeltaan lieviä tai keskivaikeita ylähengitystieinfektioita, kuten nenän ja nielun tulehduksia, eivätkä ne vaatineet hoidon keskeyttämistä. Limakalvojen tai ihon kandidiaasin esiintyvyys suureni, kuten vaikutusmekanismin perusteella oli odotettavissa, mutta tapaukset olivat vaikeusasteeltaan lieviä tai keskivaikeita, ei-vakavia, reagoivat vakiintuneeseen hoitoon eikä hoitoa tarvinnut keskeyttää niiden vuoksi. Vakavia infektioita ilmeni 0,14 %:lla sekukinumabi-hoitoa ja 0,3 %:lla lumelääkettä saaneista potilaista (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Koko hoitojakson aikana (yhteensä 3 430 potilasta, jotka saivat sekukinumabi-hoitoa ja joista suurin osa sai hoitoa enintään 52 viikon ajan) infektioita ilmoitettiin 47,5 %:lla sekukinumabi-hoitoa saaneista (seurannassa 0,9 potilasvuotta kohti). Vakavia infektioita ilmoitettiin 1,2 %:lla sekukinumabi-hoitoa saaneista potilaista (seurannassa 0,015 potilasvuotta kohti).
Infektioita havaittiin kliinisissä nivelpsoriaasitutkimuksissa ja aksiaalisen spondylartriitin (selkärankareuman ja non-radiografisen aksiaalisen spondylartriitin) kliinisissä tutkimuksissa saman verran kuin psoriaasitutkimuksissa.
Potilaat, joilla on hidradenitis suppurativa, ovat alttiimpia infektioille. Hidradenitis suppurativaa sairastavilla potilailla tehtyjen kliinisten tutkimusten lumelääkekontrolloidussa vaiheessa (yhteensä 721 potilasta, jotka saivat sekukinumabi-hoitoa, ja 363 potilasta, jotka saivat lumelääkettä, enintään 16 viikon ajan) infektioita esiintyi lukumääräisesti enemmän kuin psoriaasitutkimuksissa (30,7 %:lla sekukinumabi-hoitoa saaneista vs. 31,7 %:lla lumelääkettä saaneista potilaista). Useimmat infektiot eivät olleet vakavia vaan vaikeusasteeltaan lieviä tai keskivaikeita eivätkä vaatineet hoidon lopettamista tai keskeyttämistä.
Neutropenia
Kliinisissä vaiheen III psoriaasitutkimuksissa neutropeniaa todettiin useammin sekukinumabi- kuin lumelääkeryhmässä, mutta useimmat tapaukset olivat lieviä, ohimeneviä ja palautuvia. Neutropeniaa, jossa arvo oli < 1,0⎼0,5 x 109/l (CTCAE-luokka 3), ilmoitettiin 18:lla potilaalla 3 430:stä (0,5 %) sekukinumabia saaneesta potilaasta, mutta 15:ssä tapauksessa 18:sta ei havaittu korrelaatiota sekukinumabi-annokseen tai infektioiden esiintymisen ajankohtaan. Vakavampia neutropeniatapauksia ei havaittu. Muut kolme tapausta olivat ei-vakavia infektioita, jotka reagoivat vakiintuneeseen hoitoon, eivätkä edellyttäneet sekukinumabi-hoidon keskeyttämistä.
Neutropeniaa ilmeni nivelpsoriaasin, aksiaalisen spondylartriitin (selkärankareuman ja non-radiografisen aksiaalisen spondylartriitin) ja hidradenitis suppurativan yhteydessä saman verran kuin psoriaasin yhteydessä.
On raportoitu harvinaisia neutropeniatapauksia, joissa arvo on < 0,5 x 109/l (CTCAE-luokka 4).
Immunogeenisuus
Kliinisissä psoriaasi‑ ja nivelpsoriaasitutkimuksissa, aksiaalisen spondylartriitin (selkärankareuman ja non-radiografisen aksiaalisen spondylartriitin) ja hidradenitis suppurativan tutkimuksissa alle 1 % sekukinumabi-hoitoa saaneista potilaista kehitti vasta-aineita sekukinumabille enintään 52 viikkoa kestäneen hoidon aikana. Noin puolet hoidon aiheuttamista lääkeaineelle kehittyneistä vasta-aineista oli neutraloivia, mutta tätä ei voitu yhdistää tehon heikentymiseen tai farmakokineettisiin poikkeavuuksiin.
Pediatriset potilaat
Haittavaikutukset vähintään 6-vuotiailla pediatrisilla läiskäpsoriaasipotilailla
Sekukinumabin turvallisuutta arvioitiin kahdessa vaiheen III tutkimuksessa pediatrisilla läiskäpsoriaasipotilailla. Ensimmäinen tutkimus (pediatrinen tutkimus 1) oli kaksoissokkoutettu, lumekontrolloitu tutkimus 162:lla vaikeaa läiskäpsoriaasia sairastavalla potilaalla, jotka olivat iältään 6 – < 18 vuotta. Toinen tutkimus (pediatrinen tutkimus 2) oli avoin tutkimus 84:llä keskivaikeaa tai vaikeaa läiskäpsoriaasia sairastavalla potilaalla, jotka olivat iältään 6 – < 18 vuotta. Näiden kahden tutkimuksen tuottama turvallisuusprofiili oli yhdenmukainen aikuisten läiskäpsoriaasipotilaiden turvallisuusprofiilin kanssa.
Haittavaikutukset juveniilia idiopaattista artriittia sairastavilla pediatrisilla potilailla
Sekukinumabin turvallisuutta arvioitiin myös vaiheen III tutkimuksessa 86:lla potilaalla, jotka sairastivat juveniilia idiopaattista artriittia (entesiitteihin liittyvä artriitti tai juveniili nivelpsoriaasi) ja olivat iältään 2 – < 18 vuotta. Tämän tutkimuksen tuottama turvallisuusprofiili oli yhdenmukainen aikuispotilaiden turvallisuusprofiilin kanssa.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Kliinisissä tutkimuksissa annettiin jopa 30 mg/kg:n annoksia (noin 2 000‑3 000 mg) laskimoon ilman annosta rajoittavaa toksisuutta. Yliannostustapauksissa suositellaan potilaan tarkkailua haittavaikutusten oireiden tai merkkien varalta ja sopivan oireenmukaisen hoidon antamista välittömästi.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: immunosuppressantit, interleukiinin estäjät, ATC-koodi: L04AC10
Vaikutusmekanismi
Sekukinumabi on ihmisen monoklonaalinen IgG1/κ-vasta-aine, joka sitoutuu selektiivisesti tulehdusta aiheuttavaan sytokiiniin interleukiini 17A:han (IL‑17A) neutraloiden sen. Sekukinumabi vaikuttaa sitoutumalla IL‑17A:han ja estämällä sen kiinnittymisen IL‑17-reseptoriin, joka ilmentyy erilaisissa solutyypeissä, kuten keratinosyyteissä. Tämän seurauksena sekukinumabi estää tulehdusta aiheuttavien sytokiinien, kemokiinien ja kudosvaurion välittäjäaineiden vapautumista ja vähentää IL‑17A-välitteistä vaikutusta autoimmuuni- ja tulehdussairauksiin. Kliinisesti merkitykselliset sekukinumabipitoisuudet saavuttavat ihon ja vähentävät paikallisia tulehdusmerkkiaineita. Sekukinumabihoidon suorana seurauksena läiskäpsoriaasileesioille tyypillinen punoitus, paksuus ja hilseily vähenevät.
IL‑17A on luontainen sytokiini, joka on osallisena normaalin tulehdus- ja immuunivasteen kehittymisessä. IL‑17A:lla on keskeinen tehtävä läiskäpsoriaasin, hidradenitis suppurativan, nivelpsoriaasin ja aksiaalisen spondylartriitin (selkärankareuman ja non-radiografisen aksiaalisen spondylartriitin) synnyssä. Sitä tuotetaan läiskäpsoriaasipotilaiden vaurioituneella iholla enemmän kuin terveellä iholla ja sitä muodostuu enemmän nivelpsoriaasipotilaiden synoviaalikudoksessa. IL‑17A:ta tuotetaan enemmän myös hidradenitis suppurativa leesioissa, ja tautia sairastavilla on todettu seerumin IL‑17A-pitoisuuden suurenemista. IL-17:ää tuottavia soluja oli myös huomattavasti enemmän selkärankareumapotilaiden fasettinivelten subkondraalisessa luuytimessä. Non-radiografista aksiaalista spondylartriittia sairastavilla potilailla on myös todettu suurentuneita määriä IL-17A-sytokiinia tuottavia lymfosyyttejä. IL-17A:n esto on osoittautunut tehokkaaksi selkärankareuman hoidossa, mikä vahvistaa, että tällä sytokiinilla on keskeinen merkitys aksiaalisessa spondylartriitissa.
Farmakodynaamiset vaikutukset
Alussa kokonais-IL‑17A:n (vapaan ja sekukinumabiin sitoutuneen IL‑17A:n) pitoisuus seerumissa suurenee potilailla, jotka saavat sekukinumabia. Tämän jälkeen pitoisuus pienenee hitaasti sekukinumabiin sitoutuneen IL‑17A:n vähentyneen puhdistuman seurauksena, mikä viittaa siihen, että sekukinumabi sitoo selektiivisesti vapaata IL‑17A:ta, jolla on keskeinen tehtävä läiskäpsoriaasin synnyssä.
Sekukinumabilla tehdyssä tutkimuksessa läiskäpsoriaasipotilaiden vaurioituneella iholla runsaina havaittavien infiltroivien epidermaalisten neutrofiilien ja erilaisten neutrofiileihin liittyvien merkkiaineiden määrä oli selvästi vähentynyt, kun hoitoa oli jatkettu yhden tai kahden viikon ajan.
Sekukinumabin on osoitettu pienentävän tulehduksen merkkiaineena toimivan C-reaktiivisen proteiinin pitoisuutta (1−2 viikon sisällä hoidosta).
Kliininen teho ja turvallisuus
Läiskäpsoriaasi aikuisilla
Sekukinumabin turvallisuutta ja tehoa arvioitiin neljässä satunnaistetussa, kaksoissokkoutetussa, lumelääkekontrolloidussa vaiheen III tutkimuksessa. Tutkimuksiin osallistui keskivaikeaa tai vaikeaa läiskäpsoriaasia sairastavia potilaita, joille harkittiin valohoitoa tai systeemistä hoitoa [ERASURE, FIXTURE, FEATURE, JUNCTURE]. Sekukinumabin 150 mg:n ja 300 mg:n annoksen tehoa verrattiin lumelääkkeeseen tai etanerseptiin. Lisäksi yhdessä tutkimuksessa verrattiin pitkäkestoista hoito-ohjelmaa hoito-ohjelmaan, jossa lääkehoito toistettiin tarpeen vaatiessa [SCULPTURE].
Lumelääkekontrolloituihin tutkimuksiin mukaan otetuista 2 403 potilaasta 79 % ei ollut aiemmin saanut hoitoa biologisilla lääkkeillä, 45 %:lla hoito muilla kuin biologisilla lääkkeillä ei ollut tehonnut ja 8 %:lla hoito biologisilla lääkkeillä ei ollut tehonnut (6 %:lla TNF-salpaajahoito ei ollut tehonnut ja 2 %:lla p40-salpaajahoito ei ollut tehonnut). Suunnilleen 15‑25 %:lla vaiheen III tutkimuksiin osallistuneista potilaista oli lähtötilanteessa nivelpsoriaasi.
Psoriaasitutkimuksessa 1 (ERASURE) arvioitiin 738 potilasta. Sekukinumabi-hoitoon satunnaistetut potilaat saivat joko 150 mg:n tai 300 mg:n annoksen viikolla 0, 1, 2, 3 ja 4 ja sen jälkeen samaa annosta kerran kuukaudessa. Psoriaasitutkimuksessa 2 (FIXTURE) arvioitiin 1 306 potilasta. Sekukinumabi-hoitoon satunnaistetut potilaat saivat joko 150 mg:n tai 300 mg:n annoksen viikolla 0, 1, 2, 3 ja 4 ja sen jälkeen samaa annosta kerran kuukaudessa. Etanerseptiryhmään satunnaistetut potilaat saivat 50 mg:n annoksen kahdesti viikossa 12 viikon ajan ja sen jälkeen 50 mg kerran viikossa. Sekä tutkimuksessa 1 että tutkimuksessa 2 lumelääkeryhmään satunnaistetut potilaat, jotka eivät olleet saaneet vastetta viikkoon 12 mennessä, siirrettiin saamaan sekukinumabia (joko 150 mg tai 300 mg) viikolla 12, 13, 14 ja 15 ja sen jälkeen samaa annosta kerran kuukaudessa viikosta 16 lähtien. Kaikkia potilaita seurattiin enintään 52 viikon ajan ensimmäisen tutkimuslääkeannoksen antamisen jälkeen.
Psoriaasitutkimuksessa 3 (FEATURE) arvioitiin esitäytetyllä ruiskulla itse 12 viikon ajan annetun sekukinumabin turvallisuutta, siedettävyyttä ja käytettävyyttä plaseboon nähden 177 potilaalla. Psoriaasitutkimuksessa 4 (JUNCTURE) arvioitiin esitäytetyllä kynällä itse 12 viikon ajan annetun sekukinumabin turvallisuutta, siedettävyyttä ja käytettävyyttä plaseboon nähden 182 potilaalla. Sekä tutkimuksessa 3 että tutkimuksessa 4 sekukinumabi-hoitoon satunnaistetut potilaat saivat joko 150 mg:n tai 300 mg:n annoksen viikolla 0, 1, 2, 3 ja 4 ja sen jälkeen samaa annosta kerran kuukaudessa. Osa potilaista satunnaistettiin myös saamaan lumelääkettä viikolla 0, 1, 2, 3 ja 4 ja sen jälkeen samaa annosta kerran kuukaudessa.
Psoriaasitutkimuksessa 5 (SCULPTURE) arvioitiin 966 potilasta. Kaikki potilaat saivat sekukinumabia 150 mg tai 300 mg viikolla 0, 1, 2, 3, 4, 8 ja 12 ja sen jälkeen heidät satunnaistettiin saamaan joko samansuuruista ylläpitoannosta kerran kuukaudessa viikosta 12 lähtien tai tarpeen vaatiessa toistettavaa hoitoa samalla annoksella. Tarpeen vaatiessa toteutettua hoitoa saaneiden ryhmään satunnaistettujen potilaiden vaste ei säilynyt riittävänä ja siksi suositellaan lääkkeen antoa säännöllisesti kerran kuukaudessa.
Lumelääke- ja aktiivikontrolloitujen tutkimusten rinnakkaisia ensisijaisia päätemuuttujia olivat niiden potilaiden osuus, jotka saavuttivat PASI 75 -vasteen ja IGA mod 2011 -asteikon mukaisen tuloksen oireeton tai lähes oireeton viikolla 12 verrattuna lumelääkkeeseen (ks. taulukot 4 ja 5). Kaikissa tutkimuksissa 300 mg:n annoksella saavutetut ihon parantumista koskeneet tulokset olivat paremmat erityisesti oireeton- tai lähes oireeton -tuloksen suhteen kaikkien tehoa mittaavien päätemuuttujien osalta, jotka olivat PASI 90, PASI 100 ja 0- tai 1-vaste IGA mod 2011-asteikolla, ja maksimivaikutus todettiin viikolla 16. Siksi suositellaan 300 mg:n annosta.
Taulukko 4 Yhteenveto kliinisistä vasteista PASI 50/75/90/100 ja IGA⃰ mod 2011 oireeton tai lähes oireeton psoriaasitutkimuksissa 1, 3 ja 4 (ERASURE, FEATURE ja JUNCTURE)
Viikko 12 | Viikko 16 | Viikko 52 | |||||
Lume lääke | 150 mg | 300 mg | 150 mg | 300 mg | 150 mg | 300 mg | |
Tutkimus 1 | |||||||
Potilaiden määrä | 246 | 244 | 245 | 244 | 245 | 244 | 245 |
PASI 50 -vaste, n (%) | 22 (8,9 %) | 203 (83,5 %) | 222 (90,6 %) | 212 (87,2 %) | 224 (91,4 %) | 187 (77 %) | 207 (84,5 %) |
PASI 75 -vaste, n (%) | 11 (4,5 %) | 174 (71,6 %)** | 200 (81,6 %)** | 188 (77,4 %) | 211 (86,1 %) | 146 (60,1 %) | 182 (74,3 %) |
PASI 90 -vaste, n (%) | 3 (1,2 %) | 95 (39,1 %)** | 145 (59,2 %)** | 130 (53,5 %) | 171 (69,8 %) | 88 (36,2 %) | 147 (60,0 %) |
PASI 100 -vaste, n (%) | 2 (0,8 %) | 31 (12,8 %) | 70 (28,6 %) | 51 (21,0 %) | 102 (41,6 %) | 49 (20,2 %) | 96 (39,2 %) |
IGA mod 2011 oireeton tai lähes oireeton -vaste, n (%) | 6 (2,40 %) | 125 (51,2 %)** | 160 (65,3 %)** | 142 (58,2 %) | 180 (73,5 %) | 101 (41,4 %) | 148 (60,4 %) |
Tutkimus 3 | |||||||
Potilaiden määrä | 59 | 59 | 58 | - | - | - | - |
PASI 50 -vaste, n (%) | 3 (5,1 %) | 51 (86,4 %) | 51 (87,9 %) | - | - | - | - |
PASI 75 -vaste, n (%) | 0 (0,0 %) | 41 (69,5 %)** | 44 (75,9 %)** | - | - | - | - |
PASI 90 -vaste, n (%) | 0 (0,0 %) | 27 (45,8 %) | 35 (60,3 %) | - | - | - | - |
PASI 100 -vaste, n (%) | 0 (0,0 %) | 5 (8,5 %) | 25 (43,1 %) | - | - | - | - |
IGA mod 2011 oireeton tai lähes oireeton -vaste, n (%) | 0 (0,0 %) | 31 (52,5 %)** | 40 (69,0 %)** | - | - | - | - |
Tutkimus 4 | |||||||
Potilaiden määrä | 61 | 60 | 60 | - | - | - | - |
PASI 50 -vaste, n (%) | 5 (8,2 %) | 48 (80,0 %) | 58 (96,7 %) | - | - | - | - |
PASI 75 -vaste, n (%) | 2 (3,3 %) | 43 (71,7 %)** | 52 (86,7 %)** | - | - | - | - |
PASI 90 -vaste, n (%) | 0 (0,0 %) | 24 (40,0 %) | 33 (55,0 %) | - | - | - | - |
PASI 100 -vaste, n (%) | 0 (0,0 %) | 10 (16,7 %) | 16 (26,7 %) | - | - | - | - |
IGA mod 2011 oireeton tai lähes oireeton -vaste, n (%) | 0 (0,0 %) | 32 (53,3 %)** | 44 (73,3 %)** | - | - | - | - |
* IGA mod 2011 on asteikko, joka muodostuu 5 kategoriasta, jotka ovat 0 = oireeton, 1 = lähes oireeton 2 = lievä, 3 = keskivaikea tai 4 = vaikea. Asteikko kuvaa lääkärin kokonaisarviota psoriaasin vaikeusasteesta ja arvioi erityisesti paksuutta, punoitusta ja hilseilyä. Hoidon onnistumisen aste oireeton tai lähes oireeton tarkoitti, ettei merkkejä psoriaasista ollut tai psoriaasileesioiden väri vaihteli normaalista vaaleanpunaiseen, läiskä ei ollut paksuuntunut ja pesäkkeiden hilseilyä ei ollut lainkaan tai sitä oli erittäin vähän. ** p-arvot lumelääkkeeseen nähden ja monivertailukorjatut p-arvot: p < 0,0001. | |||||||
Taulukko 5 Yhteenveto kliinisistä vasteista, psoriaasitutkimus 2 (FIXTURE)
Viikko 12 | Viikko 16 | Viikko 52 | ||||||||
Lumelääke | 150 mg | 300 mg | Etanersepti | 150 mg | 300 mg | Etanersepti | 150 mg | 300 mg | Etanersepti | |
Potilaiden määrä | 324 | 327 | 323 | 323 | 327 | 323 | 323 | 327 | 323 | 323 |
PASI 50 -vaste, n (%) | 49 (15,1 %) | 266 (81,3 %) | 296 (91,6 %) | 226 (70,0 %) | 290 (88,7 %) | 302 (93,5 %) | 257 (79,6 %) | 249 (76,1 %) | 274 (84,8 %) | 234 (72,4 %) |
PASI 75 -vaste, n (%) | 16 (4,9 %) | 219 (67,0 %)** | 249 (77,1 %)** | 142 (44,0 %) | 247 (75,5 %) | 280 (86,7 %) | 189 (58,5 %) | 215 (65,7 %) | 254 (78,6 %) | 179 (55,4 %) |
PASI 90 -vaste, n (%) | 5 (1,5 %) | 137 (41,9 %) | 175 (54,2 %) | 67 (20,7 %) | 176 (53,8 %) | 234 (72,4 %) | 101 (31,3 %) | 147 (45,0 %) | 210 (65,0 %) | 108 (33,4 %) |
PASI 100 -vaste, n (%) | 0 (0 %) | 47 (14,4 %) | 78 (24,1 %) | 14 (4,3 %) | 84 (25,7 %) | 119 (36,8 %) | 24 (7,4 %) | 65 (19,9 %) | 117 (36,2 %) | 32 (9,9 %) |
IGA mod 2011 oireeton tai lähes oireeton vaste, n (%) | 9 (2,8 %) | 167 (51,1 %)** | 202 (62,5 %)** | 88 (27,2 %) | 200 (61,2 %) | 244 (75,5 %) | 127 (39,3 %) | 168 (51,4 %) | 219 (67,8 %) | 120 (37,2 %) |
** p-arvot vs. etanersepti: p = 0,0250
Psoriaasilisätutkimuksessa (CLEAR) arvioitiin 676 potilasta. Tutkimuksessa saavutettiin sekukinumabi 300 mg annoksella ensisijainen ja toissijaiset päätetapahtumat (superioriteetti): sekukinumabiryhmässä useampi saavutti PASI 90 -vasteen viikolla 16 (ensisijainen päätetapahtuma), sai PASI 75 -vasteen nopeammin (mitattuna viikolla 4), sekä useammalla oli pitkäaikainen PASI 90 -vaste viikolla 52, verrattuna ustekinumabiryhmään. Sekukinumabin parempi teho ustekinumabiin verrattuna havaittiin aikaisessa vaiheessa ja jatkui viikolle 52 asti seuraavien päätemuuttujien osalta: PASI 75/90/100 -vasteen saavuttaneiden osuus, ja 0 tai 1 pistettä IGA mod 2011-asteikolla (”oireeton” tai ”lähes oireeton”) saaneiden osuus (taulukko 6).
Taulukko 6 Yhteenveto kliinisistä vasteista, CLEAR-tutkimus
Viikko 4 | Viikko 16 | Viikko 52 | ||||
Sekukinumabi 300 mg | Ustekinumabi* | Sekukinumabi 300 mg | Ustekinumabi* | Sekukinumabi 300 mg | Ustekinumabi* | |
Potilaiden määrä | 334 | 335 | 334 | 335 | 334 | 335 |
PASI 75 -vaste, n (%) | 166 (49,7%)** | 69 (20,6%) | 311 (93,1%) | 276 (82,4%) | 306 (91,6%) | 262 (78,2%) |
PASI 90 -vaste, n (%) | 70 (21,0%) | 18 (5,4%) | 264 (79,0%)** | 192 (57,3%) | 250 (74,9%)*** | 203 (60,6%) |
PASI 100 -vaste, n (%) | 14 (4,2%) | 3 (0,9%) | 148 (44,3%) | 95 (28,4%) | 150 (44,9%) | 123 (36,7%) |
IGA mod 2011 oireeton tai lähes oireeton vaste, n (%) | 128 (38,3%) | 41 (12,2%) | 278 (83,2%) | 226 (67,5%) | 261 (78,1%) | 213 (63,6%) |
* Sekukinumabilla hoidetut potilaat saivat 300 mg annoksen viikoilla 0, 1, 2, 3 ja 4, sekä 4 viikon välein viikolle 52 asti. Ustekinumabilla hoidetut potilaat saivat 45 mg tai 90 mg annoksen viikoilla 0 ja 4, sekä 12 viikon välein viikolle 52 asti (annostelu painon mukaan hyväksytyn annostuksen mukaisesti)
** p‑arvot verrattuna ustekinumabiin: p<0,0001 ensisijaiselle päätetapahtumalle (PASI 90-vaste viikolla 16) ja toissijaiselle päätetapahtumalle (PASI 75-vaste viikolla 4)
*** p‑arvot verrattuna ustekinumabiin: p=0,0001 toissijaiselle päätetapahtumalle (PASI 90-vaste viikolla 52)
Sekukinumabi oli tehokas systeemisille ja biologisille hoidoille naiiveilla potilailla, aiemmin biologisilla lääkkeillä / TNF-salpaajilla hoidetuilla potilailla sekä potilailla, joilla hoito biologisilla lääkkeillä / TNF-salpaajilla ei ollut tehonnut. Potilailla, joilla oli samanaikaista psoriartriittia lähtötilanteessa, PASI75 vasteen saavuttaneiden potilaiden osuus oli samansuuruinen kuin läiskäpsoriaasipotilaiden kokonaispopulaatiossa.
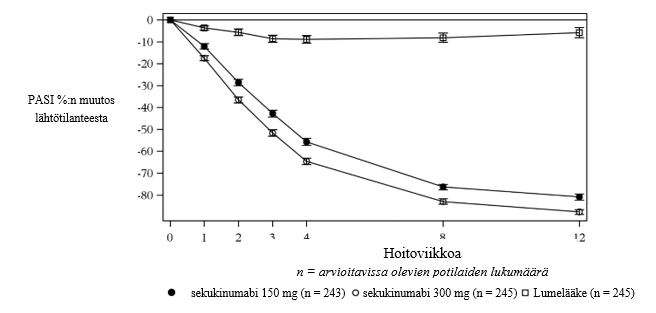
Sekukinumabin vaikutus alkoi nopeasti ja annoksella 300 mg keskimääräinen PASI-vaste pieneni 50 % viikkoon 3 mennessä.
Kuva 1 Keskimääräisen PASI-arvon prosentuaalinen muutos ajan suhteen lähtötilanteesta tutkimuksessa 1 (ERASURE)
Läiskäpsoriaasin erityiset esiintymismuodot
Kahdessa lumelääkekontrolloidussa lisätutkimuksessa havaittiin paranemista sekä kynsipsoriaasissa (TRANSFIGURE, 198 potilasta) että kämmenten ja jalkapohjien psoriaasissa (GESTURE, 205 potilasta). TRANSFIGURE-tutkimuksessa sekukinumabi oli lumelääkettä parempi viikolla 16 (46,1% 300 mg annoksella, 38,4% 150 mg annoksella ja 11,7% lumelääkkeellä) arvioitaessa merkitsevää paranemista lähtötilanteeseen verrattuna Nail Psoriasis Severity Index (NAPSI %) –asteikolla potilailla, jotka sairastivat keskivaikeaa tai vaikeaa läiskäpsoriaasia, johon liittyy kynsioireita. GESTURE-tutkimuksessa sekukinumabi oli lumelääkettä parempi viikolla 16 (33,3% 300 mg annoksella, 22,1% 150 mg annoksella ja 1,5% lumelääkkeellä) arvioitaessa merkitsevää paranemista 0- tai 1-vasteessa ppIGA mod 2011-asteikolla (”oireeton” tai ”lähes oireeton”) potilailla, jotka sairastivat keskivaikeaa tai vaikeaa kämmenten ja jalkapohjien psoriaasia.
Lumelääkekontrolloidussa tutkimuksessa arvioitiin 102 potilasta, joilla oli keskivaikea tai vaikea päänahan psoriaasi (oirepisteet asteikoilla Psoriasis Scalp Severity Index (PSSI) ≥12, IGA mod 2011 päänahan osalta ≥3 ja vähintään 30 % päänahasta on psoriaasin peitossa). Sekukinumabi 300 mg oli lumelääkettä parempi viikolla 12, mikä näkyi merkitsevänä paranemisena lähtötilanteeseen verrattuna niiden potilaiden osuudessa, jotka saavuttivat PSSI 90 -vasteen (52,9 % 300 mg annoksella ja 2,0 % lumelääkkeellä) ja niiden potilaiden osuudessa, jotka saivat 0 tai 1 pistettä päänahan IGA mod 2011 -asteikolla (56,9 % 300 mg annoksella ja 5,9% lumelääkkeellä). Molempien päätetapahtumien tulokset säilyivät sekukinumabihoitoa saavilla potilailla viikolle 24 asti.
Elämänlaatu / potilaiden ilmoittamat vaikutukset
DLQI-mittarilla (Dermatology Life Quality Index) osoitettiin tilastollisesti merkitsevää paranemista lähtötilanteesta viikolla 12 verrattuna lumelääkkeeseen (tutkimukset 1−4). Viikolla 12 todettu keskimääräinen pisteiden alenema (paraneminen) DLQI-pistearvoissa lähtötilanteesta vaihteli arvosta ‑10,4 arvoon -11,6 sekukinumabin 300 mg:n annoksella, arvosta ‑7,7 arvoon ‑10,1 sekukinumabin 150 mg:n annoksella ja arvosta ‑1,1 arvoon ‑1,9 lumelääkkeellä. Nämä tulokset säilyivät 52 viikon ajan (tutkimukset 1 ja 2).
Tutkimuksiin 1 ja 2 osallistuneista 40 % täytti psoriaasin oirepäiväkirjaa (Psoriasis Symptom Diary©). Kussakin näistä tutkimuksista päiväkirjaa täyttäneillä tutkittavilla osoitettiin lumelääkkeeseen nähden tilastollisesti merkitsevää paranemista viikolla 12 potilaiden ilmoittamien oireiden suhteen, joita olivat kutina, kipu ja hilseily.
DLQI-mittarilla osoitettiin tilastollisesti merkitsevää paranemista lähtötilanteesta sekukinumabihoitoa saaneilla potilailla verrattuna ustekinumabihoitoa (CLEAR) saaneisiin potilaisiin viikolla 4. Tulokset säilyivät 52 viikon ajan.
Psoriaasin oirepäiväkirjalla osoitettiin tilastollisesti merkitsevää paranemista potilaan itse raportoimissa oireissa (kutina, kipu ja hilseily) sekukinumabihoitoa saaneilla potilailla verrattuna ustekinumabihoitoa saaneisiin potilaisiin viikolla 16 ja 52 (CLEAR).
Päänahan psoriaasitutkimuksessa potilaan itse raportoimissa oireissa (päänahan kutina, kipu ja hilseily) osoitettiin tilastollisesti merkitsevää paranemista (vähenemistä) lähtötilanteesta verrattuna lumelääkettä saaneisiin potilaisiin viikolla 12.
Joustava annostus läiskäpsoriaasissa
Satunnaistetussa, kaksoissokkoutetussa monikeskustutkimuksessa arvioitiin kahta ylläpitoannostusta (300 mg 2 viikon välein ja 300 mg 4 viikon välein). Hoitoa annettiin 150 mg:n esitäytetyllä ruiskulla 331 potilaalle (paino ≥ 90 kg), joilla oli keskivaikea tai vaikea psoriaasi. Potilaat satunnaistettiin suhteessa 1:1 seuraavasti:
- sekukinumabi 300 mg viikoilla 0, 1, 2, 3 ja 4 ja sen jälkeen sama annos 2 viikon välein viikolle 52 asti (n = 165).
-
sekukinumabi 300 mg viikoilla 0, 1, 2, 3 ja 4 ja sen jälkeen sama annos 4 viikon välein viikolle 16 asti (n = 166).
- Potilaat, jotka satunnaistettiin saamaan sekukinumabia 300 mg 4 viikon välein ja jotka saavuttivat PASI 90 ‑vasteen viikon 16 kohdalla, jatkoivat saman annostuksen käyttöä viikolle 52 asti. Potilaat, jotka satunnaistettiin saamaan sekukinumabia 300 mg 4 viikon välein ja jotka eivät saavuttaneet PASI 90 ‑vastetta viikon 16 kohdalla, joko jatkoivat saman annostuksen käyttöä tai siirtyivät käyttämään sekukinumabia 300 mg 2 viikon välein viikolle 52 asti.
Tehovasteet olivat kaiken kaikkiaan korkeammat 2 viikon välein hoitoa saaneiden ryhmässä verrattuna 4 viikon välein hoitoa saaneiden ryhmään (taulukko 7).
Taulukko 7 Yhteenveto kliinisistä vasteista joustavan annostuksen läiskäpsoriaasitutkimuksessa*
Viikko 16 | Viikko 52 | |||
sekukinumabi 300 mg 2 vk välein | sekukinumabi 300 mg 4 vk välein | sekukinumabi 300 mg 2 vk välein | sekukinumabi 300 mg 4 vk välein1 | |
Potilaiden määrä | 165 | 166 | 165 | 83 |
PASI 90 ‑vaste, n (%) | 121 (73,2 %)** | 92 (55,5 %) | 126 (76,4 %) | 44 (52,4 %) |
IGA mod 2011 oireeton tai lähes oireeton ‑vaste, n (%) | 122 (74,2 %)2 | 109 (65,9 %)2 | 125 (75,9 %) | 46 (55,6 %) |
* Moni‑imputointi 1 300 mg 4 vk välein: potilaat saivat jatkuvasti 300 mg 4 viikon välein riippumatta PASI 90 ‑vasteen statuksesta viikon 16 kohdalla; 43 potilasta saavutti PASI 90 ‑vasteen viikon 16 kohdalla ja 40 potilasta ei saavuttanut PASI 90 ‑vastetta viikon 16 kohdalla. ** Yksitahoinen p‑arvo = 0,0003 ensisijaisen päätetapahtuman eli PASI 90 ‑vasteen osalta viikon 16 kohdalla 2 Ei tilastollisesti merkitsevä | ||||
Tutkittavilla, jotka eivät saavuttaneet PASI 90 ‑vastetta viikon 16 kohdalla ja joiden annostus titrattiin tasolle 300 mg sekukinumabia 2 viikon välein, PASI 90 ‑vasteluvut paranivat verrattuna tutkittaviin, jotka jatkoivat käyttöä annostuksella 300 mg sekukinumabia 4 viikon välein. IGA mod 2011 0/1 -vasteet pysyivät ajanjaksolla vakaina molemmissa hoitoryhmissä.
Kyseisten kahden annostuksen (300 mg sekukinumabia 4 viikon välein ja 300 mg sekukinumabia 2 viikon välein) turvallisuusprofiilit ≥ 90 kg painavilla potilailla olivat samankaltaiset ja yhdenmukaiset psoriaasipotilaiden ilmoitetun turvallisuusprofiilin kanssa.
Hidradenitis suppurativa
Sekukinumabin turvallisuutta ja tehoa arvioitiin kahdessa satunnaistetussa, kaksoissokkoutetussa, lumelääkekontrolloidussa vaiheen III tutkimuksessa yhteensä 1 084 potilaalla. Tutkimuksiin osallistui keskivaikeaa tai vaikeaa hidradenitis suppurativaa (HS‑tautia) sairastavia aikuispotilaita, joille harkittiin systeemistä biologista hoitoa. Tutkimukseen otetuilla potilailla oli oltava lähtötilanteessa vähintään 5 tulehduksellista leesiota vähintään kahdella anatomisella alueella. HS‑tutkimuksen 1 (SUNSHINE) potilaista 4,6 %:lla taudin vaikeusaste oli Hurley-astetta I, 61,4 %:lla Hurley-astetta II ja 34,0 %:lla Hurley-astetta III. HS‑tutkimuksen 2 (SUNRISE) potilaista 2,8 %:lla tauti oli Hurley-astetta I, 56,7 %:lla Hurley-astetta II ja 40,5 %:lla Hurley-astetta III. Vähintään 90 kg painavien potilaiden osuus oli 54,7 % HS‑tutkimuksessa 1 ja 50,8 % HS‑tutkimuksessa 2. Näiden tutkimusten potilailla oli keskivaikea tai vaikea HS‑tauti, jonka diagnoosista oli kulunut keskimäärin 7,3 vuotta. 56,3 % tutkittavista oli naisia.
Aiempaa hoitoa biologisella lääkkeellä oli saanut 23,8 % HS‑tutkimuksen 1 potilaista ja 23,2 % HS‑tutkimuksen 2 potilaista. Aiempaa hoitoa systeemisellä antibiootilla oli saanut 82,3 % HS‑tutkimuksen 1 potilaista ja 83,6 % HS‑tutkimuksen 2 potilaista.
HS‑tutkimuksessa 1 arvioitiin 541 potilasta, joista 12,8 % sai samanaikaista vakaa-annoksista antibioottihoitoa. HS‑tutkimuksessa 2 vastaavat luvut olivat 543 ja 10,7 %. Molemmissa tutkimuksissa sekukinumabi-hoitoon satunnaistetut potilaat saivat 300 mg:n annoksen ihon alle viikoilla 0, 1, 2, 3 ja 4 ja sen jälkeen 300 mg 2 tai 4 viikon välein. Viikon 16 kohdalla potilaat, jotka oli satunnaistettu saamaan lumelääkettä, siirtyivät käyttämään sekukinumabia 300 mg viikoilla 16, 17, 18, 19 ja 20 ja sen jälkeen sekukinumabia 300 mg joko 2 tai 4 viikon välein.
Molempien tutkimusten (HS‑tutkimus 1 ja HS‑tutkimus 2) ensisijainen päätetapahtuma oli niiden potilaiden osuus, jotka saavuttivat viikolla 16 HiSCR50‑vasteen (Hidradenitis Suppurativa Clinical Response), jonka määritelmänä on vähintään 50 %:n vähenemä absessien ja tulehduksellisten kyhmyjen määrässä ilman absessien ja/tai vuotavien fistelien määrän kasvua suhteessa lähtötilanteeseen. Toissijaisena päätetapahtumana arvioitiin numeerisella arviointiasteikolla (Numerical Rating Scale, NRS) HS‑tautiin liittyvän ihon kivun lievittymistä potilailla, joiden NRS-pistemäärä oli lähtötilanteessa vähintään 3. Arviointi tehtiin HS‑tutkimusten 1 ja 2 yhdistettyjen tietojen pohjalta.
HS‑tutkimuksissa 1 ja 2 viikolla 16 HiSCR50‑vasteen ja absessien ja tulehduksellisten kyhmyjen (AN) vähenemän saavuttaneiden potilaiden osuus oli suurempi sekukinumabia 300 mg 2 viikon välein saaneilla verrattuna lumelääkkeeseen. HS‑tutkimuksessa 2 myös sekukinumabi 300 mg 4 viikon välein ‑hoidon yhteydessä havaittiin ero HiSCR50‑vasteessa ja AN‑määrässä. Pahenemisvaiheita esiintyi lumelääkkeeseen verrattuna viikkoon 16 mennessä pienemmällä osalla HS‑tutkimuksessa 1 sekukinumabia 300 mg 2 viikon välein saaneista ja HS‑tutkimuksessa 2 sekukinumabia 300 mg 4 viikon välein saaneista potilaista. Sekukinumabia 300 mg 2 viikon välein saaneista potilaista (yhdistetyt tiedot) suuremmalla osalla todettiin viikolla 16 kliinisesti merkityksellinen vähenemä HS‑tautiin liittyvässä ihon kivussa verrattuna lumelääkkeeseen (taulukko 8).
Taulukko 8 Kliininen vaste viikolla 16 HS‑tutkimuksissa 1 ja 21
HS‑tutkimus 1 | HS‑tutkimus 2 | |||||
Lumelääke | 300 mg 4 vk välein | 300 mg 2 vk välein | Lumelääke | 300 mg 4 vk välein | 300 mg 2 vk välein | |
Satunnaistettujen potilaiden lukumäärä | 180 | 180 | 181 | 183 | 180 | 180 |
HiSCR50, n (%) | 61 (33,7) | 75 (41,8) | 82 (45,0*) | 57 (31,2) | 83 (46,1*) | 76 (42,3*) |
AN-määrän keskimuutos (%) lähtötilanteesta | –24,3 | –42,4 | –46,8* | –22,4 | –45,5* | –39,3* |
Pahenemisvaiheet, n (%) | 52 (29,0) | 42 (23,2) | 28 (15,4*) | 50 (27,0) | 28 (15,6*) | 36 (20,1) |
Yhdistetyt tiedot (HS‑tutkimukset 1 ja 2) | ||||||
Lumelääke | 300 mg 4 vk välein | 300 mg 2 vk välein | ||||
Potilaat, joiden NRS‑pistemäärä oli lähtötilanteessa ≥ 3 | 251 | 252 | 266 | |||
≥30% ihon kivun lievittyminen, NRS30‑vaste, n (%) | 58 (23,0) | 84 (33,5) | 97 (36,6*) | |||
1 Puuttuvien tietojen käsittelemiseen käytettiin moni-imputointia. n: Pyöristetty keskimääräinen responssin saaneiden tutkittavien lukumäärä 100 imputoinnissa. * Tilastollisesti merkitsevä verrattuna lumelääkkeeseen ennalta määritetyn hierarkian perusteella, kokonaisalfa = 0,05. AN: absessit ja tulehdukselliset kyhmyt; HiSCR: Hidradenitis Suppurativa Clinical Response ‑vaste; NRS: numeerinen arviointiasteikko, Numerical Rating Scale. | ||||||
Kummassakin tutkimuksessa sekukinumabin vaikutus näkyi jo viikolla 2, ja teho voimistui asteittain viikolle 16 asti säilyen viikolle 52.
HS‑potilailla havaittiin parenemista ensisijaisissa ja tärkeimmissä toissijaisissa päätetapahtumissa riippumatta aiemmasta tai samanaikaisesta antibioottihoidosta.
HiSCR50‑vasteessa havaittiin paranema viikolla 16 potilailla, joita ei ollut aiemmin hoidettu biologisilla lääkkeillä, sekä potilailla, jotka olivat saaneet aiempaa biologista hoitoa.
Viikolla 16 todettiin lumelääkkeeseen verrattuna suuremmat paranemat lähtötilanteesta terveyteen liittyvässä elämänlaadussa, jota mitattiin DLQI‑indeksillä (Dermatology Life Quality Index).
Nivelpsoriaasi
Sekukinumabin turvallisuutta ja tehoa arvioitiin kolmessa satunnaistetussa, kaksoissokkoutetussa, lumelääkekontrolloidussa vaiheen III tutkimuksessa 1 999 potilaalla, joilla oli aktiivinen nivelpsoriaasi (≥ 3 turvonnutta ja ≥ 3 aristavaa niveltä), ei-steroidaalisten tulehduskipulääkkeiden, kortikosteroidien tai sairauden kulkua muuttavien reumalääkkeiden käytöstä huolimatta. Näihin tutkimuksiin osallistui potilaita, joilla oli kaikkia nivelpsoriaasin alatyyppejä, kuten moniniveltulehdus ilman viitteitä reumakyhmyistä, nikamatulehdus, johon liittyy perifeerinen niveltulehdus, toispuolinen perifeerinen niveltulehdus, distaalinen interfalanginen tautimuoto ja mutiloiva niveltulehdus. Näihin tutkimuksiin osallistuneiden potilaiden nivelpsoriaasidiagnoosista oli kulunut vähintään 5 vuotta. Suurimmalla osalla potilaista oli aktiivisia psoriaasi-iholeesioita tai dokumentoitu psoriaasi. Lähtötilanteessa yli 61 %:lla potilaista oli entesiitti ja yli 42 %:lla daktyliitti. Ensisijaisena päätemuuttujana oli kaikissa tutkimuksissa ACR20-vaste (American College of Rheumatology 20). Nivelpsoriaasitutkimuksessa 1 (PsA 1) ja nivelpsoriaasitutkimuksessa 2 (PsA 2) ensisijainen päätemuuttuja arvioitiin viikolla 24. Nivelpsoriaasitutkimuksessa 3 (PsA 3) ensisijainen päätemuuttuja arvioitiin viikolla 16 ja keskeisin toissijainen päätemuuttuja eli muokattujen Sharpin kokonaispisteiden (mTSS, modified Total Sharp Score) muutos lähtötilanteesta viikolla 24.
Nivelpsoriaasitutkimuksessa 1 potilaista 29 %, nivelpsoriaasitutkimuksessa 2 potilaista 35 % ja nivelpsoriaasitutkimuksessa 3 potilaista 30 % oli saanut aiemmin TNFα-salpaajahoitoa ja keskeyttänyt TNFα-salpaajahoidon joko tehon puutteen vuoksi tai koska he eivät sietäneet hoitoa (TNFα-salpaajahoidolle riittämättömän vasteen saaneet potilaat).
Nivelpsoriaasitutkimuksessa 1 (FUTURE 1) arvioitiin 606 potilasta, joista 60,7 % sai samanaikaisesti metotreksaattia. Sekukinumabi-hoitoon satunnaistetut potilaat saivat 10 mg/kg laskimoon viikoilla 0, 2 ja 4 ja sen jälkeen joko 75 mg:n tai 150 mg:n annoksen ihon alle kerran kuukaudessa viikosta 8 lähtien. Lumelääkettä saamaan satunnaistetut potilaat, jotka eivät olleet saaneet vastetta viikolla 16 (varhainen lääkitykseen siirtyminen, early rescue), ja muut lumelääkettä viikolla 24 saaneet potilaat siirrettiin saamaan sekukinumabia (joko 75 mg tai 150 mg ihon alle) ja sen jälkeen samaa annosta kerran kuukaudessa.
Nivelpsoriaasitutkimuksessa 2 (FUTURE 2) arvioitiin 397 potilasta, joista 46,6 % sai samanaikaisesti metotreksaattia. Sekukinumabi-hoitoon satunnaistetut potilaat saivat 75 mg:n, 150 mg:n tai 300 mg:n annoksen ihon alle viikoilla 0, 1, 2, 3 ja 4 ja sen jälkeen saman annoksen kerran kuukaudessa. Lumelääkettä saamaan satunnaistetut potilaat, jotka eivät olleet saaneet vastetta viikolla 16 (varhainen lääkitykseen siirtyminen, early rescue), siirrettiin viikolla 16 saamaan sekukinumabia (joko 150 mg tai 300 mg ihon alle) ja sen jälkeen saman annoksen kerran kuukaudessa. Lumelääkettä saamaan satunnaistetut potilaat, jotka saivat vasteen viikolla 16, siirrettiin viikolla 24 saamaan sekukinumabia (joko 150 mg tai 300 mg ihon alle) ja sen jälkeen saman annoksen kerran kuukaudessa.
Nivelpsoriaasitutkimuksessa 3 (FUTURE 5) arvioitiin 996 potilasta, joista 50,1 % sai samanaikaisesti metotreksaattia. Potilaat satunnaistettiin saamaan 150 mg tai 300 mg sekukinumabia tai lumelääkettä ihon alle viikoilla 0, 1, 2, 3 ja 4 ja sen jälkeen saman annoksen kuukausittain, tai 150 mg:n sekukinumabi-injektion kerran kuukaudessa (ilman latausannosta). Lumelääkettä saamaan satunnaistetut potilaat, jotka eivät olleet saaneet vastetta viikolla 16 (varhainen lääkitykseen siirtyminen, early rescue), siirrettiin viikolla 16 saamaan sekukinumabia (joko 150 mg tai 300 mg ihon alle) ja sen jälkeen saman annoksen kuukausittain. Lumelääkettä saamaan satunnaistetut potilaat, jotka saivat vasteen viikolla 16, siirrettiin viikolla 24 saamaan sekukinumabia (joko 150 mg tai 300 mg ihon alle) ja sen jälkeen saman annoksen kuukausittain.
Oireet ja löydökset
Sekukinumabi-hoito paransi merkittävästi taudin aktiivisuuden mittalukuja lumelääkkeeseen verrattuna viikkoihin 16 ja 24 mennessä (ks. taulukko 9).
Taulukko 9 Kliininen vaste PsA 2 ‑tutkimuksessa ja PsA 3 ‑tutkimuksessa viikolla 16 ja viikolla 24
PsA 2 | PsA 3 | |||||
Lumelääke | 150 mg1 | 300 mg1 | Lumelääke | 150 mg1 | 300 mg1 | |
Satunnaistettujen potilaiden lukumäärä | 98 | 100 | 100 | 332 | 220 | 222 |
ACR20-vaste n (%) | ||||||
Viikko 16 | 18 (18,4 %) | 60 (60,0 %***) | 57 (57,0 %***) | 91◊ (27,4 %) | 122◊ (55,5 %***) | 139◊ (62,6 %***) |
Viikko 24 | 15◊ (15,3 %) | 51◊ (51,0 %***) | 54◊ (54,0 %***) | 78 (23,5 %) | 117 (53,2 %***) | 141 (63,5 %***) |
ACR50-vaste n (%) | ||||||
Viikko 16 | 6 (6,1 %) | 37 (37,0 %***) | 35 (35,0 %***) | 27 (8,1 %) | 79 (35,9 %*) | 88 (39,6 %*) |
Viikko 24 | 7 (7,1 %) | 35 (35,0 %) | 35 (35,0 %**) | 29 (8,7 %) | 86 (39,1 %***) | 97 (43,7 %***) |
ACR70-vaste n (%) | ||||||
Viikko 16 | 2 (2,0 %) | 17 (17,0 %**) | 15 (15,0 %**) | 14 (4,2 %) | 40 (18,2 %***) | 45 (20,3 %***) |
Viikko 24 | 1 (1,0 %) | 21 (21,0 %**) | 20 (20,0 %**) | 13 (3,9 %) | 53 (24,1 %***) | 57 (25,7 %***) |
DAS28‑CRP | ||||||
Viikko 16 | -0,50 | -1,45*** | -1,51*** | -0,63 | -1,29* | -1,49* |
Viikko 24 | -0,96 | -1,58** | -1,61** | -0,84 | -1,57*** | -1,68*** |
Potilaat, joilla oli lähtötilanteessa psoriaasin iho-oireita ≥ 3 %:ssa ihon pinta-alasta | 43 (43,9 %) | 58 (58,0 %) | 41 (41,0 %) | 162 (48,8 %) | 125 (56,8 %) | 110 (49,5 %) |
PASI 75 ‑vaste n (%) | ||||||
Viikko 16 | 3 (7,0 %) | 33 (56,9 %***) | 27 (65,9 %***) | 20 (12,3 %) | 75 (60,0 %*) | 77 (70,0 %*) |
Viikko 24 | 7 (16,3 %) | 28 (48,3 %**) | 26 (63,4 %***) | 29 (17,9 %) | 80 (64,0 %***) | 78 (70,9 %***) |
PASI 90 ‑vaste n (%) | ||||||
Viikko 16 | 3 (7,0 %) | 22 (37,9 %***) | 18 (43,9 %***) | 15 (9,3 %) | 46 (36,8 %*) | 59 (53,6 %*) |
Viikko 24 | 4 (9,3 %) | 19 (32,8 %**) | 20 (48,8 %***) | 19 (11,7 %) | 51 (40,8 %***) | 60 (54,5 %***) |
Daktyliitin häviäminen, n (%)† | ||||||
Viikko 16 | 10 (37 %) | 21 (65,6 %*) | 26 (56,5 %) | 40 (32,3 %) | 46 (57,5 %*) | 54 (65,9 %*) |
Viikko 24 | 4 (14,8 %) | 16 (50,0 %**) | 26 (56,5 %**) | 42 (33,9 %) | 51 (63,8 %***) | 52 (63,4 %***) |
Entesiitin häviäminen, n (%)‡ | ||||||
Viikko 16 | 17 (26,2 %) | 32 (50,0 %**) | 32 (57,1 %***) | 68 (35,4 %) | 77 (54,6 %*) | 78 (55,7 %*) |
Viikko 24 | 14 (21,5 %) | 27 (42,2 %*) | 27 (48,2 %**) | 66 (34,4 %) | 77 (54,6 %***) | 86 (61,4 %***) |
* p < 0,05, ** p < 0,01, *** p < 0,001; verrattuna lumelääkkeeseen PsA 2 ‑tutkimuksessa kaikki p-arvot korjattiin testauksen kerrannaisuuden suhteen ennalta määrätyn hierarkian mukaisesti viikolla 24 lukuun ottamatta ACR70-vastetta, daktyliittiä ja entesiittiä, jotka olivat eksploratiivisia päätemuuttujia, sekä kaikkia päätemuuttujia viikolla 16. PsA 3 ‑tutkimuksessa kaikki p-arvot korjattiin testauksen kerrannaisuuden suhteen ennalta määrätyn hierarkian mukaisesti viikolla 16 lukuun ottamatta ACR70-vastetta, joka oli eksploratiivinen päätemuuttuja, sekä kaikkia päätemuuttujia viikolla 24. Kaksiosaisen päätemuuttujan puuttuminen tulkittiin siten, että vastetta ei saatu. ACR: American College of Rheumatology; PASI: Psoriasis Area and Severity Index; DAS: Disease Activity Score ◊Ensisijainen päätemuuttuja 1Sekukinumabi 150 mg tai 300 mg ihon alle viikoilla 0, 1, 2, 3 ja 4, ja tämän jälkeen sama annos kuukausittain. †Potilailla, joilla oli lähtötilanteessa daktyliitti (n = vastaavasti 27, 32 ja 46 PsA 2 ‑tutkimuksessa ja n = vastaavasti 124, 80 ja 82 PsA 3 ‑tutkimuksessa) †Potilailla, joilla oli lähtötilanteessa entesiitti (n = vastaavasti 65, 64 ja 56 PsA 2 ‑tutkimuksessa ja n = vastaavasti 192, 141 ja 140 PsA 3 ‑tutkimuksessa) | ||||||
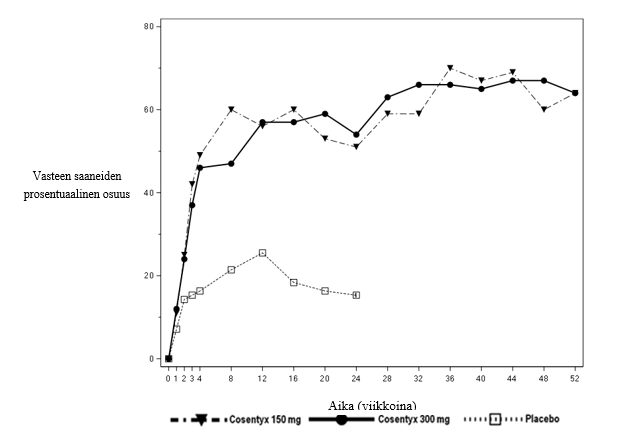
Sekukinumabin vaikutus näkyi jo aikaisin, viikolla 2. Tilastollisesti merkitsevä ero ACR20-vasteessa lumelääkkeeseen verrattuna saavutettiin viikolla 3.
ACR20-vasteen saavuttaneiden potilaiden prosentuaalinen osuus tutkimuskäyntien mukaan on esitetty kuvassa 2.
Kuva 2 ACR20-vaste nivelpsoriaasitutkimuksessa 2 ajan funktiona viikolle 52 asti
Nivelpsoriaasipotilailla todettiin samanlaiset vasteet ensisijaisten ja keskeisten toissijaisten päätemuuttujien osalta riippumatta siitä, saivatko he samanaikaisesti metotreksaattia. Nivelpsoriaasitutkimuksessa 2 viikolla 24 sekukinumabia saaneista ja samanaikaisesti metotreksaattia käyttäneistä potilaista ACR20-vasteen saavuttaneiden osuus oli 47,7 % 150 mg:n ja 54,4 % 300 mg:n annoksella, verrattuna 20,0% lumelääkkeellä. Myös ACR50-vasteen saavuttaneiden osuus oli suurempi (31,8 % 150 mg:n ja 38,6 % 300 mg:n annoksella) kuin lumelääkkeellä (8,0 %). Sekukinumabia saaneilla potilailla, jotka eivät käyttäneet samanaikaisesti metotreksaattia, ACR20-vasteen saavutti 53,6 % 150 mg:n ja 53,6 % 300 mg:n annoksella, kun lumelääkettä saaneista siihen pääsi 10,4 %. ACR50-vasteen saavuttaneiden osuus näistä potilaista oli 37,5 % 150 mg:n ja 32,1 % 300 mg:n annoksella, verrattuna 6,3 % lumelääkeryhmässä.
Nivelpsoriaasitutkimuksessa 2 sekä sellaisilla potilailla, jotka eivät olleet aiemmin saaneet TNFα-salpaajahoitoa, että potilailla, jotka eivät olleet saaneet riittävää vastetta TNFα-salpaajahoidolle, oli ACR20-vasteen saavuttaneiden osuus sekukinumabi-hoitoryhmissä huomattavasti suurempi lumelääkeryhmään verrattuna viikolla 24. ACR20-vasteen saavuttaneiden määrä oli hiukan suurempi ryhmässä, jonka potilaat eivät olleet aiemmin saaneet TNFα-salpaajahoitoa (64 % 150 mg:n ja 58 % 300 mg:n annoksella ja 15,9% lumelääkkeellä), kuin sellaisilla potilailla, jotka eivät olleet saaneet riittävää vastetta aiemmalle TNFα-salpaajahoidolle (30 % 150 mg:n ja 46 % 300 mg:n annoksella ja 14,3% lumelääkkeellä). Alaryhmässä, jonka potilaat eivät olleet saaneet riittävää vastetta TNFα-salpaajahoidolle, ainoastaan 300 mg:n annoksella todettiin merkittävästi suurempi ACR20-vasteen esiintyvyys lumelääkkeeseen verrattuna (p < 0,05) ja sille osoitettiin kliinisesti merkityksellinen hyöty 150 mg:n annokseen nähden monien toissijaisten päätemuuttujien osalta. PASI 75 ‑vasteen paraneminen havaittiin molemmissa alaryhmissä ja 300 mg:n annos osoitti tilastollisesti merkitsevän hyödyn potilailla, jotka eivät olleet saaneet riittävää vastetta TNFα-salpaajahoidolle.
Parannuksia todettiin ACR-pisteytyksen kaikissa eri osatekijöissä, potilaan arvioima kipu mukaan lukien. Nivelpsoriaasitutkimuksessa 2 muokatun PsARC-vasteen (PsA Response Criteria) saavuttaneiden potilaiden osuus oli sekukinumabia saaneilla potilailla suurempi (59,0 % 150 mg:n ja 61,0 % 300 mg:n annoksella) kuin lumelääkettä saaneilla potilailla (26,5 %) viikolla 24.
Nivelpsoriaasitutkimuksissa 1 ja 2 teho säilyi viikolle 104 asti. Nivelpsoriaasitutkimuksessa 2 alusta asti sekukinumabia (150 mg ja 300 mg) saamaan satunnaistetuista 200 potilaasta 178 (89 %) potilasta jatkoi edelleen hoitoa viikolla 52. Sekukinumabia 150 mg:n annoksella saamaan satunnaistetuista 100 potilaasta 64 sai ACR20‑, 39 sai ACR50‑ ja 20 sai ACR70-vasteen. Sekukinumabia 300 mg:n annoksella saamaan satunnaistetuista 100 potilaasta 64 sai ACR20‑, 44 sai ACR50‑ ja 24 sai ACR70-vasteen.
Radiologinen vaste
Nivelpsoriaasitutkimuksessa 3 rakenteellisten vaurioiden etenemisen estymistä arvioitiin radiologisesti ja se ilmaistiin mTSS-pisteinä ja tämän mittarin komponentteina eli eroosiopisteinä (Erosion Score, ES) ja nivelraon kaventumispisteinä (Joint Space Narrowing, JSN). Käsien, ranteiden ja jalkaterien röntgenkuvaus tehtiin lähtötilanteessa, viikolla 16 ja/tai viikolla 24, ja vähintään kaksi hoitoryhmän ja käynnin numeron suhteen sokkoutettua arvioijaa pisteytti kuvat itsenäisesti. Sekukinumabi150 mg- ja 300 mg-hoito esti merkitsevästi perifeeristen nivelvaurioiden etenemistä lumehoitoon verrattuna, kun mittarina käytettiin mTSS-pisteiden muutosta lähtötilanteesta viikolla 24 (taulukko 10).
Rakenteellisia nivelvaurioita arvioitiin myös nivelpsoriaasitutkimuksessa 1 viikoilla 24 ja 52 lähtötilanteeseen nähden. Viikon 24 tulokset on esitetty taulukossa 10.
Taulukko 10 mTSS-pistemäärän muutos nivelpsoriaasin hoidossa
PsA 3 | PsA 1 | ||||
Lumelääke n = 296 | sekukinumabi 150 mg1 n = 213 | Sekukinumabi 300 mg1 n = 217 | Lumelääke n = 179 | Sekukinumabi 150 mg2 n = 185 | |
Kokonaispistemäärä | |||||
Lähtötilanne (keskihajonta) | 15,0 (38,2) | 13,5 (25,6) | 12,9 (23,8) | 28,4 (63,5) | 22,3 (48,0) |
Keskimuutos viikolla 24 | 0,50 | 0,13* | 0,02* | 0,57 | 0,13* |
*p < 0,05 perustuu nimelliseen, ei korjattuun, p-arvoon 1sekukinumabi 150 mg tai 300 mg ihon alle viikoilla 0, 1, 2, 3 ja 4 ja sen jälkeen sama annos kuukausittain 210 mg/kg viikoilla 0, 2 ja 4 ja sen jälkeen 75 mg:n tai 150 mg:n annokset ihon alle | |||||
Nivelpsoriaasitutkimuksessa 1 sekukinumabi-hoitoon liittyvä rakenteellisten vaurioiden estovaikutus säilyi viikolle 52 asti.
Nivelpsoriaasitutkimuksessa 3 niiden potilaiden prosentuaalinen osuus, joiden tauti ei ollut edennyt (määriteltiin korkeintaan 0,5 pisteen muutoksena mTSS-pistemäärässä lähtötilanteeseen nähden) satunnaistamishetkestä viikkoon 24 mennessä, oli 80,3 % potilailla, jotka saivat sekukinumabiannoksen 150 mg, 88,5 % potilailla, jotka saivat sekukinumabiannoksen 300 mg, ja 73,6 % potilailla, jotka saivat lumelääkettä. Rakenteellisten vaurioiden estovaikutus havaittiin potilailla, jotka eivät olleet saaneet aiempaa TNFα-salpaajahoitoa, TNFα-salpaajahoidolle riittämättömän vasteen saaneilla potilailla sekä samanaikaista metotreksaattihoitoa saavilla ja saamattomilla potilailla.
Nivelpsoriaasitutkimuksessa 1 niiden potilaiden prosentuaalinen osuus, joiden tauti ei ollut edennyt (määriteltiin korkeintaan 0,5 pisteen muutoksena mTSS-pistemäärässä lähtötilanteeseen nähden) satunnaistamishetkestä viikkoon 24 mennessä, oli 82,3 % potilailla, jotka saivat sekukinumabilatausannoksen 10 mg/kg laskimoon ja 150 mg:n ylläpitoannosta ihon alle, ja 75,7 % potilailla, jotka saivat lumelääkettä. Niiden potilaiden prosentuaaliset osuudet, joilla tauti ei ollut edennyt viikolta 24 viikolle 52 olivat 85,7 % (sekukinumabilatausannos 10 mg/kg laskimoon ja 150 mg:n ylläpitoannos ihon alle) ja 86,8 % (lumelääkeryhmän potilaat, jotka vaihtoivat viikolla 16 tai viikolla 24 4 viikon välein annettavaan 75 mg:n tai 150 mg:n sekukinumabin ylläpitoannokseen ihon alle).
Nivelpsoriaasin aksiaalinen tautimuoto
Satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa (MAXIMISE) arvioitiin sekukinumabin tehoa 485 nivelpsoriaasipotilaalla, joilla oli aksiaalinen tautimuoto. Potilaat eivät olleet saaneet aiempaa biologista hoitoa, ja vaste tulehduskipulääkkeille oli riittämätön. Ensisijainen päätetapahtuma eli ASAS 20 ‑kriteerien (Assessment of SpondyloArthritis International Society) mukainen, vähintään 20 %:n paranema viikolla 12 saavutettiin. Myös oireissa ja löydöksissä (mukaan lukien selkärankakivun väheneminen lähtötilanteesta) todettiin suurempi paranema, sekä fyysisessä toimintakyvyssä paranema sekukinumabi‑hoidolla annoksilla 150 mg ja 300 mg lumelääkkeeseen verrattuna (ks. taulukko 11).
Taulukko 11 Kliininen vaste MAXIMISE‑tutkimuksessa viikolla 12
Lumelääke (n = 164) | 150 mg (n = 157) | 300 mg (n = 164) | |
ASAS 20 ‑vaste, % (95 % lv) | 31,2 (24,6; 38,7) | 66,3 (58,4; 73,3)* | 62,9 (55,2; 70,0)* |
ASAS 40 ‑vaste, % (95 % lv) | 12,2 (7,8; 18,4) | 39,5 (32,1; 47,4)** | 43,6 (36,2; 51,3)** |
BASDAI 50, % (95 % lv) | 9,8 (5,9; 15,6) | 32,7 (25,8; 40,5)** | 37,4 (30,1; 45,4)** |
Selkärankakipu, VAS (95 % lv) | ‑13,6 (‑17,2; ‑10,0) | ‑28,5 (‑32,2; ‑24,8)** | ‑26,5 (‑30,1; ‑22,9)** |
Fyysinen toimintakyky, HAQ‑DI (95 % lv) | ‑0,155 (‑0,224; ‑0,086) | ‑0,330 (‑0,401; ‑0,259)** | ‑0,389 (‑0,458; ‑0,320)** |
* p < 0,0001; lumelääkkeeseen verrattuna käyttämällä moni‑imputointia. ** Vertailu lumelääkkeeseen ilman monivertailukorjausta. ASAS: Assessment of SpondyloArthritis International Society Criteria; BASDAI: Bath Ankylosing Spondylitis Disease Activity Index; VAS: Visual Analog Scale; HAQ‑DI: Health Assessment Questionnaire – Disability Index. | |||
ASAS 20‑ ja ASAS 40 ‑vasteiden paranemat havaittiin kummallakin sekukinumabiannoksella viikkoon 4 mennessä ja ne säilyivät viikolle 52 asti.
Fyysinen toimintakyky ja terveyteen liittyvä elämänlaatu
Nivelpsoriaasitutkimuksessa 2 sekukinumabi 150 mg (p = 0,0555) ja 300 mg (p = 0,0040) saaneiden potilaiden fyysisen toimintakyvyn todettiin parantuneen lumelääkettä saaneisiin potilaisiin verrattuna HAQ-DI-kyselyllä (Health Assessment Questionnaire‑Disability Index) arvioituna viikolla 24. Nivelpsoriaasitutkimuksessa 3 Cosentyx-valmistetta 150 mg (p < 0,0001) ja 300 mg (p < 0,0001) saaneiden potilaiden fyysisen toimintakyvyn todettiin parantuneen lumelääkettä saaneisiin potilaisiin verrattuna HAQ-DI-kyselyllä arvioituna viikolla 16. HAQ-DI-pistemäärän todettiin parantuneen aiemmasta TNFα-salpaajahoidosta riippumatta. Samanlaiset vasteet todettiin nivelpsoriaasitutkimuksessa 1.
Sekukinumabia saaneet potilaat ilmoittivat merkittävistä parannuksista terveyteen liittyvän elämänlaadun suhteen SF-36 PCS ‑pistemäärällä (Short Form-36 Health Survey Physical Component Summary) (p < 0,001) mitattuna. Tilastollisesti merkitsevää paranemista todettiin myös eksploratiivisten päätemuuttujien osalta, jotka arvioitiin FACIT-F-pistemäärän (Functional Assessment of Chronic Illness Therapy – Fatigue) avulla. FACIT-F-pistemäärät olivat 150 mg:n annoksella 7,97, 300 mg:n annoksella 5,97 ja lumelääkkeellä 1,63, ja kohentunut tilanne säilyi viikolle 104 nivelpsoriaasitutkimuksessa 2.
Samankaltaisia vasteita havaittiin nivelpsoriaasitutkimuksessa 1 ja teho säilyi viikolle 52 asti.
Aksiaalinen spondylartriitti (axSpA)
Selkärankareuma (AS) / radiografinen aksiaalinen spondylartriitti
Sekukinumabin turvallisuutta ja tehoa arvioitiin kolmessa satunnaistetussa, kaksoissokkoutetussa, lumelääkekontrolloidussa vaiheen III tutkimuksessa 816 potilaalla, joilla oli aktiivinen selkärankareuma ja joiden BASDAI-indeksi (Bath Ankylosing Spondylitis Disease Activity Index) oli vähintään 4 ei-steroidaalisten tulehduskipulääkkeiden, kortikosteroidien tai sairauden kulkua muuttavien reumalääkkeiden käytöstä huolimatta. Selkärankareumatutkimukseen 1 (AS 1) ja selkärankareumatutkimukseen 2 (AS 2) osallistuvien potilaiden selkärankareumadiagnoosista kuluneen ajan mediaani oli 2,7−5,8 vuotta. Ensisijaisena päätemuuttujana oli molemmissa tutkimuksissa ASAS 20 ‑kriteerien (Assessment of SpondyloArthritis International Society) vähintään 20 %:n paraneminen viikolla 16.
Selkärankareumatutkimuksessa 1 (AS 1) 27,0 % potilaista, selkärankareumatutkimuksessa 2 (AS 2) 38,8 % potilaista ja selkärankareumatutkimuksessa 3 (AS 3) 23,5 % potilaista oli aiemmin saanut TNFα-salpaajahoitoa ja keskeyttänyt TNFα-salpaajahoidon joko tehon puutteen vuoksi tai koska he eivät sietäneet hoitoa (TNFα-salpaajahoidolle riittämättömän vasteen saaneet potilaat).
Selkärankareumatutkimuksessa 1 (MEASURE 1) arvioitiin 371 potilasta, joista 14,8 % sai samanaikaisesti metotreksaattia ja 33,4 % sai samanaikaisesti sulfasalatsiinia. Sekukinumabi-hoitoon satunnaistetut potilaat saivat 10 mg/kg laskimoon viikoilla 0, 2 ja 4 ja sen jälkeen joko 75 mg:n tai 150 mg:n annoksen ihon alle kerran kuukaudessa viikosta 8 lähtien. Lumelääkettä saamaan satunnaistetut potilaat, jotka eivät olleet saaneet vastetta viikolla 16 (varhainen lääkitykseen siirtyminen, early rescue), ja kaikki muut lumelääkettä viikolla 24 saaneet potilaat siirrettiin saamaan sekukinumabia (joko 75 mg tai 150 mg ihon alle) ja sen jälkeen samaa annosta kerran kuukaudessa.
Selkärankareumatutkimuksessa 2 (MEASURE 2) arvioitiin 219 potilasta, joista 11,9 % sai samanaikaisesti metotreksaattia ja 14,2 % sai samanaikaisesti sulfasalatsiinia. Sekukinumabi-hoitoon satunnaistetut potilaat saivat 75 mg:n tai 150 mg:n annoksen ihon alle viikoilla 0, 1, 2, 3 ja 4 ja sen jälkeen samaa annosta kerran kuukaudessa. Lähtötilanteessa lumelääkettä saamaan satunnaistetut potilaat siirrettiin viikolla 16 saamaan sekukinumabia (joko 75 mg tai 150 mg ihon alle) kerran kuukaudessa.
Selkärankareumatutkimuksessa 3 (MEASURE 3) arvioitiin 226 potilasta, joista samanaikaisesti 13,3 % sai metotreksaattia ja 23,5 % sulfasalatsiinia. Sekukinumabihoitoon satunnaistetut potilaat saivat 10 mg/kg:n laskimonsisäiset annokset viikkoina 0, 2 ja 4, jonka jälkeen he saivat joko 150 mg:n tai 300 mg:n annokset ihon alle joka kuukausi. Viikolla 16 lähtötilanteessa lumelääkeryhmään satunnaistetut potilaat satunnaistettiin uudestaan saamaan sekukinumabia (joko 150 mg tai 300 mg ihonalaisesti) kerran kuukaudessa. Tutkimuksen ensisijaisena päätemuuttujana oli ASAS 20 viikolla 16. Potilaiden hoito-ohjelmat jatkuivat sokkoutettuina viikolle 52 asti. Tutkimus jatkui viikolle 156.
Oireet ja löydökset:
Selkärankareumatutkimuksessa 2 taudin aktiivisuuteen liittyvillä mittareilla todettiin suurempi paraneminen sekukinumabi-hoidolla annoksella 150 mg lumelääkkeeseen verrattuna viikolla 16 (ks. taulukko 12).
Taulukko 12 Kliininen vaste selkärankareumatutkimuksessa 2 viikolla 16
Hoitotulos (p-arvo verrattuna lumelääkkeeseen) | Lumelääke (n = 74) | 75 mg (n = 73) | 150 mg (n = 72) |
ASAS 20 ‑vaste, % | 28,4 | 41,1 | 61,1*** |
ASAS 40 ‑vaste, % | 10,8 | 26,0 | 36,1*** |
hsCRP, (suhde lähtötilanteen jälkeen / lähtötilanne) | 1,13 | 0,61 | 0,55*** |
ASAS 5/6, % | 8,1 | 34,2 | 43,1*** |
ASAS, osittainen remissio, % | 4,1 | 15,1 | 13,9 |
BASDAI 50, % | 10,8 | 24,7* | 30,6** |
ASDAS-CRP, merkittävä paraneminen | 4,1 | 15,1* | 25,0*** |
* p < 0,05, ** p < 0,01, *** p < 0,001; verrattuna lumelääkkeeseen Kaikki p-arvot korjattiin testauksen kerrannaisuuden suhteen ennalta määrätyn hierarkian mukaisesti lukuun ottamatta BASDAI 50‑ ja ASDAS-CRP-indeksejä. Kaksiosaisen päätemuuttujan puuttuminen tulkittiin siten, että vastetta ei saatu. ASAS: Assessment of SpondyloArthritis International Society Criteria; BASDAI: Bath Ankylosing Spondylitis Disease Activity Index; hsCRP: herkkä C-reaktiivinen proteiini; ASDAS: Ankylosing Spondylitis Disease Activity Score | |||
Selkärankareumatutkimuksessa 2 sekukinumabinvaikutus näkyi ASAS 20 ‑kriteerien osalta (parempi kuin lumelääke) niinkin aikaisin kuin viikolla 1 ja ASAS 40 –kriteerien osalta (parempi kuin lumelääke) viikolla 2.
Sekukinumabia 150 mg:n annoksen saaneiden potilaiden ASAS 20 ‑vasteet olivat lumelääkkeeseen verrattuna parantuneet viikolla 16 sekä potilailla, jotka eivät olleet aiemmin saaneet TNFα-salpaajahoitoa (sekukinumabi 150 mg: 68,2 %, lumelääke: 31,1 %; p < 0,05), että potilailla, jotka eivät olleet saaneet riittävää vastetta TNFα-salpaajahoitoon (sekukinumabi 150 mg: 50,0 %, lumelääke: 24,1 %; p < 0,05).
Selkärankareumatutkimuksissa 1 ja 2 sekukinumabia saaneiden potilaiden (150 mg selkärankareumatutkimuksessa 2 ja molemmilla hoito-ohjelmilla selkärankareumatutkimuksessa 1) oireet ja löydökset olivat lievittyneet merkittävästi viikolla 16 vasteen ja tehon säilyessä vastaavan suuruisena viikolle 52 asti sekä potilailla, jotka eivät olleet saaneet aiemmin TNFα-salpaajahoitoa, että potilailla, jotka eivät olleet saaneet riittävää vastetta TNFα‑hoitoon. Selkärankareumatutkimuksessa 2 alusta asti sekukinumabia annoksella 150 mg saamaan satunnaistetuista 72 potilaasta 61 (84,7 %) potilasta jatkoi edelleen hoitoa viikolla 52. Sekukinumabia 150 mg:n annoksella saamaan satunnaistetuista 72 potilaasta 45 sai ASAS 20 ‑vasteen ja 35 sai ASAS 40 ‑vasteen.
Selkärankareumatutkimuksessa 3, sekukinumabihoitoa (150 mg ja 300 mg) saaneilla potilailla todettiin lievittyneet oireet ja löydökset sekä annoksesta riippumatta samankaltaiset, lumelääkettä paremmat tehovasteet viikolla 16 ensisijaisen päätemuuttujan (ASAS 20) osalta. Toissijaisten päätemuuttujien osalta vasteluvut olivat kaiken kaikkiaan johdonmukaisesti paremmat 300 mg:n annoksia saaneiden ryhmässä verrattuna 150 mg:n annoksia saaneiden ryhmään. Sokkoutetun jakson aikana ASAS 20-vaste oli 69,7 % ja ASAS 40-vaste 47,6 % viikolla 52 ryhmässä, joka sai 150 mg:n annoksia, ja vastaavasti 74,3 % sekä 57,4 % 300 mg:n annoksia saaneiden ryhmässä. ASAS 20- ja ASAS 40-vasteet säilyivät viikkoon 156 asti (69,5 % sekä 47,6 % ryhmässä, joka sai 150 mg:n annoksia, ja 74,8 % sekä 55,6 % ryhmässä, joka sai 300 mg:n annoksia). Parempia vastelukuja 300 mg:n annoksen eduksi nähtiin myös ASAS PR (partial remission, osittainen remissio) -arvoissa viikolla 16. Nämä säilyivät viikkoon 156 asti. Suurempia eroja vasteluvuissa 300 mg:n annoksen eduksi 150 mg:n annokseen nähden, havaittiin TNFα-salpaajahoidolle riittämättömän vasteen saaneilla potilailla (n = 36) verrattuna potilaisiin, jotka eivät olleet saaneet aiempaa TNFα-salpaajahoitoa (n = 114).
Selkärangan liikkuvuus:
Selkärankareumatutkimuksessa 1 ja 2 sekukinumabia150 mg:n annoksen saaneilla potilailla todettiin selkärangan liikkuvuuden parantuneen verrattuna lumelääkeryhmään viikolla 16 arvioituna BASMI-indeksin muutoksena lähtötilanteeseen verrattuna. Selkärankareumatutkimuksessa 1 BASMI-indeksin muutokset olivat 150 mg:n annoksella ‑0,40 ja lumelääkkeellä ‑0,12 (p=0,0114) ja selkärankareumatutkimuksessa 2 150 mg:n annoksella ‑0,51 ja lumelääkkeellä ‑0,22 (p=0,0533). Nämä parannukset säilyivät viikolle 52.
Fyysinen toimintakyky ja terveyteen liittyvä elämänlaatu:
Selkärankareumatutkimuksissa 1 ja 2 sekukinumabia 150 mg saaneiden potilaiden terveyteen liittyvän elämänlaadun todettiin parantuneen ASQoL-kyselyllä (AS Quality of Life Questionnaire) (p=0,001) ja SF-36 PCS –indeksillä (SF-36 Physical Component Summary) (p<0,001) arvioituna. Sekukinumabia 150 mg saaneilla potilailla todettiin tilastollisesti merkitsevää paranemista verrattuna lumelääkeryhmään myös eksploratiivisten päätemuuttujien osalta, jotka arvioitiin fyysisen toimintakyvyn osalta BASFI-indeksillä (Bath Ankylosing Spondylitis Functional Index) (150 mg:n annoksella ‑2,15 ja lumelääkkeellä ‑0,68) ja väsymyksen osalta FACIT-Fatique-asteikolla (Functional Assessment of Chronic Illness Therapy-Fatique) (150 mg:n annoksella 8,10 ja lumelääkkeellä 3,30). Nämä parannukset säilyivät viikolle 52.
Non-radiografinen aksiaalinen spondylartriitti (nr-axSpA)
Sekukinumabin turvallisuutta ja tehoa arvioitiin 555 tutkittavan joukossa yhdessä satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa vaiheen III tutkimuksessa (PREVENT‑tutkimus), johon kuului 2 vuoden pituinen päävaihe ja 2 vuoden pituinen jatkovaihe. Tutkittavilla oli aktiivinen non-radiografinen aksiaalinen spondylartriitti täyttäen aksiaalisen spondylartriitin ASAS-luokittelukriteerit ilman radiografisesti todettua näyttöä risti-suoliluunnivelten muutoksista, jotka olisivat täyttäneet selkärankareuman muokatut New York -kriteerit. Mukaan otetuilla tutkittavilla oli aktiivinen tauti eli määritelmän mukaisesti Bath Ankylosing Spondylitis Disease Activity Index ‑indeksin (BASDAI) pistemäärä oli ≥ 4, selkäkivun VAS-arvo oli ≥ 40 (asteikolla 0–100 mm) senhetkisestä tai aiemmasta tulehduskipulääkkeiden käytöstä huolimatta, C‑reaktiivisen proteiinin (CRP) pitoisuus oli suurentunut ja/tai magneettikuvauksessa todettiin näyttöä sakroiliitista. Tämän tutkimuksen tutkittavilla axSpA-diagnoosista kuluneen ajan keskiarvo oli 2,1–3,0 vuotta, ja 54 % tutkittavista oli naisia.
PREVENT-tutkimuksessa 9,7 % potilaista oli saanut aiemmin TNFα-salpaajahoitoa ja lopettanut sen käytön joko tehon puutteen tai siedettävyysongelmien vuoksi (TNFα-salpaajahoidolle riittämättömän vasteen saaneet potilaat).
PREVENT-tutkimuksessa 9,9 % tutkittavista käytti samanaikaisesti MTX-hoitoa ja 14,8 % sulfasalatsiinia. Tutkimuksen kaksoissokkoutetun vaiheen aikana tutkittavat saivat joko lumelääkettä tai sekukinumabia 52 viikon ajan. Sekukinumabiryhmään satunnaistetut tutkittavat saivat joko 150 mg ihon alle viikoilla 0, 1, 2, 3 ja 4 ja tämän jälkeen saman annoksen kerran kuussa tai vaihtoehtoisesti yhden sekukinumabi-injektion (150 mg) kerran kuussa. Ensisijainen päätetapahtuma oli ASAS 40 ‑vaste (vähintään 40 % paranema Assessment of SpondyloArthritis International Society ‑vastekriteereissä) viikolla 16 tutkittavilla, jotka eivät olleet saaneet aiemmin TNFα-salpaajia.
Oireet ja löydökset:
PREVENT-tutkimuksessa sekukinumabihoito (150 mg) kohensi merkitsevästi tautiaktiivisuuden mittareita verrattuna lumelääkkeeseen viikolla 16. Näitä mittareita olivat ASAS 40, ASAS 5/6, BASDAI-pisteet, BASDAI 50, herkkä CRP (hsCRP), ASAS 20 ja ASAS PR (osittainen remissio) verrattuna lumelääkkeeseen (taulukko 13). Vasteet säilyivät viikolle 52.
Taulukko 13 Kliininen vaste PREVENT-tutkimuksessa viikolla 16
Tulos (p-arvo vs. lumelääke) | Lumelääke | 150 mg1 |
Satunnaistetut tutkittavat, jotka eivät olleet saaneet aiemmin TNFα-salpaajia | 171 | 164 |
ASAS 40 -vaste, % | 29,2 | 41,5* |
Satunnaistettujen tutkittavien kokonaismäärä | 186 | 185 |
ASAS 40 -vaste, % | 28,0 | 40,0* |
ASAS 5/6, % | 23,7 | 40,0* |
BASDAI-pisteet, pienimmän neliösumman (LS) keskimuutos lähtötilanteesta | -1,46 | -2,35* |
BASDAI 50, % | 21,0 | 37,3* |
hsCRP, (suhde lähtötilanteen jälkeen / lähtötilanne) | 0,91 | 0,64* |
ASAS 20 -vaste, % | 45,7 | 56,8* |
ASAS osittainen remissio, % | 7,0 | 21,6* |
* p < 0,05; verrattuna lumelääkkeeseen Kaikki p-arvot korjattiin testauksen kerrannaisuuden suhteen ennalta määrätyn hierarkian mukaisesti. Kaksiosaisen päätemuuttujan puuttuminen tulkittiin tilanteeksi, jossa vastetta ei saavutettu. 1Sekukinumabi (150 mg) ihon alle viikoilla 0, 1, 2, 3 ja 4 ja sen jälkeen sama annos kuukausittain. ASAS: Assessment of SpondyloArthritis International Society Criteria; BASDAI: Bath Ankylosing Spondylitis Disease Activity Index; hsCRP: herkkä C-reaktiivinen proteiini; LS: Least square | ||
Sekukinumabin (150 mg) vaikutus tuli esiin ASAS 40-vasteella mitattuna jo PREVENT-tutkimuksen viikolla 3, jolloin se oli ylivertainen lumeryhmään verrattuna tutkittavilla, jotka eivät olleet saaneet aiemmin TNFα-salpaajia. Kuvassa 3 esitetään ASAS 40 ‑vasteen kullakin käynnillä saavuttaneiden prosenttiosuus tutkittavista, jotka eivät olleet saaneet aiemmin TNFα-salpaajia.
Kuva 3 ASAS 40 ‑vasteet PREVENT-tutkimuksen eri ajankohtina viikkoon 16 asti tutkittavilla, jotka eivät olleet saaneet aiemmin TNFα-salpaajia
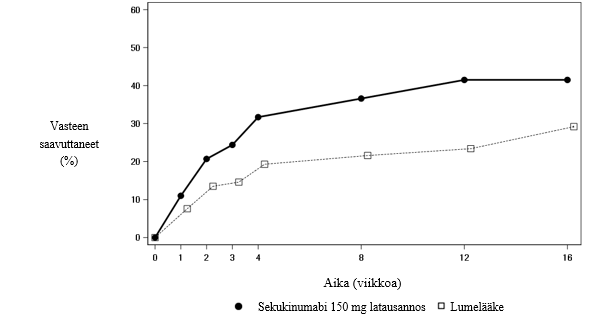
TNFα-salpaajahoidolla riittämättömän vasteen saaneilla sekukinumabiryhmän (150 mg) tutkittavilla todettiin myös paremmat ASAS 40 ‑vasteet viikolla 16 kuin lumelääkettä saaneilla.
Fyysinen toimintakyky ja terveyteen liittyvä elämänlaatu:
Sekukinumabia (150 mg) saaneiden tutkittavien fyysinen toimintakyky BASFI-indeksillä arvioituna parani tilastollisesti merkitsevästi viikkoon 16 mennessä verrattuna lumelääkeryhmään (viikko 16: ‑1,75 vs. ‑1,01; p < 0,05). Sekukinumabia saaneet ilmoittivat terveyteen liittyvän elämänlaadun parantuneen merkitsevästi viikkoon 16 mennessä verrattuna lumeryhmään, kun mittareina olivat ASQoL (pienimmän neliösumman keskimuutos, viikko 16: ‑3,45 vs. ‑1,84; p < 0,05) ja SF-36 PCS (SF-36 Physical Component Score) (pienimmän neliösumman keskimuutos, viikko 16: 5,71 vs. 2,93; p < 0,05). Tulosten paranemat säilyivät viikolle 52 asti.
Selkärangan liikkuvuus:
Selkärangan liikkuvuutta arvioitiin BASMI-indeksin avulla viikolle 16 asti. Sekukinumabia saaneilla tutkittavilla tulokset paranivat numeerisesti enemmän kuin lumelääkettä saaneilla viikoilla 4, 8, 12 ja 16.
Magneettikuvantamisella havaittavan tulehduksen estyminen:
Tulehduksen löydöksiä arvioitiin magneettikuvantamisella lähtötilanteessa ja viikolla 16, ja ne ilmaistiin Berlin SI-joint Oedema Score ‑pisteiden muutoksena lähtötilanteesta (risti-suoliluunivelet) ja ASspiMRI-a-pisteiden ja Berlin Spine Score ‑pisteiden muutoksena lähtötilanteesta (selkäranka). Sekukinumabia saaneilla tutkittavilla todettiin sekä risti-suoliluunivelten että selkärangan tulehdusmuutosten estymistä. Berlin SI-joint Oedema Score ‑pisteiden keskimuutos lähtötilanteesta oli ‑1,68 tutkittavilla, jotka saivat 150 mg sekukinumabia (n = 180), ja ‑0,39 tutkittavilla, jotka saivat lumelääkettä (n = 174) (p < 0,05).
Pediatriset potilaat
Läiskäpsoriaasi pediatrisilla potilailla
Sekukinumabin on osoitettu lievittävän oireita ja löydöksiä ja parantavan terveyteen liittyvää elämänlaatua vähintään 6-vuotiailla pediatrisilla läiskäpsoriaasipotilailla (ks. taulukot 15 ja 17).
Vaikea läiskäpsoriaasi
Sekukinumabin tehoa ja turvallisuutta arvioitiin satunnaistetussa, kaksoissokkoutetussa, lume- ja etanerseptikontrolloidussa vaiheen III tutkimuksessa 6 – < 18-vuotiailla vaikeaa läiskäpsoriaasia sairastavilla pediatrisilla potilailla, joille harkittiin systeemistä hoitoa. Läiskäpsoriaasi määriteltiin vaikeaksi, jos PASI-arvo oli ≥ 20, IGA mod 2011 ‑aste 4 ja oireiden kattavuus ≥ 10 % ihon pinta-alasta. Potilaista noin 43 % oli saanut aiemmin valohoitoa, 53 % tavanomaista systeemistä hoitoa ja 3 % biologisia lääkkeitä ja 9 %:lla oli samanaikainen nivelpsoriaasi.
Pediatrisessa psoriaasitutkimuksessa 1 arvioitiin 162 potilasta, jotka satunnaistettiin saamaan pieniannoksista sekukinumabia (75 mg < 50 kg painaville ja 150 mg ≥ 50 kg painaville), suuriannoksista sekukinumabia (75 mg < 25 kg painaville, 150 mg ≥ 25 kg – < 50 kg painaville ja 300 mg ≥ 50 kg painaville) tai lumelääkettä viikoilla 0, 1, 2, 3 ja 4 ja tämän jälkeen samaa annosta 4 viikon välein tai etanerseptia. Etanerseptiryhmään satunnaistettujen potilaiden annostus oli 0,8 mg/kg viikossa (enintään 50 mg). Potilaiden paino- ja ikäjakauma satunnaistamisvaiheessa on esitetty taulukossa 14.
Taulukko 14 Potilaiden paino- ja ikäjakauma pediatrisessa psoriaasitutkimuksessa 1
Satunnaistamisen osite | Kuvaus | Sekukinumabi, pieni annos n = 40 | Sekukinumabi, suuri annos n = 40 | Lumelääke n = 41 | Etanersepti n = 41 | Yhteensä N = 162 |
Ikä | 6 – < 12 v | 8 | 9 | 10 | 10 | 37 |
≥ 12 – < 18 v | 32 | 31 | 31 | 31 | 125 | |
Paino | < 25 kg | 2 | 3 | 3 | 4 | 12 |
≥ 25 – < 50 kg | 17 | 15 | 17 | 16 | 65 | |
≥ 50 kg | 21 | 22 | 21 | 21 | 85 |
Lumelääkeryhmään satunnaistetut potilaat, jotka eivät olleet saaneet vastetta viikkoon 12 mennessä, siirrettiin joko pieniannoksisen tai suuriannoksisen sekukinumabihoidon ryhmään (annos perustui painoryhmään). Tutkimuslääkettä annettiin viikoilla 12, 13, 14 ja 15, ja sen jälkeen samaa annosta annettiin 4 viikon välein viikosta 16 lähtien. Rinnakkaisia ensisijaisia päätemuuttujia olivat niiden potilaiden osuus, jotka saavuttivat PASI 75 ‑vasteen ja IGA mod 2011 ‑asteikon mukaisen tuloksen oireeton tai lähes oireeton (0 tai 1) viikolla 12.
Pieni- ja suuriannoksisen sekukinumabihoidon teho oli samankaltainen rinnakkaisten ensisijaisten päätemuuttujien osalta 12-viikkoisen lumekontrolloidun vaiheen aikana. Kummankin sekukinumabiannoksen kannalta suotuisat ristitulosuhde-estimaatit olivat tilastollisesti merkitseviä PASI 75 ‑vasteen ja IGA mod 2011 ‑vasteen (tulos 0 tai 1) osalta.
Tehoa ja turvallisuutta seurattiin kaikilla potilailla 52 viikon ajan ensimmäisen annoksen jälkeen. PASI 75- ja IGA mod 2011 ‑asteikon oireeton tai lähes oireeton (0 tai 1) -vasteet saavuttaneiden potilaiden osuudessa havaittiin eroavaisuutta sekukinumabihoitoryhmien ja lumeryhmän välillä ensimmäisellä lähtötilanteen jälkeisellä käynnillä viikon 4 kohdalla. Ero oli suurentunut viikon 12 kohdalla. Vaste säilyi koko 52 viikon jakson ajan (ks. taulukko 15). Myös suurempi osuus PASI 50-, PASI 90- ja PASI 100 ‑vasteita ja CDLQI-pistemäärä (Children’s Dermatology Life Quality Index) 0 tai 1 -tuloksia säilyi koko 52 viikon ajanjakson ajan.
Lisäksi PASI 75-, IGA 0 tai 1- ja PASI 90 ‑vasteiden osuudet viikkojen 12 ja 52 kohdalla olivat sekä pieniannoksisen että suuriannoksisen sekukinumabihoidon ryhmässä suuremmat kuin etanerseptiryhmässä (ks. taulukko 15).
Viikon 12 jälkeen teho pieniannoksisen ja suuriannoksisen sekukinumabihoidon ryhmissä oli samankaltainen, mutta suuren annoksen teho oli suurempi ≥ 50 kg painavilla potilailla. Pienen annoksen ja suuren annoksen turvallisuusprofiilit olivat samankaltaiset ja yhdenmukaiset aikuisten turvallisuusprofiilin kanssa.
Taulukko 15 Yhteenveto kliinisestä vasteesta vaikean pediatrisen psoriaasin hoidossa viikkojen 12 ja 52 kohdalla (pediatrinen psoriaasitutkimus 1)*
Vaste-kriteeri | Hoitovertailu | Tutkimusvalmiste | Verrokki | Ristitulosuhde- | |
Tutkimusvalmiste vs. verrokki | n**/m (%) | n**/m (%) | estimaatti (95 % lv) | p-arvo | |
Viikon 12 kohdalla*** | |||||
PASI 75 | Sekukinumabi, pieni annos vs. lumelääke | 32/40 (80,0) | 6/41 (14,6) | 25,78 (7,08; 114,66) | < 0,0001 |
Sekukinumabi, suuri annos vs. lumelääke | 31/40 (77,5) | 6/41 (14,6) | 22,65 (6,31; 98,93) | < 0,0001 | |
Sekukinumabi, pieni annos vs. etanersepti | 32/40 (80,0) | 26/41 (63,4) | 2,25 (0,73; 7,38) | ||
Sekukinumabi, suuri annos vs. etanersepti | 31/40 (77,5) | 26/41 (63,4) | 1,92 (0,64; 6,07) | ||
IGA 0/1 | Sekukinumabi, pieni annos vs. lumelääke | 28/40 (70,0) | 2/41 (4,9) | 51,77 (10,02; 538,64) | < 0,0001 |
Sekukinumabi, suuri annos vs. lumelääke | 24/40 (60,0) | 2/41 (4,9) | 32,52 (6,48; 329,52) | < 0,0001 | |
Sekukinumabi, pieni annos vs. etanersepti | 28/40 (70,0) | 14/41 (34,1) | 4,49 (1,60; 13,42) | ||
Sekukinumabi, suuri annos vs. etanersepti | 24/40 (60,0) | 14/41 (34,1) | 2,86 (1,05; 8,13) | ||
PASI 90 | Sekukinumabi, pieni annos vs. lumelääke | 29/40 (72,5) | 1/41 (2,4) | 133,67 (16,83; 6 395,22) | < 0,0001 |
Sekukinumabi, suuri annos vs. lumelääke | 27/40 (67,5) | 1/41 (2,4) | 102,86 (13,22; 4 850,13) | < 0,0001 | |
Sekukinumabi, pieni annos vs. etanersepti | 29/40 (72,5) | 12/41 (29,3) | 7,03 (2,34; 23,19) | ||
Sekukinumabi, suuri annos vs. etanersepti | 27/40 (67,5) | 12/41 (29,3) | 5,32 (1,82; 16,75) | ||
Viikon 52 kohdalla | |||||
PASI 75 | Sekukinumabi, pieni annos vs. etanersepti | 35/40 (87,5) | 28/41 (68,3) | 3,12 (0,91; 12,52) | |
Sekukinumabi, suuri annos vs. etanersepti | 35/40 (87,5) | 28/41 (68,3) | 3,09 (0,90; 12,39) | ||
IGA 0/1 | Sekukinumabi, pieni annos vs. etanersepti | 29/40 (72,5) | 23/41 (56,1) | 2,02 (0,73; 5,77) | |
Sekukinumabi, suuri annos vs. etanersepti | 30/40 (75,0) | 23/41 (56,1) | 2,26 (0,81; 6,62) | ||
PASI 90 | Sekukinumabi, pieni annos vs. etanersepti | 30/40 (75,0) | 21/41 (51,2) | 2,85 (1,02; 8,38) | |
Sekukinumabi, suuri annos vs. etanersepti | 32/40 (80,0) | 21/41 (51,2) | 3,69 (1,27; 11,61) | ||
* Arvojen puuttuminen tulkittiin siten, että vastetta ei saatu. ** n = vasteen saaneiden lukumäärä, m = arvioitavissa olevien potilaiden lukumäärä *** Laajennettu käynnin aikaikkuna viikon 12 kohdalla. Ristitulosuhde, 95 % luottamusväli ja p-arvo perustuvat eksaktiin logistiseen regressiomalliin, jossa tekijöitä olivat hoitoryhmä, lähtötilanteen painoluokka ja ikäluokka. | |||||
Terveyteen liittyvän elämänlaadun paranemista (mittarina CDLQI-pistemäärä 0 tai 1) ilmoitettiin suuremmalla määrällä sekukinumabia saaneista pediatrisista potilaista kuin lumelääkettä saaneista viikon 12 kohdalla (pienen annoksen ryhmässä 44,7 %, suuren annoksen ryhmässä 50 % ja lumelääkeryhmässä 15 %). Molemmat sekukinumabiannosryhmät olivat 52 viikon ajan numeerisesti suurempia kuin etanerseptiryhmä (pienen annoksen ryhmä 60,6 %, suuren annoksen ryhmä 66,7 % ja etanerseptiryhmä 44,4 %).
Keskivaikea tai vaikea läiskäpsoriaasi
Sekukinumabin ennakoitiin olevan tehokas pediatristen potilaiden keskivaikean läiskäpsoriaasin hoidossa aikuispotilaiden keskivaikean ja vaikean läiskäpsoriaasin hoidossa osoitetun tehon ja altistus-vastesuhteen perusteella ja koska taudinkulku, patofysiologia ja lääkkeen vaikutus ovat samojen altistustasojen osalta aikuisilla ja pediatrisilla potilailla samankaltaiset.
Lisäksi sekukinumabin tehoa ja turvallisuutta arvioitiin avoimessa, kaksiryhmäisessä, rinnakkaisryhmillä toteutetussa vaiheen III monikeskustutkimuksessa 6 – < 18-vuotiailla keskivaikeaa tai vaikeaa läiskäpsoriaasia (PASI-arvo ≥ 12, IGA mod 2011‑arvo ≥ 3 ja oireiden kattavuus ≥ 10 % ihon pinta-alasta) sairastavilla pediatrisilla potilailla, joille harkittiin systeemistä hoitoa.
Pediatrisessa psoriaasitutkimuksessa 2 arvioitiin 84 potilasta, jotka satunnaistettiin saamaan pieniannoksista sekukinumabia (75 mg < 50 kg painaville ja 150 mg ≥ 50 kg painaville) tai suuriannoksista sekukinumabia (75 mg < 25 kg painaville, 150 mg ≥ 25 kg – < 50 kg painaville ja 300 mg ≥ 50 kg painaville) viikoilla 0, 1, 2, 3 ja 4 ja tämän jälkeen samaa annosta 4 viikon välein. Potilaiden paino- ja ikäjakauma satunnaistamisvaiheessa on esitetty taulukossa 16.
Taulukko 16 Potilaiden paino- ja ikäjakauma pediatrisessa psoriaasitutkimuksessa 2
Alaryhmät | Kuvaus | Sekukinumabi, pieni annos n = 42 | Sekukinumabi, suuri annos n = 42 | Yhteensä N = 84 |
Ikä | 6 – < 12 v | 17 | 16 | 33 |
≥ 12 – < 18 v | 25 | 26 | 51 | |
Paino | < 25 kg | 4 | 4 | 8 |
≥ 25 – < 50 kg | 13 | 12 | 25 | |
≥ 50 kg | 25 | 26 | 51 |
Rinnakkaisia ensisijaisia päätemuuttujia olivat niiden potilaiden osuus, jotka saavuttivat PASI 75 ‑vasteen ja IGA mod 2011 ‑asteikon mukaisen tuloksen oireeton tai lähes oireeton (0 tai 1) viikon 12 kohdalla.
Sekukinumabin pienen annoksen ja suuren annoksen teho oli samankaltainen ja rinnakkaisten ensisijaisten päätemuuttujien osalta tilastollisesti merkitsevästi parempi kuin vertailuna käytetty historiallinen lumelääkevaste. Positiivisen hoitovaikutuksen arvioitu posteriorinen todennäköisyys oli 100 %.
Tehoa seurattiin potilailla 52 viikon ajan ensimmäisen antokerran jälkeen. Teho (määritelmä PASI 75 ‑vaste ja IGA mod 2011 ‑tulos oireeton tai lähes oireeton [0 tai 1]) havaittiin jo ensimmäisellä lähtötilanteen jälkeisellä käynnillä viikon 2 kohdalla, ja PASI 75 ‑vasteen ja IGA mod 2011 ‑tuloksen oireeton tai lähes oireeton (0 tai 1) saavuttaneiden potilaiden osuus suureni 24 viikon ajanjakson ajan säilyen viikolle 52 asti. Myös PASI 90- ja PASI 100 ‑vasteiden lisääntymistä havaittiin viikon 12 kohdalla, ja lisääntyminen jatkui 24 viikon ajanjakson ajan säilyen viikolle 52 asti (ks. taulukko 17).
Pienen annoksen ja suuren annoksen turvallisuusprofiilit olivat samankaltaiset ja yhdenmukaiset aikuisten turvallisuusprofiilin kanssa.
Taulukko 17 Yhteenveto kliinisestä vasteesta keskivaikean ja vaikean pediatrisen psoriaasin hoidossa viikkojen 12 ja 52 kohdalla (pediatrinen psoriaasitutkimus 2)*
Viikko 12 | Viikko 52 | |||
Sekukinumabi, pieni annos | Sekukinumabi, suuri annos | Sekukinumabi, pieni annos | Sekukinumabi, suuri annos | |
Potilasmäärä | 42 | 42 | 42 | 42 |
PASI 75 ‑vaste n (%) | 39 (92,9 %) | 39 (92,9 %) | 37 (88,1 %) | 38 (90,5 %) |
IGA mod 2011 ‑tulos oireeton tai lähes oireeton n (%) | 33 (78,6 %) | 35 (83,3 %) | 36 (85,7 %) | 35 (83,3 %) |
PASI 90 ‑vaste n (%) | 29 (69 %) | 32 (76,2 %) | 32 (76,2 %) | 35 (83,3 %) |
PASI 100 ‑vaste n (%) | 25 (59,5 %) | 23 (54,8 %) | 22 (52,4 %) | 29 (69,0 %) |
* Arvojen puuttuminen tulkittiin siten, että vastetta ei saatu. | ||||
Tulokset pediatristen potilaiden keskivaikean ja vaikean läiskäpsoriaasin hoidossa vahvistivat edellä mainittuja ennakko-oletuksia, jotka perustuivat aikuispotilaiden hoidossa osoitettuun tehoon ja altistus-vastesuhteeseen.
Pienen annoksen ryhmässä CDLQI-pistemäärän 0 tai 1 saavutti viikon 12 kohdalla 50 % potilaista ja viikon 52 kohdalla 70,7 % potilaista. Suuren annoksen ryhmässä CDLQI-pistemäärän 0 tai 1 saavutti viikon 12 kohdalla 61,9 % potilaista ja viikon 52 kohdalla 70,3 % potilaista.
Juveniili idiopaattinen artriitti (JIA)
Entesiitteihin liittyvä artriitti (ERA) ja juveniili nivelpsoriaasi (JPsA)
Sekukinumabin tehoa ja turvallisuutta arvioitiin kolmiosaisessa, kaksoisokkoutetussa, lumekontrolloidussa, tapahtumalähtöisessä, satunnaistetussa vaiheen III tutkimuksessa 86 potilaalla (ikä 2 – < 18 vuotta), joilla oli aktiivinen entesiitteihin liittyvä artriitti (ERA) tai juveniili nivelpsoriaasi (JPsA). Diagnoosi perustui juveniilia idiopaattista artriittia (JIA) koskeviin muokattuihin International League of Associations for Rheumatology (ILAR) -liiton luokittelukriteereihin. Tutkimukseen kuului avoin osio (osa 1), jossa kaikki potilaat saivat sekukinumbia viikolle 12 saakka. Potilaat, joilla todettiin JIA ACR 30 -vaste viikolla 12, siirtyivät osaan 2 kaksoissokkoutettuun vaiheeseen. Siinä heidät satunnaistettiin suhteessa 1:1 jatkamaan sekukinumabihoitoa tai saamaan lumehoitoa (hoidon satunnaistettu lopettaminen) viikolle 104 saakka tai pahenemisvaiheen puhkeamiseen saakka. Potilaat, joilla esiintyi pahenemisvaihe, siirtyivät avoimeen tutkimukseen (osa 3) saamaan sekukinumabihoitoa viikolle 104 saakka.
Potilaiden JIA-alatyypit tutkimukseenottovaiheessa olivat seuraavanlaiset: 60,5 %:lla oli ERA ja 39,5 %:lla JPsA, ja vähintään yksi taudin etenemiseen vaikuttava reumalääke tai vähintään yksi tulehduskipulääke oli joko tuottanut riittämättömän vasteen tai ollut huonosti siedetty. Lähtötilanteessa metotreksaatin käyttöä ilmoitettiin 65,1 %:lla potilaista; (63,5 %:lla [33/52] ERA-potilaista ja 67,6 %:lla [23/34] JPsA-potilaista). Samanaikaista sulfasalatsiinihoitoa sai 12 ERA-potilasta 52:sta (23,1 %). Lähtötilanteessa < 50 kg painaneet potilaat (n = 30) saivat 75 mg:n annoksen ja ≥ 50 kg painaneet potilaat (n = 56) 150 mg:n annoksen. Ikä oli lähtötilanteessa 2–17 vuotta; 3 potilasta oli 2 – < 6-vuotiaita, 22 potilasta 6 – < 12-vuotiaita ja 61 potilasta 12 – < 18-vuotiaita. Lähtötilanteen JADAS-27-pistemäärä (Juvenile Arthritis Disease Activity Score) oli 15,1 (keskihajonta: 7,1).
Ensisijainen päätetapahtuma oli pahenemisvaiheen puhkeamiseen kulunut aika hoidon satunnaistetussa lopettamisvaiheessa (osa 2). Taudin pahenemisvaiheen määritelmänä oli ≥ 30 % pahenema vähintään kolmen JIA ACR -vastekriteerin osalta kuudesta ja ≥ 30 % paranema enintään yhden JIA ACR -vastekriteerin osalta kuudesta ja vähintään kaksi aktiivista niveltä.
Osan 1 lopussa 75 potilaalla 86:sta (87,2 %) esiintyi JIA ACR 30 -vaste, ja he siirtyivät osaan 2.
Tutkimuksessa saavutettiin ensisijainen päätetapahtuma, sillä taudin pahenemisvaiheen puhkeamiseen kulunut aika osassa 2 oli tilastollisesti merkitsevästi pidempi sekukinumabihoitoa saaneilla kuin lumehoitoa saaneilla. Pahenemisvaiheen puhkeamisriski oli tutkimuksen osassa 2 sekukinumabia saaneilla 72 % pienempi kuin lumehoitoa saaneilla (riskitiheyssuhde = 0,28, 95 % lv: 0,13–0,63, p < 0,001) (kuva 4 ja taulukko 18). Osassa 2 pahenemisvaihe esiintyi kaikkiaan 21:llä lumehoitoa saaneista (11 JPsA-potilaalla ja 10 ERA-potilaalla) ja 10:llä sekukinumabia saaneista (4 JPsA-potilaalla ja 6 ERA-potilaalla).
Kuva 4 Kaplan–Meier-estimaatit taudin pahenemisvaiheen puhkeamiseen kuluvasta ajasta tutkimuksen osassa 2
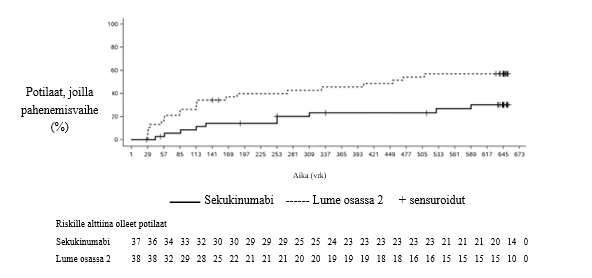
Taulukko 18 Elossaoloanalyysi taudin pahenemisvaiheeseen kuluneen ajan osalta – tutkimuksen osa 2
Sekukinumabi (N = 37) | Lumelääke tutkimuksen osassa 2 (N = 38) | |
Pahenemisvaiheiden määrä tutkimuksen osan 2 lopussa, n (%) | 10 (27,0) | 21 (55,3) |
Kaplan–Meier-estimaatit: | ||
Mediaani, vrk (95 % lv) | NC (NC, NC) | 453,0 (114,0; NC) |
Osuus potilaista, joilla ei pahenemisvaiheita 6 kk kohdalla (95 % lv) | 85,8 (69,2, 93,8) | 60,1 (42,7, 73,7) |
Osuus potilaista, joilla ei pahenemisvaiheita 12 kk kohdalla (95 % lv) | 76,7 (58,7, 87,6) | 54,3 (37,1, 68,7) |
Osuus potilaista, joilla ei pahenemisvaiheita 18 kk kohdalla (95 % lv) | 73,2 (54,6, 85,1) | 42,9 (26,7, 58,1) |
Riskitiheyssuhde vs. lume: Estimaatti (95 % lv) | 0,28 (0,13, 0,63) | |
Stratifioidun log-rank-testin p-arvo | < 0,001** | |
Analyysi tehtiin kaikkien sellaisten satunnaistettujen potilaiden osalta, jotka saivat vähintään yhden annoksen tutkimuslääkettä tutkimuksen osassa 2. Sekukinumabi: kaikki potilaat, jotka eivät saaneet lainkaan lumetta. Lume tutkimuksen osassa 2: kaikki potilaat, jotka saivat lumetta tutkimuksen osassa 2 ja sekukinumabia tutkimuksen muussa vaiheessa / muissa vaiheissa. NC = Ei laskettavissa (non calculable). ** = Tilastollinen merkitsevyys yksitahoisella 0,025:n merkitsevyystasolla. | ||
Tutkimuksen avoimessa osassa 1 kaikki potilaat saivat sekukinumbia viikolle 12 saakka. Viikolla 12 JIA ACR 50 -vasteen saavutti 83,7 % lapsista, JIA ACR 70 -vasteen 67,4 % lapsista ja JIA ACR 90 ‑vasteen 38,4 % lapsista (kuva 5). Sekukinumabin vaikutus alkoi jo viikolla 1. Viikolla 12 JADAS-27-pistemäärä oli 4,64 (keskihajonta: 4,73). JADAS-27-pisteiden keskiarvon lasku lähtötilanteesta oli -10,487 (keskihajonta: 7,23).
Kuva 5Tutkittavien JIA ACR 30/50/70/90 -vaste viikkoon 12 mennessä tutkimuksen osassa 1*
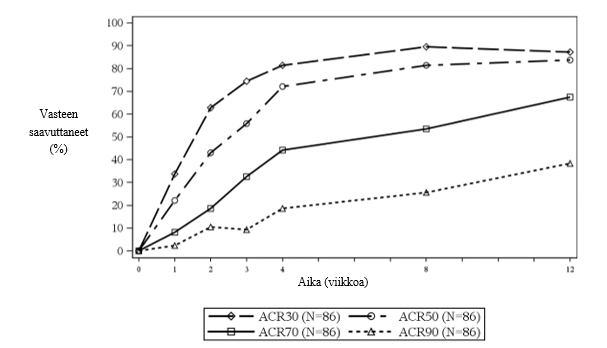
* Arvojen puuttuminen tulkittiin siten, että vastetta ei saatu.
Tiedot 2 - < 6-vuotiaiden ikäryhmästä ovat epävarmoja, koska tutkimukseen osallistui vähäinen määrä alle 6-vuotiaita potilaita.
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Cosentyx-valmisteen käytöstä vastasyntyneistä alle 6-vuotiaisiin ulottuvien pediatristen potilasryhmien läiskäpsoriaasin hoidossa ja vastasyntyneistä alle 2-vuotiaisiin ulottuvien pediatristen potilasryhmien kroonisen idiopaattisen artriitin hoidossa (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Useimmat havaitut farmakokineettiset ominaisuudet olivat samankaltaiset sekä läiskäpsoriaasissa, nivelpsoriaasissa että selkärankareumassa.
Imeytyminen
Terveille vapaaehtoisille nestemäisenä lääkemuotona ihon alle annetun 300 mg:n kerta-annoksen jälkeen sekukinumabin huippupitoisuus seerumissa oli 43,2 ± 10,4 mikrog/ml, kun annoksen antamisesta oli kulunut 2⎼ 14 vuorokautta.
Populaatiofarmakokineettisen analyysin perusteella läiskäpsoriaasipotilaille kerta-annoksena ihon alle annetun 150 mg:n annoksen jälkeen sekukinumabin huippupitoisuus seerumissa oli 13,7 ± 4.8 mikrog/ml ja 300 mg:n annoksen jälkeen 27,3 ± 9,5 mikrog/ml, kun annoksen antamisesta oli kulunut 5⎼ 6 vuorokautta.
Populaatiofarmakokineettisen analyysin perusteella ensimmäisen kuukauden aikana annettujen aloitusvaiheen viikoittaisten annosten jälkeen aika maksimipitoisuuden saavuttamiseen oli 31‑34 vuorokautta.
Simuloidun tiedon perusteella vakaan tilan huippupitoisuus (Cmax,ss) ihon alle annetun 150 mg:n annoksen jälkeen oli 27,6 mikrog/ml ja 300 mg:n annoksen jälkeen 55,2 mikrog/ml. Populaatiofarmakokineettinen analyysi viittaa siihen, että vakaa tila saavutetaan 20 viikon kuluttua, kun käytetään kuukausittain annettavia annoksia.
Populaatiofarmakokineettinen analyysi osoitti, että ylläpitohoidon aikana kuukausittain annetun lääkkeen huippupitoisuus seerumissa ja pitoisuuspinta-ala (AUC) suurenivat kaksinkertaisiksi verrattuna kerta-annoksen jälkeen potilailla todettuun altistukseen.
Populaatiofarmakokineettinen analyysi osoitti, että sekukinumabi imeytyi siten, että sen absoluuttinen biologinen hyötyosuus läiskäpsoriaasipotilailla oli keskimäärin 73 %. Kaikissa tutkimuksissa laskettiin absoluuttisen biologisen hyötyosuuden arvoja, jotka olivat 60⎼77 %.
Populaatiofarmakokineettisen mallin perusteella sekukinumabin hyötyosuus nivelpsoriaasipotilailla oli 85 %.
Yksittäisen 300 mg esitäytetyllä ruiskulla annetun ihonalaisen injektion systeeminen sekukinumabialtistus läiskäpsoriaasipotilailla oli samanlainen kuin aiemmin kahdella 150 mg injektiolla havaittu.
Kun ihon alle annettiin sekukinumabia 300 mg viikoilla 0, 1, 2, 3 ja 4 ja sen jälkeen 300 mg 2 viikon välein, vakaan tilan minimipitoisuuden keskiarvo ± keskihajonta viikolla 16 oli noin 55,1 ± 26,7 mikrog/ml HS‑tutkimuksessa 1 ja 58,1 ± 30,1 mikrog/ml HS‑tutkimuksessa 2.
Jakautuminen
Läiskäpsoriaasipotilailla kerta-annoksena laskimoon annon jälkeen keskimääräinen loppuvaiheen jakautumistilavuus (Vz) oli 7,10⎼8,60 litraa, mikä viittaa siihen, että sekukinumabi jakautuu vain vähäisessä määrin kehon ääreisosiin.
Biotransformaatio
Suurin osa IgG:stä poistuu solunsisäisen pilkkoutumisen kautta nestefaasin tai reseptorivälitteisen endosytoosin jälkeen.
Eliminaatio
Läiskäpsoriaasipotilailla kerta-annoksena laskimoon annon jälkeen keskimääräinen systeeminen puhdistuma (CL) oli 0,13⎼0,36 l/vrk. Populaatiofarmakokineettisessä analyysissä keskimääräinen systeeminen puhdistuma (CL) läiskäpsoriaasipotilailla oli 0,19 l/vrk. Sukupuoli ei vaikuttanut systeemiseen puhdistumaan. Puhdistuma oli annoksesta ja ajasta riippuvainen.
Populaatiofarmakokineettisen analyysin perusteella arvioitu keskimääräinen eliminaation puoliintumisaika läiskäpsoriaasipotilailla oli 27 vuorokautta ja vaihteli 18:sta 46:een vuorokauteen psoriaasitutkimuksissa, joissa lääke annettiin laskimoon.
Populaatiofarmakokineettisessä analyysissä keskimääräinen systeeminen puhdistuma (CL) hidradenitis suppurativa ‑potilailla oli 0,26 l/vrk, kun heille oli annettu ihon alle sekukinumabia 300 mg viikoilla 0, 1, 2, 3 ja 4 ja sen jälkeen 300 mg 2 viikon välein.
Populaatiofarmakokineettisen analyysin perusteella arvioitu keskimääräinen eliminaation puoliintumisaika oli hidradenitis suppurativa ‑potilailla 23 vuorokautta.
Lineaarisuus/ei-lineaarisuus
Sekukinumabin yksittäisen ja toistuvien annosten farmakokinetiikkaa läiskäpsoriaasipotilailla selvitettiin useissa tutkimuksissa laskimoon annetuilla annoksilla, jotka vaihtelivat annoksesta 1 x 0,3 mg/kg annokseen 3 x 10 mg/kg, ja ihon alle annetuilla annoksilla, jotka vaihtelivat annoksesta 1 x 25 mg toistuviin 300 mg:n annoksiin. Altistus muuttui annoksen mukaan kaikilla annostuksilla.
Erityisryhmät
Iäkkäät potilaat
Pienellä iäkkäiden potilaiden populaatiolla (n = 71, ≥ 65-vuotiaat; n = 7, ≥ 75-vuotiaat) tehdyn populaatiofarmakokineettisen analyysin perusteella iäkkäiden ja alle 65-vuotiaiden potilaiden puhdistuma oli samankaltainen.
Potilaat, joilla on munuaisten tai maksan vajaatoiminta
Farmakokineettisiä tietoja ei ole saatavilla potilaista, joilla on munuaisten tai maksan vajaatoiminta. Sekukinumabi on monoklonaalinen IgG-vasta-aine ja pilkkoutumattoman sekukinumabin munuaispuhdistuman odotetaan olevan vähäistä ja vähämerkityksistä. IgG eliminoituu pääasiassa pilkkoutumisen kautta eikä maksan vajaatoiminnan odoteta vaikuttavan sekukinumabin puhdistumaan.
Painon vaikutus farmakokinetiikkaan
Sekukinumabin puhdistuma ja jakautumistilavuus kasvavat painon kasvaessa.
Pediatriset potilaat
Läiskäpsoriaasi
Kahden pediatrisen tutkimuksen poolissa keskivaikeaa tai vaikeaa läiskäpsoriaasia sairastaville potilaille (ikä 6 – < 18 v) annettiin sekukinumabia suositellun pediatrisen hoito-ohjelman mukaisesti. Viikon 24 kohdalla ≥ 25 kg – < 50 kg painavien potilaiden vakaan tilan minimipitoisuuksien keskiarvo ± keskihajonta oli 19,8 ± 6,96 mikrog/ml (n = 24) heidän saatuaan 75 mg sekukinumabia, ja ≥ 50 kg painavien potilaiden minimipitoisuuksien keskiarvo ± keskihajonta oli 27,3 ± 10,1 mikrog/ml (n = 36) heidän saatuaan 150 mg sekukinumabia. Alle 25 kg painavien potilaiden (n = 8) vakaan tilan minimipitoisuuksien keskiarvo ± keskihajonta oli viikon 24 kohdalla 32,6 ± 10,8 mikrog/ml 75 mg:n annoksen jälkeen.
Juveniili idiopaattinen artriitti
Pediatrisessa tutkimuksessa sekukinumabia annettiin entesiitteihin liittyvää artriittia tai juveniilia nivelpsoriaasia sairastaville potilaille (ikä 2 – < 18 v) suositellun pediatrisen hoito-ohjelman mukaisesti. Viikon 24 kohdalla < 50 kg painavien potilaiden vakaan tilan minimipitoisuuksien keskiarvo ± keskihajonta oli 25,2 ± 5,45 mikrog/ml (n = 10) ja ≥ 50 kg painavien potilaiden 27,9 ± 9,57 mikrog/ml (n = 19).
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta ja lisääntymistoksisuutta koskevien konventionaalisten tutkimusten tulokset tai kudosten ristireagointia koskevien tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille (aikuisille tai pediatrisille potilaille).
Eläimillä ei ole tehty tutkimuksia, joissa olisi arvioitu sekukinumabin karsinogeenisuutta.
Farmaseuttiset tiedot
Apuaineet
Trehaloosidihydraatti
Histidiini
Histidiinihydrokloridimonohydraatti
Metioniini
Polysorbaatti 80
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
2 vuotta
Tarvittaessa Cosentyx-valmistetta voidaan säilyttää kertaluonteisesti jääkaapin ulkopuolella, huoneenlämmössä (alle 30 °C) korkeintaan 4 päivää.
Säilytys
Säilytä jääkaapissa (2 °C - 8 °C). Ei saa jäätyä.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
COSENTYX injektioneste, liuos, esitäytetty kynä
150 mg (L:ei) 1 kpl (SensoReady-kynä, turvaneula, 1 ml (150 mg/ml)) (522,27 €)
300 mg (L:ei) 1 kpl (UnoReady-kynä, turvaneula, 2 ml (150 mg/ml)) (1012,07 €)
COSENTYX injektioneste, liuos, esitäytetty ruisku
150 mg (L:ei) 1 kpl (turvaneula, 1 ml (150 mg/ml)) (522,27 €)
PF-selosteen tieto
Cosentyx 150 mg injektioneste, liuos, esitäytetty ruisku
Cosentyx 150 mg injektioneste esitäytetty ruisku toimitetaan esitäytetyssä 1 ml:n lasiruiskussa, jossa on silikonilla päällystetty, bromobutyylikumista valmistettu männän pysäytin, kiinteä 27G x ½″ neula ja styreenibutadieenikuminen kova neulansuojus sekä polykarbonaatista valmistettu automaattinen neulanpistosuoja.
Cosentyx 150 mg injektioneste esitäytetty ruisku on saatavilla yksikköpakkauksissa, joissa on 1 tai 2 esitäytettyä ruiskua ja monipakkauksissa, joissa on 6 (3 kahden ruiskun pakkausta) esitäytettyä ruiskua.
Cosentyx 300 mg injektioneste, liuos, esitäytetty ruisku
Cosentyx 300 mg injektioneste esitäytetty ruisku toimitetaan esitäytetyssä 2,25 ml:n lasiruiskussa, jossa on silikonilla päällystetty, bromobutyylikumista valmistettu männän pysäytin, kiinteä 27G x ½″ neula ja synteettisestä polyisopreenikumista valmistettu kova neulansuojus sekä polykarbonaatista valmistettu automaattinen neulanpistosuoja.
Cosentyx 300 mg injektioneste esitäytetty ruisku on saatavilla yksikköpakkauksissa, joissa on 1 esitäytetty ruisku ja monipakkauksissa, joissa on 3 (3 yhden ruiskun pakkausta) esitäytettyä ruiskua.
Cosentyx 150 mg injektioneste, liuos, esitäytetty kynä
Cosentyx 150 mg injektioneste esitäytetty kynä toimitetaan kertakäyttöön tarkoitetussa esitäytetyssä ruiskussa, joka on koottu kolmionmuotoiseksi kynäksi, jossa on läpinäkyvä ikkuna ja etiketti. Kynän sisällä oleva esitäytetty ruisku on 1 ml:n lasiruisku, jossa on silikonilla päällystetty, bromobutyylikumista valmistettu männän pysäytin, kiinteä 27G x ½″ neula ja styreenibutadieenikuminen kova neulansuojus.
Cosentyx 150 mg injektioneste esitäytetty kynä on saatavilla yksikköpakkauksissa, joissa on 1 tai 2 esitäytettyä kynää ja monipakkauksissa, joissa on 6 (3 kahden kynän pakkausta) esitäytettyä kynää.
Cosentyx 300 mg injektioneste, liuos, esitäytetty kynä
Cosentyx 300 mg injektioneste esitäytetty kynä toimitetaan kertakäyttöön tarkoitetussa esitäytetyssä ruiskussa, joka on koottu neliönmuotoiseksi kynäksi, jossa on läpinäkyvä ikkuna ja etiketti. Kynän sisällä oleva esitäytetty ruisku on 2,25 ml:n lasiruisku, jossa on silikonilla päällystetty, bromobutyylikumista valmistettu männän pysäytin, kiinteä 27G x ½″ neula ja synteettisestä polyisopreenikumista valmistettu kova neulansuojus.
Cosentyx 300 mg injektioneste esitäytetty kynä on saatavilla yksikköpakkauksissa, joissa on yksi esitäytetty kynä ja monipakkauksissa, joissa on 3 (3 yhden kynän pakkausta) esitäytettyä kynää.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Liuos on kirkas ja väritön tai hieman kellertävä neste.
Käyttö- ja käsittelyohjeet
Cosentyx 150 mg injektioneste esitäytetyssä ruiskussa
Cosentyx 150 mg injektioneste toimitetaan kerta-antoon tarkoitetussa esitäytetyssä ruiskussa, joka on tarkoitettu henkilökohtaiseen käyttöön. Ota ruisku jääkaapista 20 minuuttia ennen pistämistä ja anna sen lämmetä huoneenlämpöiseksi.
Cosentyx 300 mg injektioneste esitäytetyssä ruiskussa
Cosentyx 300 mg injektioneste toimitetaan kerta-antoon tarkoitetussa esitäytetyssä ruiskussa, joka on tarkoitettu henkilökohtaiseen käyttöön. Ota ruisku jääkaapista 30-45 minuuttia ennen pistämistä ja anna sen lämmetä huoneenlämpöiseksi.
Cosentyx 150 mg injektioneste esitäytetyssä kynässä
Cosentyx 150 mg injektioneste toimitetaan kerta-antoon tarkoitetussa esitäytetyssä kynässä, joka on tarkoitettu henkilökohtaiseen käyttöön. Ota kynä jääkaapista 20 minuuttia ennen pistämistä ja anna sen lämmetä huoneenlämpöiseksi.
Cosentyx 300 mg injektioneste esitäytetyssä kynässä
Cosentyx 300 mg injektioneste toimitetaan kerta-antoon tarkoitetussa esitäytetyssä kynässä, joka on tarkoitettu henkilökohtaiseen käyttöön. Ota kynä jääkaapista 30-45 minuuttia ennen pistämistä ja anna sen lämmetä huoneenlämpöiseksi.
Esitäytetty ruisku tai kynä tulisi tarkistaa silmämääräisesti ennen käyttöä. Nesteen pitää olla kirkasta. Väri voi vaihdella värittömästä hieman kellertävään. Saatat havaita pienen ilmakuplan, mikä on normaalia. Älä käytä, jos neste sisältää selvästi näkyviä hiukkasia, on sameaa tai selvästi ruskeaa.
Yksityiskohtaiset käyttöohjeet on kerrottu pakkausselosteessa.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
COSENTYX injektioneste, liuos, esitäytetty kynä
150 mg 1 kpl
300 mg 1 kpl
COSENTYX injektioneste, liuos, esitäytetty ruisku
150 mg 1 kpl
- Alempi erityiskorvaus (65 %). Abatasepti, adalimumabi, bimekitsumabi, etanersepti, golimumabi, guselkumabi, iksekitsumabi, infliksimabi, risankitsumabi, sarilumabi, sekukinumabi, sertolitsumabipegoli ja tosilitsumabi (tulehdukselliset reumasairaudet): Nivelreuman, juveniilin polyartriitin, psoriaasiin liittyvän niveltulehduksen, selkärankareuman tai edellä mainittuja niveltulehduksia läheisesti muistuttavan niveltulehduksen hoito erityisin edellytyksin / Tosilitsumabi: Aktiivisen yleisoireisen lastenreuman hoito erityisin edellytyksin (281).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Abatasepti, adalimumabi, bimekitsumabi, etanersepti, golimumabi, guselkumabi, iksekitsumabi, infliksimabi, risankitsumabi, sarilumabi, sekukinumabi, sertolitsumabipegoli, tosilitsumabi ja ustekinumabi (tulehdukselliset reumasairaudet): Eräiden reumasairauksien hoito erityisin edellytyksin / Adalimumabi: Uveiitin hoito erityisin edellytyksin / Tosilitsumabi: Aktiivisen yleisoireisen lastenreuman ja jättisoluarteriitin hoito erityisin edellytyksin (313), Adalimumabi, bimekitsumabi, brodalumabi, etanersepti, guselkumabi, iksekitsumabi, infliksimabi, risankitsumabi, sekukinumabi, sertolitsumabipegoli, tildrakitsumabi ja ustekinumabi (ihopsoriaasi): Vaikean kroonisen ihopsoriaasin hoito erityisin edellytyksin (319), Adalimumabi ja sekukinumabi: Keskivaikean ja vaikean aktiivisen hidradenitis suppurativan hoito erityisin edellytyksin (380).
ATC-koodi
L04AC10
Valmisteyhteenvedon muuttamispäivämäärä
16.10.2025
Yhteystiedot
 NOVARTIS FINLAND OY
NOVARTIS FINLAND OY Revontulenkuja 1
02100 Espoo
010 613 3200
www.novartis.fi
Lääkeinformaatiopalvelu 010 6133 210,
medinfo.nordics@novartis.com
