LEUPRORELIN SANDOZ implantaatti, esitäytetty ruisku 5 mg
Vaikuttavat aineet ja niiden määrät
Yksi implantaatti sisältää 5 mg leuproreliinia (leuproreliiniasetaattina).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Implantaatti, esitäytetty ruisku.
Kliiniset tiedot
Käyttöaiheet
- Pitkälle edennyttä hormoniriippuvaista eturauhaskarsinoomaa sairastavien potilaiden palliatiivinen hoito.
- Paikallisesti edenneen hormoniriippuvaisen eturauhassyövän hoito sädehoidon aikana ja sen jälkeen.
- Paikallisen hormoniriippuvaisen eturauhassyövän hoito kohtalaisen ja suuren riskin potilailla yhdistettynä sädehoitoon.
Annostus ja antotapa
Annostus
Tuumorien hoitoon perehtyneen lääkärin on vahvistettava hoidon indikaatio ja seurattava pitkäaikaista hoitoa.
Suositeltava annos on 5 mg:n kerta-annos Leuprorelin Sandozia 3 kuukauden välein.
Useimmilla potilailla hoitoteho ei vaarannu, jos antopäivää poikkeustapauksessa lykätään enintään 4 viikolla (ks. kohta Farmakokinetiikka).
Erityisryhmät
Annosta ei ole tarpeen muuttaa munuaisten tai maksan vajaatoimintaa sairastavilla potilailla eikä ikääntyneillä potilailla.
Pediatriset potilaat
Leuprorelin Sandoz on vasta-aiheinen lapsilla ja nuorilla, ks. kohta Vasta-aiheet.
Leuprorelin Sandoz -valmistetta voidaan käyttää neoadjuvantti- tai adjuvanttihoitona yhdessä sädehoidon kanssa paikallisesti edenneen hormoniherkän eturauhassyövän sekä paikallisen eturauhassyövän hoitoon kohtalaisen ja suuren riskiprofiilin potilailla.
Antotapa
Ainoastaan asiaan perehtyneiden terveydenhuollon ammattilaisten tulee valmistella ja antaa Leuprorelin Sandoz -valmiste.
Yksi implantaatti injektoidaan ihon alle vatsanpeitteiden anterioriseen seinämään. Ennen injektion antamista voidaan käyttää paikallispuudutusta.
Antiandrogeenin anto on suositeltavaa aloittaa adjuvanttihoitona noin 5 päivää ennen Leuprorelin Sandoz -hoidon aloittamista (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
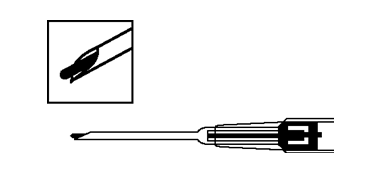
Käyttöohjeet:
Lue ohjeet huolellisesti, sillä asetin voi olla erilainen kuin aiemmin käyttämäsi.
1. Desinfioi injektiokohta, joka sijaitsee vatsanpeitteissä anteriorisesti napalinjan alapuolella.
2. Ota asetin steriilistä pussista ja tarkista, että implantaatti näkyy säiliössä (ks. rajattu kohta). Tee tämä tarkastelemalla asetinta valoa vasten tai ravistamalla sitä kevyesti.
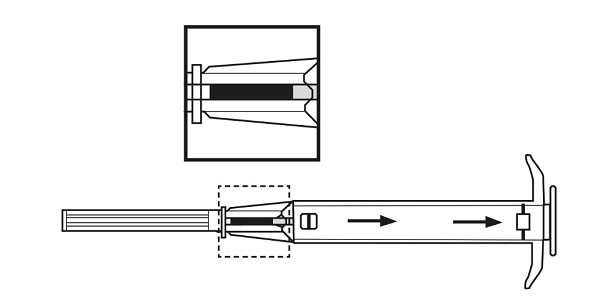
3. Vedä asettimen mäntä kokonaan ulos, kunnes toisessa ikkunassa näkyy yhtenäinen viiva.
Huomaa: Mäntää voi painaa ja implantaatin injektoida vain, jos mäntä on ensin vedetty kokonaan ulos.
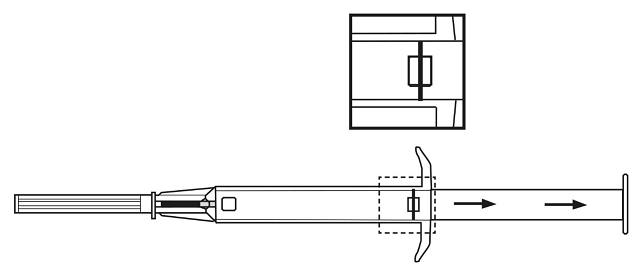
4. Poista neulan suojakorkki.
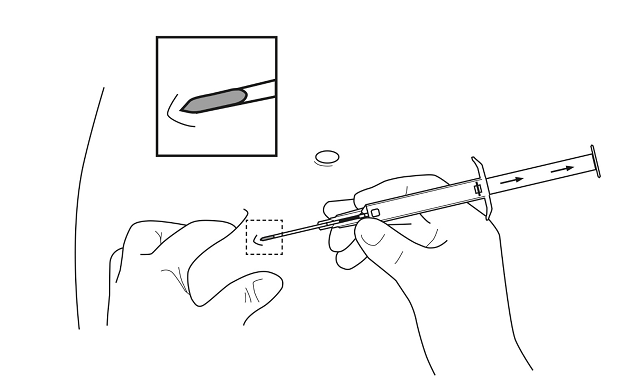
5. Pitele asettimen runkoa yhdellä kädellä. Purista toisella kädellä potilaan anterioristen vatsanpeitteiden ihoon poimu napalinjan alapuolelle. Ks. kuva. Pitele asetinta siten, että neulan aukko on ylöspäin, ja vie koko neula ihoon. Vie neula subkutaaniseen kudokseen hieman vinosti, lähes ihon suuntaisesti.
6. Vedä asetinta varovasti noin 1 cm taaksepäin. Näin implantaatille muodostuu pistokanava.
7. Injektoi implantaatti pistokanavaan painamalla mäntä kokonaan alas, kunnes se napsahtaa paikalleen.
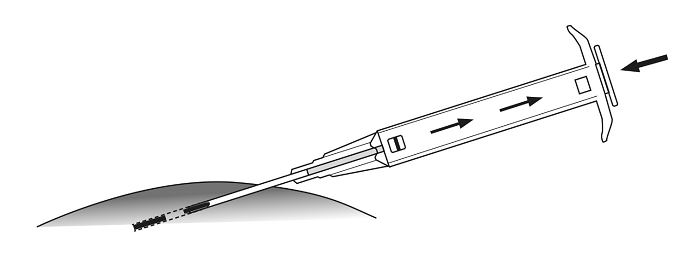
8. Vedä neula ulos. Tarkista, että neulan kärjessä näkyy männän vaaleansininen kärki, jotta voit varmistaa, että implantaatti on injektoitu oikein.
Seerumin PSA- ja kokonaistestosteronitasot on mitattava Leuprorelin Sandoz -hoidon alussa ja 3 kuukauden käytön jälkeen. Eturauhaskarsinooma on androgeeniherkkä, kun testosteronipitoisuudet ovat kastraatiotasolla (≤ 0,5 ng/ml) 3 kuukauden jälkeen ja PSA-arvo on laskenut. Varhainen huomattava PSA-arvon lasku (noin 80 % lähtötilanteen arvosta) on hyvä androgeenideprivaation pitkän aikavälin vasteen ennusteindikaattori. Hormoniablaatiohoito (esim. Leuprorelin Sandoz) on siinä tapauksessa indisoitua.
Jos PSA-arvot pysyvät ennallaan tai nousevat potilailla, joiden testosteronitaso on alhainen, eturauhaskarsinooma ei ole herkkä androgeeneille. Hormoniablaatiohoitoa ei siinä tapauksessa ole aiheellista jatkaa.
Jos potilaalla on kuitenkin havaittu kliininen vaste (esim. kipu- ja dysuriaoireiden paraneminen, eturauhasen koon pieneneminen), tulosta on pidettävä vääränä negatiivisena. Näissä harvinaisissa tapauksissa Leuprorelin Sandoz -hoitoa on jatkettava vielä 3 kuukauden ajan, minkä jälkeen PSA-arvo on mitattava uudelleen. Potilasta on lisäksi seurattava erittäin huolellisesti kliinisten oireiden osalta.
Pitkälle edenneen, hormoniriippuvaisen eturauhaskarsinooman hoito Leuprorelin Sandoz -valmisteella on yleensä pitkäkestoista.
Kliinisissä tutkimuksissa on osoitettu, että paikallisesti edenneen hormoniherkän eturauhassyövän hoidossa yhdessä sädehoidon kanssa androgeenideprivaatiohoitoa on parempi jatkaa 3 vuoden ajan kuin 6 kuukauden ajan (ks. kohta Farmakodynamiikka). Kliinisten hoitosuositusten mukainen androgeenideprivaatiohoidon kesto sädehoitoa saavilla T3–T4-potilailla on 2–3 vuotta.
Paikallista eturauhassyöpää sairastavilla kohtalaisen riskiprofiilin potilailla sädehoidon ja LHRH-agonisteilla toteutettavan androgeenideprivaatiohoidon yhdistelmää on suositeltavaa jatkaa 4–6 kuukauden ajan ja suuren riskiprofiilin potilailla 2–3 vuoden ajan.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille tai muille LHRH-analogeille.
Tilanteet, joissa karsinooman on vahvistettu olevan hormoneista riippumaton.
Leuprorelin Sandoz on vasta-aiheinen naisilla ja pediatrisilla potilailla.
Varoitukset ja käyttöön liittyvät varotoimet
Potilaita, joilla on hypertensio, on tarkkailtava huolellisesti.
Potilailla, joita hoidetaan LHRH-agonisteilla, kuten Leuprorelin Sandozilla, on suurentunut riski sairastua masennukseen (joka voi olla vakava). Potilaille pitää kertoa riskistä ja heidän tulee saada asianmukaista hoitoa, jos oireita ilmenee.
Allergisia ja anafylaktisia reaktioita on havaittu sekä injektiokohdassa että systeemisinä oireina.
Leuproreliiniasetaattihoitoa saaneilla potilailla on havaittu valmisteen markkinoille tulon jälkeen kouristuskohtauksia, riippumatta siitä, oliko epilepsiaa, kouristuskohtauksia tai altistavia tekijöitä aiemmin.
Kirurgisen kastraation jälkeen Leuprorelin Sandoz ei alenna seerumin testosteronipitoisuuksia enempää.
Seerumin testosteronipitoisuus nousee lyhyeksi ajaksi hoidon alussa, mikä voi tilapäisesti pahentaa sairauden joitakin oireita. Potilaita, joilla on neurologisten komplikaatioiden riski, selkärangan metastaaseja ja virtsatietukos, tulisi valvoa jatkuvasti ensimmäisten hoitoviikkojen aikana mieluiten sairaalahoidossa.
Sopivan antiandrogeenin antamista hoidon alkuvaiheessa on harkittava testosteronitason alkuvaiheen nousun mahdollisesti aiheuttamien seurausten ja kliinisten oireiden pahenemisen välttämiseksi.
Hoidon onnistumista on seurattava säännöllisesti (ja etenkin siinä tapauksessa, että sairauden etenemisestä on näyttöä asianmukaisesta hoidosta huolimatta) kliinisten tutkimusten avulla (eturauhasen sormitunnustelu peräsuolen kautta, ultraääni, luuston skintigrafia, tietokonetomografia) ja tarkistamalla fosfataasin ja/tai prostataspesifisen antigeenin (PSA) ja seerumin testosteronin pitoisuudet.
Pitkäaikaiseen LHRH-analogihoitoon ja/tai kivesten poistoon liittyvä hypogonadismi voi johtaa osteoporoosiin ja luunmurtumariskin suurenemiseen. Osteoporoosin kehittyminen on voimakkaampaa kivesten poiston jälkeisten kortisolitasojen nousun vuoksi kuin LHRH-analogien annon vuoksi. Suuririskisten potilaiden luun demineralisaatiota voidaan estää antamalla lisäksi bisfosfonaattia.
Joillakin LHRH-analogihoitoa saaneilla potilailla on raportoitu glukoosinsietokyvyn muutoksia. Diabeetikkoja on seurattava erittäin huolellisesti Leuprorelin Sandoz -hoidon aikana.
Androgeenideprivaatiohoito voi pidentää QT-aikaa.
Lääkärin on punnittava hoidon hyöty-riskisuhdetta (mukaan lukien torsades de pointes), ennen Leuprorelin Sandoz –hoidon aloittamista potilailla, joilla on pidentyneen QT-ajan riskitekijöitä ja potilailla, jotka käyttävät samanaikaisesti lääkkeitä, jotka voivat pidentää QT-aikaa (ks. kohta Yhteisvaikutukset).
Yhteisvaikutukset
Yhteisvaikutustutkimuksia ei ole tehty.
Koska androgeenideprivaatiohoito voi pidentää QT-aikaa, Leuprorelin Sandozin samanaikaista käyttöä tunnettujen QT-aikaa pidentävien tai torsades de pointesia indusoivien lääkkeiden (kuten ryhmän IA (esim. kinidiini, disopyramidi) tai ryhmän III (esim. amiodaroni, sotaloli, dofetilidi, ibutilidi) rytmihäiriölääkkeiden, metadonin, moksifloksasiinin, antipsykoottien jne. kanssa tulee huolellisesti harkita (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Raskaus ja imetys
Leuprorelin Sandoz on tarkoitettu käytettäväksi vain miespotilailla.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Tämä lääkevalmiste saattaa myös ohjeiden mukaisesti käytettynä heikentää reaktiokykyä siinä määrin, että ajokyky ja koneidenkäyttökyky heikkenee. Tämä johtuu joillakin potilailla esiintyvästä väsymyksestä etenkin hoidon alussa. Vaikutus saattaa johtua myös itse tuumorisairaudesta. Vaikutus on erityisen voimakas yhdessä alkoholin kanssa.
Haittavaikutukset
Seerumin testosteronitaso nousee yleensä lyhytaikaisesti hoidon alussa, mikä voi pahentaa eräitä sairauden oireita tilapäisesti (luukipu tai luukivun lisääntyminen, virtsatietukos ja sen seuraukset, luuydinkompressio, jalkojen lihasheikkous, imukudosturvotus). Tämä oireiden paheneminen palautuu yleensä spontaanisti ilman, että Leuprorelin Sandoz -hoitoa on tarpeen keskeyttää.
Sukupuolihormonien väheneminen voi aiheuttaa haittavaikutuksia.
Haittavaikutukset taulukkomuodossa:
Haittavaikutukset on esitetty elinjärjestelmän ja MedDRA-yleisyyden mukaisesti:
Hyvin yleinen: ≥ 1/10
Yleinen: ≥ 1/100, < 1/10
Melko harvinainen: ≥ 1/1 000, < 1/100
Harvinainen: ≥ 1/10 000, < 1/1 000
Hyvin harvinainen: < 1/10 000
Tuntematon: koska saatavissa oleva tieto ei riitä arviointiin
Hyvin yleinen | Yleinen | Melko harvinai-nen | Harvinainen | Hyvin harvinainen | Tuntematon | |
Immuuni-järjestelmä | yleiset allergiset reaktiot (kuume, kutina, eosinofilia, ihottuma) | anafylakti-set reaktiot | ||||
Aineen-vaihdunta ja ravitsemus | ruokahalun vähenemi-nen, ruokahalun lisäänty-minen | muutokset diabeteksen metabolisessa statuksessa (veren glukoosi-arvojen lasku tai nousu) | ||||
Psyykkiset häiriöt | Mielialan vaihtelut, masennus; unihäiriöt. | |||||
Hermosto | päänsärky, parestesia | kierto-huimaus, ohimenevä makuhäiriö | Kuten muiden tähän lääkeryhmään kuuluvien lääkkeiden kohdalla, hyvin harvinaisissa tapauksissa on raportoitu pituitaarista apopleksiaa annettaessa leuproreliinia ensimmäisen kerran potilaille, joilla on aivolisäkkeen adenooma. | kouristuskohtaukset | ||
Sydän | QT-ajan pitenemi-nen (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset) | |||||
Verisuonisto | kuumat aallot | veren-paineen muutokset (hyper-tensio tai hypo-tensio), tromboosi | ||||
Hengitys-elimet, rintakehä ja välikarsina | keuhko-embolia | Interstitiaa-linen keuhko-sairaus | ||||
Ruoansulatus-elimistö | pahoin-vointi/ oksentelu | ripuli | ||||
Iho ja ihonalainen kudos | ihon tai lima-kalvojen kuivumi-nen, yöllinen hikoilu | alopesia | ||||
Luusto, lihakset ja sidekudos | luukipu | nivel- ja/tai selkäkipu, lihasheik-kous | luun demineralisaatio (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). | |||
Munuaiset ja virtsatiet | tihentynyt virtsaamis-tarve yöllä, dysuria, pollakisuria | virtsaumpi | ||||
Sukupuoli-elimet ja rinnat | seksuaali-sen halun ja kyvyn heikkene-minen tai häviämi-nen, kivesten pienene-minen | gyneko-mastia | kiveskipu | |||
Yleisoireet ja antopaikassa todettavat haitat | lisääntynyt hikoilu; injektio-kohdan reaktiot, kuten punoitus, kipu, turvotus, kutina, jotka yleensä häviävät vaikka hoitoa jatketaan | väsymys, perifeerinen edeema | ||||
Tutkimukset | painonnousu | painonlasku, LDH-, trans-aminaasi- (ALAT, ASAT), gamma-GT- ja alkalisenfosfataasi-arvojen nousu, joka voi johtua myös itse sairaudesta |
Markkinoille tulon jälkeen on saatu ilmoituksia interstitiaalipneumoniasta pääasiassa Japanissa.
Erityistä huomattavaa
Leuprorelin Sandoz –hoidon vastetta voidaan seurata mittaamalla seerumin testosteronin, hapanfosfataasin ja PSA:n (prostataspesifinen antigeeni) pitoisuudet.
Testosteronitasot nousevat hoidon alussa, mutta laskevat jälleen 2 viikon kuluessa. Testosteronipitoisuudet palautuvat 2–4 viikon kuluessa tasolle, joka vastaa molempien kivesten poistoa, ja pysyvät sen jälkeen vakiona koko hoitojakson ajan.
Hapanfosfataasin pitoisuus voi nousta tilapäisesti hoidon alkuvaiheessa. Normaalit tai niitä lähestyvät tasot saavutetaan yleensä jälleen muutamien viikkojen kuluessa.
Harvinaisissa tapauksissa injektiokohdassa on esiintynyt märkäpesäkkeitä. Yhdessä injektiokohdan märkäpesäkettä koskeneessa tapauksessa havaittiin leuproreliinin riittämätön imeytyminen depotvalmisteesta. Siksi tällaisissa tapauksissa testosteroniarvojen seuraaminen on tarpeen.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteenhyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55 00034 FIMEA
Yliannostus
Myrkytysoireita ei ole tähän mennessä havaittu.
Varhaisissa kliinisissä tutkimuksissa annettiin leuproreliiniasetaattia päivittäin jopa 20 mg/vrk kahden vuoden ajan. Haittavaikutuksissa ei todettu eroa verrattuna annokseen 1 mg/vrk tai 11,25 mg kolmen kuukauden välein.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Gonadotropiinia vapauttavan hormonin kaltaiset yhdisteet, ATC-koodi: L02AE02
Leupropreliiniasetaatti, Leuprorelin Sandoz -valmisteen vaikuttava aine, on luontaisesti esiintyvän hypotalaamisen vapauttajahormonin LHRH:n synteettinen analogi, joka ohjaa gonadotropiinihormonien LH:n (luteinisoiva hormoni) ja FSH:n (follikkelia stimuloiva hormoni) vapautumista aivolisäkkeen etulohkosta. Nämä hormonit stimuloivat puolestaan steroidisynteesiä sukupuolirauhasissa.
Toisin kuin fysiologinen LHRH, jota vapautuu hypotalamuksesta pulssimaisesti, leuproreliiniasetaatti, jota sanotaan myös LHRH-agonistiksi, estää aivolisäkkeen LHRH-reseptoreita pitkäaikaisen hoitokäytön aikana, ja johtaa niiden alassäätelyyn alkuvaiheen lyhytkestoisen stimulaation jälkeen. Tästä seuraa gonadotropiinin vapautumisen palautuva supressio aivolisäkkeessä ja siitä johtuva testosteronipitoisuuden aleneminen. Testosteronipitoisuus aleneminen vaikuttaa karsinoomamuutoksista kärsineen eturauhaskudoksen kasvuun. Tätä kudosta stimuloi normaalisti dihydrotestosteroni, jota muodostuu eturauhasen soluissa testosteronin vähentyessä.
Jatkuva leuproreliiniasetaattihoito vähentää aivolisäkkeen reseptorien määrää ja/tai herkkyyttä (ns. alassäätely) ja tämän seurauksena LH-, FSH- ja DHT-pitoisuudet alenevat. Näin saavutetaan testosteronipitoisuuden aleneminen, joka vastaa kastraatiotasoa.
Antiandrogeeninen vaikutus ja eturauhasen karsinoomien kasvun estyminen on osoitettu myös eläinkokeissa.
Prekliinisten ja kliinisten tutkimusten mukaan leuproreliiniasetaatin anto kerran kuussa vähentää alkuvaiheen stimulaation jälkeen gonadotropiinin vapautumista.
Leuproreliiniasetaatin antaminen miehelle subkutaanisti nostaa aluksi LH-tasoa (luteinisoiva hormoni) ja FSH-tasoa (follikkelia stimuloiva hormoni). Tähän liittyy testosteroni- ja dihydrotestosteronipitoisuuksien tilapäinen nousu.
Koska yksittäistapauksissa on havaittu kliinisen tilan lyhytkestoista, oireellista heikkenemistä ensimmäisten 3 viikon aikana, antiandrogeenien antamista eturauhaskarsinoomaa sairastaville miehille liitännäishoitona on harkittava.
Sen sijaan pitkäkestoinen leuproreliiniasetaattihoito alentaa LH- ja FSH-tasoja kaikilla potilailla, jolloin saavutetaan molempien kivesten poistamisen jälkeistä tasoa vastaavat androgeenitasot miehillä. Nämä muutokset tapahtuvat yleensä 2–3 viikon kuluessa hoidon aloittamisesta ja säilyvät koko hoidon keston ajan. Näin ollen leuproreliiniasetaatin avulla voidaan myös selvittää eturauhasen karsinoomien hormoniherkkyyttä ja kivestenpoistosta mahdollisesti saatavaa terapeuttista hyötyä. Kivestenpoisto voidaan tarvittaessa korvata antamalla leuproreliiniasetaattia kuukauden välein. Tähän mennessä testosteronin kastraatiotaso on pystytty säilyttämään yli 5 vuoden ajan antamalla leuproreliiniasetaattia jatkuvasti.
Kliininen teho
Satunnaistetussa, leuproreliiniasetaatilla toteutetussa vaiheen III monikeskustutkimuksessa arvioitiin 263 potilasta, joilla oli paikallisesti edennyt eturauhaskarsinooma levinneisyysasteeltaan T3–T4 tai pT3, N0, M0.
133 potilasta sai sädehoidon ja androgeenideprivaatiohoidon yhdistelmää ja 130 potilasta pelkkää androgeenideprivaatiohoitoa leuproreliiniasetaatilla 3 vuoden ajan.
ASTRO-kriteerien (Phoenix-kriteerien) perusteella yli 5 vuoden etenemättömyysajan saavutti yhdistelmähoidolla 60,9 % (64,7 %) ja pelkällä hormonihoidolla 8,5 % (15,4 %) (p = 0,0001; [p = 0,0005]).
ASTRO-kriteerien mukaan etenemisen riski oli 3,8 kertaa suurempi pelkkää hormonihoitoa saaneessa ryhmässä (95 % lv [2,17; 6,49]).
ASTRO-kriteerien mukainen kliinisen ja biokemiallisen etenemättömyysajan mediaani oli pelkkää hormonihoitoa saaneessa ryhmässä 641 vuorokautta (95 % lv [626; 812]) ja yhdistelmähoitoryhmässä 2 804 vuorokautta (95 % lv [2 090; –]; p < 0,0001).
Yhdistelmähoitoa saaneiden ja pelkkää androgeenideprivaatiohoitoa saaneiden välillä ei havaittu tilastollisesti merkitseviä eroja lokoregionaalisen etenemisen (riskitiheyssuhde 3,6 [95 % lv {1,9; 6,8}; p < 0,0001]), etäpesäkkeiden kehittymisen (p < 0,018) eikä etäpesäkkeettömän elossaolon (p = 0,018) suhteen.
Tässä tutkimuksessa osoitettiin selvästi, että 3 vuotta jatkuva androgeenideprivaatiohoidon ja sädehoidon yhdistelmä on tehokkaampi kuin pelkkä androgeenideprivaatiohoito.
Myös seuraavat tutkimukset osoittavat, että LHRH-analogeilla toteutettu yhdistelmähoito on tehokkaampi kuin pelkkä sädehoito paikallisesti edennyttä eturauhassyöpää sairastavilla potilailla. Satunnaistettuun RTOG 85-31 -tutkimukseen otettiin 977 potilasta, joilla oli paikallisesti edennyt, levinneisyysasteen T1–T3 eturauhaskarsinooma ja etäpesäkkeitä imusolmukkeissa tai kasvaimen tunkeutumista eturauhaskapselin läpi tai rakkularauhaseen.
488 potilasta sai sädehoidon ja pitkäaikaisen, gosereliinilla toteutetun androgeenideprivaatiohoidon yhdistelmää, ja 489 potilasta sai pelkkää sädehoitoa.
Tutkimukset osoittavat selvästi yhdistelmähoidon paremmuuden pelkkään sädehoitoon verrattuna. 10 vuoden elossaolo-osuus ilman taudin etenemistä oli 37 % vs. 23 % (p < 0,001), elossaolo-osuus ilman taudin etenemistä PSA-arvon ollessa < 1,5 ng/ml oli 31 % vs. 9 %, paikallisten uusiutumisten osuus 23 % vs. 38 % (p < 0,0001) ja etäpesäkkeisen etenemisen osuus 24 % vs. 39 % (p < 0,0001).
Kokonaiselossaolo-osuus oli 49 % vs. 39 % (p = 0,002) ja tautispesifinen kuolleisuus 16 % vs. 22 % (p = 0,0052).
Sädehoidon ja LHRH-analogeilla toteutetun androgeenideprivaatiohoidon yhdistelmä on osoitettu pelkkää sädehoitoa tehokkaammaksi paikallista eturauhassyöpää sairastavilla kohtalaisen riskiprofiilin potilailla seuraavassa kliinisessä tutkimuksessa.
Satunnaistettu, vaiheen III kliininen tutkimus RTOG 94-08 toteutettiin potilailla, joilla oli levinneisyysasteen T1b, T1c, T2a tai T2b paikallinen eturauhassyöpä ja PSA-arvo ≤ 10 ng/ml. Kohtalaisen riskiprofiilin potilasalaryhmässä Gleasonin pistemäärä oli 6 ja PSA-arvo > 10 ng/ml – 20 ng/ml tai levinneisyysaste T2b. 524 tämän alaryhmän potilasta sai lyhytaikaista androgeenideprivaatiohoitoa 4 kuukauden ajan (2 kuukauden ajan ennen sädehoitoa ja 2 kuukauden ajan sädehoidon yhteydessä), ja 544 potilasta sai pelkkää sädehoitoa.
Kohtalaisen riskiprofiilin alaryhmässä sädehoidon yhdistäminen gosereliinilla tai leuproreliiniasetaatilla toteutettuun androgeenideprivaatiohoitoon tuotti paremmat tulokset kuin pelkkä sädehoito.
Kokonaiselossaolo-osuus oli 10 vuoden kohdalla 61 % vs. 54 % (riskitiheyssuhde 1,23, 95 % lv [1,02–1,49; p = 0,03]). Tautispesifinen kuolleisuus oli 3 % vs. 10 % (riskitiheyssuhde 2,49, 95 % lv [1,50–4,11; p = 0,004]) ja biokemiallisten etenemisten osuus 28 % vs. 45 % (riskitiheyssuhde 1,79, 95 % lv [1,45–2,21; p < 0,001]).
Valmisteen käyttö paikallista eturauhassyöpää sairastavilla suuren riskiprofiilin potilailla perustuu julkaistuihin kliinisiin tutkimuksiin, joissa on arvioitu sädehoidon yhdistämistä LHRH-agonisteihin, mukaan lukien leuproreliiniasetaattiin.
Kliinisiä tietoja on julkaistu viidestä kliinisestä tutkimuksesta, joissa kaikissa on selkeästi todettu sädehoidon ja LHRH-agonistien yhdistelmän hyöty (EORTC 22863, RTOG 85-31, RTOG 92-02, RTOG 8610 ja D’Amico et al., JAMA 2004). Tutkimuspopulaatiota ei pystytty selvästi jaottelemaan paikallisesti edenneen eturauhassyövän ja suuren riskiprofiilin paikallisen eturauhaskarsinooman ryhmiin.
Kliiniset tiedot ovat osoittaneet, että sädehoidon jälkeistä androgeenideprivaatiohoitoa on parempi jatkaa 3 vuoden ajan kuin 6 kuukauden ajan.
Kliinisissä hoitosuosituksissa androgeenideprivaatiohoidon kestoksi levinneisyysasteen T3–T4 potilailla on määritelty 2–3 vuotta.
Etäpesäkkeistä kastraatioresistenttiä eturauhassyöpää sairastavilla potilailla on todettu hyödylliseksi käyttää leuproreliiniasetaatin kaltaisten LHRH-agonistien lisäksi muita lääkeaineita, kuten androgeenisynteesin estäjiä (esim. abirateroniasetaatti), antiandrogeeneja (esim. entsalutamidi), taksaaneja (esim. dosetakseli tai paklitakseli) tai sädehoidossa käytettäviä valmisteita (esim. radium-223).
Farmakokinetiikka
Leuproreliiniasetaatti vapautuu polymaitohappopolymeeristä jatkuvasti jopa 182 päivän (26 viikon) ajan biohajoavan Leuprorelin Sandoz -implantaatin injektion jälkeen. Polymeeri liukenee kudoksessa samalla tavalla kuin kirurgiset ommelaineet.
Leuprorelin Sandoz -valmisteen 5 216 pg/ml:n (5,2 ng/ml) huippupitoisuus seerumissa on mitattu 2 tunnin sisällä subkutaanisen kerta-annoksen antamisesta.
AUC-arvo 3 kuukauden Leuprorelin Sandoz -hoidon aikana oli 32,4 ng/ml*d.
Mitattavissa olevia seerumipitoisuuksia on havaittavissa jopa 182 päivän (26 viikon) ajan valmisteen annosta.
Leuproreliinin jakautumistilavuus miehillä on 36 l; kokonaispuhdistuma on 139,6 ml/min.
Munuaisten tai maksan vajaatoimintaa sairastavien potilaiden leuproreliinitasot vastasivat tasoja, joita mitattiin potilailta, joilla oli terveet munuaiset tai maksa. Joillakin kroonista munuaisten vajaatoimintaa sairastavilla potilailla mitattiin seerumista korkeampia leuproreliinitasoja. Tällä havainnolla ei kuitenkaan vaikuta olevan kliinistä merkitystä.
Prekliiniset tiedot turvallisuudesta
Leuprorelin Sandozilla tehdyissä prekliinisissä tutkimuksissa on todettu vaikutuksia sukuelimiin, mikä oli odotettavissa leuproreliinin tiedossa olevien farmakologisten ominaisuuksien perusteella.
Karsinogeenisuus
Annoksesta riippuvainen nousu aivolisäkkeen adenoomissa todettiin rotilla, kun leuproreliinia annettiin päivittäin 0,6–4 mg/kg/pv 12 tai 24 kuukauden ajan. Vastaavaa vaikutusta ei havaittu hiirillä 24 kuukauden aikana.
Mutageenisuus
In vitro- ja in vivo -tutkimukset leuproreliiniasetaatilla eivät osoittaneet mitään potentiaalista mutageenisuutta tutkittaessa geneettisiä ja kromosomimutaatioita.
Lisääntymistoksisuus
Kaneilla tehdyissä lisääntymistoksisuustutkimuksissa havaittiin sikiökuolleisuuden kasvua ja alhaisempaa syntymäpainoa. Sikiökuolleisuuteen liittyvät vaikutukset ovat odotettavissa tämän aineen farmakodynaamisen vaikutuksen vuoksi.
Paikallinen toleranssi
Koirilla ja kaneilla tehdyissä ei-kliinisissä tutkimuksissa todettiin hyvä paikallinen toleranssi Leuprorelin Sandoz -valmisteelle.
Farmaseuttiset tiedot
Apuaineet
Polymaitohappo
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
4 vuotta.
Säilytys
Säilytä alle 30 ºC.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
LEUPRORELIN SANDOZ implantaatti, esitäytetty ruisku
5 mg (L:ei) 1 kpl (292,95 €)
PF-selosteen tieto
Esitäytetty polykarbonaattimuoviruisku, jonka mäntä on akrylonitriilibutadieenistyreenikopolymeeria, sekä neula; pakattu polyeteenitereftalaatti-/alumiini-PE-komposiittikalvosta valmistettuun suljettuun pussiin.
Pakkauskoot: 1 x 1 implantaatti; yksi implantaatti sisältää 5 mg leuproreliinia (leuproreliiniasetaattina)
2 x 1 implantaattia; yksi implantaatti sisältää 5 mg leuproreliinia (leuproreliiniasetaattina)
3 x 1 implantaattia; yksi implantaatti sisältää 5 mg leuproreliinia (leuproreliiniasetaattina)
5 x 1 implantaattia; yksi implantaatti sisältää 5 mg leuproreliinia (leuproreliiniasetaattina)
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Biohajoava, valkoinen tai vaaleankeltainen, sylinterinmuotoinen sauva (pituus 10 mm) esitäytetyssä ruiskussa.
Käyttö- ja käsittelyohjeet
Ei erityisvaatimuksia.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
LEUPRORELIN SANDOZ implantaatti, esitäytetty ruisku
5 mg 1 kpl
- Ylempi erityiskorvaus (100 %). Eturauhassyöpä (116).
- Peruskorvaus (40 %).
ATC-koodi
L02AE02
Valmisteyhteenvedon muuttamispäivämäärä
27.04.2021
Yhteystiedot
Edvard Thomsens Vej 14
København S København
Danmark
010 6133 415
info.suomi@sandoz.com
