AFINITOR tabletti 2,5 mg, 5 mg, 10 mg
Vaikuttavat aineet ja niiden määrät
Afinitor 2,5 mg tabletti
Yksi tabletti sisältää 2,5 mg everolimuusia.
Apuaine, jonka vaikutus tunnetaan
Yksi tabletti sisältää 74 mg laktoosia.
Afinitor 5 mg tabletti
Yksi tabletti sisältää 5 mg everolimuusia.
Apuaine, jonka vaikutus tunnetaan
Yksi tabletti sisältää 149 mg laktoosia.
Afinitor 10 mg tabletti
Yksi tabletti sisältää 10 mg everolimuusia.
Apuaine, jonka vaikutus tunnetaan
Yksi tabletti sisältää 297 mg laktoosia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Tabletti.
Kliiniset tiedot
Käyttöaiheet
Hormonireseptoripositiivinen edennyt rintasyöpä
Afinitor on tarkoitettu hormonireseptoripositiivisen, HER‑2/neu‑negatiivisen, edenneen rintasyövän hoitoon yhdessä eksemestaanin kanssa postmenopausaalisilla naisilla, joilla ei ole oireista viskeraalista sairautta ja joiden tauti uusiutuu tai etenee, kun heitä on hoidettu ei-steroidaalisella aromataasin estäjällä.
Haiman neuroendokriiniset kasvaimet
Afinitor on tarkoitettu leikkaukseen soveltumattomien tai etäpesäkkeisten, hyvin erilaistuneiden tai kohtalaisesti erilaistuneiden haiman neuroendokriinisten kasvainten hoitoon aikuisilla, joilla on etenevä tauti.
Ruoansulatuskanavan tai keuhkojen neuroendokriiniset kasvaimet
Afinitor on tarkoitettu leikkaukseen soveltumattomien tai etäpesäkkeisten, hyvin erilaistuneiden (gradus 1 tai gradus 2), ei-toiminnallisten ruoansulatuskanavan tai keuhkojen neuroendokriinisten kasvainten hoitoon aikuisilla, joilla on etenevä tauti (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakodynamiikka).
Munuaiskarsinooma
Afinitor on tarkoitettu levinneen ja etäpesäkkeisen munuaiskarsinooman hoitoon potilailla, joiden tauti on edennyt VEGF‑täsmähoidon aikana tai sen jälkeen.
Ehto
Valmistetta tulee käyttää vain syövän hoitoon perehtyneen lääkärin valvonnassa.
Annostus ja antotapa
Afinitor‑hoidon aloittavalla ja hoitoa seuraavalla lääkärillä tulee olla kokemusta syövän hoidon toteuttamisesta.
Annostus
Afinitor on saatavissa 2,5 mg, 5 mg ja 10 mg tabletteina eri annoksia varten.
Suositusannos on 10 mg everolimuusia kerran vuorokaudessa. Hoitoa tulee jatkaa niin pitkään kuin siitä havaitaan olevan kliinistä hyötyä tai ei hyväksyttävän toksisuuden ilmenemiseen saakka.
Jos annos jää väliin, potilaan ei pidä ottaa ylimääräistä annosta vaan ottaa seuraava annos tavanomaiseen tapaan lääkemääräyksen mukaan.
Annoksen muuttaminen haittavaikutusten vuoksi
Vaikeiden ja/tai ei hyväksyttävien epäiltyjen haittavaikutusten hoito voi vaatia annoksen pienentämistä ja/tai Afinitor-hoidon tilapäistä keskeyttämistä. Annosta ei yleensä tarvitse muuttaa, jos haittavaikutus on vaikeusasteeltaan luokkaa 1. Jos annosta pitää pienentää, suositeltu annos on 5 mg/vrk, eikä se saa olla alle 5 mg vuorokaudessa.
Taulukossa 1 on yhteenveto suositelluista annosmuutoksista tiettyjen haittavaikutusten yhteydessä (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet).
Taulukko 1 Afinitor-hoidon annosmuutoksia koskevat suositukset
Haittatapahtuma | Vaikeusaste1 | Afinitor-annoksen muutos |
Ei‑infektioosi pneumoniitti | Vaikeusaste 2 | Harkitse hoidon keskeyttämistä väliaikaisesti, kunnes oireet lievittyvät vaikeusasteeseen ≤ 1. Aloita hoito uudelleen annoksella 5 mg vuorokaudessa. Lopeta hoito, jos paranemista ei tapahdu neljän viikon kuluessa. |
Vaikeusaste 3 | Keskeytä hoito väliaikaisesti, kunnes oireet lievittyvät vaikeusasteeseen ≤ 1. Harkitse hoidon aloittamista uudelleen annoksella 5 mg vuorokaudessa. Jos 3. vaikeusasteen toksisuuksia ilmenee uudelleen, harkitse hoidon lopettamista. | |
Vaikeusaste 4 | Lopeta hoito. | |
Suutulehdus | Vaikeusaste 2 | Keskeytä annostelu väliaikaisesti, kunnes oireet paranevat vaikeusasteeseen ≤ 1. Aloita hoito samalla annoksella uudelleen. Jos suutulehdus uusiutuu vaikeusasteeltaan 2:na, keskeytä anto, kunnes oireet paranevat vaikeusasteeseen ≤ 1. Aloita hoito uudelleen annoksella 5 mg vuorokaudessa. |
Vaikeusaste 3 | Keskeytä annostelu väliaikaisesti, kunnes oireet paranevat vaikeusasteeseen ≤ 1. Aloita hoito uudelleen annoksella 5 mg vuorokaudessa. | |
Vaikeusaste 4 | Lopeta hoito. | |
Muut ei‑hematologiset toksisuudet (pois lukien metaboliset tapahtumat) | Vaikeusaste 2 | Annoksen muuttaminen ei ole tarpeen, jos toksisuus on siedettävää. Jos toksisuus muuttuu sietämättömäksi, keskeytä anto väliaikaisesti, kunnes oireet lievittyvät vaikeusasteeseen ≤ 1. Aloita hoito samalla annoksella uudelleen. Jos toksisuus uusiutuu vaikeusasteeltaan 2:na, keskeytä hoito, kunnes oireet lievittyvät vaikeusasteeseen ≤ 1. Aloita hoito uudelleen annoksella 5 mg vuorokaudessa. |
Vaikeusaste 3 | Keskeytä annostelu väliaikaisesti, kunnes oireet paranevat vaikeusasteeseen ≤ 1. Harkitse hoidon aloittamista uudelleen annoksella 5 mg vuorokaudessa. Jos 3. vaikeusasteen toksisuuksia ilmenee uudestaan, harkitse hoidon lopettamista. | |
Vaikeusaste 4 | Lopeta hoito. | |
Metaboliset tapahtumat (esim. hyperglykemia, dyslipidemia) | Vaikeusaste 2 | Annoksen muuttaminen ei ole tarpeen. |
Vaikeusaste 3 | Väliaikainen annon keskeytys. Aloita hoito uudestaan annoksella 5 mg vuorokaudessa. | |
Vaikeusaste 4 | Lopeta hoito. | |
Trombosytopenia | Vaikeusaste 2 (< 75, ≥ 50 x 109/l) | Keskeytä annostelu väliaikaisesti, kunnes oireet paranevat vaikeusasteeseen ≤ 1 (≥ 75 x 109/l). Aloita hoito samalla annoksella uudelleen. |
Vaikeusasteet 3 ja 4 (< 50 x 109/l) | Keskeytä annostelu väliaikaisesti, kunnes oireet paranevat vaikeusasteeseen ≤ 1 (≥ 75 x 109/l). Aloita hoito uudelleen annoksella 5 mg vuorokaudessa. | |
Neutropenia | Vaikeusaste 2 (≥ 1 x 109/l) | Annoksen muuttaminen ei ole tarpeen. |
Vaikeusaste 3 (<1, ≥0,5 x 109/l) | Keskeytä annostelu väliaikaisesti, kunnes oireet paranevat vaikeusasteeseen ≤ 2 (≥ 1 x 109/l). Aloita hoito samalla annoksella uudelleen. | |
Vaikeusaste 4 (< 0,5 x 109/l) | Keskeytä annostelu väliaikaisesti, kunnes oireet paranevat vaikeusasteeseen ≤ 2 (≥ 1 x 109/l). Aloita hoito uudelleen annoksella 5 mg vuorokaudessa. | |
Kuumeinen neutropenia | Vaikeusaste 3 | Keskeytä annostelu väliaikaisesti, kunnes oireet paranevat vaikeusasteeseen ≤ 2 (≥ 1,25 x 109/l) ja potilaalla ei ole kuumetta. Aloita hoito uudelleen annoksella 5 mg vuorokaudessa. |
Vaikeusaste 4 | Lopeta hoito. | |
1 Vaikeusasteet perustuvat National Cancer Instituten (NCI:n) Common Terminology Criteria for Adverse Events -luokitukseen (CTCAE) v3.0 | ||
Erityisryhmät
Iäkkäät potilaat (≥ 65 vuotta)
Annoksen muuttaminen ei ole tarpeen (ks. kohta Farmakokinetiikka).
Munuaisten vajaatoiminta
Annoksen muuttaminen ei ole tarpeen (ks. kohta Farmakokinetiikka).
Maksan vajaatoiminta
- Lievä maksan vajaatoiminta (Child–Pugh-luokka A) – suositeltava annos on 7,5 mg vuorokaudessa.
- Keskivaikea maksan vajaatoiminta (Child–Pugh-luokka B) – suositeltava annos on 5 mg vuorokaudessa.
- Vaikea maksan vajaatoiminta (Child–Pugh-luokka C) – Afinitorin käyttöä suositellaan vain, jos käytön odotettavissa olevat hyödyt ovat suuremmat kuin sen riskit. Tällöin annos ei saa olla suurempi kuin 2,5 mg vuorokaudessa.
Jos potilaan maksan vajaatoimintaluokitus (Child–Pugh) muuttuu hoidon aikana, annosta on muutettava (ks. myös kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Pediatriset potilaat
Afinitorin turvallisuutta ja tehoa 0–18 vuoden ikäisten lasten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Antotapa
Afinitor otetaan suun kautta kerran vuorokaudessa samaan aikaan joka päivä, johdonmukaisesti joko ruoan kanssa tai tyhjään mahaan (ks. kohta Farmakokinetiikka). Afinitor-tabletit tulee niellä kokonaisina vesilasillisen kanssa. Niitä ei saa pureskella eikä murskata.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle, muille rapamysiinijohdoksille tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Ei‑infektioperäinen pneumoniitti
Ei‑infektioperäinen pneumoniitti on rapamysiinijohdosten kuten everolimuusin luokkavaikutus. Ei‑infektioperäistä pneumoniittia (myös interstitiaalista keuhkosairautta) on ilmoitettu usein Afinitor-hoitoa saaneilla potilailla (ks. kohta Haittavaikutukset). Jotkin tapaukset olivat vaikeita, ja harvinaisissa tapauksissa tilanne on johtanut kuolemaan. Ei‑infektioperäisen pneumoniitin mahdollisuus tulee ottaa huomioon, jos potilaalla on epäspesifisiä hengitystieoireita ja ‑löydöksiä kuten hypoksiaa, pleuraeffuusiota, yskää tai hengenahdistusta ja jos infektion, kasvaimen ja muiden lääkehoitoon liittymättömien syiden mahdollisuus on suljettu pois asianmukaisten tutkimusten avulla. Opportunistiset infektiot kuten pneumocystis jiroveci (carinii) -keuhkokuume (PJP/PCP) tulee sulkea pois ei-infektioperäisen pneumoniitin erotusdiagnostiikassa (ks. ”Infektiot” alla). Potilaita tulee kehottaa ilmoittamaan viipymättä kaikista uusista hengitystieoireista ja hengitystieoireiden pahenemisesta.
Jos potilaalle kehittyy ei‑infektioperäiseen pneumoniittiin viittaavia radiologisia muutoksia, mutta oireita on vähän tai ei lainkaan, hän voi jatkaa Afinitor-hoitoa ilman annosmuutoksia. Jos oireet ovat keskivaikeita (vaikeusaste 2) tai vaikeita (vaikeusaste 3) kortikosteroidien käyttö voi olla aiheellista siihen saakka, kunnes kliiniset oireet ovat parantuneet.
Potilaat, jotka tarvitsevat kortikosteroideja ei-infektioperäiseen pneumoniitin hoitoon, saattavat tarvita PJP-/PCP‑keuhkokuumeen estohoitoa.
Infektiot
Everolimuusilla on immunosuppressiivinen vaikutus, ja se saattaa altistaa potilaan bakteeri-, sieni-, virus- tai alkueläininfektioille, myös opportunisti-infektioille (ks. kohta Haittavaikutukset). Afinitor-hoitoa käyttävillä potilailla on kuvattu paikallisia ja systeemisiä infektioita kuten keuhkokuumetta, muita bakteeri-infektioita, invasiivisia sieni-infektioita kuten aspergilloosia, kandidiaasia tai PJP‑/PCP‑keuhkokuumetta ja virusinfektioita kuten hepatiitti B viruksen uudelleen aktivoitumista. Jotkin näistä infektioista olivat vaikeita (esim. johtivat verenmyrkytykseen, hengitysvajaukseen tai maksan vajaatoimintaan) ja johtivat joissakin tapauksissa kuolemaan.
Lääkäreiden ja potilaiden tulee olla tietoisia infektioriskin suurenemisesta Afinitor-hoidon aikana. Potilaalla entuudestaan olevat infektiot tulee hoitaa asianmukaisesti ja saada paranemaan täysin ennen Afinitor-hoidon aloittamista. Afinitor-hoidon aikana tulee seurata tilannetta mahdollisten infektio-oireiden ja ‑löydösten varalta: jos infektiodiagnoosi tehdään, tulee asianmukainen hoito aloittaa viipymättä ja harkita Afinitor-hoidon keskeyttämistä tai lopettamista.
Jos potilaalla todetaan invasiivinen systeeminen sieni-infektio, Afinitor-hoito tulee lopettaa heti ja pysyvästi ja potilaalle tulee antaa asianmukaista antimykoottista hoitoa.
PJP-/PCP‑tapauksia, jotkin kuolemaanjohtavia, on raportoitu everolimuusia saavilla potilailla. PJP/PCP-tapauksiin voi liittyä yhdistelmäkäyttöä kortikosteroidihoitoon tai muuhun immunosuppressiiviseen hoitoon. PJP/PCP estohoitoa on harkittava kun yhdistelmähoitoja kortikosteroidien tai muiden immunosuppressanttien kanssa on tarpeen käyttää.
Yliherkkyysoireet
Everolimuusin käytön yhteydessä on havaittu yliherkkyysreaktioita, jotka ilmenevät seuraavina oireina (mutta eivät rajoitu niihin): anafylaksia, hengenahdistus, punoitus, rintakipu tai angioödeema (esim. hengitysteiden tai kielen turvotus, johon saattaa liittyä hengitystoiminnan heikkenemistä) (ks. kohta Vasta-aiheet).
Samanaikainen angiotensiinikonvertaasin estäjien (ACE:n estäjien) käyttö
Samanaikaisesti ACE:n estäjähoitoa (esim. ramipriilia) saavien potilaiden riski angioedeemalle (esim. hengitysteiden tai kielen turvotukselle sekä siihen mahdollisesti liittyville hengitysvaikeuksille) voi olla tavallista suurempi (ks. kohta Yhteisvaikutukset).
Suutulehdus
Afinitor-hoitoa saavilla potilailla suutulehdus, mukaan lukien suun haavaumat ja suun limakalvotulehdus, on yleisimmin raportoitu haittavaikutus (ks. kohta Haittavaikutukset). Suutulehdus ilmenee useimmiten ensimmäisten 8 viikon aikana hoidon aloittamisesta. Yksihaaraisessa tutkimuksessa Afinitoria ja eksemestaania saaneilla postmenopausaalisilla rintasyöpäpotilailla havaittiin, että alkoholiton kortikosteroidia sisältävä oraaliliuos saattaa vähentää suutulehduksen esiintyvyyttä ja vaikeusastetta, kun sitä käytetään suuvetenä ensimmäisten 8 hoitoviikon aikana (ks. kohta Farmakodynamiikka). Suutulehduksen hoitoon voi siten kuulua paikallishoitojen, kuten alkoholittoman kortikosteroidia sisältävän oraaliliuoksen, profylaktinen ja/tai terapeuttinen käyttö. Alkoholia, vetyperoksidia, jodia ja timjamijohdannaisia sisältävien suuhuuhteiden käyttöä tulee kuitenkin välttää, sillä ne saattavat pahentaa tilannetta. Seurantaa sieni-infektioiden varalta sekä niiden hoitoa suositellaan erityisesti potilailla, joita hoidetaan kortikosteroidipohjaisilla lääkevalmisteilla. Sienilääkkeitä ei tule käyttää, ellei potilaalla ole todettu sieni-infektiota (ks. kohta Yhteisvaikutukset).
Munuaisten vajaatoimintaan liittyvät tapahtumat
Afinitor-hoitoa saaneilla potilailla on todettu munuaisten vajaatoimintatapauksia (munuaisten äkillinen vajaatoiminta mukaan lukien), joista jotkut olivat kuolemaan johtavia (ks. kohta Haittavaikutukset). Munuaistoimintaa on seurattava erityisesti, jos potilailla on muita riskitekijöitä, jotka saattavat vaikuttaa munuaisten toimintaan.
Laboratoriotutkimukset ja seuranta
Munuaistoiminta
Seerumin kreatiniiniarvojen suurenemista, joka oli yleensä lievää, sekä proteinuriaa on ilmoitettu (ks. kohta Haittavaikutukset). On suositeltavaa seurata potilaan munuaistoimintaa mm. veren ureatypen, virtsan proteiinin tai seerumin kreatiniinin mittauksin ennen Afinitor-hoidon aloittamista ja säännöllisin välein hoidon aikana.
Veren glukoosiarvot
Hyperglykemiaa on ilmoitettu (ks. kohta Haittavaikutukset). On suositeltavaa tutkia seerumin paastoglukoosiarvot ennen Afinitor‑hoidon aloittamista ja säännöllisin välein sen jälkeen. Potilaita, jotka käyttävät Afinitor‑valmisteen kanssa joitakin muita hyperglykemiaa mahdollisesti aiheuttavia lääkevalmisteita, suositellaan seurattavan useammin. Ennen Afinitor‑hoidon aloittamista verensokeri tulee saada optimaaliseen hoitotasapainoon, mikäli mahdollista.
Veren lipidiarvot
Dyslipidemiaa (mukaan lukien hyperkolesterolemiaa ja hypertriglyseridemiaa) on ilmoitettu. Veren kolesteroli- ja triglyseridiarvojen seurantaa suositellaan ennen Afinitor‑hoidon aloittamista ja säännöllisin välein sen jälkeen, kuten myös asianmukaista lääketieteellistä hoitoa.
Hematologiset määritykset
Hemoglobiini-, lymfosyytti-, neutrofiili- ja trombosyyttiarvojen pienenemistä on ilmoitettu (ks. kohta Haittavaikutukset). On suositeltavaa tutkia potilaan täydellinen verenkuva ennen Afinitor‑hoidon aloittamista ja säännöllisin välein hoidon aikana.
Toiminnalliset neuroendokriiniset kasvaimet
Afinitorin ja pitkävaikutteisen oktreotidin yhdistelmää verrattiin lumelääkkeen ja pitkävaikutteisen oktreotidin yhdistelmään satunnaistetussa, kaksoissokkoutetussa monikeskustutkimuksessa potilailla, joilla oli toiminnallisia neuroendokriinisiä kasvaimia. Tutkimuksessa ei saavutettu ensisijaista tehopäätetapahtumaa (etenemisvapaa elossaolo) ja välianalyysi oli kokonaiselossaolon (OS) suhteen numeerisesti parempi ryhmässä, joka sai lumelääkkeen ja depotmuotoisen oktreotidin yhdistelmää. Täten Afinitorin turvallisuutta ja tehoa ei ole todennettu potilailla, joilla on toiminnallisia neuroendokriinisiä kasvaimia.
Ruoansulatuskanavan tai keuhkojen neuroendokriinisten kasvainten ennustetekijät
Potilaille, joilla on ei-toiminnallinen ruoansulatuskanavan tai keuhkojen neuroendokriininen kasvain ja hyvää ennustetta ennakoivia tekijöitä lähtötilanteessa, esim. ileumissa sijaitseva primaarikasvain ja normaalit kromograniini A ‑arvot tai ei luustoaffisiota, on tehtävä tapauskohtainen hyöty–riski-arvio ennen Afinitor-hoidon aloittamista. Tieto etenemisvapaan elossaoloajan pidentymisestä on rajallista alaryhmässä, jonka potilailla oli ileumissa sijaitseva primaarikasvain (ks. kohta Farmakodynamiikka).
Yhteisvaikutukset
CYP3A4‑entsyymitoimintaa ja/tai monien lääkkeiden ulosvirtauspumppuna toimivan P-glykoproteiinin (P-gp) toimintaa estävien tai indusoivien aineiden samanaikaista käyttöä pitää välttää. Jos kohtalaisen voimakkaan CYP3A4- ja/tai P-gP‑estäjän tai ‑induktorin samanaikainen käyttö on välttämätöntä, potilaan kliinistä tilaa on seurattava tarkasti. Afinitor-annoksen muutokset voidaan ottaa huomioon ennakoidun AUC‑arvon perusteella (ks. kohta Yhteisvaikutukset).
Voimakkaiden CYP3A4/P-gp ‑estäjien samanaikainen käyttö suurentaa plasman everolimuusipitoisuuksia huomattavasti (ks. kohta Yhteisvaikutukset). Nykyiset tiedot eivät riitä kyseistä tilannetta koskevien annostussuositusten antamiseen. Näin ollen Afinitorin ja voimakkaiden estäjien samanaikainen käyttö ei ole suositeltavaa.
Mahdollisien yhteisvaikutuksien takia varovaisuutta on noudatettava, kun Afinitoria otetaan samanaikaisesti suun kautta annosteltavien CYP3A4‑substraattien kanssa, joilla on kapea terapeuttinen indeksi. Jos Afinitoria otetaan samanaikaisesti suun kautta annosteltavien CYP3A4‑substraattien kanssa, joilla on kapea terapeuttinen indeksi (esim. pimotsidi, terfenadiini, astemitsoli, sisapridi, kinidiini tai ergotalkaloidijohdannaiset), potilasta tulee seurata suun kautta otettavan CYP3A4‑substraatin valmisteyhteenvedossa mainittujen haittavaikutusten varalta (ks. kohta Yhteisvaikutukset).
Maksan vajaatoiminta
Everolimuusialtistus oli suurentunut potilailla, joilla oli lievä (Child–Pugh A), keskivaikea (Child–Pugh B) tai vaikea (Child–Pugh C) maksan vajaatoiminta (ks. kohta Farmakokinetiikka).
Afinitorin käyttöä potilaille, joilla on vaikea maksan vajaatoiminta (Child–Pugh C) suositellaan vain, jos hoidon mahdolliset hyödyt ovat sen riskejä suuremmat (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka).
Maksan vajaatoimintapotilaiden osalta ei toistaiseksi ole saatavilla haittavaikutusten hallintaan liittyviä annosmuutossuosituksia tukevia teho- ja turvallisuustietoja.
Rokotukset
Elävien rokotteiden käyttöä tulee välttää Afinitor-hoidon aikana (ks. kohta Yhteisvaikutukset).
Laktoosi
Potilaiden, joilla on harvinainen perinnöllinen galaktoosi-intoleranssi, täydellinen laktaasinpuutos tai glukoosi-galaktoosi-imeytymishäiriö, ei pidä käyttää tätä lääkettä.
Komplikaatiot haavojen paranemisessa
Haavojen huono paraneminen on rapamysiinijohdosten, kuten everolimuusin, luokkavaikutus. Afinitorin perioperatiivisessa käytössä tulee siis noudattaa varovaisuutta.
Sädehoitoon liittyvät komplikaatiot
Vakavia ja vaikeita sädereaktioita (kuten säde-esofagiitti, sädepneumoniitti ja ihon sädevauriot), myös kuolemaan johtaneita tapauksia, on ilmoitettu käytettäessä everolimuusia sädehoidon aikana tai pian sen jälkeen. Sädehoidon toksisuutta voimistavan vaikutuksen vuoksi varovaisuutta on noudatettava hoidettaessa potilaita, jotka käyttävät everolimuusia lyhyen ajan sisällä sädehoidosta.
Sädereaktion uusiutumisoireyhtymää on myös ilmoitettu sädehoitoa aiemmin saaneilla everolimuusin käyttäjillä. Uusiutumisoireyhtymätapauksissa on harkittava everolimuusihoidon keskeyttämistä tai lopettamista.
Yhteisvaikutukset
Everolimuusi on CYP3A4:n substraatti ja myös P‑gp:n substraatti ja kohtalainen estäjä. CYP3A4- ja/tai P‑gp‑toimintaan vaikuttavat valmisteet saattavat siis vaikuttaa everolimuusin imeytymiseen ja eliminaatioon. Everolimuusi on kilpaileva CYP3A4‑estäjä ja osittainen CYP2D6‑estäjä in vitro.
Tunnettuja ja teoreettisia yhteisvaikutuksia CYP3A4- tai P-gp-estäjien ja induktorien kanssa on lueteltu alla taulukossa 2.
CYP3A4- ja P‑gp‑estäjät, jotka suurentavat everolimuusipitoisuuksia
CYP3A4- tai P-gp-estäjät voivat suurentaa veren everolimuusipitoisuutta hidastamalla metaboliaa tai everolimuusin ulosvirtausta suoliston soluista.
CYP3A4- ja P‑gp‑induktorit, jotka pienentävät everolimuusipitoisuuksia
Aineet, jotka ovat CYP3A4- tai P‑gp‑induktoreita, voivat pienentää veren everolimuusipitoisuutta voimistamalla metaboliaa tai ulosvirtausta suoliston soluista.
Taulukko 2 Muiden lääkeaineiden vaikutukset everolimuusiin
Lääkeaine yhteisvaikutuskohtaisesti | Yhteisvaikutus – everolimuusin AUC-/Cmax‑arvojen muutos Geometrinen keskiarvo (havaittu alue) | Suositukset yhteiskäytölle |
Voimakkaat CYP3A4/P‑gp‑estäjät | ||
Ketokonatsoli | AUC ↑15,3-kertaiseksi (vaihteluväli 11,2‑22,5) Cmax ↑4,1-kertaiseksi (vaihteluväli 2,6‑7,0) | Afinitorin ja voimakkaiden CYP3A4- tai P‑gp‑estäjien samanaikaista käyttöä ei suositella. |
Itrakonatsoli, posakonatsoli, vorikonatsoli | Ei tutkittu. Everolimuusipitoisuuden suuri nousu on odotettavissa. | |
Telitromysiini, klaritromysiini | ||
Nefatsodoni | ||
Ritonaviiri, atatsanaviiri, sakinaviiri, darunaviiri, indinaviiri, nelfinaviiri | ||
Kohtalaisen voimakkaat CYP3A4/P‑gp‑estäjät | ||
Erytromysiini | AUC ↑4,4‑kertaiseksi (vaihteluväli 2,0‑12,6) Cmax ↑2,0‑kertaiseksi (vaihteluväli 0,9‑3,5) | Jos kohtalaisen voimakkaiden CYP3A4‑estäjien tai P‑gp‑estäjien käyttö samanaikaisesti Afinitorin kanssa on välttämätöntä, siinä tulee noudattaa varovaisuutta. Jos potilas tarvitsee samanaikaisesti kohtalaisen voimakkaan CYP3A4‑estäjän tai P‑gp estäjän, on harkittava annoksen pienentämistä 5 mg:aan vuorokaudessa tai 2,5 mg:aan vuorokaudessa. Tästä annosmuutoksesta ei kuitenkaan ole kliinisiä tietoja. Yksilöllisen vaihtelun vuoksi suositellut annosmuutokset eivät välttämättä ole kaikille potilaille optimaalisia, joten potilasta tulee seurata tarkoin haittavaikutusten varalta (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet). Jos kohtalaisen voimakkaan estäjän käyttö lopetetaan, on harkittava vähintään 2‑3 päivän mittaista jaksoa (yleisimmin käytettyjen kohtalaisten estäjien keskimääräinen eliminaatioaika) ennen kuin Afinitor-annos palautetaan samanaikaista käyttöä edeltäneelle tasolle. |
Imatinibi | AUC ↑ 3,7‑kertaiseksi Cmax ↑ 2,2‑kertaiseksi | |
Verapamiili | AUC ↑3,5‑kertaiseksi (vaihteluväli 2,2‑6,3) Cmax ↑2,3‑kertaiseksi (vaihteluväli 1,3‑3,8) | |
Suun kautta otettava siklosporiini | AUC ↑2,7‑kertaiseksi (vaihteluväli 1,5‑4,7) Cmax ↑1,8‑kertaiseksi (vaihteluväli 1,3‑2,6) | |
Kannabidioli (P-gp-estäjä) | AUC ↑ 2,5-kertainen Cmax ↑ 2,5-kertainen | |
Flukonatsoli | Ei tutkittu. Korkeampi altistus odotettavissa. | |
Diltiatseemi | ||
Dronedaroni | Ei tutkittu. Korkeampi altistus odotettavissa. | |
Amprenaviiri, fosamprenaviiri | Ei tutkittu. Korkeampi altistus odotettavissa. | |
Greippimehu tai muut elintarvikkeet, jotka vaikuttavat CYP3A4/P‑gp‑toimintaan | Ei tutkittu. Korkeampi altistus odotettavissa (teho vaihtelee laajasti). | Yhteiskäyttöä tulee välttää. |
Voimakkaatja kohtalaiset CYP3A4/P‑gp‑induktorit | ||
Rifampisiini | AUC ↓63 % (vaihteluväli 0–80 %) Cmax ↓58 % (vaihteluväli 10–70 %) | Voimakkaiden CYP3A4- tai P‑gp‑induktorien samanaikaista käyttöä tulee välttää. Jos potilas tarvitsee voimakasta CYP3A4‑induktorin samanaikaista käyttöä, on harkittava 10 mg Afinitor-päiväannoksen nostamista 20 mg päiväannokseen asti, nostaen 5 mg tai vähemmän kerrallaan 4. ja 8. päivänä induktorin käytön aloittamisen jälkeen. Tämän Afinitor-annoksen pitäisi säätää AUC-arvot induktorien käyttöä edeltävälle tasolle. Tästä annoksen säätämisestä ei kuitenkaan ole mitään kliinistä näyttöä. Mikäli induktorihoito lopetetaan, on harkittava vähintään 3‑5 päivän mittaista jaksoa (kohtuullinen aika entsyymitoiminnan normalisoitumiseen) ennen kuin Afinitor-annos palautetaan samanaikaista käyttöä edeltäneelle tasolle. |
Deksametasoni | Ei tutkittu. Matalampi altistus odotettavissa. | |
Karbamatsepiini, fenobarbitaali, fenytoiini | Ei tutkittu. Matalampi altistus odotettavissa. | |
Efavirentsi, nevirapiini | Ei tutkittu. Matalampi altistus odotettavissa. | |
Mäkikuisma (Hypericum perforatum) | Ei tutkittu. Huomattavasti matalampi altistus odotettavissa. | Mäkikuismaa sisältäviä valmisteita ei pidä käyttää everolimuusihoidon aikana. |
Aineet joiden plasmapitoisuutta everolimuusi saattaa muuttaa
In vitro -tulosten perusteella 10 mg oraalisen annoksen jälkeiset systeemiset pitoisuudet ovat sitä luokkaa, että P‑gp:n, CYP3A4:n ja CYP2D6:n esto on epätodennäköinen. CYP3A4:n ja P‑gp:n estoa suolessa ei voida kuitenkaan poissulkea. Yhteisvaikutustutkimus terveillä tutkimushenkilöillä osoitti, että samanaikaisesti everolimuusin kanssa suun kautta otettu annos midatsolaamia, joka on herkkä CYP3A‑substraatin tunnistin, nosti midatsolaamin Cmax‑pitoisuutta 25 % ja midatsolaamin AUC(0-inf)-pitoisuutta 30 %. Tämä vaikutus johtuu todennäköisesti everolimuusin aiheuttamasta, suolistossa olevan CYP3A4:n estosta, joten everolimuusi saattaa vaikuttaa samanaikaisesti suun kautta annettavien CYP3A4‑substraattien hyötyosuuteen. Kliinisesti merkittävä vaikutus systeemisesti annettaville CYP3A4‑substraateille ei ole odotettavissa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Everolimuusin ja pitkävaikutteisen oktreotidin samanaikainen käyttö suurensi oktreotidin Cmin‑arvoa; geometristen keskiarvojen suhde (everolimuusi/lumelääke) oli 1,47. Ei pystytty todentamaan, että ilmiö vaikuttaisi kliinisesti merkitsevästi everolimuusin tehoon potilailla, joilla on edenneitä neuroendokriinisiä kasvaimia.
Everolimuusin ja eksemestaanin samanaikainen käyttö suurensi eksemestaanin Cmin-arvoa 45 % ja C2h-arvoa 64 %. Vastaavissa vakaan tilan (4 viikkoa) estradiolipitoisuuksissa ei kuitenkaan todettu eroa kahden hoitoryhmän välillä. Eksemestaaniin liittyvien haittavaikutusten määrä ei suurentunut hormonireseptoripositiivista edennyttä rintasyöpää sairastavilla potilailla, jotka saivat tätä yhdistelmää. Suurentuneet eksemestaanin pitoisuudet eivät todennäköisesti vaikuta lääkkeen tehoon tai turvallisuuteen.
Samanaikainen angiotensiinikonvertaasin estäjien (ACE:n estäjien) käyttö
Samanaikaisesti ACE:n estäjähoitoa (esim. ramipriilia) saavien potilaiden riski angioedeemalle voi olla tavallista suurempi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Rokotukset
Rokotuksella aikaansaatava immuunivaste saattaa heikentyä, joten rokotusten teho voi olla tavanomaista huonompi Afinitor-hoidon aikana. Elävien rokotteiden käyttöä tulee välttää Afinitor-hoidon aikana (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Eläviä rokotteita ovat esimerkiksi nenään annettava influenssarokote, tuhkarokko-, sikotauti- ja vihurirokkorokotteet, peroraalinen poliorokote, BCG-rokote (Bacillus Calmette‑Guérin) sekä keltakuume-, vesirokko- ja TY21a-lavantautirokotteet.
Sädehoito
Everolimuusia käyttävillä potilailla on raportoitu sädehoidon toksisuuden voimistumista (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset).
Raskaus ja imetys
Hedelmällisessä iässä olevat naiset / Ehkäisy miehille ja naisille
Hedelmällisessä iässä olevien naisten on käytettävä erittäin tehokasta ehkäisyä (esim. oraalinen, injisoitava tai implantoitu hormonaalinen ehkäisy ilman estrogeenia, progesteronipohjainen ehkäisy, hysterektomia, munatorviklipsit, täydellinen pidättyväisyys, estomenetelmät, kohdunsisäiset ehkäisyvälineet [IUD] ja/tai naisen/miehen sterilisaatio) everolimuusihoidon aikana ja 8 viikon ajan hoidon lopettamisesta. Miespuolisia potilaita ei pidä kieltää yrittämästä isäksi tuloa.
Raskaus
Ei ole olemassa riittävästi tietoja everolimuusin käytöstä raskaana oleville naisille. Eläinkokeissa on havaittu lisääntymistoksisuutta mukaan lukien alkio- ja sikiötoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Mahdollista ihmisille aiheutuvaa riskiä ei tunneta.
Everolimuusin käyttö ei ole suositeltavaa raskauden aikana eikä naisilla, jotka voivat saada lapsia mutta eivät käytä ehkäisyä.
Imetys
Ei tiedetä, erittyykö everolimuusi ihmisen rintamaitoon. Rotalla everolimuusi ja/tai sen metaboliitit erittyvät kuitenkin herkästi maitoon (ks. kohta Prekliiniset tiedot turvallisuudesta). Näin ollen everolimuusia käyttävien naisten ei pidä imettää hoidon aikana, eikä 2 viikon kuluessa viimeisestä otetusta annoksesta.
Hedelmällisyys
Ei tiedetä, onko everolimuusilla nais- ja miespuolisille potilaille hedelmättömyyttä aiheuttavia ominaisuuksia, mutta naispuolisilla potilailla on havaittu amenorreaa (sekundaarista amenorreaa ja muita kuukautisiin liittyviä epäsäännöllisyyksiä) ja siihen liittyvää epätasapainoa luteinisoivan hormonin (LH) ja follikkelia stimuloivan hormonin (FSH) määrien suhteessa. Ei-kliinisten löydösten perusteella everolimuusi saattaa heikentää miehen ja naisen hedelmällisyyttä (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Afinitor-valmisteella on vähäinen tai kohtalainen vaikutus ajokykyyn ja koneiden käyttökykyyn. Potilaille tulee kertoa, että varovaisuutta on noudatettava ajaessa tai koneita käytettäessä, jos Afinitor-hoidon aikana esiintyy uupumusta.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Turvallisuusprofiili perustuu yhdistettyihin tietoihin yhdestätoista kliinisestä tutkimuksesta, joihin on osallistunut 2 879 Afinitor‑valmisteella hoidettua potilasta. Tutkimuksista viisi oli satunnaistettua, kaksoissokkoutettua, lumekontrolloitua vaiheen III ja kuusi avointa vaiheen I ja II hyväksyttyihin käyttöaiheisiin liittyvää tutkimusta.
Yleisimmin ilmoitetut haittavaikutukset (esiintyvyys ≥ 1/10) yhdistetyistä turvallisuustiedoista olivat (vähenevässä järjestyksessä): suutulehdus, ihottuma, väsymys, ripuli, infektiot, pahoinvointi, vähentynyt ruokahalu, anemia, makuhäiriö, pneumoniitti, ääreisosien turvotus, hyperglykemia, heikkouden tunne, kutina, painon lasku, hyperkolesterolemia, nenäverenvuoto, yskä ja päänsärky.
Yleisimpiä asteen 3‑4 haittavaikutuksia (ilmaantuvuus ≥ 1/100, <1/10) olivat suutulehdus, anemia, hyperglykemia, infektiot, väsymys, ripuli, pneumoniitti, heikkouden tunne, trombosytopenia, neutropenia, hengenahdistus, proteinuria, lymfopenia, verenvuoto, hypofosfatemia, ihottuma, kohonnut verenpaine, keuhkokuume, alaniiniaminotransferaasiarvojen (ALAT) suureneminen, aspartaattiaminotransferaasi (ASAT) -arvojen suureneminen ja diabetes. Vaikeusasteet ovat CTCAE versioiden 3.0 ja 4.03 mukaisia.
Taulukkomuotoinen luettelo haittavaikutuksista
Taulukossa 3 on kuvattu yhdistettyjen turvallisuustietojen analyysiin mukaan otettujen ilmoitettujen haittavaikutusten esiintymistiheydet. Haittavaikutukset on luokiteltu MedDRA-elinjärjestelmäluokituksen ja ‑yleisyysluokituksen mukaisesti. Yleisyysluokat on määritelty seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin). Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 3 Kliinisissä tutkimuksissa haittavaikutukset
Infektiot | |||
Hyvin yleiset | Infektiot a, * | ||
Veri ja imukudos | |||
Hyvin yleiset | Anemia | ||
Yleiset | Trombosytopenia, neutropenia, leukopenia, lymfopenia | ||
Melko harvinaiset | Pansytopenia | ||
Harvinaiset | Puhdas punasoluaplasia | ||
Immuunijärjestelmä | |||
Melko harvinaiset | Yliherkkyys | ||
Aineenvaihdunta ja ravitsemus | |||
Hyvin yleiset | Heikentynyt ruokahalu, hyperglykemia, hyperkolesterolemia | ||
Yleiset | Hypertriglyseridemia, hypofosfatemia, diabetes, hyperlipidemia, hypokalemia, nestehukka, hypokalsemia | ||
Psyykkiset häiriöt | |||
Yleiset | Unettomuus | ||
Hermosto | |||
Hyvin yleiset | Makuhäiriö, päänsärky | ||
Melko harvinaiset | Makuaistin puute | ||
Silmät | |||
Yleiset | Silmäluomien turvotus | ||
Melko harvinaiset | Konjunktiviitti | ||
Sydän | |||
Melko harvinaiset | Kongestiivinen sydämen vajaatoiminta | ||
Verisuonisto | |||
Yleiset | Verenvuoto b, hypertensio, lymfedeemag | ||
Melko harvinaiset | Kuumat aallot, syvä laskimotromboosi | ||
Hengityselimet, rintakehä ja välikarsina | |||
Hyvin yleiset | Pneumoniitti c, nenäverenvuodot, yskä | ||
Yleiset | Hengenahdistus | ||
Melko harvinaiset | Veriyskökset, keuhkoembolia | ||
Harvinaiset | Akuutti hengitysvaikeusoireyhtymä | ||
Ruoansulatuselimistö | |||
Hyvin yleiset | Suutulehdus d, ripuli, pahoinvointi | ||
Yleiset | Oksentelu, suun kuivuminen, vatsakipu, limakalvotulehdus, suukipu, dyspepsia, dysfagia | ||
Maksa ja sappi | |||
Yleiset | ASAT-arvojen suureneminen, ALAT-arvojen suureneminen | ||
Iho ja ihonalainen kudos | |||
Hyvin yleiset | Ihottuma, kutina | ||
Yleiset | Ihon kuivuus, kynsimuutokset, lievä hiustenlähtö, akne, punoitus, kynsien murtuminen, palmoplantaarinen erytrodysestesia, ihon kesiminen, ihomuutokset | ||
Harvinaiset | Angioödeema* | ||
Luusto, lihakset ja sidekudos | |||
Yleiset | Nivelkipu | ||
Munuaiset ja virtsatiet | |||
Yleiset | Proteinuria*, veren kreatiniiniarvojen suureneminen, munuaisten vajaatoiminta* | ||
Melko harvinaiset | Lisääntynyt päiväsaikainen virtsaaminen, akuutti munuaisten vajaatoiminta* | ||
Sukupuolielimet ja rinnat | |||
Yleiset | Epäsäännölliset kuukautiset e | ||
Melko harvinaiset | Amenorrea e* | ||
Yleisoireet ja antopaikassa todettavat haitat | |||
Hyvin yleiset | Väsymys, astenia, ääreisosien turvotus | ||
Yleiset | Kuume | ||
Melko harvinaiset | Ei-sydänperäinen rintakipu, haavojen huono paraneminen | ||
Tutkimukset | |||
Hyvin yleiset | Painon lasku | ||
Vammat, myrkytykset ja hoitokomplikaatiot | |||
Tuntematonf | Sädereaktion uusiutumisoireyhtymä, sädereaktion voimistuminen | ||
* Ks. myös alakohta ”Tiettyjen haittavaikutusten kuvaus” a Kattaa kaikki Infektiot-elinjärjestelmäluokan reaktiot kuten (yleinen) keuhkokuume, virtsatieinfektio; (melko harvinainen) keuhkoputkitulehdus, vyöruusu, sepsis, paise ja yksittäiset opportunisti-infektiotapaukset [esim. aspergilloosi, kandidiaasi, PJP/PCP ja B-hepatiitti (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet)] ja (harvinainen) virusmyokardiitti b Kattaa erilaiset eri alueiden verenvuototapahtumat, joita ei ole luetteloitu erikseen c Kattaa (hyvin yleinen) pneumoniitin, (yleinen) interstitiaalisen keuhkosairauden, keuhkoinfiltraatit ja (harvinainen) alveolien verenvuodon, keuhkotoksisuuden ja alveoliitin d Kattaa (hyvin yleinen) suutulehduksen, (yleinen) haavaisen suutulehduksen, suun ja kielen haavaumat sekä (melko harvinainen) kielikipu ja kielitulehdus e Yleisyysluokittelu perustuu 10‑55 –vuotiaista naisista saatuihin yhdistettyihin tietoihin f Haittavaikutus havaittu markkinoille tulon jälkeen. g Haittavaikutus määritettiin markkinoille tulon jälkeisten raporttien perusteella. Yleisyys määritettiin syöpätutkimusten yhdistettyjen turvallisuustietojen perusteella. | |||
Tiettyjen haittavaikutusten kuvaus
Kliinisissä tutkimuksissa ja markkinoille tulon jälkeisissä spontaaneissa raporteissa everolimuusi on yhdistetty vakaviin tapauksiin, joissa hepatiitti B on aktivoitunut uudelleen, myös sellaisiin joissa seurauksena on ollut kuolema. Immunosuppression aikana infektion uudelleen aktivoituminen on odotettu tapahtuma.
Sekä kliinisissä tutkimuksissa että spontaaneissa haittatapahtumaraporteissa everolimuusi on yhdistetty munuaisten vajaatoimintatapauksiin (kuolemaan johtavia tapauksia mukaan lukien) ja proteinuriaan. Munuaistoiminnan seuraamista on suositeltavaa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Kliinisissä tutkimuksissa ja markkinoille tulon jälkeisissä spontaaneissa haittavaikutusraporteissa everolimuusin käyttöön on liittynyt amenorreatapauksia (sekundaarista amenorreaa ja muita kuukautisiin liittyviä epäsäännöllisyyksiä).
Kliinisissä tutkimuksissa ja markkinoille tulon jälkeisissä spontaaneissa haittavaikutusraporteissa everolimuusin käyttöön on liittynyt PJP-/PCP‑tapauksia, jotkin kuolemaanjohtavia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Kliinisissä tutkimuksissa ja markkinoille tulon jälkeisissä spontaaneissa haittavaikutusraporteissa, angioedeema on raportoitu sekä ACE-estäjien yhteiskäytössä että yksinään (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Iäkkäät potilaat
Onkologian yhdistettyjen turvallisuustietojen mukaan 37 % Afinitor‑valmisteella hoidetuista potilaista oli ≥ 65‑vuotiaita. Niiden potilaiden lukumäärä, jotka keskeyttivät lääkehoidon haittavaikutusten vuoksi oli suurempi potilailla, jotka olivat ≥ 65‑vuotiaita (20 % vs 13 %). Yleisimmät hoidon keskeytymiseen johtaneet haittavaikutukset olivat pneumoniitti (myös interstitiaalinen keuhkosairaus), suutulehdus, väsymys ja hengenahdistus.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista liitteessä V luetellun kansallisen ilmoitusjärjestelmän kautta.
Yliannostus
Ihmisillä ilmoitetut yliannostuskokemukset ovat hyvin rajallisia. Akuutti siedettävyys on ollut hyväksyttävää enintään 70 mg kerta-annoksia annettaessa. Kaikissa yliannostustapauksissa tulee ryhtyä yleisluontoisiin tukitoimiin.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: solunsalpaajat, proteiinikinaasin estäjät, ATC-koodi: L01EG02
Vaikutusmekanismi
Everolimuusi on selektiivinen mTOR-estäjä (nisäkkään rapamysiinin kohde). mTOR on solun toiminnan kannalta keskeinen seriini‑treoniini‑kinaasi, jonka toiminnan tiedetään olevan yliaktiivista monissa ihmisen syövissä. Everolimuusi sitoutuu solunsisäiseen FKBP‑12‑proteiiniin ja muodostaa mTOR 1:n toimintaa estävän kompleksin (mTORC1:n).mTORC1‑signalointireitin estyminen häiritsee translaatiota ja proteiinisynteesiä vähentämällä ribosomaalisen S6-proteiinikinaasin (S6K1) ja eukaryoottien elongaatiotekijä 4E:tä sitovan proteiinin (4EBP‑1) toimintaa. Molemmat proteiinit säätelevät solusykliin, angiogeneesiin ja glykolyysiin osallistuvien proteiinien toimintaa. S6K1:n arvellaan fosforyloivan estrogeenireseptorin toiminnallista vaikutuskohtaa 1, joka aiheuttaa ligandista riippumattoman reseptorin aktivaation. Everolimuusi pienentää kasvaimen angiogeneesiä (uudisverisuonitusta) tehostavan verisuoniendoteelin kasvutekijän (VEGF) pitoisuuksia. Everolimuusi estää tehokkaasti kasvainsolujen, endoteelisolujen, fibroblastien ja verisuonten sileiden lihassolujen kasvua ja jakautumista, ja sen on osoitettu vähentävän kiinteissä kasvaimissa tapahtuvaa glykolyysiä in vitro ja in vivo.
Kliininen teho ja turvallisuus
Edennyt hormonireseptoripositiivinen rintasyöpä
Satunnaistetussa, kaksoisokkoutetussa vaiheen III BOLERO‑2 (CRAD001Y2301) monikeskustutkimuksessa verrattiin Afinitorin ja eksemestaanin yhdistelmää lumelääkkeen ja eksemestaanin yhdistelmään postmenopausaalisilla naisilla, joilla oli estrogeenireseptoripositiivinen, HER2/neu‑negatiivinen, edennyt rintasyöpä, joka oli uusiutunut tai edennyt aiemmin annetun letrotsoli- tai anastrotsolihoidon jälkeen. Satunnaistamisen ositus tapahtui aiemmalle hormoniterapialle todetun dokumentoidun herkkyyden ja todettujen viskeraalisten etäpesäkkeiden perusteella. Herkkyys aiemmalle hormonihoidolle määriteltiin tarkoittamaan joko (1) vähintään yhdestä aiemmasta hormonihoidosta saatua dokumentoitua kliinistä hyötyä (täydellinen vaste [CR], osittainen vaste [PR], vakaa tauti ≥ 24 viikkoa) edennyttä tautia sairastavalla tai (2) vähintään 24 kuukauden ajan saatua liitännäishormonihoitoa ennen taudin uusiutumista.
Tutkimuksen ensisijainen päätetapahtuma oli etenemisvapaa elossaolo, jonka tutkijalääkäri (paikallinen radiologi) arvioi RECIST‑kriteerien (Response Evaluation Criteria in Solid Tumors) perusteella. Etenemisvapaata elossaoloa koskevia tuloksia tukevat analyysit perustuivat riippumattoman radiologin keskitetysti tekemään arvioon.
Toissijaisia päätetapahtumia olivat kokonaiselossaolo (OS), objektiivinen vasteprosentti, kliininen hyöty, turvallisuus, elämänlaadun muutos ja aika toimintakykyluokituksen (Eastern Cooperative Oncology Group performance status, ECOG PS) heikkenemiseen.
Yhteensä 724 potilasta satunnaistettiin suhteessa 2:1 saamaan everolimuusin (10 mg/vrk) ja eksemestaanin (25 mg/vrk) yhdistelmää (n = 485) tai lumelääkkeen ja eksemestaanin yhdistelmää (25 mg/vrk) (n = 239). Lopullisen OS-analyysin ajankohtana everolimuusihoidon keston mediaani oli 24,0 viikkoa (vaihteluväli 1,0‑199,1 viikkoa). Eksemestaanihoidon keston mediaani oli pidempi everolimuusin ja eksemestaanin yhdistelmää saaneiden ryhmässä, jossa hoidon kesto oli 29,5 viikkoa (1,0‑199,1) kuin lumelääkettä ja eksemestaania saaneiden ryhmässä, jossa hoidon kesto oli 14,1 viikkoa (1,0‑156,0).
Ensisijaisen päätetapahtuman tehoa koskevat tulokset saatiin lopullisesta etenemisvapaata elossaoloa koskeneesta analyysista (ks. taulukko 4 ja kuva 1). Lumelääkkeen ja eksemestaanin yhdistelmää saaneiden ryhmässä potilaat eivät vaihtaneet käyttämään everolimuusia taudin etenemisen hetkellä.
Taulukko 4 BOLERO‑2, tehoa koskevat tulokset
Analyysi | Afinitora n = 485 | Lumelääkea n = 239 | Riskisuhde | p-arvo |
Etenemisvapaan elossaoloajan mediaani (kk) (95 % lv) | ||||
Tutkijan radiologinen arvio | 7,8 (6,9‑8,5) | 3,2 (2,8‑4,1) | 0,45 (0,38‑0,54) | < 0,0001 |
Riippumaton radiologinen arvio | 11,0 (9,7‑15,0) | 4,1 (2,9‑5,6) | 0,38 (0,31‑0,48) | < 0,0001 |
Kokonaiselossaolon mediaani (kk) (95 % lv) | ||||
Kokonaiselossaolon mediaani | 31,0 (28,0‑34,6) | 26,6 (22,6‑33,1) | 0,89 (0,73‑1,10) | 0,1426 |
Paras kokonaisvaste (%) (95 % lv) | ||||
Objektiivinen vastelukub | 12,6 % (9,8‑15,9) | 1,7 % (0,5‑4,2) | n/ad | < 0,0001e |
Kliininen hyötyc | 51,3 % (46,8‑55,9) | 26,4 % (20,9‑32,4) | n/ad | < 0,0001e |
a Yhdessä eksemestaanin kanssa b Objektiivinen vasteluku = niiden potilaiden osuus, jotka saivat täydellisen tai osittaisen vasteen c Kliininen hyöty = niiden potilaiden osuus, jotka saivat täydellisen tai osittaisen vasteen tai joiden tauti oli vakaa ≥ 24 viikon ajan d Ei sovellettavissa e p-arvo lasketaan tarkasta Cochran–Mantel–Haenszel-testistä käyttäen Cochran-Armitage permutaatiotestin ositettua versiota | ||||
Kuva 1 BOLERO‑2 Etenemisvapaa elossaolo: Kaplan−Meier-käyrät (tutkijan radiologinen arvio)
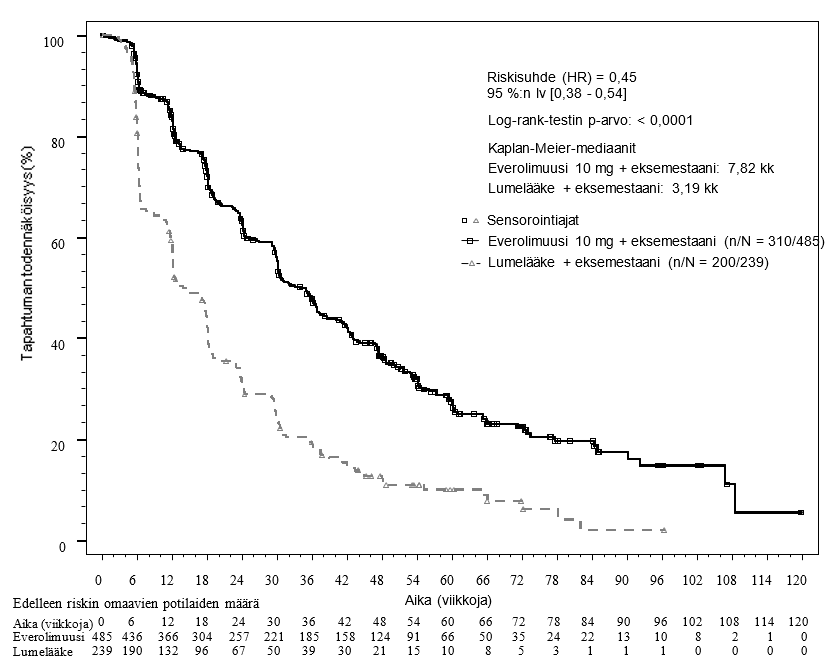
Tutkijan arvioon perustuneen etenemisvapaan elossaolon suunniteltu alaryhmäanalyysi tuki arviota hoidon vaikutuksesta etenemisvapaaseen elossaoloon. Everolimuusin ja eksemestaanin yhdistelmää saaneiden hoitoryhmässä todettiin kaikkien analysoitujen alaryhmien (ikä, herkkyys aiemmalle hormonaaliselle hoidolle, syöpäsairaiden elinten lukumäärä, pelkkien luuleesioiden olemassaolo lähtötilanteessa sekä viskeraalisten metastaasien olemassaolo, ja analyysit tärkeimmistä demografisista ja prognostisista alaryhmistä) osalta positiivinen hoitovaikutus verrattuna lumelääkkeen ja eksemestaanin yhdistelmään, riskisuhde oli 0,25‑0,60.
Kahden hoitoryhmän välillä ei todettu eroa ajassa yleisen elämänlaadun ja toimintakyvyn QLQ-C30-pisteiden heikkenemiseen ≥ 5 %:lla.
Kolmiryhmäisessä, satunnaistetussa, avoimessa vaiheen II BOLERO-6-tutkimuksessa (CRAD001Y2201) verrattiin everolimuusin ja eksemestaanin yhdistelmää pelkkään everolimuusiin ja kapesitabiiniin postmenopausaalisilla naisilla, joilla oli estrogeenireseptoripositiivinen, HER2/neu-negatiivinen paikallisesti edennyt, uusiutunut tai metastasoitunut rintasyöpä, joka oli uusiutunut tai edennyt aiemmin annetun letrotsoli- tai anastrotsolihoidon jälkeen.
Tutkimuksen ensisijaisena tavoitteena oli arvioida etenemisvapaan elossaolon riskisuhdetta everolimuusin ja eksemestaanin yhdistelmän käytössä pelkkään everolimuusiin verrattuna.
Tärkeimpänä toissijaisena tavoitteena oli arvioida etenemisvapaan elossaolon riskisuhdetta everolimuusin ja eksemestaanin yhdistelmän käytössä kapesitabiiniin verrattuna.
Muita toissijaisia tavoitteita olivat kokonaiselossaolon, objektiivisen vasteprosentin, kliinisen hyötyprosentin, turvallisuuden, ECOG-toimintakykyluokan heikkenemiseen kuluvan ajan, elämänlaadun heikkenemiseen kuluvan ajan ja hoitotyytyväisyyden arviointi. Muodollisia tilastollisia vertailuja ei suunniteltu.
Yhteensä 309 potilaista satunnaistettiin suhteessa 1:1:1 saamaan everolimuusin (10 mg/vrk) + eksemestaanin (25 mg/vrk) yhdistelmää (n = 104), pelkkää everolimuusia (10 mg/vrk) (n = 103) tai kapesitabiinia (1 250 mg/m2 annos kahdesti vuorokaudessa 2 viikon ajan ja sen jälkeen viikon tauko; 3 viikon hoitojakso) (n = 102). Tiedonkeruun katkaisuhetkenä hoidon keston mediaani oli 27,5 viikkoa (vaihteluväli 2,0–165,7) everolimuusin ja eksemestaanin yhdistelmää saaneiden ryhmässä, 20 viikkoa (1,3–145,0) everolimuusiryhmässä ja 26,7 viikkoa (1,4–177,1) kapesitabiiniryhmässä.
Lopullinen etenemisvapaata elossaoloa koskenut analyysi perustui 154:ään havaittuun etenemisvapaan elossaolon tapahtumaan, jotka paikallinen tutkija oli arvioinut. Tulosten perusteella arvioitu riskisuhde oli 0,74 (90 % lv: 0,57–0,97), everolimuusin ja eksemestaanin yhdistelmää saaneiden ryhmän eduksi suhteessa everolimuusiryhmään. Etenemisvapaan elossaolon mediaani yhdistelmähoitoryhmässä oli 8,4 kk (90 % lv: 6,6–9,7) ja everolimuusiryhmässä 6,8 kk (90 % lv: 5,5–7,2).
Kuva 2 BOLERO‑6 Etenemisvapaa elossaolo: Kaplan−Meier-käyrät (tutkijan radiologinen arvio)
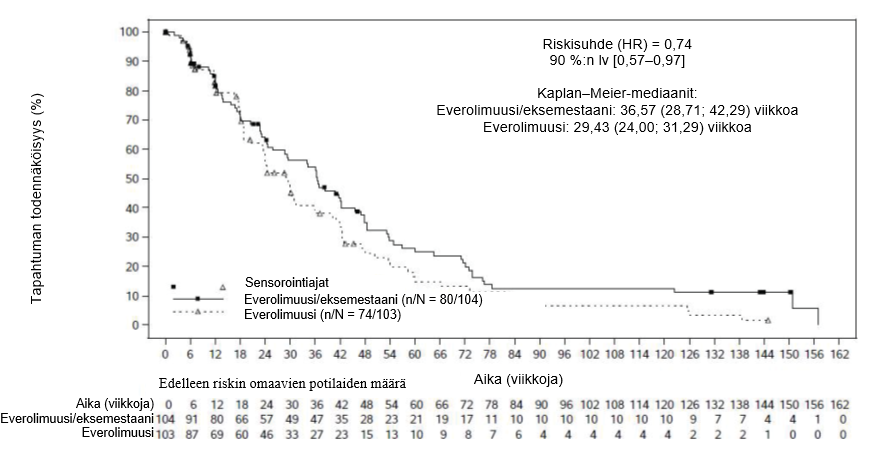
Tärkeimmässä toissijaisessa päätetapahtumassa eli etenemisvapaassa elossaolossa arvioitu riskisuhde oli 1,26 (90 % lv: 0,96–1,66) kapesitabiiniryhmän eduksi suhteessa everolimuusin ja eksemestaanin yhdistelmää saaneiden ryhmään, perustuen yhteensä 148 havaittuun etenemisvapaan elossaolon tapahtumaan.
Kokonaiselossaoloa koskevan toissijaisen päätetapahtuman tulokset eivät olleet yhdenmukaisia etenemisvapaata elossaoloa koskevan ensisijaisen päätetapahtuman kanssa; havaitun trendin perusteella tulokset olivat paremmat pelkkää everolimuusia saaneiden ryhmässä. Kokonaiselossaolon arvioitu riskisuhde oli 1,27 (90 % lv: 0,95–1,70) pelkkää everolimuusia saaneiden ryhmässä verrattaessa everolimuusin ja eksemestaanin yhdistelmää saaneiden ryhmään. Everolimuusin ja eksemestaanin yhdistelmää saaneiden ryhmän kokonaiselossaolon arvioitu riskisuhde oli 1,33 (90 % lv: 0,99–1,79) verrattaessa kapesitabiiniryhmään.
Edenneet haiman neuroendokriiniset kasvaimet
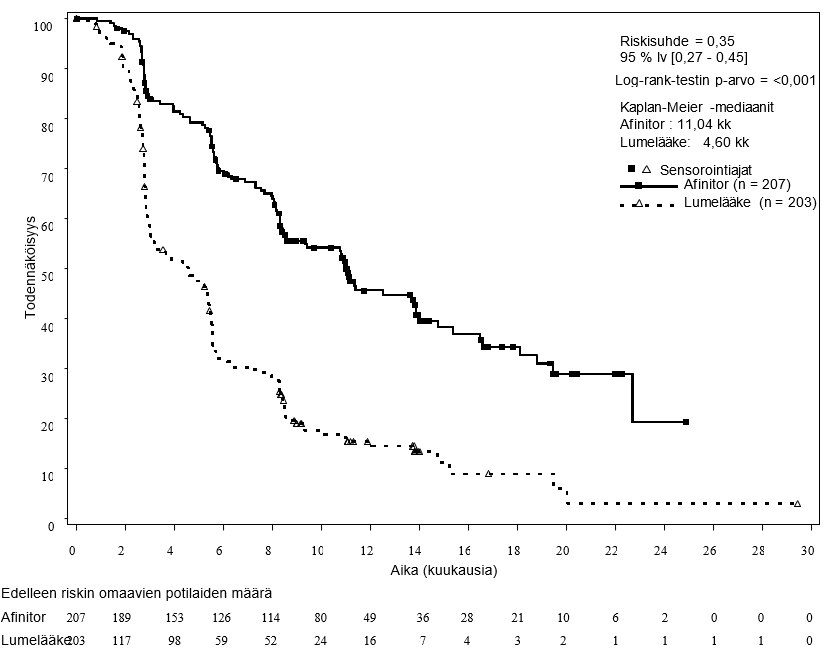
Satunnaistetussa, kaksoissokkoutetussa vaiheen III RADIANT‑3- monikeskustutkimuksessa (CRAD001C2324‑tutkimus) verrattiin Afinitorin ja parhaan mahdollisen tukihoidon yhdistelmää lumelääkkeen ja parhaan mahdollisen tukihoidon yhdistelmään potilailla, joilla oli edenneitä haiman neuroendokriinisiä kasvaimia. Afinitor-hoidolla todettiin olevan tilastollisesti merkitseviä kliinisiä etuja lumelääkkeeseen verrattuna, sillä se pidensi etenemisvapaan elossaolon mediaanin 2,4-kertaiseksi (11,04 kk vs 4,6 kk), (riskisuhde 0,35; 95 % lv 0,27–0,45; p < 0,0001) (ks. taulukko 5 ja kuva 3).
RADIANT‑3-tutkimukseen osallistui potilaita, joilla oli hyvin erilaistuneita tai kohtalaisesti erilaistuneita, edenneitä haiman neuroendokriinisiä kasvaimia ja joiden tauti oli edennyt edeltävien 12 kk aikana. Somatostatiinianalogien käyttö sallittiin osana parasta mahdollista tukihoitoa.
Tutkimuksen ensisijainen päätetapahtuma oli etenemisvapaa elossaolo, joka arvioitiin RECIST‑kriteerien (Response Evaluation Criteria in Solid Tumors) perusteella. Jos taudin todettiin edenneen dokumentoitujen radiologisten löydösten perusteella, tutkija saattoi purkaa potilaan sokkoutuksen. Tällöin myös lumeryhmään satunnaistetut potilaat saivat mahdollisuuden saada Afinitor-hoitoa avoimesti.
Toissijaisia päätetapahtumia olivat turvallisuus, objektiivinen vasteprosentti, vasteen kesto ja kokonaiselossaolo (OS).
Yhteensä 410 potilasta satunnaistettiin suhteessa 1:1 saamaan joko Afinitor‑hoitoa 10 mg/vrk (n = 207) tai lumehoitoa (n = 203). Demografiset tiedot olivat molemmissa ryhmissä samaa luokkaa (mediaani-ikä 58 v, 55 % miehiä, 78,5 % valkoihoisia). Molemmissa ryhmissä 58 % potilaista oli saanut aiempaa systeemistä hoitoa. Sokkoutetun tutkimushoidon mediaanikesto oli 37,8 viikkoa (vaihteluväli 1,1–129,9 viikkoa) everolimuusia saaneilla potilailla ja 16,1 viikkoa (vaihteluväli 0,4–147,0 viikkoa) lumelääkettä saaneilla potilailla.
Alun perin lumeryhmään satunnaistetuista potilaista 172 potilasta 203:sta (84,7 %) siirtyi taudin etenemisen tai tutkimuskoodin avaamisen jälkeen avoimeen Afinitor-hoitoon. Kaikkien tutkimukseen osallistuneiden potilaiden avoimen hoidon mediaanikesto oli 47,7 viikkoa. Mediaanikesto oli 67,1 viikkoa niillä 53 potilaalla, jotka alun alkaen oli satunnaistettu everolimuusiryhmään ja jotka jatkoivat hoitoaan avoimen everolimuusin käytöllä, sekä 44,1 viikkoa niillä 172 potilaalla, jotka alun alkaen oli satunnaistettu lumelääkeryhmään ja jotka siirtyivät käyttämään avointa everolimuusia.
Taulukko 5 RADIANT‑3 – tehoa koskevat tulokset
Populaatio | Afinitor n = 207 | Lume n = 203 | Riskisuhde (95 % lv) | p-arvo |
Etenemisvapaan elinajan mediaani (kk) (95 % lv) | ||||
Tutkijan radiologinen arvio | 11,04 (8,41, 13,86) | 4,60 (3,06, 5,39) | 0,35 (0,27, 0,45) | < 0,0001 |
Riippumaton radiologinen arvio | 13,67 (11,17, 18,79) | 5,68 (5,39, 8,31) | 0,38 (0,28, 0,51) | < 0,0001 |
Kokonaiselossaolon mediaani (kk) (95 % lv) | ||||
Kokonaiselossaolon mediaani | 44,02 (35,61, 51,75) | 37,68 (29,14, 45,77) | 0,94 (0,73, 1,20) | 0,300 |
Kuva 3 RADIANT‑3 – Etenemisvapaa elossaolo: Kaplan–Meier-käyrät (tutkijoiden radiologisten arviointien perusteella)
Edenneet ruoansulatuskanavan tai keuhkojen neuroendokriiniset kasvaimet
RADIANT-4 (tutkimus CRAD001T2302) oli satunnaistettu, kaksoissokkoutettu vaiheen III monikeskustutkimus, jossa Afinitorin ja parhaan mahdollisen tukihoidon yhdistelmää verrattiin lumelääkkeen ja parhaan mahdollisen tukihoidon yhdistelmään potilailla, joilla oli edenneitä, hyvin erilaistuneita (gradus 1 tai gradus 2), ei-toiminnallisia ruoansulatuskanavan tai keuhkojen neuroendokriinisia kasvaimia ja joilla ei ollut anamneesissa karsinoidioireyhtymää eikä aktiivisia karsinoidioireyhtymään liittyviä oireita.
Tutkimuksen ensisijainen päätetapahtuma oli etenemisvapaa elossaolo, joka arvioitiin RECIST-kriteerein ja perustui riippumattomaan radiologiseen arvioon. Etenemisvapaata elossaoloa tutkittiin myös lisäanalyysissä, joka perustui paikallisen tutkijan arvioon. Toissijaisia päätetapahtumia olivat kokonaiselossaolo, kokonaisvasteprosentti, taudin hallintaprosentti, turvallisuus, elämänlaadun muutos (FACT-G) ja aika Maailman terveysjärjestön (WHO) toimintakykyluokan heikkenemiseen.
Yhteensä 302 potilasta satunnaistettiin suhteessa 2:1 saamaan joko everolimuusia (10 mg vuorokaudessa) (n = 205) tai lumelääkettä (n = 97). Ryhmät olivat yleisesti ottaen tasapainossa demografisten tietojen ja taudin piirteiden suhteen (mediaani-ikä 63 v [vaihteluväli 22–86], 76 % valkoihoisia, somatostatiinianalogien [SSA] käyttöanamneesi). Sokkoutetun hoidon mediaanikesto oli Afinitor-ryhmässä 40,4 viikkoa ja lumeryhmässä 19,6 viikkoa. Etenemisvapaan elossaolon ensisijaisen analyysin jälkeen 6 potilasta siirtyi lumelääkeryhmästä avoimeen everolimuusihoitoon.
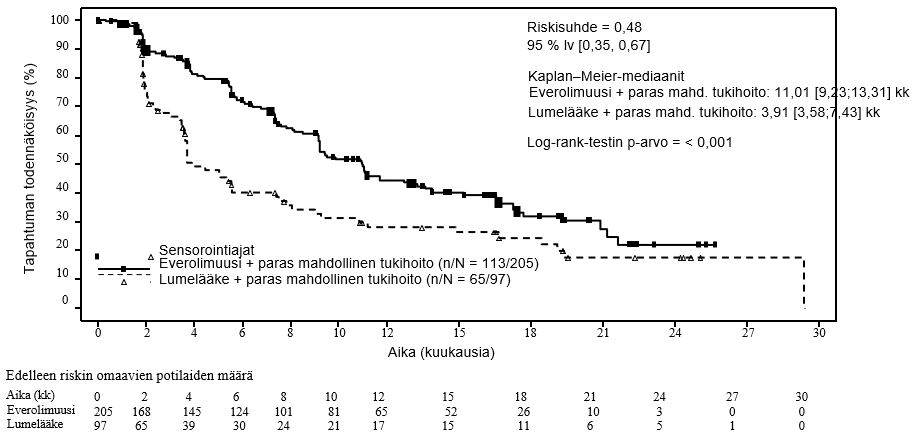
Ensisijaista päätetapahtumaa, etenemisvapaata elossaoloa (riippumaton radiologinen arvio), koskevat tehotulokset perustuivat etenemisvapaan elossaolon lopulliseen analyysiin (ks. taulukko 6 ja kuva 4). Etenemisvapaata elossaoloa (tutkijan radiologinen arvio) koskevat tehotulokset saatiin lopullisesta kokonaiselinajan analyysistä (ks. taulukko 6).
Taulukko 6 RADIANT-4 – etenemisvapaata elossaoloa koskevat tulokset
Populaatio | Afinitor n = 205 | Lumelääke n = 97 | Riskisuhde (95 % lv) | p-arvoa |
Etenemisvapaan elinajan mediaani (kk) (95 % lv) | ||||
Riippumaton radiologinen arvio | 11,01 (9,2, 13,3) | 3,91 (3,6, 7,4) | 0,48 (0,35, 0,67) | < 0,001 |
Tutkijan radiologinen arvio | 14,39 (11,24, 17,97) | 5,45 (3,71, 7,39) | 0,40 (0,29, 0,55) | < 0,001 |
aYksitahoinen p-arvo, perustuu stratifioituun log-rank-testiin | ||||
Kuva 4 RADIANT-4 – Etenemisvapaa elossaolo: Kaplan−Meier-käyrät (riippumaton radiologinen arvio)
Lisäanalyyseissä on todettu positiivinen hoitovaikutus kaikissa alaryhmissä lukuun ottamatta alaryhmää, jonka potilaiden primaarikasvain sijaitsi ileumissa (ileum: HR = 1,22 [95 % lv 0,56–2,65]; muu kuin ileum: HR = 0,34 [95 % lv 0,22–0,54]; keuhko: HR = 0,43 [95 % lv 0,24–0,79]) (ks. kuva 5).
Kuva 5 RADIANT-4 – Etenemisvapaan elossaolon tulokset ennalta määriteltyjen potilasryhmien mukaisesti esitettyinä (riippumaton radiologinen arvio)
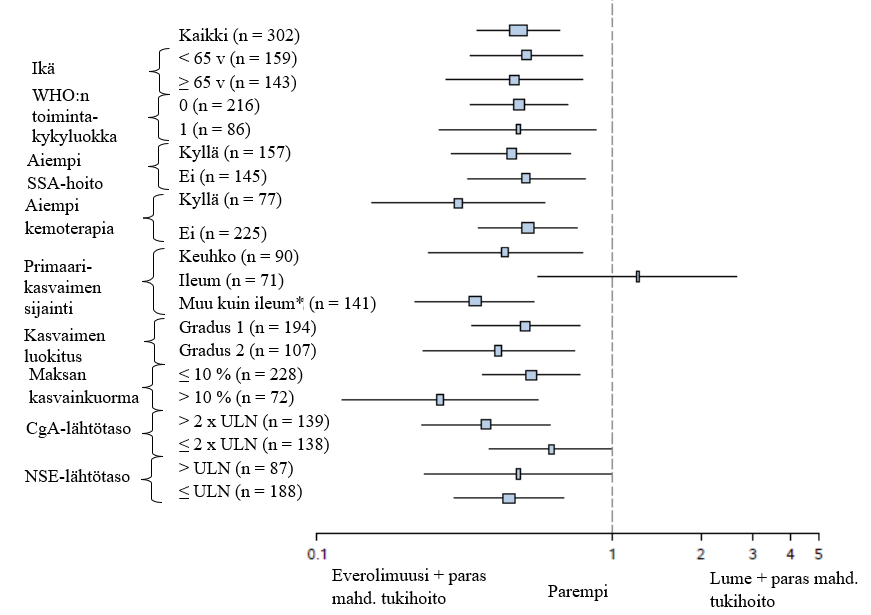
* Muu kuin ileum: mahalaukku, paksusuoli, peräsuoli, umpilisäke, umpisuoli, pohjukaissuoli, jejunum, karsinooman primaarisijainti tuntematon tai lähtökohta muualla ruoansulatuskanavan alueella
ULN: viitearvojen yläraja
CgA: kromograniini A
NSE: neuronispesifinen enolaasi
Riskisuhde (95 % lv) perustuu stratifioituun Coxin malliin.
Kokonaiselinajan lopullinen analyysi ei osoittanut tilastollisesti merkitsevää eroa Afinitoria tai lumelääkettä saaneiden potilaiden välillä tutkimuksen sokkoutetun vaiheen aikana (HR = 0,90 [95 % lv: 0,66-1,22]).
Ryhmien välillä ei todettu eroa WHO:n toimintakykyluokan selvään heikkenemiseen (HR = 1,02; [95 % lv: 0,65-1,61]) kuluneessa ajassa eikä ajassa, joka kului elämänlaadun selvään heikkenemiseen (FACT-G-kokonaispisteiden HR = 0,74; [95 % lv: 0,50-1,10]).
Edennyt munuaiskarsinooma
Everolimuusia (10 mg/vrk) ja lumelääkettä, joita käytettiin yhdessä parhaan mahdollisen tukihoidon kanssa, vertailtiin vaiheen III kansainvälisessä, satunnaistetussa, kaksoissokkoutetussa RECORD‑1-monikeskustutkimuksessa (CRAD001C2240‑tutkimus) potilailla, joiden etäpesäkkeinen munuaiskarsinooma oli edennyt aiemman VEGFR‑tyrosiinikinaasinestäjähoidon aikana tai sen jälkeen (kyseessä joko sunitinibi, sorafenibi tai molemmat). Myös aiempi bevasitsumabi- ja alfainterferonihoito sallittiin. Potilaat stratifioitiin Memorial Sloan-Kettering Cancer Center- eli MSKCC-keskuksen ennustepisteiden (hyvän, kohtalaisen ja huonon ennusteen ryhmät) ja aiempien syöpähoitojen määrän (1 tai 2 aiempaa VEGFR‑tyrosiinikinaasin estäjähoitoa) perusteella.
Ensisijainen päätetapahtuma oli etenemisvapaa elinaika. Se dokumentoitiin RECIST‑kriteerien (Response Evaluation Criteria in Solid Tumours) perusteella ja arvioitiin sokkoutetun, riippumattoman keskitetyn arvioinnin avulla. Toissijaisia päätetapahtumia olivat siedettävyys, objektiivinen kasvainhoitovaste, kokonaiselossaoloaika, tautiin liittyvät oireet ja elämänlaatu. Jos dokumentoitujen radiologisten löydösten perusteella todettiin taudin edenneen, tutkija saattoi purkaa potilaan sokkoutuksen, jolloin lumeryhmään satunnaistetut henkilöt saivat mahdollisuuden käyttää avointa everolimuusihoitoa 10 mg vuorokausiannoksilla. Riippumaton tietojen seurantaryhmä (Independent Data Monitoring Committee) suositteli toisen välianalyysin yhteydessä, että tutkimus lopetettaisiin, sillä ensisijainen päätetapahtuma oli saavutettu.
Yhteensä 416 potilasta satunnaistettiin suhteessa 2:1 saamaan Afinitor-hoitoa (n = 277) tai lumehoitoa (n = 139). Demografiset tiedot olivat molemmissa ryhmissä samaa luokkaa (poolattujen tietojen mukaan mediaani-ikä oli 61 v [vaihteluväli 27‑85], 78 % oli miehiä, 88 % valkoihoisia, 74 % oli saanut yhtä aiempaa VEGFR-tyrosiinikinaasin estäjähoitoa ja 26 % taas kahta tällaista hoitoa). Sokkoutetun tutkimushoidon mediaanikesto oli 141 päivää (vaihteluväli 19‑451 päivää) everolimuusia saaneilla potilailla ja 60 päivää (vaihteluväli 21–295 päivää) lumelääkettä saaneilla potilailla.
Afinitor oli tilastollisesti merkittävissä määrin tehokkaampi kuin lumehoito ensisijaisen etenemisvapaan elinajan -päätetapahtuman suhteen. Afinitor pienensi taudin etenemisen tai kuoleman riskiä 67 % (ks. taulukko 7 ja kuva 6).
Taulukko 7 RECORD‑1 – Tulokset: taudin etenemisvapaa elinaika
Populaatio | n | Afinitor n = 277 | Lumelääke n = 139 | Riskisuhde (95 % luottamusväli) | p-arvo |
Mediaani taudin etenemisvapaa elinaika (kk) (95 % lv) | |||||
Ensisijainen analyysi | |||||
Kaikki (sokkoutettu, riippumaton keskitetty arviointi) | 416 | 4,9 (4,0‑5,5) | 1,9 (1,8‑1,9) | 0,33 (0,25‑0,43) | < 0,0001a |
Supportiiviset/herkkyysanalyysit | |||||
Kaikki (tutkijan paikallinen arviointi) | 416 | 5,5 (4,6‑5,8) | 1,9 (1,8‑2,2) | 0,32 (0,25‑0,41) | < 0,0001a |
MSKCC‑ennustepisteet (sokkoutettu, riippumaton keskitetty arviointi) | |||||
Hyvä ennuste | 120 | 5,8 (4,0‑7,4) | 1,9 (1,9‑2,8) | 0,31 (0,19‑0,50) | < 0,0001 |
Kohtalainen ennuste | 235 | 4,5 (3,8‑5,5) | 1,8 (1,8‑1,9) | 0,32 (0,22‑0,44) | < 0,0001 |
Huono ennuste | 61 | 3,6 (1,9‑4,6) | 1,8 (1,8‑3,6) | 0,44 (0,22‑0,85) | 0,007 |
a Stratifioitu log‑rank‑testi | |||||
Kuva 6 RECORD‑1 – Etenemisvapaa elinaika: Kaplan–Meier-käyrät (riippumaton keskitetty arviointi)
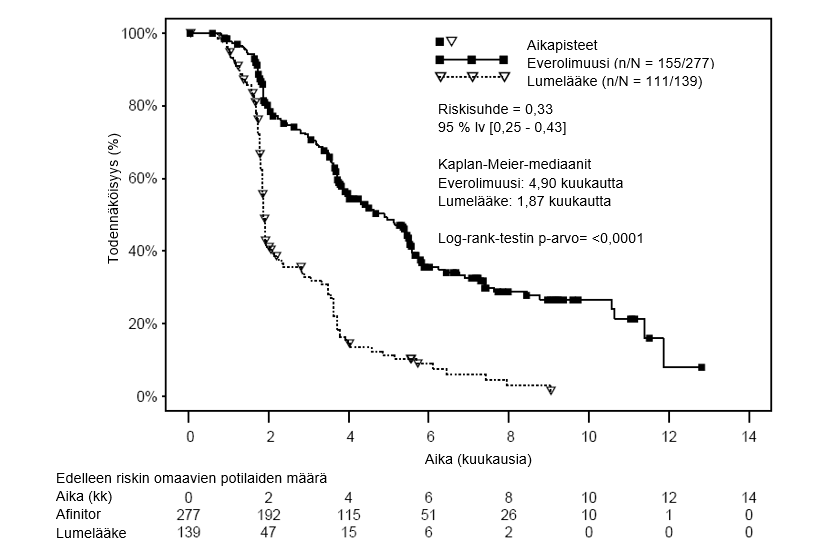
Afinitor-ryhmässä etenemisvapaa elinaikaprosentti oli 6 kk kohdalla 36 % ja lumeryhmässä 9 %.
Afinitor-ryhmässä 5 potilaalla (2 %) todettiin vahvistettu osittainen kasvaimen hoitovaste, lumeryhmässä taas ei kenelläkään. Etenemisvapaa elinaika parani lähinnä populaatiossa, jossa taudin eteneminen pysähtyi (vastaten 67 prosenttia Afinitor-hoitoryhmästä).
Kokonaiselossaolossa ei todettu tilastollisesti merkitsevää hoitoon liittyvää eroa (riskisuhde 0,87, luottamusväli 0,65–1,17, p = 0,177). Lumeryhmään satunnaistettujen potilaiden siirtyminen taudin etenemisen jälkeen avoimeen Afinitor-hoitoon vaikeutti hoitoon liittyvien erojen havaitsemista kokonaiselossaolon kohdalla.
Muut tutkimukset
Afinitor-hoitoa saavilla potilailla suutulehdus on yleisimmin raportoitu haittavaikutus (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset). Myyntiluvan myöntämisen jälkeisessä, yksihaaraisessa tutkimuksessa postmenopausaalisille, edennyttä rintasyöpää sairastaville potilaille (N=92) annettiin paikallishoitona alkoholitonta deksametasonioraaliliuosta 0,5 mg/5 ml suuvetenä (4 kertaa päivässä ensimmäisten 8 hoitoviikon aikana) vähentämään suutulehduksen esiintyvyyttä ja vaikeusastetta. Samanaikaisesti potilaille aloitettiin Afinitor-hoito (10 mg/vrk) yhdessä eksemestaanin (25 mg/vrk) kanssa. Vaikeusasteen ≥ 2 suutulehduksen esiintyvyys oli viikon 8 kohdalla 2,4 % (n=2/85 arvioitavista potilaista), joka on vähemmän kuin historiallisesti on raportoitu. Vaikeusasteen 1 suutulehduksen esiintyvyys oli 18,8 % (n=16/85), eikä vaikeusasteen 3 tai 4 suutulehduksia raportoitu. Kokonaisuudessaan tutkimuksen turvallisuusprofiili oli yhdenmukainen everolimuusin aikaisemmin havaitun turvallisuustiedon kanssa (ml. onkologiset ja tuberoosiskleroosiin liittyvät indikaatiot). Poikkeuksena oli suun kandidiaasi, jonka esiintyvyys oli hieman korkeampi ja jota raportoitiin 2,2 % (n=2/92) potilaista.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Afinitor-valmisteen käytöstä haiman neuroendokriinisten kasvainten, rintakehän neuroendokriinisten kasvainten ja munuaissolukarsinooman hoidossa kaikissa pediatrisissa potilasryhmissä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Potilailla, joilla oli edenneitä kiinteitä kasvaimia, everolimuusin huippupitoisuuksien (Cmax) saavuttamiseen kulunut mediaaniaika oli 1 tunti, kun 5 mg tai 10 mg everolimuusiannos otettiin kerran vuorokaudessa joko tyhjään mahaan tai pienen rasvattoman välipalan yhteydessä. Cmax on suhteessa annokseen 5‑10 mg annoksia käytettäessä. Everolimuusi on P-gp:n substraatti ja estää kohtalaisessa määrin P-gp-toimintaa.
Ruoan vaikutus
Terveillä henkilöillä runsasrasvaiset ateriat pienensivät 10 mg:n everolimuusiannoksilla saavutettua systeemistä altistusta (AUC-arvoilla mitattuna) 22 %, ja huippupitoisuus plasmassa (Cmax) pieneni 54 %. Vähärasvainen ateria pienensi AUC-arvoa 32 % ja Cmax-arvoa 42 %. Vaikuttaa kuitenkin siltä, että ruoka ei vaikuttanut elimistöön imeytyneen lääkkeen pitoisuus-aikaprofiiliin.
Jakautuminen
Veren ja plasman everolimuusipitoisuuksien suhde riippuu lääkkeen pitoisuuksista ja on 17‑73 %, kun pitoisuus on 5‑5 000 ng/ml. Syöpäpotilailla, jotka käyttävät 10 mg:n everolimuusiannoksia vuorokaudessa, noin 20 % kokoveren everolimuusista on plasmassa. Sitoutuminen plasman proteiineihin on noin 74-prosenttista sekä terveillä henkilöillä että potilailla, joilla on keskivaikea maksan vajaatoiminta. Potilailla, joilla oli edenneitä kiinteitä kasvaimia, näennäisen sentraalisen tilan jakautumistilavuus (Vd) oli 191 l ja näennäisen perifeerisen tilan jakautumistilavuus 517 l.
Biotransformaatio
Everolimuusi on CYP3A4:n ja P‑gp:n substraatti. Kun lääke otetaan suun kautta, tärkein ihmisen verenkierrossa havaittava komponentti on everolimuusi. Ihmisveressä on havaittu kuusi everolimuusin päämetaboliittia, joista kolme on monohydroksyloituneita metaboliitteja, kaksi taas rengasrakenteen hydrolyysin kautta muodostuvia metaboliitteja ja yksi everolimuusin fosfatidyylikoliinikonjugaatti. Näitä metaboliitteja havaittiin myös eläimillä tehdyissä toksisuustutkimuksissa, ja niiden aktiviteetti vaikutti olevan noin 100 kertaa pienempi kuin kanta-aineen. Näin ollen everolimuusin katsotaan aikaansaavan valtaosan farmakologisesta kokonaisvaikutuksesta.
Eliminaatio
10 mg/vrk everolimuusiannosten oraalisen puhdistuman (Cl/F) keskiarvo oli 24,5 l/h potilailla, joilla oli edenneitä kiinteitä kasvaimia. Everolimuusin eliminaation puoliintumisaika on keskimäärin noin 30 tuntia.
Syöpäpotilailla ei ole tehty spesifisiä eliminaatiotutkimuksia, mutta käytettävissä on elinsiirtopotilailla tehdyistä tutkimuksista saatuja tietoja. Kun kerta‑annos radioaktiivisesti leimattua everolimuusia otettiin yhdessä siklosporiinin kanssa, 80 % radioaktiivisuudesta erittyi ulosteeseen ja 5 % virtsaan. Kanta-ainetta ei havaittu sen paremmin virtsassa kuin ulosteessakaan.
Vakaan tilan farmakokinetiikka
Kun everolimuusia annettiin potilaille, joilla oli edenneitä kiinteitä kasvaimia, vakaan tilan AUC0‑τ oli suhteessa annokseen 5‑10 mg vuorokausiannoksia käytettäessä. Vakaa tila saavutettiin kahdessa viikossa. Cmax on suhteessa annokseen 5‑10 mg annoksia käytettäessä. tmax on 1‑2 tuntia annoksen jälkeen. Vakaassa tilassa AUC0‑τ-arvon ja annosta edeltävien minimipitoisuuksien välillä oli merkitsevä korrelaatio.
Erityisryhmät
Maksan vajaatoiminta
Everolimuusin turvallisuutta, siedettävyyttä ja farmakokinetiikkaa arvioitiin kahdessa tutkimuksessa, joissa 8 ja 34 tutkittavalle, joilla maksan toiminta oli heikentynyt, annettiin suun kautta kerta-annos Afinitor-tabletteja ja heitä verrattiin potilaisiin, joiden maksan toiminta oli normaali.
Ensimmäisessä tutkimuksessa everolimuusin AUC-keskiarvo 8 potilaalla, joilla oli keskivaikea maksan vajaatoiminta (Child–Pugh-luokka B), oli kaksinkertainen verrattuna 8 potilaaseen, joiden maksan toiminta oli normaali.
Toiseen tutkimukseen osallistui 34 potilasta, joilla oli eriasteista maksan vajaatoimintaa. Normaaleihin henkilöihin verrattuna altistus (AUC0-inf) suureni 1,6-kertaiseksi kun maksan vajaatoiminta oli lievää (Child–Pugh-luokka A), 3,3-kertaiseksi kun maksan vajaatoiminta oli keskivaikeaa (Child–Pugh-luokka B) ja 3,6-kertaiseksi kun maksan vajaatoiminta oli vaikeaa (Child–Pugh-luokka C).
Toistuvien annosten farmakokinetiikan simulaatiot tukevat Child–Pugh-luokitukseen perustuvien annossuositusten käyttöä maksan vajaatoimintapotilailla.
Näiden kahden tutkimuksen tulosten perusteella annoksen muuttamista suositellaan potilaille, joilla on maksan vajaatoiminta (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Munuaisten vajaatoiminta
Kun populaatiofarmakokinetiikan analyysissä tutkittiin 170 potilasta, joilla oli edenneitä kiinteitä kasvaimia, kreatiniinipuhdistuman (25‑178 ml/min) ei havaittu vaikuttavan merkitsevässä määrin everolimuusin oraaliseen puhdistumaan. Elinsiirron jälkeinen munuaisten vajaatoiminta (kreatiniinipuhdistuman vaihteluväli 11‑107 ml/min) ei vaikuttanut everolimuusin farmakokinetiikkaan elinsiirtopotilailla.
Iäkkäät potilaat
Syöpäpotilailla tehdyssä populaatiofarmakokinetikan analyysissä ei havaittu, että ikä (27‑85 v) olisi vaikuttanut merkitsevässä määrin everolimuusin oraaliseen puhdistumaan.
Etninen tausta
Oraalinen puhdistuma (Cl/F) on samaa luokkaa japanilaisilla ja valkoihoisilla syöpäpotilailla, joiden maksan toiminta on samanlaista. Populaatiofarmakokinetiikan analyysin perusteella Cl/F on mustilla elinsiirtopotilailla keskimäärin 20 % suurempi.
Prekliiniset tiedot turvallisuudesta
Everolimuusin turvallisuusprofiilia arvioitiin prekliinisesti hiirellä, rotalla, kääpiösialla, apinalla ja kanilla. Tärkeimmät kohde-elimet olivat molempien sukupuolten sukuelimet (kivesten siementiehyiden degeneraatio, siittiöiden määrän pieneneminen lisäkiveksissä ja kohdun atrofia) useilla lajeilla, keuhkot (alveolien makrofagimäärän suureneminen) rotalla ja hiirellä, haima (eksokriinisisten solujen degranulaatio ja vakuolisaatio apinoissa ja miniporsaissa vastaavasti, ja saarekesolujen degeneroituminen apinoissa) ja silmät (mykiön etusauman sameus) ainoastaan rotalla. Vähäisiä munuaismuutoksia havaittiin rotalla (ikään liittyvän lipofuskiinikertymän paheneminen munuaistubulusten epiteelissä, hydronefroosin lisääntyminen) ja hiirellä (taustamuutosten paheneminen). Apinalla ja kääpiösialla ei havaittu viitteitä munuaistoksisuudesta.
Everolimuusi vaikutti pahentavan spontaanisti eläinten perussairauksia (krooninen myokardiitti rotalla, plasman ja sydämen coxsackievirusinfektiot apinalla, ruoansulatuskanavan kokkidi-infektiot kääpiösialla, ihomuutokset hiirellä ja apinalla). Näitä löydöksiä havaittiin yleensä terapeuttisen altistuksen luokkaa olevilla tai sitä suuremmilla systeemisillä altistustasoilla. Rotalla havaitut löydökset todettiin kuitenkin terapeuttista altistusta pienempien pitoisuuksien yhteydessä, sillä aine jakautuu voimakkaasti kudoksiin.
Rotalla tehdyssä urosten hedelmällisyyttä koskeneessa tutkimuksessa kivesten morfologiassa esiintyi muutoksia vähintään 0,5 mg/kg pitoisuuksien yhteydessä, ja 5 mg/kg pitoisuuksien yhteydessä havaittiin siittiöiden liikkuvuuden ja määrän ja plasman testosteronipitoisuuksien pienenemistä. Nämä pitoisuudet heikensivät urosten hedelmällisyyttä. Muutosten korjautuvuudesta saatiin näyttöä.
Eläimillä tehdyissä lisääntymistutkimuksissa valmiste ei vaikuttanut naaraiden hedelmällisyyteen. Kun naarasrotille annettiin suun kautta ≥ 0,1 mg/kg everolimuusiannoksia (noin 4 % AUC0-24h-arvosta potilailla, joiden vuorokausiannos on 10 mg), implantaatiota edeltävät alkiokuolemat kuitenkin lisääntyivät.
Everolimuusi läpäisi istukan ja oli toksista sikiölle. Rotalla everolimuusi aiheutti alkio-/sikiötoksisuutta terapeuttista altistusta pienemmän systeemisen altistuksen yhteydessä. Seurauksina olivat kuolleisuuden lisääntyminen ja sikiöiden painon pieneneminen. Luustomuutosten ja epämuodostumien (esim. rintalastahalkioiden) esiintyvyys suureni 0,3 ja 0,9 mg/kg annoksilla. Kanilla havaittiin selvää alkiotoksisuutta, joka ilmeni myöhäisten resorptioiden yleistymisenä.
Geenitoksisuustutkimuksessa, joissa tarkasteltiin relevantteja geenitoksisuuden päätetapahtumia, ei saatu näyttöä klastogeenisuudesta eikä mutageenisuudesta. Kun everolimuusia annettiin hiirelle ja rotalle enintään 2 vuoden ajan, ei havaittu mitään onkogeenisiä vaikutuksia edes suurimmilla annoksilla, jotka vastasivat 3,9 kertaa (hiiri) ja 0,2 kertaa (rotta) arvioitua kliinistä altistusta.
Farmaseuttiset tiedot
Apuaineet
Butyylihydroksitolueeni
Magnesiumstearaatti
Laktoosimonohydraatti
Hypromelloosi
Krospovidoni (tyyppi A)
Vedetön laktoosi
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta.
Säilytys
Säilytä alle 25°C.
Säilytä alkuperäispakkauksessa. Herkkä valolle. Herkkä kosteudelle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
AFINITOR tabletti
2,5 mg (L:kyllä) 30 fol (385,90 €)
5 mg (L:kyllä) 30 fol (437,20 €)
10 mg (L:kyllä) 30 fol (638,56 €)
PF-selosteen tieto
Al/polyamidi/Al/PVC-läpipainopakkaus, jossa 10 tablettia.
Afinitor 2,5 mg tabletti
Pakkauksissa on 30 tai 90 tablettia.
Afinitor 5 mg tabletti
Pakkauksissa on 10, 30 tai 90 tablettia.
Afinitor 10 mg tabletti
Pakkauksissa on 10, 30 tai 90 tablettia.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Afinitor 2,5 mg tabletti
Valkoinen tai vaaleankeltainen, pitkulainen noin 10,1 mm pitkä ja 4,1 mm leveä tabletti, jossa viistetty reuna, ei jakouurretta, toisella puolella kaiverrus ”LCL” ja toisella puolella kaiverrus ”NVR”.
Afinitor 5 mg tabletti
Valkoinen tai vaaleankeltainen, pitkulainen noin 12,1 mm pitkä ja 4,9 mm leveä tabletti, jossa viistetty reuna, ei jakouurretta, toisella puolella kaiverrus ”5” ja toisella puolella kaiverrus ”NVR”.
Afinitor 10 mg tabletti
Valkoinen tai vaaleankeltainen, pitkulainen noin 15,1 mm pitkä ja 6,0 mm leveä tabletti, jossa viistetty reuna, ei jakouurretta, toisella puolella kaiverrus ”UHE” ja toisella puolella kaiverrus ”NVR”.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
AFINITOR tabletti
2,5 mg 30 fol
5 mg 30 fol
10 mg 30 fol
- Ylempi erityiskorvaus (100 %). Everolimuusi: Munuaissyövän, haiman neuroendokriinisten kasvainten ja rintasyövän hoito erityisin edellytyksin (158).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Everolimuusi: Edenneen munuaissyövän, haiman neuroendokriinisten kasvainten ja pitkälle edenneen rintasyövän sekä tuberoosiskleroosiin liittyvän subependymaalisen jättisoluisen astrosytooman ja munuaisten angiomyolipooman hoito erityisin edellytyksin (340).
ATC-koodi
L01EG02
Valmisteyhteenvedon muuttamispäivämäärä
20.11.2025
Yhteystiedot
 NOVARTIS FINLAND OY
NOVARTIS FINLAND OY Revontulenkuja 1
02100 Espoo
010 613 3200
www.novartis.fi
Lääkeinformaatiopalvelu 010 6133 210,
medinfo.nordics@novartis.com
