DUODOPA geeli suoleen 20 mg/ml+5 mg/ml
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Lääkäri
Potilas
Vaikuttavat aineet ja niiden määrät
1 ml sisältää 20 mg levodopaa ja 5 mg karbidopamonohydraattia.
100 ml sisältää 2000 mg levodopaa ja 500 mg karbidopamonohydraattia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Geeli suoleen.
Kliiniset tiedot
Käyttöaiheet
Edennyt, levodopaan reagoiva Parkinsonin tauti, johon liittyy vaikeita motorisia tilanvaihteluja ja hyperkinesiaa tai dyskinesiaa, eivätkä saatavilla olevat Parkinsonin taudin lääkkeiden yhdistelmät tuota tyydyttäviä tuloksia.
Annostus ja antotapa
Duodopa on geeli jatkuvaan enteraaliseen annosteluun. Pitkäaikaisessa annostelussa geeli annostellaan pumpulla suoraan duodenumiin tai jejunumin yläosaan pysyvän perkutaanisen endoskooppisen gastrostomialetkun kautta, jossa letkun ulko-osa on transabdominaalinen ja sisäosa on enteraalinen. Vaihtoehtoisesti voidaan käyttää radiologista gastrojejunostomialetkua, jos perkutaaninen endoskooppinen gastrostomia ei sovellu jostain syystä. Avanne ja annosten määritykset tulee tehdä yhteistyössä neurologin kanssa.
Väliaikaisen nenä-suoliletkun (duodenaalinen/jejunaalinen) käyttöä tulee harkita selvitettäessä, hyötyykö potilas tästä hoitotavasta, ennen kuin pysyvä jejunaalinen letku asetetaan perkutaanisella endoskooppisella gastrostomialla (PEG-J). Testivaihe nenä-suoliletkun avulla voidaan kuitenkin ohittaa, ja hoito voidaan aloittaa suoraan asettamalla PEG-J, mikäli lääkäri arvioi testivaiheen olevan turha. Annostus tulee määritellä yksilöllisesti kunkin potilaan tarpeita vastaavaksi. Tavoitteena on maksimoida päivän toiminnallinen aika (on-vaihe) vähentämällä mahdollisimman paljon off-kohtausten (bradykinesia) määrää ja kestoa sekä invalidisoivaa on-vaiheen dyskinesiaa. Ks. annossuositukset kohdassa ”Annostus”.
Alussa Duodopa tulisi antaa ainoana lääkkeenä. Muita Parkinsonin taudin lääkkeitä voidaan tarvittaessa käyttää samanaikaisesti. Duodopan antoon saa käyttää ainoastaan CADD-legacy 1400 -pumppua (CE‑merkitty). Pumpun käyttöohje toimitetaan yhdessä pumpun kanssa.
Duodopa-hoito pysyvää letkua käyttäen voidaan lopettaa milloin tahansa poistamalla letku ja antamalla aukon parantua. Hoitoa tulisi tällöin jatkaa suun kautta annettavilla lääkkeillä, mukaan lukien levodopa/karbidopa.
Annostus:
Duodopan vuorokausiannos koostuu kolmesta yksilöllisesti sovitetusta annoksesta, jotka annostellaan noin 16 tunnin aikana: aamuannos, jatkuva ylläpitoannos ja lisäannokset. Hoito annostellaan tavallisesti potilaan hereilläoloaikana. Duodopaa voidaan antaa jopa 24 tunnin ajan, jos se on lääketieteellisistä syistä tarpeellista.
Lääkekasetit ovat kertakäyttöisiä, eikä niitä pidä käyttää 24 tuntia pidempään, vaikka lääkettä jäisi jäljelle. Älä käytä uudelleen jo avattua kasettia.
Säilytysajan lopulla lääke voi muuttua kellertäväksi. Tämä ei vaikuta lääkkeen pitoisuuteen tai hoitoon.
Aamuannos: Aamuannoksella terapeuttinen taso saavutetaan nopeasti (10–30 min aikana). Annoksen pitäisi perustua potilaan aikaisempaan levodopan aamuannokseen + letkun täyttötilavuuteen. Tavallinen aamuannos on 5-10 ml, joka vastaa 100-200 mg levodopaa. Aamuannos ei saa olla suurempi kuin 15 ml (300 mg levodopaa).
Jatkuva ylläpitoannos: Tätä annosta voidaan muuttaa nopeudella 2 mg/h (0,1 ml/h). Annos tulee laskea levodopan aiemman vuorokausiannoksen suuruuden perusteella. Kun muut lääkkeet lopetetaan, Duodopan annos tulee tarkistaa. Jatkuva ylläpitoannos määräytyy yksilöllisesti. Sen tulee olla tasoa 1–10 ml/h (20–200 mg/h levodopaa) ja yleensä 2–6 ml/h (40–120 mg/h levodopaa). Suurin suositeltu päiväannos on 200 ml (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Poikkeustapauksissa voidaan tarvita suurempaa annosta.
Esimerkki:
Levodopan vuorokausiannos Duodopana: 1640 mg päivässä.
Aamuannos: 140 mg = 7 ml (poislukien enteraalisen letkun täyttötilavuus)
Jatkuva ylläpitoannos: 1500 mg päivässä
1500 mg/vrk: 20 mg/ml = 75 ml Duodopaa vuorokaudessa
Vuorokausiannos lasketaan 16 tunnin ajalle: 75 ml/16 tuntia = 4,7 ml/tunti.
Lisäannos: Lisäannos annetaan, jos potilaasta tulee hypokineettinen päivän mittaan. Lisäannos määritetään yksilöllisesti, normaalisti 0,5–2,0 ml. Harvinaisissa tapauksissa voidaan tarvita suurempia annoksia. Jos potilas tarvitsee päivän aikana yli 5 lisäannosta, ylläpitoannosta tulee suurentaa.
Kun annosmääritys on tehty, tulee aamuannosta, ylläpitoannosta ja lisäannosta hienosäätää muutaman viikon kuluessa hoidon aloittamisesta.
Hoidon seuranta: Hoitovasteen äkillinen heikkeneminen ja toistuvat motoriset tilanvaihtelut viittaavat siihen, että letkun distaalinen pää on siirtynyt duodenumista/jejunumista mahalaukkuun. Letkun sijainti tulee tarkistaa röntgen tutkimuksella ja asettaa takaisin paikoilleen duodenumiin/jejunumiin.
Erityisryhmät
Pediatriset potilaat
Ei ole asianmukaista käyttää Duodopa-valmistetta pediatristen potilaiden hoidossa käyttöaiheeseen edennyt, levodopaan reagoiva Parkinsonin tauti, johon liittyy vaikeita motorisia tilanvaihteluja ja hyper-/dyskinesiaa.
Vanhukset
Levodopan/karbidopan käytöstä vanhuksilla on huomattavaa kokemusta. Annos sovitetaan titraamalla yksilöllisesti kaikille potilaille mukaan lukien vanhukset.
Munuaisten/maksan vajaatoiminta
Karbidopan ja levodopan farmakokinetiikkaa ei ole tutkittu maksan tai munuaisten vajaatoimintaa sairastavilla potilailla. Duodopan annos sovitetaan yksilöllisesti titraamalla optimaalisen tehon saavuttamiseksi (vastaten yksilöllisesti optimoitua levodopan ja karbidopan plasmapitoisuutta). Näin ollen maksan tai munuaisten vajaatoiminnan mahdolliset vaikutukset levodopan ja karbidopan plasmapitoisuuteen otetaan epäsuorasti huomioon annosta titrattaessa. Annostitraus tulee suorittaa varoen potilailla, joilla on vaikea munuaisten ja maksan vajaatoiminta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Hoidon keskeyttäminen
Potilaita tulisi tarkkailla huolellisesti, jos annosta on pienennettävä äkillisesti tai jos Duodopa-hoito on tarpeen keskeyttää, erityisesti jos potilas käyttää antipsykootteja, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Jos potilaalla epäillään dementiaa tai dementia on todettu ja sekavuustila on mahdollinen, vain hoitohenkilökunnan tai potilasta hoitavan henkilön pitäisi käsitellä pumppua.
Kun kasettia aiotaan käyttää, se kiinnitetään pumppuun ja järjestelmä yhdistetään annostelua varten nenä-duodenaaliletkuun tai duodenaali-/jejunaaliletkuun annettujen ohjeiden mukaisesti.
Vasta-aiheet
Duodopaa ei saa käyttää potilailla, joilla on:
- yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille
- ahdaskulmaglaukooma
- vaikea sydämen vajaatoiminta
- vaikeita sydämen rytmihäiriöitä
- akuutti aivohalvaus
- epäselektiivisten MAO:n estäjien ja selektiivisten MAO-A:n estäjien samanaikainen käyttö Duodopan kanssa on vasta-aiheista. Näiden MAO:n estäjien käyttö tulee lopettaa vähintään kaksi viikkoa ennen Duodopa-hoidon aloitusta. Duodopaa voidaan annostella samanaikaisesti selektiivisten MAO-B:n estäjien kanssa (esim. selegiliinihydrokloridi) valmistajan suosittelemalla annoksella (ks. kohta Yhteisvaikutukset).
- tilat, jolloin adrenergisten aineiden käyttö on vasta-aiheista, esim. feokromosytooma, hypertyreoosi, Cushingin oireyhtymä.
Koska levodopa voi aktivoida melanooman, Duodopaa ei tule antaa potilaille, joilla on epäillyttäviä diagnosoimattomia iholeesioita tai tautihistoriassa melanooma.
Varoitukset ja käyttöön liittyvät varotoimet
Duodopaan pätevät samat varoitukset ja varotoimet kuin levodopan muidenkin lääkemuotojen kohdalla.
- Duodopaa ei suositella lääkeaineiden aiheuttamien ekstrapyramidaalioireiden hoitoon.
- Duodopa-hoitoa tulisi antaa varoen potilaille, joilla on vaikea sydän- ja verisuonitauti tai keuhkosairaus, keuhkoastma, munuais-, maksa- tai endokrinologinen sairaus tai aiempi ulkustauti tai kouristuksia.
- Potilaiden, joilla on ollut sydäninfarkti ja on edelleen sydämen eteissolmukkeeseen liittyviä tai kammioperäisiä rytmihäiriöitä, sydämen toimintaa pitäisi seurata erityisen huolellisesti hoidon alussa annosmäärityksen ajan.
- Kaikkia Duodopa-hoitoa saavia potilaita tulisi seurata huolellisesti mielialamuutosten, masennuksen ja siihen liittyvän itsemurhavaaran ja muiden vakavien mielialahäiriöiden varalta. Hoidettaessa potilaita, joilla on tai on ollut psykoosi, tulee olla varovainen.
- Psykoosilääkkeitä, jotka salpaavat dopamiinireseptoreita (erityisesti D2-reseptoriantagonistit), tulisi antaa hyvin varovaisesti samanaikaisesti Duodopan kanssa ja potilasta tulee seurata huolellisesti antiparkinsonismivaikutuksen heikkenemisen ja Parkinsonin taudin oireiden pahenemisen varalta, ks. kohta Yhteisvaikutukset.
- Duodopaa voidaan antaa varoen potilaille, joilla on krooninen avokulmaglaukooma, jos silmänpaine on hyvässä hallinnassa ja potilaan silmänpaineen muutoksia seurataan huolellisesti.
- Duodopa voi aiheuttaa ortostaattista hypotensiota. Tämän vuoksi Duodopaa tulee antaa varoen potilaille, jotka käyttävät muita lääkkeitä, jotka voivat aiheuttaa ortostaattista hypotensiota, ks. kohta Yhteisvaikutukset.
- Levodopan käyttöön on liittynyt uneliaisuutta ja äkillistä nukahtamista potilailla, joilla on Parkinsonin tauti. Varovaisuus on siksi tarpeen ajettaessa autoa tai käytettäessä koneita, ks. kohta Vaikutus ajokykyyn ja koneidenkäyttökykyyn.
- Parkinsonin taudin lääkityksen äkillisen lopettamisen yhteydessä on havaittu neuroleptioireyhtymää muistuttava oireisto, johon liittyy lihasjäykkyys, kohonnut kehon lämpötila, mielialanvaihtelut (esim. agitaatio, sekavuustila, syvä tajuttomuus) ja seerumin kreatiinikinaasipitoisuuden suureneminen. Parkinsonin tautia sairastavilla potilailla on harvoin havaittu rabdomyolyysia neuroleptioireyhtymän seurauksena tai vaikeaa dyskinesiaa. Tästä syystä erityisesti psykoosilääkkeitä käyttäviä potilaita tulisi tarkkailla huolellisesti, jos levodopa/karbidopayhdistelmän annosta pienennetään äkillisesti tai hoito lopetetaan. Neuroleptioireyhtymää ja rabdomyolyysia ei ole raportoitu esiintyneen Duodopan käytön yhteydessä.
- Potilaita pitää seurata säännöllisesti impulssikontrollihäiriöiden kehittymisen varalta. Potilaiden ja heidän läheisten / hoitajien on hyvä tietää, että impulssikontrollihäiriöihin liittyviä käytösoireita (kuten pelihimo, lisääntynyt libido, hyperseksuaalisuus, pakonomainen tuhlaaminen tai ostelu, ahmiminen ja pakonomainen syöminen) voi esiintyä potilailla, jotka ovat käyttäneet dopamiiniagonistia ja/tai muuta dopaminergista levodopaa sisältävää lääkettä Duodopa mukaan lukien. Hoidon uudelleenarviointi on suositeltavaa, jos tällaisia oireita esiintyy.
- Epidemiologisten tutkimusten mukaan Parkinsonin tautia sairastavilla potilailla on muuta väestöä korkeampi melanoomariski. On epäselvää, onko riski kohonnut itse Parkinsonin taudin vai muiden tekijöiden, kuten Parkinsonin tautiin käytettävien lääkkeiden seurauksena. Näin ollen potilaita ja heidän läheisiä/hoitajia suositellaan tarkkailemaan ihon muutoksia säännöllisesti, kun Duodopaa käytetään mihin tahansa käyttöaiheeseen. Ideaalitilanteessa ihotutkimukset olisi hyvä suorittaa määräajoin asianmukaisesti koulutetun henkilön (esim. ihotautilääkäri) toimesta.
- Yleisanestesiaa tarvittaessa Duodopa-hoitoa voidaan jatkaa niin kauan kuin potilas voi ottaa nesteitä ja lääkkeitä suun kautta. Jos hoito keskeytetään väliaikaisesti, Duodopan normaalia annosta voidaan jatkaa heti, kun potilas voi ottaa nesteitä suun kautta.
- Duodopan annosta voidaan joutua laskemaan, jotta vältytään levodopan aiheuttamalta dyskinesialta.
- Duodopan pitkäaikaisessa käytössä suositellaan maksan, hematopoeesin, verenkiertoelimistön ja munuaisten toiminnan tutkimista säännöllisin väliajoin.
- Duodopa sisältää karbidopan hajoamistuotetta, hydratsiinia, joka saattaa olla genotoksinen ja mahdollisesti karsinogeeninen. Duodopan keskimääräinen päivittäinen suositusannos on 100 ml, joka sisältää 2 g levodopaa ja 0,5 g karbidopaa. Suositeltava päivittäinen enimmäisannos on 200 ml. Tällöin hydratsiinialtistus on keskimäärin 4 mg/vrk ja enintään 8 mg/vrk. Tämän hydratsiinialtistuksen kliinistä merkitystä ei tiedetä.
- Ylävatsan alueelle tehty leikkaus saattaa vaikeuttaa gastrostomiaa/jejunostomiaa.
- Kliinisissä tutkimuksissa on raportoitu ja markkinoille tulon jälkeen on havaittu hoidon komplikaationa absessi, besoaari, ileus, implanttikohdan eroosio/haavauma, suolistoverenvuoto, suoliston iskemia, suolitukos, suolen perforaatio, suolentuppeuma, pankreatiitti, peritoniitti, keuhkokuume (mukaan lukien aspiraatiokeuhkokuume), pneumoperitoneum, toimenpiteen jälkeinen haavatulehdus ja sepsis. Besoaarit ovat sulamattoman aineen (kuten sulamattomat vihannes- tai kasvikuidut) jäänteitä suolistossa. Suurin osa besoaareista sijaitsee mahalaukussa, mutta ne voivat olla myös muualla suolistossa. Jejunaaliletkun pään ympärillä oleva besoaari voi johtaa suolitukokseen tai suolentuppeumaan. Yllämainittujen komplikaatioiden oireena voi olla vatsakipua. Ne voivat joskus johtaa vakaviin seurauksiin, kuten leikkaukseen ja/tai kuolemaan. Potilaita tulee neuvoa ilmoittamaan lääkärille, jos heille tulee mitä tahansa edellä mainittuihin tapahtumiin liittyviä oireita.
- Jos potilaalla on vaikeuksia järjestelmän käytössä (pumppu, letkun liitännät), komplikaatioita voi esiintyä. Tällaisissa tapauksissa hoitajan (esim. sairaanhoitajan, lähihoitajan tai läheisen / sukulaisen) on avustettava potilasta.
- Bradykinesian yllättävä tai asteittainen paheneminen voi viitata laitteen tukkeutumiseen mistä tahansa syystä, joka on selvitettävä.
- Dopamiinin säätelyhäiriöön liittyvä oireyhtymä (dopamiinidysregulaatio-oireyhtymä, DDS) on joillakin karbidopa-levodopahoitoa saaneilla potilailla todettu riippuvuushäiriö, joka johtaa valmisteen liialliseen käyttöön. Ennen hoidon aloittamista potilaita ja heistä huolehtivia henkilöitä on varoitettava mahdollisesta DDS:n riskistä (ks. myös kohta Haittavaikutukset).
- Polyneuropatiaa on raportoitu esiintyneen potilailla, jotka ovat saaneet levodopaa/karbidopaa geelinä suoleen. Ennen hoidon aloittamista sekä määräajoin sen jälkeen on arvioitava, onko potilaalla ollut polyneuropatia, merkkejä siitä tai tunnettuja riskitekijöitä.
Yhteisvaikutukset
Duodopalla ei ole tehty interaktiotutkimuksia. Seuraavia yhteisvaikutuksia on todettu yleisen levodopa/karbidopayhdistelmän käytössä.
Duodopan ja seuraavien lääkkeiden yhteiskäytössä on noudatettava varovaisuutta:
Verenpainelääkkeet
Oireista posturaalista hypotensiota on esiintynyt, kun levodopan ja dekarboksylaasi-inhibiittorin yhdistelmä on lisätty verenpainelääkkeitä saavien potilaiden hoito-ohjelmaan. Verenpainelääkkeen annostusta voidaan joutua muuttamaan.
Masennuslääkkeet
Joissakin harvinaisissa tapauksissa trisyklisten masennuslääkkeiden ja karbidopa/levodopavalmisteiden samanaikaiseen käyttöön on liittynyt haittavaikutuksia, mukaan lukien hypertensiota ja dyskinesiaa.
Antikolinergit
Antikolinergit voivat toimia synergistisesti levodopan kanssa vähentäen vapinaa. Yhteiskäyttö voi kuitenkin pahentaa epänormaaleja tahdosta riippumattomia liikkeitä. Antikolinergit voivat heikentää levodopan vaikutusta hidastamalla sen imeytymistä. Duodopa-annosta voidaan joutua muuttamaan.
COMT-inhibiittorit (tolkaponi, entakaponi)
COMT (katekoli-O-metyylitransferaasi) -inhibiittorin ja Duodopan samanaikainen käyttö voi suurentaa levodopan biologista hyötyosuutta. Duodopa-annoksen muuttaminen voi olla tarpeen.
Muut lääkkeet
Dopamiinireseptoriantagonistit (jotkut psykoosilääkkeet, esim. fentiatsiinit, butyrofenonit ja risperidoni sekä antiemeetit esim. metoklopramidi), bentsodiatsepiinit, isoniatsidi, fenytoiini ja papaveriini voivat heikentää levodopan tehoa. Potilaita, jotka ottavat näitä lääkkeitä samanaikaisesti Duodopan kanssa, pitäisi seurata huolellisesti terapeuttisen vasteen heikkenemisen varalta.
Duodopa voidaan ottaa samanaikaisesti selektiivisen MAO-B:n estäjän suositellun annoksen kanssa (esim. selegiliinihydrokloridi). Levodopa-annosta tulee mahdollisesti alentaa, jos selektiivinen MAO-B:n estäjä lisätään.
Selegiliinin ja levodopa/karbidopavalmisteen samanaikaiseen käyttöön voi liittyä vakavaa ortostaattista hypotensiota.
Amantadiinilla on synergistinen vaikutus levodopan kanssa ja se voi lisätä levodopan aiheuttamia haittavaikutuksia. Duodopa-annoksen muuttaminen voi olla tarpeen.
Sympatomimeetit voivat lisätä levodopan aiheuttamia kardiovaskulaarisia haittavaikutuksia.
Levodopa muodostaa raudan kanssa kelaatin ruoansulatuskanavassa, mikä pienentää imeytyneen levodopan määrää.
Koska levodopa kilpailee eräiden aminohappojen kanssa, sen imeytyminen saattaa häiriintyä joillakin runsasproteiinista ruokavaliota noudattavilla potilailla.
Antasidien ja Duodopan samanaikaisen annostelun vaikutusta levodopan biologiseen hyötyosuuteen ei ole tutkittu.
Raskaus ja imetys
Raskaus
Ei ole olemassa tietoja tai on vain vähän tietoja levodopa/karbidopan käytöstä raskaana oleville naisille. Eläinkokeissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Duodopan käyttöä ei suositella raskauden aikana eikä sellaisten naisten hoitoon, jotka voivat tulla raskaaksi ja jotka eivät käytä ehkäisyä, paitsi jos hyödyt äidille ovat suuremmat kuin mahdolliset riskit sikiölle.
Imetys
Levodopa ja mahdollisesti levodopan metaboliitit erittyvät ihmisen rintamaitoon. On näyttöä, että maidon eritys vähenee levodopahoidon aikana.
Ei tiedetä, erittyykö karbidopa tai sen metaboliitit ihmisen rintamaitoon. Eläinkokeissa karbidopan on todettu erittyvän rintamaitoon.
Ei ole olemassa riittävästi tietoa levodopan/karbidopan tai niiden metaboliittien vaikutuksista vastasyntyneisiin/imeväisiin. Rintaruokinta on lopetettava Duodopa-hoidon ajaksi.
Hedelmällisyys
Prekliinisissä tutkimuksissa pelkällä levodopalla tai karbidopalla ei ole havaittu olevan hedelmällisyyteen liittyviä haittavaikutuksia. Eläimillä tehdyissä hedelmällisyystutkimuksissa ei ole tutkittu levodopan ja karbidopan yhdistelmää.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Duodopalla voi olla huomattava vaikutus ajokykyyn ja koneidenkäyttökykyyn. Levodopa ja karbidopa voivat aiheuttaa huimausta ja ortostaattista hypotoniaa. Varovaisuus on tästä syystä tarpeen autoa ajettaessa tai koneita käytettäessä. Jos Duodopaa saavalla potilaalla esiintyy uneliaisuutta ja/tai äkillisiä nukahtamiskohtauksia, tulee häntä neuvoa pidättäytymään autolla ajamisesta tai sellaisista toimista, joissa valppauden heikentyminen saattaa aiheuttaa vakavien vammojen tai kuoleman riskin potilaalle itselleen tai muille (esim. koneiden käyttö), kunnes kohtaukset ja uneliaisuus ovat hävinneet, ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet.
Haittavaikutukset
Duodopa-hoitoon liittyviä yleisiä lääkkeen haittavaikutuksia ovat pahoinvointi ja dyskinesia.
Laitteisiin tai toimenpiteeseen liittyviä yleisiä Duodopa-hoidon haittavaikutuksia ovat vatsakipu, laitteen asennukseen liittyvät komplikaatiot, liiallinen granulaatiokudos, viiltoalueen eryteema, toimenpiteen jälkeinen haavatulehdus, erittäminen toimenpiteen jälkeen, toimenpiteeseen liittyvä kipu sekä toimenpidealueen reaktio.
Suurin osa haittavaikutuksista on raportoitu tutkimusten alkuvaiheessa, perkutaanisen endoskooppisen gastrostomian jälkeen ensimmäisen 28 päivän aikana.
Duodopa-hoidon yhteydessä raportoidut haittavaikutukset
Duodopan turvallisuutta on verrattu peroraaliseen levodopa/karbidopastandardivalmisteeseen (100 mg/25 mg) yhteensä 71:llä edennyttä Parkinsonin tautia sairastavalla potilaalla, jotka osallistuivat 12 viikkoa kestävään randomoituun, kaksoissokko, kaksoislume, aktiivikontrolloituun tutkimukseen. Lisäksi turvallisuustietoa on kerätty avoimesta 12 kuukautta kestäneestä tutkimuksesta, johon osallistui 354 edennyttä Parkinsonin tautia sairastavaa potilasta sekä avoimista jatkotutkimuksista.
Lääkkeeseen liittyvien haittavaikutusten yhteenvetoa varten analysoitiin kaikista tutkimuksista Duodopaa saaneiden potilaiden tulokset yhdessä tutkimusasetelmasta riippumatta (kaksoissokkoutettu tai avoin tutkimus). Toimenpiteeseen sekä laitteeseen liittyvien haittavaikutusten yhteenvetoa varten analysoitiin kaikista tutkimuksista ne potilaat, jotka saivat Duodopaa tai lumegeeliä PEG-J:n kautta tutkimusasetelmasta riippumatta (kaksoissokkoutettu tai avoin tutkimus).
Syy-yhteydestä riippumatta taulukossa 1on lueteltu hoidon aikana ilmenneet lääkkeeseen, toimenpiteeseen ja laitteeseen liittyvät haittavaikutukset sekä ne haittavaikutukset, jotka tulivat esille Duodopan käytön yhteydessä myyntiluvan myöntämisen jälkeen.
Taulukko 1. Haittavaikutustiedot kliinisistä tutkimuksista sekä myyntiluvan myöntämisen jälkeisestä käyttökokemuksesta
| MedDRA-luokittelu elinryhmittäin | Hyvin yleinena (≥1/10) | Yleinena (≥1/100, <1/10) | Melko harvinainenb (≥1/1 000, <1/100) | Harvinainen*b (≥1/10 000, <1/1 000) | Esiintymistiheys tuntematon, myyntiluvan myöntämisen jälkeinen käyttökokemus |
| Lääkkeeseen liittyvät haittavaikutukset | |||||
| Infektiot | Virtsatieinfektiot | ||||
| Veri ja imukudos | Anemia | Leukopenia, trombosytopenia | |||
| Immuunijärjestelmä | Anafylaktinen reaktio | ||||
| Aineenvaihdunta ja ravitsemus | Painon lasku | Painon nousu, kohonnut aminohappotaso (kohonnut metyylimalonihappo), kohonnut veren homokysteiini, ruokahalun heikentyminen, B6-vitamiinin puutos, B12-vitamiinin puutos | |||
| Psyykkiset häiriöt | Ahdistuneisuus, masennus, unettomuus | Epänormaalit unet, agitaatio, sekavuustila, hallusinaatiot, impulssikäyttäytyminenc, psykoottiset episodit, nukahtamiskohtaukset, unihäiriö | Toteutunut itsemurha, dementia, desorientaatio, euforinen mieliala, pelko, lisääntynyt libido (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), painajaiset, itsemurhayritys | Poikkeavat ajatukset | Dopamiinin säätelyhäiriöön liittyvä oireyhtymäd |
| Hermosto | Dyskinesia, Parkinsonin tauti | Huimaus, dystonia, päänsärky, heikentynyt tunto, on-off -episodit, parestesia, polyneuropatia, uneliaisuus, synkopee, vapina | Ataksia, kouristukset, kävelyhäiriö | ||
| Silmät | Ahdaskulmaglaukooma, luomikouristus, kaksoiskuvat, iskeeminen optikusneuropatia, näön hämärtyminen | ||||
| Sydän | Epäsäännöllinen sydämen rytmi | Palpitaatio | |||
| Verisuonisto | Ortostaattinen hypotensio | Hypertensio, hypotensio | Laskimotulehdus | ||
| Hengityselimet, rintakehä ja välikarsina | Hengenahdistus, suunielun kipu | Rintakipu, dysfonia | Epänormaali hengitys | ||
| Ruoansulatuselimistö | Pahoinvointi, ummetus | Vatsan pingottuminen, ripuli, suun kuivuminen, makuhäiriö, dyspepsia, nielemishäiriö, ilmavaivat, oksentelu | Lisääntynyt syljeneritys | Narskutus, syljen värjäytyminen, kielikipu, hikka | |
| Iho ja ihonalainen kudos | Kontakti-ihottuma, liikahikoilu, perifeerinen turvotus, kutina, ihottuma | Hiustenlähtö, punoitus, nokkosihot-tuma | Hien värjäytyminen, melanooma (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) | ||
| Luusto, lihakset ja sidekudos | Lihasspasmit, niskakipu | ||||
| Munuaiset ja virtsatiet | Virtsainkontinenssi, virtsaumpi | Kromaturia | Priapismi | ||
| Yleisoireet ja antopaikassa todettavat haitat | Uupumus, kipu, voimattomuus | Pahoinvointi | |||
| Vammat ja myrkytykset | Kaatuminen | ||||
| Laitteeseen ja toimenpiteeseen liittyvät haittavaikutukset | |||||
| Infektiot | Toimenpiteen jälkeinen haavatulehdus | Viiltoalueen ihonalaisen sidekudoksen tulehdus, toimenpiteen jälkeinen infektio | Toimenpiteen jälkeinen absessi | Sepsis | |
| Ruoansulatuselimistö | Vatsakipu | Vatsavaivat, ylävatsakipu, peritoniitti, pneumoperitoneum | Besoaari (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), iskeeminen koliitti, mahasuolikanavan iskemia, mahasuolikanavan tukos, suolentuppeuma, pankreatiitti, ohutsuolen verenvuoto, ohutsuolen haavauma, paksusuolen perforaatio | Vatsan perforaatio, mahasuolikanavan perforaatio, ohutsuolen iskemia, ohutsuolen perforaatio | |
| Hengityselimet, rintakehä ja välikarsina | Keuhkokuume/ aspiraatiokeuhkokuume | ||||
| Iho ja ihonalainen kudos | Liiallinen granulaatiokudos | ||||
| Yleisoireet ja antopaikassa todettavat haitat | Laitteen asennuksen komplikaatiote | Laitteen dislokaatio, laitteen tukkeutuminen | |||
| Vammat ja myrkytykset | Viiltoalueen eryteema, erittäminen toimenpiteen jälkeen, toimenpiteeseen liittyvä kipu, toimenpidealueen reaktio | Mahasuolikanavastooman komplikaatio, viiltoalueen kipu, toimenpiteen jälkeinen ileus, toimenpiteen jälkeinen komplikaatio, toimenpiteen jälkeinen vaiva, toimenpiteen jälkeinen verenvuoto | |||
a Haittavaikutukset havaittu kliinisissä tutkimuksissa. Ilmoitetut esiintymistiheydet heijastavat tutkimuksessa esiin tulleiden haittavaikutusten tiheyttä riippumatta tutkijan arvioimasta syy-yhteydestä.
b Haittavaikutukset havaittu Duodopan käytön yhteydessä siten, ettei esiintymistiheys ole saatavilla. Esiintymistiheydet pohjautuvat peroraalisten levodopa/karbidopavalmisteiden käyttöhistoriaan.
c Impulssikontrollin häiriöt: Pelihimoa, lisääntynyttä libidoa, hyperseksuaalisuutta, pakonomaista tuhlaamista tai ostelua, ahmimista ja pakonomaista syömistä, voi esiintyä potilailla, jotka käyttävät dopamiiniagonistia ja/tai muuta dopaminergista levodopaa sisältävää lääkettä, kuten Duodopa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet Varoitukset ja käyttöön liittyvät varotoimet).
d Dopamiinin säätelyhäiriöön liittyvä oireyhtymä (dopamiinidysregulaatio-oireyhtymä, DDS) on riippuvuushäiriö, jota on todettu joillakin karbidopa-levodopahoitoa saaneilla potilailla. Siihen liittyy pakonomaista dopaminergisen lääkkeen väärinkäyttöä ja suurempien lääkeannosten käyttöä kuin on tarpeen motoristen oireiden lievittämiseksi. Tämä voi joissakin tapauksissa johtaa vaikeisiin dyskinesioihin (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet).
e Laitteen asennukseen liittyvä komplikaatio on raportoitu yleisenä haittavaikutuksena sekä naso-jejunaaliletkuille että PEG-J:lle. Tämä haittavaikutus raportoitiin yhdessä yhden tai useamman seuraavista naso-jejunaaliletkun haittavaikutuksista: suunielun kipu, vatsan pingotus, vatsakipu, vatsavaiva, kipu, kurkun ärsytys, mahasuolikanavan vaurio, ruokatorven verenvuoto, ahdistuneisuus, nielemishäiriö ja oksentelu. PEG-J:lle tämä haittavaikutus raportoitiin yhdessä yhden tai useamman seuraavista haittavaikutuksista: vatsakipu, vatsavaiva, vatsan pingotus, ilmavaiva tai pneumoperitoneum. Muita ei-vakavia haittavaikutuksia, jotka raportoitiin yhdessä laitteen asennukseen liittyvän komplikaation kanssa, olivat vatsavaiva, ylävatsakipu, duodenaalinen haavauma, duodenaalisen haavauman verenvuoto, erosiivinen duodeniitti, erosiivinen gastriitti, mahasuolikanavan verenvuoto, peritoniitti, pneumoperitoneum, ohutsuolen haavauma.
Suoliletkun dislokaatio kääntymällä kohti vatsaa tai laitteeseen liittyvä tukos johtaa motoristen tilanvaihteluiden paluuseen.
Seuraavat haittavaikutukset (listattu MedDRA termeillä) ovat lisäksi havaittu peroraalisilla levodopa/karbidopavalmisteilla ja voivat ilmaantua Duodopan käytön yhteydessä:
Taulukko 2. Peroraalisilla levodopa/karbidopavalmisteilla havaitut haittavaikutukset
| MedDRA-luokittelu elinryhmittäin | Harvinainen (≥1/10 000, <1/1 000) | Hyvin harvinainen (<1/10 000) |
| Veri ja imukudos | Hemolyyttinen anemia | Agranulosytoosi |
| Hermosto | Leukalukko, neuroleptioireyhtymä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) | |
| Silmät | Hornerin oireyhtymä, mydriaasi, okulogyyrinen kriisi | |
| Iho ja ihonalainen kudos | Angioedeema, Henoch–Schönleinin purppura |
Laboratorioarvot: Seuraavia poikkeavia laboratorioarvoja on raportoitu levodopa/karbidopahoitoa saavilla, joten ne on huomioitava hoidettaessa potilaita Duodopalla: kohonnut ureatyppi, alkalinen fosfataasi, S-ASAT, S-ALAT, LDH, bilirubiini, verensokeri, kreatiniini, virtsahappo ja positiivinen Coombsin koe, hemoglobiinin ja hematokriitin lasku. Leukosyyttejä, bakteereja ja verta on raportoitu esiintyneen virtsassa. Levodopa/karbidopa ja täten Duodopa voi aiheuttaa virheellisesti positiivisen tuloksen liuskamenetelmällä tehdyssä ketonuriamäärityksessä: virtsanäytteen keittäminen ei ratkaise ongelmaa. Glukoosioksidaasimenetelmien käyttö voi antaa virheellisen negatiivisen tuloksen glukosuriamäärityksessä.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Huomattavimpia levodopa/karbidopan kliinisiä yliannostusoireita ovat dystonia ja dyskinesia. Luomikouristus voi olla yliannostuksen ensimerkki.
Duodopan akuutin yliannostuksen hoito on periaatteessa samanlainen kuin levodopan akuutin yliannostuksen hoito; pyridoksiini ei kuitenkaan ole tehokas mitätöimään Duodopan vaikutuksia. EKG-seuranta on aloitettava ja potilasta on tarkkailtava huolellisesti mahdollisten rytmihäiriöiden kehittymisen varalta. Tarpeen vaatiessa on annettava sopivaa rytmihäiriöhoitoa. On myös otettava huomioon mahdollisuus, että potilas on ottanut Duodopan lisäksi muita lääkkeitä. Tähän mennessä ei ole kokemusta dialyysin käytöstä ja siksi sen merkitystä yliannostuksen hoidossa ei tunneta.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Parkinsonismilääkkeet, levodopa ja dekarboksylaasin estäjä, ATC-koodi: N04BA02.
Vaikutusmekanismi
Duodopa on levodopaa ja karbidopaa (suhde 4:1) sisältävä yhdistelmävalmiste geelin muodossa, ja se on tarkoitettu jatkuvaan enteraaliseen annosteluun edenneessä Parkinsonin taudissa, johon liittyy vaikeita motorisia tilanvaihteluita ja hyper-/dyskinesiaa. Levodopa on metabolinen dopamiinin esiaste, joka lievittää Parkinsonin taudin oireita siten, että se muuttuu dekarboksylaation kautta dopamiiniksi aivoissa. Karbidopa, joka ei läpäise veri-aivoestettä, estää levodopan dekarboksylaatiota aivojen ulkopuolella, jolloin enemmän levodopaa jää kuljetettavaksi aivoihin ja muutettavaksi dopamiiniksi. Jos karbidopaa ei annettaisi samanaikaisesti, halutun vaikutuksen saavuttamiseksi tarvittaisiin huomattavasti suurempi levodopamäärä. Yksilölliset Duodopan suolistoinfuusioannokset mahdollistavat, että plasman levodopapitoisuus pysyy vakaana yksilöllisissä terapeuttisissa rajoissa.
Farmakodynaamiset vaikutukset
Suoleen annettava Duodopa-hoito vähentää motorisia tilanvaihteluita ja lyhentää off-aikaa edennyttä Parkinsonin tautia sairastavilla potilailla, jotka ovat saaneet tablettimuotoista levodopan ja dekarboksylaasin estäjän yhdistelmähoitoa useiden vuosien ajan. Motoriset tilanvaihtelut ja hyper-/dyskinesiat vähenevät, koska plasmapitoisuudet ovat vakaammat kuin peroraalisella levodopa/karbidopa-hoidolla, minkä seurauksena hoito pysyy terapeuttisissa rajoissa. Motorisiin tilanvaihteluihin ja hyper-/dyskinesioihin kohdistuva hoitovaikutus saavutetaan usein jo ensimmäisenä hoitopäivänä.
Kliininen teho ja turvallisuus
Duodopa-valmisteen teho vahvistettiin kahdessa tutkimusasetelmaltaan identtisessä 12 viikon pituisessa vaiheen 3 satunnaistetussa, kaksoissokkoutetussa, kahdella lumeella ja rinnakkaisryhmissä toteutetussa aktiivikontrolloidussa monikeskustutkimuksessa, joissa Duodopa-hoidon tehoa, turvallisuutta ja siedettävyyttä verrattiin 100/25 mg levodopa/karbidopatabletteihin. Tutkimuksiin osallistui edennyttä Parkinsonin tautia sairastavia potilaita, jotka reagoivat levodopahoitoon ja joilla oli sitkeitä motorisia tilanvaihteluita optimoidusta peroraalisesta levodopa/karbidopalääkityksestä ja muusta saatavilla olevasta optimoidusta Parkinson-lääkityksestä huolimatta. Mukaan otettiin yhteensä 71 potilasta. Tutkimusten tulokset yhdistettiin ja niistä tehtiin yhteinen analyysi.
Ensisijainen tehon päätetapahtuma oli Parkinson’s Disease Diary© ‑päiväkirjan tietoihin perustuva vakioidun off-ajan muutos lähtötilanteesta päätetapahtumaan. Analyyseissä käytettiin tuoreinta havaintoa (Last Observation Carried Forward, LOCF). Pienimmän neliösumman keskiarvojen ero oli Duodopa-ryhmässä tilastollisesti merkitsevästi parempi (taulukko 3).
Ensisijaista päätetapahtumaa koskevia tuloksia tuki myös toistomittausten sekamallin (MMRM) analyysi, jossa arvioitiin muutosta lähtötilanteen ja kunkin lähtötilanteen jälkeisen tutkimuskäynnin välillä. Tässä off-ajan analyysissä todettiin, että Duodopa-ryhmän potilaiden tilanne parani viikon 4 kohdalla tilastollisesti merkitsevästi enemmän kuin peroraalista levodopa/karbidopahoitoa saaneiden ja että tulosten paranema oli tilastollisesti merkitsevä viikoilla 8, 10 ja 12.
Off-ajan muutoksen lisäksi todettiin, että ilman hankalia dyskinesioita vietetyn päivittäisen vakioidun on-ajan keskiarvon kohdalla pienimmän neliösumman keskiarvoissa oli tilastollisesti merkitsevä ero, kun Duodopa-ryhmää verrattiin aktiivista vertailuvalmistetta saaneeseen ryhmään Parkinson’s Disease Diary© ‑päiväkirjan tietojen pohjalta. Lähtötilanteen arvot kirjattiin kolme päivää ennen satunnaistamista ja 28 päivää peroraalisen hoidon standardoinnin jälkeen.
Taulukko 3 Off-ajan ja ilman hankalia dyskinesioita vietetyn on-ajan muutos lähtötilanteesta päätetapahtumaan
Hoitoryhmä | N | Lähtötilanteen keskiarvo (SD)(h) | Päätetapahtuma(SD)(h) | Muutoksen (h) pienimmän neliösumman keskiarvo (SE) | Eron (h) pienimmän neliösumman keskiarvo (SE) | p-arvo | |||||
Ensisijainen muuttuja | |||||||||||
Off-aika Aktiivinen vertailuvalmistea | 31 | 6,90 (2,06) | 4,95 (2,04) | ‑2,14 (0,66) | |||||||
Duodopa | 35 | 6,32 (1,72) | 3,05 (2,52) | ‑4,04 (0,65) | ‑1,91 (0,57) | 0,0015 | |||||
Toissijainen muuttuja | |||||||||||
On-aika ilman hankalia dyskinesioita Aktiivinen vertailuvalmiste | 31 | 8,04 (2,09) | 9,92 (2,62) | 2,24 (0,76) | |||||||
Duodopa | 35 | 8,70 (2,01) | 11,95 (2,67) | 4,11 (0,75) | 1,86 (0,65) | 0,0059 | |||||
SD = keskihajonta; SE = keskivirhe
a. Aktiivinen vertailuvalmiste, peroraaliset 100/25 mg levodopa/karbidopatabletit
Kun muut toissijaiset tehon päätetapahtumat analysoitiin hierarkkisessa testausjärjestyksessä, todettiin, että Duodopa tuotti tilastollisesti merkitsevästi paremmat tulokset kuin peroraalinen levodopa/karbidopahoito, kun mittareina käytettiin Parkinson’s Disease Questionnaire ‑lomakkeen (PDQ-39) Summary Index ‑yhteispisteitä (mittaa Parkinsonin tautiin liittyvää elämänlaatua), lääkärin yleisarviopisteitä (Clinical Global Impression, CGI-I) ja Unified Parkinson’s Disease Rating Scale ‑mittarin (UPDRS) osan II pisteitä (päivittäistoiminnot). PDQ-39-yhteispisteet pienenivät 10,9 pistettä lähtötilanteesta viikolle 12. Muissa toissijaisissa päätetapahtumissa (UPDRS-mittarin osan III pisteet, EQ-5D-lomakkeen yhteispisteet ja ZBI-kokonaispisteet) ei tapahtunut hierarkkisen testauksen mukaan tilastollisesti merkitsevää muutosta.
Duodopa-hoidon pitkäaikaisturvallisuutta ja ‑siedettävyyttä arvioitiin avoimessa, yksiryhmäisessä vaiheen 3 monikeskustutkimuksessa, joka kesti 12 kuukautta ja johon osallistui 354 potilasta. Kohderyhmänä olivat edennyttä Parkinsonin tautia sairastavat, levodopaan reagoivat potilaat, joilla oli motorisia tilanvaihteluita, vaikka saatavilla oleva Parkinson-lääkitys oli optimoitu. Päivittäisen vakioidun off-ajan keskiarvo lyheni 4,44 tuntia lähtötilanteen ja päätetapahtuman välillä (lähtötilanteessa 6,77 h, päätetapahtuman kohdalla 2,32 h), ja on-aika ilman dyskinesioita lisääntyi vastaavasti 4,8 tuntia.
Duodopa-hoidon vaikutusta dyskinesiaan verrattuna optimoituun lääkehoitoon arvioitiin avoimessa satunnaistetussa vaiheen 3 monikeskustutkimuksessa, joka kesti 12 viikkoa ja johon osallistui 61 potilasta. Kohderyhmänä olivat edennyttä Parkinsonin tautia sairastavat, levodopaan reagoivat potilaat, joilla oli motorisia tilanvaihteluita, joita ei pystytty riittävän hyvin hallitsemaan optimoidulla lääkehoidolla, ja joiden yhteisen dyskinesian arviointiluokituksen (UDysRS) kokonaispistemäärä oli lähtötilanteessa ≥30. UDysRS-kokonaispistemäärän muutos (ensisijainen tehon päätetapahtuma) lähtötilanteesta viikkoon 12 mennessä osoitti tilastollisesti merkitsevän pienimmän neliösumman keskiarvojen eron (–15,05; p-arvo < 0,0001) Duodopa-hoitoa saaneen ryhmän hyväksi optimoitua lääkehoitoa saaneeseen ryhmään verrattuna. Kun toissijaiset tehon päätetapahtumat analysoitiin kiinteäsekvenssisessä testausjärjestyksessä, todettiin, että Duodopa tuotti tilastollisesti merkitsevästi paremmat tulokset verrattuna optimoituun lääkehoitoon on-ajassa ilman vaikeaa dyskinesiaa Parkinson’s Disease Diary -päiväkirjan pohjalta, kun mittareina käytettiin Parkinson’s Disease Questionnaire‑8 ‑lomakkeen (PDQ‑8) Summary Index -yhteispisteitä, lääkärin arviota potilaan voinnin muutoksesta (Clinical Global Impression Change, CGI‑C) ja UPDRS-mittarin osan II pisteitä, sekä off-ajassa Parkinson’s Disease Diary -päiväkirjan pohjalta. UPDRS-mittarin osan III pisteissä ei tapahtunut tilastollisesti merkitsevää muutosta.
Pediatriset potilaat
Duodopan turvallisuutta alle 18 vuoden ikäisten lasten hoidossa ei ole varmistettu, eikä sen käyttöä suositella alle 18-vuotiaille potilaille.
Farmakokinetiikka
Imeytyminen
Duodopa annetaan letkulla suoraan duodenumiin tai jejunumiin. Levodopa imeytyy suolesta nopeasti ja tehokkaasti aminohappojen tehokkaan kuljetusjärjestelmän avulla. Välittömästi vapautuvien peroraalisten levodopa/karbidopatablettien absoluuttisen biologisen hyötyosuuden on ilmoitettu olevan 84–99 %. Eri tutkimusten tiedoista tehty populaatiofarmakokinetiikan analyysi viittasi siihen, että Duodopa-valmisteen sisältämän levodopan biologinen hyötyosuus vastaa peroraalisten 100/25 mg levodopa/karbidopatablettien sisältämän levodopan biologista hyötyosuutta.
Eräässä vaiheen 1 tutkimuksessa Duodopan anto jejunumiin tuotti nopeasti terapeuttiset levodopapitoisuudet plasmassa ja piti levodopapitoisuudet tasaisina koko infuusion ajan. Kun infuusio lopetettiin, levodopapitoisuudet pienenivät nopeasti (kuva 1). Kun infuusion aloituksesta oli kulunut 2–16 tuntia, plasman yksilökohtaiset levodopapitoisuudet vaihtelivat vain vähän (13 %).
Kuva 1. Plasman levodopapitoisuudet (keskiarvo ± keskihajonta) suhteessa aikaan 16 tuntia kestävän Duodopa-infuusion yhteydessä
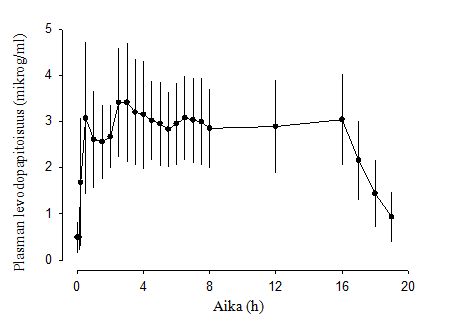
Kaksoissokkoutetussa, aktiivikontrolloidussa vaiheen 3 Duodopa-tutkimuksessa plasman levodopapitoisuuksien yksilökohtainen vaihtelu oli vähäisempää Duodopa-hoitoa käytettäessä (21 %) kuin kapseloituja peroraalisia 100/25 mg levodopa/karbidopatabletteja käytettäessä (67 %).
Jakautuminen
Levodopa annetaan dekarboksylaasin estäjän, karbidopan, kanssa, mikä lisää biologista hyötyosuutta ja vähentää levodopan puhdistumaa. Kun levodopa annetaan dekarboksylaasin estäjän kanssa, sen puhdistuma on 0,3 l/h/kg ja jakautumistilavuus 0,9-1,6 l/kg. Levodopa jakautuu punasoluihin ja plasmaan noin suhteessa 1. Levodopan proteiiniinsitoutumisaste on mitätön (noin 10 - 30 %). Suurten, neutraalien aminohappojen kuljetusmekanismi kuljettaa levodopan aivoihin.
Karbidopa sitoutuu noin 36-prosenttisesti plasman proteiineihin. Karbidopa ei läpäise veri-aivoestettä.
Biotransformaatio ja eliminaatio
Kun levodopa annetaan karbidopan kanssa, levodopan eliminaation puoliintumisaika on noin 1,5 h. Levodopan eliminaatio tapahtuu täysin metabolian kautta, ja muodostuvat metaboliitit erittyvät lähinnä virtsaan. Tiedossa on neljä eri metaboliareittiä. Levodopa eliminoituu lähinnä aromaattisen aminohappodekarboksylaasin (AAAD) ja katekoli-O-metyylitransferaasin (COMT) välittämän metabolian kautta. Muita metaboliareittejä ovat transaminaatio ja hapettuminen. Jos entsyymitoimintaa estäviä aineita ei anneta samanaikaisesti, levodopan AAAD-välitteinen dekarboksylaatio dopamiiniksi on sen tärkein entsymaattinen metaboliareitti. Kun levodopa annostellaan samanaikaisesti karbidopan kanssa, dekarboksylaasientsyymin toiminta estyy, jolloin metaboloituminen tapahtuu pääosin katekoli-O-metyylitransferaasin (COMT) kautta. Levodopan COMT-välitteinen O-metylaatio johtaa 3-O-metyylidopan muodostukseen.
Karbidopa metaboloituu kahdeksi päämetaboliitiksi (α-metyyli-3-metoksi-4-hydroksifenyylipropionihappo ja α-metyyli-3,4-dihydroksifenyylipropionihappo). Nämä kaksi metaboliittia erittyvät lähinnä virtsaan joko muuttumattomina tai glukuronidikonjugaatteina. Noin 30 % virtsaan erittyvästä kokonaismäärästä erittyy muuttumattoman karbidopan muodossa. Karbidopan eliminaation puoliintumisaika on noin 2 tuntia.
Farmakokineettiset/farmakodynaamiset suhteet
Pienempien plasman levodopapitoisuusvaihteluiden ansioista myös hoitovasteessa havaittava vaihtelu pienenee. Edenneen Parkinsonin taudin hoitoon vaadittava levodopa-annos voi vaihdella suuresti, minkä vuoksi annosmääritys tulee tehdä yksilöllisesti kliinisen vasteen perusteella. Duodopa-hoidossa ei ole havaittu toleranssin kehittymistä.
Prekliiniset tiedot turvallisuudesta
Turvallisuutta, farmakologiaa, toistuvien annosten toksisuutta, genotoksisuutta ja karsinogeenisuutta koskevien tavanomaisten tutkimusten ei-kliiniset tiedot eivät viittaa mihinkään erityiseen vaaraan ihmiselle käytettäessä. Lisääntymistoksisuustutkimuksissa sekä levodopa että levodopan ja karbidopan yhdistelmä on aiheuttanut viskeraalisia ja skeletaalisia epämuodostumia kaneilla.
Hydratsiini on karbidopan hajoamistuote. Eläinkokeissa hydratsiini osoitti merkittävää systeemistä toksisuutta, erityisesti jos altistus tapahtui hengittämällä. Näissä tutkimuksissa todettiin, että hydratsiini on maksatoksinen, sillä on keskushermostotoksisuutta (vaikka tätä ei ole todettu suun kautta annettavan lääkityksen yhteydessä) ja se on sekä genotoksinen että karsinogeeninen (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet).
Farmaseuttiset tiedot
Apuaineet
Karmelloosinatrium
Puhdistettu vesi
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
Avaamattomana: 15 viikkoa.
Avaamisen jälkeen: Käytettävä välittömästi. Valmiste on käytettävä 24 tunnin sisällä jääkaapista poistamisen jälkeen. Käyttämättä jäänyt annos on hävitettävä.
Säilytys
Säilytä ja kuljeta kylmässä (2 °C - 8 °C).
Pidä kasetti ulkopakkauksessa. Herkkä valolle.
Käyttökuntoon saatetun avatun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
DUODOPA geeli suoleen
20 mg/ml+5 mg/ml (L:ei) 7 x 100 ml (806,81 €)
PF-selosteen tieto
Kokonaismäärä 100 ml PVC-pussissa kovan, muovisen suojakasetin sisässä, pakkaus, jossa 7 kasettia.
Valmisteen kuvaus:
Luonnonvalkoinen tai kellertävä geeli.
Käyttö- ja käsittelyohjeet
Kasetit on tarkoitettu ainoastaan kertakäyttöön.
Älä käytä avattua kasettia uudelleen.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Toimita tyhjät/käytetyt kasetit apteekkiin hävitettäväksi.
Korvattavuus
DUODOPA geeli suoleen
20 mg/ml+5 mg/ml 7 x 100 ml
- Ylempi erityiskorvaus (100 %). Parkinsonin tauti ja siihen verrattavat liikehäiriöt (110).
- Peruskorvaus (40 %).
ATC-koodi
N04BA02
Valmisteyhteenvedon muuttamispäivämäärä
14.07.2023
Yhteystiedot
 ABBVIE OY
ABBVIE OY Veturitie 11 T 132
00520 Helsinki
010 2411 200
www.abbvie.fi
