ABRAXANE infuusiokuiva-aine, dispersiota varten 5 mg/ml
Vaikuttavat aineet ja niiden määrät
Yksi injektiopullo sisältää 100 mg paklitakselia albumiiniin sidottuna nanopartikkelivalmistemuotona.
Käyttökuntoon saattamisen jälkeen yksi millilitra dispersiota sisältää 5 mg paklitakselia albumiiniin sidottuna nanopartikkelivalmistemuotona.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Infuusiokuiva-aine, dispersiota varten.
Käyttökuntoon saatetun dispersiota pH on 6 ‑ 7,5 ja osmolaalisuus 300 – 360 mOsm/kg.
Kliiniset tiedot
Käyttöaiheet
Abraxane ainoana lääkkeenä on tarkoitettu metastaattisen rintasyövän hoitoon aikuisilla potilailla, joiden metastaattisen sairauden ensilinjan hoito on epäonnistunut ja joille vakiintunut antrasykliiniä sisältävä hoito ei ole indisoitu (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Abraxane yhdistelmänä gemsitabiinin kanssa on tarkoitettu ensilinjan hoidoksi aikuisille potilaille, joilla on metastaattinen haiman adenokarsinooma.
Abraxane yhdistelmänä karboplatiinin kanssa on tarkoitettu ensilinjan hoidoksi ei-pienisoluista keuhkosyöpää sairastaville aikuisille potilaille, joille mahdollisesti kuratiivinen leikkaus ja/tai sädehoito eivät sovi.
Ehto
Paklitakseli-lääkitys tulee antaa vain syöpätautien erikoislääkärin valvonnassa sytostaattien käyttöön erikoistuneissa sairaalayksiköissä.
Annostus ja antotapa
Abraxane tulee antaa potilaalle ainoastaan pätevän onkologin valvonnassa sytotoksisten aineiden antamiseen erikoistuneessa yksikössä. Sitä ei saa korvata muilla paklitakselin valmistemuodoilla, eikä sitä saa käyttää yhdessä muiden paklitakselivalmistemuotojen kanssa.
Annostus
Rintasyöpä
Suositeltu Abraxane-annos on 260 mg/m2 laskimoon 30 minuutin aikana joka kolmas viikko.
Annostuksen sovittaminen rintasyövän hoidon aikana
Jos potilaalla on ollut voimakas neutropenia (neutrofiilit < 500 solua/mm3 vähintään viikon ajan) tai voimakas sensorinen neuropatia Abraxane-hoidon aikana, hänen annostaan on pienennettävä siten, että se on seuraavilla hoitojaksoilla 220 mg/m2. Voimakkaan neutropenian tai voimakkaan sensorisen neuropatian uusiutumisen jälkeen annosta on pienennettävä lisää siten, että se on 180 mg/m2.
Abraxane-valmistetta ei tule antaa, ennen kuin neutrofiilimäärä on palautunut lukemaan > 1 500 solua/mm3. Asteen 3 sensorisessa neuropatiassa hoito keskeytetään, kunnes neuropatia on lieventynyt asteeseen 1 tai 2, minkä jälkeen kaikkien seuraavien hoitojaksojen annosta pienennetään.
Haiman adenokarsinooma
Abraxane-valmisteen suositeltu annos yhdistelmänä gemsitabiinin kanssa on 125 mg/m2 laskimoon 30 minuutin kestoisena infuusiona kunkin 28 vuorokauden pituisen hoitosyklin päivinä 1,8 ja 15. Samanaikaisesti annettavan gemsitabiinin suositeltu annos on 1 000 mg/m2 laskimoon 30 minuutin aikana välittömästi Abraxane-valmisteen annon päätyttyä kunkin 28 vuorokauden pituisen hoitosyklin päivinä 1,8 ja 15.
Annostuksen sovittaminen haiman adenokarsinooman hoidon aikana
Taulukko 1. Annoksen pienentäminen haiman adenokarsinoomaa sairastaville potilaille
Annostaso | Abraxane-annos (mg/m2) | Gemsitabiiniannos (mg/m2) |
Täysi annos | 125 | 1 000 |
1. annostason pienentäminen | 100 | 800 |
2. annostason pienentäminen | 75 | 600 |
Jos annosta täytyy tämän lisäksi pienentää | Lopeta hoito | Lopeta hoito |
Taulukko 2. Annoksen muuttaminen neutropenian ja/tai trombosytopenian yhteydessä hoitosyklin alussa tai sen kuluessa haiman adenokarsinoomaa sairastaville potilaille
Hoito-syklin päivä | Absoluuttinen neutrofiilimäärä (solua/mm3) | Verihiutalemäärä (solua/mm3) | Abraxane-annos | Gemsitabiiniannos | |
Päivä 1 | < 1 500 | TAI | < 100 000 | Myöhennä annoksia kunnes määrät ovat normalisoituneet | |
Päivä 8 | ≥ 500, mutta < 1 000 | TAI | ≥ 50 000, mutta < 75 000 | Pienennä annoksia 1 annostason verran | |
< 500 | TAI | < 50 000 | Älä anna annoksia | ||
Päivä 15: Jos päivän 8 annokset annettiin ilman muutosta: | |||||
Päivä 15 | ≥ 500, mutta < 1 000 | TAI | ≥ 50 000, mutta < 75 000 | Hoida päivän 8 annostasolla ja jatka sen jälkeen veren valkosolujen kasvutekijöillä TAI Pienennä annoksia 1 annostasolla päivän 8 annoksista | |
< 500 | TAI | < 50 000 | Älä anna annoksia | ||
Päivä 15: Jos päivän 8 annoksia pienennettiin: | |||||
Päivä 15 | ≥ 1 000 | JA | ≥ 75 000 | Palaa päivän 1 annostasoihin ja jatka sen jälkeen veren valkosolujen kasvutekijöillä TAI Hoida samansuuruisilla annoksilla kuin päivänä 8 | |
≥ 500, mutta < 1 000 | TAI | ≥ 50 000, mutta < 75 000 | Hoida päivän 8 annostasoilla ja jatka sen jälkeen veren valkosolujen kasvutekijöillä TAI Pienennä annoksia 1 annostasolla päivän 8 annoksista | ||
< 500 | TAI | < 50 000 | Älä anna annoksia | ||
Päivä 15: Jos päivän 8 annoksia ei annettu: | |||||
Päivä 15 | ≥ 1 000 | JA | ≥ 75 000 | Palaa päivän 1 annostasoihin ja jatka sen jälkeen veren valkosolujen kasvutekijöillä TAI Pienennä annoksia 1 annostasolla päivän 1 annoksista | |
≥ 500, mutta < 1 000 | TAI | ≥ 50 000, mutta < 75 000 | Pienennä annosta 1 annostasolla ja jatka sen jälkeen veren valkosolujen kasvutekijöillä TAI Pienennä annoksia 2 annostasolla päivän 1 annoksista | ||
< 500 | TAI | < 50 000 | Älä anna annoksia | ||
Taulukko 3. Haiman adenokarsinoomaa sairastavien potilaiden annosmuutokset muiden haittavaikutusten yhteydessä
Haittavaikutus | Abraxane-annos | Gemsitabiiniannos |
Kuumeinen neutropenia: aste 3 tai 4 | Älä anna annoksia ennen kuin kuume häviää ja absoluuttinen neutrofiilimäärä ≥ 1 500; jatka hoitoa sitten seuraavaksi pienemmällä annostasollaa | |
Perifeerinen neuropatia: aste 3 tai 4 | Älä anna annosta ennen kuin neuropatia korjaantuu ≤ asteeseen 1; jatka hoitoa sitten seuraavaksi pienemmällä annostasollaa | Hoida samalla annoksella |
Ihotoksisuus: aste 2 tai 3 | Pienennä seuraavaksi pienempään annostasoona; lopeta hoito, jos haittavaikutus pitkittyy | |
Gastrointestinaalinen toksisuus: asteen 3 mukosiitti tai ripuli | Älä anna annoksia ennen kuin toksisuus korjautuu ≤ asteeseen 1; jatka hoitoa sitten seuraavaksi pienemmällä annostasollaa | |
aKs. annoksen pienentäminen taulukosta 1
Ei-pienisoluinen keuhkosyöpä:
Suositeltu Abraxane-annos on 100 mg/m2 laskimoon 30 minuutin kestoisena infuusiona kunkin 21 vuorokauden pituisen hoitosyklin päivinä 1, 8 ja 15. Suositeltu karboplatiiniannos on AUC = 6 mg•min/ml kunkin 21 vuorokauden pituisen hoitosyklin päivänä 1 siten, että anto aloitetaan heti Abraxane-valmisteen annon päätyttyä.
Annostuksen sovittaminen ei-pienisoluisen keuhkosyövän hoidon aikana:
Abraxane-valmistetta ei saa antaa hoitosyklin päivänä 1 ennen kuin absoluuttinen neutrofiilimäärä on ≥ 1500 solua/mm3 ja trombosyyttimäärä ≥ 100 000 solua/mm3. Kunkin seuraavan viikoittaisen Abraxane-annoksen yhteydessä potilaan absoluuttisen neutrofiilimäärän on oltava ≥ 500 solua/mm3 ja trombosyyttimäärän > 50 000 solua/mm3 tai muussa tapauksessa annoksen antoa pitää myöhentää, kunnes määrät ovat korjautuneet. Määrien korjauduttua antoa jatketaan seuraavalla viikolla taulukon 4 kriteerien mukaisesti. Seuraavaa annosta saa pienentää vain, jos taulukon 4 kriteerit täyttyvät.
Taulukko 4: Ei-pienisoluista keuhkosyöpää sairastavien potilaiden annoksen pienentäminen hematologisen toksisuuden yhteydessä
Hematologinen toksisuus | Esiintymis-kerta | Abraxane-annos (mg/m2)1 | Karboplatiiniannos (AUC mg•min/ml)1 |
Pienin ANC-arvo < 500/mm3 ja neutropeeninen kuume > 38 °C TAI Seuraavan hoitosyklin siirtäminen myöhempään ajankohtaan pitkittyvän neutropenian vuoksi2 (pienin ANC-arvo < 1500/mm3) TAI Pienin ANC-arvo < 500/mm3 > 1 viikon ajan | Ensimmäinen | 75 | 4,5 |
Toinen | 50 | 3,0 | |
Kolmas | Lopeta hoito | ||
Pienin trombosyyttimäärä < 50 000/mm3 | Ensimmäinen | 75 | 4,5 |
Toinen | Lopeta hoito | ||
1 Pienennä Abraxane- ja karboplatiiniannosta samanaikaisesti 21 vuorokauden mittaisen hoitosyklin päivänä 1. Pienennä sen jälkeen Abraxane-annosta 21 vuorokauden mittaisen hoitosyklin päivänä 8 tai 15, ja pienennä karboplatiiniannosta sitä seuraavan hoitosyklin aikana.
2 Enintään 7 vuorokautta seuraavan hoitosyklin aikataulun mukaisen päivän 1 annoksen jälkeen.
Asteen 2 tai 3 ihotoksisuuden, asteen 3 ripulin tai asteen 3 mukosiitin ilmaantuessa hoito keskeytetään, kunnes toksisuus on lieventynyt asteeseen ≤ 1, minkä jälkeen hoito aloitetaan uudelleen taulukon 5 ohjeiden mukaisesti. Asteen ≥ 3 perifeerisen neuropatian yhteydessä hoito keskeytetään, kunnes neuropatia on lieventynyt asteeseen ≤ 1. Hoitoa voidaan jatkaa seuraavissa hoitosykleissä seuraavaksi pienemmällä annostasolla taulukon 5 ohjeiden mukaisesti. Minkä tahansa muun asteen 3 tai 4 ei-hematologisen toksisuuden yhteydessä hoito keskeytetään, kunnes toksisuus on lieventynyt asteeseen ≤ 2, minkä jälkeen hoito aloitetaan uudelleen taulukon 5 ohjeiden mukaisesti.
Taulukko 5: Ei-pienisoluista keuhkosyöpää sairastavien potilaiden annoksen pienentäminen ei-hematologisen toksisuuden yhteydessä
Ei-hematologinen toksisuus | Esiintymis-kerta | Abraxane-annos (mg/m2)1 | Karboplatiiniannos (AUC mg•min/ml)1 |
Asteen 2 tai 3 ihotoksisuus Asteen 3 ripuli Asteen 3 mukosiitti Asteen ≥ 3 perifeerinen neuropatia Mikä tahansa muu asteen 3 tai 4 ei-hematologinen toksisuus | Ensimmäinen | 75 | 4,5 |
Toinen | 50 | 3,0 | |
Kolmas | Lopeta hoito | ||
Asteen 4 ihotoksisuus, ripuli tai mukosiitti | Ensimmäinen | Lopeta hoito | |
1 Pienennä Abraxane- ja karboplatiiniannosta samanaikaisesti 21 vuorokauden mittaisen hoitosyklin päivänä 1. Pienennä sen jälkeen Abraxane-annosta 21 vuorokauden mittaisen hoitosyklin päivänä 8 tai 15, ja pienennä karboplatiiniannosta sitä seuraavan hoitosyklin aikana.
Erityispotilasryhmät
Maksan vajaatoiminta
Lievää maksan vajaatoimintaa sairastavien potilaiden (kokonaisbilirubiinipitoisuus > 1 – ≤ 1,5 x ULN ja aspartaattiaminotransferaasipitoisuus [ASAT] ≤ 10 x ULN) annosta ei tarvitse käyttöaiheesta riippumatta muuttaa. Hoida samansuuruisilla annoksilla kuin potilaat, joiden maksan toiminta on normaali.
Metastaattista rintasyöpää sairastaville potilaille ja ei-pienisoluista keuhkosyöpää sairastaville potilaille, joilla on kohtalainen tai vaikea maksan vajaatoiminta (kokonaisbilirubiinipitoisuus > 1,5 – ≤ 5 x ULN ja ASAT-arvo ≤ 10 x ULN), suositellaan annoksen pienentämistä 20 %. Jos potilas sietää hoidon vähintään kahden hoitosyklin ajan, pienennetty annos voidaan suurentaa vähitellen annokseen, jota annetaan potilaille, joiden maksan toiminta on normaali (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Metastaattista haiman adenokarsinoomaa sairastavista potilaista, joilla on kohtalainen tai vaikea maksan vajaatoiminta, ei ole riittävästi tietoa annostussuositusten antamiseksi (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Potilaista, joiden kokonaisbilirubiinipitoisuus on > 5 x ULN tai ASAT-arvo > 10 x ULN, ei ole riittävästi tietoa annostussuositusten antamiseksi käyttöaiheesta riippumatta (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Munuaisten vajaatoiminta
Abraxane-valmisteen aloitusannosta ei tarvitse säätää, jos potilaalla on lievää tai kohtalaista munuaisten vajaatoimintaa (laskennallinen kreatiniinipuhdistuma ≥ 30 – < 90 ml/min). Saatavana on riittämättömästi tietoa, jotta voitaisiin suositella Abraxanen annoksen säätöä vaikeaa munuaisten vajaatoimintaa tai loppuvaiheen munuaissairautta sairastaville potilaille (laskennallinen kreatiniinipuhdistuma < 30 ml/min) (ks. kohta Farmakokinetiikka).
Iäkkäät
Vähintään 65-vuotiaille potilaille ei suositella muuta kuin kaikille potilaille yleensäkin suositeltua annoksen pienentämistä.
Abraxane-valmistetta satunnaistetussa tutkimuksessa rintasyövän hoitoon monoterapiana saaneista 229 potilaasta 13 % oli vähintään 65-vuotiaita ja < 2 % oli vähintään 75-vuotiaita. Vähintään 65-vuotiailla Abraxane-valmistetta saaneilla potilailla ei esiintynyt toksisuutta huomattavasti useammin kuin muilla. Tämän jälkeen analysoitiin 981 Abraxane-valmistetta metastasoituneen rintasyövän hoitoon monoterapiana saaneen potilaan tiedot; näistä potilaista 15 % oli ≥ 65-vuotiaita ja 2 % oli ≥ 75-vuotiaita. Analyysi osoitti, että ≥ 65-vuotiailla potilailla nenäverenvuodon, ripulin, elimistön kuivumistilan, väsymyksen ja perifeerisen ödeeman esiintyvyys oli suurempi.
Niistä haiman adenokarsinoomaa sairastavista, satunnaistettuun tutkimukseen osallistuneista 421 potilaasta, jotka saivat Abraxane-valmistetta yhdistelmänä gemsitabiinin kanssa, 41 % oli vähintään 65-vuotiaita ja 10 % oli vähintään 75-vuotiaita. Vähintään 75-vuotiailla Abraxane-valmistetta ja gemsitabiinia saaneilla potilailla vakavat haittavaikutukset ja hoidon lopettamiseen johtaneet haittavaikutukset olivat yleisempiä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Vähintään 75-vuotiaat haiman adenokarsinoomaa sairastavat potilaat on tutkittava huolellisesti ennen kuin hoitoa harkitaan (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Niistä satunnaistettuun tutkimukseen osallistuneista ei-pienisoluista keuhkosyöpää sairastavista 514 potilaasta, jotka saivat Abraxane-valmistetta yhdistelmänä karboplatiinin kanssa, 31 % oli vähintään 65-vuotiaita ja 3,5 % oli vähintään 75-vuotiaita. Myelosuppressiotapahtumat, perifeeriset neuropatiatapahtumat ja artralgia olivat yleisempiä vähintään 65-vuotiailla potilailla kuin alle 65-vuotiailla potilailla. Abraxane-valmiteen/karboplatiinin käytöstä vähintään 75-vuotiaiden potilaiden hoitoon on vähän kokemusta.
Farmakokineettinen/farmakodynaaminen mallinnus 125 sellaisen potilaan tiedoista, joilla oli pitkälle edenneitä kiinteitä kasvaimia, osoittaa, että ≥ 65-vuotiaille potilaille saattaa kehittyä herkemmin neutropenia ensimmäisen hoitosyklin kuluessa.
Pediatriset potilaat
Abraxane-valmisteen turvallisuutta ja tehoa 0–17 vuoden ikäisten lasten ja nuorten hoidossa ei ole varmistettu. Annostuksesta ei voida antaa suosituksia saatavissa olevan tietojen perusteella, jotka on kuvattu kohdissa Haittavaikutukset, Farmakodynamiikka ja Farmakokinetiikka. Ei ole asianmukaista käyttää Abraxane-valmistetta pediatrisille potilaille metastaattisen rintasyövän, haiman adenokarsinooman tai ei-pienisoluisen keuhkosyövän hoitoon.
Antotapa
Anna käyttökuntoon saatettu Abraxane-dispersio laskimoon infuusiovälineiden avulla käyttämällä 15 µm ‑suodatinta. Laskimokatetri suositellaan huuhtelemaan annon jälkeen 9 mg/ml (0,9 %) natriumkloridi-injektioliuoksella, millä varmistetaan, että potilas on saanut koko annoksen.
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen saattamisesta käyttökuntoon ennen lääkkeen antoa.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Imetys (ks. kohta Raskaus ja imetys).
Potilaat, joiden lähtötason neutrofiilimäärä on alle < 1 500 solua/mm3.
Varoitukset ja käyttöön liittyvät varotoimet
Abraxane on paklitakselin albumiiniin sidottu nanopartikkelivalmistemuoto, jonka farmakologiset ominaisuudet voivat erota olennaisesti paklitakselin muista valmistemuodoista (ks. kohdat Farmakodynamiikka ja Farmakokinetiikka). Sitä ei saa korvata muilla paklitakselin muodoilla, eikä sitä saa käyttää yhdessä muiden paklitakselimuotojen kanssa.
Yliherkkyys
Harvoin ilmenneitä vaikea-asteisia yliherkkyysreaktioita, mukaan lukien hyvin harvoin ilmenneitä kuolemaan johtaneita anafylaktisia reaktioita, on raportoitu. Jos yliherkkyysreaktio ilmaantuu, valmisteen käyttö tulee lopettaa välittömästi ja aloittaa oireiden mukainen hoito. Tällaista potilasta ei saa enää hoitaa paklitakselilla.
Hematologia
Luuydinsuppressiota (pääasiassa neutropeniaa) esiintyy usein Abraxane-valmistetta käytettäessä. Neutropenia on annoksesta riippuvainen ja annosta rajoittava toksisuus. Abraxane-hoidon aikana verenkuvaa on seurattava tiheään. Potilaita ei tule hoitaa uusilla Abraxane-hoitojaksoilla, ennen kuin neutrofiilit ovat palautuneet tasolle > 1 500 solua/mm3 ja verihiutaleet tasolle > 100 000 solua/ mm3 (ks. kohta Annostus ja antotapa).
Neuropatia
Sensorista neuropatiaa esiintyy usein Abraxane-valmistetta käytettäessä, joskin vakavien oireiden kehittyminen on epätavallista. Asteen 1 tai 2 sensorinen neuropatia ei yleensä vaadi annostuksen pienentämistä. Jos potilaalle kehittyy asteen 3 sensorinen neuropatia käytettäessä Abraxane-valmistetta monoterapiana, hoitoa on siirrettävä, kunnes tauti on lieventynyt asteeseen 1 tai 2. Tämän jälkeen suositellaan annettavaksi pienennetty annos kaikilla seuraavilla Abraxane-jaksoilla (ks. kohta Annostus ja antotapa). Jos Abraxane-valmisteen ja gemsitabiinin yhdistelmäkäytössä kehittyy asteen 3 tai sitä korkeamman asteen perifeerinen neuropatia, älä anna Abraxane-valmistetta, mutta jatka gemsitabiinihoitoa samalla annoksella. Jatka Abraxane-hoitoa pienemmällä annoksella, kun perifeerinen neuropatia korjautuu asteeseen 0 tai 1 (ks. kohta Annostus ja antotapa).
Jos Abraxanen ja karboplatiinin yhdistelmäkäytössä kehittyy asteen 3 tai sitä korkeamman asteen perifeerinen neuropatia, hoitoa on siirrettävä, kunnes perifeerinen neuropatia on lieventynyt asteeseen 0 tai 1, minkä jälkeen kaikkina seuraavina Abraxane- ja karboplatiinijaksoina annetaan pienennetty annos (ks. kohta Annostus ja antotapa).
Sepsis
Sepsistä raportoitiin 5 %:lla sekä neutropeniaa sairastavista että sairastamattomista potilaista, jotka saivat Abraxane-valmistetta yhdistelmänä gemsitabiinin kanssa. Perussairautena sairastettavasta haimasyövästä aiheutuneet komplikaatiot, erityisesti sappitietukos tai sappitiestentti, tunnistettiin merkittäviksi edistäviksi tekijöiksi. Jos potilaalle ilmaantuu kuumetta (neutrofiilimäärästä riippumatta), aloita hoito laajakirjoisilla antibiooteilla. Älä anna kuumeisen neutropenian yhteydessä Abraxane-valmistetta ja gemsitabiinia ennen kuin kuume häviää ja absoluuttinen neutrofiilimäärä on ≥ 1 500 solua/mm3. Jatka hoitoa sitten pienemmällä annostasolla (ks. kohta Annostus ja antotapa).
Pneumoniitti
Pneumoniittia esiintyi 1 %:lla potilaista, kun Abraxane-valmistetta käytettiin monoterapiana, ja 4 %:lla potilaista, kun Abraxane-valmistetta käytettiin yhdistelmänä gemsitabiinin kanssa. Tarkkaile kaikkia potilaita huolellisesti pneumoniitin oireiden ja löydösten havaitsemiseksi. Kun on varmistettu, että taudin syy ei ole infektio ja taudiksi varmistuu pneumoniitti, lopeta Abraxane- ja gemsitabiinihoito pysyvästi ja aloita asianmukainen hoito sekä tukitoimenpiteet välittömästi (ks. kohta Annostus ja antotapa).
Maksan vajaatoiminta
Koska paklitakselin toksisuus voi lisääntyä maksan vajaatoiminnan yhteydessä, tulee Abraxane annostella varovaisesti maksan vajaatoimintaa sairastaville potilaille. Maksan vajaatoiminnasta kärsivillä potilailla saattaa olla lisääntynyt toksisten vaikutusten vaara, erityisesti myelosuppressiosta aiheutuva. Tällaisia potilaita tulee tarkkailla tiiviisti vaikean myelosuppression kehittymisen varalta.
Abraxane-valmistetta ei suositella potilaille, joiden kokonaisbilirubiinipitoisuus on > 5 x ULN tai ASAT-arvo on > 10 x ULN. Abraxane-valmistetta ei myöskään suositella metastaattisen haiman adenokarsinooman hoitoon, jos potilaalla on kohtalaista tai vaikeaa maksan vajaatoimintaa (kokonaisbilirubiinipitoisuus > 1,5 x ULN ja ASAT-arvo ≤ 10 x ULN) (ks. kohta Farmakokinetiikka).
Kardiotoksisuus
Kongestiivista sydämen vajaatoimintaa ja vasemman kammion toimintahäiriötä on harvinaisissa tapauksissa raportoitu Abraxane-valmistetta saavilla potilailla. Useimmat näistä potilaista ovat aiemmin altistuneet kardiotoksisille lääkevalmisteille, kuten antrasykliineille, tai heillä on taustalla sydänsairaus. Siksi lääkärien tulee seurata Abraxane-valmistetta käyttäviä potilaita tarkasti sydänsairauksien osalta.
Keskushermoston metastaasit
Abraxane-valmisteen tehoa ja turvallisuutta keskushermoston metastaaseista kärsivillä potilailla ei ole tutkittu. Keskushermoston metastaaseja ei yleensä pystytä hallitsemaan hyvin systeemisellä solunsalpaajahoidolla.
Ruoansulatuselimistön oireet
Jos potilaalla esiintyy pahoinvointia, oksentelua ja ripulia Abraxane-valmisteen ottamisen jälkeen, häntä voi hoitaa normaaleilla pahoinvointi- ja ripulilääkkeillä.
Silmät
Rakkulaista makulaturvotusta on ilmoitettu esiintyneen Abraxane‑hoitoa saaneilla potilailla. Potilaalle on tehtävä nopeasti täydellinen oftalmologinen tutkimus, jos hänen näkönsä heikkenee. Jos rakkulainen makulaturvotus diagnosoidaan, Abraxane‑hoito on lopetettava ja asianmukainen hoito aloitettava (ks. kohta Haittavaikutukset).
Vähintään 75-vuotiaat potilaat
Vähintään 75-vuotiailla potilailla ei ole osoitettu hyötyä Abraxane-valmisteen ja gemsitabiinin yhdistelmähoidosta verrattuna gemsitabiinimonoterapiaan. Abraxane-valmistetta ja gemsitabiinia saaneilla hyvin iäkkäillä (vähintään 75-vuotiailla) potilailla vakavien ja hoidon lopettamiseen johtaneiden haittavaikutusten esiintyvyys oli suurempi. Tällaisia haittavaikutuksia olivat esim. hematologinen toksisuus, perifeerinen neuropatia, ruokahalun väheneminen ja elimistön kuivumistila. Abraxane-valmisteen ja gemsitabiinin yhdistelmähoidon siedettävyys vähintään 75-vuotiailla haiman adenokarsinoomaa sairastavilla potilailla on arvioitava huolellisesti. Erityistä huomiota on kiinnitettävä suorituskykyyn, muihin samanaikaisiin sairauksiin ja lisääntyneeseen infektioriskiin (ks. kohdat Annostus ja antotapa ja Haittavaikutukset).
Muu
Vaikka tietoja on saatavissa vähän, haiman adenokarsinoomaa sairastavien potilaiden ei ole osoitettu selvästi hyötyneen kokonaiseloonjäännin pidentymisen suhteen, jos CA 19‑9 ‑arvot olivat normaalit ennen Abraxane- ja gemsitabiinihoidon aloittamista (ks. kohta Farmakodynamiikka).
Erlotinibia ei saa käyttää samanaikaisesti Abraxane-valmisteen ja gemsitabiinin yhdistelmähoidon aikana (ks. kohta Yhteisvaikutukset).
Apuaineet
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per 100 mg eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Paklitakseli metaboloituu osittain sytokromin P450 isoentsyymien CYP2C8 ja CYP3A4 katalysoimana (ks. kohta Farmakokinetiikka). Tämän vuoksi ja koska farmakokineettisiä lääkkeiden yhteisvaikutustutkimuksia ei ole tehty, on noudatettava varovaisuutta annettaessa paklitakselia samanaikaisesti sellaisten lääkkeiden kanssa, joiden tiedetään estävän joko CYP2C8- tai CYP3A4-isoentsyymejä (esimerkiksi ketokonatsoli ja muut antifungaaliset imidatsolit, erytromysiini, fluoksetiini, gemfibrotsiili, klopidogreeli, simetidiini, ritonaviiri, sakvinaviiri, indinaviiri ja nelfinaviiri), koska suurempi paklitakselialtistus voi lisätä paklitakselin toksisuutta. Paklitakselin antamista samanaikaisesti sellaisten lääkkeiden kanssa, joiden tiedetään indusoivan joko CYP2C8- tai CYP3A4-isoentsyymejä (esimerkiksi rifampisiini, karbamatsepiini, fenytoiini, efavirentsi, nevirapiini), ei suositella, koska hoidon teho voi vaarantua pienemmän paklitakselialtistuksen vuoksi.
Paklitakselilla ja gemsitabiinilla ei ole yhteistä metaboliareittiä. Paklitakselin puhdistuman määrittää pääasiassa CYP2C8- ja CYP3A4-välitteinen metabolia, jota seuraa erittyminen sapen mukana, kun taas gemsitabiini inaktivoituu sytidiinideaminaasin vaikutuksesta, mitä seuraa erittyminen virtsaan. Abraxane-valmisteen ja gemsitabiinin farmakokineettisiä yhteisvaikutuksia ei ole tutkittu ihmisellä.
Abraxane-valmisteella ja karboplatiinilla tehtiin farmakokineettinen tutkimus ei-pienisoluista keuhkosyöpää sairastavilla potilailla. Abraxane-valmisteen ja karboplatiinin välillä ei esiintynyt kliinisesti oleellisia farmakokineettisiä yhteisvaikutuksia.
Abraxane on tarkoitettu monoterapiana rintasyövän hoitoon, yhdistelmänä gemsitabiinin kanssa haiman adenokarsinooman hoitoon tai yhdistelmänä karboplatiinin kanssa ei-pienisoluisen keuhkosyövän hoitoon (ks. kohta Käyttöaiheet). Abraxane-valmistetta ei pidä käyttää yhdessä muiden syöpälääkkeiden kanssa.
Pediatriset potilaat
Yhteisvaikutuksia on tutkittu vain aikuisille tehdyissä tutkimuksissa.
Raskaus ja imetys
Ehkäisy miehille ja naisille
Naisten, jotka voivat tulla raskaaksi, tulee käyttää tehokasta ehkäisyä Abraxane-hoidon aikana ja vähintään kuusi kuukautta viimeisen annoksen jälkeen. Miespotilaita, joilla on kumppanina nainen, joka voi tulla raskaaksi, neuvotaan käyttämään tehokasta ehkäisyä ja välttämään lapsen siittämistä Abraxane-hoidon aikana ja vähintään kolme kuukautta viimeisen Abraxane-annoksen jälkeen.
Raskaus
Paklitakselin käytöstä ihmisen raskauden aikana on vain vähän tietoa. Paklitakselin epäillään aiheuttavan vakavia synnynnäisiä vaurioita, jos sitä käytetään raskauden aikana. Eläimillä tehdyissä tutkimuksissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Naisten, jotka voivat tulla raskaaksi, on tehtävä raskaustesti ennen Abraxane-hoidon aloittamista. Raskaana olevien tai riittämätöntä ehkäisyä käyttävien naisten ei pidä käyttää Abraxane-valmistetta, ellei äidin kliininen tilanne edellytä paklitakselihoitoa.
Imetys
Paklitakseli ja/tai sen metaboliitit erittyivät imettävien rottien maitoon (ks. kohta Prekliiniset tiedot turvallisuudesta). Ei tiedetä, erittyykö paklitakseli ihmisillä äidinmaitoon. Abraxane on vasta-aiheista imetyksen aikana imetettäville vauvoille aiheutuvien mahdollisten vakavien haittavaikutusten takia. Imetys on lopetettava hoidon ajaksi.
Hedelmällisyys
Abraxane aiheutti koiraspuolisissa rotissa hedelmättömyyttä (ks. kohta Prekliiniset tiedot turvallisuudesta). Eläimillä tehtyjen löydösten perusteella miesten ja naisten hedelmällisyys saattaa heikentyä. Miespuolisten potilaiden tulisi kysyä neuvoa sperman tallettamisesta ennen hoitoa, koska Abraxane-hoito voi aiheuttaa pysyvää hedelmättömyyttä.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Abraxane-valmisteella on vähäinen tai kohtalainen vaikutus ajokykyyn ja koneidenkäyttökykyyn. Abraxane saattaa aiheuttaa haittavaikutuksia, kuten väsymystä (hyvin yleistä) ja huimausta (yleistä), mikä saattaa vaikuttaa ajokykyyn ja kykyyn käyttää koneita. Potilaita tulee neuvoa pidättäytymään autonajosta ja koneiden käytöstä, jos he kokevat väsymystä tai huimausta.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisimmät kliinisesti merkitsevät Abraxane-valmisteen käyttöön liittyvät haittavaikutukset ovat olleet neutropenia, perifeerinen neuropatia, artralgia/myalgia ja maha-suolikanavan häiriöt.
Haittavaikutustaulukko
Taulukossa 6 luetellaan haittavaikutukset, jotka liittyvät Abraxane-valmisteeseen monoterapiana millä tahansa annoksella mihin tahansa käyttöaiheeseen kliinisten tutkimusten aikana (N = 789), Abraxane-valmisteen käyttöön yhdistelmänä gemsitabiinin kanssa haiman adenokarsinooman hoitoon faasin III kliinisessä tutkimuksessa (N = 421), Abraxane-valmisteen käyttöön yhdistelmänä karboplatiinin kanssa ei-pienisoluisen keuhkosyövän hoitoon faasin III kliinisessä tutkimuksessa (N = 514) ja markkinoille tulon jälkeiseen käyttöön.
Esiintymistiheydet määritellään seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100 – < 1/10), melko harvinainen (≥ 1/1 000 – < 1/100), harvinainen (≥ 1/10 000 – < 1/1 000), hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin). Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 6. Haittavaikutukset, jotka on raportoitu käytettäessä Abraxane-valmistetta
Monoterapia (N = 789) | Yhdistelmähoito gemsitabiinin kanssa (N = 421) | Yhdistelmähoito karboplatiinin kanssa (N = 514) | |
Infektiot | |||
Yleinen: | Infektio, virtsatieinfektio, follikuliitti, ylähengitystieinfektio, kandidiaasi, sinuiitti | Sepsis, keuhkokuume, suusammas | Keuhkokuume, keuhkoputkitulehdus, ylähengitystieinfektio, virtsatieinfektio |
Melko harvinainen: | Sepsis1, neutropeeninen sepsis1, keuhkokuume, suusammas, nasofaryngiitti, selluliitti, yskänrokko, virusinfektio, vyöruusu, sieni-infektio, katetriin liittyvä infektio, injektiopaikan infektio | Sepsis, suusammas | |
Hyvän- ja pahanlaatuiset kasvaimet (mukaan lukien kystat ja polyypit) | |||
Melko harvinainen: | Tuumorinekroosi, metastaasikipu | ||
Veri ja imukudos | |||
Hyvin yleinen: | Luuydinsuppressio, neutropenia, trombosytopenia, anemia, leukopenia, lymfopenia | Neutropenia, trombosytopenia, anemia | Neutropenia3, trombosytopenia3, anemia3, leukopenia3 |
Yleinen: | Kuumeinen neutropenia | Pansytopenia | Kuumeinen neutropenia, lymfopenia |
Melko harvinainen: | Tromboottinen trombosytopeeninen purppura | Pansytopenia | |
Harvinainen: | Pansytopenia | ||
Immuunijärjestelmä | |||
Melko harvinainen: | Yliherkkyys | Lääkeyliherkkyys, yliherkkyys | |
Harvinainen: | Vaikea yliherkkyys1 | ||
Aineenvaihdunta ja ravitsemus | |||
Hyvin yleinen: | Anoreksia | Kuivumistila, vähentynyt ruokahalu, hypokalemia | Vähentynyt ruokahalu |
Yleinen: | Kuivumistila, vähentynyt ruokahalu, hypokalemia | Kuivumistila | |
Melko harvinainen: | Hypofosfatemia, nesteretentio, hypoalbuminemia, polydipsia, hyperglykemia, hypokalsemia, hypoglykemia, hyponatremia | ||
Tuntematon: | Tuumorilyysioireyhtymä1 | ||
Psyykkiset häiriöt | |||
Hyvin yleinen: | Depressio, unettomuus | ||
Yleinen: | Depressio, unettomuus, ahdistuneisuus | Ahdistuneisuus | Unettomuus |
Melko harvinainen: | Rauhattomuus | ||
Hermosto | |||
Hyvin yleinen: | Perifeerinen neuropatia, neuropatia, hypestesia, parestesia | Perifeerinen neuropatia, huimaus, päänsärky, makuhäiriö | Perifeerinen neuropatia |
Yleinen: | Perifeerinen sensorinen neuropatia, huimaus, perifeerinen motorinen neuropatia, ataksia, päänsärky, sensorinen häiriö, uneliaisuus, makuhäiriö | Huimaus, päänsärky, makuhäiriö | |
Melko harvinainen: | Polyneuropatia, arefleksia, pyörtyminen, asentohuimaus, dyskinesia, hyporefleksia, neuralgia, neuropaattinen kipu, vapina, tunnottomuus | Kasvohermohalvaus | |
Tuntematon: | Aivohermohalvaus useita1 | ||
Silmät | |||
Yleinen: | Hämärtynyt näkö, lisääntynyt lakrimaatio, kuivasilmäisyys, kyynelvajauksesta johtuva sarveis- ja sidekalvontulehdus, madaroosi | Lisääntynyt lakrimaatio | Hämärtynyt näkö |
Melko harvinainen: | Näöntarkkuuden heikkeneminen, epänormaali näkö, silmä-ärsytys, silmäkipu, sidekalvotulehdus, näköhäiriöt, silmän kutina, sarveiskalvotulehdus | Rakkulainen makulaturvotus | |
Harvinainen: | Rakkulainen makulaturvotus1 | ||
Kuulo ja tasapainoelin | |||
Yleinen: | Huimaus | ||
Melko harvinainen: | Tinnitus, korvakipu | ||
Sydän | |||
Yleinen: | Rytmihäiriö, takykardia, supraventrikulaarinen takykardia | Sydämen kongestiivinen vajaatoiminta, takykardia | |
Harvinainen: | Sydänpysähdys, kongestiivinen sydämen vajaatoiminta, vasemman kammion toimintahäiriö, eteiskammiokatkos1, bradykardia | ||
Verisuonisto | |||
Yleinen: | Korkea verenpaine, imunesteturvotus, punastuminen, kuumat aallot | Matala verenpaine, korkea verenpaine | Matala verenpaine, korkea verenpaine |
Melko harvinainen: | Matala verenpaine, ortostaattinen matala verenpaine, perifeerinen kylmyys | Punastuminen | Punastuminen |
Harvinainen: | Tromboosi | ||
Hengityselimet, rintakehä ja välikarsina | |||
Hyvin yleinen: | Hengenahdistus, nenäverenvuoto, yskä | Hengenahdistus | |
Yleinen: | Interstitiaalinen pneumoniitti2, hengenahdistus, nenäverenvuoto, nielun ja kurkunpään kipu, yskä, nuha, nenän vuotaminen | Pneumoniitti, nenän tukkoisuus | Veriyskä, nenäverenvuoto, yskä |
Melko harvinainen: | Keuhkoveritulppa, keuhkotromboembolia, pleuraeffuusio, rasitushengenahdistus, sivuonteloiden limakalvoturvotus, hiljentyneet hengitysäänet, limainen yskä, allerginen nuha, käheys, nenän tukkoisuus, nenän kuivuus, hengityksen vinkuminen | Kurkun kuivuus, nenän kuivuus | Pneumoniitti |
Tuntematon: | Äänihuulipareesi1 | ||
Ruoansulatuselimistö | |||
Hyvin yleinen: | Ripuli, oksentelu, huonovointisuus, ummetus, stomatiitti | Ripuli, oksentelu, huonovointisuus, ummetus, vatsakipu, ylävatsan kipu | Ripuli, oksentelu, huonovointisuus, ummetus |
Yleinen: | Gastroesofageaalinen refluksisairaus, dyspepsia, vatsakipu, vatsan pingottuminen, ylävatsakipu, oraalinen hypestesia | Suolitukos, koliitti, stomatiitti, suun kuivuus | Stomatiitti, dyspepsia, dysfagia, vatsakipu |
Melko harvinainen: | Peräsuoliverenvuoto, dysfagia, ilmavaivat, kielikipu, suun kuivuus, ikenien kipu, löysä uloste, esofagiitti, alavatsan kipu, suuhaavat, suukipu | ||
Maksa ja sappi | |||
Yleinen: | Kolangiitti | Hyperbilirubinemia | |
Melko harvinainen: | Hepatomegalia | ||
Iho ja ihonalainen kudos | |||
Hyvin yleinen: | Karvakato, ihottuma | Karvakato, ihottuma | Karvakato, ihottuma |
Yleinen: | Kutina, kuivaihoisuus, kynsimuutokset, eryteema, kynsien värjääntyminen, ihon hyperpigmentaatio, kynsien irtoaminen, kynsien muutokset | Kutina, kuivaihoisuus, kynsimuutokset | Kutina, kynsimuutokset |
Melko harvinainen: | Valoherkkyysreaktiot, urtikaria, ihokipu, yleinen kutina, kutiava ihottuma, ihohäiriöt, pigmentaatiohäiriö, hyperhidroosi, onykomadeesi, erytematoottinen ihottuma, yleisihottuma, dermatiitti, yöhikoilu, makulo-papulaarinen ihottuma, valkopälvisyys, hypotrikoosi, kynsipedin arkuus, kynsimuutokset, makulaarinen ihottuma, näppyläinen ihottuma, iholeesio, kasvojen turvotus | Ihon hilseily, allerginen dermatiitti, urtikaria | |
Erittäin harvinainen: | Stevens-Johnsonin oireyhtymä1, toksinen epidermaalinen nekrolyysi1 | ||
Tuntematon: | Käsi-jalkaoireyhtymä1, 4, skleroderma1 | ||
Luusto, lihakset ja sidekudos | |||
Hyvin yleinen: | Artralgia, myalgia | Artralgia, myalgia, raajakipu | Artralgia, myalgia |
Yleinen: | Selkäkipu, raajakipu, luukipu, lihaskouristukset, jäsenkipu | Lihasheikkous, luukipu | Selkäkipu, raajakipu, muskuloskeletaalinen kipu |
Melko harvinainen: | Rintakehäkipu, lihasheikkous, niskakipu, nivuskipu, lihaskouristukset, muskuloskeletaalinen kipu, kylkikipu, raajavaivat, lihasheikkous | ||
Munuaiset ja virtsatiet | |||
Yleinen: | Akuutti munuaisten vajaatoiminta | ||
Melko harvinainen: | Hematuria, dysuria, pollakisuria, nokturia, runsasvirtsaisuus, virtsankarkailu | Hemolyyttis-ureeminen oireyhtymä | |
Sukupuolielimet ja rinnat | |||
Melko harvinainen: | Rintakipu | ||
Yleisoireet ja antopaikassa todettavat haitat | |||
Hyvin yleinen: | Väsymys, astenia, pyreksia | Väsymys, astenia, pyreksia, perifeerinen ödeema, vilunpuistatukset | Väsymys, astenia, perifeerinen ödeema |
Yleinen: | Huonovointisuus, heikkous, perifeerinen ödeema, limakalvotulehdus, kipu, vilunpuistatukset, ödeema, alentunut suorituskyky, rintakipu, influenssan tapainen sairaus, hyperpyreksia | Injektiopaikan reaktiot | Pyreksia, rintakipu |
Melko harvinainen: | Rintavaivat, kävelyhäiriöt, turvotus, injektiopaikan reaktiot | Limakalvotulehdus, infuusiopaikan ekstravasaatio, infuusiopaikan tulehdus, infuusiopaikan ihottuma | |
Harvinainen: | Ekstravasaatio | ||
Tutkimukset | |||
Hyvin yleinen: | Painon lasku, lisääntynyt alaniiniaminotransferaasi | ||
Yleinen: | Painon lasku, lisääntynyt alaniiniaminotransferaasi, lisääntynyt aspartaattiaminotransferaasi, alentunut hematokriitti, alentunut veren punasolumäärä, kehon lämpötilan nousu, lisääntynyt gammaglutamyylitransferaasi, lisääntynyt veren alkaliinifosfataasi | Lisääntynyt aspartaattiaminotransferaasi, kohonnut veren bilirubiiniarvo, kohonnut veren kreatiniini | Painon lasku, lisääntynyt alaniiniaminotransferaasi, lisääntynyt aspartaattiaminotransferaasi, lisääntynyt veren alkaliinifosfataasi |
Melko harvinainen: | Kohonnut verenpaine, painonnousu, kohonnut veren laktaattidehydrogenaasi, kohonnut veren kreatiniinitaso, kohonnut veren glukoositaso, kohonnut veren fosforitaso, laskenut veren kaliumtaso, kohonnut bilirubiiniarvo | ||
Vammat, myrkytykset ja hoitokomplikaatiot | |||
Melko harvinainen: | Ruhjevamma | ||
Harvinainen: | Säteilyreaktion uusiutuminen (radiation recall), säteilypneumoniitti | ||
1 Kuten Abraxane-valmisteen markkinoille tulon jälkeisen seurannan aikana on raportoitu.
2 Pneumoniitin esiintymistiheys on laskettu 1 310 potilaan yhdistetyistä tiedoista kliinisissä tutkimuksissa, joissa potilaille annettiin Abraxane-valmistetta monoterapiana rintasyövän hoitoon ja muihin käyttöaiheisiin.
3 Perustuu laboratorioarviointeihin: myelosuppression enimmäisaste (hoidettu väestö).
4 Joillain potilailla, jotka ovat aiemmin altistuneet kapesitabiinille.
Valikoitujen haittavaikutusten kuvaus
Tämä kohta sisältää yleisimmät ja kliinisesti merkitykselliset Abraxane-hoitoon liittyvät haittavaikutukset
Haittavaikutuksia arvioitiin 229_llä metastaattista rintasyöpää sairastavalla potilaalla, joille annettiin keskeisessä faasin III kliinisessä tutkimuksessa 260 mg/m2 Abraxane-valmistetta kolmen viikon välein (Abraxane-monoterapia).
Haittavaikutuksia arvioitiin 421:llä metastaattista haimasyöpää sairastavalla potilaalla, jotka saivat Abraxane-valmistetta yhdistelmänä gemsitabiinin kanssa (125 mg/m2 Abraxane-valmistetta yhdistelmänä gemsitabiiniannosten 1 000 mg/m2 kanssa kunkin 28 vuorokauden pituisen hoitosyklin päivinä 1, 8 ja 15) ja 402 potilaalla, jotka saivat gemsitabiinia monoterapiana ensilinjan systeemisenä hoitona metastaattiseen haiman adenokarsinoomaan. (Abraxane/gemsitabiini).
Haittavaikutuksia arvioitiin 514:llä ei-pienisoluista keuhkosyöpää sairastavalla potilaalla, joita hoidettiin Abraxane-valmisteella yhdistelmänä karboplatiinin kanssa (100 mg/m2 Abraxane‑valmistetta kunkin 21 vuorokauden pituisen hoitosyklin päivinä 1, 8 ja 15 yhdistelmänä kunkin hoitosyklin päivänä 1 annetun karboplatiinin kanssa) faasin III satunnaistetussa, kontrolloidussa kliinisessä tutkimuksessa (Abraxane/karboplatiini). Potilaiden raportoimaa taksaanin aiheuttamaa toksisuutta arvioitiin käyttämällä taksaaneja koskevan FACT-kyselyn (Functional Assessment of Cancer Therapy - Taxane) neljää ala-asteikkoa. Toistuvien mittausten analyysissa Abraxane-valmisteen ja karboplatiinin tulokset olivat paremmat kolmessa ala-asteikossa neljästä (perifeerinen neuropatia, käsien/jalkojen kipu ja kuulo) (p ≤ 0,002). Neljännessä asteikossa (ödeema) hoitoryhmien välillä ei ollut eroa.
Infektiot
Abraxane/gemsitabiini
Sepsistä raportoitiin 5 %:lla sekä neutropeniaa sairastavista että sairastamattomista potilaista, jotka saivat Abraxane-valmistetta yhdistelmänä gemsitabiinin kanssa haiman adenokarsinoomaa koskevan tutkimuksen aikana. 22 tapauksesta, joissa sepsistä raportoitiin Abraxane‑valmisteen ja gemsitabiinin yhdistelmällä hoidetuilla potilailla, 5 johti kuolemaan. Perussairautena sairastettavasta haimasyövästä aiheutuneet komplikaatiot, erityisesti sappitietukos tai sappitiestentti, tunnistettiin merkittäviksi edistäviksi tekijöiksi. Jos potilaalle ilmaantuu kuumetta (neutrofiilimäärästä riippumatta), aloita hoito laajakirjoisilla antibiooteilla. Älä anna kuumeisen neutropenian yhteydessä Abraxane-valmistetta ja gemsitabiinia ennen kuin kuume häviää ja absoluuttinen neutrofiilimäärä on ≥ 1 500 solua/mm3. Jatka hoitoa sitten pienemmällä annostasolla (ks. kohta Annostus ja antotapa).
Veri ja imukudos
Abraxane-monoterapia – metastaattinen rintasyöpä
Neutropenia oli merkittävin hematologinen haittavaikutus potilailla, joilla oli metastaattinen rintasyöpä (raportoitu 79 %:lla potilaista). Se oli nopeasti korjaantuva ja annoksesta riippuvainen. Leukopeniaa raportoitiin 71 %:lla potilaista. Asteen 4 neutropeniaa (< 500 solua/mm3) esiintyi 9 %:lla potilaista, joita oli hoidettu Abraxane-valmisteella. Kuumeista neutropeniaa esiintyi neljällä Abraxane-valmistetta käyttäneellä potilaalla. Anemiaa (Hb < 100 g/l) havaittiin 46 %:lla Abraxane-valmistetta käyttäneistä potilaista, ja anemia oli kolmessa tapauksessa vaikea (Hb < 80 g/l). Lymfopeniaa esiintyi 45 %:lla potilaista.
Abraxane/gemsitabiini
Taulukossa 7 on esitetty laboratoriokokeissa havaittujen hematologisten poikkeavuuksien esiintyvyys ja vaikeusaste potilailla, joita hoidettiin Abraxane-valmisteen ja gemsitabiinin yhdistelmällä tai pelkästään gemsitabiinilla.
Taulukko 7. Laboratoriokokeissa havaitut hematologiset poikkeavuudet haiman adenokarsinoomaa koskevassa tutkimuksessa
Abraxane (125 mg/m2) / gemsitabiini | Gemsitabiini | |||
Aste 1–4 (%) | Aste 3–4 (%) | Aste 1–4 (%) | Aste 3–4 (%) | |
Anemiaa,b | 97 | 13 | 96 | 12 |
Neutropenia a,b | 73 | 38 | 58 | 27 |
Trombosytopeniab,c | 74 | 13 | 70 | 9 |
a 405 potilasta, jotka arvioitiin Abraxane-/gemsitabiinihoitoa saaneessa ryhmässä
b 388 potilasta, jotka arvioitiin gemsitabiinihoitoa saaneessa ryhmässä
c 404 potilasta, jotka arvioitiin Abraxane-/gemsitabiinihoitoa saaneessa ryhmässä
Abraxane/karboplatiini
Anemiaa ja trombosytopeniaa raportoitiin yleisemmin Abraxane- ja karboplatiiniryhmässä kuin Taxol- ja karboplatiiniryhmässä (54 % vs. 28 % ja 45 % vs. 27 %).
Hermosto
Abraxane-monoterapia – metastaattinen rintasyöpä
Neurotoksisuuden esiintymistiheys ja vaikeusaste olivat Abraxane-valmistetta saaneilla potilailla yleensä annoksesta riippuvaisia. Perifeerinen neuropatia (useimmiten asteen 1 tai 2 sensorinen neuropatia) havaittiin 68 %:lla potilaista, joita oli hoidettu Abraxane-valmisteella, ja näistä 10 %:lla oli asteen 3 neuropatiaa. Yhtään asteen 4 neuropatiatapausta ei ollut.
Abraxane/gemsitabiini
Abraxane-hoitoa yhdistelmänä gemsitabiinin kanssa saaneilla potilailla mediaaniaika asteen 3 perifeerisen neuropatian ensimmäiseen ilmaantumiseen oli 140 vuorokautta. Mediaaniaika siihen, että tila parani vähintään 1 asteen, oli 21 vuorokautta, ja mediaaniaika siihen, että tila parani asteen 3 perifeerisestä neuropatiasta asteeseen 0 tai 1, oli 29 vuorokautta. Niistä potilaista, joiden hoito keskeytettiin perifeerisen neuropatian vuoksi, 44 % (31/70 potilasta) kykeni jatkamaan Abraxane-hoitoa pienemmällä annoksella. Yhdelläkään Abraxane-valmistetta yhdistelmänä gemsitabiinin kanssa saaneella potilaalla ei ollut asteen 4 perifeeristä neuropatiaa.
Abraxane/karboplatiini
Abraxane-hoitoa yhdistelmänä karboplatiinin kanssa saaneilla ei-pienisoluista keuhkosyöpää sairastavilla potilailla ajan mediaani hoitoon liittyvän asteen 3 perifeerisen neuropatian ensimmäiseen ilmaantumiskertaan oli 121 vuorokautta. Ajan mediaani siihen, että hoitoon liittyvä asteen 3 perifeerinen neuropatia parani asteeseen 1, oli 38 vuorokautta. Yhdelläkään Abraxane-valmistetta yhdistelmänä karboplatiinin kanssa saaneista potilaista ei esiintynyt asteen 4 perifeeristä neuropatiaa.
Silmät
Rakkulaisesta makulaturvotuksesta johtuvaa näöntarkkuuden heikkenemistä on raportoitu markkinoilletulon jälkeisessä seurannassa harvoin Abraxane-hoidon aikana (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Hengityselimet, rintakehä ja välikarsina
Abraxane/gemsitabiini
Pneumoniittia on raportoitu 4 %:lla potilaista, kun Abraxane-valmistetta käytettiin yhdistelmänä gemsitabiinin kanssa. Niistä 17 pneumoniittitapauksesta, jotka ilmoitettiin Abraxane-valmistetta yhdistelmänä gemsitabiinin kanssa saaneilla potilailla, kaksi johti potilaan kuolemaan. Potilaita on tarkkailtava huolellisesti pneumoniitin oireiden ja löydösten havaitsemiseksi. Kun on varmistettu, että taudin syy ei ole infektio ja taudiksi varmistuu pneumoniitti, lopeta Abraxane- ja gemsitabiinihoito pysyvästi ja aloita asianmukainen hoito sekä tukitoimenpiteet välittömästi (ks. kohta Annostus ja antotapa).
Ruoansulatuselimistö
Abraxane-monoterapia – metastaattinen rintasyöpä
Pahoinvointia esiintyi 29 %:lla ja ripulia 25 %:lla potilaista.
Iho ja ihonalainen kudos
Abraxane-monoterapia – metastaattinen rintasyöpä
Alopesiaa havaittiin > 80 %:lla potilaista, joita oli hoidettu Abraxane-valmisteella. Suurin osa alopesiatapauksista esiintyi alle yhden kuukauden kuluessa Abraxane-hoidon aloittamisesta. Suurimmalla osalla potilaista, joilla alopesiaa esiintyy, on odotettavissa merkittävää, yli 50 %:n, hiustenlähtöä.
Luusto, lihakset ja sidekudos
Abraxane-monoterapia – metastaattinen rintasyöpä
Nivelkipua esiintyi 32 %:lla potilaista, joita oli hoidettu Abraxane-valmisteella, ja 6 %:lla tapauksista nivelkipu oli vaikea-asteista. Lihaskipua esiintyi 24 %:lla potilaista, joita oli hoidettu Abraxane-valmisteella, ja 7 %:ssa tapauksista lihaskipu oli vaikea-asteista. Oireet olivat yleensä ohimeneviä. Tyypillisesti niitä esiintyi kolmena päivänä Abraxane-hoidon jälkeen, ja ne hävisivät viikon sisällä.
Yleisoireet ja antopaikassa todettavat haitat
Abraxane-monoterapia – metastaattinen rintasyöpä
Asteniaa/väsymystä raportoitiin 40 %:lla potilaista.
Pediatriset potilaat
Tutkimus koostui 106 potilaasta, joista 104 oli pediatrisia potilaita (ikä 6 kk – 17 vuotta) (katso kohta Farmakodynamiikka). Kaikilla potilailla havaittiin vähintään yksi haittavaikutus. Yleisimpiä ilmoitettuja haittavaikutuksia olivat neutropenia, anemia, leukopenia ja pyreksia. Useammalla kuin kahdella potilaalla ilmoitettuja vakavia haittavaikutuksia olivat pyreksia, selkäkipu, perifeerinen ödeema ja oksentelu. Abraxane-valmisteella hoidetuilla potilailla ei havai ttu uusia turvallisuu teen liittyviä signaaleja tässä kooltaan rajallisessa pediatristen potilaiden ryhmässä. Lääkkeen turvallisuusprofiili oli samankaltainen kuin aikuisväestöllä.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty‑haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista
seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Paklitakselin yliannostukseen ei tunneta vasta-ainetta. Yliannostustapauksessa potilasta tulee tarkkailla tiiviisti. Hoito tulee kohdistaa eniten odotettavissa oleviin toksisiin vaikutuksiin eli luuydinsuppressioon, mukosiittiin ja perifeeriseen neuropatiaan.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Solunsalpaajat, kasvialkaloidit ja muut luonnontuotteet, taksaanit, ATC-koodi: L01CD01
Vaikutusmekanismi
Paklitakseli on antimikrotubulusaine, joka edistää mikrotubulusten yhdistymistä tubuliinidimeereistä ja stabiloi mikrotubuluksia estämällä depolymerisaatiota. Tämä stabiloituminen estää mikrotubulusverkoston normaalin dynaamisen uudelleenjärjestymisen, mikä on olennaista solujen elintärkeissä interfaasi- ja mitoositoiminnoissa. Lisäksi paklitakseli aiheuttaa epänormaalien mikrotubulusryhmien tai ”-kimppujen” muodostumista koko solusyklin ajan ja useiden mikrotubulushaarojen syntymistä mitoosin aikana.
Abraxane sisältää ihmisseerumin albumiini-paklitakseli –nanopartikkeleita kooltaan noin 130 nm, joissa paklitakseli esiintyy kiteytymättömässä, rakenteettomassa muodossa. Annettaessa laskimoon nanopartikkelit hajoavat nopeasti liukeneviksi albumiiniin sidotuiksi paklitakseliyhdisteiksi kooltaan noin 10 nm. Albumiinin tiedetään toimivan välittäjänä plasmaosien endoteelisessa kaveolaarisessa transsytoosissa, ja in vitro -tutkimukset ovat osoittaneet, että Abraxane-valmisteen sisältämä albumiini lisää paklitakselin kulkeutumista endoteelisolujen läpi. On oletettu, että tässä lisääntyneessä kaveolaarisessa transendoteelikulkeutumisessa välittäjänä on gp‑60 albumiinireseptori ja että paklitakselin lisääntynyt kerääntyminen tuumorin alueella johtuu albumiiniin sidotusta SPARC-proteiinista (secreted protein acidic rich in cysteine).
Kliininen teho ja turvallisuus
Rintasyöpä
Kahdessa yhden hoitoryhmän avoimessa tutkimuksessa kerätyt tiedot 106 potilaasta sekä satunnaistetussa faasin III vertailevassa tutkimuksessa saadut tiedot 454 potilaasta tukevat Abraxane-valmisteen käyttöä metastaattisessa rintasyövässä. Tämä tutkimustieto esitetään seuraavassa:
Yhden hoitohaaran avoimet tutkimukset
Yhdessä tutkimuksessa Abraxane-valmistetta annettiin 175 mg/m2 suuruisena annoksena 30 minuutin infuusiona 43 potilaalle, joilla oli metastaattinen rintasyöpä. Toisessa tutkimuksessa käytettiin 300 mg/m2 annostusta 30 minuutin infuusiona 63 potilaalle, jotka sairastivat metastaattista rintasyöpää. Potilaita hoidettiin ilman steroidiesilääkitystä tai suunniteltua G‑CSF-tukea. Hoitojaksojen väli oli kolme viikkoa. Vasteluvut olivat kaikilla potilailla 39,5 % (95 % CI: 24,9 % ‑ 54,2 %) ensimmäisessä ryhmässä ja 47,6 % (95 % CI: 35,3 % ‑ 60,0 %) toisessa ryhmässä. Taudin etenemisajan mediaani oli 5,3 kuukautta (175 mg/m2; 95 % luottamusväli: 4,6 – 6,2 kuukautta) ja 6,1 kuukautta (300 mg/m2; 95 % luottamusväli: 4,2 – 9,8 kuukautta).
Satunnaistettu vertaileva tutkimus
Tämä monikeskustutkimus toteutettiin potilailla, joilla oli metastaattinen rintasyöpä ja joille annettiin joka kolmas viikko paklitakselia ainoana lääkkeenä, joko liuotinpohjaisena paklitakselina 175 mg/m2 annoksella kolmen tunnin infuusiona, jolloin annettiin esilääkitystä yliherkkyysreaktioiden estoon (N = 225), tai Abraxane-valmistetta 260 mg/m2 annoksena 30 minuutin infuusiona ilman esilääkitystä (N = 229).
Potilaista 64 %:lla oli tutkimuksen alkaessa heikentynyt suorituskyky (ECOG 1 tai 2); 79 %:lla oli viskeraalisia metastaaseja ja 76 %:lla oli > 3 metastaasin esiintymispaikkaa. Potilaista 14 % ei ollut saanut aikaisemmin solunsalpaajahoitoa, 27 % oli saanut solunsalpaajahoitoa vain liitännäishoitona, 40 % vain metastaattisien yhteydessä ja 19 % sekä metastaaseihin että liitännäishoitona. Potilaista 59 % sai tutkimuslääkettä toisen linjan hoitona tai myöhemmin kuin toisen linjan hoitona. Potilaista 77 % oli saanut aikaisemmin antrasykliinejä.
Kokonaisvaste (ORR) ja aika taudin etenemiseen sekä aika ilman taudin etenemistä potilailla (PFS), jotka saivat myöhempää kuin ensilinjan hoitoa, esitetään seuraavassa.
Taulukko 8. Kokonaisvaste, taudin etenemiseen kuluneen ajan mediaani ja aika ilman taudin etenemistä tutkijan arvioimana
Tehomuuttuja | Abraxane (260 mg/m2) | Liuotinpohjainen paklitakseli (175 mg/m2) | p‑arvo | |
Vasteluku [95 % CI] (%) | ||||
Myöhempi kuin ensilinjan hoito | 26,5 [18,98; 34,05] (n = 132) | 13,2 [7,54; 18,93] (n = 136) | 0,006a | |
*Taudin etenemiseen kuluneen ajan mediaani[95 % CI] (viikkoina) | ||||
> Myöhemmin kuin ensilinjan hoito | 20,9 [15,7; 25,9] (n = 131) | 16,1 [15,0; 19,3] (n = 135) | 0,011b | |
* Ilman taudin etenemistä kuluneen ajan mediaani [95 % luottamusväli] (viikkoina) | ||||
Myöhempi kuin ensilinjan hoito | 20,6 [15,6; 25,9] (n = 131) | 16,1 [15,0; 18,3] (n = 135) | 0,010b | |
*Eloonjääminen [95 % CI] (viikkoina) | ||||
Myöhempi kuin ensilinjan hoito | 56,4 [45,1; 76,9] (n = 131) | 46,7 [39,0; 55,3] (n = 136) | 0,020b | |
*Tämä tieto perustuu kliinisen tutkimuksen raporttiin: CA012‑0. Liite päivätty lopullisena (23.3.2005)
a Khi‑neliötesti
b Log‑rank-testi
Kaksisataakaksikymmentäyhdeksän potilasta, jotka saivat Abraxane-hoitoa satunnaistetussa, vertailevassa kliinisessä kokeessa, arvioitiin turvallisuuden osalta. Paklitakselin neurotoksisuus arvioitiin yhden asteen parantumisen perusteella potilailla, joilla ilmeni 3. asteen perifeeristä neuropatiaa hoidon aikana. Perifeerisen neuropatian luonnollista normalisoitumista lähtötasolle Abraxane-valmisteen kumulatiivisen toksisuuden vuoksi >6 hoitokuurin jälkeen ei arvioitu ja on edelleen selvittämättä.
Haiman adenokarsinooma
Monikansallinen, satunnaistettu, avoin monikeskustutkimus, johon osallistui 861 potilasta, tehtiin Abraxane-valmisteen/gemsitabiinin yhdistelmäkäytön vertaamiseksi gemsitabiinimonoterapiaan ensilinjan hoitona potilaille, joilla oli metastaattinen haiman adenokarsinooma. Abraxane-valmistetta annettiin potilaille (N = 431) 30–40 minuutin kestoisena infuusiona laskimoon annoksella 125 mg/m2, jonka jälkeen annettiin gemsitabiinia 30–40 minuutin kestoisena infuusiona laskimoon annoksella 1 000 mg/m2 kunkin 28 vuorokauden pituisen hoitosyklin päivinä 1, 8 ja 15. Vertailuryhmässä potilaille (N = 430) annettiin gemsitabiinimonoterapiaa suositetun annoksen ja hoito-ohjelman mukaisesti. Hoitoa annettiin niin kauan kunnes sairaus eteni tai kehittyi haittaavaa toksisuutta. Niistä haiman adenokarsinoomaa sairastavista 431 potilaasta, jotka satunnaistettiin saamaan Abraxane-valmistetta yhdistelmähoitona gemsitabiinin kanssa, suurin osa (93 %) oli valkoihoisia, 4 % oli mustaihoisia ja 2 % oli aasialaisia. Kuudellatoista prosentilla (16 %) Karnofskyn suorituskykypisteet (KPS) olivat 100; 42 %:lla KPS oli 90, 35 %:lla KPS oli 80, 7 %:lla KPS oli 70 ja alle 1 %:lla potilaista KPS oli alle 70. Tutkimukseen ei otettu mukaan potilaita, joilla oli suuri kardiovaskulaarinen riski, aikaisempi perifeerinen valtimosairaus ja/tai sidekudossairauksia ja/tai interstitiaalinen keuhkosairaus.
Potilaiden hoitoajan mediaani oli Abraxane/gemsitabiiniryhmässä 3,9 kuukautta ja gemsitabiiniryhmässä 2,8 kuukautta. Abraxane/gemsitabiiniryhmän potilaista 32 % verrattuna 15 %:iin gemsitabiiniryhmän potilaista sai hoitoa vähintään 6 kuukauden ajan. Hoitoa saaneessa potilasjoukossa gemsitabiinin suhteellisen annosintensiteetin mediaani oli Abraxane/gemsitabiiniryhmässä 75 % ja gemsitabiiniryhmässä 85 %. Abraxane-valmisteen suhteellisen annosintensiteetin mediaani oli 81 %. Gemsitabiinin suurempi kumulatiivinen mediaaniannos annettiin Abraxane/gemsitabiiniryhmässä (11 400 mg/m2) verrattuna gemsitabiiniryhmään (9 000 mg/m2).
Tehon ensisijainen päätetapahtuma oli kokonaiseloonjäänti (OS). Tärkeimmät toissijaiset päätetapahtumat olivat aika ilman taudin etenemistä (PFS) ja kokonaisvaste (ORR), joista kumpikin arvioitiin riippumattoman, keskitetyn, sokkoutetun radiologisen tarkistuksen avulla käyttämällä RECIST-ohjeistoa (versio 1.0).
Taulukko 9. Tehon tulokset haiman adenokarsinoomaa sairastavilla potilailla tehdystä satunnaistetusta tutkimuksesta (hoitoaikeen mukainen (ITT) potilasjoukko)
Abraxane (125 mg/m2) / gemsitabiini (N = 431) | Gemsitabiini (N = 430) | |
Kokonaiseloonjäänti | ||
Kuolleiden lukumäärä (%) | 333 (77) | 359 (83) |
Kokonaiseloonjäännin mediaani kuukausina (95 % CI) | 8,5 (7,89; 9,53) | 6,7 (6,01; 7,23) |
Riskisuhde (HR)A+G/G (95 % CI)a | 0,72 (0,617; 0,835) | |
P-arvob | < 0,0001 | |
Eloonjääntiluku % (95 % CI) | ||
1 vuoden kuluttua | 35 % (29,7; 39,5) | 22 % (18,1; 26,7) |
2 vuoden kuluttua | 9 % (6,2; 13,1) | 4 % (2,3; 7,2) |
Kokonaiseloonjäännin 75. persentiili (kk) | 14,8 | 11,4 |
Aika ilman taudin etenemistä (PFS) | ||
Kuolema tai taudin eteneminen, n (%) | 277 (64) | 265 (62) |
Mediaaniaika ilman taudin etenemistä kuukausina (95 % CI) | 5,5 (4,47; 5,95) | 3,7 (3,61; 4,04) |
Riskisuhde (HR)A+G/G (95 % CI)a | 0,69 (0,581; 0,821) | |
P-arvob | < 0,0001 | |
Kokonaisvaste | ||
Varmistettu täydellinen tai osittainen kokonaisvaste, n (%) | 99 (23) | 31 (7) |
95 % CI | 19,1; 27,2 | 5,0; 10,1 |
pA+G/pG (95 % CI) | 3,19 (2,178; 4,662) | |
P-arvo (khi-neliötesti) | < 0,0001 | |
CI = luottamusväli, HRA+G/G = Abraxane+gemsitabiinin/gemsitabiinin riskisuhde, pA+G/pG = Abraxane+gemsitabiinin/gemsitabiinin vasteluvun suhde
a ositettu Coxin suhteellisen riskin malli
b ositettu log-rank-testi, ositettu maantieteellisen alueen (Pohjois-Amerikka vs. muut), KPS:n (70–80 vs. 90–100) ja maksametastaasien esiintymisen (kyllä vs. ei) suhteen.
Kokonaiseloonjäännissä todettiin tilastollisesti merkitsevää paranemista Abraxane-valmisteen ja gemsitabiinin yhdistelmää saaneilla verrattuna pelkästään gemsitabiinia saaneisiin, kun kokonaiseloonjäännin mediaani piteni 1,8 kuukaudella, kuoleman kokonaisriski väheni 28 %, 1 vuoden eloonjääntiluku parani 59 % ja 2 vuoden eloonjääntiluku parani 125 %.
Kuvio 1. Kokonaiseloonjäännin Kaplan–Meier-käyrä (hoitoaikeen mukainen (ITT) potilasjoukko)
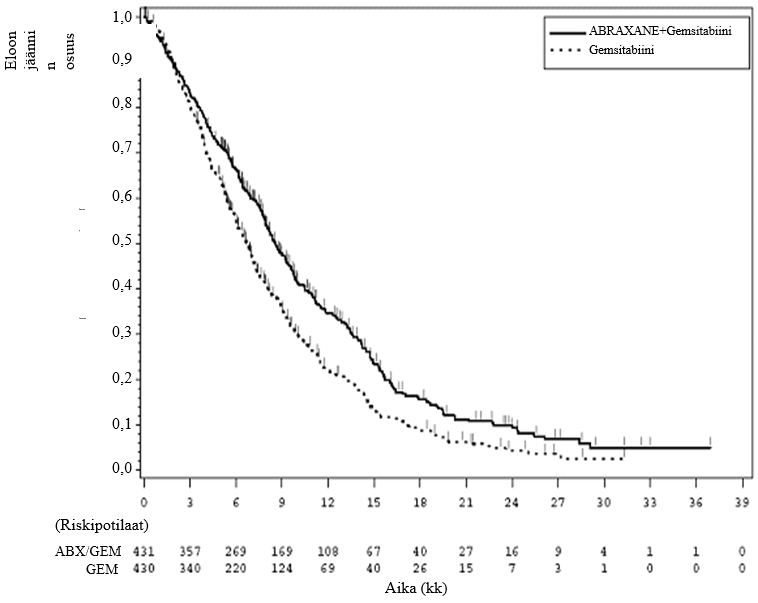
Hoidon vaikutus kokonaiseloonjääntiin oli parempi Abraxane/gemsitabiiniryhmässä useimmissa ennalta määritellyissä alaryhmissä (mukaan lukien sukupuoli, Karnofskyn suorituskykypisteet (KPS), maantieteellinen alue, haimasyövän ensisijainen sijainti, syövän levinneisyys diagnoosivaiheessa, maksametastaasien esiintyminen, peritoneaalisen karsinomatoosin esiintyminen, aiemmin tehty Whipplen leikkaus, sappitiestentti lähtötilanteessa, keuhkometastaasien esiintyminen ja metastaasipaikkojen lukumäärä). Abraxane/gemsitabiini- ja gemsitabiiniryhmien vähintään 75-vuotiaiden potilaiden eloonjäännin riskisuhde (HR) oli 1,08 (95 % CI 0,653; 1,797). Potilailla, joiden CA19-9-merkkiainepitoisuus seerumissa oli lähtötilanteessa normaali, eloonjäännin riskisuhde oli 1,07 (95 % CI 0,692; 1,661).
Abraxane/gemsitabiiniryhmän ajassa ilman taudin etenemistä (PFS) todettiin tilastollisesti merkitsevä paraneminen pelkkää gemsitabiinia saaneeseen ryhmään verrattuna, kun PFS:n mediaani piteni 1,8 kuukautta.
Ei-pienisoluinen keuhkosyöpä
Satunnaistettu, avoin monikeskustutkimus tehtiin 1052 levinneisyysasteen IIIb/IV ei-pienisoluista keuhkosyöpää sairastavalla potilaalla, jotka eivät olleet aiemmin saaneet solunsalpaajahoitoa. Tutkimuksessa verrattiin Abraxane-valmisteen ja karboplatiinin yhdistelmää liuotinpohjaisen paklitakselin ja karboplatiinin yhdistelmään ensilinjan hoitona pitkälle edennyttä ei-pienisoluista keuhkosyöpää sairastavilla potilailla. Yli 99 %:lla potilaista ECOG (Eastern Cooperative Oncology Group) -asteikon mukainen suorituskyky oli 0 tai 1. Tutkimukseen ei otettu mukaan potilaita, joilla oli ennestään asteen ≥ 2 neuropatia tai tärkeisiin elinjärjestelmiin liittyviä vakavia lääketieteellisiä riskitekijöitä. Abraxane-valmistetta annettiin potilaille (N = 521) 30 minuutin kestoisena infuusiona laskimoon annoksena 100 mg/m2 kunkin 21 vuorokauden pituisen hoitosyklin päivinä 1, 8 ja 15 ilman steroidiesilääkitystä ja ilman profylaktista hoitoa granulosyyttiryhmiä stimuloivilla kasvutekijöillä. Karboplatiinia annettiin laskimoon annoksena AUC = 6 mg•min/ml välittömästi Abraxane-valmisteen annon päätyttyä kunkin 21 vuorokauden pituisen hoitosyklin päivänä 1. Liuotinpohjaista paklitakselia annettiin potilaille (N = 531) 200 mg/m2:n annoksena 3 tunnin kestoisena infuusiona laskimoon yhdessä tavanomaisen esilääkityksen kanssa, minkä jälkeen heille annettiin välittömästi karboplatiinia laskimoon annoksena AUC = 6 mg•min/ml. Jokaista lääkettä annettiin kunkin 21 vuorokauden pituisen hoitosyklin päivänä 1. Kummassakin tutkimusryhmässä annettiin hoitoa niin kauan kunnes sairaus eteni tai kehittyi haittaavaa toksisuutta. Potilaiden saamien hoitosyklien mediaani oli kummassakin tutkimusryhmässä 6 sykliä.
Tehon ensisijainen päätetapahtuma oli kokonaisvaste, joka määriteltiin niiden potilaiden prosenttiosuutena, jotka saavuttivat objektiivisen, varmistetun täydellisen vasteen tai osittaisen vasteen, joka perustui riippumattomaan, keskitettyyn, sokkoutettuun RECIST-ohjeiston (versio 1.0) mukaisesti tehtyyn radiologiseen arvioon. Kokonaisvaste oli Abraxane/karboplatiini-ryhmän potilailla merkitsevästi parempi verrattuna vertailuryhmän potilaisiin: 33 % vs. 25 %, p = 0,005 (taulukko 10).
Kokonaisvasteessa oli merkitsevä ero Abraxane-/karboplatiiniryhmän ja verrokkiryhmän potilaiden välillä, kun potilailla oli histologialtaan levyepiteeliperäinen ei-pienisoluinen keuhkosyöpä (N = 450, 41 % vs. 24 %, p < 0,001), mutta tällaista eroa ei ollut nähtävissä ajassa ilman taudin etenemistä (PFS) eikä kokonaiseloonjäännissä (OS). Kokonaisvasteessa ei ollut eroa hoitoryhmien välillä, kun potilaiden tauti ei ollut histologialtaan levyepiteeliperäinen (N = 602, 26 % vs. 25 %, p = 0,808).
Taulukko 10: Kokonaisvaste ei-pienisoluista keuhkosyöpää koskevassa satunnaistetussa tutkimuksessa (hoitoaikeen mukainen (ITT) potilasjoukko)
Tehomuuttuja | Abraxane (100 mg/m2/viikko) + karboplatiini (N = 521) | Liuotinpohjainen paklitakseli (200 mg/m2 joka 3. viikko) + karboplatiini (N = 531) |
Kokonaisvaste (riippumaton arvio) | ||
Varmistettu täydellinen tai osittainen kokonaisvaste, n (%) | 170 (33 %) | 132 (25 %) |
95 % CI (%) | 28,6, 36,7 | 21,2, 28,5 |
pA/pT (95,1 % CI) | 1,313 (1,082, 1,593) | |
P‑arvoa | 0,005 | |
CI = luottamusväli, HRA/T = Abraxane-valmisteen/karboplatiinin ja liuotinpohjaisen paklitakselin/karboplatiinin riskisuhde,
pA/pT = Abraxane-valmisteen/karboplatiinin ja liuotinpohjaisen paklitakselin/karboplatiinin vastelukujen suhde.
a P‑arvo perustuu khi‑neliötestiin.
Ajassa ilman taudin etenemistä (PFS) (sokkoutettu radiologin arvio) ja kokonaiseloonjäännissä (OS) ei ollut näiden kahden hoitoryhmän välillä tilastollisesti merkitsevää eroa. Ajasta ilman taudin etenemistä ja kokonaiseloonjäännistä tehtiin vertailukelpoisuusanalyysi (non-inferiority-analyysi), jossa ennalta määritetty vertailukelpoisuusmarginaali oli 15 %. Vertailukelpoisuuskriteeri täyttyi sekä ajan ilman taudin etenemistä että kokonaiseloonjäännin osalta; näihin liittyvien riskisuhteiden 95 %:n luottamusvälin yläraja oli alle 1,176 (taulukko 11).
Taulukko 11: Vertailukelpoisuusanalyysit (non-inferiority) ajasta ennen taudinetenemistä ja kokonaiseloonjäännistä ei-pienisoluista keuhkosyöpää koskevassa satunnaistetussa tutkimuksessa (hoitoaikeen mukainen (ITT) potilasjoukko)
Tehomuuttuja | Abraxane (100 mg/m2/viikko) + karboplatiini (N = 521) | Liuotinpohjainen paklitakseli (200 mg/m2 joka 3. viikko) + karboplatiini (N = 531) |
Aika ilman taudin etenemistäa (riippumaton arvio) | ||
Kuolema tai taudin eteneminen, n (%) | 429 (82 %) | 442 (83 %) |
Ajan ilman taudin etenemistä mediaani (95 % CI) (kuukautta) | 6,8 (5,7, 7,7) | 6,5 (5,7, 6,9) |
HRA/T (95 %:n CI) | 0,949 (0,830, 1,086) | |
Kokonaiseloonjäänti | ||
Kuolleiden lukumäärä, n (%) | 360 (69 %) | 384 (72 %) |
Kokonaiseloonjäännin mediaani (95 % CI) (kuukautta) | 12,1 (10,8, 12,9) | 11,2 (10,3, 12,6) |
Riskisuhde (HRA/T) (95,1 % CI) | 0,922 (0,797, 1,066) | |
CI = luottamusväli, HRA/T = Abraxane-valmisteen/karboplatiinin ja liuotinpohjaisen paklitakselin/karboplatiinin riskisuhde,
pA/pT = Abraxane-valmisteen/karboplatiinin ja liuotinpohjaisen paklitakselin/karboplatiinin vastelukujen suhde.
a Ajan ilman taudin etenemistä käyttöä päätetapahtumana koskevien Euroopan lääkeviraston metodologisten ohjeiden mukaisesti puuttuvia havaintoja tai myöhemmin annetun uuden hoidon aloittamista ei käytetty sensurointiin.
Pediatriset potilaat
Turvallisuutta ja tehoa pediatristen potilaiden hoidossa ei ole varmistettu (katso kohta Annostus ja antotapa).
Tutkimuksessa ABI-007-PST-001, joka oli faasin 1/2 avoin monikeskustutkimus, arvioitiin viikottaisen Abraxane-annoksen turvallisuutta, siedettävyyttä ja alustavaa tehokkuutta pediatrisilla potilailla, joilla oli uusiutuneita tai vaikeahoitoisia kiinteitä kasvaimia. Tutkimuksessa oli yhteensä 106 potilaista, joiden ikä oli 6 kk – 24 vuotta.
Faasin 1 tutkimusosiossa, johon osallistui yhteensä 64 potilasta, joiden ikä oli 6 kk – 17 vuotta, suurimmaksi siedetyksi annokseksi (MTD) määritettiin 240 mg/m2 annettuna 30 minuutin infuusiona laskimoon kunkin 28 vuorokautta kestävän hoitosyklin päivinä 1, 8 ja 15.
Faasin 2 tutkimusosiossa oli yhteensä 42 potilasta, ja faasissa käytettiin Simonin kaksivaiheista minimax-mallia. Potilaat olivat iältään 6 kk – 24 vuotta, ja heillä oli uusiutunut tai vaikeahoitoinen Ewingin sarkooma, neuroblastooma tai rabdomyosarkooma, ja antituumorivaikutusta arvioitiin kokonaisvastemäärällä (ORR). 42 potilaasta 1 oli alle 2-vuotias, 27 oli 2–12-vuotiaita, 12 oli 12–17-vuotiaita ja 2 aikuispotilasta olivat 18–24-vuotiaita.
Potilaiden hoidon mediaani oli 2 MTD-sykliä. Faasin 1 tehokkuusarviointiin soveltuvista 41 potilaasta yhdellä rabdomyosarkoomaryhmän potilaista (N = 14) todettiin osittainen vaste (PR), jolloin kokonaisvasteeksi saatiin 7,1 % (95 % CI: 0,2; 33,9). Vahvistettua täydellistä vastetta (CR) tai osittaista vastetta ei todettu Ewingin sarkoomaa sairastavassa ryhmässä (N = 13) eikä neuroblastoomaryhmässä (N = 14). Mikään tutkimuksen haaroista ei jatkunut 2. vaiheeseen, sillä tutkimussuunnitelman vaatimusta siitä, että vähintään 2 potilaalla olisi havaittu vahvistettava vaste, ei saavutettu.
Kokonaiselossaolon mediaanitulokset, 1 vuoden seurantajakso mukaan lukien, olivat Ewingin sarkoomaryhmässä 32,1 viikkoa (95 % CI: 21,4, 72,9), neuroblastoomaryhmässä 32,0 viikkoa (95 % CI: 12, ei määritetty) ja rabdomyosarkoomaryhmässä 19,6 viikkoa (95 % CI: 4, 25,7).
Abraxane-valmisteen yleinen turvallisuusprofiili pediatrisilla potilailla vastasi Abraxane-valmisteen tiedossa olevaa turvallisuusprofiilia aikuisilla (katso kohta Haittavaikutukset). Näiden tulosten perusteella todettiin, että Abraxane-valmisteella ei monoterapiana ole merkittävää kliinistä tai elossaolohyötyä, joka oikeuttaisi jatkotutkimuksiin pediatrisessa potilailla.
Farmakokinetiikka
Kliinisissä tutkimuksissa määritettiin kokonaispaklitakselin farmakokinetiikka 30 ja 180 minuutin Abraxane-infuusion jälkeen annostasojen ollessa 80–375 mg/m2. Altistus paklitakselille (AUC) kasvoi lineaarisesti 2 653:sta arvoon 16 736 ng/h/ml annostuksen kasvaessa 80:stä 300:aan mg/m2.
Tutkimuksessa paklitakselin farmakokineettisiä ominaisuuksia verrattiin niiden edenneestä, kiinteästä tuumorista kärsivien potilaiden, joille oli annettu Abraxane-valmistetta laskimoon 260 mg/m2 annoksena 30 minuutin ajan ja niiden potilaiden, jotka olivat saaneet 175 mg/m2 liuotinpohjaista paklitakselia kolmen tunnin infuusiona. Paklitakselin puhdistuma plasmasta oli tilamalleista riippumattoman farmakokineettisen analyysin perusteella Abraxane-valmistetta käytettäessä suurempi (43 %) kuin liuotinpohjaista paklitakselipistosta seurannut puhdistuma plasmasta, ja myös jakautumistilavuus oli Abraxane-valmisteella suurempi (53 %). Terminaalisessa puoliintumisajassa ei ollut eroja.
Tutkimuksessa, jossa 12 potilaalle annettiin toistuvasti Abraxane-annoksia 260 mg/m2 laskimoon, AUC:n potilaskohtainen vaihtelu oli 19 % (vaihteluväli = 3,21 % – 37,70 %). Paklitakselin kerääntymisestä ei ollut todisteita monihoito-ohjelmia käytettäessä.
Jakautuminen
Jos potilaalla on kiinteitä tuumoreita, paklitakseli jakautuu Abraxane-valmisteen annon jälkeen tasaisesti verisoluihin ja plasmaan ja sitoutuu voimakkaasti plasman proteiineihin (94 %).
Paklitakselin sitoutumista proteiiniin Abraxane-valmisteen antamisen jälkeen on arvioitu ultrafiltraation avulla potilaskohtaisessa vertailevassa tutkimuksessa. Vapaan paklitakselin fraktio oli merkitsevästi suurempi Abraxane-valmisteella (6,2 %) kuin liuotinpohjaisella paklitakselilla (2,3 %). Tämä johti Abraxane-valmistetta käytettäessä merkitsevästi suurempaan altistumiseen sitoutumattomaan paklitakseliin verrattuna liuotinpohjaiseen paklitakseliin, vaikka niiden kokonaisaltistus on toisiinsa verrattavissa. Tämä johtuu mahdollisesti siitä, että paklitakseli ei ole Cremofor EL’in miselleihin sitoutuneena kuten liuotinpohjainen paklitakseli. Julkaistun kirjallisuuden perusteella in vitro ‑tutkimukset ihmisseerumin proteiineihin sitoutumisesta osoittavat, että (käytettäessä paklitakselia pitoisuuksina 0,1–50 µg/ml) simetidiini, ranitidiini, deksametasoni tai difenhydramiini eivät vaikuttaneet paklitakselin proteiinin sitoutumiseen.
Kokonaisjakautumistilavuus on populaatiofarmakokineettisen analyysin perusteella noin 1741 litraa. Suuri jakautumistilavuus osoittaa, että paklitakseli jakautuu laajasti ekstravaskulaarisesti ja/tai sitoutuu voimakkaasti kudoksiin.
Biotransformaatio ja eliminaatio
Julkaistun kirjallisuuden perusteella ihmisen maksan mikrosomeilla ja kudosviipaleilla tehdyt in vitro -tutkimukset osoittavat, että paklitakseli metaboloituu pääasiassa 6α‑hydroksipaklitakseliksi ja vähäisemmin kahdeksi muuksi metaboliitiksi, 3’‑p‑hydroksipaklitakseliksi ja 6α-3’‑p‑dihydroksipaklitakseliksi. 6α‑hydroksipaklitakseli muodostuu CYP2C8-isoentsyymin, 3’‑p‑hydroksipaklitakseli CYP3A4-isoentsyymin ja 6α-3’‑p‑dihydroksipaklitakseli sekä CYP3A4- että CYP2C8-isoentsyymien katalysoimana.
Metastaattista rintasyöpää sairastaville potilaille 30 minuutin kestoisena infuusiona annoksena 260 mg/m2 annetusta Abraxane-valmisteen kokonaisannoksesta keskimäärin 4 % erittyi muuttumattomana vaikuttavana aineena kumulatiivisesti virtsaan; tästä alle 1 % oli metaboliitteja, 6α‑hydroksipaklitakselia ja 3’‑p‑hydroksipaklitakselia. Tämä viittaa laajaan, muuta reittiä kuin munuaisten kautta tapahtuvaan puhdistumaan. Paklitakseli eliminoituu pääasiassa maksametabolian ja sappierityksen kautta.
Paklitakselin keskimääräinen puhdistuma plasmasta vaihtelee kliinisellä annosvälillä 80–300 mg/m2 välillä 13−30 l/h/m2, ja terminaalisen puoliintumisajan vaihteluväli on keskimäärin 13−27 tuntia.
Maksan vajaatoiminta
Maksan vajaatoiminnan vaikutusta Abraxane-valmisteen populaatiofarmakokinetiikkaan tutkittiin potilailla, joilla oli pitkälle edenneitä kiinteitä tuumoreita. Tässä analyysissa oli mukana potilaita, joiden maksan toiminta oli normaali (n = 130) tai joilla oli ennestään lievää (n = 8), kohtalaista (n = 7) tai vaikeaa (n = 5) maksan vajaatoimintaa (NCI Organ Dysfunction Working Group ‑luokituksen perusteella). Tulosten mukaan lievä maksan vajaatoiminta (kokonaisbilirubiinipitoisuus > 1 – ≤ 1,5 x ULN) ei vaikuta kliinisesti merkityksellisesti paklitakselin farmakokinetiikkaan. Jos potilaan maksan vajaatoiminta on kohtalaista (kokonaisbilirubiinipitoisuus > 1,5 – ≤ 3 x ULN) tai vaikea-asteista (kokonaisbilirubiinipitoisuus > 3 – ≤ 5 x ULN), paklitakselin suurin eliminaationopeus hidastuu noin 22 % – 26 %, ja paklitakselin keskimääräinen AUC suurenee noin 20 % verrattuna potilaisiin, joiden maksan toiminta on normaali. Maksan vajaatoiminta ei vaikuta paklitakselin keskimääräiseen Cmax-arvoon. Paklitakselin eliminaatio korreloi lisäksi käänteisesti kokonaisbilirubiinipitoisuuden kanssa ja positiivisesti seerumin albumiinipitoisuuden kanssa.
Farmakokineettinen/farmakodynaaminen mallinnus osoittaa, ettei maksan toiminnan (lähtötilanteen albumiini- tai kokonaisbilirubiinipitoisuuden perusteella) ja neutropenian välillä ole korrelaatiota Abraxane-altistuksen säätämisen jälkeen.
Potilaista, joiden kokonaisbilirubiinipitoisuus on > 5 x ULN tai joilla on metastaattinen haiman adenokarsinooma, ei ole saatavissa farmakokineettisiä tietoja (ks. kohta Annostus ja antotapa).
Munuaisten vajaatoiminta
Populaatiofarmakokineettisessä analyysissä oli mukana potilaita, joiden munuaisten toiminta oli normaali (n = 65), sekä potilaita, joilla oli ennestään lievää (n = 61), kohtalaista (n = 23) tai vaikeaa (n = l) munuaisten vajaatoimintaa (FDA:n kriteeriluonnoksen 2010 perusteella). Lievällä tai kohtalaisella munuaisten vajaatoiminnalla (kreatiniinipuhdistuma ≥ 30 – < 90 ml/min) ei ole kliinisesti merkittävää vaikutusta paklitakselin suurimpaan eliminaationopeuteen tai systeemiseen altistukseen (AUC ja Cmax). Farmakokineettiset tiedot vaikeaa munuaisten vajaatoimintaa sairastavista potilaista ovat riittämättömät eikä potilaista, joilla on loppuvaiheen munuaissairaus, ole tietoja saatavissa.
Iäkkäät
Abraxane-valmisteen populaatiofarmakokineettisessä analyysissä oli mukana iältään 24–85-vuotiaita potilaita, ja analyysi osoitti, ettei ikä vaikuta merkittävästi paklitakselin suurimpaan eliminaationopeuteen eikä systeemiseen altistukseen (AUC ja Cmax).
Farmakokineettinen/farmakodynaaminen mallinnus 125 sellaisen potilaan tiedoista, joilla oli pitkälle edenneitä kiinteitä kasvaimia, osoittaa, että ≥ 65-vuotiaille potilaille saattaa kehittyä herkemmin neutropenia ensimmäisen hoitosyklin kuluessa, mutta ikä ei vaikuta plasman paklitakselialtistukseen.
Pediatriset potilaat
Paklitakselin farmakokinetiikkaa 30 minuuttia kestävän laskimonsisäisen annon jälkeen (annostasolla 120 mg/m2 – 270 mg/m2) selvitettiin 64 potilaalla (ikä 2 – ≤ 18 vuotta) faasin 1/2 tutkimuksen 1. vaiheessa uusiutuneiden tai vaikeahoitoisten pediatristen kiinteiden kasvainten hoidossa. Kun annos suurennettiin tasolta 120 mg/m2 tasolle 270 mg/m2, paklitakselin keskimääräinen AUC(0-inf) vaihteli välillä 8 867–14 361 ng*h/ml ja keskimääräinen Cmax vaihteli välillä 3 488–8 078 ng/ml.
Annoksen mukaan normalisoidut lääkealtistuksen huippuarvot olivat vertailukelpoisia koko tutkitulla annosalueella. Annoksen mukaan normalisoidut kokonaisaltistusarvot olivat kuitenkin vertailukelpoisia vain annoksilla 120 mg/m2 – 240 mg/m2; annoksen mukaan normalisoitu AUC∞ oli pienempi annostasolla 270 mg/m2. Suurimmalla siedetyllä annoksella 240 mg/m2 keskimääräinen puhdistuma oli 19,1 l/h ja keskimääräinen terminaalinen puoliintumisaika oli 13,5 tuntia.
Lasten ja nuorten potilaiden altistus paklitakselille suureni annosten suurentuessa, ja viikoittaiset lääkealtistukset olivat suurempia kuin aikuispotilailla.
Muita olennaisia tekijöitä
Abraxane-valmisteen populaatiofarmakokineettiset analyysit osoittavat, että sukupuoli, rotu (aasialainen vs. valkoihoinen) ja kiinteiden tuumorien tyyppi eivät vaikuta kliinisesti merkityksellisesti paklitakselin systeemiseen altistukseen (AUC ja Cmax). Potilailla, jotka painoivat 50 kg, paklitakselin AUC oli noin 25 % pienempi kuin potilailla, jotka painoivat 75 kg. Tämän löydöksen kliininen merkitys on epäselvä.
Prekliiniset tiedot turvallisuudesta
Paklitakselin mahdollisia karsinogeenisiä ominaisuuksia ei ole tutkittu. Julkaistun kirjallisuuden perusteella paklitakseli on kuitenkin kliinisinä annoksina farmakodynaamisen toimintamekanisminsa perusteella mahdollisesti karsinogeeninen ja genotoksinen aine. Paklitakselin on osoitettu olevan klastogeeninen in vitro (kromosomipoikkeamat ihmisen lymfosyyteissä) ja in vivo -testeissä (hiirien mikrotumatutkimus). Paklitakselin on osoitettu olevan genotoksinen in vivo mutta tämä ei aiheuttanut mutageenisyyttä Ames-testissä tai kiinahamsterin munasarja-/hypoksantiini-guaniini fosforibosyylitransferaasi (CHO/HGPRT) geenimutaatioanalyysissa.
Paklitakselilla oli yhteys alhaiseen hedelmällisyyteen uros- ja naarasrotilla, kun sitä annettiin ennen parittelua ja sen aikana, ja sikiötoksisuuteen rotissa, kun annokset olivat pienempiä kuin ihmisten hoitoon käytettävät annokset. Eläimillä tehdyt tutkimukset Abraxane-valmisteella osoittivat kliinisesti relevanteilla altistusmäärillä olevan palautumattomia toksisia vaikutuksia urosten sukuelimiin.
Paklitakseli ja/tai sen metaboliitit erittyivät imettävien rottien maitoon. Kun rotille annettiin radiomerkittyä paklitakselia laskimoon 9. ja 10. päivänä synnytyksen jälkeen, maidossa todettiin radioaktiivisuutta suurempina pitoisuuksina kuin plasmassa ja pitoisuudet pienenivät yhtä nopeasti kuin plasmassa.
Farmaseuttiset tiedot
Apuaineet
Ihmisen albumiiniliuos (sisältää natriumkaprylaattia ja N-asetyyli-L-tryptofaania).
Yhteensopimattomuudet
Tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa, lukuun ottamatta niitä, jotka mainitaan kohdassa Käyttö- ja käsittelyohjeet.
Kestoaika
Avaamattomat injektiopullot
3 vuotta
Käyttökuntoon saatetun dispersion säilyvyys injektiopullossa
Käytön aikaisen kemiallisen ja fysikaalisen säilyvyyden on osoitettu olevan 24 tuntia 2 °C:n ‑ 8 °C:n lämpötilassa säilytettynä alkuperäisessä ulkopakkauksessa suojassa valolta.
Käyttökuntoon saatetun dispersion säilyvyys infuusionestepussissa
Käytön aikaisen kemiallisen ja fysikaalisen säilyvyyden on osoitettu olevan 24 tuntia 2 °C:n ‑ 8 °C:n lämpötilassa ja sen jälkeen 4 tuntia 25 °C:n lämpötilassa säilytettynä suojassa valolta.
Mikrobiologisista syistä valmiste tulisi kuitenkin käyttää välittömästi käyttökuntoon saattamisen ja infuusiopussien täytön jälkeen, ellei käyttökuntoon saattamista ja infuusiopussien täyttöä ole tehty siten, ettei mikrobikontaminaation vaaraa ole.
Jos valmistetta ei käytetä välittömästi, käytön aikaiset säilytysajat ja -olosuhteet ovat käyttäjän vastuulla.
Käyttökuntoon saatetun lääkevalmisteen kokonaissäilytysaika injektiopullossa ja infuusiopussissa jääkaapissa säilytettynä ja valolta suojattuna on 24 tuntia. Tämän jälkeen lääkevalmistetta voidaan säilyttää infuusiopussissa 4 tunnin ajan alle 25 °C:n lämpötilassa.
Säilytys
Avaamattomat injektiopullot
Pidä injektiopullo ulkopakkauksessa. Herkkä valolle. Pakastimessa tai jääkaapissa säilyttäminen eivät vaikuta haitallisesti valmisteen säilyvyyteen. Tämä lääkevalmiste ei vaadi lämpötilan suhteen erityisiä säilytysolosuhteita.
Käyttökuntoon saatettu dispersio
Käyttökuntoon saatetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
ABRAXANE infuusiokuiva-aine, dispersiota varten
5 mg/ml (L:ei) 100 mg (503,40 €)
PF-selosteen tieto
50 ml:n injektiopullo (tyypin 1 lasi), jossa on korkki (butyylikuminen) ja sinetti (alumiininen) ja joka sisältää 100 mg paklitakselia albumiiniin sidottuna nanopartikkelivalmistemuotona..
Pakkauskoko yksi injektiopullo.
Valmisteen kuvaus:
Jauheen väri vaihtelee valkoisesta keltaiseen.
Käyttö- ja käsittelyohjeet
Valmistelua ja antoa koskevat varotoimet
Paklitakseli on sytotoksinen syöpälääkevalmiste, ja kuten muitakin mahdollisesti toksisia yhdisteitä, myös Abraxane-valmistetta on käsiteltävä varoen. Käsineiden, suojalasien ja suojavaatetuksen käyttäminen on suositeltavaa. Jos dispersio joutuu kosketukseen ihon kanssa, iho tulee pestä heti perusteellisesti saippualla ja vedellä. Jos dispersiota pääsee limakalvoille, limakalvot tulee huuhtoa perusteellisesti vedellä. Vain sytotoksisten aineiden käsittelyyn asianmukaisesti koulutettu henkilö saa valmistaa ja antaa Abraxane-valmistetta. Raskaana olevan henkilökunnan ei tule käsitellä Abraxane-valmistetta.
Koska ekstravasaation mahdollisuus on olemassa, infuusiopaikan huolellista tarkkailua lääkevalmisteen annon aikana suositellaan mahdollisen infiltraation varalta. Abraxane-infuusion rajoittaminen ohjeiden mukaisesti 30 minuuttiin vähentää infuusioon liittyvien reaktioiden todennäköisyyttä.
Valmisteen käyttökuntoon saattaminen ja anto
Abraxane toimitetaan steriilinä kylmäkuivattuna jauheena, joka saatetaan käyttökuntoon ennen käyttöä. Käyttökuntoon saattamisen jälkeen yksi millilitra dispersiota sisältää 5 mg paklitakselia albumiiniin sidottuna nanopartikkelivalmistemuotona.
100 mg:n injektiopullo: Ruiskuta steriilillä ruiskulla hitaasti, vähintään yhden minuutin ajan, 20 ml 9 mg/ml (0,9 %) natriumkloridi-infuusionestettä.
Suuntaa liuos injektiopullon sisäseinämään. Liuosta ei saa suunnata suoraan jauheeseen, koska se aiheuttaa vaahtoamista.
Kun kaikki liuos on lisätty injektiopulloon, anna injektiopullon seistä vähintään 5 minuuttia, jotta kiinteä aine kostuu kunnolla. Kieputa ja/tai kääntele injektiopulloa sen jälkeen varovasti ja hitaasti vähintään 2 minuutin ajan, kunnes jauhe on sekoittunut täysin. Vaahdon muodostumista on vältettävä. Jos liuoksessa on vaahtoa tai kokkareita, seisota sitä vähintään 15 minuuttia, kunnes vaahto häviää.
Käyttökuntoon saatetun dispersion tulee olla maidonvalkoista ja homogeenista, eikä siinä saa erottua saostumaa. Käyttökuntoon saatetussa dispersiossa saattaa olla hieman sakkaa. Jos näkyvissä on saostumaa tai sakkaa, käännä injektiopullo varovasti ylösalaisin, jotta koko seos dispersoituu uudelleen ennen käyttöä.
Tarkista, onko injektiopullossa olevassa dispersiossa hiukkasia. Jos injektiopullossa näkyy hiukkasia, älä anna käyttökuntoon saatettua dispersiota.
Potilaan tarvitsema 5 mg/ml dispersion tarkka kokonaistilavuus tulee laskea ja tarvittava määrä käyttökuntoon saatettua Abraxane-valmistetta tulee injisoida tyhjään, steriiliin PVC- tai ei-PVC-tyyppiseen infuusionestepussiin.
Silikoniöljyä liukastimena sisältävien lääketieteellisten laitteiden (ruiskujen ja infuusionestepussien) käyttäminen Abraxane-valmisteen käyttökuntoon saattamiseen ja antamiseen saattaa johtaa proteiinimaisten ainesosien muodostumiseen. Anna Abraxane infuusiovälineiden avulla käyttämällä 15 µm ‑suodatinta, jotta vältät tällaisten ainesosien antamisen. 15 µm:n suodattimen käyttäminen poistaa nämä ainesosat, mutta ei muuta käyttökuntoon saatetun valmisteen fysikaalisia tai kemiallisia ominaisuuksia.
Jos suodattimen huokoskoko on alle 15 µm, suodatin saattaa tukkeutua.
Abraxane-valmisteen valmistukseen tai antamiseen ei tarvita välttämättä erityistä di(2-etyyliheksyyli)ftalaattia (DEHP) sisältämätöntä astiaa tai annosteluvälineitä.
Laskimokatetri suositellaan huuhtelemaan annon jälkeen 9 mg/ml (0,9 %) natriumkloridi-injektioliuoksella, millä varmistetaan, että potilas on saanut koko annoksen.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
ABRAXANE infuusiokuiva-aine, dispersiota varten
5 mg/ml 100 mg
- Ei korvausta.
ATC-koodi
L01CD01
Valmisteyhteenvedon muuttamispäivämäärä
20.01.2026
Yhteystiedot
09 2512 1244
www.bms.com/fi
medinfo.finland@bms.com
