SONOVUE injektiokuiva-aine ja liuotin, dispersiota varten 8 mikrol/ml
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Yleinen
Vaikuttavat aineet ja niiden määrät
Jokainen ml valmista dispersiota sisältää 8 μL rikkiheksafluoridia mikrokuplina vastaten 45 mikrogrammaa.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektiokuiva-aine ja liuotin, dispersiota varten.
Kliiniset tiedot
Käyttöaiheet
Tämä lääkevalmiste on tarkoitettu ainoastaan diagnostiseen käyttöön.
SonoVueta käytetään ultraäänitutkimuksissa parantamaan veren tai virtsateiden nesteiden kaikuominaisuuksia, jolloin signaali-kohinasuhde paranee.
SonoVueta tulee käyttää vain sellaisilla potilailla, joilla tutkimus ilman varjoainetehostusta on riittämätön.
Kaikukardiografia
SonoVue on transpulmonaarinen kaikukardiografiatehosteaine, joka on tarkoitettu käytettäväksi aikuispotilailla, joilla epäillään tai tiedetään olevan kardiovaskulaarinen sairaus, parantamaan sydämen kammioitten korostumista ja vasemman kammion endokardiumin rajan piirtymistä.
Makrovaskulaarinen Doppler
SonoVue voimistaa doppler-signaalia ja lisää tarkkuutta aikuispotilaiden aivovaltimoiden ja ekstrakraniaalisen kaulavaltimon tai perifeeristen valtimoiden epämuodostumien havaitsemisessa tai poissulkemisessa.
SonoVue parantaa aikuispotilaiden doppler-virtauksen havaitsemista ja kliinisesti merkittävän signaalitehostuksen kestoa porttilaskimotutkimuksissa.
Mikrovaskulaarinen Doppler
SonoVue parantaa aikuispotilaiden maksa- ja rintaleesioiden verisuonituksen havaitsemista doppler-sonografian aikana, jolloin leesioiden tunistaminen paranee.
Virtsateiden ultraäänitutkimus
SonoVue on tarkoitettu lapsipotilaiden (vastasyntyneistä 18-vuotiaisiin) virtsateiden ultraäänitutkimukseen vesikoureteraalisen refluksin havaitsemiseksi. Virtsateiden ultraäänikuvauksen negatiivisen tuloksen tulkinta, ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakodynamiikka.
Ehto
Valmistetta saavat käyttää vain ultraäänitutkimuksiin erikoistuneet lääkärit.
Annostus ja antotapa
Tätä valmistetta saavat käyttää vain ultraäänitutkimuksiin erikoistuneet lääkärit. Hätätilanteiden hoitamiseen tarvittava välineistön ja sen käyttämiseen koulutetun henkilökunnan on oltava nopeasti käytettävissä.
Annostus
Anto laskimoon
Aikuisille suositellut SonoVue-annokset ovat:
- B-mallin sydämen kammioitten kaikukuvaus, joko levossa tai rasituksessa: 2 ml.
- Verisuonten dopplerkaikukuvaus: 2,4 ml.
Yksittäisen tutkimuksen aikana voidaan suositeltu annos antaa toisen kerran, jos lääkäri pitää sitä tarpeellisena.
Iäkkäät potilaat
Laskimoannon annossuositukset koskevat myös iäkkäitä potilaita.
Pediatriset potilaat
SonoVuen laskimoannon turvallisuutta ja tehoa ei ole tutkittu alle 18‑vuotiaiden potilaiden kaikukardiografiassa ja vaskulaarisessa Doppler-kaikukuvauksessa.
Anto virtsarakkoon
Lapsipotilaille suositeltu SonoVue-annos on 1 ml.
Antotapa
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen valmistamisesta ennen lääkkeen antoa.
Anto laskimoon
SonoVue tulee annostella välittömästi ruiskuun vetämisen jälkeen injektiona ääreislaskimoon. Jokaisen injektion jälkeen suoritetaan huuhtelu 5 ml:lla 9 mg/ml (0,9 %) natriumkloridi-injektionestettä.
Anto virtsarakkoon
Rakkoon laitetaan steriili 6F-8F-virtsakatetri steriileissä olosuhteissa, ja rakko tyhjennetään virtsasta, mikä jälkeen sinne laitetaan suolaliuosta (normaalia steriiliä 9 mg/ml ‑natriumkloridiliuosta) noin kolmasosa tai puolet rakon arvioidusta tilavuudesta [(ikä vuosina + 2) x 30] ml. Tämä jälkeen SonoVue valutetaan rakkoon katetrin avulla. SonoVue-annon jälkeen rakkoon laitetaan suolaliuosta sen verran, että potilaalle tulee virtsaamistarve tai infuusiossa tuntuu heikko vastapaineen merkki. Rakon ja munuaisten ultraäänitutkimus tehdään rakon täyttämisen ja tyhjentämisen aikana. Heti ensimmäisen tyhjennyksen jälkeen rakko voidaan täyttää uudestaan suolaliuoksella toista tyhjennys- ja tutkimuskertaa varten ilman uutta SonoVue-annosta. Alhainen mekaaninen indeksi (≤ 0,4) on suositeltava rakon, virtsajohtimien ja munuaisten ultraäänitutkimuksessa, kun käytetään ultraäänikuvausainetta.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle (vaikuttaville aineille) tai kohdassa Apuaineet mainituille apuaineille.
SonoVue-valmisteen anto laskimoon on vasta-aiheinen potilailla, joilla tiedetään olevan veren oikovirtaus sydämen oikealta puolelta vasemmalle puolelle, vaikea pulmonaarinen hypertonia (systolinen keuhkovaltimopaine > 90 mmHg), kontrolloimaton systeemihypertonia tai aikuisten hengenahdistussyndrooma.
SonoVue-valmistetta ei pidä käyttää yhdistettynä dobutamiiniin niille potilaille, joilla on epästabiiliin kardiovaskulaariseen tilaan viittaavia tiloja, jolloin dobutamiini on vasta-aiheinen.
Varoitukset ja käyttöön liittyvät varotoimet
Yliherkkyysreaktiot
Vakavia yliherkkyysreaktioita on havaittu SonoVue-valmisteen antamisen aikana tai vähän sen jälkeen potilailla, jotka eivät aiemmin ole altistuneet rikkiheksafluoridia mikrokuplina sisältäville tuotteille, mukaan lukien potilaat, jotka ovat aiemmin saaneet yliherkkyysreaktion (-reaktioita) makrogolista, joka tunnetaan myös polyetyleeniglykolina (PEG) (ks. kohta Haittavaikutukset).
SonoVue sisältää polyetyleeniglykolia (ks. kohta Apuaineet). Vakavien reaktioiden riski saattaa olla suurentunut potilailla, jotka ovat aiemmin saaneet yliherkkyysreaktion (-reaktioita) polyetyleeniglykolista.
On suositeltavaa seurata kaikkia potilaita tarkkaan SonoVue-valmisteen antamisen aikana ja vähintään 30 minuuttia sen jälkeen vakavien yliherkkyysreaktioiden riskin tarkkailemiseksi (ks. kohta Annostus ja antotapa).
Varovaisuutta on noudatettava, kun beetasalpaajia käyttävien potilaiden anafylaksiaa hoidetaan adrenaliinilla, koska vaste voi olla heikko tai potilaalle voi tulla alfa-adrenergisiä ja vagotonisia haittavaikutuksia (hypertensio, bradykardia).
Anto laskimoon
Potilaat, joilla on epävakaa kardiopulmonaalinen tila
EKG:tä on seurattava suuren riskin omaavilla potilailla, kun se on kliinisesti perusteltua, ja tarkka valvonta on suositeltavaa.
Erityistä varovaisuutta on noudatettava hoidettaessa potilaita, joilla on hiljattain havaittu akuutti koronaaritautisyndrooma tai kliinisesti epävakaa iskeeminen sydänsairaus, mukaan luettuna kehittyvä tai meneillään oleva sydäninfarkti; edeltävän 7 vuorokauden kuluessa esiintynyt tyypillinen koronaaritautiin liittyvä lepokipu; sydänoireiden merkittävä pahentuminen edeltävän 7 vuorokauden kuluessa; hiljattain tehty sepelvaltimotoimenpide tai muita kliinisiä merkkejä sydäntilanteen epävakaudesta (kuten äskettäiset muutokset EKG:ssä, laboratoriokokeissa tai kliinisissä löydöksissä); akuutti sydämen vajaatoiminta, luokan III/IV sydämen vajaatoiminta tai vaikeita rytmihäiriöitä. Näillä potilailla yliherkkyystyyppiset ja/tai vasodilatoriset reaktiot voivat olla henkeä uhkaavia. SonoVue-valmistetta tulee antaa näille potilaille ainoastaan huolellisen hyöty-riskiarvion jälkeen ja valmisteen antamisen aikana ja sen jälkeen on potilaan elintoimintoja seurattava huolellisesti.
On erityisesti huomattava, että rasituskaikukardiografia voi aiheuttaa iskeemisen kohtauksen ja siinä käytettävät aineet voivat mahdollisesti myös aiheuttaa ennakoitavia, annoksesta riippuvia vaikutuksia sydän- ja verisuonijärjestelmään (esim. dobutamiini voi nostaa sydämen sykettä, verenpainetta ja ventrikulaarista ektooppista aktiviteettia tai adenosiini ja dipyridamoli voivat laskea verenpainetta) ja ennakoimattomia yliherkkyysreaktioita. Tämän vuoksi potilaiden tilan tulee olla vakaa käytettäessä SonoVue-valmistetta rasituskaikukardiografiassa, eli rintakipua tai EKG:n muutoksia ei saa olla esiintynyt kahden edeltävän päivän aikana. Lisäksi EKG:n ja verenpaineen seurantaa on jatkettava tehostetun SonoVue-kaikukardiografian aikana farmakologisissa rasitustilanteissa (esim. dobutamiinia käytettäessä).
Muut samanaikaiset sairaudet
Varovaisuutta on noudatettava, kun valmistetta annetaan potilaille, joilla on akuutti endokardiitti, keinoläppä, akuutti systeemitulehdus ja/tai verenmyrkytys, hyperaktiivinen koagulaatiohäiriö ja/tai äskettäinen tromboembolia, loppuvaiheen munuais- tai maksasairaus, koska kliinisissä tutkimuksissa näitä sairauksia sairastavia potilaita altistettiin SonoVue-valmisteelle vain rajoitettu määrä.
Virtsateiden SonoVue-ultraäänitutkimuksen tulkinta ja käyttörajoitukset
Virtsateiden SonoVue-ultraäänitutkimuksessa voi tulla vääriä negatiivisia tuloksia, joita ei ole selvitetty (ks. kohta Farmakodynamiikka).
Tekninen suositus
Eläinkokeissa varjoaineet ovat aiheuttaneet biologisia haittavaikutuksia (esim. endoteelisolujen vaurioita, kapillaarien repeämiä), kun niitä käytettiin yhdessä ultraäänen kanssa. Vaikka näitä biologisia haittavaikutuksia ei ole raportoitu ihmisillä, suositellaan käytettäväksi alhaista mekaanista indeksiä.
Apuaineet
Tämä lääkevalmiste sisältää alle 1 mmol (23 mg) natriumia per annos eli sen on olennaisesti natriumiton.
Yhteisvaikutukset
Interaktiotutkimuksia ei ole tehty.
Raskaus ja imetys
Raskaus
Kliinisiä tietoja raskaana olevien altistumisesta ei ole saatavilla. Eläintutkimuksissa ei ole havaittu haitallisia vaikutuksia raskaudelle, sikiön/alkion kehitykselle, synnytykselle tai syntymän jälkeiselle kehitykselle (ks. kohta Prekliiniset tiedot turvallisuudesta Prekliiniset tiedot turvallisuudesta). Varotoimenpiteenä on suositeltavaa välttää SonoVuen käyttöä raskauden aikana.
Imetys
Rikkiheksafluoridin imeytymisestä äidinmaitoon ei ole olemassa tietoa. Perustuen SonoVuen nopeaan poistumiseen elimistöstä uloshengitysilman kautta on kuitenkin katsottu, että imetystä voidaan jatkaa 2–3 tunnin kuluttua SonoVue -annostuksen jälkeen.
Hedelmällisyys
Kliinisiä tietoja ei ole saatavilla. Eläinkokeissa ei ole ilmennyt haitallisia vaikutuksia hedelmällisyyteen.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
SonoVue-valmisteella ei ole haitallista vaikutusta ajokykyyn tai koneiden käyttökykyyn.
Haittavaikutukset
Aikuispotilaat - anto laskimoon
SonoVuen laskimoannon jälkeinen turvallisuus arvioitiin 58 kliiniseen tutkimukseen osallistuneella 4653 aikuispotilaalla. SonoVuen laskimoannosta raportoidut haittavaikutukset eivät yleensä olleet vakavia, ja ne olivat ohimeneviä ja hävisivät itsestään ilman jälkivaikutuksia. Kliinisissä tutkimuksissa yleisimmin raportoituja haittavaikutuksia laskimoannon jälkeen ovat päänsärky, injektiokohdan reaktiot ja pahoinvointi.
Haittavaikutukset luokitellaan elinjärjestelmän ja yleisyyden mukaan seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
Elinjärjestelmä | Haittavaikutukset | ||
Yleisyys | |||
Melko harvinainen (≥ 1/1 000, < 1/100) | Harvinainen (≥ 1/10 000, < 1/1 000) | Tuntematon (koska saatavissa oleva tieto ei riitä arviointiin) | |
Immuunijärjestelmä |
| Yliherkkyys* |
|
Hermosto | Päänsärky, tuntoharhat, heitehuimaus, makuhäiriöt |
| Vasovagaalinen reaktio |
Silmät |
| Hämärtynyt näkö |
|
Verisuonisto | Punastuminen | Matala verenpaine |
|
Sydän |
|
| Sydäninfarkti ** Sydänlihasiskemia ** Kounisin oireyhtymä*** |
Ruoansulatuselimistö | Pahoinvointi, vatsakipu |
| Oksentelu |
Iho ja ihonalainen kudos | Ihottuma | Kutina |
|
Luusto, lihakset ja sidekudos |
| Selkäkipu |
|
Yleisoireet ja antopaikassa todettavat haitat | Epämiellyttävä tunne rinnassa, injektiokohdan reaktiot, kuumotus | Rintakipu, kipu, väsymys |
|
* Yliherkkyysreaktioihin viittaavia oireita voivat olla: ihon punoitus, bradykardia, hypotensio, hengenahdistus, tajuttomuus, sydämen/sydämen ja hengityksen pysähtyminen anafylaktinen reaktio, anafylaktinen sokki.
** Joissakin yliherkkyystapauksissa sepelvaltimotautia sairastavilla potilailla havaittiin myös sydänlihasiskemiaa ja/tai sydäninfarkteja.
*** Allerginen sepelvaltimotautikohtaus
Erittäin harvoissa tapauksissa on raportoitu kuolemaan johtaneita haittavaikutuksia, jotka ovat ajallisesti liittyneet SonoVue-valmisteen käyttöön. Kaikilla näillä potilailla oli olemassa suuri vakavien, jopa kuolemaan johtavien, sydänkomplikaatioiden riski.
Anto virtsarakkoon lapsipotilailla
SonoVue-valmisteen virtsarakkoannon jälkeinen turvallisuus perustui julkistetun kirjallisuuden tutkimiseen. SonoVue-valmistetta oli käytetty yli 6000 lapsipotilaalla (ikäjakauma 2 päivästä 18 vuoteen). Raportoituja haittavaikutuksia ei ole ollut.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Koska tähän mennessä ei ole raportoitu yhdestäkään yliannostustapauksesta, yliannostuksen merkkejä tai oireita ei ole identifioitu. Faasi I tutkimuksissa annettiin enimmillään 52 ml:n annoksia terveille vapaaehtoisille, eikä vaikeita haittavaikutustapauksia havaittu. Yliannostustapauksessa potilasta tulee hoitaa oireiden mukaisesti.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Ultraäänikuvausaineet ATC-koodi: V08DA05
Rikkiheksafluoridi on inertti, heikosti liukeneva, vaaraton kaasu. Kirjallisuudessa on raportteja kaasun käytöstä hengityselinten fysiologian tutkimisessa ja pneumaattisessa retinopeksissa. Kun 9 mg/ml (0,9 %) natriumkloridi-injektioneste lisätään lyofilisoituun jauheeseen ja ravistetaan voimakkaasti, muodostuu rikkiheksafluoridi-hienojakoista dispersiota sisältävä valmiste. Mikrokuplien läpimitta on keskimäärin noin 2,5 μm, 90 % mikrokuplista on läpimitaltaan alle 6 μm ja 99 % alle 11 μm. Yksi millilitra SonoVueta sisältää 8 μL mikrokuplia. Heijastuksen voimakkuus riippuu mikrokuplien määrästä ja ultraäänisignaalin frekvenssistä. Rikkiheksafluoridikuplien ja vesifaasin rajapinta toimii heijastimena utraäänisignaaleille ja parantaa siten veren kaikuominaisuuksia ja lisää kontrastia veren ja ympäröivän kudoksen välillä.
Anto laskimoon
Suositelluilla laskimoon annetuilla annoksilla SonoVuen on osoitettu lisäävän merkittävästi signaalin intensiteettiä yli 2 minuutin ajan B-mallin kaikukardiografiatutkimuksessa ja 3‑8 minuutin ajan makro- ja mikrovaskulaarisessa dopplerkaikukuvauksessa.
Anto virtsarakkoon
Lapsipotilaiden virtsateiden ultraäänitutkimusta varten virtsarakkoon annettu SonoVue lisää virtsaputken, virtsarakon, virtsajohtimien ja munuaisaltaan nesteiden signaali-intensiteettiä ja helpottaa siten rakosta virtsajohtimiin tulevan nesterefluksin havaitsemista. SonoVuen teho vesikoureteraalisen nesterefluxin havaitsemissa/poissulkemisessa on todettu kahdessa julkaistussa avoimessa yksikeskustutkimuksessa. SonoVue-ultraäänen avulla havaittua tai poissuljettua vesikoureteraalista nesterefluxia verrattiin radiograafiseen referenssistandardiin. Yhdessä 183 potilaan tutkimuksessa (366 munuais-virtsajohdinyksikköä) SonoVue-ultraääni oli oikein positiivinen 89/103 yksikössä, joissa refluksia ilmeni, ja oikein negatiivinen 226/263 yksikössä, joissa refluksia ei ilmennyt. Toisessa 228 potilaan tutkimuksessa (463 munuais-virtsajohdinyksikköä) SonoVue-ultraääni oli oikein positiivinen 57/71 yksikössä, joissa refluksia ilmeni, ja oikein negatiivinen 302/392 yksikössä, joissa refluksia ei ilmennyt.
Farmakokinetiikka
Annostellun rikkiheksafluoridin kokonaismäärä kliinisillä annoksilla on erittäin pieni (2 ml:n annos mikrokuplia sisältää 16 μl kaasua). Rikkiheksafluoridi liukenee vereen ja poistuu täydellisesti uloshengityksen mukana.
Terveille vapaaehtoisille laskimoon annetun SonoVue-kertainjektion jälkeen, joka oli 0,03 ml/kg tai 0,3 ml/kg (noin 1 ja 10 kertaa maksimaalinen kliininen annos), rikkiheksafluoridi poistui verestä nopeasti. Terminaalisen puoliintumisajan keskiarvo oli 12 minuuttia (vaihtelu välillä 2-33 minuuttia). Yli 80 % annetusta rikkiheksafluoridista oli poistunut uloshengitysilman mukana 2 minuutin kuluttua injektiosta ja lähes 100 % 15 minuutin kuluttua.
Diffuusista interstitiaalisesta pulmonaarisesta fibroosista kärsivillä potilailla uloshengityksen mukana poistui noin 100 % ja terminaalinen puoliintumisaika oli sama kuin terveillä vapaaehtoisilla.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, geenitoksisuutta sekä lisääntymistoksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille. Umpisuolileesioita havaittiin rotilla joissakin toistuvilla annoksilla tehdyissä tutkimuksissa, apinoilla vastaavaa ei havaittu. Kyseisellä havainnolla ei ole merkitystä ihmisille normaaleissa annostusolosuhteissa.
Myös SonoVue-valmisteen paikallinen rakonsisäinen siedettävyys arvioitiin. Kerta-annostutkimus ja toistuvilla annoksilla tehty tutkimus, joita molempia seurasi hoidoton jakso, tehtiin naarasrotilla, joiden kummankin munuaisen, virtsajohtimien, virtsarakon ja virtsaputken paikallinen toksisuus tutkittiin makroskooppisessa ja histopatologisessa tutkimuksessa. Kummassakaan tutkimuksessa ei löytynyt kokeisiin liittyviä leesioita yhdestäkään tutkituista elimistä (erityisesti virtsarakosta). Sen vuoksi tehtiin johtopäätös, että rotan virtsatiet kestävät hyvin SonoVue-valmistetta.
Farmaseuttiset tiedot
Apuaineet
Jauhe: Makrogoli 4000, distearoyylifosfatidyylikoliini, dipalmitoyylifosfatidyyliglyserolinatrium ja palmitiinihappo.
Liuotin: 9 mg/ml (0,9 %) natriumkloridi-injektioneste, liuos.
Yhteensopimattomuudet
Lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa, lukuun ottamatta niitä, jotka mainitaan kohdassa Käyttö- ja käsittelyohjeet.
Kestoaika
2 vuotta.
Valmiiksi saatetun liuoksen kemiallinen ja fysikaalinen säilyvyys on 6 tuntia.
Mikrobiologiselta kannalta valmiste tulee käyttää välittömästi valmistamisen jälkeen.
Mikäli valmistetta ei käytetä heti valmistamisen jälkeen, on käyttäjä vastuussa käyttöä edeltävistä säilytysolosuhteista ja -ajasta.
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Käyttökuntoon saatetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
SONOVUE injektiokuiva-aine ja liuotin, dispersiota varten
8 mikrol/ml (L:ei) 25 mg (Mini-Spike) (114,09 €)
PF-selosteen tieto
Tyypin I väritön lasinen injektiopullo, jossa on 25 mg kuivaa, kylmäkuivattua jauhetta rikkiheksafluoridikaasussa. Pullossa on harmaa butyylikumitulppa ja repäistävä alumiinisinetti. Siirtosysteemi (MiniSpike).
Esitäytetty tyypin I kirkkaasta lasista valmistettu ruisku sisältää 5 ml 9 mg/ml (0,9 %) natriumkloridi-injektionestettä.
Valmisteen kuvaus:
Valkoinen jauhe.
Kirkas, väritön liuos.
Käyttö- ja käsittelyohjeet
Tarkista ennen käyttöä, että injektiopullo ja suljin ovat vahingoittumattomat.
SonoVue tulee valmistaa ennen käyttöä injektoimalla injektiopulloon septumin läpi 5 ml 9 mg/ml (0,9 %) natriumkloridi-injektionestettä.
Tämän jälkeen injektiopulloa ravistetaan voimakkaasti 20 sekunnin ajan, jonka jälkeen haluttu määrä dispersiota voidaan vetää ruiskuun
seuraavien
ohjeiden mukaisesti.
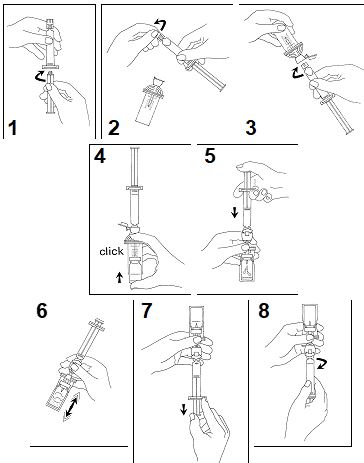
- Kiinnitä mäntä ruiskuun kiertämällä sitä myötäpäivään.
- Avaa Mini-Spike-siirtosysteemipakkaus ja poista ruiskusta korkki.
- Avaa siirtosysteemin korkki ja liitä ruisku siirtosysteemiin kiertämällä sitä myötäpäivään.
- Poista suojalevy injektiopullosta. Työnnä injektiopullo siirtosysteemin läpinäkyvään putkeen ja paina voimakkaasti, jotta injektiopullo kiinnittyy paikalleen.
- Tyhjennä ruiskun sisältö injektiopulloon painamalla mäntää.
- Ravista voimakkaasti 20 sekuntia sekoittaen koko injektiopullon sisällön saadaksesi valkoisen, tasalaatuisen, maitomaisen liuoksen.
- Käännä systeemi ylösalaisin ja vedä SonoVue varovasti ruiskuun.
- Irrota ruisku siirtosysteemistä.
Älä käytä, jos valmistettu liuos on kirkas ja/tai suspensiossa näkyy kiinteitä injektiokuiva-ainehiukkasia.
SonoVue tulee annostella välittömästi injektiona ääreislaskimoon aikuisten kaikukardiografiaa ja verisuonten Doppler-kaikukuvausta varten tai virtsarakkoon lasten virtsateiden ultraäänitutkimusta varten.
Jos SonoVueta ei annostella heti valmistamisen jälkeen, hienojakoinen dispersio tulee ravistella uudelleen ennen sen imemistä ruiskuun. Dispersion kemiallinen ja fysikaalinen säilyvyys on 6 tuntia.
Injektiopullo on vain yhtä käyttökertaa varten.
Lääkkeitä ei tule heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
Korvattavuus
SONOVUE injektiokuiva-aine ja liuotin, dispersiota varten
8 mikrol/ml 25 mg
- Ei korvausta.
ATC-koodi
V08DA05
Valmisteyhteenvedon muuttamispäivämäärä
24.06.2021
Yhteystiedot
Fabrikstorget 1
41250 Göteborg
Sverige
www.braccoimaging.fi
productservicesfi@bracco.com
