EZETIMIB KRKA tabletti 10 mg
Vaikuttavat aineet ja niiden määrät
Yksi tabletti sisältää 10 mg etsetimibiä.
Täydellinen apuaineluettelo, ks. kohta Apuaineet
Lääkemuoto
Tabletti.
Kliiniset tiedot
Käyttöaiheet
Primaarinen hyperkolesterolemia
Ezetimib Krka yhdessä HMG CoA-reduktaasin estäjän (statiinin) kanssa on tarkoitettu ruokavalion lisähoidoksi primaarista (heterotsygoottista familiaalista ja ei-familiaalista) hyperkolesterolemiaa sairastaville potilaille, joille pelkällä statiinilla ei ole saavutettu riittävää hoitovastetta.
Ezetimib Krka monoterapiana on tarkoitettu ruokavalion lisähoidoksi primaarista (heterotsygoottista familiaalista ja ei-familiaalista) hyperkolesterolemiaa sairastaville potilaille, joille statiinilääkitys ei ole tarkoituksenmukainen tai jotka eivät siedä statiineja.
Sydän- ja verisuonitapahtumien ehkäisy
Ezetimib Krka statiinihoidon lisänä tai aloitettuna samanaikaisesti statiinihoidon kanssa on tarkoitettu pienentämään sydän- ja verisuonitapahtumien riskiä (ks. kohta Farmakodynamiikka) potilailla, joilla on sepelvaltimotauti ja aiemmin sairastettu äkillinen sepelvaltimo-oireyhtymä.
Homotsygoottinen familiaalinen hyperkolesterolemia (HoFH)
Ezetimib Krka yhdessä statiinin kanssa on tarkoitettu ruokavalion lisähoidoksi HoFH-tautia sairastavien potilaiden hoitoon. Potilaat voivat saada lisäksi myös muuta hoitoa (esim. LDL-afereesi).
Annostus ja antotapa
Annostus
Potilaan on noudatettava asianmukaista veren lipidejä vähentävää ruokavaliota, jota on jatkettava myös Ezetimib Krka-hoidon aikana.
Suositeltu annos on yksi Ezetimib Krka 10 mg tabletti kerran päivässä. Ezetimib Krka voidaan ottaa mihin vuorokauden aikaan tahansa, joko aterian yhteydessä tai tyhjään mahaan.
Yhdistettäessä Ezetimib Krka statiiniin on joko käytettävä asianomaisen statiinin normaalia aloitusannosta tai jatkettava jo vakiintunutta suurempaa statiiniannosta. Yhdistelmähoitoa käytettäessä on tutustuttava asianomaisen statiinin annostusohjeisiin.
Käyttö potilaille, joilla on sepelvaltimotauti ja aiemmin sairastettu äkillinen sepelvaltimo-oireyhtymätapahtuma
10 mg etsetimibiä voidaan antaa sepelvaltimotautia sairastaville potilaille, joilla on aiemmin sairastettu äkillinen sepelvaltimo-oireyhtymätapahtuma, sydän- ja verisuonitapahtumien lisävähentämiseen yhdessä statiinin kanssa, jonka kardiovaskulaarinen hyöty on osoitettu.
Yhteiskäyttö sappihappoa sitovien aineiden kanssa
Ezetimib Krka tulisi ottaa vähintään 2 tuntia ennen sappihappoa sitovien aineiden ottamista tai vähintään 4 tuntia sen jälkeen.
Ikääntyneet
Annostusta ei tarvitse muuttaa iäkkäitä potilaita hoidettaessa (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Hoito on aloitettava erikoislääkärin valvonnassa.
6 vuotta täyttäneet lapset ja nuoret: etsetimibin turvallisuutta ja tehoa 6–17 vuoden ikäisten lasten hoidossa ei ole varmistettu. Saatavissa olevan tiedon perusteella, joka on kuvattu kohdissa Varoitukset ja käyttöön liittyvät varotoimet, Haittavaikutukset, Farmakodynamiikka ja Farmakokinetiikka, ei voida antaa suosituksia annostuksesta.
Kun Ezetimib Krkaa annetaan yhdessä statiinin kanssa, statiinin lapsipotilaita koskevat annostusohjeet on tarkistettava.
Alle 6-vuotiaat lapset: etsetimibin turvallisuutta ja tehoa alle 6 vuoden ikäisten lasten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Maksan vajaatoiminta
Annostusta ei tarvitse muuttaa lievässä maksan vajaatoiminnassa (Child-Pughin asteikolla 5–6). Ezetimib Krka ‑hoitoa ei suositella potilaille, joilla on kohtalainen (Child-Pughin asteikolla 7–9) tai vaikea (Child-Pughin asteikolla > 9) maksan vajaatoiminta. (Ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka.)
Munuaisten vajaatoiminta
Annostusta ei tarvitse muuttaa munuaisten vajaatoimintaa sairastavia potilaita hoidettaessa (ks. kohta Farmakokinetiikka).
Antotapa
Ezetimib Krka otetaan suun kautta.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Kun Ezetimib Krkaa käytetään yhdessä statiinin kanssa, tutustu käytettävän statiinin valmisteyhteenvetoon.
Ezetimib Krkan ja statiinin yhdistelmähoito on kontraindikoitu raskauden ja imetyksen aikana.
Ezetimib Krkan ja statiinin yhdistelmähoito on kontraindikoitu, jos potilaalla on aktiivisessa vaiheessa oleva maksasairaus tai pitkäaikainen seerumin transaminaasipitoisuuksien nousu, jonka syytä ei tunneta.
Varoitukset ja käyttöön liittyvät varotoimet
Kun Ezetimib Krkaa käytetään yhdessä statiinin kanssa, tutustu käytettävän statiinin valmisteyhteenvetoon.
Maksaentsyymit
Kontrolloiduissa tutkimuksissa, joissa Ezetimib Krkaa on annettu yhdessä statiinin kanssa, on havaittu transaminaasiarvojen kohoamista peräkkäisissä mittauksissa [≥ 3 x viitearvojen yläraja (ULN)]. Kun Ezetimib Krka-hoitoa annetaan yhdessä statiinin kanssa, maksan toimintakokeet on tehtävä hoitoa aloitettaessa ja sen jälkeen statiinia koskevien suositusten mukaisesti. (Ks. kohta Haittavaikutukset.)
IMProved Reduction of Outcomes: Vytorin Efficacy International Trial (IMPROVE-IT) ‑tutkimuksessa 18 144 sepelvaltimotautipotilasta, joilla oli aiemmin sairastettu äkillinen sepelvaltimo-oireyhtymätapahtuma, satunnaistettiin saamaan etsetimibiä ja simvastatiinia 10/40 mg vuorokaudessa (n = 9067) tai simvastatiinia 40 mg vuorokaudessa (n = 9077). 6,0 vuoden pituisen mediaaniseuranta-ajan aikana peräkkäisten transaminaasiarvojen kohoamisten (≥ 3 x ULN) ilmaantuvuus oli 2,5 % etsetimibiä ja simvastatiinia saaneilla ja 2,3 % simvastatiinia saaneilla (ks. kohta Haittavaikutukset).
Kliinisessä vertailututkimuksessa, jossa yli 9000:lle kroonista munuaistautia sairastavalle potilaalle annettiin satunnaistetusti joko10 mg etsetimibiä yhdessä 20 mg simvastatiiniannoksen kanssa kerran vuorokaudessa (n = 4650) tai lumevalmistetta (n = 4620) (seuranta-ajan mediaani 4,9 vuotta), transaminaasiarvojen kohoamista peräkkäisissä mittauksissa (> 3 x viitearvojen yläraja) havaittiin etsetimibi-simvastatiiniryhmässä 0,7 prosentilla ja lumeryhmässä 0,6 prosentilla potilaista (ks. kohta Haittavaikutukset).
Lihakset
Etsetimibin tultua kliiniseen käyttöön on raportoitu joitakin myopatia- ja rabdomyolyysitapauksia. Useimmat potilaat, jotka saivat rabdomyolyysin, käyttivät samanaikaisesti statiinia ja etsetimibiä. Rabdomyolyysia on kuitenkin raportoitu hyvin harvoin, kun etsetimibiä on käytetty yksinään tai kun etsetimibiä on annettu yhdessä muiden lääkkeiden kanssa, joihin tiedetään liittyvän rabdomyolyysivaaraa. Jos myopatiaa epäillään lihasoireiden perusteella tai se on varmistettu toteamalla kreatiinikinaasiarvo (CK), joka on > 10 x viitearvojen yläraja (ULN), Ezetimib Krkan, statiinin tai näiden muiden potilaan samanaikaisesti käyttämien lääkkeiden käyttö on heti lopetettava. Kaikkia Ezetimib Krka ‑hoidon aloittavia potilaita on informoitava myopatiavaarasta ja heitä on kehotettava viipymättä ilmoittamaan lääkärilleen selittämättömästä lihaskivusta, -arkuudesta tai -heikkoudesta (ks. kohta Haittavaikutukset).
IMPROVE-IT-tutkimuksessa 18 144 sepelvaltimotautipotilasta, joilla oli aiemmin sairastettu äkillinen sepelvaltimo-oireyhtymätapahtuma, satunnaistettiin saamaan etsetimibiä ja simvastatiinia 10/40 mg vuorokaudessa (n = 9067) tai simvastatiinia 40 mg vuorokaudessa (n = 9077). 6,0 vuoden pituisen mediaaniseuranta-ajan aikana myopatian ilmaantuvuus oli 0,2 % etsetimibiä ja simvastatiinia saaneilla ja 0,1 % simvastatiinia saaneilla, kun myopatia määriteltiin selittämättömäksi lihasheikkoudeksi tai ‑kivuksi, johon liittyi seerumin CK-arvo, joka oli ≥ 10 kertaa ULN, tai kaksi peräkkäin havaittua CK-arvoa, jotka olivat ≥ 5 ja < 10 kertaa ULN. Rabdomyolyysin ilmaantuvuus oli 0,1 % etsetimibiä ja simvastatiinia saaneilla ja 0,2 % simvastatiinia saaneilla, kun rabdomyolyysi määriteltiin selittämättömäksi lihasheikkoudeksi tai -kivuksi, johon liittyi seerumin CK-arvo, joka oli ≥ 10 kertaa ULN ja johon liittyi näyttöä munuaisvauriosta, kaksi peräkkäin havaittua CK-arvoa, jotka olivat ≥ 5 kertaa ULN ja < 10 kertaa ULN ja joihin liittyi näyttöä munuaisvauriosta, tai CK-arvo, joka oli ≥ 10 000 IU/l ilman näyttöä munuaisvauriosta (ks. kohta Haittavaikutukset.).
Kliinisessä tutkimuksessa, jossa yli 9000:lle kroonista munuaistautia sairastavalle potilaalle annettiin satunnaistetusti joko 10 mg etsetimibiä yhdessä 20 mg simvastatiiniannoksen kanssa kerran vuorokaudessa (n = 4650) tai lumevalmistetta (n = 4620) (seuranta-ajan mediaani 4,9 vuotta), myopatian/rabdomyolyysin ilmaantuvuus oli etsetimibi-simvastatiiniryhmässä 0,2 % ja lumeryhmässä 0,1 % (ks. kohta Haittavaikutukset).
Maksan vajaatoiminta
Ezetimib Krka ‑hoitoa ei suositella potilaille, joilla on kohtalainen tai vaikea maksan vajaatoiminta, koska suurentuneiden etsetimibipitoisuuksien vaikutuksia näihin potilaisiin ei tunneta (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Ezetimib Krkan tehoa ja turvallisuutta on tutkittu heterotsygoottista familiaalista tai ei-familiaalista hyperkolesterolemiaa sairastavien 6–10-vuotiaiden potilaiden hoidossa 12 viikkoa kestäneessä lumekontrolloidussa kliinisessä tutkimuksessa. Yli 12 viikkoa kestävän etsetimibihoidon vaikutuksia ei ole tutkittu tässä ikäryhmässä (ks. kohdat Annostus ja antotapa, Haittavaikutukset, Farmakodynamiikka ja Farmakokinetiikka).
Etsetimibiä ei ole tutkittu alle 6-vuotiaiden potilaiden hoidossa (ks. kohdat Annostus ja antotapa ja Haittavaikutukset).
Yhdessä simvastatiinin kanssa käytetyn etsetimibin tehoa ja turvallisuutta on tutkittu heterotsygoottista familiaalista hyperkolesterolemiaa sairastavien 10–17-vuotiaiden potilaiden hoidossa kontrolloidussa kliinisessä tutkimuksessa, jossa oli mukana murrosikäisiä poikia (puberteettikehityksen aste vähintään II Tannerin luokituksen mukaan) ja tyttöjä, joiden kuukautisten alkamisesta oli kulunut vähintään vuosi.
Tässä suppeassa kontrolloidussa tutkimuksessa ei esiintynyt yleisesti nuorten poikien tai tyttöjen kasvuun tai sukupuoliseen kypsymiseen kohdistuvia havaittavia vaikutuksia eikä tyttöjen kuukautiskierron pituuteen kohdistuvia vaikutuksia. Yli 33 viikkoa kestävän etsetimibihoidon vaikutuksia kasvuun tai sukupuoliseen kypsymiseen ei kuitenkaan ole tutkittu (ks. kohdat Annostus ja antotapa ja Haittavaikutukset).
Etsetimibin turvallisuutta ja tehoa ei ole tutkittu simvastatiinin yli 40 mg:n vuorokausiannoksiin yhdistettynä 10–17-vuotiaiden lasten ja nuorten hoidossa.
Etsetimibin turvallisuutta ja tehoa yhdessä simvastatiinin kanssa ei ole tutkittu alle 10-vuotiaiden pediatristen potilaiden hoidossa (ks. kohdat Annostus ja antotapa ja Haittavaikutukset).
Alle 17-vuotiaille potilaille annetun etsetimibihoidon pitkäaikaista tehoa aikuisiän sairastavuuden ja kuolleisuuden vähentämisessä ei ole tutkittu.
Fibraatit
Ezetimib Krkan tehoa ja turvallisuutta yhdessä fibraattien kanssa ei ole vahvistettu.
Jos Ezetimib Krkaa ja fenofibraattia saavalla potilaalla epäillään kolelitiaasia, sappirakon tutkimukset ovat tarpeen ja hoito on keskeytettävä (ks. kohdat Yhteisvaikutukset ja Haittavaikutukset).
Siklosporiini
Aloitettaessa Ezetimib Krka-hoito siklosporiinia saavalle potilaalle on syytä noudattaa varovaisuutta. Jos potilas käyttää Ezetimib Krkaa ja siklosporiinia, on siklosporiinipitoisuuksia seurattava (ks. kohta Yhteisvaikutukset).
Antikoagulantit
Jos varfariinihoitoon, johonkin muuhun kumariiniantikoagulanttihoitoon tai fluindionihoitoon lisätään
Ezetimib Krka, INR-arvoa (International Normalised Ratio) tulisi seurata asianmukaisesti (ks. kohta Yhteisvaikutukset).
Yhteisvaikutukset
Prekliinisissä tutkimuksissa on osoitettu, ettei etsetimibi indusoi lääkeaineita metaboloivia sytokromi P450 (CYP) -entsyymejä. Etsetimibillä ei ole havaittu kliinisesti merkitseviä farmakokineettisiä yhteisvaikutuksia sellaisten lääkkeiden kanssa, joiden tiedetään metaboloituvan sytokromi P450-entsyymien 1A2, 2D6, 2C8, 2C9 ja 3A4 tai N-asetyylitransferaasin välityksellä.
Kliinisissä interaktiotutkimuksissa etsetimibi ei vaikuttanut dapsonin, dekstrometorfaanin, digoksiinin, ehkäisytablettien (etinyyliestradiolin ja levonorgestreelin), glipitsidin, tolbutamidin eikä midatsolaamin farmakokinetiikkaan yhteiskäytön aikana. Yhtä aikaa etsetimibin kanssa annettu simetidiini ei vaikuttanut etsetimibin hyötyosuuteen.
Antasidit: Antasidien samanaikainen käyttö hidasti etsetimibin imeytymistä mutta ei vaikuttanut etsetimibin hyötyosuuteen. Hidastuneen imeytymisen ei katsota olevan kliinisesti merkitsevä.
Kolestyramiini: Kolestyramiini laski etsetimibin kokonaispitoisuuden (etsetimibi + etsetimibiglukuronidi) AUC:n keskiarvoa noin 55 %. Tämä yhteisvaikutus saattaa heikentää LDL-kolesterolin laskua tehostavaa vaikutusta, jonka Ezetimib Krkan lisääminen kolestyramiinihoitoon saa aikaan (ks. kohta Annostus ja antotapa).
Fibraatit: Lääkäreiden tulisi ottaa huomioon mahdollinen kolelitiaasin ja sappirakon sairauden vaara fenofibraattia ja Ezetimib Krkaa saavilla potilailla (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset).
Jos Ezetimib Krkaa ja fenofibraattia saavilla potilailla epäillään kolelitiaasia, sappirakon tutkimukset ovat tarpeen, ja hoito on keskeytettävä (ks. kohta Haittavaikutukset).
Fenofibraatin tai gemfibrotsiilin samanaikainen antaminen nosti jonkin verran etsetimibin kokonaispitoisuuksia (noin 1,5- ja 1,7-kertaiseksi). Etsetimibin antamista yhdessä muiden fibraattien kanssa ei ole tutkittu.
Fibraatit saattavat lisätä kolesterolin erittymistä sappeen, ja aiheuttaa siten sappikiviä. Eläinkokeissa etsetimibi nosti joskus sapen kolesterolipitoisuutta sappirakossa, mutta näin ei tapahtunut kaikilla koeeläinlajeilla (ks. kohta Prekliiniset tiedot turvallisuudesta). Etsetimibin terapeuttiseen käyttöön liittyvää litogeenisen vaikutuksen vaaraa ei voida sulkea pois.
Statiinit: Kliinisesti merkitseviä farmakokineettisiä yhteisvaikutuksia ei havaittu, kun etsetimibiä annettiin yhdessä atorvastatiinin, simvastatiinin, pravastatiinin, lovastatiinin, fluvastatiinin tai rosuvastatiinin kanssa.
Siklosporiini: Kahdeksalle munuaisensiirtopotilaalle, joiden kreatiniinipuhdistuma oli > 50 ml/min ja jotka saivat stabiilia siklosporiiniannosta, tehdyssä tutkimuksessa 10 mg:n kerta-annos etsetimibiä nosti etsetimibin kokonaispitoisuuden AUC:n keskiarvon 3,4-kertaiseksi (vaihteluväli 2,3–7,9-kertainen) toisessa tutkimuksessa etsetimibiä yksin saaneilla terveillä vapaaehtoisilla (n = 17) todettuihin pitoisuuksiin verrattuna. Toisessa tutkimuksessa munuaisensiirtopotilaalla, jolla oli vaikea munuaisten vajaatoiminta ja joka sai siklosporiinia ja useita muita lääkkeitä, todettiin 12 kertaa suurempi altistuminen etsetimibin kokonaispitoisuudelle verrattuna kontrolliryhmään, joka sai etsetimibiä yksin. Kaksijaksoisessa, vaihtovuoroisessa tutkimuksessa, johon osallistui 12 tervettä henkilöä, 20 mg etsetimibiä vuorokaudessa kahdeksan vuorokauden ajan yhdessä seitsemäntenä päivänä annetun siklosporiinin (100 mg kerta-annoksena) kanssa nosti siklosporiinin AUC-arvoa keskimäärin 15 % (vaihteluväli 10 %:n lasku – 51 %:n nousu), verrattuna yksinään annettuun 100 mg:n kerta-annokseen siklosporiinia. Samanaikaisesti annetun etsetimibin vaikutuksesta siklosporiinialtistumiseen potilailla, joille on tehty munuaisensiirto, ei ole tehty kontrolloitua tutkimusta. Aloitettaessa Ezetimib Krka ‑hoito siklosporiinia saavalle potilaalle on syytä noudattaa varovaisuutta. Jos potilas käyttää Ezetimib Krkaa ja siklosporiinia, on siklosporiinipitoisuuksia seurattava (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Antikoagulantit: Kahdelletoista terveelle aikuiselle miehelle tehdyssä tutkimuksessa etsetimibin (10 mg kerran vuorokaudessa) samanaikainen antaminen ei vaikuttanut merkitsevästi varfariinin hyötyosuuteen tai protrombiiniaikaan. Lääkkeen tultua kliiniseen käyttöön on kuitenkin raportoitu tapauksia INR-arvon noususta potilailla, joiden varfariini- tai fluindionihoitoon oli lisätty etsetimibi. Jos varfariinihoitoon tai johonkin muuhun kumariiniantikoagulanttihoitoon tai fluindionihoitoon lisätään Ezetimib Krka, INR-arvoa tulisi seurata asianmukaisesti (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Pediatriset potilaat: Yhteisvaikutuksia on tutkittu vain aikuisille tehdyissä tutkimuksissa.
Raskaus ja imetys
Ezetimib Krkan ja statiinin yhdistelmähoito on kontraindikoitu raskauden ja imetyksen aikana (ks. kohta Vasta-aiheet). Tutustu myös käytettävän statiinin valmisteyhteenvetoon.
Raskaus
Ezetimib Krkaa tulisi antaa raskaana oleville naisille vain, jos se on selvästi välttämätöntä. Etsetimibin raskaudenaikaisesta käytöstä ei ole kliinistä tietoa. Etsetimibillä yksinään tehdyt eläinkokeet eivät ole tuoneet esiin suoria eivätkä epäsuoria haitallisia vaikutuksia raskauteen, alkion- ja sikiönkehitykseen, synnytykseen tai postnataaliseen kehitykseen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Imetys
Ezetimib Krkaa ei pitäisi käyttää imetyksen aikana. Rotilla tehdyt tutkimukset osoittivat, että etsetimibi erittyi imettävien rottien maitoon. Ei tiedetä, erittyykö lääkeaine myös äidinmaitoon.
Hedelmällisyys
Etsetimibin vaikutuksesta ihmisen hedelmällisyyteen ei ole olemassa kliinistä tutkimustietoa. Etsetimibillä ei ole vaikutusta uros- tai naarasrottien hedelmällisyyteen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Tutkimuksia valmisteen vaikutuksesta ajokykyyn tai koneiden käyttökykyyn ei ole tehty. Ajoneuvoa ajettaessa tai koneita käytettäessä on kuitenkin huomioitava, että heitehuimausta on ilmoitettu esiintyneen.
Haittavaikutukset
Ezetimib Krka ‑hoidon aikana mahdollisesti ilmenevien haittavaikutusten yleisyydet on arvioitu seuraavasti:
- hyvin yleinen (≥ 1/10)
- harvinainen (≥ 1/100, < 1/10)
- melko harvinainen (≥ 1/1 000, < 1/100)
- harvinainen (≥ 1/10 000, < 1/1,000)
- hyvin harvinainen (< 1/10 000)
- tuntematon (koska saatavissa oleva tieto ei riitä arviointiin)
Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Taulukoitu luettelo haittavaikutuksista (kliiniset tutkimukset ja markkinoillaolon aikaiset kokemukset)
Enintään 112 viikkoa kestäneissä kliinisissä tutkimuksissa etsetimibiä annettiin 10 mg/vrk yksinään 2396 potilaalle, yhdessä statiinin kanssa 11 308 potilaalle tai yhdessä fenofibraatin kanssa 185 potilaalle. Haittavaikutukset olivat yleensä lieviä ja ohimeneviä. Haittavaikutusten kokonaismäärä oli samansuuruinen etsetimibihoidon ja plasebohoidon yhteydessä. Haittavaikutuksista johtunut keskeyttämisprosentti oli myös samansuuruinen etsetimibihoidon ja plasebohoidon aikana.
Etsetimibi yksinään tai yhdessä statiinin kanssa:
Seuraavia haittavaikutuksia havaittiin etsetimibiä yksinään saaneilla potilailla (n = 2396), ja niitä esiintyi enemmän kuin plaseboa saaneilla potilailla (n = 1159). Näitä haittavaikutuksia havaittiin myös potilailla, jotka saivat etsetimibiä yhdessä statiinin kanssa (n = 11 308) ja niitä esiintyi enemmän kuin statiinia yksinään saaneilla potilailla (n = 9361). Markkinoillaolon aikana esiintyneet haittavaikutukset ovat peräisin raporteista, joissa etsetimibiä on annettu yksinään tai yhdessä statiinin kanssa.
Etsetimibi yksinään | ||
Elinjärjestelmä | Haittavaikutukset | Yleisyys |
Tutkimukset | Kohonnut ALAT- ja/tai ASAT-arvo, kohonnut veren kreatiinikinaasi, kohonnut gammaglutamyylitransferaasiarvo, maksan toimintakokeiden muutokset | Melko harvinainen |
Hengityselimet, rintakehä ja välikarsina | yskä | Melko harvinainen |
Ruoansulatuselimistö | vatsakipu, ripuli, ilmavaivat | Yleinen |
dyspepsia, ruokatorven refluksitauti, pahoinvointi | Melko harvinainen | |
Yleisoireet ja antopaikassa todettavat haitat | nivelsärky, lihaskouristukset, niskasärky | Melko harvinainen |
Aineenvaihdunta ja ravitsemus | heikentynyt ruokahalu | Melko harvinainen |
Verisuonisto | kuumat aallot, hypertensio | Melko harvinainen |
Yleisoireet ja antopaikassa todettavat haitat | väsymys | Yleinen |
rintakipu, kipu | Melko harvinainen | |
Muut haittavaikutukset, kun etsetimibiä on annettu yhdessä statiinin kanssa | ||
Elinjärjestelmä | Haittavaikutukset | Yleisyys |
Tutkimukset | Kohonnut ALAT ja/tai ASAT-arvo | Yleinen |
Hermosto | päänsärky | Yleinen |
parestesiat | Melko harvinainen | |
Ruoansulatuselimistö | suun kuivuminen, gastriitti | Melko harvinainen |
Iho ja ihonalainen kudos | kutina, ihottuma, nokkosihottuma | Melko harvinainen |
Yleisoireet ja antopaikassa todettavat haitat | lihassärky | Yleinen |
selkäsärky, lihasheikkous, raajasärky | Melko harvinainen | |
Yleisoireet ja antopaikassa todettavat haitat | voimattomuus, perifeerinen edeema | Melko harvinainen |
Markkinoillaolon aikaiset kokemukset (yhdessä statiinin kanssa tai ilman) | ||
Elinjärjestelmä | Haittavaikutukset | Yleisyys |
Veri ja imukudos | trombosytopenia | Tuntematon |
Hermosto | heitehuimaus, parestesia | Tuntematon |
Hengityselimet, rintakehä ja välikarsina | hengenahdistus | Tuntematon |
Ruoansulatuselimistö | pankreatiitti, ummetus | Tuntematon |
Iho ja ihonalainen kudos | erythema multiforme | Tuntematon |
Yleisoireet ja antopaikassa todettavat haitat | lihassärky, myopatia/rabdomyolyysi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) | Tuntematon |
Yleisoireet ja antopaikassa todettavat haitat | voimattomuus | Tuntematon |
Immuunijärjestelmä | yliherkkyys, mukaan lukien ihottuma, nokkosihottuma, anafylaksi ja angioedeema | Tuntematon |
Maksa ja sappi | maksatulehdus, sappikivitauti, sappirakkotulehdus | Tuntematon |
Psyykkiset häiriöt | depressio | Tuntematon |
Etsetimibi yhdessä fenofibraatin kanssa
Ruoansulatuselimistö: vatsakipu (yleinen)
Kaksoissokkoutetussa, plasebokontrolloidussa kliinisessä monikeskustutkimuksessa, johon osallistui sekamuotoista hyperlipidemiaa sairastavia potilaita, 625 potilasta sai hoitoa enintään 12 viikkoa ja 576 potilasta enintään vuoden. Tässä tutkimuksessa 172 potilasta sai etsetimibiä ja fenofibraattia 12 viikkoa ja 230 potilasta vuoden (mukaan lukien 109 potilasta, jotka saivat pelkkää etsetimibiä ensimmäiset 12 viikkoa). Tutkimusta ei ollut suunniteltu vertaamaan tutkimusryhmiä harvinaisten tapahtumien suhteen. Kliinisesti tärkeiden seerumin transaminaasien nousujen (> 3 x viitearvojen yläraja peräkkäisissä mittauksissa) esiintymistiheys (95 %:n luottamusväli) oli fenofibraattia monoterapiana saaneiden hoitoryhmässä 4,5 % (1,9; 8,8) ja etsetimibiä yhdessä fenofibraatin kanssa saaneiden hoitoryhmässä 2,7 % (1,2; 5,4) hoitoaltistuksen perusteella mukautettuna. Kolekystektomian vastaavat esiintymistiheydet olivat 0,6 % (0,0; 3,1) ja 1,7 % (0,6; 4,0) (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset).
Pediatriset potilaat (6–17-vuotiaat)
Tutkimuksessa, jossa oli mukana heterotsygoottista familiaalista tai ei-familiaalista hyperkolesterolemiaa sairastavia pediatrisia (6–10-vuotiaita) potilaita (n = 138), koholla olevia ALAT- ja/tai ASAT-arvoja (≥ 3x viitealueen yläraja (ULN) peräkkäisissä mittauksissa) todettiin 1,1 prosentilla (1 potilaalla) etsetimibiä saaneista ja 0 prosentilla lumelääkettä saaneista potilaista. Kohonneita kreatiinikinaasiarvoja (≥ 10 x ULN) ei ollut. Yhtään myopatiatapausta ei raportoitu.
Erillisessä tutkimuksessa, jossa oli mukana heterotsygoottista familiaalista hyperkolesterolemiaa sairastavia nuoria (10–17-vuotiaita) potilaita (n = 248), koholla olevia ALAT- ja/tai ASAT-arvoja (≥ 3 x viitealueen yläraja (ULN) peräkkäisissä mittauksissa) todettiin 3 prosentilla (4 potilaalla) etsetimibiä/simvastatiinia saaneista ja 2 prosentilla (2 potilaalla) pelkkää simvastatiinia saaneista potilaista. Kohonneiden kreatiinikinaasiarvojen (≥ 10 x ULN) osalta vastaavat luvut olivat 2 % (2 potilasta) ja 0 %. Yhtään myopatiatapausta ei raportoitu.
Nämä tutkimukset eivät soveltuneet lääkkeiden harvinaisten haittavaikutusten arviointiin.
Potilaat, joilla on sepelvaltimotauti ja aiemmin sairastettu äkillinen sepelvaltimo-oireyhtymätapahtuma
IMPROVE-IT-tutkimuksessa (ks. kohta Farmakodynamiikka) johon osallistui 18 144 joko etsetimibiä ja simvastatiinia 10/40 mg saanutta potilasta (n = 9067, joista 6 %:lla annos suurennettiin 10/80 mg:aan etsetimibiä ja simvastatiinia) tai simvastatiinia 40 mg saanutta potilasta (n = 9077, joista 27 %:lla annos suurennettiin 80 mg:aan simvastatiinia), turvallisuusprofiilit olivat samanlaiset 6,0 vuoden pituisen mediaaniseuranta-ajan aikana. Haittavaikutusten vuoksi tutkimuksen keskeytti 10,6 % potilaista, jotka saivat etsetimibiä ja simvastatiinia, ja 10,1 % potilaista, jotka saivat simvastatiinia. Myopatian ilmaantuvuus oli 0,2 % etsetimibiä ja simvastatiinia saaneilla ja 0,1 % simvastatiinia saaneilla, kun myopatia määriteltiin selittämättömäksi lihasheikkoudeksi tai -kivuksi, johon liittyi seerumin CK-arvo, joka oli ≥ 10 kertaa ULN, tai kaksi peräkkäin havaittua CK-arvoa, jotka olivat ≥ 5 ja < 10 kertaa ULN. Rabdomyolyysin ilmaantuvuus oli 0,1 % etsetimibiä ja simvastatiinia saaneilla ja 0,2 % simvastatiinia saaneilla, kun rabdomyolyysi määriteltiin selittämättömäksi lihasheikkoudeksi tai -kivuksi, johon liittyi seerumin CK-arvo, joka oli ≥ 10 kertaa ULN ja johon liittyi näyttöä munuaisvauriosta, kaksi peräkkäin havaittua CK-arvoa, jotka olivat ≥ 5 kertaa ULN ja < 10 kertaa ULN ja joihin liittyi näyttöä munuaisvauriosta, tai CK-arvo, joka oli ≥ 10 000 IU/l ilman näyttöä munuaisvauriosta. Peräkkäisten transaminaasiarvojen kohoamisten (≥ 3 x ULN) ilmaantuvuus oli 2,5 % etsetimibiä ja simvastatiinia saaneilla ja 2,3 % simvastatiinia saaneilla (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Sappirakkoon liittyviä haittavaikutuksia ilmoitettiin 3,1 %:lla etsetimibiä ja simvastatiinia saaneilla ja 3,5 %:lla simvastatiinia saaneilla potilailla. Kolekystektomiasta johtuneiden sairaalahoitojaksojen ilmaantuvuus oli 1, 5 % kummassakin hoitoryhmässä. Syöpä (määriteltiin miksi tahansa uudeksi pahanlaatuisuudeksi) todettiin tutkimuksen aikana 9,4 %:lla etsetimibiä ja simvastatiinia saaneista potilaista ja 9,5 %:lla simvastatiinia saaneista potilaista.
Kroonista munuaistautia sairastavat potilaat
SHARP-tutkimuksessa (the Study of Heart and Renal Protection) (ks. kohta Farmakodynamiikka), jossa yli 9000 potilaalle annettiin joko kiinteänä annosyhdistelmänä 10 mg etsetimibiä ja 20 mg simvastatiinia kerran vuorokaudessa (n = 4650) tai lumevalmistetta (n = 4620), turvallisuusprofiilit olivat vertailukelpoiset keskimäärin 4,9 vuotta (mediaani) kestäneen seurannan aikana. Tässä tutkimuksessa rekisteröitiin vain vakavat haittatapahtumat ja mistä tahansa haittatapahtumasta johtuneet hoidon keskeyttämiset. Haittatapahtumien vuoksi hoidon keskeyttäneiden potilaiden osuudet olivat vertailukelpoiset (10,4 % etsetimibi-simvastatiiniryhmässä ja 9,8 % lumeryhmässä). Myopatian/rabdomyolyysin ilmaantuvuus oli etsetimibi-simvastatiinihoitoa saaneessa ryhmässä 0,2 % ja lumevalmistetta saaneessa ryhmässä 0,1 %. Transaminaasiarvojen kohoamista peräkkäisissä mittauksissa (> 3 x viitearvojen yläraja) havaittiin 0,7 prosentilla etsetimibi-simvastatiiniryhmän ja 0,6 prosentilla lumeryhmän potilaista (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Tässä tutkimuksessa ei havaittu tilastollisesti merkitsevää lisääntymistä etukäteen määritellyissä haittatapahtumissa, joita olivat syöpä (9,4 % Etsetimibi-simvastatiiniryhmässä ja 9,5 % lumeryhmässä), maksatulehdus, kolekystektomia tai sappikivien komplikaatiot tai haimatulehdus.
Laboratorioarvot
Kontrolloiduissa kliinisissä monoterapiatutkimuksissa kliinisesti tärkeää seerumin transaminaasiarvojen nousua (ALAT ja/tai ASAT ≥ 3 x viitearvojen yläraja, peräkkäisissä mittauksissa) esiintyi samassa määrin etsetimibin (0,5 %) ja plasebon (0,3 %) yhteydessä. Yhdistelmähoitotutkimuksissa näitä esiintyi 1,3 %:lla etsetimibin ja statiinin yhdistelmää ja 0,4 %:lla pelkkää statiinia saaneista potilaista. Nämä muutokset olivat yleensä oireettomia eikä niihin liittynyt kolestaasia, ja arvot palautuivat lähtötasolle hoidon lopettamisen jälkeen tai hoitoa jatkettaessa. (Ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.)
Kliinisissä tutkimuksissa raportoitiin kreatiinikinaasiarvoja (CK), jotka olivat > 10 x viitearvojen yläraja 4 potilaalla 1674:stä (0,2 %), jotka saivat etsetimibiä yksinään, 1 potilaalla 786:sta (0,1 %), jotka saivat plaseboa, 1 potilaalla 917:sta (0,1 %), jotka saivat etsetimibiä ja statiinia yhdessä ja 4 potilaalla 929:stä (0,4 %), jotka saivat statiinia yksinään. Etsetimibiin ei liittynyt enempää myopatiaa tai rabdomyolyysiä kuin asianmukaisiin vertailuhoitoihin (plasebo tai statiini yksinään) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Etsetimibi siedettiin yleensä hyvin, kun sitä annettiin kliinisissä tutkimuksissa 15 terveelle koehenkilölle 50 mg/vrk enintään 14 vuorokauden ajan tai 18:lle primaarista hyperkolesterolemiaa sairastavalle potilaalle 40 mg/vrk enintään 56 vuorokauden ajan. Eläinkokeissa ei havaittu toksisia vaikutuksia, kun etsetimibiä annettiin oraalisina kerta-annoksina rotille ja hiirille 5000 mg/kg ja koirille 3000 mg/kg.
Etsetimibin yliannostustapauksia on raportoitu muutamia, ja useimpiin niistä ei ole liittynyt haittavaikutuksia. Raportoidut haittavaikutukset eivät olleet vakavia. Yliannostustapauksissa on annettava oireenmukaista ja elintoimintoja tukevaa hoitoa.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: lipidejä muuntavat lääkeaineet, muut lipidejä muuntavat lääkeaineet, ATC-koodi: C10AX09
Vaikutusmekanismi
Etsetimibi kuuluu uuteen veren lipidejä vähentävien lääkeaineiden luokkaan, ja se estää selektiivisesti kolesterolin ja vastaavien kasvisterolien imeytymistä suolistosta. Etsetimibi on tehokas suun kautta annettuna, ja sen vaikutusmekanismi poikkeaa muiden kolesterolia alentavien lääkeaineryhmien (esim. statiinien, sappihappoja sitovien aineiden [resiinien], fibraattijohdosten ja kasvistanolien) vaikutusmekanismeista. Etsetimibin vaikutuskohde molekyylitasolla on sterolien kuljettaja, Niemann-Pick C1 Like 1(NPC1L1) -proteiini, joka vastaa kolesterolin ja fytosterolien imeytymisestä suolistossa.
Etsetimibi asettuu ohutsuolen sukareunukseen (”brush border”), missä se estää kolesterolin imeytymistä ja vähentää siten suolistossa olevan kolesterolin siirtymistä maksaan; statiinit vähentävät kolesterolin synteesiä maksassa ja yhdessä nämä erilliset mekanismit täydentävät toistensa kolesterolia alentavaa vaikutusta. Kaksi viikkoa kestäneessä kliinisessä tutkimuksessa, jossa oli mukana 18 hyperkolesterolemiapotilasta, etsetimibi vähensi kolesterolin imeytymistä suolistosta 54 % plaseboon verrattuna.
Farmakodynaamiset vaikutukset
Etsetimibin kolesterolin imeytymistä estävän vaikutuksen selektiivisyyttä on tutkittu prekliinisissä tutkimuksissa. Etsetimibi esti 14C-kolesterolin imeytymistä, mutta sillä ei ollut vaikutusta triglyseridien, rasvahappojen, sappihappojen, progesteronin, etinyyliestradiolin tai rasvaliukoisten A- ja D-vitamiinien imeytymiseen.
Epidemiologiset tutkimukset ovat osoittaneet, että kardiovaskulaarinen sairastuvuus ja kuolleisuus ovat suoraan verrannollisia kokonaiskolesteroli- ja LDL-kolesterolipitoisuuteen ja kääntäen verrannollisia HDL-kolesterolipitoisuuteen.
Etsetimibi annettuna yhdessä statiinin kanssa pienentää sydän- ja verisuonitapahtumien riskiä sepelvaltimotautipotilailla, joilla on aiemmin sairastettu äkillinen sepelvaltimo-oireyhtymätapahtuma.
Kliininen teho ja turvallisuus
Kontrolloiduissa kliinisissä tutkimuksissa etsetimibi joko yksin tai yhdessä statiinin kanssa vähensi merkitsevästi hyperkolesterolemiaa sairastavien potilaiden kokonaiskolesteroli-, LDL-kolesteroli-, apo-B- ja triglyseridipitoisuutta ja lisäsi HDL-kolesterolin pitoisuutta.
Primaarinen hyperkolesterolemia
Kahdeksan viikon plasebokontrolloituun kaksoissokkotutkimukseen osallistui 769 hyperkolesterolemiapotilasta, jotka saivat pelkkää statiinihoitoa eivätkä olleet saavuttaneet NCEP-suosituksen (National Cholesterol Education Program) mukaista LDL-kolesterolin tavoitearvoa (lähtötilanteesta riippuen 2,6–4,1 mmol/l). Näille potilaille annettiin satunnaistetusti joko etsetimibiä 10 mg tai plaseboa aikaisemman statiinihoidon lisäksi.
Niistä statiinia saaneista potilaista, joiden LDL-kolesteroli ei ollut tavoitetasolla tutkimuksen alkaessa (~82 %), merkitsevästi useampi etsetimibiryhmään (72 %) kuin plaseboryhmään (19 %) satunnaistetuista potilaista oli saavuttanut LDL-kolesterolin tavoitetason, kun tutkimuksen päätemuuttuja (end point) saavutettiin. Vastaava LDL-kolesterolin lasku oli merkitsevästi erilainen (etsetimibi 25 % ja plasebo 4 %). Aikaisempaan statiinihoitoon lisätty etsetimibi vähensi myös merkitsevästi kokonaiskolesteroli-, apoB- ja triglyseridipitoisuutta ja lisäsi HDL-kolesterolipitoisuutta plaseboon verrattuna. Statiinihoitoon lisätty etsetimibi laski C-reaktiivisen proteiinin mediaania 10 % ja plasebo 0 % lähtöarvoon verrattuna.
Kahdessa satunnaistetussa 12 viikkoa kestäneessä plasebokontrolloidussa kaksoissokkotutkimuksessa, joihin osallistui 1719 primaarista hyperkolesterolemiaa sairastavaa potilasta, 10 mg etsetimibiä vähensi merkitsevästi kokonaiskolesteroli- (13 %), LDL-kolesteroli- (19 %), apoB- (14 %) ja triglyseridipitoisuutta (8 %) ja lisäsi HDL-kolesterolin pitoisuutta (3 %) plaseboon verrattuna. Etsetimibi ei vaikuttanut rasvaliukoisten A-, D- ja E-vitamiinien pitoisuuteen plasmassa. Etsetimibi ei myöskään vaikuttanut tromboplastiiniaikaan eikä, kuten eivät muutkaan veren lipidejä vähentävät lääkkeet, vähentänyt lisämunuaiskuoren steroidihormonien tuotantoa.
Kaksoissokkoutetussa kontrolloidussa kliinisessä monikeskustutkimuksessa (ENHANCE) heterotsygoottista familiaalista hyperkolesterolemiaa sairastaville 720 potilaalle annettiin satunnaistetusti joko yhdistelmähoitona etsetimibiä 10 mg ja simvastatiinia 80 mg (n = 357) tai simvastatiinia 80 mg yksinään (n = 363) kahden vuoden ajan. Tutkimuksen ensisijaisena tavoitteena oli selvittää etsetimibin ja simvastatiinin yhdistelmähoidon vaikutusta kaulavaltimon seinämäpaksuuteen (intima-media thickness, IMT) pelkkään simvastatiinihoitoon verrattuna. Tämän korvikemuuttujan vaikutusta sydän- ja verisuonisairastuvuuteen ja ‑kuolleisuuteen ei ole toistaiseksi osoitettu.
Ensisijainen päätemuuttuja oli kaulavaltimon kaikkien kuuden segmentin seinämäpaksuuksien keskiarvon muutos, eikä siinä havaittu merkitsevää eroa (p = 0,29) kahden hoitoryhmän välillä kaikukuvauksella (B-moodi) mitattuna. Kaulavaltimon seinämäpaksuus suureni etsetimibiä 10 mg ja simvastatiinia 80 mg saaneessa ryhmässä 0,0111 mm ja pelkkää simvastatiinia 80 mg saaneessa ryhmässä 0,0058 mm kaksi vuotta kestäneen tutkimusjakson aikana (kaulavaltimon seinämäpaksuuden keskiarvo oli lähtötilanteessa yhdistelmähoitoryhmässä 0,68 mm ja pelkkää simvastatiinia saaneessa ryhmässä 0,69 mm).
Etsetimibin (10 mg) ja simvastatiinin (80 mg) yhdistelmähoito pienensi LDL-kolesteroli-, kokonaiskolesteroli-, apoB- ja triglyseridipitoisuutta merkitsevästi enemmän kuin simvastatiini (80 mg) yksinään. HDL-kolesterolipitoisuuden prosentuaalinen nousu oli molemmissa hoitoryhmissä samansuuruinen. Yhdessä simvastatiinin (80 mg) kanssa annetun etsetimibin (10 mg) raportoidut haittavaikutukset vastasivat etsetimibin tunnettua turvallisuusprofiilia.
Pediatriset potilaat
Kontrolloituun kaksoissokkoutettuun monikeskustutkimukseen osallistui 138 (59 poikaa ja 79 tyttöä) heterotsygoottista familiaalista tai ei-familiaalista hyperkolesterolemiaa (HeFH) sairastavaa 6–10-vuotiasta (keski-ikä 8,3 vuotta) potilasta. Potilaiden LDL-kolesteroliarvo oli lähtötilanteessa 3,74−9,92 mmol/l, ja he saivat satunnaistetusti joko etsetimibiä 10 mg tai lumelääkettä 12 viikon ajan.
Viikolla 12 etsetimibi oli laskenut merkitsevästi seuraavia arvoja pelkkään lumelääkkeeseen verrattuna: kokonaiskolesteroli (‑21 % vs. 0 %), LDL-kolesteroli (-28 % vs. ‑1 %), apoB (-22 % vs. ‑1 %) ja non- HDL-kolesteroli ( 26 % vs. 0 %). Näiden kahden hoitoryhmän triglyseridi- ja HDL-kolesteroliarvojen tulokset olivat samankaltaiset (triglyseridi -6 % ja +8 % ja HDL-kolesteroli +2 % ja +1 %).
Kontrolloituun kaksoissokkoutettuun monikeskustutkimukseen osallistui heterotsygoottista familiaalista hyperkolesterolemiaa (HeFH) sairastavia 10–17-vuotiaita (keski-ikä 14,2 vuotta) potilaita, joista 142 oli poikia (puberteettikehityksen aste vähintään II Tannerin luokituksella) ja 106 tyttöjä, joiden kuukautiset olivat alkaneet. Potilaiden LDL-kolesteroliarvo oli lähtötilanteessa 4,1–10,4 mmol/l, ja he saivat satunnaistetusti joko etsetimibiä 10 mg yhdessä simvastatiinin (10, 20 tai 40 mg) kanssa tai simvastatiinia (10, 20 tai 40 mg) yksinään 6 viikon ajan, etsetimibiä yhdessä simvastatiinin 40 mg kanssa tai simvastatiinia 40 mg yksinään seuraavien 27 viikon ajan ja sen jälkeen avoimessa jatkotutkimuksessa etsetimibiä yhdessä simvastatiinin (10 mg, 20 mg tai 40 mg) kanssa 20 viikon ajan.
Viikolla 6 etsetimibin ja simvastatiinin (kaikki annokset) yhdistelmähoito oli laskenut merkitsevästi seuraavia arvoja pelkkään simvastatiiniin (kaikki annokset) verrattuna: kokonaiskolesteroli (etsetimibi+simvastatiini 38 %, simvastatiini 26 %), LDL-kolesteroli (49 %, 34 %), apoB (39 %, 27 %) ja non-HDL-kolesteroli (47 %, 33 %). Näiden kahden hoitoryhmän tulokset olivat samanlaiset triglyseridi- ja HDL-kolesteroliarvojen osalta (triglyseridi ‑17 % ja ‑12 % ja HDL-kolesteroli +7 % ja +6 %). Viikon 33 tulokset vastasivat viikon 6 tuloksia, ja NCEP:n ja AAP:n (American Academy of Pediatrics) suositusten mukaisen LDL-kolesterolin tavoitearvon (< 2,8 mmol/l (110 mg/dl)) saavutti merkitsevästi suurempi osa etsetimibin ja simvastatiinin 40 mg yhdistelmähoitoa saaneista (62 %) kuin pelkkää simvastatiinia 40 mg saaneista (25 %) potilaista. Vaikutukset veren rasva-arvoihin säilyivät viikkoon 53 eli avoimen jatkotutkimuksen loppuun asti.
Etsetimibin turvallisuutta ja tehoa ei ole tutkittu simvastatiinin yli 40 mg:n vuorokausiannoksiin yhdistettynä 10–17-vuotiaiden lasten ja nuorten hoidossa. Etsetimibin turvallisuutta ja tehoa yhdessä simvastatiinin kanssa ei ole tutkittu alle 10-vuotiaiden pediatristen potilaiden hoidossa.
Alle 17-vuotiaille potilaille annetun etsetimibihoidon pitkäaikaista tehoa aikuisiän sairastavuuden ja kuolleisuuden vähentämisessä ei ole tutkittu.
Sydän- ja verisuonitapahtumien ehkäisy
IMProved Reduction of Outcomes: Vytorin Efficacy International Trial (IMPROVE-IT) oli satunnaistettu, kaksoissokkoutettu, aktiivikontrolloitu monikeskustutkimus, johon osallistui 18 144 potilasta, jotka otettiin mukaan tutkimukseen 10 päivän kuluessa sairaalaan otosta äkillisen sepelvaltimo-oireyhtymän (joko äkillisen sydäninfarktin tai epästabiilin angina pectoriksen) vuoksi. Potilaiden LDL-kolesteroli oli ≤ 3,2 mmol/l (≤ 125 mg/dl) heidän tullessaan sairaalaan äkillisen sepelvaltimo-oireyhtymän vuoksi, jos he eivät käyttäneet rasva-arvoja alentavaa lääkitystä, tai ≤ 2,6 mmol/l (≤ 100 mg/dl), jos he käyttivät rasva-arvoja alentavaa lääkitystä. Kaikki potilaat satunnaistettiin suhteessa 1:1 saamaan joko etsetimibiä ja simvastatiinia 10/40 mg (n = 9067) tai simvastatiinia 40 mg (n = 9077), ja seuranta-ajan mediaani oli 6,0 vuotta.
Potilaat olivat iältään keskimäärin 63,6 vuotta; 76 % oli miehiä, 84 % oli valkoihoisia ja 27 %:lla oli diabetes. Keskimääräinen LDL-kolesteroliarvo tutkimuksen mukaanottokriteerin täyttymishetkellä oli 2,1 mmol/l (80 mg/dl) potilailla, jotka käyttivät rasva-arvoja alentavaa lääkitystä (n = 6390), ja 2,6 mmol/l (101 mg/dl) potilailla, jotka eivät käyttäneet rasva-arvoja alentavaa lääkitystä (n = 11 594). 34 % potilaista sai statiinihoitoa ennen sairaalaan ottoa tutkimuksen mukaanottokriteerinä olleen äkillisen sepelvaltimo-oireyhtymän vuoksi. Yhden vuoden kohdalla hoitoa jatkaneiden potilaiden keskimääräinen LDL-kolesteroliarvo oli 1,4 mmol/l (53,2 mg/dl) etsetimibiä ja simvastatiinia saaneiden ryhmässä ja 1,8 mmol/l (69,9 mg/dl) pelkkää simvastatiinia saaneiden ryhmässä. Yleensä rasva-arvot saatiin potilailta, jotka jatkoivat tutkimushoitoa.
Ensisijainen päätemuuttuja oli yhdistelmä, joka muodostui kardiovaskulaarikuolemasta, merkittävästä sepelvaltimotapahtumasta (määriteltiin kuolemaan johtamattomaksi sydäninfarktiksi, dokumentoiduksi sairaalahoitoa vaativaksi epästabiiliksi angina pectorikseksi tai miksi tahansa sepelvaltimon revaskularisaatiotoimenpiteeksi, joka tehdään vähintään 30 päivää hoitoryhmään satunnaistamisen jälkeen) ja kuolemaan johtamattomasta aivohalvauksesta. Tutkimus osoitti, että etsetimibihoito simvastatiinin lisänä tuotti lisähyötyä ensisijaisen yhdistelmäpäätemuuttujan eli kardiovaskulaarikuoleman, merkittävän sepelvaltimotapahtuman ja kuolemaan johtamattoman aivohalvauksen vähentämisen suhteen verrattuna pelkkään simvastatiiniin (riskin suhteellinen vähenemä 6,4 %, p = 0,016). Ensisijainen päätetapahtuma todettiin 2572:lla 9067 potilaasta (7 vuoden Kaplan-Meier-luku [KM] 32,72 %) etsetimibiä ja simvastatiinia saaneiden ryhmässä ja 2742:lla 9077 potilaasta (7 vuoden KM-luku oli 34,67 %) pelkkää simvastatiinia saaneiden ryhmässä (ks. kuva 1 ja taulukko 1). Tämän lisähyödyn odotetaan olevan samanlainen, kun etsetimibiä annetaan samanaikaisesti muiden statiinien kanssa, joiden on osoitettu tehokkaasti pienentävän sydän- ja verisuonitapahtumien riskiä. Kokonaiskuolleisuus säilyi muuttumattomana tässä korkean riskin ryhmässä (ks. taulukko 1).
Kokonaishyöty oli nähtävissä aivohalvausten suhteen; kuitenkin todettiin pieni ei-merkitsevä hemorragisten aivohalvausten määrän suureneminen etsetimibiä ja simvastatiinia saaneiden ryhmässä verrattuna pelkkää simvastatiinia saaneiden ryhmään (ks. taulukko 1). Hemorragisen aivohalvauksen riskiä ei ole arvioitu pitkällä aikavälillä, kun etsetimibiä annetaan yhtäaikaisesti tehokkaamman statiinin kanssa.
Etsetimibi/simvastatiini-yhdistelmähoidon vaikutus oli yleensä yhdenmukainen kokonaistulosten kanssa useissa alaryhmissä, jotka perustuivat mm. sukupuoleen, ikään, rotuun, aiemmin todettuun diabetekseen, lähtötilanteen rasva-arvoihin, aiempaan statiinihoitoon, aiemmin sairastettuun aivohalvaukseen ja hypertensioon.
Kuva 1: Etsetimibin/simvastatiinin vaikutus ensisijaiseen yhdistelmäpäätemuuttujaan, joka oli kardiovaskulaarikuolema, merkittävä sepelvaltimotapahtuma tai kuolemaan johtamaton aivohalvaus
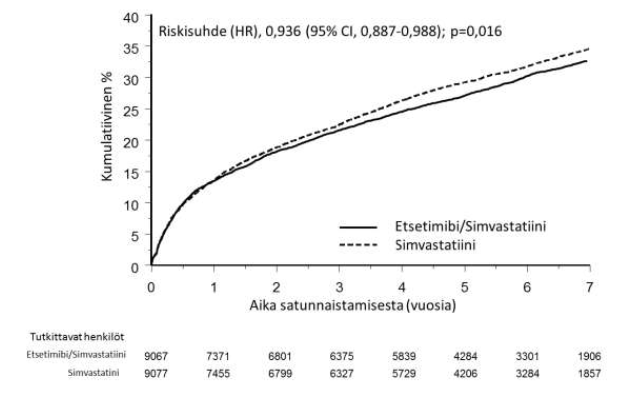
Taulukko 1
Merkittävät sydän- ja verisuonitapahtumat hoitoryhmittäin IMPROVE-IT-tutkimuksen kaikkien satunnaistettujen potilaiden osalta
Tulos | Etsetimibi/simvastatiini 10/40 mga (N=9067) | Simvastatiini 40 mgb (N=9077) | Riskisuhde (HR) (95 % CI) | p-arvo | ||
n | K-M % c | n | K-M % c | |||
Ensisijainen tehon yhdistelmäpäätemuuttuja | ||||||
(kardiovaskulaarikuolema, merkittävät sepelvaltimotapahtumat ja kuolemaan johtamaton aivohalvaus) | 2572 | 32,72 % | 2742 | 34,67 % | 0,936 (0,887, 0,988) | 0,016 |
Toissijaiset tehon yhdistelmäpäätemuuttujat | ||||||
kardiovaskulaarikuolema, merkittävät sepelvaltimotapahtumat ja kuolemaan johtamaton aivohalvaus | 1322 | 17,52 % | 1448 | 18,88 % | 0,912 (0,847, 0,983) | 0,016 |
Merkittävä sepelvaltimotapahtuma, kuolemaan johtamaton aivohalvaus, kuolema (kaikki syyt) | 3089 | 38,65 % | 3246 | 40,25 % | 0,948 (0,903, 0,996) | 0,035 |
Kardiovaskulaarikuolema, kuolemaan johtamaton sydäninfarkti, sairaalahoitoa vaativa epästabiili angina pectoris, mikä tahansa revaskularisaatio, kuolemaan johtamaton aivohalvaus | 2716 | 34,49 % | 2869 | 36,20 % | 0,945 (0,897, 0,996) | 0,035 |
Ensisijaisen yhdistelmäpäätemuuttujan osatekijät ja valikoidut tehon päätemuuttujat (mainittujen tapahtumien ensimmäiset ilmenemiset milloin tahansa) | ||||||
Kardioovaskulaarikuolema | 537 | 6,89 % | 538 | 6,84 % | 1,000 (0,887, 1,127) | 0,997 |
Merkittävä sepelvaltimotapahtuma: | ||||||
Kuolemaan johtamaton sydäninfarkti | 945 | 12,77 % | 1083 | 14,41 % | 0,871 (0,798, 0,950) | 0,002 |
Sairaalahoitoa vaativa epästabiili angina pectoris | 156 | 2,06 % | 148 | 1,92 % | 1,059 (0,846, 1,326) | 0,618 |
Sepelvaltimon revaskularisaatio 30 päivän jälkeen | 1690 | 21,84 % | 1793 | 23,36 % | 0,947 (0,886, 1,012) | 0,107 |
Kuolemaan johtamaton aivohalvaus | 245 | 3,49 % | 305 | 4,24 % | 0,802 (0,678, 0,949) | 0,010 |
Kaikki sydäninfarktit (kuolemaan johtaneet ja johtamattomat) | 977 | 13,13 % | 1118 | 14,82 % | 0,872 (0,800, 0,950) | 0,002 |
Kaikki aivohalvaukset (kuolemaan johtaneet ja johtamattomat) | 296 | 4,16 % | 345 | 4,77 % | 0,857 (0,734, 1,001) | 0,052 |
Ei-hemorraginen aivohalvaus d | 242 | 3,48 % | 305 | 4,23 % | 0,793 (0,670, 0,939) | 0,007 |
Hemorraginen aivohalvaus | 59 | 0,77 % | 43 | 0,59 % | 1,377 (0,930, 2,040) | 0,110 |
Kuolema mistä tahansa syystä | 1215 | 15,36 % | 1231 | 15,28 % | 0,989 (0,914, 1,070) | 0,782 |
a 6 %:lla potilaista annos suurennettiin etsetimibiin/simvastatiiniin 10/80 mg.
b 27 %:lla potilaista annos suurennettiin simvastatiiniin 80 mg.
c Kaplan-Meier-estimaatti 7 vuoden kohdalla.
d sisältää iskeemisen aivohalvauksen tai määrittelemättömän tyyppisen aivohalvauksen.
Kroonista munuaistautia sairastavien potilaiden merkittävien verisuonitautitapahtumien ehkäisy
SHARP-tutkimus (The Study of Heart and Renal Protection) oli monikansallinen, satunnaistettu, kaksoissokkoutettu lumevertailututkimus, jossa oli mukana 9438 kroonista munuaistautia sairastavaa potilasta, joista kolmannes oli dialyysihoidossa tutkimuksen alkaessa. Kiinteäannoksisen 10 mg etsetimibin ja 20 mg simvastatiinin yhdistelmän ryhmässä oli yhteensä 4650 potilasta ja lumeryhmässä 4620 potilasta, ja seuranta-ajan mediaani oli 4,9 vuotta. Potilaiden keski-ikä oli 62 vuotta, ja 63 % oli miehiä ja 72 % valkoihoisia. Diabetesta sairasti 23 % potilaista, ja glomerulusten laskennallinen suodatusnopeus (eGFR) oli keskimäärin 26,5 ml/min /1,73 m2 potilailla, jotka eivät olleet dialyysihoidossa. Rasva-arvot eivät olleet hyväksymiskriteeri. LDL-kolesteroliarvojen keskiarvo oli lähtötilanteessa 2,8 mmol/l (108 mg/dl). Vuoden kuluttua, kun mukana olivat myös potilaat, jotka eivät enää käyttäneet tutkimuslääkettä, LDL-kolesteroli oli laskenut 26 % pelkkää simvastatiinia 20 mg saaneessa ryhmässä ja 38 % 10 mg etsetimibiä ja 20 mg simvastatiinia saaneessa ryhmässä lumeryhmään verrattuna.
SHARP-tutkimuksen tutkimussuunnitelman mukainen ensisijainen vertailu oli hoitoaikeeseen perustuva (intention-to-treat) analyysi ”merkittävistä verisuonitautitapahtumista” (major vascular events, MVE, joita olivat kuolemaan johtamaton sydäninfarkti tai sydänkuolema, aivohalvaus tai mikä tahansa revaskularisaatiotoimenpide) vain niistä potilaista, jotka oli alun perin satunnaistettu etsetimibi-simvastatiiniryhmään (n = 4193) tai lumeryhmään (n = 4191). Toissijaisissa analyyseissä analysoitiin sama tapahtumien yhdistelmä etsetimibi-simvastatiiniryhmään (n = 4650) tai lumeryhmään (n = 4620) (tutkimuksen lähtötilanteessa tai yhden vuoden kuluttua) satunnaistetussa koko kohortissa sekä tämän yhdistelmän eri osatekijät.
Ensisijaisen päätemuuttujan analyysi osoitti, että etsetimibi yhdessä simvastatiinin kanssa vähensi merkittävien verisuonitapahtumien riskiä merkitsevästi (tapahtumia todettiin 749 potilaalla lumeryhmässä ja 639 potilaalla etsetimibi-simvastatiiniryhmässä), ja riskin suhteellinen vähenemä oli 16 % (p = 0,001).
Tässä tutkimusasetelmassa ei kuitenkaan voitu erikseen arvioida etsetimibin osuutta yksittäisenä komponenttina merkittävien verisuonitautitapahtumien riskiä merkitsevästi pienentäneessä tehossa kroonista munuaistautia sairastavilla potilailla.
Taulukossa 2 on esitetty merkittävien verisuonitautitapahtumien yksittäiset osatekijät kaikilla satunnaistetuilla potilailla. Etsetimibi yhdessä simvastatiinin kanssa pienensi merkitsevästi aivohalvauksen ja revaskularisaatioiden riskiä, ja kuolemaan johtamattomien sydäninfarktien ja sydänkuolemien määrässä todettiin numeerisia eroja etsetimibi-simvastatiiniyhdistelmän hyväksi, mutta erot eivät olleet merkitseviä.
Taulukko 2
Merkittävät verisuonitautitapahtumat hoitoryhmittäin kaikilla satunnaistetuilla potilailla SHARP-tutkimuksessaa
Tapahtuma | Etsetimibi 10 mg yhdessä 20 mg simvastatiiniannoksen kanssa (N=4650) | Lume (N=4620) | Riskisuhde (RR) (95 % CI) | p-arvo |
Merkittävät verisuonitautitapahtumat | 701 (15,1 %) | 814 (17,6 %) | 0,85 (0,77–0,94) | 0,001 |
Kuolemaan johtamaton sydäninfarkti | 134 (2,9 %) | 159 (3,4 %) | 0,84 (0,66–1,05) | 0,12 |
Sydänkuolema | 253 (5,4 %) | 272 (5,9 %) | 0,93 (0,78–1,10) | 0,38 |
Aivohalvaus | 171 (3,7 %) | 210 (4,5 %) | 0,81 (0,66–0,99) | 0,038 |
Muu kuin aivoverenvuodosta johtuva aivohalvaus | 131 (2,8 %) | 174 (3,8 %) | 0,75 (0,60–0,94) | 0,011 |
Aivoverenvuodosta johtuva halvaus | 45 (1,0 %) | 37 (0,8 %) | 1,21 (0,78–1,86) | 0,40 |
Mikä tahansa revaskularisaati | 284 (6,1 %) | 352 (7,6 %) | 0,79 (0,68–0,93) | 0,004 |
Merkittävät ateroskleroottiset tapahtumat (MAE)b | 526 (11,3 %) | 619 (13,4 %) | 0,83 (0,74–0,94) | 0,002 |
a Hoitoaikeeseen perustuva (intention-to-treat) analyysi kaikista SHARP-pot ilaista, jotka satunnaistettiin etsetimibi-simvastatiini- tai lumeryhmään joko lähtötilanteessa tai 1 vuoden kuluttua.
b Merkit tävät ateroskleroottiset tapahtumat (major atherosclerotic events, MAE) määriteltiin yhdistelmäpäätemuuttujaksi, johon kuuluivat kuolemaan johtamaton sydäninfarkti, sepelvaltimotautikuolema, muu kuin aivoverenvuodosta johtuva aivohalvaus ja mikä tahansa revaskularisaatio.
Etsetimibin ja simvastatiinin yhdessä aikaansaama LDL-kolesterolin absoluuttinen vähenemä oli pienempi potilailla, joilla oli matalampi LDL-kolesterolin lähtötaso (< 2,5 mmol/l), ja potilailla, jotka olivat dialyysihoidossa lähtötilanteessa, kuin muilla potilailla, ja vastaavat riskin vähenemät olivat vähäisemmät näissä kahdessa ryhmässä.
Homotsygoottinen familiaalinen hyperkolesterolemia (HoFH)
12 viikon satunnaistettuun kaksoissokkotutkimukseen otettiin mukaan 50 potilasta, joilla oli kliinisesti ja/tai genotyypin perusteella diagnosoitu HoFH ja jotka saivat atorvastatiini- tai simvastatiinihoitoa (40 mg) mahdollisesti yhdessä LDL-afereesin kanssa. Etsetimibi yhdessä atorvastatiinin (40 tai 80 mg) tai simvastatiinin (40 tai 80 mg) kanssa alensi LDL-kolesterolia merkitsevästi, 15 %:lla, verrattuna monoterapiana annetun simvastatiinin tai atorvastatiinin annoksen nostoon 40 mg:sta 80 mg:an.
Aorttastenoosi
SEAS-tutkimus (Simvastatin and Ezetimibe for the Treatment of Aortic Stenosis) oli kaksoissokkoutettu, plasebokontrolloitu monikeskustutkimus. Tutkimukseen osallistui 1873 potilasta, joilla oli oireeton aorttastenoosi (AS) ja joiden dopplerkuvauksella mitattu aortan huippuvirtausnopeus oli 2,5–4,0 m/s. Tutkimus kesti keskimäärin 4,4 vuotta (mediaani). Tutkimukseen hyväksyttiin vain potilaat, joiden ei katsottu tarvitsevan statiinihoitoa ateroskleroottisen sydän- ja verisuonisairauden riskin pienentämiseksi. Potilaat jaettiin satunnaistetusti suhteessa 1:1 plaseboa tai etsetimibin (10 mg/vrk) ja simvastatiinin (40 mg/vrk) yhdistelmähoitoa saavaan ryhmään.
Ensisijainen päätemuuttuja oli merkittävien sydän- ja verisuonitapahtumien yhdistetty määrä. Näihin kuuluivat sydän- ja verisuonikuolema, aorttakeinoläppäleikkaus, aorttastenoosin etenemisestä johtuva kongestiivinen sydämen vajaatoiminta, ei-kuolemaan johtanut sydäninfarkti, sepelvaltimoiden ohitusleikkaus, sepelvaltimoiden pallolaajennushoito, epästabiilista angina pectoriksesta johtuva sairaalahoito ja ei-hemorraginen aivohalvaus. Tärkeimpiä toissijaisia päätemuuttujia olivat yhdistelmät ensisijaisen päätemuuttujan tapahtumaluokkien alaryhmistä.
Etsetimibi-simvastatiinihoito (10/40 mg) ei pienentänyt merkittävien sydän- ja verisuonitapahtumien riskiä merkitsevästi plaseboon verrattuna.
Ensisijainen lopputulosmuuttuja esiintyi 333 potilaalla (35,3 %) etsetimibi-simvastatiiniryhmässä ja 355 potilaalla (38,2 %) plaseboryhmässä (riskisuhde etsetimibisimvastatiiniryhmässä 0,96; 95 %:n luottamusväli 0,83–1,12; p = 0,59). Aorttakeinoläppä asennettiin 267 potilaalle (28,3 %) etsetimibi-simvastatiiniryhmässä ja 278 potilaalle (29,9 %) plaseboryhmässä (riskisuhde 1,00; 95 %:n luottamusväli 0,84–1,18; p = 0,97). Iskeemisiä sydän- ja verisuonitapahtumia esiintyi vähemmän etsetimibi-simvastatiiniryhmässä (n = 148) kuin plaseboryhmässä (n = 187) (riskisuhde 0,78; 95 %:n luottamusväli 0.63–0,97; p = 0,02). Tämä johtui pääasiassa ohitusleikkauspotilaiden pienemmästä määrästä.
Syöpää esiintyi yleisemmin etsetimibi-simvastatiiniryhmässä (105 tapausta; plaseboryhmässä 70 tapausta, p = 0.01). Tämän havainnon kliininen merkitys on epävarma, sillä laajemmassa SHARP-tutkimuksessa ei havaittu eroa niiden potilaiden kokonaismäärässä, joilla todettiin mikä tahansa syöpä (438 etsetimibi-simvastatiiniryhmässä ja 439 lumeryhmässä). Lisäksi IMPROVE-IT-tutkimuksessa niiden potilaiden kokonaismäärä, joilla todettiin mikä tahansa uusi pahanlaatuisuus (853 etsetimibi-simvastatiini ryhmässä ja 863 simvastatiiniryhmässä) eivät eronneet merkitsevästi ja siksi SHARP-tutkimus ja IMPROVE-IT-tutkimus eivät vahvistaneet SEAS-tutkimuksen havaintoa.
Farmakokinetiikka
Imeytyminen
Etsetimibi imeytyy nopeasti suun kautta annettaessa ja konjugoituu merkittävässä määrin farmakologisesti aktiiviseksi fenoliglukuronidiksi (etsetimibiglukuronidiksi). Etsetimibiglukuronidin keskimääräinen maksimipitoisuus plasmassa (Cmax) saavutetaan 1–2 tunnissa ja etsetimibin maksimipitoisuus 4–12 tunnissa. Etsetimibin absoluuttista hyötyosuutta ei voida määrittää, sillä valmiste on lähes täysin liukenematon vesipitoisiin injektionesteisiin.
Samanaikaisesti nautittu (rasvapitoinen tai rasvaton) ruoka ei vaikuta suun kautta otetun etsetimibin hyötyosuuteen käytettäessä 10 mg:n etsetimibitabletteja. Etsetimibi voidaan ottaa aterian yhteydessä tai tyhjään mahaan
Jakautuminen
Etsetimibi sitoutuu 99,7-prosenttisesti ja etsetimibiglukuronidi 88–92-prosenttisesti plasman proteiineihin.
Biotransformaatio
Etsetimibi metaboloituu pääasiassa ohutsuolessa ja maksassa glukuronidikonjugaation (II vaiheen reaktio) kautta ja erittyy sen jälkeen sappeen. Kaikilla tutkituilla lajeilla on todettu hyvin vähäistä oksidatiivista metaboliaa (I vaiheen reaktio). Etsetimibi ja etsetimibiglukuronidi ovat tärkeimmät plasmassa tavatut lääkeaineesta peräisin olevat yhdisteet, ja etsetimibin osuus on 10–20 % ja etsetimibiglukuronidin osuus 80–90 % koko lääkeaineen pitoisuudesta plasmassa. Sekä etsetimibi että etsetimibiglukuronidi eliminoituvat hitaasti plasmasta, ja viitteitä merkittävästä enterohepaattisesta kiertokulusta on havaittu. Etsetimibin ja etsetimibiglukuronidin puoliintumisaika on noin 22 tuntia.
Eliminaatio
Koehenkilöille suun kautta annetun 14C-etsetimibiannoksen (20 mg) jälkeen etsetimibin kokonaispitoisuus vastasi noin 93 % plasman kokonaisradioaktiivisuudesta. Ulosteeseen erittyi noin 78 % ja virtsaan noin 11 % radioaktiivisesti merkitystä annoksesta 10 päivän keräysjakson aikana. 48 tunnin kuluttua plasmassa ei ollut havaittavaa radioaktiivisuutta.
ERITYISRYHMÄT
Pediatriset potilaat
Etsetimibin farmakokinetiikka on samanlainen 6 vuotta täyttäneillä lapsilla ja aikuisilla. Alle 6-vuotiaiden lasten ikäryhmästä ei ole farmakokineettisiä tutkimustuloksia. Kliiniset kokemukset lasten ja nuorten hoidosta kattavat HoFH- ja HeFH-potilaat.
Ikääntyneet
Etsetimibin kokonaispitoisuus plasmassa on iäkkäiden (≥ 65-vuotiaat) elimistössä noin kaksi kertaa suurempi kuin nuorten (18–45-vuotiaat). LDL-kolesteroliarvon lasku ja turvallisuusprofiili ovat vertailukelpoiset Ezetimib Krkaa saaneilla iäkkäillä ja nuorilla koehenkilöillä. Annostusta ei siis tarvitse muuttaa iäkkäitä potilaita hoidettaessa.
Maksan vajaatoiminta
Etsetimibin 10 mg:n kerta-annoksen jälkeen etsetimibin kokonaispitoisuuden AUC (keskiarvo) oli lievää maksan vajaatoimintaa (Child-Pughin asteikolla 5 tai 6) sairastavilla potilailla noin 1,7-kertainen terveisiin koehenkilöihin verrattuna. Kohtalaista maksan vajaatoimintaa (Child-Pughin asteikolla 7–9) sairastaville potilaille tehdyssä 14 päivän moniannostutkimuksessa (10 mg/vrk) etsetimibin kokonaispitoisuuden AUC (keskiarvo) oli ensimmäisenä ja neljäntenätoista tutkimuspäivänä noin 4-kertainen terveiden koehenkilöiden vastaavaan arvoon verrattuna. Annostusta ei tarvitse muuttaa lievää maksan vajaatoimintaa sairastavia potilaita hoidettaessa. Koska ei tiedetä, kuinka suurentunut etsetimibipitoisuus vaikuttaa kohtalaista tai vaikeaa maksan vajaatoimintaa (Child-Pughin asteikolla > 9) sairastaviin potilaisiin, Ezetimib Krkaa ei suositella näille potilaille (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Munuaisten vajaatoiminta
Kun etsetimibiä annettiin 10 mg:n kerta-annoksena vaikeaa munuaisten vajaatoimintaa sairastaville potilaille (n = 8; kreatiniinipuhdistuman keskiarvo ≤ 30 ml/min/1,73 m2), etsetimibin kokonaispitoisuuden AUC (keskiarvo) oli noin 1,5-kertainen terveisiin koehenkilöihin (n = 9) verrattuna. Tätä tulosta ei pidetä kliinisesti merkitsevänä. Annostusta ei tarvitse muuttaa munuaisten vajaatoimintaa sairastavia potilaita hoidettaessa.
Lisäksi yhdessä tämän tutkimuksen potilaassa (munuaisensiirtopotilas, joka sai useita lääkkeitä, mm. siklosporiinia) etsetimibin kokonaispitoisuus nousi 12-kertaiseksi.
Sukupuoli
Etsetimibin kokonaispitoisuus plasmassa on naisilla jonkin verran suurempi (noin 20 %) kuin miehillä. LDL-kolesteroliarvon lasku ja turvallisuusprofiili ovat etsetimibihoitoa saaneilla miehillä ja naisilla vertailukelpoiset. Annostusta ei siis tarvitse muuttaa sukupuolen perusteella.
Prekliiniset tiedot turvallisuudesta
Etsetimibin pitkäaikaistoksisuutta selvittelevissä eläinkokeissa ei havaittu toksisia vaikutuksia missään kohde-elimissä. Koirilla, jotka saivat etsetimibiä (≥ 0,03 mg/kg/vrk) neljän viikon ajan, sappirakon sapen kolesterolipitoisuus nousi 2,5–3,5-kertaiseksi. Vuoden kestäneessä tutkimuksessa, jossa koirat saivat etsetimibiä enintään 300 mg/kg/vrk, ei kuitenkaan havaittu normaalia runsaampaa sappikivien muodostumista eikä muita hepatobiliaarisia vaikutuksia. Näiden löydösten merkitystä ihmiselle ei tunneta. Etsetimibin terapeuttiseen käyttöön liittyvää sappikivien muodostumisen riskiä ei voida sulkea pois.
Etsetimibin ja statiinin yhdistelmähoidosta tehdyissä tutkimuksissa todetut toksiset vaikutukset olivat pääasiassa statiineille tyypillisiä toksisia vaikutuksia. Jotkut näistä vaikutuksista olivat voimakkaampia kuin pelkän statiinilääkityksen aikana. Tämän katsotaan johtuvan yhdistelmähoitoon liittyvistä farmakokineettisistä ja farmakodynaamisista yhteisvaikutuksista. Kliinisissä tutkimuksissa ei esiintynyt tällaisia yhteisvaikutuksia. Myopatioita esiintyi rotilla vain annostasoilla, jotka olivat moninkertaisia ihmisen terapeuttiseen annokseen verrattuna (noin 20 kertaa statiinien AUC-arvo ja 500–2000 kertaa aktiivisten metaboliittien AUC-arvo).
In vivo- ja in vitro ‑analyysisarjoissa etsetimibillä yksinään tai yhdessä statiinien kanssa annettuna ei havaittu geenitoksisia vaikutuksia. Etsetimibin pitkäaikaisten karsinogeenisuustutkimusten tulokset olivat negatiivisia. Etsetimibi ei vaikuttanut uros- eikä naarasrottien fertiliteettiin, sen ei havaittu aiheuttavan epämuodostumia rotille eikä kaniineille eikä se vaikuttanut prenataaliseen eikä postnataaliseen kehitykseen. Etsetimibi läpäisi tiineiden rottien ja kaniinien istukan, kun sitä annettiin toistuvina annoksina 1000 mg/kg/vrk. Etsetimibin ja statiinien samanaikainen käyttö ei aiheuttanut epämuodostumia rotille. Tiineillä kaniineilla todettiin vähäisessä määrin luuston epämuodostumia (yhteensulautuneita rinta- ja häntänikamia, häntänikamien vähenemistä). Etsetimibin ja lovastatiinin yhteiskäyttö aiheutti alkioiden kuolemaan johtaneita vaikutuksia.
Farmaseuttiset tiedot
Apuaineet
Natriumlauryylisulfaatti
Povidoni K30
Mannitoli (E421)
Kroskarmelloosinatrium
Mikrokiteinen selluloosa (E460)
Natriumstearyylifumaraatti
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
5 vuotta
Säilytys
Säilytä alkuperäispakkauksessa. Herkkä kosteudelle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
EZETIMIB KRKA tabletti
10 mg (L:ei) 30 fol (4,86 €), 100 fol (9,39 €)
PF-selosteen tieto
Läpipainopakkaus (OPA/Al/PVC//Al): 14, 28, 30, 50, 56, 60, 90, 98, 100 tablettia rasiassa.
Läpipainopakkaus (yksittäispakatut läpipainopakkaukset, OPA/Al/PVC//Al): 14 x 1, 28 x 1, 30 x 1, 50 x 1, 56 x 1, 60 x 1, 90 x 1, 98 x 1, 100 x 1 tablettia rasiassa.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Valkoinen tai luonnonvalkoinen kapselinmuotoinen viistoreunainen tabletti. Tabletin mitat: 8 x 4 mm.
Käyttö- ja käsittelyohjeet
Ei erityisvaatimuksia.
Korvattavuus
EZETIMIB KRKA tabletti
10 mg 30 fol, 100 fol
- Alempi erityiskorvaus (65 %). Krooninen sepelvaltimotauti ja krooniseen sepelvaltimotautiin liittyvä rasva-aineenvaihdunnan häiriö (206), Periytyvät rasva-aineenvaihdunnan vaikea-asteiset häiriöt (familiaalinen hyperkolesterolemia ja tyyppi III dyslipoproteinemia) (211).
- Peruskorvaus (40 %).
ATC-koodi
C10AX09
Valmisteyhteenvedon muuttamispäivämäärä
31.10.2016
Yhteystiedot
Tekniikantie 14
02150 Espoo
Suomi
020-7545330
www.krka.biz
info.fi@krka.biz
