IXIARO injektioneste, suspensio
Vaikuttavat aineet ja niiden määrät
1 annos (0,5 ml) IXIAROa sisältää:
Japanin aivotulehdusviruskantaa SA14-14-2 (inaktivoitu)1,2 6 AU3, joka vastaa ≤ 460 ng:n ED50-arvon väkevyyttä.
1 tuotettu Vero-soluissa
2 adsorboitu alumiinihydroksidiin, hydratoitu (noin 0,25 milligrammaa Al3+)
3 antigeeniyksikköä
Apuaineet, joiden vaikutus tunnetaan:
Tämä lääkevalmiste sisältää kaliumia alle 1 mmol (39 mg) per 0,5 ml yksittäinen annos eli sen voidaan sanoa olevan ”kaliumiton”, ja alle 1 mmol natriumia (23 mg) per 0,5 ml yksittäinen annos, eli sen voidaan sanoa olevan ”natriumiton”. Tämä tuote saattaa sisältää jäännöksiä natriummetabisulfiitista, joka on havaitsemisrajan alapuolella.
Fosfaattipuskuroidun suolaliuoksen 0,0067 M (PO4:ssä) koostumus on seuraava:
NaCl – 9 mg/ml
KH2PO4 – 0,144 mg/ml
Na2HPO4 – 0,795 mg/ml.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, suspensio.
Kliiniset tiedot
Käyttöaiheet
IXIAROa käytetään aikuisilla, nuorilla, lapsilla ja 2 kuukautta täyttäneillä imeväisillä aktiivisen immunisaation hankkimiseen Japanin aivotulehdusta vastaan.
IXIAROn käyttöä tulee harkita henkilöillä, jotka voivat altistua aivotulehdukselle matkustaessaan tai työtehtävissään.
Annostus ja antotapa
Annostus
Aikuiset (18 – ≤ 65-vuotiaat)
Perusrokotus koostuu kahdesta erillisestä 0,5 ml:n annoksesta, jotka annetaan seuraavan tavanomaisen aikataulun mukaan:
Ensimmäinen annos päivänä 0.
Toinen annos: 28 päivää ensimmäisen annoksen jälkeen.
Nopea aikataulu
18 – ≤ 65-vuotiaat henkilöt voidaan rokottaa nopean aikataulun mukaisesti seuraavasti:
Ensimmäinen annos päivänä 0.
Toinen annos: 7 päivää ensimmäisen annoksen jälkeen.
Molemmilla aikatauluilla perusrokotukset on annettava vähintään viikkoa ennen mahdollista altistusta Japanin aivotulehdusvirukselle (JEV) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Jos rokotussarjan ensimmäisen annos on IXIARO-rokote, on suositeltavaa täydentää 2-annoksinen perusrokotus IXIARO-rokotteella.
Jos kahden injektion perusrokotusta ei saateta loppuun, täydellistä suojaa sairautta vastaan ei ehkä saavuteta. Tutkimustiedot ovat osoittaneet, että viimeistään 11 kuukauden kuluttua ensimmäisestä annoksesta annettu toinen injektio johtaa korkeaan serokonversio-asteeseen (ks. kohta Farmakodynamiikka).
Tehosteannos
Tehosteannos (kolmas annos) tulisi antaa toisen vuoden (ts. 12–24 kuukauden) kuluessa perusrokotuksen jälkeen ennen mahdollista uudelleenaltistumista Japanin aivotulehdusvirukselle (JEV).
Jos Japanin aivotulehduksen tartuntariski on jatkuva (laboratoriohenkilökunta tai endeemisellä alueella asuvat henkilöt), henkilöiden tulisi saada tehosteannos 12 kuukauden kuluttua perusrokotuksesta (ks. kohta Farmakodynamiikka). Pitkän aikavälin immuunisaation seurantatiedot ensimmäisen, 12–24 kuukautta perusrokotuksesta annetun tehosteannoksen jälkeen osoittavat, että toinen tehosteannos tulisi antaa 10 vuoden kuluttua ensimmäisestä tehosteannoksesta ennen mahdollista altistumista JE-virukselle.
Iäkkäät henkilöt (>65-vuotiaat)
Ensimmäinen rokotesarja koostuu kahdesta erillisestä 0,5 ml:n annoksesta seuraavan tavanomaisen aikataulun mukaan:
Ensimmäinen annos päivänä 0.
Toinen annos 28 päivää ensimmäisen annoksen jälkeen.
Perusrokotus tulee antaa kokonaisuudessaan vähintään viikkoa ennen mahdollista altistumista Japanin aivotulehdusvirukselle (JEV) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
On suositeltavaa, että ensimmäisen IXIARO-annoksen saaneet ottavat koko 2 annoksen perusrokotuksen IXIARO-valmistetta.
Jos kahden rokotteen perusrokotusta ei ole otettu kokonaan, täydellistä rokotussuojaa sairautta vastaan ei välttämättä saavuteta. Saatavilla oleva tutkimustieto osoittaa, että viimeistään 11 kuukautta ensimmäisen annoksen jälkeen saatu toinen annos johtaa korkeaan serokonversion asteeseen (ks. kohta Farmakodynamiikka)
Tehosteannos
Kuten monien rokotteiden kohdalla, iäkkäiden henkilöiden (65-vuotiaiden ja sitä vanhempien) immuunivaste IXIARO-rokotteelle on matalampi kuin nuorempien aikuisten. Rokotesuojan kestosta iäkkäillä henkilöillä ei ole varmuutta, ja siksi tehosteannosta (3. annos) tulisi harkita ennen lisäaltistusta JE-virukselle. Tehosteannoksen jälkeisestä pitkän aikavälin immunisaatiosta ei ole tutkimustietoa.
Pediatrinen populaatio
Lapset ja nuoret, vähintään 3 vuoden ikäiset mutta alle 18-vuotiaat
Perusrokotus koostuu kahdesta erillisestä 0,5 ml:n annoksesta, jotka annetaan seuraavan aikataulun mukaan:
Ensimmäinen annos päivänä 0.
Toinen annos 28 päivää ensimmäisen annoksen jälkeen.
Lapset, vähintään 2 kuukauden ikäiset mutta alle 3-vuotiaat
Perusrokotus koostuu kahdesta erillisestä 0,25 ml:n annoksesta, jotka annetaan seuraavan aikataulun mukaan:
Ensimmäinen annos päivänä 0.
Toinen annos 28 päivää ensimmäisen annoksen jälkeen.
Katso kohdasta Käyttö- ja käsittelyohjeet ohjeet 0,25 ml annoksen valmistamiseen lapsille, jotka ovat vähintään 2 kuukauden ikäisiä mutta alle 3-vuotiaita.
On suositeltavaa, että ensimmäisen IXIARO-annoksen saaneet ottavat koko 2 annoksen perusrokotuksen.
Tehosteannos (lapset ja nuoret)
Tehosteannos (3. annos) tulee antaa kahden vuoden sisällä (12–24 kk kuluessa) perusrokotuksen jälkeen ennen mahdollista altistusta JE-virukselle.
Lasten ja nuorten, joilla on jatkuva Japanin aivotulehduksen riski (endeemisellä alueella asuvat henkilöt) tulee saada tehosteannos 12 kuukauden kuluttua perusrokotuksesta (ks. kohta Farmakodynamiikka).
3–18-vuotiaille lapsille ja nuorille tulee antaa yksi 0,5 ml:n tehosteannos.
Vähintään 14 kk mutta alle 3-vuotialle lapsille annetaan yksi 0,25 ml:n tehosteannos.
Katso kohdasta Käyttö- ja käsittelyohjeet ohjeet 0,25 ml annoksen valmistamiseen lapsille, jotka ovat vähintään 2 kuukauden ikäisiä mutta alle 3-vuotiaita.
Pitkän aikavälin seurantatietoa immunisaatiosta lapsilla ensimmäisen, vuosi perusrokotuksesta annetun tehosteannoksen jälkeen ei ole saatavilla kahta vuotta pidemmälle.
Lapset, alle 2 kuukauden ikäiset
IXIARO-valmisteen turvallisuutta ja tehoa alle 2 kuukauden ikäisten lasten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Antotapa
Rokote tulee antaa injektiona hartialihakseen. Imeväisillä sen voi injisoida reiden anterolateraaliseen osaan. IXIAROa ei pidä koskaan injisoida suonensisäisesti.
Kun IXIAROa annetaan samanaikaisesti muiden injisoitavien rokotteiden kanssa, ne tulee antaa eri ruiskulla vastakkaisiin kohtiin.
Poikkeustapauksissa IXIARO voidaan antaa ihonalaisena ruiskeena potilaille, joilla on trombosytopenia tai verenvuotohäiriöitä, koska lihaksensisäisestä injektiosta voi seurata verenvuotoa. Ihonalaisesti annetun rokotteen teho voi jäädä normaalia heikommaksi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). On huomattava, että rokotteen tehoa koskevat kliiniset tiedot eivät tue ihonalaista antoreittiä.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille tai rokotteen ainesosien jäämille, joita ovat protamiinisulfaatti, formaldehydi, naudan seerumin albumiini, isäntäsolun DNA, natriummetabisulfiitti (katso osio 2.), isäntäsolun proteiini.
Ensimmäisestä rokoteannoksesta yliherkkyysreaktioita saaville henkilöille ei tule antaa toista annosta.
Rokotteen antoa on lykättävä akuuteista vakavista kuumetiloista kärsivillä potilailla.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi annettavan tuotteen nimi ja eränumero on kirjattava selvästi.
Kuten injisoitavien rokotteiden kanssa yleensä, saatavilla tulee olla asiantuntevaa lääketieteellistä hoitoa ja valvontaa niitä harvoja tapauksia varten, että rokotteen saaneelle henkilölle tulee rokotteen antamisen jälkeen anafylaktinen reaktio.
IXIAROa ei saa missään tapauksessa antaa suonensisäisesti.
Kuten mikään muukaan rokote, IXIARO-rokote ei välttämättä anna suojaa kaikissa tapauksissa.
IXIARO ei suojaa jonkin toisen pieneliön aiheuttamalta aivotulehdukselta.
Kuten muitakaan lihakseen annettavia injektioita, tätäkään rokotetta ei tule antaa lihakseen henkilöille, joilla on trombosytopenia, verenvuototauti tai jokin muu verenvuotohäiriö (ks. kohta Annostus ja antotapa).
Positiivinen serokonversio on havaittu 29,4 prosentilla rokotetuista aikuisista 10 päivän kuluttua ensimmäisen rokotteen antamisesta lihakseen ja 97,3 prosentilla viikon kuluttua toisesta rokotteesta lihakseen, kun rokote on annettu tavanomaisen aikataulun mukaan. Nopean aikataulun mukaan annettuna positiivinen serokonversio on havaittu 99 prosentilla seitsemän päivän kuluttua toisesta rokotuksesta. Primaari-immunisaatio tulisi olla hankittuna vähintään viikkoa ennen mahdollista altistumista Japanin aivotulehdusvirukselle (JEV, Japanese encephalitis virus).
Suoja Japanin aivotulehdusta vastaan ei ole varmistettu ennen toisen annoksen saamista.
Yhteisvaikutukset
IXIAROn samanaikainen annostelu muiden rokotteiden kanssa:
IXIAROn samanaikaista antamista inaktivoidun hepatiitti A -rokotteen ja inaktivoidun rabiesrokotteen kanssa kahden eri aikataulun mukaan on tutkittu kliinisissä tutkimuksissa. Immuunivasteissa Japanin aivotulehdusvirus- (JEV) sekä hepatiitti A -virus- (HAV) ja rabiesvirus-rokotteille ei havaittu häiriöitä (ks. kohta Farmakodynamiikka)
IXIAROn ja muiden tutkittavien rokotteiden turvallisuusprofiili ei vaarantunut, kun rokotteita annettiin samanaikaisesti.
Immunosuppressiivista hoitoa saavilla tai immuunipuutosta sairastavilla potilailla riittävää immuunivastetta ei välttämättä saavuteta.
Pediatriset potilaat
Yhteisvaikutuksia ei ole tutkittu lapsille eikä nuorille tehdyissä tutkimuksissa.
Raskaus ja imetys
Raskaus
IXIAROn käytöstä raskaana olevilla naisilla on vain vähän tietoja.
Eläinkokeissa on tehty havaintoja, joiden kliininen relevanssi on epäselvä (ks. kohta Prekliiniset tiedot turvallisuudesta).
Varotoimena IXIAROn käyttöä raskauden aikana tulee välttää.
Imetys
Ei tiedetä, erittyykö IXIAROa ihmisen maitoon.
Mitään vaikutuksia rintamaitoa saaviin vastasyntyneisiin/vauvoihin ei odoteta, koska imettävän naisen systeeminen altistus IXIAROlle on häviävän pieni. Tietojen puutteessa IXIAROn käyttöä imetyksen aikana tulisi kuitenkin varmuuden vuoksi välttää.
Hedelmällisyys
Rotilla tehdyssä tutkimuksessa ei saatu viitteitä rokotteeseen liittyvistä vaikutuksista naaraiden lisääntymiseen, sikiön painoon, eloonjäämiseen eikä jälkeläisten kehitykseen.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
IXIAROlla ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Tiivistelmä turvallisuusprofiilista
IXIAROn turvallisuutta tutkittiin kontrolloiduissa ja kontrolloimattomissa kliinisissä tutkimuksissa, joissa oli mukana 5021 tervettä aikuista (maista, joissa tauti ei ole endeeminen) ja 1559 lasta ja nuorta (suurimmaksi osaksi maista, joissa se on endeeminen).
Systeemisiä haittavaikutuksia ilmeni noin 40 prosentilla ja injektiokohdan reaktioita noin 54 prosentilla rokotetuista. Haittavaikutukset ilmenevät yleensä rokotteen antamista seuraavien kolmen päivän aikana. Ne ovat tavallisesti lieviä ja menevät ohi muutaman päivän kuluessa. Ensimmäisen ja toisen annoksen tai tehosteannoksen välillä ei havaittu haittavaikutusten lisääntymistä aikuisilla.
Aikuisilla yleisimmin ilmoitettuja haittavaikutuksia ovat päänsärky (20 % tutkittavista), lihaskipu (13 %), injektiokohdan kipu (33 %) ja arkuus (33 %) sekä väsymys (12,9 %).
Lapsilla ja nuorilla yleisimpiä haittavaikutuksia ovat kuume, ripuli, influenssan kaltainen sairaus, ärtyisyys sekä injektiokohdan kipu, injektiokohdan arkuus ja injektiokohdan punoitus (ks. taulukko 1).
Haittavaikutukset luetellaan seuraavien yleisyysluokkien mukaisesti:
Hyvin yleinen: ≥ 1/10
Yleinen: ≥ 1/100 – < 1/10
Melko harvinainen: ≥1/1 000 – < 1/100
Harvinainen: ≥1/10 000 – < 1/1 000
Aikuiset ja iäkkäät (>65-vuotiaat) potilaat
Veri ja imukudos
Melko harvinainen: lymfadenopatia
Harvinainen: trombosytopenia
Hermosto
Hyvin yleinen: päänsärky
Melko harvinainen: migreeni, heitehuimaus
Harvinainen: tuntoharha, hermotulehdus, makuhäiriöt, synkopee*
Silmät
Harvinainen; silmäluomen turvotus
Kuulo ja tasapainoelin
Melko harvinainen: huimaus
Sydän
Harvinainen: sydämentykytys, sydämen tiheälyöntisyys
Hengityselimet, rintakehä ja välikarsina
Harvinainen: hengenahdistus
Ruoansulatuselimistö
Yleinen: pahoinvointi
Melko harvinainen: oksentelu, ripuli, vatsakipu
Iho ja ihonalainen kudos
Melko harvinainen: ihottuma, kutina, liikahikoilu
Harvinainen: nokkosihottuma, punoitus
Luusto, lihakset ja sidekudos
Hyvin yleinen: lihaskipu
Melko harvinainen: luu- ja lihasjäykkyys, nivelsärky Harvinainen: raajakipu,
Yleisoireet ja antopaikassa todettavat haitat
Hyvin yleinen: pistoskohdan kipu ja arkuus, väsymys
Yleinen: influenssan kaltainen sairaus, kuume, muut pistoskohdan reaktiot, kuten punoitus, kovettuminen, turvotus, kutina
Melko harvinainen: vilunväristykset, huonovointisuus, voimattomuus Harvinainen: perifeerinen edeema
Tutkimukset
Melko harvinainen: kohonneet maksaentsyymiarvot
*raportoitu myös markkinoilletulon jälkeisistä kokemuksista
Pediatriset potilaat (2 kuukaudesta < 18 vuoden ikään)
Taulukko 1: Haittavaikutusten yleisyys 0,25 ml saaneilla (vähintään 2 kuukauden ikäisillä mutta alle 3-vuotiailla) lapsilla ja 0,5 ml saaneilla (vähintään 3 vuoden ikäisillä mutta alle 18-vuotiailla) lapsilla ja nuorilla
Haittavaikutusten yleisyys (%) annoksen/iän mukaan | |||
Elinjärjestelmäluokka Suositeltu termi | 0,25 ml N = 783 2 kk − < 3 vuotta | 0,5 ml N = 628 3 − < 18 vuotta | |
Veri ja imukudos | |||
Lymfadenopatia | 0,1 | 0,0 | |
Aineenvaihdunta ja ravitsemus | |||
Ruokahalun heikkeneminen | 8,2 | 1,9 | |
Hermosto | |||
Päänsärky | 2,9 | 6,1 | |
Hengityselimet, rintakehä ja välikarsina | |||
Yskä | 0,5 | 0,3 | |
Ruoansulatuselimistö | |||
Ripuli | 11,9 | 1,4 | |
Oksentelu | 7,3 | 1,9 | |
Pahoinvointi | 3,9 | 1,9 | |
Vatsakipu | 0,1 | 0,0 | |
Iho ja ihonalainen kudos | |||
Ihottuma | 6,3 | 1,4 | |
Luusto, lihakset ja sidekudos | |||
Lihaskipu | 3,0 | 7,1 | |
Yleisoireet ja antopaikassa todettavat haitat | |||
Kuume | 28,5 | 10,4 | |
Influenssan kaltainen sairaus | 10,9 | 2,9 | |
Ärtyisyys | 10,9 | 1,9 | |
Väsymys | 3,5 | 3,5 | |
Pistoskohdan punoitus | 10,0 | 4,1 | |
Pistoskohdan kipu | 6,1 | 14,1 | |
Pistoskohdan arkuus | 4,2 | 14,7 | |
Pistoskohdan turvotus | 3,6 | 2,2 | |
Pistoskohdan kovettuminen | 1,2 | 1,9 | |
Pistoskohdan kutina | 0,6 | 1,6 | |
Tutkimukset | |||
Kohonneet maksaentsyymiarvot | 0,5 | 0,2 | |
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista kansallisen ilmoitusjärjestelmän kautta: www.fimea.fi.
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yliannostusoireista ei ole ilmoitettu.
Pediatriset potilaat:
Pediatrisessa populaatiossa ei ole raportoitu yliannostusta. Jos lapselle, joka on täyttänyt vuoden mutta on alle 3-vuotias, annetaan vahingossa 0,5 ml IXIAROa, se ei vaaranna lapsen turvallisuutta (ks. kohta Farmakodynamiikka).
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Rokotteet. Virusrokotteet. Enkefaliittirokotteet. ATC-koodi: J07BA02
Vaikutusmekanismi
Japanin aivotulehdusta (JE) vastaan kehitettyjen rokotteiden vaikutustapaa ei täysin tunneta. Eläinkokeista on saatu selville, että rokote laukaisee elimistön puolustusjärjestelmän tuottamaan vasta-aineita, jotka useimmiten muodostavat suojan Japanin aivotulehdusvirusta vastaan. Altistustutkimuksia on tehty hiirillä, joita hoidettiin ihmiselle tarkoitetulla IXIARO-antiseerumilla. Tutkimukset osoittivat, että lähes kaikille hiirille, joilla plakkineutralisaatiokokeen titteri oli vähintään 1:10, oli muodostunut suoja tappavaa Japanin aivotulehdusvirusta vastaan.
Kliininen teho ja turvallisuus
Prospektiivisia tehotutkimuksia ei ole tehty. IXIAROn immunogeenisyyttä tutkittiin noin 3119 terveellä aikuisella seitsemässä satunnaistetussa ja kontrolloidussa ja viidessä kontrolloimattomassa vaiheen 3 tutkimuksessa sekä noin 550 terveellä lapsella kahdessa satunnaistetussa, kontrolloidussa ja kahdessa kontrolloimattomassa vaiheen 3 kliinisessä tutkimuksessa.
Keskeinen immunogeenisuustutkimus (aikuiset)
Rokotteen immunogeenisuutta tarkasteltiin satunnaistetussa, aktiivi-kontrolloidussa, sokkoutetussa vaiheen 3 kliinisessä monikeskustutkimuksessa, johon osallistui 867 tervettä miestä ja naista. Heille annettiin IXIAROa tai Yhdysvalloissa hyväksyttyä JEV-rokotetta nimeltä JE-VAX (rokotusaikataulu 0, 7 ja 28 päivää, ihonalaisesti annettu rokote). Ensisijainen yhdistetty päätetapahtuma oli serokonversion (anti-JEV-vasta-aineen titteri ≥1:10) yleisyys ja geometriset keskiarvotitterit tutkimuksen 56. päivänä plakkineutralisaatiokokeen (PRNT) perusteella koko tutkimusväestöstä arvioituna.
56. päivänä niiden henkilöiden määrä, joilla serokonversio oli todettu, oli samanlainen molemmissa hoitoryhmissä (96,4 % IXIARO-ryhmässä vs. 93,8 % JE-VAX-ryhmässä). Geometrinen keskiarvotitteri nousi 56. päivään mennessä siten, että se oli 243,6 IXIAROlla ja 102,0 JE-VAXilla. IXIAROn aikaansaamat immuunivasteet olivat yhdenvertaiset JE-VAXin aikaansaamien kanssa (taulukko 2).
Taulukko 2. IXIAROn ja JE-VAXin serokonversioaste ja geometriset keskiarvotitterit tutkimuspöytäkirjan mukaisessa tutkimusväestössä. Neutralisoivat vasta-ainetitterit JE-virusta vastaan mitattiin JE-viruskannalla SA14-14-2.
Serokonversioaste | ||
Ajankohta | IXIARO N = 365 % (n) | JE‑VAX N = 370 % (n) |
Tutkimuskäynti 0 (seulonta) | 0 | 0 |
Tutkimuskäynti 3 (28. päivä) | 54 (197) | 86,8 (321) |
Tutkimuskäynti 4 (56. päivä) | 96,4 (352) | 93,8 (347) |
Geometrinen keskiarvotitteri (plakkineutralisaatiokokeen perusteella) | ||
Ajankohta | IXIARO N = 365 GMT (n) | JE‑VAX N = 370 GMT (n) |
Tutkimuskäynti 0 (seulonta) | 5,0 (365) | 5,0 (370) |
Tutkimuskäynti 3 (28. päivä) | 17,4 (363) | 76,9 (367) |
Tutkimuskäynti 4 (56. päivä) | 243,6 (361) | 102,0 (364) |
Iän vaikutusta IXIAROn ja JE-VAXin immuunivasteisiin tutkittiin toissijaisena päätetapahtumana tässä aktiivisesti kontrolloidussa tutkimuksessa, jossa verrattiin 50-vuotiaita ja sitä vanhempia henkilöitä (N = 262, keski-ikä 59,8) alle 50-vuotiaisiin (N = 605, keski-ikä 33,9).
IXIAROn ja JE-VAXin serokonversion yleisyydessä ei ollut merkittävää eroa <50-vuotiailla ja ≥50-vuotiailla henkilöillä 28 tai 56 päivää rokotteen antamisen jälkeen. Geometriset keskiarvotitterit olivat 28. päivänä huomattavasti korkeampia <50-vuotiaiden ryhmässä verrattuna ≥50-vuotiaisiin JE-VAX-rokotetta saaneisiin (80,9 vs. 45,9, p = 0,0236), mutta 56. päivänä tässä hoitoryhmässä ei ollut merkittävää eroa. IXIAROa saaneiden henkilöiden ryhmässä iällä ei ollut merkittävää vaikutusta geometrisiin keskiarvotittereihin. Serokonversion yleisyydessä ei ollut merkittävää eroa <50-vuotiailla henkilöillä verrattuna ≥50-vuotiaisiin henkilöihin 28 tai 56 päivää rokotteen antamisen jälkeen kummassakaan hoitoryhmässä.
Vasta-aineiden pysyvyys (aikuiset)
Vasta-aineiden pysyvyyttä arvioitiin kontrolloimattomassa vaiheen 3 kliinisessä seurantatutkimuksessa. Siihen osallistui kahteen keskeiseen tutkimukseen osallistuneita henkilöitä, jotka olivat saaneet vähintään yhden annoksen IXIAROa. IXIAROn pitkän ajan immunogeenisuutta arvioitiin 181 henkilön alaryhmässä 24. kuukauteen saakka (Intent-to-treat, ITT-tutkimusväestö) ja 152 henkilöllä 36. kuukauteen saakka ensimmäisen IXIARO-rokotuksen jälkeen.
Yhteenveto PRNT50≥1:10-arvon saavuttaneista ja GMT-arvoista kuukausina 2, 6, 12, 24 ja 36 on esitetty ITT-tutkimusväestöä koskevassa taulukossa 3.
Taulukko 3. PRNT50≥1:10-arvon yleisyys ja geometriset keskiarvotitterit (GMT) kuukausina 2, 6, 12, 24 ja 36 IXIARO-rokotuksen jälkeen (ITT-tutkimusväestö)
PRNT50≥1:10-arvon yleisyys | GMT | |||
Ajankohta | % (n/N) | 95 %:n luottamusväli | GMT (N) | 95 %:n luottamusväli |
2. kuukausi | 98,9 (179/181) | [96,1, 99,7] | 310,8 (181) | [268,8, 359,4] |
6. kuukausi | 95,0 (172/181) | [90,8, 97,4] | 83,5 (181) | [70,9, 98,4] |
12. kuukausi | 83,4 (151/181) | [77,3, 88,1] | 41,2 (181) | [34,4, 49,3] |
24. kuukausi | 81,8 (148/181) | [75,5, 86,7] | 44,3 (181) | [36,7, 53,4] |
36. kuukausi | 84,9 (129/152) | [78, 3, 89,7] | 43,8 (152) | [36,5, 52,6] |
Geometrisissa keskiarvotittereissä havaittu lasku on odotettu ja vastaa muita inaktivoiduista JE-rokotteista saatuja tietoja.
Toisessa avoimessa vaiheen 3 seurantatutkimuksessa arvioitiin vasta-aineiden pysyvyyttä 24 kuukauteen saakka perusrokotuksen jälkeen. Tähän seurantatutkimukseen osallistui yhteensä 116 henkilöä, jotka olivat saaneet IXIAROa suositellun perusrokotusaikataulun mukaisesti. PRNT50≥1:10-arvon saavutti 82,8 % (95 %:n luottamusväli: 74,9, 88,6, N=116) 6. kuukautena ja 58,3 % 12. kuukautena (95 %:n luottamusväli: 49,1, 66,9, N=115). 24. kuukautena 48,3 %:lla (95 %:n luottamusväli: 39,4, 57,3, N=116) perusrokotuksen saaneista, PRNT50-titterit olivat edelleen ≥1:10. Näiden henkilöiden GMT oli 16,2 % (95 %:n luottamusväli: 13,8, 19,0) 24. kuukautena.
Tehosterokotus (aikuiset)
Kontrolloimattomassa avoimessa vaiheen 3 tutkimuksessa annettiin yksi 6 mikrogramman (0,5 ml) tehosteannos IXIAROa 15. kuukautena primaari-immunisaation jälkeen. Kaikki 198 hoidettua henkilöä sisällytettiin ITT- ja turvallisuustutkimusväestöön. PRNT50≥1:10-arvon saavuttaneet ja GMT-arvot tutkimusaikana on esitetty taulukossa 4.
Taulukko 4: PRNT50≥1:10-arvon yleisyys ja GMT-arvot ennen yhden 6 mikrogramman (0,5 ml) tehosteannoksen antamista ja kuukausina 1, 6 ja 12 sen jälkeen, kun tehosteannos oli annettu 15 kuukauden kuluttua suositellusta primaari-immunisaatiosta IXIAROlla (ITT-tutkimusväestö).
PRNT50≥1:10-arvon yleisyys | GMT | |||
95 %:n luottamusväli | 95 %:n luottamusväli | |||
Ennen tehosteannosta, 0. päivä (n=198) | 69,2 % | [62,4 %, 75,2 %] | 22,5 | [19,0, 26,7] |
28. päivä (n=198) | 100,0 % | [98,1 %, 100,0 %] | 900,1 | [742,4, 1091,3] |
6. kuukausi (n=197) | 98,5 % | [95,6 %, 99,5 %] | 487,4 | [390,7, 608,1] |
12. kuukausi (n=194) | 98,5 % | [95,6 %, 99,5 %] | 361,4 | [294,5, 443,5] |
Vasta-aineiden pysyvyys tehosterokotteen jälkeen (aikuiset)
Edellä kuvatun tehosterokotteen tutkimuksen kontrolloimattomassa ja avoimessa jatkotutkimuksessa seurattiin JE-virusta neutralisoivia vasta-ainetittereitä 67 tutkimushenkilöllä noin kuusi vuotta tehosteannoksen jälkeen. Tutkituista 96 prosentilla (64/67) vasta-aineet olivat edelleen suojaavalla tasolla (PRNT50≥1:10) ja GMT-arvo oli 148 (95 %:n luottamusväli: 107; 207). Rokotesuojan keskimääräisen keston arvioimiseksi sovellettiin matemaattista mallinnusta. Mallinnuksen perusteella voidaan arvioida rokotesuojan keskimääräisen keston olevan 14 vuotta ja 75 prosentin rokotetuista säilyttävän suojaavan vasta-ainetason (PRNT50≥1:10) kymmenen vuoden ajan. Näin ollen toinen tehosteannos tulisi antaa kymmenen vuoden kuluttua ensimmäisestä, yksi vuosi perusrokotuksesta annetusta tehosteannoksesta ennen mahdollista altistusta JE-virukselle.
Nopea aikataulu (aikuiset)
IXIAROn immunogeenisyyttä nopealla aikautaululla rokotettaessa arvioitiin satunnaistetussa ja sokkoutetussa vaiheen 3 tutkimuksessa. Yhteensä 217 18 – ≤ 65-vuotiasta henkilöä sai IXIARO-rokotteen yhdessä inaktivoidun rabiesrokotteen (Rabipur) kanssa nopean aikataulun mukaisesti päivinä 0 ja 7 ja 56 henkilöä sai ainoastaan IXIARO-rokotteen tavanomaisen aikataulun mukaisesti päivinä 0 ja 28. Positiivisen serokonversion saaneiden henkilöiden osuus 7. ja 28. päivään mennessä oli sama molemmissa aikatauluissa. Serokonversioaste ja vasta-ainetitterit säilyivät myös vertailukelpoisen korkeina aina 12 kuukauteen saakka ensimmäisen rokotuksen jälkeen molemmilla aikatauluilla (taulukko 5).
Nopean aikataulun annostelua tutkittiin IXIAROn ja Rabipurin samanaikaisen annostelun yhteydessä, mutta sitä voi myös käyttää pelkän IXIAROn annosteluun, sillä kummankaan rokotteen immuunivasteessa ei havaittu häiriöitä (ks. Yhteisvaikutukset).
Taulukko 5: Serokonversioaste ja GMT neutralisoiville anti-JEV vasta-aineille päivinä 0, 14, 21, 35, 56, ja 356 IXIAROn ja inaktivoidun rabiesrokotteen jälkeen nopean aikataulun mukaisesti sekä vain IXIAROlla tavanomaisen aikataulun mukaisesti (lähtöryhmissä pysyneet)
Serokonversioaste (PRNT50≥1:10 arvon yleisyys) | GMT (plakkineutralisaatiokoe) | |||
Nopea aikataulu % (n/N) | Tavanomainen aikataulu % (n/N) | Nopea aikataulu (N) | Tavanomainen aikataulu (N) | |
Rokotejärjestely | IXIARO Päivä 0, 7 Rabipur Päivä 0, 3, 7 | IXIARO Päivä 0, 28 - | IXIARO Päivä 0, 7 Rabipur Päivä 0, 3, 7 | IXIARO Päivä 0, 28 - |
Päivä 0 | 6 (13/215) | 9 (5/55) | 5,63 (215) | 5,73 (55) |
Päivä 14 | 99 (206/209) | NA | 715 (209) | NA |
Päivä 21 | 100 (207/208) | NA | 1255 (208) | NA |
Päivä 35 | 99 (203/206) | 100 (47/47) | 690 (206) | 376 (47) |
Päivä 56 | 98 (200/204) | 100 (49/49) | 372 (204) | 337 (49) |
Päivä 365 | 94 (188/199) | 88 (42/48) | 117 (199) | 39 (48) |
NA= ei sovellettavissa
Epätäydellinen perusrokotus (aikuiset)
Tehosteannosten immunogeenisuutta arvioitiin myös tutkimuksessa, jossa tutkittiin immuniteetin pysyvyyttä erilaisten perusrokotusten jälkeen (2 x 6 mikrogrammaa: N=116, 1 x 12 mikrogrammaa: N=116 tai 1 x 6 mikrogrammaa: N=117). Yksi 6 mikrogramman (0,5 ml) tehosteannos annettiin 11. tai 23. kuukautena ensimmäisen annoksen jälkeen henkilöille, joiden todettiin olevan seronegatiivisia (PRNT50-titterit <1:10) 6. kuukautena ja/tai 12. kuukautena perusrokotuksen jälkeen. Tulokset osoittavat, että perusrokotussarjan toinen injektio voidaan antaa viimeistään 11 kuukauden kuluttua ensimmäisestä annoksesta. Immuunivasteet lisäannoksille eri ajankohtina täydellisen tai epätäydellisen primaari-immunisaation jälkeen esitetään taulukossa 6.
Taulukko 6: SCR ja GMT viikkona 4 sen jälkeen, kun yksi 6 mikrogramman tehosteannos on annettu henkilöille, joiden PRNT50 <1:10 (PRNT50 < 1:10 tarkoittaa, että henkilöllä ei ole enää serologista suojaa) 11. kuukautena tai 23. kuukautena suositellun perusrokotuksen (2 x 6 mikrogrammaa) tai epätäydellisen (1 x 6 mikrogrammaa) perusrokotuksen jälkeen IXIAROlla (ITT-tutkimusväestö)
(n / N) | SCR | GMT | [95 %:n luottamusväli] | |
Tehosteannos suositellun primaari-immunisaation jälkeen (2 x 6 mikrogrammaa) | ||||
Tehosteannos 11. kuukautena | (17 / 17) | 100 % | 673,6 | [378,7, 1198,2] |
Tehosteannos 23. kuukautena | (27 / 27) | 100 % | 2536,7 | [1467,7, 4384,4] |
Toinen annos epätäydellisen primaari-immunisaation jälkeen (1 x 6 mikrogrammaa) | ||||
Toinen annos 11. kuukautena | (99 / 100) | 99 % | 504,3 | [367,3, 692,3] |
Toinen annos 23. kuukautena | (5 / 5) | 100 % | 571,4 | [88,2, 3702,9] |
Samanaikainen käyttö (aikuiset)
IXIAROn samanaikainen annostelu yhdessä hepatiitti A(HAV) -virusrokotteen (HAVRIX 1440) kanssa
IXIAROn samanaikaista käyttöä inaktivoidun hepatiitti A -virusrokotteen (HAVRIX 1440) kanssa on tutkittu yhdessä kliinisessä tutkimuksessa. JE-viruksen ja HA-viruksen immuunivasteissa ei havaittu häiriöitä. IXIAROn ja hepatiitti A -rokotteen samanaikainen annostelu vaikutti olevan yhdenvertainen yksittäisiin rokotteisiin nähden Japanin aivotulehdusvirusta neutraloivan vasta-aineen ja hepatiitti A-viruksen vasta-aineen geometristen keskiarvotittereiden sekä molempien vasta-ainetyyppien serokonversion yleisyyden osalta (taulukko 7).
Taulukko 7. Japanin aivotulehdusvirusta neutraloivan vasta-aineen serokonversion yleisyys ja geometriset keskiarvotitterit 56. päivänä ja hepatiitti A -viruksen vasta-aineen serokonversion yleisyys ja geometriset keskiarvotitterit 28. päivänä tutkimuspöytäkirjan mukaisessa tutkimusväestössä
Japanin aivotulehdusvirusta neutraloivan vasta-aineen serokonversion yleisyys ja geometriset keskiarvotitterit 56. päivänä | |||
% SCR | GMT | 95 % CI | |
Ryhmä C: IXIARO + HAVRIX 1440 | 100,0 | 202,7 | [153,7, 261,2] |
Ryhmä A: IXIARO + lumelääke | 98,2 | 192,2 | [147,9, 249,8] |
Hepatiitti A -virusta neutraloivan vasta-aineen serokonversion yleisyys ja geometriset keskiarvotitterit 28. päivänä | |||
% SCR | GMT | 95 % CI | |
Ryhmä C: IXIARO + HAVRIX 1440 | 100,0 | 150,0 | [111,7, 202,3] |
Ryhmä B: HAVRIX + lumelääke | 96,2 | 124,0 | [91,4, 168,2] |
IXAROn ja inaktivoidun rabiesrokotteen (Rabipur) samanaikainen annostelu:
IXIARO- ja Rabipur-rokotteiden samanaikaista annostelua tutkittiin havainnoitsijalta sokkoutetussa vaiheen 3 tutkimuksessa 18 – ≤ 65-vuotiailla henkilöillä verrattuna yhden rokotteen annosteluun tavanomaisella aikataululla. Geometrisessa keskiarvotitterissä ja neutralisoivien anti-JEV-vasta-aineiden serokonversioasteessa ei havaittu häiriöitä (Taulukko 8). Immuunivasteessa Rabipurille ei myöskään havaittu häiriöitä.
Taulukko 8: Serokonversioaste (PRNT50≥1:10 arvon yleisyys) ja GMT (plakkineutralisaatiokoe) neutralisoiville anti-JEV-vasta-aineille IXIAROn ja Rabipurin tavanomaisen aikataulun mukaisen annostelun jälkeen, lähtöryhmissä pysyneet
Serokonversioaste ja geometrinen keskiarvotitteri neutralisoivalle JEV-vasta-aineelle 56. päivänä | ||
SCR [%] (n/N) | GMT [95% CI] (N) | |
IXIARO + Rabipur | 100 (157/157) | 299 [254-352] (157) |
IXIARO | 100 (49/49) | 337 [252-451] (49) |
Rokotusaikataulu: IXIARO: päivä 0/28, Rabipur: päivä 0/7/28.
Immunogeenisyys iäkkäillä henkilöillä (≥ 65-vuotiailla)
IXIAROn immunogeenisyyttä arvioitiin avoimessa kontrolloimattomassa tutkimuksessa 200 terveellä ≥ 65–83-vuotiaalla henkilöllä, joista osalla oli tasapainossa olevia perussairauksia kuten hyperkolesterolemia, verenpainetauti, sydän- ja verisuonitauti tai ei-insuliiniriippuvainen diabetes mellitus. Neutralisoivia JEV-vasta-aineita havaittiin 42 päivää ensimmäisen rokotusjakson toisen annoksen jälkeen (70. päivä). Iäkkäillä henkilöillä on matalampi immuunivaste verrattuna nuorempiin aikuisiin ja lapsiin sekä serokonversioasteteen (PRNT50 titteri ≥1:10-arvon prosenttiosuus) että geometristen keskiarvotittereiden suhteen (Taulukko 9).
Taulukko 9: Serokonversioaste ja geometrinen keskiarvotitteri neutralisoiville JEV-vasta-aineille 70. päivänä lähtöryhmien mukaisessa koko tutkimusväestössä ja iän mukaan ositettuna.
Serokonversion aste ja geometrinen keskiarvotitteri neutralisoiville JEV-vasta-aineille 70. päivänä | ||||
n / N | SCR | GMT | 95% CI | |
Koko tutkimusväestö | 128/197 | 65 % | 37 | 29,2; 47,8 |
Ikäryhmä ≥ 65 – < 75-vuotiaat | 113/173 | 65,3 % | 37,2 | 28,6; 48,3 |
Ikäryhmä ≥75-vuotiaat | 15/23 | 65,2 % | 42,2 | 19,2; 92,7 |
Pediatriset potilaat
Vaiheen 2 tutkimuksessa, jossa tutkittiin 1 vuoden täyttäneitä mutta alle 3-vuotiaita, terveitä intialaisia lapsia, 24 lapselle annettiin rokotuksena 0,25 ml IXIAROa (tälle ikäryhmälle hyväksytty annos) ja 24 lapselle aikuisten annos, 0,5 ml. Tietoja on niukasti, mutta 0,25 ml:n ja 0,5 ml:n annoksen turvallisuusprofiilissa ei ollut tässä ikäryhmässä eroa.
IXIAROn immunogeenisuus ja turvallisuus JEV-endeemisen maan lapsilla ja nuorilla
IXIAROn turvallisuutta ja immunogeenisuutta arvioitiin satunnaistetussa, kontrolloidussa, avoimessa kliinisessä tutkimuksessa Filippiineillä, jossa JEV on endeeminen. IXIAROn turvallisuusprofiilia verrattiin kahteen verrokkirokotteeseen, Havrix (A-hepatiittirokote, pediatrinen 720 EL.U./0,5 ml) ja Prevenar (7-valenttinen pneumokokkikonjugaattirokote [difteria CRM197 ‑proteiini]).
Immunogeenisuus arvioitiin osalla tutkittavista. Arvioinnissa määritettiin serokonversion (määritelmän mukaan anti-JEV-vasta-ainetitteri ≥ 1:10) yleisyys (SCR), niiden tutkittavien osuus, joiden vasta-ainetitteri suureni vähintään nelinkertaiseksi, ja titterien geometrinen keskiarvo (GMT) 56. päivänä ja 7. kuukautena annoksen ja ikäryhmän mukaan. IXIAROn aikaansaama immuunivaste on kuvattu taulukossa 10.
Taulukko 10: Serokonversion yleisyys, niiden tutkittavien osuus, joiden JE-virusta neutraloivan vasta-aineen titteri suureni vähintään 4-kertaiseksi, ja titterien geometrinen keskiarvo tutkimuksen alussa, 56. päivänä ja 7. kuukautena jaoteltuina ikäryhmän ja hoitoaikeen mukaisen (intent-to-treat) ryhmän mukaan
Rokoteannos | 0,25 ml | 0,5 ml | |||
Ikäryhmä | 2 kk – < 6 kk | 6 kk – < 12 kk | 1 v – < 3 v | 3 v - < 12 v | 12 v - < 18 v |
Serokonversion yleisyys, % (n/N) | |||||
Ennen rokotusta | 30 % (3/10) | 0 % (0/20) | 3,2 % (4/125) | 16,8 % (17/101) | 45,7 % (64/140) |
56. päivä | 100 % (9/9) | 100 % (19/19) | 99,2 % (119/120) | 100,0 % (100/100) | 100 % (137/137) |
7. kuukausi | 100 % (10/10) | 100 % (18/18) | 85,5 % (106/124) | 91,0 % (91/100) | 97,1 % (133/137) |
Niiden tutkittavien osuus, joiden JEV-vasta-ainetitteri nousi ≥ 4-kertaiseksi, % (n/N) | |||||
56. päivä | 100 (9/9) | 94,7 (18/19) | 96,7 (116/120) | 94,0 (94/100) | 77,4 (106/137) |
7. kuukausi | 90,0 (9/10) | 83,3 (15/18) | 75,8 (94/124) | 71,0 (71/100) | 65,0 (89/137) |
Titterien geometrinen keskiarvo (N) | |||||
Ennen rokotusta | 8,42 (10 ) | 5◊ (20) | 5,52 (124) | 6,54 (101) | 13,08 (140) |
56. päivä | 687,35 (9) | 377,79 (19) | 258,90 (121) | 213,67 (100) | 175,63 (137) |
7. kuukausi | 159,27 (10) | 64,00 (18) | 38,91 (125) | 43,60 (100) | 86,61 (137) |
◊Negatiiviset rokotusta edeltävät titterit imputoitiin arvoon 5.
Turvallisuus ja siedettävyys arvioitiin koko tutkimusryhmässä. Vanhemmat tai tutkittavat kirjasivat haittatapahtumat seitsemänä päivänä joka rokotuksen jälkeen päiväkirjakortille. Vanhemmilta tai tutkittavilta kysyttiin ilmoittamattomista haittatapahtumista toisena rokotuspäivänä ja henkilökohtaisilla käynneillä, joihin kuului lääkärintarkastus 28 päivää (56. päivänä) ja 6 kuukautta (7. kuukautena) toisen annoksen jälkeen. IXIARO vastasi turvallisuusprofiililtaan Havrixia ja Prevenaria.
Vasta-aineiden pysyvyys ja tehosteannos JEV-endeemisen maan lapsilla ja nuorilla
JE-virusta neutralisoivien vasta-aineiden pysyvyyttä perusrokotuksen jälkeen sekä yksi vuosi perusrokotuksesta annetun IXIARO-tehosteannoksen turvallisuutta ja immunogeenisuutta arvioitiin satunnaistetussa, kontrolloidussa avoimessa kliinisessä tutkimuksessa Filippiineillä, jossa JE-virus on endeeminen (300, keski-iältään 5,3-vuotiasta lasta, ikäjakauma 1,2–17,3 vuotta). 150 lasta seurattiin ilman tehosterokotusta kolmeen vuoteen asti, toiset 150 lasta saivat tehosteannoksen 1 vuoden kuluttua perusrokotuksesta (0,25 ml tehosteannoksen antohetkellä alle 3-vuotialle ja 0,5 ml tehosteannoksen antohetkellä yli 3-vuotialle), ja jälkimmäistä ryhmää seurattiin vielä kaksi vuotta tehosteen jälkeen. Immunisaation aste (SPR), joka on määritelty ≥1:10 neutralisoivaksi vasta-ainetitteriksi, ja geometrinen keski-arvotitteri (GMT) esitetään taulukossa 11. Tehosteannoksesta seurasi GMT:n huomattava kasvu ja immunisaation aste säilyi 100 prosentissa kaksi vuotta tehosteannoksen jälkeen.
Table 11: Immunisaation aste ja geometrinen keskiarvotitteri ilman IXIARO-tehostetta ja IXIARO-tehosteella 12, 13, 24 ja 36 kuukautta perusrokotuksesta, hoitoaikeen (intent-to-treat) mukainen ryhmä
Ilman tehostetta N = 150 | Tehosteannos 12 kk perusrokotuksesta N = 149 | ||
Perusrokotuksesta kulunut aika | 0,25 ml:n tehosteannos N=81 | 0,5 ml:n tehosteannos N=67 | |
Immunisaation aste % (n/N) | |||
12 kk | 89,9 (134/149) | 97,5 (79/81) | 89,6 (60/67) |
13 kk | NA | 100 (81/81) | 100,0 (67/67) |
24 kk | 89,0 (130/146) | 100 (80/80) | 100,0 (67/67) |
36 kk | 90,1 (128/142) | 100,0 (76/76) | 100,0 (67/67) |
Geometrinen keskiarvotitteri | |||
12 kk | 46 | 67 | 40 |
13 kk | NA | 2911 | 1366 |
24 kk | 50 | 572 | 302 |
36 kk | 59 | 427 | 280 |
NA. = ei sovellettavissa
Immunogeenisuus ja turvallisuus ei-endeemisten maiden lapsilla ja nuorilla
IXIAROn turvallisuutta ja immunogeenisuutta arvioitiin kontrolloimattomassa, avoimessa Yhdysvalloissa, Euroopassa ja Australiassa tehdyssä kliinisessä tutkimuksessa, jossa oli mukana terveitä mies- ja naispuolisia tutkittavia, jotka ovat matkustamassa alueelle, jolla JE-virusta on endeemisenä. Kolme vuotta täyttäneille mutta alle 18-vuotiaille lapsille ja nuorille annettin kaksi 0,5 ml:n rokoteannosta, ja 2 kuukautta täyttäneille mutta alle 3-vuotiaille lapsille kaksi 0,25 ml:n rokoteannosta 0. ja 28. päivänä injektiona lihakseen. Immunogeenisuutta arvioitiin 64 henkilöltä. Taulukossa 12 esitetään serokonversion yleisyys (SCR) ja titterien geometrinen keskiarvo (GMT).
Taulukko 12: Serokonversion yleisyys ja JE-virusta neutraloivan vasta-aineen titterien geometrinen keskiarvo rokoteannoksen ja ikäryhmän mukaan jaoteltuna. Hoitoaikeen mukainen (intent-to-treat) ryhmä.
IXIARO- annos | Ajankohta | SCR n / N | GMT | 95 % CI | |
Ikäryhmä ≥2 kk – < 3 v | 0,25 ml | 56. päivä | 100 % 5/5 | 216,2 | 106,0; 441,0 |
7. kk | 100 % 2/2 | 48,0 | 0,0; 3214485,7 | ||
Ikäryhmä ≥ 3 – < 18 v | 0,5 ml | 56. päivä | 100 % 57/57 | 340,7 | 269,8; 430,3 |
7. kk | 90,6 % 29/32 | 57,1 | 38,4; 84,9 |
Vasta-aineiden pysyvyys ei-endeemisten maiden lapsilla ja nuorilla
Vasta-aineiden pysyvyyttä kolme vuotta IXIARO-perusrokotuksen jälkeen tutkittiin kontrolloimattomassa avoimessa, Yhdysvalloissa, Euroopassa ja Australiassa suoritetussa kliinisessä seurantatutkimuksessa. Pitkän aikavälin immunogeenisuustietoja tutkittiin 23 lapselta (iältään 3–18 vuotta, keski-ikä 14,3 vuotta). Immunisaation aste (SPR) ja geometriset keskiarvotitterit (GMT) on esitetty taulukossa 13.
Taulukko 13: Immunisaation aste ja geometrinen keskiarvotitteri JEV-neutralisoiville vasta-aineille rokoteannoksen ja ikäryhmän mukaan. Hoitoaikeen mukainen (intent-to-treat) ryhmä.
Immunisaation aste (PRNT50≥1:10-arvon yleisyys) % (n/N) | Geometrinen keskiarvotitteri (plakkineutralisaatiokoe) GMT [95 %:n luottamusväli] | |||
0,25 ml:n perusrokotuksen jälkeen | 0,50 ml:n perusrokotuksen jälkeen | 0,25 ml:n perusrokotuksen jälkeen | 0,50 ml:n perusrokotuksen jälkeen | |
12 kk | 0 % (0/0) | 89,5 % (17/19) | - | 48 [28; 80] |
24 kk | 100 % (1/1) | 90,9 % (20/22) | 193 [NA] | 75 [46; 124] |
36 kk | 100 % (1/1) | 88,9 % (16/18) | 136 [NA] | 61 [35; 106] |
NA 95 % :n luottamusväliä ei voitu määrittää (vain yhden tutkittavan tiedot).
Farmakokinetiikka
Ei sovellettavissa.
Prekliiniset tiedot turvallisuudesta
Ei-kliiniset toksisuustiedot ovat vähäiset.
Reproduktiivisessa ja pre-/postnataalisessa toksisuustutkimuksessa rokotteeseen liittyviä vaikutuksia ei havaittu lisääntymisessä, sikiön painossa eikä jälkeläisten eloonjäämisessä ja kehityksessä. Luuston epätäydellistä luutumista tosin havaittiin kaksi annosta saaneiden ryhmässä, mutta ei kolme annosta saaneiden ryhmässä. Tällä hetkellä on vaikea arvioida, liittyykö tämä ilmiö hoitoon vai ei.
Farmaseuttiset tiedot
Apuaineet
Fosfaattipuskuroitu suolaliuos, joka sisältää seuraavia aineita:
Natriumkloridi
Kaliumdivetyfosfaatti
Dinatriumvetyfosfaatti
Injektionesteisiin käytettävä vesi
Katso adjuvantti kohdasta Vaikuttavat aineet ja niiden määrät.
Yhteensopimattomuudet
Koska yhteensopimattomuustutkimuksia ei ole tehty, lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
3 vuotta
Säilytys
Säilytä jääkaapissa (2°C – 8°C).
Ei saa jäätyä.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
IXIARO injektioneste, suspensio
0,5 ml (157,67 €)
PF-selosteen tieto
0,5 ml:n suspensio esitäytetyssä ruiskussa (tyypin I lasia), jossa männän pysäytin (klorobutyyli-elastomeeri). Pakkauksessa yksi ruisku joko erillisen neulan kanssa tai ilman sitä.
Valmisteen kuvaus:
Kirkas neste, jossa valkoista sakkaa.
Käyttö- ja käsittelyohjeet
Esitäytetty ruisku on kertakäyttöinen ja sitä tulee käyttää vain yhden henkilön rokottamiseen. Esitäytetty ruisku on käyttövalmis. Jos pakkauksessa ei ole neulaa, käytä steriiliä neulaa.
Älä käytä rokotetta, jos suojakalvo ei ole ehjä tai jos pakkaus on vaurioitunut.
Rokotteen säilytyksen aikana siinä voidaan havaita valkoista hienojakoista sakkaa, jossa on kirkas, väritön supernatantti.
Ravista ruiskua hyvin ennen käyttöä, jotta saat aikaan valkoisen, samean, homogeenisen suspension. Älä käytä tuotetta, jos siinä on ravistamisen jälkeen hiukkasia, jos se vaikuttaa värjääntyneeltä tai jos ruisku näyttää vialliselta.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Tietoa 0,5 ml:n IXIARO-annoksen antamisesta 3 vuotta täyttäneille
Antaessasi koko 0,5 ml:n annoksen toimi seuraavasti:
1. Ravista ruiskua, niin että saat homogeenisen suspension.
2. Irrota korkki ruiskun kärjestä kiertämällä korkkia varovasti. Älä yritä napsauttaa tai vetää korkkia irti, sillä ruisku saattaa vaurioitua.
3. Kiinnitä neula esitäytettyyn ruiskuun.
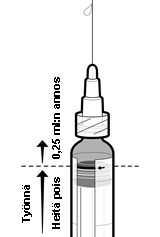
Tietoa 0,25 ml:n IXIARO-annoksen valmistamisesta annettavaksi alle 3-vuotiaille
Antaessasi 0,25 ml:n annoksen vähintään 2 kuukauden mutta alle 3 vuoden ikäiselle lapselle toimi seuraavasti:
1. Ravista ruiskua, niin että saat homogeenisen suspension.
2. Irrota korkki ruiskun kärjestä kiertämällä korkkia varovasti. Älä yritä napsauttaa tai vetää korkkia irti, sillä ruisku saattaa vaurioitua.
3. Kiinnitä neula esitäytettyyn ruiskuun.
4. Pidä ruiskua pystyasennossa.
5. Poista ylimääräinen suspensio työntämällä männän pysäytin ruiskun säiliön punaisen viivan reunaan asti, joka on merkitty punaisella nuolella (ks. kuvaa 1)*.
6. Kiinnitä ruiskuun uusi, steriili neula ennen jäljelle jääneen suspension injisointia.
*Jos työnnät männän pysäyttimen punaisen viivan ohi, jäljellä ei enää välttämättä ole 0,25 ml:n annosta, ja on syytä ottaa käyttöön uusi ruisku.
Kuva 1: Valmistelut ennen 0,25 ml:n annoksen antamista
Korvattavuus
IXIARO injektioneste, suspensio
0,5 ml
- Ei korvausta.
ATC-koodi
J07BA02
Valmisteyhteenvedon muuttamispäivämäärä
19.03.2021
Yhteystiedot
SE-105 21 Stockholm
Sverige
+46 8-121 015 00
www.valneva.com
Lääketieteellisissä kysymyksissä puh: +358 (0) 306 705 310 (arkisin klo 8-16) sekä sähköpostitse infofinland@valneva.com
