ORADEXON injektioneste, liuos 5 mg/ml
Vaikuttavat aineet ja niiden määrät
Yksi ml sisältää vaikuttavana aineena 5 mg glukokortikoidia, deksametasoninatriumfosfaattia.
Apuaine(et), joiden vaikutus tunnetaan
Natrium: < 1 mmol natriumia (23 mg) per annos.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, liuos.
Kliiniset tiedot
Käyttöaiheet
Oradexon injektionestettä käytetään erilaisten tulehdustilojen ja autoimmuunisairauksien hoitoon, esimerkiksi:
Reuma: kipu, jäykkyys tai liikerajoitus, etenkin nivelissä ja niihin liittyvissä rakenteissa, mukaan luettuna lihakset, limapussit, jänteet, säikeinen sidekudos.
Kollageenitauti: lupus erythematosus (LED), dermatomyosiitti, polyarteritis nodosa, idiopaattinen trombosytopeeninen purppura ja nivelreuma.
Allergiat: status asthmaticus, silmän ja siihen liittyvien rakenteiden tulehdustilat, vaikeat yliherkkyysreaktiot lääkkeille tai hyönteisenpuremille, anafylaktinen sokki, uhkaava allograftisiirteen hyljintä.
Akuuttilisämunuaiskuoren vajaatoiminta: leikkauksen, vaikean stressin tai trauman yhteydessä.
Lisäksi Oradexonia käytetään adjuvanttihoitona aivoturvotuksen hoitoon (ei niissä tapauksissa, joissa turvotus aiheutuu pään vammasta), antiemeettinä syöpähoidon yhteydessä ja palliatiiviseen hoitoon neoplastisten sairauksien terminaalivaiheessa.
Oradexon on tarkoitettu koronavirustauti-2019:n (COVID-19) hoitoon lisähappea tarvitseville aikuisille ja nuorille (12-vuotiaille ja vanhemmille ja vähintään 40 kg painaville) potilaille.
Annostus ja antotapa
Antotapa
Oradexon injektionestettä käytetään, kun tilan vakavuus vaatii nopeaa ja voimakasta oireiden lievitystä tai kun oraalinen hoito ei käy päinsä.
Oradexon voidaan antaa laskimoon, lihakseen tai paikallisena injektiona. Oradexon voidaan myös laimentaa infuusionesteellä tai injisoida suoraan siirtoletkuun.
Suuriannoksiset laskimoinjektiot on annettava hitaasti, usean minuutin aikana.
Lihaksensisäinen injektio annetaan syvälle lihakseen ihonalaisen rasvakudoksen atrofian estämiseksi.
Nivelensisäiset injektiot on annettava ehdottoman aseptisissa oloissa, koska glukokortikoidit heikentävät vastustuskykyä infektioille.
Oradexon voidaan laimentaa johonkin seuraavista infuusionesteistä tai injisoida suoraan siirtoletkuun ilman että tapahtuu aineosien saostumista.
Näihin infuusionesteisiin laimennettu Oradexon säilyttää tehonsa joko 12 tuntia säilytettynä huoneenlämmössä tai 24 tuntia säilytettynä 2-8 oC:ssa.
Infuusionesteet: 0,9 % natriumkloridi, 5 % glukoosianhydridi, 10 % inverttisokeri, 5 % sorbitoli, Ringerin liuos, Hartmannin liuos (Ringerin laktaatti), Rheomacrodex, Isodex, Haemaccel.
Annostus
Oradexonannostus riippuu tilan vaikeusasteesta ja hoitovasteesta. Haittavaikutukset voidaan minimoida käyttämällä pienintä tehokasta annosta lyhimmän mahdollisen ajan tai annostelemalla joka toinen päivä. Potilasta on seurattava tiheästi, jotta annos saadaan sovitetuksi taudin aktiivisuuden mukaan. Ellei suotuisaa vaikutusta havaita parin päivän sisällä, glukokortikoidihoidon jatkamista ei suositella.
Systeemihoitoon riittää yleensä 0,05–0,20 mg/kg/vrk. Heti kun oireet lievittyvät, annosta pienennetään kliinistä kuvaa jatkuvasti seuraten pienimpään mahdolliseen, tai lopetetaan asteittain kokonaan.
Hätätilanteissa (esim. anafylaksi, akuutti vaikea astma tai aivoödeemat, jotka eivät liity pään vammaan) tarvitaan tuntuvasti suurempia annoksia. Aloitusannos on 10–20 mg (aikuiset) laskimoon ja sen jälkeen 6 mg laskimoon tai lihakseen kuuden tunnin välein, kunnes tyydyttävä vaste on saavutettu. Sen jälkeen annostusta vähitellen pienennetään.
Paikallishoitoon suositellaan seuraavia annoksia:
niveleen: 2–4 mg suuriin ja 0,8–1 mg pikkuniveliin
limapussiin: 2–4 mg, jännetuppeen: 0,4–1 mg.
Injektioiden väli on 3–5 päivää – 2–3 viikkoa.
Hoidon aikana tapahtuva sairastuminen, trauma tai kirurginen toimenpide vaativat tilapäistä annostuksen suurentamista. Pitkäaikaishoito on aina lopetettava vähitellen akuutin lisämunuaisen toiminnanvajauksen välttämiseksi. Annostusta pienennetään useiden viikkojen tai kuukausien aikana annoksesta ja hoidon kestosta riippuen. Tämän tulee tapahtua antamalla päivittäin, tai mieluiten kerta-annoksena aamulla joka toinen päivä, yksi annos oraalista glukokortikoidia, esim. prednis(ol)onia, jolla on lyhyempi biologinen puoliintumisaika kuin deksametasonilla. Jos glukokortikoidihoito on lopetettu sen kestettyä pitkään, se joudutaan ehkä tilapäisesti aloittamaan uudestaan.
"Vieroitusoireisto" on mahdollinen ja siihen kuuluvat kuume, lihas- ja nivelkivut, riniitti, konjunktiviitti, kivuliaat kutiavat ihokyhmyt ja painonlasku.
Liian nopea glukokortikoidiannostuksen pienentäminen hoidon kestettyä pitkään voi johtaa akuuttiin lisämunuaisen vajaatoimintaan, verenpaineen laskuun ja kuolemaan.
COVID-19:n hoito
Aikuispotilaille 7,89 mg (vastaa 6 mg:aa deksametasonin emäsmuotoa) laskimoon kerran vuorokaudessa enintään 10 vuorokauden ajan.
Pediatriset potilaat
Pediatrisille potilaille (vähintään 12-vuotiaille nuorille) suositeltu annos on 7,89 mg (vastaa 6 mg:aa deksametasonin emäsmuotoa) laskimoon kerran vuorokaudessa enintään 10 vuorokauden ajan.
Hoidon kesto määräytyy kliinisen vasteen ja potilaan yksilöllisten tarpeiden mukaan.
Iäkkäät potilaat, munuaisten vajaatoiminta, maksan vajaatoiminta
Annoksen muuttaminen ei ole tarpeen.
Vasta-aiheet
Systeeminen tai paikallinen infektio hoidettavassa nivelessä tai sen ympäristössä, ellei erityistä mikrobilääkitystä käytetä.
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Vaikeat allergiset reaktiot. Parenteraalista kortikosteroidihoitoa saavilla potilailla on esiintynyt harvoin anafylaktoidisia/anafylaktisia reaktioita, joihin on voinut liittyä sokki. Asianmukaisiin varotoimiin on ryhdyttävä, jos potilas on saanut aiemmin allergisia reaktioita kortikosteroideista.
Epiduraaliseen käyttöön liittyvät vakavat neurologiset haittavaikutukset. Vakavia neurologisia haittavaikutuksia, joista joidenkin seurauksena on ollut kuolema, on raportoitu kortikosteroidien epiduraalisen injektion yhteydessä. Raportoituihin haittavaikutuksiin kuuluvat, niihin kuitenkaan rajoittumatta, selkäydininfarkti, alaraajahalvaus, neliraajahalvaus, kortikaalinen sokeus ja aivohalvaus. Näitä vakavia haittavaikutuksia on raportoitu sekä fluoroskopian käytön yhteydessä että ilman fluoroskopiaa. Kortikosteroidien epiduraalisen käytön turvallisuutta ja tehokkuutta ei ole varmistettu, eikä kortikosteroideja ole hyväksytty tähän käyttöön.
Tuumorinhajoamisoireyhtymä. Pahanlaatuista veritautia sairastavilla potilailla on valmisteen markkinoille tulon jälkeen ilmoitettu tuumorilyysioireyhtymää, kun käytössä on ollut pelkkä deksametasoni tai sen lisäksi jokin muu kemoterapeuttinen aine. Potilaita, joilla tuumorilyysioireyhtymän riski on suuri (esim. potilaat, joilla on suuri proliferaationopeus, suuri kasvaintaakka ja suuri herkkyys sytotoksisille aineille), on seurattava tarkkaan, ja asianmukaiset varotoimet ovat tarpeen.
Lisämunuaiskuorenatrofia kehittyy pitkäaikaishoidossa ja voi jatkua vuosia hoidon lopettamisen jälkeen. Siksi pitkään kestänyt kortikoidihoito on aina lopetettava vähitellen akuutin lisämunuaisten vajaatoiminnan välttämiseksi, ja annostusta pienennetään useiden viikkojen tai kuukausien aikana annoksen ja hoidon keston mukaan. Pitkäaikaishoidon aikana ilmenevä sairaus, trauma tai kirurginen toimenpide vaatii tilapäistä annostuksen lisäämistä. Jos kortikosteroidihoito on lopetettu sen kestettyä pitkään, se voidaan joutua aloittamaan tilapäisesti uudestaan.
Anti-inflammatoriset/Immunosuppressiivisetvaikutukset. Glukokortikoidihoito on epäspesifinen, tukahduttaa sairauden oireet ja heikentää infektionvastustuskykyä. Kliininen kuva voi usein olla epätyyppinen, ja vaikeat infektiot kuten septikemia ja tuberkuloosi voivat peittyä ja edetä pitkälle ennen kuin ne havaitaan. Tarvittaessa glukokortikoidihoitoon on liitettävä tehokas antimikrobilääkitys.
Eläviärokotteita ei pidä antaa henkilöille, joilla on heikentynyt immuunivaste. Vasta-ainemuodostus muille rokotteille voi vähetä.
Näköhäiriö. Systeemisesti tai topikaalisesti käytettävien kortikosteroidien käytön yhteydessä saatetaan ilmoittaa näköhäiriöistä. Jos potilaalla esiintyy oireita, kuten näön hämärtymistä tai muita näköhäiriöitä, potilas on ohjattava silmälääkärille, joka arvioi oireiden mahdolliset syyt. Niitä voivat olla kaihi, glaukooma tai harvinaiset sairaudet, kuten sentraalinen seroosi korioretinopatia, joista on ilmoitettu systeemisten tai topikaalisten kortikosteroidien käytön jälkeen.
Feokromosytoomakriisi. Feokromosytoomakriisi voi johtaa kuolemaan, ja sitä on raportoitu systeemisten kortikosteroidien annon jälkeen. Kortikosteroideja saa antaa potilaille, joilla on todettu tai joilla epäillään olevan feokromosytooma, vain asianmukaisen riski-hyötyarvion jälkeen.
Vesirokko on erityinen huolenaihe, koska tämä normaalisti ohimenevä sairaus voi immunosuppression yhteydessä olla fataali. Jos vesirokko todetaan, se vaatii kiireellisesti erikoislääkärin hoitoa. Kortikosteroidihoitoa ei pidä lopettaa, ja annosta voidaan joutua jopa lisäämään.
Glukokortikoidit voivat aiheuttaa annoksesta riippuvaa kasvunhidastumista lapsilla ja nuorilla, joka voi jäädä pysyväksi.
Yleiset systeemisten glukokortikoidien haittavaikutukset voivat aiheuttaa vakavampia seurauksia vanhuksilla, etenkin osteoporoosia, hypertensiota, hypokalemiaa, diabetesta, infektioalttiutta ja ihon ohenemista. Tarkka kliininen seuranta on tarpeen hengenvaarallisten reaktioiden välttämiseksi.
Pitkäaikainen ja toistuva glukokortikoidien käyttö kuormitetuissanivelissä voi vaikeuttaa nivelen degeneraatiota entisestään. Se johtuu luultavasti sairaan nivelen liikarasituksesta, kun kipu ja muut oireet hellittävät.
Systeemisten glukokortikoidien käyttöä on harkittava tarkkaan potilailla, joilla on jokin seuraavista tiloista, ja potilaita on seurattava tiheään:
- Osteoporoosi (postmenopausaaliset naiset erityinen riskiryhmä)
- Hypertensio tai kongestiivinen sydämen vajaatoiminta
- Vaikea senhetkinen tai aikaisemmin sairastettu mielialahäiriö (etenkin aikaisempi steroidipsykoosi)
- Diabetes mellitus (tai diabetesta suvussa)
- Sairastettu tuberkuloosi
- Glaukooma (tai glaukoomaa suvussa)
- Aiempi glukokortikoidin indusoima myopatia
- Maksan toimintahäiriö
- Munuaisten vajaatoiminta
- Epilepsia
- Peptinen haavauma
Kortikosteroideja ei tule käyttää päävammojen ja aivohalvauksen hoidossa, koska on epätodennäköistä, että siitä on hyötyä ja se saattaa olla jopa haitallista.
Ennenaikaiset vastasyntyneet: Saatavilla oleva näyttö viittaa siihen, että pitkäkestoisia, hermoston kehitykseen kohdistuvia haittavaikutuksia on esiintynyt, kun keskosia, joilla on krooninen keuhkosairaus, on hoidettu varhaisessa vaiheessa (< 96 tuntia) aloitusannoksilla 0,25 mg/kg kahdesti vuorokaudessa.
Hypertrofinen kardiomyopatia. Hypertrofisesta kardiomyopatiasta on tehty ilmoituksia ennenaikaisesti syntyneillä vauvoilla, joille on annettu systeemisesti kortikosteroideja, mukaan lukien deksametasonia. Suurimmassa osassa ilmoitettuja tapauksia haittavaikutus korjaantui, kun hoito lopetettiin. Systeemisesti deksametasonilla hoidettavien keskosten sydämen toimintaa ja rakennetta on arvioitava ja seurattava (kohta Haittavaikutukset).
Jos potilasta hoidetaan jo systeemisillä (suun kautta otettavilla) kortikosteroideilla jostakin muusta syystä (esim. keuhkoahtaumataudin takia) eikä hän tarvitse lisähappea, systeemistä kortikosteroidihoitoa ei pidä lopettaa.
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”
Yhteisvaikutukset
Rifampisiini, rifabutiini, karbamatsepiini, fenobarbitaali, fenytoiini, primidoni ja aminoglutetimidi kiihdyttävät glukokortikoidien metaboliaa, ja terapeuttinen vaikutus voi heiketä.
Glukokortikoidit voivat estää sokeritautilääkkeiden (insuliini mukaan lukien), verenpainelääkkeiden ja diureettien vaikutusta ja voimistaa asetatsolamidin, loop-diureettien, tiatsididiureettien ja karbenoksolonin hypokaleemista vaikutusta.
Kumariiniantikoagulanttien vaikutus voi voimistua samanaikaisen glukokortikoidihoidon aikana, ja veren hyytymisarvoja, esim. protrombiiniaikaa, on seurattava tarkoin spontaanivuodon välttämiseksi.
Salisylaattien munuaispuhdistuma lisääntyy glukokortikoidihoidon aikana, ja hoidon lopettaminen voi johtaa salisylaattimyrkytykseen.
Deksametasoni on kohtalainen CYP3A4:n induktori. Deksametasonin anto samanaikaisesti CYP3A4:n kautta metaboloituvien lääkkeiden (mm. indinaviiri, erytromysiini) kanssa voi lisätä niiden puhdistumaa, mikä johtaa näiden lääkkeiden pienempiin pitoisuuksiin plasmassa.
Yhteiskäytön CYP3A:n estäjien kuten kobisistaattia sisältävien valmisteiden kanssa odotetaan suurentavan systeemisten haittavaikutusten riskiä. Tämän yhdistelmän käyttöä on vältettävä, ellei hyöty ole suurempi kuin suurentunut systeemisten kortikosteroidihaittavaikutusten riski, jolloin potilaita on seurattava systeemisten kortikosteroidihaittavaikutusten varalta.
Raskaus ja imetys
Raskaus
Deksametasoni läpäisee istukan helposti.
Kortikosteroidien antaminen tiineille eläimille voi aiheuttaa sikiönkehityksen poikkeavuuksia, mukaan lukien suulakihalkioita, sikiön kasvun hidastumista ja vaikutuksia aivojen kasvuun ja kehitykseen. Ei ole näyttöä siitä, että kortikosteroidit lisäisivät synnynnäisten epämuodostumien, kuten suulakihalkion/huulihalkion esiintyvyyttä ihmisissä. Ks. myös kohta Prekliiniset tiedot turvallisuudesta.
Vastasyntyneellä voi esiintyä hypoandrenalismia.
Jos glukokortikoidihoito kuitenkin on välttämätöntä (esim. hengitysvajauksen, RDS, estämiseksi) ja raskaus etenee normaalisti, voidaan äitiä hoitaa aivan kuten henkilöä, joka ei ole raskaana. Jos potilaalla on pre-eklampsia tai nesteretentiota, häntä on seurattava huolellisesti.
Tutkimuksissa on osoitettu, että vastasyntyneiden hypoglykemian riski on suurentunut, kun kortikosteroideja, myös deksametasonia, on annettu lyhytaikaisesti raskauden aikana naisille, joilla oli myöhäisen ennenaikaisen synnytyksen riski.
Imetys
Glukokortikoidit erittyvät vähäisessä määrin äidinmaitoon, ja farmakologisia annoksia saavien äitien lapsia on seurattava huolellisesti lisämunuaissuppression varalta.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Glukokortikoidit voivat aiheuttaa mielialanvaihteluita tai näköhäiriöitä. Jos niitä ilmenee, on varottava autolla-ajoa ja koneiden käyttöä.
Haittavaikutukset
Tuumorinhajoamisoireyhtymää on raportoitu hyvin harvoin (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Glukokortikoidien odotettavissa olevien haittavaikutusten ilmaantuvuus on yhteydessä annokseen, annosteluajankohtaan ja hoidon kestoon. Lääkärin on tasapainotettava glukokortikoidien terapeuttinen vaikutus ja haittavaikutusriski käyttämällä pienintä mahdollista tehokasta annosta lyhyimmän mahdollisen ajan, mieluiten joka toisen päivän hoitokaavion mukaan. Haittavaikutusten varhainen havaitseminen ja asianmukainen hoito voivat minimoida mahdollisesti vaikeat glukokortikoidihoidon komplikaatiot.
Maha- ja pohjukaissuolen haavaumia ja mahdollista verenvuotoa voi joskus esiintyä lyhytaikaisen hoidon jälkeen.
Seuraavat haittavaikutukset on liitetty pitkäaikaiseen systeemiseen glukokortikoidihoitoon:
Endokriiniset/metaboliset. Hypotalamus-aivolisäke-lisämunuaisakselin suppressio, kasvun hidastuminen lapsilla ja nuorilla, kuukautisten epäsäännöllisyys ja poisjääminen. Cushingin kasvomuutokset, hirsutismi, painonnousu, heikentynyt hiilihydraattien sieto ja sokeritautilääkityksen tarpeen lisääntyminen. Negatiivinen proteiini- ja kalsiumtasapaino. Ruokahalun lisääntyminen.
Anti-inflammatoriset jaimmunosuppressiivisetvaikutukset. Lisääntynyt infektioalttius ja vakavien infektioiden kliinisten oireiden peittyminen, opportunisti-infektiot, tuberkuloosin aktivoituminen.
Muskuloskeletaaliset. Osteoporoosi, selkänikamien ja pitkien luiden murtumat, avaskulaarinen osteonekroosi, jänneruptuura. Proksimaalinen myopatia.
Neste- jaelektrolyyttihäiriöt. Natriumin ja veden retentio, hypertensio, kaliumhukka, hypokaleeminen alkaloosi.
Neuropsykiatriset. Euforia, psykologinen riippuvuus, depressio, insomnia, skitsofrenian paheneminen. Kallonsisäisen paineen nousu ja papillödeema lapsilla (pseudotumour cerebri), tavallisesti hoidon lopettamisen jälkeen. Epilepsian paheneminen.
Silmät. Silmänpaineen nousu, glaukooma, papillödeema, posteriorinen subkapsulaarinen kaihi, kornean ja skleran oheneminen, silmän virus- tai sieni-infektioiden paheneminen, korioretinopatia, näön hämärtyminen (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet).
Gastrointestinaaliset. Dyspepsia, peptinen haavauma, perforaatio ja verenvuoto, akuutti pankreatiitti, kandidiaasi.
Iho. Huonontunut paraneminen, ihoatrofia, mustelmat, telangiektasiat, striamuodostus, akne.
Yleiset. Yliherkkyyttä, myös anafylaksiaa ja angioedeemaa on raportoitu. Leukosytoosi. Tromboembolia.
Sydän. Hypertrofinen kardiomyopatia ennenaikaisesti syntyneillä vauvoilla (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) (esiintymistiheys tuntematon).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty‐haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Glukokortikoidin liika-annosta on vaikea määritellä, koska terapeuttinen annos vaihtelee indikaation ja potilaan tarpeiden mukaan. Massiiviset laskimonsisäiset glukokortikoidiannokset pulssihoitona hätätilanteissa ovat suhteellisen haitattomia. Glukokortikoidivaikutus voi ilmetä liian voimakkaana. Hoito on oireenmukaista ja tarpeen mukaan tukihoitoa.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Systeemisesti käytettävät kortikosteroidit, Glukokortikoidit, ATC-koodi: H02AB02
Deksametasoni on synteettinen glukokortikoidi, jonka anti-inflammatorinen vaikutus on noin 7-kertainen prednisoloniin ja 30-kertainen hydrokortisoniin verrattuna.
Glukokortikoidit vaikuttavat hypotalamus-hypofyysiakseliin spesifisissä solukalvoreseptoreissa. Muihin kudoksiin glukokortikoidit diffundoituvat solukalvon läpi ja sitoutuvat spesifisiin sytoplasmareseptoreihin, jotka sen jälkeen siirtyvät tumaan ja stimuloivat proteiinisynteesiä. Glukokortikoideilla on antiallerginen, antitoksinen, antisokki-, antipyreettinen ja immunosuppressiivinen vaikutus.
Deksametasonilla on vain vähäinen mineralokortikoidivaikutus, jonka vuoksi se sopii käytettäväksi potilailla, joilla on sydämen vajaatoiminta tai hypertensio.
RECOVERY-tutkimus (Randomised Evaluation of COVid-19 thERapY)1 on tutkijalähtöinen, yksilöllisesti satunnaistettu, kontrolloitu, avoin, adaptiivisesti toteutettava platform-tutkimus, jossa arvioidaan mahdollisten hoitojen vaikutuksia potilaisiin, jotka ovat sairaalahoidossa COVID-19:n takia.
Tutkimus tehtiin Isossa-Britanniassa 176 sairaalaorganisaatiossa.
Yhteensä 6 425 potilasta satunnaistettiin saamaan joko deksametasonia (2 104 potilasta) tai pelkkää tavanomaista hoitoa (4 321 potilasta). Potilaista 89 %:lla oli laboratoriokokein varmistettu SARS-CoV-2-infektio.
Satunnaistamisvaiheessa 16 % potilaista tarvitsi kajoavaa hengityskonehoitoa tai ECMO-hoitoa (kehonulkoista happeuttamista), 60 % sai ainoastaan happea (kajoamattoman ventilaation kanssa tai ilman sitä) ja 24 % ei saanut mitään näistä.
Potilaiden keskimääräinen ikä oli 66,1 +/- 15,7 vuotta. Potilaista 36 % oli naisia. Potilaista 24 %:lla oli anamneesissa diabetes, 27 %:lla sydänsairaus ja 21 %:lla krooninen keuhkosairaus.
Ensisijainen päätetapahtuma
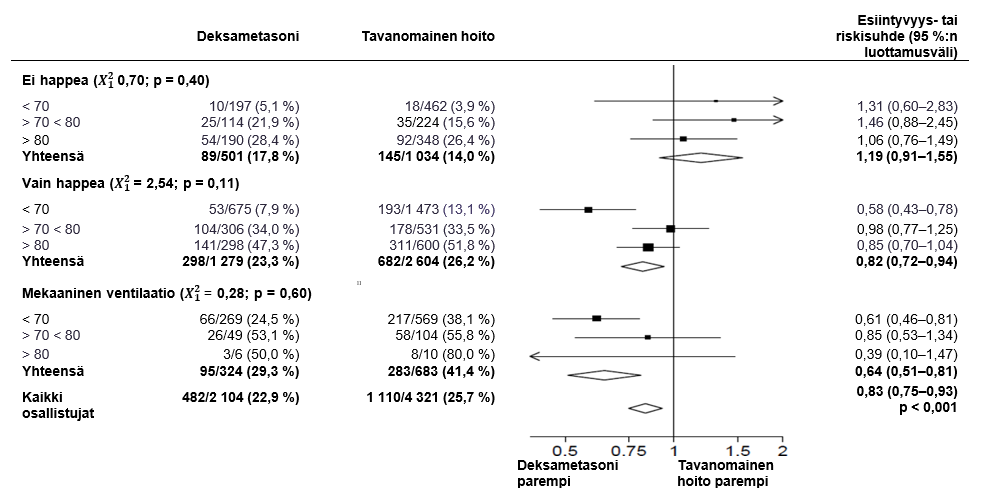
Kuolleisuus 28 päivän kohdalla oli merkitsevästi pienempi deksametasonia saaneessa ryhmässä, jossa 482 potilaan 2 104:stä (22,9 %) ilmoitettiin kuolleen, verrattuna tavanomaista hoitoa saaneeseen ryhmään, jossa 1 110 potilaan 4 321:sta (25,7 %) ilmoitettiin kuolleen (esiintyvyyssuhde 0,83; 95 %:n luottamusväli 0,75–0,93; p < 0,001).
Deksametasoniryhmässä kuoleman ilmaantuvuus oli pienempi kuin tavanomaista hoitoa saaneessa ryhmässä niillä potilailla, joita hoidettiin kajoavalla hengityskonehoidolla (29,3 % vs. 41,4 %; esiintyvyyssuhde 0,64; 95 %:n luottamusväli 0,51–0,81), ja niillä potilailla, jotka saivat lisähappea, mutta joita ei hoidettu kajoavalla hengityskonehoidolla (23,3 % vs. 26,2 %; esiintyvyyssuhde 0,82; 95 %:n luottamusväli 0,72–0,94).
Deksametasonilla ei todettu selkeää vaikutusta potilaisiin, jotka eivät saaneet satunnaistamisvaiheessa mitään hengitystukea (17,8 % vs. 14,0 %; esiintyvyyssuhde 1,19; 95 %:n luottamusväli 0,91–1,55).
Toissijaiset päätetapahtumat
Deksametasoniryhmän potilaiden sairaalahoitojakso oli lyhyempi kuin tavanomaista hoitoa saaneen ryhmän potilaiden (mediaani 12 vuorokautta vs. 13 vuorokautta), ja heillä oli suurempi todennäköisyys kotiutua sairaalasta elossa 28 vuorokauden kuluessa (esiintyvyyssuhde 1,10; 95 %:n luottamusväli 1,03–1,17).
Suurin vaikutus kotiutumiseen 28 vuorokauden sisällä oli ensisijaisen päätetapahtuman tavoin havaittavissa potilailla, joita hoidettiin satunnaistamisvaiheessa kajoavalla hengityskonehoidolla (esiintyvyyssuhde 1,48; 95 %:n luottamusväli 1,16–1,90). Seuraavaksi suurin vaikutus oli havaittavissa potilailla, jotka saivat vain happea (esiintyvyyssuhde 1,15; 95 %:n luottamusväli 1,06–1,24), ja hyödyllistä vaikutusta ei todettu lainkaan potilailla, jotka eivät saaneet happihoitoa (esiintyvyyssuhde 0,96; 95 %:n luottamusväli 0,85–1,08).
Hoitotulos | Deksametasoni (N = 2 104) | Tavanomainen hoito (N = 4 321) | Esiintyvyys- tai riskisuhde (95 %:n luottamusväli)* |
potilaiden lukumäärä/kokonaismäärä (%) | |||
Ensisijainen hoitotulos | |||
Kuolleisuus 28 vrk:n kohdalla | 482 / 2 104 (22,9) | 1 110 / 4 321 (25,7) | 0,83 (0,75–0,93) |
Toissijaiset hoitotulokset | |||
Sairaalasta kotiutuminen 28 vrk:n sisällä | 1 413 / 2 104 (67,2) | 2 745 / 4 321 (63,5) | 1,10 (1,03–1,17) |
Kajoava hengityskonehoito tai kuolema†
- Kajoava hengityskonehoito
- Kuolema | 456 / 1 780 (25,6) | 994 / 3 638 (27,3) | 0,92 (0,84–1,01) |
102 / 1 780 (5,7) | 285 / 3 638 (7,8) | 0,77 (0,62–0,95) | |
387 / 1 780 (21,7) | 827 / 3 638 (22,7) | 0,93 (0,84–1,03) | |
* Esiintyvyyssuhteet on vakioitu iän suhteen 28 vuorokauden kuolleisuutta ja sairaalasta kotiutumista koskevien hoitotulosten osalta. Riskisuhteet on vakioitu iän suhteen kajoavaa hengityskonehoitoa tai kuolemaa ja sen osakomponentteja koskevien hoitotulosten osalta.
† Tästä kategoriasta suljettiin pois potilaat, joita hoidettiin satunnaistamisvaiheessa kajoavalla hengityskonehoidolla.
Turvallisuus
Tutkimushoitoon liittyviä vakavia haittatapahtumia (SAE) todettiin neljä: kaksi hyperglykemiatapausta, yksi steroideista aiheutunut psykoosi ja yksi ylemmän maha-suolikanavan verenvuoto. Kaikki tapahtumat korjaantuivat.
Alaryhmäanalyysit
DEKSAMETASONIHOITOON määräämisen vaikutukset 28 vuorokauden kuolleisuuteen iän ja satunnaistamisvaiheessa saadun hengitystuen mukaan2
DEKSAMETASONIHOITOON määräämisen vaikutukset 28 vuorokauden kuolleisuuteen satunnaistamisvaiheessa saadun hengitystuen ja anamneesissa olevien kroonisten sairauksien mukaan3
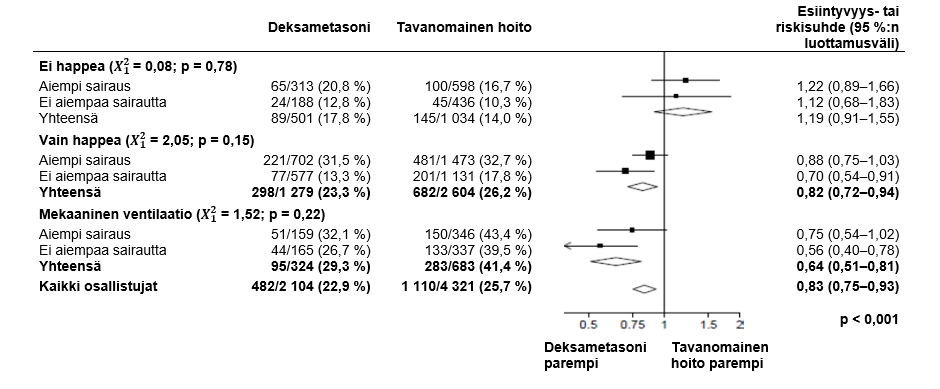
2, 3 (lähde: Horby P. et al., 2020; https://www.medrxiv.org/content/10.1101/2020.06.22.20137273v1; doi: https://doi.org/10.1101/2020.06.22.20137273)
Farmakokinetiikka
Imeytyminen
Oradexon injektion jälkeen deksametasoninatriumfosfaatti hydrolysoituu nopeasti deksametasoniksi. Annettaessa 20 mg deksametasonia laskimoon huippupitoisuus plasmassa saavutetaan 5 minuutissa.
Jakautuminen
Deksametasoni sitoutuu (ad 77 %:sti) plasmaproteiineihin, pääosin albumiiniin. Deksametasoni kertyy maksaan, munuaisiin ja lisämunuaisiin.
Biotransformaatio ja eliminaatio
Se metaboloituu maksassa hitaasti ja erittyy lähinnä virtsaan, suureksi osaksi konjugoitumattomina steroideina. Eliminaation puoliintumisaika plasmassa on 3,5-4,5 tuntia, mutta koska vaikutukset kestävät pitempään kuin merkitsevät steroidipitoisuudet plasmassa, puoliintumisajalla plasmassa ei ole sanottavaa merkitystä ja biologinen puoliintumisaika on merkityksellisempi. Deksametasonin biologisen aktiivisuuden puoliintumisaika on 36-54 tuntia.
Prekliiniset tiedot turvallisuudesta
Eläinkokeissa on havaittu suulakihalkioita rotilla, hiirillä, hamstereilla, kaneilla, koirilla ja kädellisillä: näitä ei ole havaittu hevosilla eikä lampailla. Joissakin tapauksissa näihin poikkeavuuksiin liittyi keskushermosto- ja sydänvikoja. Kädellisillä havaittiin vaikutuksia aivoissa altistuksen jälkeen. Lisäksi sikiön kasvu voi hidastua. Kaikkia näitä vaikutuksia havaittiin käytettäessä suuria annoksia.
Farmaseuttiset tiedot
Apuaineet
Dinatriumedetaatti, glyseroli, natriumhydroksidi ja fosforihappo, injektionesteisiin käytettävä vesi.
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta.
Säilytys
Säilytä jääkaapissa (2 ºC – 8 ºC). Ei saa jäätyä. Säilytä alkuperäispakkauksessa.
Infuusionesteisiin laimennettu Oradexon säilyttää tehonsa joko 12 tuntia säilytettynä huoneenlämmössä (15 º – 25 ºC) tai 24 tuntia säilytettynä 2–8 oC:ssa.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
ORADEXON injektioneste, liuos
5 mg/ml (L:ei) 10 x 1 ml (33,05 €)
PF-selosteen tieto
10 x 1 ml ja 50 x 1 ml
2 ml:n väritön injektiopullo.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Väritön, kirkas liuos.
Käyttö- ja käsittelyohjeet
Ei erityisvaatimuksia.
Korvattavuus
ORADEXON injektioneste, liuos
5 mg/ml 10 x 1 ml
- Ei korvausta.
ATC-koodi
H02AB02
Valmisteyhteenvedon muuttamispäivämäärä
29.08.2022
Yhteystiedot
Borupvang 3
2750 Ballerup
Denmark
+358 9 74790156
aspennordic@aspenpharma.eu
