CETIMAX tabletti, kalvopäällysteinen 10 mg
not_interestedSaatavuushäiriö
Ei saatavilla
CETIMAX tabletti, kalvopäällysteinen
- 10 mg100 fol13.02.2026 - 18.03.2026
Saatavilla
Saman valmisteen muut pakkaukset ja/tai vaihtokelpoiset valmisteet
CETIMAX tabletti, kalvopäällysteinen
- 10 mg10 fol, 30 fol, 100 fol
CETIRIZIN SANDOZ tabletti, kalvopäällysteinen
- 10 mg100 fol
CETIRIZIN-RATIOPHARM tabletti, kalvopäällysteinen
- 10 mg10 fol, 30 fol, 100 fol
HEINIX tabletti, kalvopäällysteinen
- 10 mg10 fol, 30 fol, 30 fol, 100 fol, 100 fol
HISTEC tabletti, kalvopäällysteinen
- 10 mg10 fol, 30 fol, 100 fol, 100 fol
ZYRTEC tabletti, kalvopäällysteinen (ORIFARM)
- 10 mg30 fol
ZYRTEC tabletti, kalvopäällysteinen (UCB)
- 10 mg10 fol, 30 fol
Muut samaa lääkeainetta sisältävät valmisteet
HEINIX imeskelytabletti, puristettu
- 10 mg14 fol, 28 fol
HISTEC imeskelytabletti, puristettu
- 10 mg14 fol, 28 fol
ZYRTEC tipat, liuos (ORIFARM)
- 10 mg/ml20 ml
ZYRTEC tipat, liuos (PARANOVA)
- 10 mg/ml20 ml
ZYRTEC oraaliliuos (UCB)
- 1 mg/ml75 ml
ZYRTEC tipat, liuos (UCB)
- 10 mg/ml20 ml
Vaikuttavat aineet ja niiden määrät
Yksi kalvopäällysteinen tabletti sisältää 10 mg setiritsiinidihydrokloridia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Kalvopäällysteinen tabletti.
Kliiniset tiedot
Käyttöaiheet
Aikuiset ja vähintään 6-vuotiaat lapset:
- setiritsiini on tarkoitettu lievittämään kausiluontoiseen ja ympärivuotiseen allergiseen nuhaan liittyviä nenä- ja silmäoireita.
- setiritsiini on tarkoitettu kroonisen idiopaattisen urtikarian oireiden hoitoon.
Annostus ja antotapa
Annostus
Aikuiset
10 mg kerran vuorokaudessa (1 tabletti).
Iäkkäät potilaat
Tiedot viittaavat siihen, ettei iäkkäiden potilaiden annostusta tarvitse pienentää, jos heidän munuaisensa toimivat normaalisti.
Keskivaikeaa tai vaikeaa munuaisten vajaatoimintaa sairastavat
Munuaisten vajaatoimintaa sairastavista ei ole tietoja teho-/turvallisuussuhteen dokumentoimiseksi. Koska setiritsiini eliminoituu lähinnä munuaisten kautta (ks. kohta Farmakokinetiikka), antoväliä on muutettava yksilöllisesti munuaisten toiminnan mukaisesti, jos potilaalle ei ole muita hoitovaihtoehtoja. Katso annostusohjeet seuraavasta taulukosta ja muuta annosta sen mukaisesti. Jotta annostus voidaan määritellä tämän annostustaulukon avulla, potilaan kreatiniinipuhdistuma ml/min (CLcr) on arvioitava. CLcr-arvo (ml/min) voidaan arvioida seerumin kreatiniiniarvon (mg/dl) perusteella seuraavan laskukaavan avulla:
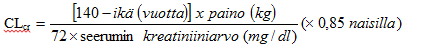
Munuaisten vajaatoimintaa sairastavien aikuispotilaiden annoksen muuttaminen:
| Potilasryhmä | Kreatiniinipuhdistuma (ml/min) | Annostus ja antoväli |
|---|---|---|
| Normaali | ≥80 | 10 mg kerran vuorokaudessa |
| Lievä | 50 – 79 | 10 mg kerran vuorokaudessa |
| Keskivaikea | 30 – 49 | 5 mg kerran vuorokaudessa |
| Vaikea | <30 | 5 mg joka toinen vuorokausi |
| Loppuvaiheen munuaissairaus tai dialyysihoitoa saavat potilaat | <10 | Vasta-aiheinen |
Maksan vajaatoimintaa sairastavat
Jos potilaalla on pelkästään maksan vajaatoiminta, annostusta ei tarvitse muuttaa. Potilailla, joilla on maksan-ja munuaisten vajaatoiminta, suositellaan annostuksen muuttamista (Katso Keskivaikeaa tai vaikeaa munuaisten vajaatoimintaa sairastavat yläpuolella).
Pediatriset potilaat
Tablettimuotoa ei tulisi käyttää alle 6-vuotiaille lapsille, koska se ei salli tarvittavia annosmuutoksia.
6−12-vuotiaat lapset: 5 mg kaksi kertaa vuorokaudessa (puolikas tabletti kaksi kertaa vuorokaudessa).
Yli 12-vuotiaat nuoret: 10 mg kerran päivässä (1 tabletti).
Jos lapsipotilaalla on munuaisten vajaatoiminta, annostusta on muutettava yksilöllisesti potilaan munuaispuhdistuman, iän ja painon perusteella.
Antotapa
Tabletin nielemisen yhteydessä on juotava lasillinen nestettä.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle; kohdassa Apuaineet mainituille apuaineille, hydroksitsiinille tai piperatsiinijohdokselle.
Vaikeaa munuaisten vajaatoimintaa sairastavan kreatiniinipuhdistuma on alle 10 ml/min.
Varoitukset ja käyttöön liittyvät varotoimet
Kun valmistetta on käytetty hoitoannoksina, alkoholin (veren alkoholipitoisuus 0,5 g/l) yhteydessä ei ole osoitettu kliinisesti merkitseviä yhteisvaikutuksia. Tästä huolimatta alkoholin samanaikaisessa käytössä suositellaan varovaisuutta.
Varovaisuutta on noudatettava niiden potilaiden kohdalla, joilla on virtsaumpeen altistavia tekijöitä (esimerkiksi selkäydinvamma, eturauhasen liikakasvu), sillä setiritsiini voi lisätä riskiä saada virtsaumpi.
Epilepsiapotilaiden hoidossa samoin kuin silloin, jos potilaalla on kouristusten riski, on oltava varovainen.
Koska antihistamiinit saattavat vaikuttaa allergia ihotestien tuloksiin, valmisteen käyttö on lopetettava 3 päivää ennen allergiatestiä.
Pediatriset potilaat
Tabletteja ei suositella alle 6-vuotiaiden lasten hoitoon, koska tämän lääkemuodon käytön yhteydessä asianmukaiset annosmuutokset eivät ole mahdollisia. Lapsille suositellaan käytettäväksi lapsille tarkoitettua lääkemuotoa.
Yhteisvaikutukset
Setiritsiinin farmakokineettisten, farmakodynaamisten ja siedettävyysominaisuuksien perusteella tämän antihistamiinin käytön yhteydessä ei odoteta esiintyvän yhteisvaikutuksia. Tehdyissä lääkeaineiden yhteisvaikutustutkimuksissa ei raportoitu farmakodynaamisia eikä merkitseviä farmakokineettisiä yhteisvaikutuksia, etenkään pseudoefedriinin tai teofylliinin (400 mg/vrk) kanssa.
Ruokailu ei heikennä setiritsiinin imeytymistä, vaikka imeytymisnopeus hidastuu.
Alkoholin ja muiden keskushermoston toimintaa vaimentavien aineiden samanaikainen käyttö voi entisestään heikentää herkkien potilaiden tarkkaavaisuutta ja suorituskykyä, vaikka setiritsiini ei voimistakaan alkoholin vaikutusta (veren alkoholipitoisuus 0,5g/l).
Raskaus ja imetys
Raskaus
Prospektiivisesti kerätyt tiedot raskauksien lopputuloksesta eivät viittaa siihen, että setiritsiini aiheuttaisi äitiin tai sikiöön/alkioon kohdistuvaa toksisuutta esiintyvyyden taustatasoa enemmän.
Eläinkokeiden tulokset eivät viittaa siihen, että setiritsiinillä olisi suoria tai epäsuoria haitallisia vaikutuksia raskauteen, alkion tai sikiön kehitykseen, synnytykseen tai postnataaliseen kehitykseen. Valmisteen määräämisessä raskaana oleville naisille on oltava varovainen.
Imetys
Setiritsiini erittyy äidinmaitoon pitoisuuksissa, jotka ovat mittausajankohdasta riippuen 25 % – 90 % plasman setiritsiinipitoisuuksiin nähden. Valmisteen määräämisessä imettäville naisille on oltava varovainen.
Hedelmällisyys
Ihmisen hedelmällisyyteen kohdistuvista vaikutuksista on rajoitetusti tietoa, mutta turvallisuuteen liittyviä ongelmia ei ole havaittu. Prekliiniset tiedot eivät ole tuoneet esiin turvallisuutta koskevia huolenaiheita ihmisen lisääntymisen kannalta.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Ajokyvyn, univiiveen ja kokoonpanolinjalla tehdyn työsuorituksen objektiiviset mittaukset eivät osoittaneet suositellulla annoksella 10 mg olevan kliinisesti merkitseviä vaikutuksia.
Jos potilaalla kuitenkin ilmenee uneliaisuutta, hänen on pidättäydyttävä auton ajamisesta, mahdollisesti vaaraa aiheuttavista toimista ja koneiden käytöstä.
Suositusannosta ei saa ylittää, ja potilaan vaste lääkehoitoon on huomioitava.
Haittavaikutukset
Kliiniset tutkimukset
- Yleiskatsaus
Kliiniset tutkimukset ovat viitanneet siihen, että setiritsiini aiheuttaa suositusannoksina käytettäessä vähäisiä haitallisia keskushermostovaikutuksia, kuten uneliaisuutta, uupumusta, heitehuimausta ja päänsärkyä. Muutamissa tapauksissa on ilmoitettu paradoksista keskushermoston stimulaatiota.
Vaikka setiritsiini on selektiivinen perifeeristen H1-reseptorien salpaaja eikä sillä ole juuri lainkaan antikolinergisiä vaikutuksia, yksittäisinä tapauksina on raportoitu esiintyneen virtsaamisvaikeuksia, silmän mukautumiskyvyn häiriöitä ja suun kuivumista.
Maksan toiminnan poikkeavuuksia, joihin on liittynyt maksaentsyymipitoisuuden suurenemista ja bilirubiiniarvojen suurenemista, on raportoitu. Tällaiset vaikutukset häviävät useimmiten setiritsiinidihydrokloridihoidon lopettamisen jälkeen.
- Haittavaikutusten luettelo
Kaksoissokkoutetuissa kontrolloiduissa kliinisissä tutkimuksissa verrattiin setiritsiiniä (10 mg vuorokaudessa) lumelääkkeeseen tai muihin antihistamiineihin sellaisina suositeltuina annoksina, joista on runsaasti turvallisuustietoja saatavissa, ja yli 3200 potilasta altistettiin setiritsiinille.
Näiden yhdistettyjen tietojen perusteella lumelääkekontrolloiduissa tutkimuksissa 10 mg:n setiritsiiniannoksia saaneilla potilailla raportoitiin esiintyneen seuraavia haittavaikutuksia 1,0 %:lla potilaista tai yleisemmin:
Haittavaikutus (WHO-ART) | Setiritsiini 10 mg (n=3260) | Lumelääke (n=3061) |
Yleisoireet ja antopaikassa todettavat haitat Uupumus | 1,63 % | 0,95 % |
Hermosto Heitehuimaus Päänsärky | 1,10 % 7,42 % | 0,98 % 8,07 % |
Ruoansulatuselimistö Vatsakipu Suun kuivuminen Pahoinvointi | 0,98 % 2,09 % 1,07 % | 1,08 % 0,82 % 1,14 % |
Psyykkiset häiriöt Uneliaisuus | 9,63 % | 5,00 % |
Hengityselimet, rintakehä ja välikarsina Nielutulehdus | 1,29 % | 1,34 % |
Vaikka uneliaisuus oli tilastollisesti yleisempää kuin lumelääkkeen yhteydessä, se oli useimmiten lievää tai keskivaikeaa. Toisten tutkimusten perusteella objektiivisiksi osoitetut testit viittasivat siihen, etteivät suositellut vuorokausiannokset vaikuttaneet nuorten terveiden vapaaehtoisten koehenkilöiden tavanomaisiin päivittäisiin toimiin.
Pediatriset potilaat
Lumelääkekontrolloituihin kliinisiin tutkimuksiin osallistuneissa lapsissa, jotka olivat iältään 6 kuukaudesta 12 vuoteen, 1 %:lla potilaista tai yleisemmin esiintyneitä haittavaikutuksia olivat:
Haittavaikutus (WHO-ART) | Setiritsiini 10 mg (n=1656) | Lumelääke (n=1294) |
Ruoansulatuselimistö Ripuli | 1,0 % | 0,6 % |
Psyykkiset häiriöt Uneliaisuus | 1.8 % | 1,4 % |
Hengityselimet, rintakehä ja välikarsina Nuha | 1,4 % | 1,1 % |
Yleisoireet ja antopaikassa todettavat haitat Uupumus | 1,0 % | 0,3 % |
Myyntiluvan saamisen jälkeinen käyttökokemus
Kliinisissä tutkimuksissa raportoitujen ja edellä lueteltujen haittavaikutusten lisäksi myyntiluvan saamisen jälkeisen käyttökokemuksen yhteydessä on raportoitu esiintyneen seuraavia haittavaikutuksia. Haittavaikutukset on lueteltu MedDRA-luokittelun mukaan ja arviot niiden esiintymistiheydestä perustuvat valmisteen myyntiin tulon jälkeiseen käyttökokemukseen.
Haittavaikutusten frekvenssiluokitus on seuraava:
- Hyvin yleinen (≥ 1/10)
- Yleinen (≥ 1/100, < 1/10)
- Melko harvinainen (≥ 1/1 000, < 1/100)
- Harvinainen (≥ 1/10 000, < 1/1 000)
- Hyvin harvinainen (< 1/10 000)
- Tuntematon (koska saatavissa oleva tieto ei riitä arviointiin)
Veri ja imukudos:
hyvin harvinainen: trombosytopenia
Immuunijärjestelmä:
harvinainen: yliherkkyys
hyvin harvinainen: anafylaktinen sokki
Aineenvaihdunta ja ravitsemus:
tuntematon: lisääntynyt ruokahalu
Psyykkiset häiriöt:
melko harvinainen: agitaatio
harvinainen: aggressiivisuus, sekavuus, masennus, aistiharhat, unettomuus
hyvin harvinainen: nykimisoire
tuntematon: itsemurha-ajatukset
Hermosto:
melko harvinainen: parestesiat
harvinainen: kouristukset
hyvin harvinainen: makuhäiriö, pyörtyminen, vapina, dystonia, dyskinesia
tuntematon: muistinmenetys, muistin heikkeneminen
Silmät:
hyvin harvinainen: mukautumishäiriöt, näön sumeneminen, silmien kiertoliike
Kuulo ja tasapainoelin:
tuntematon: huimaus
Sydän:
harvinainen: takykardia
Ruoansulatuselimistö:
melko harvinainen: ripuli
Maksa ja sappi:
harvinainen: maksan toiminnan poikkeavuudet (transaminaasiarvojen, alkalisen fosfataasin arvojen, gammaglutamyylitransferaasiarvojen ja bilirubiiniarvojen suureneminen).
Iho ja ihonalainen kudos:
melko harvinainen: kutina, ihottuma
harvinainen: nokkosihottuma
hyvin harvinainen: angioneuroottinen edeema, toistopunoittuma (erythema fixum)
Munuaiset ja virtsatiet:
hyvin harvinainen: dysuria, kastelu
tuntematon: virtsaumpi
Yleisoireet ja antopaikassa todettavat haitat:
melko harvinainen: voimattomuus, huonovointisuus
harvinainen: turvotus
Tutkimukset:
harvinainen: painon nousu
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Oireet
Setiritsiinin yliannoksen jälkeen havaitut oireet ovat liittyneet lähinnä keskushermostovaikutuksiin tai antikolinergisiin vaikutuksiin viittaaviin oireisiin.
Suositeltuun vuorokausiannokseen nähden vähintään viisinkertaisen annoksen ottamisen jälkeen raportoituja haittavaikutuksia ovat: sekavuus, ripuli, heitehuimaus, uupumus, päänsärky, huonovointisuus, silmän mustuaisen laajentuminen, kutina, levottomuus, sedaatio, uneliaisuus, tokkuraisuus, takykardia, vapina ja virtsaumpi.
Hoito
Setiritsiinille ei tunneta spesifistä vastavaikuttajaa.
Yliannostuksen yhteydessä suositellaan oireenmukaista ja elimistön toimintaa tukevaa hoitoa. Mahahuuhtelua voidaan harkita, jos lääkkeen nielemisestä on kulunut vasta vähän aikaa.
Setiritsiini ei poistu elimistöstä tehokkaasti dialyysin avulla.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: systeemiset antihistamiinit, piperatsiinijohdokset, ATC-koodi R06A E07.
Vaikutusmekanismi
Setiritsiini on hydroksitsiinin metaboliitti. Se on voimakas ja selektiivinen perifeeristen H1-reseptorien salpaaja. Tutkimukset in vitro lääkeaineen sitoutumisesta reseptoreihin eivät viitanneet mitattavissa olevaan affiniteettiin muihin kuin H1-reseptoreihin.
Farmakodynaamiset vaikutukset
Setiritsiinillä on osoitettu olevan sen H1-antagonistisen vaikutuksen lisäksi allergiaa lievittäviä vaikutuksia: kerran tai kaksi kertaa vuorokaudessa annettuina 10 mg:n annoksina se estää eosinofiilien loppuvaiheen aktivoitumista atooppisten potilaiden ihossa ja silmän sidekalvossa, kun heidät altistettiin allergeenille.
Kliininen teho ja turvallisuus
Terveille vapaaehtoisille tehdyt tutkimukset osoittivat, että annoksina 5 mg ja 10 mg annettu setiritsiini estää huomattavasti paukamien muodostumista ja ihon punoitusreaktioita, jotka aiheutuvat ihon hyvin suuresta histamiinipitoisuudesta, mutta vastaavuussuhdetta tehoon ei ole osoitettu.
Kuusi viikkoa kestäneessä lumelääkekontrolloidussa tutkimuksessa, joka tehtiin 186:lle allergista nuhaa ja samanaikaista lievää tai keskivaikeaa astmaa sairastavalle potilaalle, kerran vuorokaudessa annettu 10 mg:n setiritsiiniannos lievitti nuhaoireita, mutta ei muuttanut keuhkojen toimintaa. Tämän tutkimuksen tulokset tukevat sitä, että setiritsiini on turvallinen lievää tai keskivaikeaa astmaa sairastaville allergiapotilaille.
Lumelääkekontrolloidussa tutkimuksessa seitsemän vuorokauden ajan annetut suuret setiritsiiniannokset 60 mg vuorokaudessa eivät aiheuttaneet tilastollisesti merkitsevää QT-ajan pidentymistä.
Suositeltuina annoksina annetun setiritsiinin on osoitettu parantavan kausittaista tai ympärivuotista allergista nuhaa sairastavien potilaiden elämänlaatua.
Pediatriset potilaat
Lapsille (5–12-vuotiaille) tehdyssä 35 vuorokauden mittaisessa tutkimuksessa lapsille ei havaittu
kehittyneen toleranssia setiritsiinin antihistamiinivaikutukselle (paukamien ja ihon punoituksen
häviäminen). Kun setiritsiinihoito lopetetaan usean antokerran jälkeen, ihon normaalit reaktiot
histamiinille palautuvat kolmen vuorokauden kuluessa.
Farmakokinetiikka
Imeytyminen
Plasman vakaan tilan pitoisuus on noin 300 ng/ml ja se saavutetaan 1,0 ± 0,5 tunnin kuluessa. Farmakokineettisten muuttujien, kuten plasman huippupitoisuuden (Cmax) ja plasman lääkeainepitoisuuden aikakäyrän alle jäävän pinta-alan (AUC-arvon), jakautuminen on yksihuippuista.
Ruokailu ei vähennä setiritsiinin imeytymistä, mutta imeytymisnopeus hidastuu. Liuoksena, kapseleina ja tabletteina annetun setiritsiinin biologinen hyötyosuus on samankaltainen.
Jakautuminen
Näennäinen jakaantumistilavuus on 0,50 l/kg. Setiritsiinistä 93 ± 0,3 % sitoutuu plasman proteiineihin. Setiritsiini ei muuta varfariinin sitoutumista proteiineihin.
Biotransformaatio
Setiritsiini ei käy läpi laajaa alkureitin metaboliaa.
Eliminaatio
Terminaalinen puoliintumisaika on noin 10 tuntia ja setiritsiinin kertymistä ei ole havaittu 10 mg päiväannoksella 10 päivän ajan otettuna.
Noin kaksi kolmasosaa annoksesta erittyy muuttumattomana aineena virtsaan.
Lineaarisuus / ei-lineaarisuus
Setiritsiinin kinetiikka on lineaarinen annoksilla 5−60 mg.
Erityiset potilasryhmät
Iäkkäät: Kun 16 iäkkäälle potilaalle annettiin suun kautta 10 mg:n kerta-annos, puoliintumisaika oli noin 50 % pitempi ja puhdistuma 40 % pienempi verrattuna muista tutkimuspotilaista saatuihin tuloksiin. Näiden iäkkäiden vapaaehtoisten setiritsiinipuhdistuman heikkeneminen näytti olevan yhteydessä heidän munuaistensa toiminnan heikkenemiseen.
Pediatriset potilaat: Setiritsiinin puoliintumisaika oli 6−12-vuotiaiden lasten elimistössä noin 6 tuntia ja 2−6-vuotiaidenlasten elimistössä 5 tuntia. Imeväisikäisten ja pikkulasten (iältään 6 kuukaudesta 2 vuoteen) elimistössä se oli 3,1 tuntia.
Munuaisten vajaatoiminta: Lääkkeen farmakokinetiikka oli samankaltainen sekä lievää munuaisten vajaatoimintaa sairastavien (kreatiniinipuhdistuma yli 40 ml/min) että terveiden vapaaehtoisten elimistössä. Keskivaikeaa munuaisten vajaatoimintaa sairastavien elimistössä puoliintumisaika oli pidentynyt kolminkertaiseksi ja puhdistuma oli vähentynyt 70 % terveisiin vapaaehtoisiin verrattuna.
Hemodialyysihoitoa saaville potilaille (kreatiniinipuhdistuma alle 7 ml/min) kerta-annoksena suun kautta annetun 10 mg:n setiritsiiniannoksen puoliintumisaika oli kolminkertaistunut ja puhdistuma oli vähentynyt 70 % terveisiin vapaaehtoisiin verrattuna. Setiritsiini poistuu elimistöstä heikosti hemodialyysin avulla. Keskivaikeaa tai vaikeaa munuaisten vajaatoimintaa sairastavien annostusta on muutettava (ks. kohta Annostus ja antotapa).
Maksan vajaatoiminta: Kroonista maksasairautta (hepatosellulaarinen, kolestaattinen ja biliaarinen kirroosi) sairastaville annetun 10 mg:n tai 20 mg:n setiritsiinikerta-annoksen puoliintumisaika suureni 50 % ja puhdistuma heikkeni 40 % terveisiin vapaaehtoisiin verrattuna.
Annosmuutos on tarpeen vain, jos maksan vajaatoimintaa sairastavalla potilaalla on samanaikaisesti myös munuaisten vajaatoimintaa.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, genotoksisuutta, karsinogeenisuutta sekä reproduktiotoksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Farmaseuttiset tiedot
Apuaineet
Tabletin ydin:
- Mikrokiteinen selluloosa
- Pregelatinoitu tärkkelys
- Kroskarmelloosinatrium
- Piidioksidi, kolloidinen vedetön
- Magnesiumstearaatti
Tabletin päällyste:
- Polydekstroosi
- Hypromelloosi
- Titaanidioksidi (E171)
- Makrogoli
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
4 vuotta.
Säilytys
Säilytä alle 30 °C.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
CETIMAX tabletti, kalvopäällysteinen
10 mg (J) (L:ei) 100 fol (4,70 €)
Itsehoito
CETIMAX tabletti, kalvopäällysteinen
10 mg (J) (L:ei) 10 fol (3,87 €), 30 fol (7,62 €), 100 fol (15,44 €)
PF-selosteen tieto
Al/Al-läpipainopakkaus ja kartonkikotelo.
Pakkauskoot: 7, 10, 14, 20, 30, 50 ja 100 tablettia.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Valkoinen, pyöreä, kupera tabletti, jossa on jakouurre yhdellä puolella ja merkintä ”5”. Halkaisija on 7 mm.
Tabletin voi jakaa yhtä suuriin annoksiin.
Käyttö- ja käsittelyohjeet
Ei erityisvaatimuksia.
Korvattavuus
CETIMAX tabletti, kalvopäällysteinen
10 mg 100 fol
- Peruskorvaus (40 %).
CETIMAX tabletti, kalvopäällysteinen
10 mg 10 fol, 30 fol, 100 fol
- Ei korvausta.
ATC-koodi
R06AE07
Valmisteyhteenvedon muuttamispäivämäärä
18.09.2020
Yhteystiedot
 VITABALANS OY
VITABALANS OY Varastokatu 8
13500 Hämeenlinna
03-615 600
www.vitabalans.com
