MINULET tabletti, päällystetty 75/30 mikrog
Vaikuttavat aineet ja niiden määrät
Yksi tabletti sisältää 75 mikrogrammaa gestodeenia ja 30 mikrogrammaa etinyyliestradiolia.
Apuaineet, joiden vaikutus tunnetaan: Laktoosimonohydraatti 37,43 mg, sakkaroosi 19,7 mg
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Tabletti, päällystetty.
Kliiniset tiedot
Käyttöaiheet
Raskauden ehkäisy.
Minulet-valmisteen määräämistä koskevassa päätöksessä on otettava huomioon valmisteen käyttäjän nykyiset riskitekijät, erityisesti laskimotromboembolian (VTE) riskitekijät, ja millainen Minulet-valmisteen käytön VTE:n riski on verrattuna muiden yhdistelmäehkäisyvalmisteiden riskeihin (ks. kohdat Vasta-aiheet ja Varoitukset ja käyttöön liittyvät varotoimet).
Annostus ja antotapa
Älä aloita tai jatka Minulet-tablettien käyttöä, jos olet raskaana tai epäilet olevasi raskaana.
Minulet-tabletin ottaminen
Tabletit otetaan pakkaukseen merkityssä järjestyksessä joka päivä suurin piirtein samaan kellonaikaan pienen nestemäärän kera. Joka päivä otetaan yksi tabletti, 21 peräkkäisenä päivänä. Ennen uuden pakkauksen aloittamista pidetään seitsemän päivän tablettitauko, jonka aikana tulee tavallisesti tyhjennysvuoto. Vuoto alkaa yleensä 2–3 päivän kuluttua siitä, kun pakkauksen viimeinen tabletti on otettu ja saattaa jatkua vielä seuraavaa pakkausta aloitettaessa.
Minulet-tablettien käytön aloittaminen
Ei edeltävää hormonaalista ehkäisyä (kuluneen kuukauden aikana)
Tablettien käyttö aloitetaan luonnollisen kuukautiskierron ensimmäisenä päivänä (eli ensimmäisenä vuotopäivänä). Tablettien käyttö voidaan aloittaa myös kierron 2.–7. päivänä, mutta tällöin suositellaan lisäksi ensimmäisen kierron aikana jonkin ehkäisymenetelmän (kondomi, spermisidi) käyttöä ensimmäisten seitsemän tablettipäivän aikana.
Vaihto toisesta yhdistelmätablettivalmisteesta
Minulet-tablettien käyttö aloitetaan mieluiten aiemman yhdistelmätablettivalmisteen viimeisen vaikuttavan tabletin ottoa seuraavana päivänä, mutta viimeistään aiemman yhdistelmätablettivalmisteen tabletti- tai plasebotablettitauon päättymisen jälkeisenä päivänä.
Vaihto pelkkää progestiinia sisältävästä valmisteesta (minipilleri, injektio, implantti, kierukka)
Pelkkää progestiinia sisältävästä valmisteesta voidaan milloin tahansa siirtyä käyttämään Minulet-valmistetta, jolla jatketaan heti seuraavana päivänä. Minulet-tablettien käyttö aloitetaan implantin tai kierukan poistamisen jälkeen niiden poistopäivänä. Injektiota käytettäessä Minulet-tabletti otetaan samana päivänä, kun injektio on määrä antaa. Edellä mainituissa tilanteissa tulisi lisäksi käyttää ehkäisymenetelmää seitsemänä ensimmäisenä tablettipäivänä.
Ensimmäisellä raskauskolmanneksella tapahtuneen raskauden keskeytyksen jälkeen
Tablettien käyttö voidaan aloittaa heti. Muita ehkäisymenetelmiä ei tällöin tarvita.
Synnytyksen jälkeen
Koska tromboemboliariski synnytyksen jälkeen on suurentunut, yhdistelmäehkäisytablettien käyttö aloitetaan vasta 28 päivää synnytyksen (jos äiti ei imetä) tai toisella raskauskolmanneksella tapahtuneen raskauden keskeytyksen jälkeen. Naista on kehotettava käyttämään lisäksi jotain ehkäisymenetelmää ensimmäisten seitsemän tablettipäivän aikana. Jos hän on kuitenkin jo ollut yhdynnässä, raskaus on poissuljettava ennen yhdistelmäehkäisytablettien käytön varsinaista aloittamista tai naisen on odotettava seuraavien kuukautisten alkamista. (ks. kohta Raskaus ja imetys)
Tabletin unohtaminen
Ehkäisyn luotettavuus voi vähentyä, jos tabletin otto unohtuu ja etenkin jos tablettitauko pitenee.
- Jos tabletin unohtamisesta on ehtinyt kulua alle 12 tuntia, se on otettava heti kun asia muistuu mieleen ja sitä seuraavat tabletit tavanomaiseen aikaan.
-
Jos tabletin unohtamisesta on ehtinyt kulua yli 12 tuntia, ehkäisysuoja voi olla heikentynyt.
- Viimeinen unohdettu tabletti on otettava heti kun asia muistuu mieleen, vaikka tällöin olisi otettava kaksi tablettia samana päivänä. Seuraavat tabletit otetaan tavanomaiseen aikaan. Lisäksi tulisi käyttää jotain lisäehkäisyä, kuten kondomia, seuraavien 7 päivän ajan.
- Jos kyseinen 7 päivän jakso, jolloin tarvitaan lisäehkäisyä, kestää kauemmin kuin nykyinen pakkaus, uusi pakkaus on aloitettava heti edellisen loputtua eli pakkausten välissä ei pidetä tablettitaukoa. Tämä estää pitkittyneen tauon tablettien käytössä, mikä voi suurentaa hallitsemattoman ovulaation riskiä. Tyhjennysvuoto tulee todennäköisesti vasta toisen pakkauksen loputtua, mutta tiputteluvuotoa tai läpäisyvuotoa voi ilmetä tablettien käytön aikana.
- Jos tyhjennysvuoto ei ole tullut toisen pakkauksen loppuessa, raskauden mahdollisuus on poissuljettava ennen uuden pakkauksen aloittamista.
Oksenteluun ja/tai ripuliin liittyvät ohjeet
Oksentaminen tai ripuliulostus 4 tunnin sisällä tabletin ottamisesta saattaa johtaa valmisteen epätäydelliseen imeytymiseen. Tällöin sovelletaan ohjeita Tabletin unohtaminen. Naisen on otettava tarvittavat ylimääräiset tabletit uudesta pakkauksesta.
Kuukautisten siirtäminen
Kuukautisia voidaan siirtää myöhemmäksi aloittamalla uusi Minulet-pakkaus heti edellisen loputtua ilman tablettitaukoa. Kuukautisia voidaan siirtää niin pitkälle kuin halutaan, kuitenkin enintään toisen pakkauksen loppumiseen saakka. Tänä aikana voi esiintyä läpäisyvuotoa tai tiputteluvuotoa.
Minulet-tablettien säännöllinen käyttö aloitetaan uudestaan tavanomaisen seitsemän päivän tablettitauon jälkeen.
Pediatriset potilaat
Yhdistelmäehkäisytablettien turvallisuutta ja tehokkuutta on arvioitu fertiili-ikäisillä naisilla. Näitä valmisteita ei ole tarkoitettu lapsille tai murrosikäisille ennen kuukautisten alkamista.
Iäkkäät
Yhdistelmäehkäisytabletteja ei ole tarkoitettu käytettäväksi vaihdevuodet ohittaneilla naisilla.
Vasta-aiheet
Yhdistelmäehkäisyvalmisteita ei pidä käyttää seuraavien tilojen yhteydessä:
-
laskimotromboembolia (VTE) tai sen riski
- laskimotromboembolia ‑ tällä hetkellä esiintyvä VTE (potilas antikoagulanttilääkityksellä) tai anamneesissa VTE (esim. syvä laskimotromboosi [SLT] tai keuhkoembolia)
- tiedossa oleva perinnöllinen tai hankittu laskimotromboembolia-alttius, kuten APC-resistenssi, (mukaan lukien Faktori V Leiden), antitrombiini III:n puutos, C-proteiinin puutos, S-proteiinin puutos
- suuri leikkaus ja siihen liittyvä pitkittynyt immobilisaatio (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
- useiden riskitekijöiden aiheuttama suuri laskimotromboembolian riski (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
-
valtimotromboembolia tai sen riski
- valtimotromboembolia ‑ tällä hetkellä esiintyvä tai aiemmin esiintynyt valtimotromboembolia (esim. sydäninfarkti) tai sitä ennakoiva tila (esim. angina pectoris)
- aivoverisuonisairaus ‑ tällä hetkellä esiintyvä tai aiemmin esiintynyt aivohalvaus tai sitä ennakoiva tila (esim. ohimenevä aivoverenkiertohäiriö, TIA)
- tiedossa oleva perinnöllinen tai hankittu valtimotromboembolia-alttius, kuten hyperhomokysteinemia ja fosfolipidivasta-aineet (kardiolipiinivasta-aineet, lupusantikoagulantti)
- anamneesissa migreeni, johon liittyy fokaalisia neurologisia oireita
- monista riskitekijöistä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) tai yhden vakavan riskitekijän esiintymisestä johtuva suuri valtimotromboemboliariski. Näitä riskitekijöitä voivat olla:
- diabetes, jossa esiintyy verisuonioireita
- vaikea hypertensio
- vaikea dyslipoproteinemia.
- tromboflebiitti tai aiempi syvän laskimon tromboflebiitti
- trombogeeninen valvulopatia
- trombogeeninen rytmihäiriö
- todettu tai oletettu rintasyöpä
- endometriumin syöpä tai muu todettu tai epäilty estrogeenille herkkä neoplasia
- diagnosoimaton verenvuoto emättimestä
- kolestaattinen raskauteen liittyvä keltaisuus tai keltaisuus ennen yhdistelmäehkäisytablettien käyttöä
- maksa-adenooma tai karsinooma, tai aktiivinen maksasairaus, niin kauan kuin maksan toimintakokeiden arvot eivät ole palautuneet normaaleiksi
- todettu tai oletettu raskaus
- pankreatiitti tai aiempi pankreatiitti, jonka yhteydessä todettu vakava hypertriglyseridemia
- yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille.
Ombitasviirin, paritapreviirin ja ritonaviirin yhdistelmää ja dasabuviiria, glekapreviirin ja pibrentasviirin yhdistelmää tai sofosbuviirin, velpatasviirin ja voksilapreviirin yhdistelmää sisältävien lääkevalmisteiden samanaikainen käyttö Minulet-tablettien kanssa on vasta-aiheista (ks. kohta Yhteisvaikutukset).
Varoitukset ja käyttöön liittyvät varotoimet
VAROITUKSET
Minulet-valmisteen soveltuvuudesta on keskusteltava naisen kanssa, jos hänellä esiintyy mikä tahansa alla mainituista tiloista tai riskitekijöistä.
Jos jokin näistä tiloista tai riskitekijöistä pahenee tai ilmenee ensimmäisen kerran, käyttäjää on kehotettava ottamaan yhteys lääkäriin, joka päättää, pitääkö Minulet-valmisteen käyttö keskeyttää.
Yhdistelmäehkäisytablettien käyttöön liittyvä vaikeiden kardiovaskulaaristen haittavaikutusten riski kasvaa iän ja runsaan tupakoinnin myötä (vähintään 15 savuketta päivässä) ja on melko huomattava yli 35-vuotiailla naisilla. Siksi naisia, jotka käyttävät yhdistelmäehkäisytabletteja, on vakavasti kehotettava lopettamaan tupakointi.
1. Laskimo‑ ja valtimotromboosi ja tromboembolia
Laskimotromboembolian (VTE) riski
Minkä tahansa yhdistelmäehkäisyvalmisteen käyttö lisää laskimotromboembolian (VTE) riskiä verrattuna siihen, että tällaista valmistetta ei käytetä lainkaan. Levonorgestreelia, norgestimaattia tai noretisteronia sisältäviin valmisteisiin liittyy pienin VTE:n riski. Tämä riski voi olla jopa kaksinkertainen muilla valmisteilla, kuten esimerkiksi Minulet-valmisteella. Päätöksen muun kuin VTE:n riskiltään pienimmän valmisteen käyttämisestä saa tehdä vain sen jälkeen, kun ehkäisyä harkitsevan naisen kanssa on keskusteltu. Keskustelussa on varmistettava, että hän ymmärtää Minulet-valmisteen käyttöön liittyvän VTE:n riskin, miten hänen nykyiset riskitekijänsä vaikuttavat tähän riskiin ja että hänen VTE:n riskinsä on suurimmillaan ensimmäisen vuoden aikana, jona hän käyttää yhdistelmäehkäisyvalmistetta ensimmäistä kertaa elämässään. On myös jonkin verran näyttöä siitä, että riski suurenee, kun yhdistelmäehkäisyvalmisteen käyttö aloitetaan uudelleen vähintään 4 viikon tauon jälkeen
Mitä tahansa estrogeeni/progestiini-yhdistelmää käytettäessä annostus tulisi määrätä käyttäen pienintä soveltuvaa estrogeeni- ja progestiinimäärää, jolla saavutetaan mahdollisimman varma hoidon onnistuminen sekä soveltuvuus kyseisen potilaan tarpeisiin.
Jos potilas ei ole aiemmin saanut yhdistelmäehkäisytabletteja, hänelle tulee aluksi määrätä valmiste, joka sisältää alle 50 µg estrogeenia.
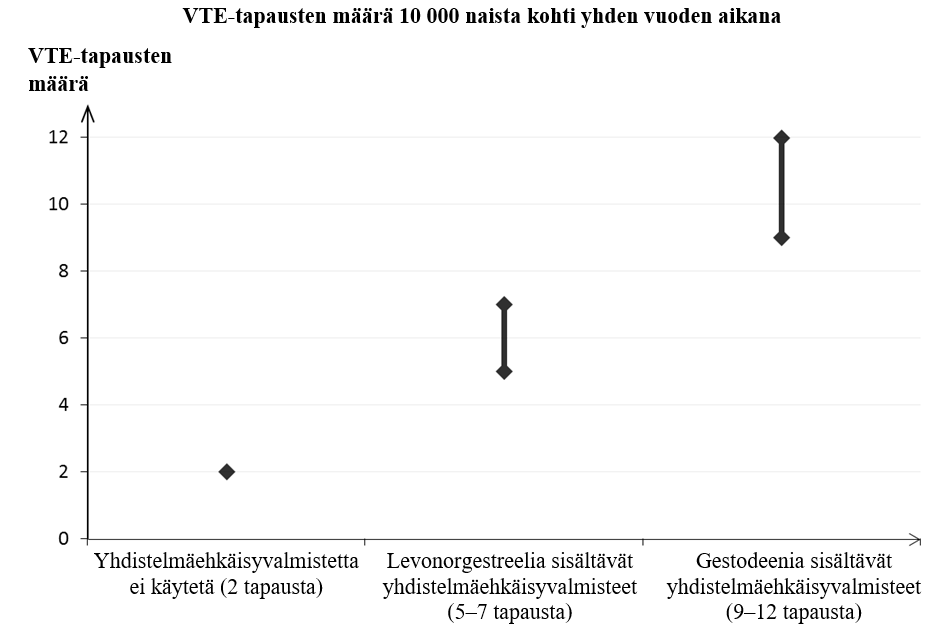
Noin kahdelle naiselle 10 000:sta, jotka eivät käytä yhdistelmäehkäisyvalmistetta eivätkä ole raskaana, kehittyy VTE yhden vuoden aikana. Yksittäisellä naisella tämä riski voi kuitenkin olla suurempi riippuen hänen omista, taustalla vaikuttavista riskitekijöistä (ks. jäljempänä).
Arviolta noin 9–12 naiselle1 10 000:sta, jotka käyttävät gestodeenia sisältävää yhdistelmäehkäisyvalmistetta, kehittyy VTE yhden vuoden aikana. Levonorgestreelia sisältävää yhdistelmäehkäisyvalmistetta käyttävillä naisilla vastaava luku on 62.
Molemmissa tapauksissa VTE-tapausten määrä vuotta kohti on pienempi kuin määrä, joka on odotettavissa raskauden aikana tai synnytyksen jälkeisenä aikana. VTE saattaa aiheuttaa kuoleman 1–2 %:ssa tapauksista.
_____________________________________
1Ilmaantuvuus arvioitiin kaikista epidemiologisista tutkimustuloksista vertaamalla eri valmisteiden suhteellisia riskejä levonorgestreelia sisältäviin yhdistelmäehkäisyvalmisteisiin.
2Vaihteluvälin 5–7 keskipiste 10 000 naisvuotta kohden, mikä perustuu levonorgestreelia sisältävien yhdistelmäehkäisyvalmisteiden käytön suhteelliseen riskiin verrattuna käyttämättömyyteen, jolloin riski on noin 2,3–3,6.
Yhdistelmäehkäisyvalmisteiden käyttäjillä tromboosia on erittäin harvoin raportoitu esiintyneen muissa verisuonissa (esim. maksan, suoliliepeen, munuaisten tai verkkokalvon laskimoissa ja valtimoissa).
Laskimotromboembolian riskitekijät
Yhdistelmäehkäisyvalmisteiden käyttäjillä esiintyvien laskimotromboembolisten komplikaatioiden riski voi suurentua huomattavasti, jos naisella on muita riskitekijöitä, erityisesti jos riskitekijöitä on useita (ks. taulukko).
Minulet-valmiste on vasta-aiheinen naisella, jolla on useita riskitekijöitä, jotka aiheuttavat suuren VTE:n riskin (ks. kohta Vasta-aiheet). Jos naisella on useampia kuin yksi riskitekijä, nämä yhdessä voivat muodostaa yksittäisten tekijöiden summaa suuremman riskin – tässä tapauksessa VTE:n kokonaisriski on otettava huomioon. Jos hyöty-riski-suhteen katsotaan olevan negatiivinen, yhdistelmäehkäisyvalmistetta ei pidä määrätä (ks. kohta Vasta-aiheet).
Taulukko: Laskimotromboembolian (VTE) riskitekijät
Riskitekijä | Kommentti |
Ylipaino (painoindeksi yli 30 kg/m2) | Riski suurenee huomattavasti painoindeksin noustessa. Huomioitava erityisesti silloin, jos muita riskitekijöitä on myös olemassa. |
Pitkittynyt immobilisaatio, suuri leikkaus, kaikki jalkojen tai lantion alueen leikkaukset, neurokirurgia tai merkittävä trauma Huomioitavaa: väliaikainen immobilisaatio, mukaan lukien > 4 tunnin lentomatka, voi myös olla VTE:n riskitekijä, erityisesti naisilla, joilla on myös muita riskitekijöitä | Näissä tilanteissa on suositeltavaa lopettaa laastarin/tabletin/renkaan käyttö (elektiivisen leikkauksen kohdalla vähintään neljä viikkoa etukäteen), eikä sitä pidä jatkaa ennen kuin käyttäjä on ollut kaksi viikkoa täysin liikuntakykyinen. Jotain muuta raskaudenehkäisymenetelmää on käytettävä ei-toivotun raskauden ehkäisemiseksi. Antitromboottista hoitoa on harkittava, ellei Minulet‑valmisteen käyttöä ole lopetettu etukäteen. |
Positiivinen sukuanamneesi (tämänhetkinen tai aikaisempi VTE sisaruksella tai vanhemmalla, etenkin suhteellisen nuorella iällä, esim. alle 50‑vuotiaana) | Jos perinnöllistä alttiutta epäillään, potilas on syytä ohjata erikoislääkärin tutkimuksiin ennen kuin minkään yhdistelmäehkäisyvalmisteen käytöstä päätetään. |
Muut laskimotromboemboliaan liitetyt sairaudet | Syöpä, systeeminen lupus erythematosus, hemolyyttis-ureeminen oireyhtymä, krooninen tulehduksellinen suolistosairaus (Crohnin tauti tai haavainen koliitti) ja sirppisoluanemia |
Ikääntyminen | Erityisesti yli 35 vuoden ikä |
Suonikohjujen ja pinnallisen laskimontukkotulehduksen mahdollisesta yhteydestä laskimotromboosin alkamiseen tai etenemiseen ei ole yksimielisyyttä.
Laskimotromboembolian suurempi riski raskauden ja erityisesti synnytyksen jälkeisten noin 6 viikon aikana on otettava huomioon (ks. lisätiedot kohdasta Raskaus ja imetys "Raskaus ja imetys”).
Laskimotromboembolian oireet (syvä laskimotromboosi ja keuhkoembolia)
Jos oireita ilmaantuu, naisia on neuvottava hakeutumaan välittömästi lääkärin hoitoon ja kertomaan, että he käyttävät yhdistelmäehkäisyvalmistetta.
Syvän laskimotromboosin (SLT) oireita voivat olla:
- toisen jalan ja/tai jalkaterän turvotus tai turvotus jalan laskimon kohdalla
- jalan kipu tai arkuus, joka saattaa tuntua vain seistessä tai kävellessä
- jalan lisääntynyt lämmöntunne, jalan ihon värin muutos tai punoitus.
Keuhkoembolian oireita voivat olla:
- äkillisesti alkanut, selittämätön hengenahdistus tai nopeutunut hengitys
- äkillinen yskä, johon saattaa liittyä veriysköksiä
- pistävä rintakipu
- vaikea pyörrytys tai huimaus
- nopea tai epäsäännöllinen sydämen syke.
Jotkut näistä oireista (esim. hengenahdistus, yskä) ovat epäspesifisiä, ja ne voidaan tulkita virheellisesti yleisluontoisemmiksi tai vähemmän vaikeiksi tapahtumiksi (esim. hengitystieinfektioksi).
Muita verisuonitukoksen merkkejä voivat olla mm. äkillinen kipu, turvotus ja sinertävä värimuutos raajassa.
Jos tukos tulee silmään, oireena voi olla esim. kivuton näön hämärtyminen, joka voi edetä näön menetykseen. Joskus näön menetys voi tapahtua lähes välittömästi.
Valtimotromboembolian (ATE) riski
Epidemiologisissa tutkimuksissa on osoitettu, että yhdistelmäehkäisyvalmisteiden käyttöön liittyy suurentunut valtimotromboembolian (sydäninfarkti) tai aivoverisuonitapahtuman (esim. aivojen ohimenevä verenkiertohäiriö (TIA), aivohalvaus) riski. Valtimotromboemboliset tapahtumat voivat johtaa kuolemaan.
Valtimotromboembolian (ATE) riskitekijät
Valtimotromboembolisten komplikaatioiden tai aivoverisuonitapahtuman riski yhdistelmäehkäisyvalmisteen käyttäjillä on korkeampi niillä naisilla, joilla on riskitekijöitä (ks. taulukko). Minulet-valmiste on vasta-aiheinen, jos naisella on joko yksi vakava tai useampia ATE:n riskitekijöitä, mikä aiheuttaa suuren valtimotromboemboliariskin (ks. kohta Vasta-aiheet). Jos naisella on useampi kuin yksi riskitekijä, nämä yhdessä voivat muodostaa yksittäisten tekijöiden summaa suuremman riskin – tässä tapauksessa kokonaisriski on otettava huomioon. Jos hyöty-riski-suhteen katsotaan olevan negatiivinen, yhdistelmäehkäisyvalmistetta ei pidä määrätä (ks. kohta Vasta-aiheet).
Taulukko: Valtimotromboembolian (ATE) riskitekijät
Riskitekijä | Kommentti |
Ikääntyminen | Erityisesti yli 35 vuoden ikä |
Tupakointi | Yhdistelmäehkäisyvalmistetta käyttäviä naisia on neuvottava olemaan tupakoimatta. Yli 35-vuotiaita, tupakoimista jatkavia naisia on vakavasti kehotettava käyttämään jotakin muuta ehkäisymenetelmää. |
Korkea verenpaine | |
Ylipaino (painoindeksi yli 30 kg/m2) | Riski kasvaa huomattavasti painoindeksin noustessa. Erityisen tärkeää naisilla, joilla on muitakin riskitekijöitä. |
Positiivinen sukuanamneesi (tämänhetkinen tai aikaisempi valtimotromboembolia sisaruksella tai vanhemmalla, etenkin suhteellisen nuorella iällä, alle 50‑vuotiaana). | Jos perinnöllistä alttiutta epäillään, potilas on syytä ohjata erikoislääkärin tutkimuksiin ennen kuin minkään yhdistelmäehkäisyvalmisteen käytöstä päätetään. |
Migreeni | Migreenin esiintymistiheyden kasvu tai vaikeusasteen lisääntyminen (mikä saattaa olla aivoverisuonitapahtumaa ennakoiva oire) yhdistelmäehkäisyvalmisteen käytön aikana voi olla syy yhdistelmäehkäisyvalmisteen käytön välittömään keskeyttämiseen. |
Muut verisuoniston haittatapahtumiin liitetyt sairaudet | Diabetes, hyperhomokysteinemia, sydämen läppävika ja eteisvärinä, dyslipoproteinemia ja systeeminen lupus erythematosus (SLE). |
Valtimotromboembolian (ATE) oireet
Jos oireita ilmaantuu, naisia on neuvottava hakeutumaan välittömästi lääkärin hoitoon ja kertomaan, että he käyttävät yhdistelmäehkäisyvalmistetta.
Aivoverisuonitapahtuman oireita voivat olla:
- kasvojen, käsivarren tai jalan äkillinen tunnottomuus tai heikkous (varsinkin vain yhdellä puolella vartaloa esiintyvä)
- äkillinen kävelyn vaikeutuminen, huimaus, tasapainon tai koordinaation menetys
- äkillinen sekavuus, puhe- tai ymmärtämisvaikeudet
- äkillinen näön heikentyminen yhdessä tai molemmissa silmissä
- äkillinen, voimakas tai pitkittynyt päänsärky, jonka syytä ei tiedetä
- tajunnan menetys tai pyörtyminen, johon saattaa liittyä kouristuskohtaus.
Ohimenevät oireet viittaavat siihen, että tapahtuma on ohimenevä aivoverenkiertohäiriö (TIA).
Sydäninfarktin oireita voivat olla:
- kipu, epämiellyttävä tunne, paineen tunne, painon tunne, puristuksen tai täysinäisyyden tunne rinnassa, käsivarressa tai rintalastan takana
- selkään, leukaan, kurkkuun, käsivarteen ja/tai vatsaan säteilevä epämiellyttävä tunne
- täyteläisyyden, ruoansulatushäiriöiden tai tukehtumisen tunne
- hikoilu, pahoinvointi, oksentelu tai huimaus
- erittäin voimakas heikkouden tunne, ahdistuneisuus tai hengenahdistus
- nopea tai epäsäännöllinen sydämen syke.
2. Sukupuolielinten kasvaimet
Kohdunkaulan syöpä
Kohdunkaulan syövän tärkein riskitekijä on pysyvä ihmisen papilloomavirusinfektio.
Eräiden tutkimusten mukaan yhdistelmäehkäisytablettien käyttöön saattaa liittyä lisääntynyt kohdunkaulan intraepiteelineoplasian tai invasiivisen kohdunkaulan syövän riski joillakin naisryhmillä. Edelleen on kuitenkin erimielisyyttä siitä, missä määrin tämä voi johtua sukupuolikäyttäytymisen eroista ja muista tekijöistä. Jos kyseessä on diagnosoimaton emätinverenvuoto, asianmukaiset diagnostiset toimenpiteet ovat aiheellisia.
Rintasyöpä
Meta-analyysi 54 epidemiologisesta tutkimuksesta osoitti, että rintasyöpädiagnoosin riski on hieman suurentunut (suhteellinen riskikerroin 1,24) yhdistelmäehkäisytablettien käyttäjillä verrattuna niihin, jotka eivät ole koskaan käyttäneet niitä. Tämä riski häviää vähitellen 10 vuoden kuluessa yhdistelmäehkäisytablettien käytön lopettamisesta. Tutkimukset eivät todista syy-yhteyttä. Havaittu riskin suureneminen saattaa johtua rintasyövän varhaisemmasta toteamisesta yhdistelmäehkäisytablettien käyttäjillä seurauksena säännöllisestä kliinisestä seurannasta, yhdistelmäehkäisytablettien biologisesta vaikutuksesta tai molemmista. Koska rintasyöpä on harvinainen alle 40-vuotiailla naisilla, rintasyöpädiagnoosien lisääntyminen nykyisin ja äskettäin yhdistelmäehkäisytabletteja käyttäneillä on pieni suhteessa rintasyövän elinikäiseen riskiin. Yhdistelmäehkäisytablettien käyttäjillä diagnosoidut rintasyövät ovat kliinisesti yleensä vähemmän edenneitä kuin ehkäisytabletteja käyttämättömillä.
3. Maksan neoplasia / maksasairaus
Yhdistelmäehkäisytablettien käyttöön voi erittäin harvinaisissa tapauksissa liittyä hyvänlaatuisten maksakasvaimien esiintymistä ja vieläkin harvemmin pahanlaatuisten maksasolukasvainten esiintymistä. Riski vaikuttaa suurenevan yhdistelmäehkäisytablettien käyttöajan pidentyessä. Hyvänlaatuisen maksakasvaimen repeämä voi aiheuttaa kuolemaan johtavan vatsansisäisen verenvuodon.
Tämä tila kehittyy yhdistelmäehkäisytablettien käytön aikana todennäköisemmin naisille, joilla on ollut kolestaasi liittyen yhdistelmäehkäisytablettien käyttöön tai raskauteen. Jos näille naisille määrätään yhdistelmäehkäisytabletteja, heitä tulee seurata tarkoin, ja jos tila uusiutuu, yhdistelmäehkäisytablettien käyttö tulee lopettaa.
Maksasoluvaurioita on raportoitu yhdistelmäehkäisytablettien käytön aikana. Aikaisessa vaiheessa todettu lääkkeeseen liittyvä maksasoluvaurio ja tabletin käytön lopettaminen voi lieventää hepatotoksisuuden vaikeusastetta. Jos potilaalla todetaan maksasoluvaurio, hänen tulee lopettaa yhdistelmäehkäisytablettien käyttö heti, ottaa käyttöönsä ei-hormonaalinen ehkäisytapa ja keskustella lääkärin kanssa.
Maksatoiminnan akuutti tai krooninen häiriö saattaa vaatia yhdistelmäehkäisytablettien käytön lopettamista, kunnes maksatoiminta on normalisoitunut.
4. Silmävauriot
Yhdistelmäehkäisytablettien käytön yhteydessä on raportoitu verkkokalvotromboosia, joka on voinut johtaa osittaiseen tai täydelliseen näönmenetykseen. Yhdistelmäehkäisytablettien käyttö tulee keskeyttää ja oireiden syy on selvitettävä erityisesti, jos on viitteitä seuraavista oireista; näköhäiriö, proptoosi tai diplopia, papilledeema tai retinan verisuonivauriot.
5. Sappirakko
Aiempien tutkimusten mukaan yhdistelmäehkäisytablettien ja estrogeenien käyttäjillä on lisääntynyt suhteellinen elinaikainen sappirakkoleikkausriski. Tuoreempien tutkimusten mukaan sappirakon sairauden saamisen suhteellinen riski yhdistelmäehkäisytablettien käyttäjillä on vähäinen.
6. Verenpaine
Kohonnutta verenpainetta on raportoitu esiintyvän naisilla, jotka käyttävät yhdistelmäehkäisytabletteja.
Jos naisella on ollut hypertensio tai siihen liittyvä tauti tai munuaissairaus, häntä tulee kehottaa käyttämään muuta ehkäisykeinoa. Jos hypertensiiviselle naiselle määrätään yhdistelmäehkäisy-tabletteja, häntä tulee seurata huolellisesti ja jos verenpaine nousee merkitsevästi, yhdistelmäehkäisytablettien käyttö tulee lopettaa (ks. kohta Vasta-aiheet). Useimmilla naisilla kohonnut verenpaine normalisoituu yhdistelmäehkäisytablettien käytön päätyttyä, eikä hypertension esiintymisessä ole eroa yhdistelmäehkäisytabletteja joskus käyttäneillä ja ei koskaan käyttäneiden välillä.
7. Migreeni/päänsärky
Migreenin paheneminen tai päänsäryn ilmaantuminen toistuvana, itsepintaisena tai vaikeana vaatii yhdistelmäehkäisytablettien käytön lopettamista ja syyn arviointia.
Migreeniä sairastavilla (erityisesti migreeniä auralla) yhdistelmäehkäisytablettien käyttäjillä saattaa olla suurentunut aivohalvausriski.
8. Immuunijärjestelmä
Angioedeema
Eksogeeniset estrogeenit saattavat aiheuttaa tai pahentaa perinnöllisen ja hankinnaisen angioedeeman oireita.
KÄYTTÖÖN LIITTYVÄT VAROTOIMET
1. Lääkärintarkastus ja seuranta
Ennen Minulet-valmisteen käytön aloittamista tai uudelleen aloittamista potilaan sairaushistoria on selvitettävä täydellisesti (mukaan lukien sukuanamneesi), ja raskaus on suljettava pois. Naisen verenpaine on mitattava, ja hänelle on tehtävä lääkärintarkastus ottaen huomioon vasta-aiheet (ks. kohta Vasta-aiheet) ja varoitukset (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). On tärkeää kiinnittää naisen huomiota laskimo- ja valtimoveritulppia koskeviin tietoihin, kuten Minulet-valmisteen käyttöön liittyvään riskiin verrattuna muihin yhdistelmäehkäisyvalmisteisiin, laskimo- ja valtimoveritulppien oireisiin, tiedossa oleviin riskitekijöihin sekä siihen, mitä tehdä, jos epäilee veritulppaa.
Naista on myös neuvottava lukemaan pakkausseloste huolellisesti ja noudattamaan siinä annettuja ohjeita. Tarkastuskäyntien tiheyden ja luonteen pitää perustua vakiintuneisiin hoitosuosituksiin, ja ne on toteutettava kunkin naisen kliinisten tarpeiden mukaisesti.
Naisia on varoitettava siitä, että hormonaaliset ehkäisyvalmisteet eivät suojaa HIV-infektiolta (AIDS) tai muilta sukupuoliteitse tarttuvilta taudeilta.
2. Vaikutukset hiilihydraatti- ja rasva-aineenvaihduntaan
Yhdistelmäehkäisytablettien käyttäjillä on ilmoitettu glukoosi-intoleranssia. Naisia, joilla on heikentynyt glukoosintoleranssi tai sairastavat diabetes mellitusta tulee seurata tarkoin yhdistelmäehkäisytablettien käytön aikana.
Pienellä osalla naisista esiintyy haitallisia rasva-aineenvaihdunnan muutoksia ehkäisytablettien käytön aikana. Ei-hormonaalista ehkäisyä tulee harkita naisilla, joilla on kontrolloimaton dyslipidemia. Pienelle osalle naisista kehittyy pysyvä hypertriglyseridemia yhdistelmäehkäisytablettien käytön aikana. Plasman triglyseridien nousu saattaa aiheuttaa haimatulehdusta tai muuta komplikaatiota (ks. kohta Vasta-aiheet).
Seerumin HDL-pitoisuuden pienenemistä on ilmoitettu useiden progestiinivalmisteiden käytön yhteydessä. Koska estrogeeni lisää HDL-kolesterolin määrää, yhdistelmäehkäisytablettien kokonaisvaikutus riippuu estrogeeni- ja progestiiniannosten välisestä tasapainosta ja ehkäisyvalmisteessa käytettyjen progestiinien ominaisuuksista ja kokonaismäärästä. Kummankin hormonin määrä tulee ottaa huomioon yhdistelmäehkäisytablettia valitessa.
Hyperlipidemiapotilaita tulee seurata tarkoin yhdistelmäehkäisytablettien käytön aikana.
3. Emätinverenvuoto
Läpäisyvuotoa ja tiputtelua ilmenee joskus yhdistelmäehkäisytablettien käytön yhteydessä, etenkin kolmen ensimmäisen käyttökuukauden aikana. Progestiinin tyyppi ja annoskoko voivat vaikuttaa tähän. Hormoneihin liittymättömät syyt tulee ottaa huomioon ja mahdollinen maligniteetti tai raskaus on poissuljettava. Mikäli kyseessä ei ole sairaus, yhdistelmäehkäisytablettien käytön jatkaminen tai vaihto toiseen valmisteeseen voi ratkaista ongelman.
Joillakin naisilla tyhjennysvuoto saattaa jäädä tulematta tablettitauon aikana. Jos yhdistelmäehkäisytabletit on otettu ohjeiden mukaan, raskauden mahdollisuus on epätodennäköinen. Mikäli yhdistelmäehkäisytabletteja ei kuitenkaan ole otettu ohjeiden mukaisesti ennen ensimmäistä tyhjennysvuodon poisjäämistä tai jos kaksi peräkkäistä tyhjennysvuotoa jää tulematta, tablettien otto tulee keskeyttää ja siirtyä hormonittomaan ehkäisymenetelmään, kunnes raskauden mahdollisuus on poissuljettu.
Joillakin naisilla voi ehkäisytablettien käytön lopettamisen jälkeen ilmetä amenorreaa (mahdollisesti myös anovulaatiota) tai oligomenorreaa etenkin, jos sitä on esiintynyt aiemmin.
4. Maksa
Akuutti tai krooninen maksan toimintahäiriö voi vaatia yhdistelmäehkäisytablettien käytön lopettamista, kunnes maksan toiminta normalisoituu. Steroidihormonit voivat metaboloitua huonosti potilailla, joilla on maksan vajaatoimintaa.
5. Masennus
Jos yhdistelmäehkäisytablettien käytön yhteydessä ilmenee merkittävä masennus, tulee lääkitys lopettaa ja siirtyä toiseen ehkäisymenetelmään, jotta saadaan selville oireen yhteys lääkitykseen. Henkilöitä, jotka ovat aiemmin sairastuneet masennukseen, on seurattava huolellisesti ehkäisytablettien käytön aikana ja valmisteen käyttö on keskeytettävä masennuksen uusiutuessa.
6. Folaattipitoisuudet
Seerumin folaattipitoisuudet voivat laskea yhdistelmäehkäisytablettien käytön seurauksena. Lasku voi olla kliinisesti merkitsevä, jos nainen tulee raskaaksi heti yhdistelmäehkäisytablettien käytön lopettamisen jälkeen.
7. Nesteretentio
Yhdistelmäehkäisytabletteja on määrättävä harkiten potilaille, joilla nesteretentio voi huonontaa vointia.
8. Muut
Ripuli ja/tai oksentelu voi heikentää hormonien imeytymistä ja aiheuttaa seerumipitoisuuksien laskun.
Mäkikuismaa (Hypericum perforatum) sisältäviä rohdosvalmisteita ei tule käyttää samanaikaisesti Minulet-valmisteen kanssa. Mäkikuisma voi aiheuttaa valmisteen vaikuttavien aineiden plasmapitoisuuksien laskun ja vaikutuksen heikentymisen (ks. kohta Yhteisvaikutukset Yhteisvaikutukset).
Psyykkiset häiriöt
Masentunut mieliala ja masennus ovat tunnettuja hormonaalisten ehkäisyvalmisteiden käyttöön liittyviä haittavaikutuksia (ks. kohta Haittavaikutukset). Masennus voi olla vakavaa, ja se on itsetuhoisen käyttäytymisen ja itsemurhan tunnettu riskitekijä. Naisia on kehotettava ottamaan yhteyttä lääkäriinsä, jos heillä esiintyy mielialan muutoksia ja masennuksen oireita, myös pian hoidon aloittamisen jälkeen.
Tietoa apuaineista
Minulet sisältää laktoosimonohydraattia ja sakkaroosia. Naisten, joilla on harvinainen perinnöllinen galaktoosi- tai fruktoosi-intoleranssi, täydellinen laktaasinpuutos, glukoosi-galaktoosi-imeytymishäiriö tai sakkaroosi-isomaltaasin puutos, ei pidä käyttää tätä lääkettä.
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per tabletti eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Lääkkeiden väliset yhteisvaikutukset
Etinyyliestradiolin ja muiden aineiden väliset yhteisvaikutukset voivat johtaa seerumin etinyyliestradiolipitoisuuden laskuun tai kohoamiseen.
Seerumin etinyyliestradiolipitoisuuden pieneneminen saattaa lisätä läpäisyvuotoja, kuukautisten epäsäännöllisyyttä ja vähentää yhdistelmäehkäisytabletin tehoa.
Jos etinyyliestradiolin kanssa käytetään valmisteita, jotka voivat pienentää etinyyliestradiolin pitoisuutta plasmassa, on suositeltavaa käyttää ei-hormonaalista ehkäisymenetelmää (kuten kondomia tai spermisidiä) säännöllisen Minulet-valmisteen käytön lisäksi. Mikäli valmisteita joudutaan käyttämään pitkäaikaisesti, eivät yhdistelmäehkäisytabletit ole ensisijainen ehkäisymenetelmä.
Kun plasman etinyyliestradiolin pitoisuutta alentavien valmisteiden käyttö on lopetettu, on suositeltavaa käyttää ei-hormonaalista lisäehkäisyä vähintään 7 päivää. Lisäehkäisyä on hyvä käyttää pidempään, mikäli lopetettu valmiste on indusoinut maksan mikrosomaalisia entsyymejä ja siten pienentänyt seerumin etinyyliestradiolipitoisuutta. Entsyymi-induktio voi kestää useampia viikkoja riippuen annoksesta, käytön kestosta ja indusoivan aineen eliminaationopeudesta.
Esimerkkejä aineista, jotka voivat laskea seerumin etinyyliestradiolipitoisuutta:
- Aine, joka vähentää maha-suolikanavan läpikulkuaikaa.
- Aine, joka indusoi maksan mikrosomaalisia entsyymejä, kuten rifampisiini, rifabutiini, barbituraatit, primidoni, fenyylibutatsoni, fenytoiini, deksametasoni, griseofulviini, topiramaatti, eräät proteaasin estäjät ja modafiniili.
- Ritonaviiri (mahdollisesti indusoimalla maksan mikrosomaalisia entsyymejä)
Esimerkkejä aineista, jotka voivat nostaa seerumin etinyyliestradiolipitoisuutta:
- Atorvastatiini
- Kilpailevat inhibiittorit etinyyliestradiolin metaboloituessa sulfaatiksi gastrointestinaalisessa seinämässä, kuten askorbiinihappo (C-vitamiini) ja parasetamoli.
- Sytokromi P 450 3A4-isoentsyymin estäjät, kuten indinaviiri, flukonatsoli ja troleandomysiini.
Troleandomysiini voi lisätä maksansisäisen kolestaasin riskiä, jos sitä käytetään yhdessä yhdistelmäehkäisytablettien kanssa.
Etinyyliestradioli voi vaikuttaa muiden lääkeaineiden metaboliaan inhiboimalla maksan mikrosomaalisia entsyymejä tai indusoimalla niiden hepaattista konjugoitumista, erityisesti glukuronidaatiota. Pitoisuus plasmassa ja kudoksessa voi siis joko nousta (esim. syklosporiini, teofylliini, kortikosteroidit) tai laskea (esim. lamotrigiini).
Yhdessä flunaritsiinihoidon kanssa ehkäisytablettien käytön on ilmoitettu suurentavan galaktorrean riskiä.
Varovaisuutta tulee noudattaa määrättäessä titsanidiinia oraalista ehkäisyvalmistetta käyttäville. Oraaliset etinyyliestradiolia ja gestodeenia sisältävät ehkäisytabletit suurentavat kliinisesti merkittävässä määrin titsanidiinin pitoisuutta plasmassa ja lisäävät sen vaikutusta.
Samanaikaisiin muihin lääkehoitoihin tulee tutustua, jotta mahdolliset yhteisvaikutukset voidaan tunnistaa.
Mäkikuismaa (Hypericum perforatum) sisältäviä rohdosvalmisteita ei tule käyttää samanaikaisesti tämän lääkevalmisteen kanssa, koska se saattaa heikentää lääkkeen ehkäisytehoa. Läpäisyvuotoa ja ei-toivottuja raskauksia on raportoitu. Tämä johtuu mäkikuisman metaboliaentsyymejä indusoivasta vaikutuksesta ja vaikutus voi kestää 2 viikkoa mäkikuismahoidon lopettamisen jälkeen.
Farmakodynaamiset yhteisvaikutukset
Kun kliinisissä tutkimuksissa hoidettiin hepatiitti C -virusinfektiota (HCV) ombitasviirin, paritapreviirin ja ritonaviirin yhdistelmällä ja dasabuviirilla ribaviriinin kanssa tai ilman, transaminaasiarvon (ALAT) kohoamista yli 5 x ULN (viitealueen yläraja) esiintyi merkitsevästi useammin naisilla, jotka käyttivät etinyyliestradiolia sisältävää valmistetta, kuten yhdistelmäehkäisyvalmistetta. Myös glekapreviirin ja pibrentasviirin yhdistelmää tai sofosbuviirin, velpatasviirin ja voksilapreviirin yhdistelmää käyttävillä potilailla ALAT-arvojen kohoamista havaittiin etinyyliestradiolia sisältävää valmistetta (kuten yhdistelmäehkäisyvalmistetta) käyttävillä naisilla (ks. kohta Vasta-aiheet). Tästä syystä Minulet-tabletteja käyttävien on vaihdettava toiseen ehkäisymenetelmään (esim. pelkkää progestiinia sisältävään tai hormonittomaan ehkäisymenetelmään) ennen kyseisten yhdistelmähoitojen aloittamista. Minulet-tablettien käyttö voidaan aloittaa uudelleen 2 viikon kuluttua näiden yhdistelmähoitojen päättymisestä.
Laboratoriokokeet
Kontraseptiivisten steroidien käyttö voi vaikuttaa tiettyjen laboratoriokokeiden tuloksiin, kuten maksan, kilpirauhasen, lisämunuaisen ja munuaisten toiminnan biokemiallisiin parametreihin, (kantaja)proteiinien (esimerkiksi kortikosteroideja sitovan globuliinin ja lipidi/lipoproteiini-fraktioiden) pitoisuuteen plasmassa, hiilihydraattiaineenvaihdunnan parametreihin ja veren hyytymis- ja fibrinolyysiarvoihin.
Raskaus ja imetys
Valmistetta ei saa käyttää raskauden aikana.
Raskaus
Jos henkilö tulee raskaaksi yhdistelmäehkäisytablettien käytön aikana, niiden käyttö tulee lopettaa. Ei ole olemassa vakuuttavaa näyttöä siitä, että yhdistelmäehkäisytablettien sisältämä estrogeeni ja progestiini aiheuttaisivat vaurioita kehittyvälle sikiölle, jos ehkäisytabletteja otetaan vahingossa raskauden varhaisvaiheessa.
Kun Minulet-valmisteen käyttö aloitetaan uudelleen, on huomioitava, että laskimotromboembolian riski on suurentunut synnytyksen jälkeisenä aikana (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Imetys
Yhdistelmäehkäisytabletit voivat vaikuttaa imettämiseen, sillä ne vähentävät rintamaidon määrää ja muuttavat sen koostumusta. Yhdistelmäehkäisytablettien käyttöä ei suositella ennen kuin lapsi on kokonaan vieroitettu rintaruokinnasta. Pieniä määriä ehkäisytablettien steroideja ja/tai niiden metaboliitteja voi erittyä rintamaitoon. Joitakin lapseen kohdistuneita haittavaikutuksia on raportoitu, mm. keltaisuutta ja rintojen suurenemista.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Ei oleellinen.
Haittavaikutukset
Yhdistelmäehkäisytablettien käyttöön on liittynyt seuraavien tapahtumien suurentunut riski:
- Yhdistelmäehkäisyvalmisteita käyttävillä naisilla on havaittu valtimoiden ja laskimoiden tromboottisten ja tromboembolisten tapahtumien lisääntynyt riski. Näitä tapahtumia ovat mm. sydäninfarkti, aivohalvaus, ohimenevät aivoverenkiertohäiriöt (TIA), laskimoveritulppa ja keuhkoembolia. Tapahtumia kuvataan tarkemmin kohdassa Varoitukset ja käyttöön liittyvät varotoimet.
- kohdunkaulan epiteelin atypia (CIN) ja kohdunkaulasyöpä
- rintasyöpädiagnoosi
- hyvänlaatuiset maksakasvaimet (esim. fokaalinen nodulaarinen hyperplasia ja maksa-adenooma).
Muita mahdollisia haittavaikutuksia yhdistelmäehkäisytablettien käyttäjillä:
Elinjärjestelmä | Yleinen (≥1/100, <1/10) | Melko harvinainen (≥1/1000, <1/100) | Harvinainen (≥1/10000,<1/1000) | Tuntematon (saatavissa oleva tieto ei riitä esiintyvyyden arviointiin) |
Infektiot | Vaginiitti, mukaan lukien kandidiaasi | |||
Hyvän- ja pahanlaatuiset kasvaimet | maksasolukarsinooma | |||
Immuunijärjestelmä | Anafylaktiset/ anafylaktoidiset reaktiot mukaan lukien hyvin harvinaisia urtikariatapauksia, angioedeema ja vaikeita reaktioita hengitys- ja verenkiertojärjestelmässä, SLE:n (systemic lupus erythematosus) paheneminen | Perinnöllisen ja hankinnaisen angioedeeman oireiden paheneminen. | ||
Aineenvaihdunta ja ravitsemus | Muuttunut ruokahalu (heikentynyt tai parantunut) | Glukoosi-intoleranssi, porfyrian paheneminen | ||
Psyykkiset häiriöt | Mielialamuutokset, mukaan lukien masennus, libidon muutokset | |||
Hermosto | Päänsärky, mukaan lukien migreeni, hermostuneisuus, huimaus | Korean paheneminen | ||
Silmät | Piilolinssien sopimattomuus, näköhermon tulehdus, retinaalinen vaskulaarinen tromboosi | |||
Verisuonisto | Suonikohjujen paheneminen, laskimo- tai valtimotromboembolia | |||
Ruoansulatuselimistö | Pahoinvointi, oksentelu, vatsakipuja | Vatsakouristuksia, turvotuksia | Pankreatiitti, iskeeminen koliitti, maksa-adenooma, hepatosellulaarinen karsinooma, tulehduksellinen suolistosairaus (yleisyys tuntematon) (Crohnin tauti, haavainen koliitti) | |
Maksa ja sappi | Kolestaattista keltaisuutta, sappi-rakkosairauksia, mukaan lukien sappikivi. Maksasoluvaurio (yleisyys tuntematon) esim. hepatiitti, poikkeava maksatoiminta | |||
Iho ja ihonalainen kudos | Akne | Ihottuma, kloasma (melasma) joka voi jäädä pysyväksi, hirsutismi, alopesia | Erythema nodosum, erythema multiforme | |
Munuaiset ja virtsatiet | Hemolyyttis-ureeminen oireyhtymä | |||
Sukupuolielimet ja rinnat | Muutokset kuukautisissa, tiputtelu- ja läpäisyvuotoja, rintakipua, rintojen arkuus, rintojen kasvu, sekreetio. Dysmenorrea, muutokset kohdunkaulan ektropiumissa ja sekreetiossa, amenorrea | |||
Yleisoireet | Nesteretentio/turvotus | |||
Tutkimukset | Painonmuutokset (nousu tai lasku) | Verenpaineen nousu, muutoksia seerumin lipidipitoisuuksissa mukaan lukien hypertriglyseridemia | Seerumin folaattipitoisuuksien aleneminen |
Näköhermon tulehdus saattaa johtaa osittaiseen tai täydelliseen näönmenetykseen.
Yhdistelmäehkäisytabletit saattavat pahentaa olemassa olevaa sappirakkosairautta ja saattavat nopeuttaa tämän sairauden kehitystä aiemmin oireettomilla naisilla.
Yhdistelmäehkäisyhoito saattaa alentaa seerumin folaattipitoisuutta.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Oraalisten ehkäisyvalmisteiden yliannostukseen liittyneitä oireita on raportoitu aikuisilla ja lapsilla. Tällaisia ovat pahoinvointi, oksentelu, rintojen arkuus, huimaus, vatsakipu, uneliaisuus/väsymys, tyhjennysvuoto. Antidoottia ei ole ja jatkohoito on oireenmukaista.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Progestageenit ja estrogeenit, kiinteät yhdistelmävalmisteet, ATC-koodi: G03AA10.
Minulet on yhdistelmäehkäisytabletti, joka sisältää etinyyliestradiolia ja gestodeenia.
Yhdistelmäehkäisytablettien vaikutuksen on todettu perustuvan siihen, että ne vähentävät gonadotropiinien eritystä ja siten estävät munasarjojen toimintaa. Tästä johtuva raskautta ehkäisevä vaikutus perustuu eri mekanismeihin, joista tärkein on ovulaation esto.
Oikein ja säännöllisesti käytettäessä yhdistelmätablettien ehkäisytehon pettämisen todennäköisyys on 0,1 %. Kaikentyyppisten ehkäisytablettien ehkäisytehon pettämisen todennäköisyys on tyypillisessä käytössä 5 %. Useimpien ehkäisyvälineiden luotettavuus riippuu käytön säännöllisyydestä. Ehkäisytehon pettäminen on todennäköisempää silloin, kun tabletteja jää ottamatta.
Farmakokinetiikka
Gestodeeni
Imeytyminen
Suun kautta annettaessa gestodeeni imeytyy nopeasti ja täydellisesti. Seerumin huippupitoisuus,
n. 2–4 ng/ml, saavutetaan noin tunnin kuluttua kerta-annoksen ottamisesta. Biologinen hyötyosuus on noin 99 %.
Jakautuminen
Gestodeeni sitoutuu seerumin albumiiniin ja sukupuolihormoneja sitovaan globuliiniin (SHBG). Vain 1–2 % lääkkeen kokonaispitoisuudesta seerumissa on vapaan steroidin muodossa,
50–70 % sitoutuu spesifisesti SHBG:hen. Etinyyliestradiolin aiheuttama SHBG:n lisääntyminen vaikuttaa gestodeenin sitoutumiseen seerumin proteiineihin siten, että SHBG:hen sitoutuva fraktio suurenee ja albumiiniin sitoutuva fraktio pienenee. Gestodeenin jakautumistilavuus on
0,7–1,4 l/kg.
Biotransformaatio
Gestodeeni metaboloituu täydellisesti steroidiaineenvaihdunnan tunnettuja reittejä pitkin. Keskimääräinen metabolinen puhdistuma seerumista on 0,8–1,0 ml/min/kg. Kun gestodeenia annettiin kerta-annoksena yhtä aikaa etinyyliestradiolin kanssa, suoria interaktioita ei havaittu.
Eliminaatio
Gestodeenin pitoisuudet seerumissa vähenevät kahdessa vaiheessa. Terminaaliselle eliminaatiovaiheelle on tyypillistä 12–20 tunnin puoliintumisaika. Gestodeeni erittyy vain metaboloituneessa muodossa virtsaan ja sappeen (suhteessa 6:4). Metaboliittierityksen puoliintumisaika on n. 1 vuorokausi.
Vakaa tila
Gestodeenin farmakokinetiikkaan vaikuttaa SHBG-pitoisuus, joka noin kolminkertaistuu annettaessa gestodeenia samaan aikaan etinyyliestradiolin kanssa. Päivittäisen annon myötä lääkkeen pitoisuus seerumissa noin kolmin- tai nelinkertaistuu ja vakaa tila saavutetaan hoitosyklin jälkimmäisen puoliskon aikana.
Etinyyliestradioli
Imeytyminen
Suun kautta annettaessa etinyyliestradioli imeytyy nopeasti ja täydellisesti. Seerumin huippupitoisuus, n. 30–80 pg/ml, saavutetaan 1–2 tunnin kuluessa. Presysteemisestä konjugaatiosta ja alkureitin aineenvaihdunnasta johtuen absoluuttinen biologinen hyötyosuus on n. 60 %.
Jakautuminen
Etinyyliestradioli sitoutuu voimakkaasti, mutta ei spesifisesti seerumin albumiiniin
(n. 98,5 %) ja lisää SHBG:n pitoisuutta seerumissa. Jakautumistilavuudeksi määritettiin n. 5–18 l/kg.
Biotransformaatio
Etinyyliestradioli konjugoituu presysteemisesti sekä ohutsuolen limakalvolla että maksassa. Etinyyliestradioli metaboloituu pääasiassa aromaattisen hydroksylaation kautta, mutta tällöin muodostuu erilaisia hydroksyloituneita ja metyloituneita metaboliitteja ja nämä esiintyvät vapaina metaboliitteina ja glukuronidi- ja sulfaattikonjugaatteina. Metabolinen puhdistuma on
n. 5–13 ml/min/kg.
Eliminaatio
Etinyyliestradiolin pitoisuudet seerumissa vähenevät kahdessa vaiheessa, terminaaliselle eliminaatiovaiheelle on tyypillistä n. 16–24 tunnin puoliintumisaika. Etinyyliestradioli erittyy vain metaboloituneessa muodossa virtsaan ja sappeen (suhteessa 4:6). Metaboliittierityksen puoliintumisaika on n. 1 vuorokausi.
Vakaa tila
Vakaa tila saavutetaan 3–4 päivän kuluttua ja lääkkeen pitoisuudet seerumissa ovat 20 % suuremmat kuin kerta-annoksen annon jälkeen.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, genotoksisuutta, karsinogeenisuutta sekä lisääntymistoksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Farmaseuttiset tiedot
Apuaineet
Tabletin ydin:
Laktoosimonohydraatti, maissitärkkelys, povidoni 25, magnesiumstearaatti, natriumkalsiumedetaatti.
Päällyste:
sakkaroosi, makrogoli 6000, kalsiumkarbonaatti, talkki, povidoni 90, montaaniglykolivaha (vaha E).
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta.
Säilytys
Säilytä alle 25 °C.
Pidä läpipainopakkaus ulkopakkauksessa. Herkkä valolle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
MINULET tabletti, päällystetty
75/30 mikrog (L:kyllä) 3 x 21 fol (27,49 €)
PF-selosteen tieto
Sisäpakkaus
Alumiini/PVC-läpipainopakkaus.
Alumiini/PVC-läpipainopakkaus alumiinisuojapussissa. Pakkaus sisältää myös silikageelikuivausainepussin.
Pakkauskoko
3 x 21 tablettia
Valmisteen kuvaus:
Valmisteen kuvaus: Valkoinen, kiiltävä sokeripäällysteinen tabletti.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
MINULET tabletti, päällystetty
75/30 mikrog 3 x 21 fol
- Ei korvausta.
ATC-koodi
G03AA10
Valmisteyhteenvedon muuttamispäivämäärä
12.10.2022
Yhteystiedot
 PFIZER OY
PFIZER OY Tietokuja 4
00330 Helsinki
09 430 040
www.pfizer.fi
etunimi.sukunimi@pfizer.com
