ABILIFY MAINTENA injektiokuiva-aine ja liuotin, depotsuspensiota varten 400 mg, injektiokuiva-aine ja liuotin, depotsuspensiota varten, esitäytetty ruisku 400 mg
Vaikuttavat aineet ja niiden määrät
Abilify Maintena 400 mg injektiokuiva-aine ja liuotin, depotsuspensiota varten
Yksi injektiopullo sisältää 400 mg aripipratsolia.
Abilify Maintena 400 mg injektiokuiva-aine ja liuotin, depotsuspensiota varten, esitäytetty ruisku
Yksi esitäytetty ruisku sisältää 400 mg aripipratsolia.
Käyttökuntoon saattamisen jälkeen yksi millilitra suspensiota sisältää 200 mg aripipratsolia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektiokuiva- aine ja liuotin, depotsuspensiota varten
Kliiniset tiedot
Käyttöaiheet
Abilify Maintena on tarkoitettu skitsofrenian ylläpitohoitoon aikuispotilailla, joiden tila on vakautettu suun kautta otettavalla aripipratsolilla.
Annostus ja antotapa
Annostus
Potilailla, jotka eivät ole aiemmin käyttäneet aripipratsolia, suun kautta otettavan aripiratsolin siedettävyys on todettava ennen Abilify Maintena -hoidon aloittamista.
Abilify Maintena -valmisteen annoksen titraaminen ei ole tarpeen.
Aloitusannos voidaan antaa noudattaen jompaakumpaa seuraavista kahdesta hoito-ohjelmasta:
- Hoidon aloitus yhdellä injektiolla: Hoidon aloituspäivänä on annettava yksi injektio Abilify Maintena 400 mg -valmistetta, ja hoitoa 10 mg – 20 mg:lla suun kautta otettavaa aripipratsolia per vuorokausi on jatkettava 14 peräkkäisen vuorokauden ajan, jotta aripipratsolin terapeuttinen pitoisuus säilyy hoidon alkuvaiheen ajan.
- Hoidon aloitus kahdella injektiolla: Hoidon aloituspäivänä on annettava kaksi erillistä injektiota Abilify Maintena 400 mg -valmistetta kahteen eri injektiokohtaan (ks. antotapa) sekä yksi 20 mg:n annos suun kautta otettavaa aripipratsolia.
Aloitusinjektion/-injektioiden jälkeen Abilify Maintena -valmisteen suositeltu ylläpitoannos on 400 mg. Abilify Maintena 400 mg annetaan kerran kuukaudessa kertainjektiona (aikaisintaan 26 vuorokauden kuluttua edellisestä injektiosta). Jos 400 mg:n annokseen liittyy haittavaikutuksia, annoksen pienentämistä 300 mg:aan kerran kuukaudessa on harkittava.
Väliin jääneet annokset
| Väliin jääneet annokset | |
| Väliin jääneen annoksen ajoitus | Toimintaohje |
| Jos 2. tai 3. annos jää väliin ja edellisestä injektiosta kulunut aika on: | |
| Yli 4 viikkoa mutta alle 5 viikkoa | Injektio annetaan mahdollisimman pian ja tämän jälkeen kuukausittain. |
| Yli 5 viikkoa | Samanaikainen suun kautta otettava aripipratsoli aloitetaan uudelleen 14 vuorokauden ajaksi tai samalla kertaa annetaan kaksi erillistä injektiota ja yksi 20 mg:n kerta-annos suun kautta otettavaa aripipratsolia. Tämän jälkeen injektiot annetaan kuukausittain. |
| Jos 4. tai myöhempi annos jää väliin (tilan vakauttamisen jälkeen) ja edellisestä injektiosta kulunut aika on: | |
| Yli 4 viikkoa mutta alle 6 viikkoa | Injektio annetaan mahdollisimman pian ja tämän jälkeen kuukausittain. |
| Yli 6 viikkoa | Samanaikainen suun kautta otettava aripipratsoli aloitetaan uudelleen 14 vuorokauden ajaksi tai samalla kertaa annetaan kaksi erillistä injektiota ja yksi 20 mg:n kerta-annos suun kautta otettavaa aripipratsolia. Tämän jälkeen injektiot annetaan kuukausittain. |
Erityiset potilasryhmät
Iäkkäät henkilöt
Abilify Maintena 400 mg/300 mg -valmisteen turvallisuutta ja tehoa 65 vuoden ikäisten ja tätä vanhempien potilaiden skitsofrenian hoidossa ei ole varmistettu (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Munuaisten vajaatoiminta
Annosta ei tarvitse muuttaa potilailla, joilla on munuaisten vajaatoimintaa (ks. kohta Farmakokinetiikka).
Maksan vajaatoiminta
Annosta ei tarvitse muuttaa potilailla, joilla on lievä tai kohtalainen maksan vajaatoiminta. Vaikeaa maksan vajaatoimintaa sairastavien potilaiden hoidosta on liian vähän tutkimustietoa annostussuositusten antamiseksi. Näillä potilailla annostus on määritettävä varovaisuutta noudattaen. Ensisijaisesti on käytettävä suun kautta otettavaa lääkemuotoa (ks. kohta Farmakokinetiikka).
Hitaat CYP2D6-metaboloijat
Potilaat, joilla CYP2D6-välitteisen metabolian tiedetään olevan hidasta:
- Hoidon aloitus yhdellä injektiolla: Aloitusannos on Abilify Maintena 300 mg -valmistetta. Hoitoa suun kautta otettavan aripipratsolin määrätyllä vuorokausiannoksella on jatkettava 14 peräkkäisen vuorokauden ajan. Ylläpitoannoksen on oltava 300 mg Abilify Maintena -valmistetta kerran kuukaudessa.
- Hoidon aloitus kahdella injektiolla: Aloitusannos on kaksi erillistä injektiota Abilify Maintena 300 mg -valmistetta (ks. antotapa) ja yksi aiemmin määrätyn suuruinen kerta-annos suun kautta otettavan aripipratsolia. Ylläpitoannoksenon oltava 300 mg Abilify Maintena -valmistetta kerran kuukaudessa.
Potilaat, joiden CYP2D6-välitteisen metabolian tiedetään olevan hidasta, ja jotka käyttävät samanaikaisesti voimakasta CYP3A4:n estäjää:
- Hoidon aloitus yhdellä injektiolla: Aloitusannosta pienennetään 200 mg:aan (ks. kohta Yhteisvaikutukset) ja hoitoa suun kautta otettavan aripipratsolin määrätyllä vuorokausiannoksella on jatkettava 14 peräkkäisen vuorokauden ajan.
- Hoitoa ei saa aloittaa kahdella injektiolla potilaille, joiden CYP2D6-välitteisen metabolian tiedetään olevan hidasta ja jotka käyttävät samanaikaisesti voimakasta CYP3A4:n estäjää.
Aloitusinjektion jälkeisen hoidon osalta katso suositeltu Abilify Maintena 400 mg ja 300 mg -valmisteen ylläpitoannos jäljempänä olevasta taulukosta. Abilify Maintena annetaan kerran kuukaudessa kertainjektiona (aikaisintaan 26 vuorokauden kuluttua edellisestä injektiosta).
Ylläpitoannoksen muuttaminen CYP2D6:n ja/tai CYP3A4:n estäjien ja/tai CYP3A4:n induktorien kanssa tapahtuvien yhteisvaikutuksien vuoksi
Ylläpitoannosta muutetaan potilailla, jotka käyttävät samanaikaisesti voimakkaita CYP3A4:n estäjiä tai voimakkaita CYP2D6:n estäjiä yli 14 vuorokauden ajan. Jos CYP3A4:n estäjän tai CYP2D6:n estäjän käyttö lopetetaan, annosta saattaa olla tarpeen nostaa aiemmalle tasolle (ks. kohta Yhteisvaikutukset). Jos haittavaikutuksia ilmenee Abilify Maintena -valmisteen annoksen muuttamisesta huolimatta, samanaikaisen CYP2D6:n estäjän tai CYP3A4:n estäjän käytön tarpeellisuus on arvioitava uudelleen.
CYP3A4:n induktorien yli 14 vuorokautta kestävää samanaikaiskäyttöä Abilify Maintena 400 mg tai 300 mg -valmisteen kanssa pitää välttää, koska se aiheuttaa veren aripipratsolipitoisuuden laskun jopa alle tehokkaan pitoisuustason (ks. kohta Yhteisvaikutukset).
Abilify Maintena -valmisteen ylläpitoannoksen muuttaminen potilailla, jotka käyttävät samanaikaisesti voimakkaita CYP2D6:n estäjiä, voimakkaita CYP3A4:n estäjiä ja/tai CYP3A4:n induktoreita yli 14 vuorokauden ajan
| Muutettu kuukausittainen annos | |
| Potilaat, jotka saavat Abilify Maintena 400 mg -valmistetta | |
| Voimakkaat CYP2D6:n estäjät tai voimakkaat CYP3A4:n estäjät | 300 mg |
| Voimakkaat CYP2D6:n estäjät ja voimakkaat CYP3A4:n estäjät | 200 mg* |
| CYP3A4:n induktorit | Käyttöä vältettävä |
| Potilaat, jotka saavat Abilify Maintena 300 mg -valmistetta | |
| Voimakkaat CYP2D6:n estäjät tai voimakkaat CYP3A4:n estäjät | 200 mg* |
| Voimakkaat CYP2D6:n estäjät ja voimakkaat CYP3A4:n estäjät | 160 mg* |
| CYP3A4:n induktorit | Käyttöä vältettävä |
* Mukauttaminen 200 mg:n ja 160 mg:n annokseen on mahdollista ainoastaan käyttämällä valmistetta Abilify Maintena -injektiokuiva-aine ja liuotin, depotsuspensiota varten.
Pediatriset potilaat
Abilify Maintena 400 mg/300 mg -valmisteen turvallisuutta ja tehoa 0–17-vuotiaiden lasten ja nuorten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Antotapa
Abilify Maintena 400 mg ja 300 mg on tarkoitettu annettavaksi vain lihakseen. Sitä ei saa antaa laskimoon eikä ihon alle. Valmisteen antavan henkilön täytyy olla terveydenhuollon ammattilainen.
Suspensio on injisoitava hitaasti kertainjektiona (annoksia ei saa jakaa) pakaralihakseen tai olkavarren hartialihakseen. Varovaisuutta on noudatettava, jotta vältetään injisoimasta verisuoneen.
Jos hoito aloitetaan kahdella injektiolla, valmiste injisoidaan kahteen eri kohtaan kahteen eri lihakseen. Molempia injektioita EI SAA injisoida samanaikaisesti samaan olkavarren hartialihakseen tai pakaralihakseen. Henkilöille, joiden CYP2D6-välitteisen metabolian tiedetään olevan hidasta, injektio annetaan joko kahteen eri olkavarren hartialihakseen tai yhteen olkavarren hartialihakseen ja yhteen pakaralihakseen. Valmistetta EI SAA injisoida kahteen pakaralihakseen.
Täydelliset Abilify Maintena 400 mg ja 300 mg -valmisteiden käyttö- ja käsittelyohjeet löytyvät pakkausselosteesta (Ohjeita hoitohenkilökunnalle -kohdasta).
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen saattamisesta käyttökuntoon ennen lääkkeen antoa.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Psykoosilääkityksen aikana potilaan tilan kliininen paraneminen voi kestää useista päivistä joihinkin viikkoihin. Potilaan tilaa on seurattava tarkoin koko tämän jakson ajan.
Käyttö potilaan akuutin agitaatiotilan tai vaikea-asteisen psykoottisen tilan hoitoon
Abilify Maintena 400 mg/300 mg -valmistetta ei saa käyttää akuutin agitaatiotilan tai vaikea-asteisen psykoottisen tilan hoitoon, kun oireet on saatava nopeasti hallintaan
Suisidaalisuus
Itsetuhoinen käyttäytyminen on yleistä psykoottisissa sairauksissa, ja sitä on raportoitu joissakin tapauksissa pian psykoosilääkityksen aloittamisen tai vaihtamisen jälkeen, myös aripipratsolihoidon yhteydessä (ks. kohta Haittavaikutukset). Potilaita, joilla itsemurhariski on suuri, on seurattava tarkoin psykoosilääkityksen aikana.
Kardiovaskulaariset häiriöt
Aripipratsolia on käytettävä varoen potilaille, joilla on kardiovaskulaarisairaus (anamneesissa sydäninfarkti tai iskeeminen sydänsairaus, sydämen vajaatoiminta tai johtumishäiriöitä), aivoverenkierron sairaus, hypotensiolle altistava tila (kuivuminen, hypovolemia ja verenpainetta laskevien lääkevalmisteiden käyttö) tai verenpainetauti, mukaan lukien maligni verenpainetauti.
Laskimotukoksia (VTE) on raportoitu antipsykoottisten lääkkeiden käytön yhteydessä. Koska psykoosilääkkeillä hoidettavilla potilailla usein on hankittuja laskimotukoksille altistavia riskitekijöitä, kaikki mahdolliset riskitekijät on tunnistettava ennen aripipratsolihoidon aloittamista sekä hoidon aikana ja ennaltaehkäisevät toimenpiteet on suoritettava (ks. kohta Haittavaikutukset).
QT-ajan pidentyminen
Suun kautta otettavan aripipratsolin kliinisissä tutkimuksissa QT-ajan pidentymisen esiintymistiheys oli sama suuruusluokkaa kuin lumelääkkeellä. Aripipratsolia pitää käyttää varoen potilaille, joiden suvussa on esiintynyt QT-ajan pidentymistä (ks. kohta Haittavaikutukset).
Tardiivi dyskinesia
Enintään vuoden kestäneissä kliinisissä tutkimuksissa kiireellistä hoitoa vaativa dyskinesia oli melko harvinainen aripipratsolihoidon aikana. Jos aripipratsolihoidon aikana ilmaantuu tardiivin dyskinesian oireita ja löydöksiä, on harkittava annoksen pienentämistä tai hoidon keskeyttämistä (ks. kohta Haittavaikutukset). Nämä oireet voivat vaikeutua tilapäisesti tai jopa ilmaantua hoidon keskeyttämisen jälkeen.
Maligni neuroleptioireyhtymä
Maligni neuroleptioireyhtymä on psykoosilääkkeiden käyttöön liittyvä oireyhtymä, joka voi johtaa kuolemaan. Kliinisissä tutkimuksissa maligni neuroleptioireyhtymä oli harvinainen aripipratsolihoidon yhteydessä. Malignin neuroleptioireyhtymän kliinisiä löydöksiä ovat korkea kuume, lihasjäykkyys, psyykkisen tilan muutokset ja autonomisen hermoston epävakaus (pulssin tai verenpaineen heilahtelu, takykardia, voimakas hikoilu ja sydämen rytmihäiriöt). Muita löydöksiä voivat olla kohonnut kreatiinifosfokinaasiarvo, myoglobinuria (rabdomyolyysi) ja akuutti munuaisten vajaatoiminta. Myös maligniin neuroleptioireyhtymään liittymätöntä kreatiinifosfokinaasiarvon nousua ja rabdomyolyysia on esiintynyt. Jos potilaalle kehittyy maligniin neuroleptioireyhtymään viittaavia oireita ja löydöksiä tai jos hänellä esiintyy selittämätöntä korkeaa kuumetta, johon ei liity muita neuroleptioireyhtymän kliinisiä ilmenemismuotoja, kaikki psykoosilääkkeet, myös aripipratsoli, on keskeytettävä (ks. kohta Haittavaikutukset).
Kouristuskohtaukset
Kliinisissä tutkimuksissa kouristuskohtaukset olivat melko harvinaisia aripipratsolihoidon yhteydessä. Aripipratsolia on annettava varoen potilaille, joilla on aikaisemmin ollut kouristuskohtauksia tai joilla on jokin kouristuskohtauksia aiheuttava sairaus (ks. kohta Haittavaikutukset).
Iäkkäät dementiaan liittyvää psykoosia sairastavat potilaat
Lisääntynyt kuolleisuus
Kolmessa lumelääkekontrolloidussa tutkimuksessa, joihin osallistui suun kautta otettavaa aripipratsolia käyttäviä iäkkäitä potilaita, joilla oli Alzheimerin tautiin liittyvä psykoosi (n = 938; iän keskiarvo: 82,4 vuotta; iän vaihteluväli: 56–99 vuotta), aripipratsolihoitoa saaneilla potilailla oli kohonnut kuolleisuusriski lumelääkkeeseen verrattuna. Suun kautta otettavaa aripipratsolihoitoa saaneilla potilailla kuolleisuus oli 3,5 % ja lumelääkeryhmässä 1,7 %. Vaikkakin kuolinsyyt olivat vaihtelevia, suurin osa oli joko kardiovaskulaarisia (esim. sydämen vajaatoiminta, äkkikuolema) tai infektioperäisiä (esim. keuhkokuume) (ks. kohta Haittavaikutukset).
Aivoverenkiertoon kohdistuvat haittavaikutukset
Edellä mainituissa suun kautta otettavaa aripipratsolia koskevissa tutkimuksissa potilailla (iän keskiarvo 84 vuotta; vaihteluväli 78–88 vuotta) havaittiin aivoverenkiertoon kohdistuvia haittavaikutuksia (esim. aivohalvaus, ohimenevä aivoverenkiertohäiriö (TIA)), myös kuolemantapauksia. Kaikkiaan 1,3 %:lla aripipratsolihoitoa ja 0,6 %:lla lumelääkettä saaneista potilaista havaittiin aivoverenkiertoon kohdistuvia haittavaikutuksia. Ero ei ole tilastollisesti merkitsevä. Kuitenkin yhdessä näistä tutkimuksista, jossa aripipratsoliannos oli vakioitu, havaittiin merkittävä annos-vaikutussuhde aivoverenkiertoon kohdistuvien haittavaikutusten osalta aripipratsolihoitoa saaneilla potilailla (ks. kohta Haittavaikutukset).
Aripipratsoli ei ole indisoitu dementiaan liittyvän psykoosin hoitoon.
Hyperglykemia ja diabetes
Aripipratsolin käytön yhteydessä on esiintynyt hyperglykemiaa, joka on joissain tapauksissa ollut erittäin voimakasta ja johon on joskus liittynyt ketoasidoosi, hyperosmolaarinen kooma tai kuolema. Vaikeille komplikaatioille mahdollisesti altistavia riskitekijöitä ovat mm. ylipaino ja suvussa esiintyvä diabetes. Aripipratsolilla hoidettavien potilaiden hyperglykemian oireita ja löydöksiä (kuten polydipsia, polyuria, polyfagia ja heikotus) pitää seurata. Diabetesta sairastavien potilaiden ja potilaiden, joilla on diabeteksen riskitekijöitä, sokeritasapainoa pitää seurata säännöllisesti (ks. kohta Haittavaikutukset).
Yliherkkyys
Aripipratsolin käytön yhteydessä voi ilmetä allergisten oireiden kaltaisia yliherkkyysreaktioita (ks. kohta Haittavaikutukset).
Painonnousu
Psykoosilääkityksestä, komorbiditeeteista ja puutteellisista elämäntavoista johtuva painonnousu on yleistä skitsofreniaa sairastavilla potilailla ja se voi johtaa vaikeisiin komplikaatioihin. Painonnoususta suun kautta otettavan aripipratsolihoidon yhteydessä on ilmoitettu valmisteen markkinoillaolon aikana. Havaittu painonnousu on yleensä esiintynyt potilailla, joilla on merkittäviä riskitekijöitä, kuten diabetes, kilpirauhasen toimintahäiriö tai aivolisäkkeen adenooma. Aripipratsoli ei aiheuttanut kliinisesti merkittävää painonnousua kliinisissä tutkimuksissa (ks. kohta Haittavaikutukset).
Dysfagia
Ruokatorven dysmotiliteettia ja aspiraatiota on esiintynyt aripipratsolin käytön yhteydessä. Aripipratsolia pitää käyttää varoen potilaille, joilla on riski aspiraatiopneumoniaan.
Pelihimo ja muut impulssikontrollin häiriöt
Potilailla saattaa aripipratsolihoidossa ilmetä alentunutta impulssikontrollia, erityisesti pelihimoa, ja kyvyttömyyttä hallita näitä impulsseja. Muita ilmoitettuja impulssikontrollin ongelmia ovat lisääntyneet seksuaaliset tarpeet, pakonomainen ostelu, ahmiminen tai pakonomainen syöminen sekä muu impulsiivinen ja pakonomainen käyttäytyminen. Lääkettä määräävien on tärkeä kysyä potilailta tai heidän hoitajiltaan erityisesti alkaneista tai pahentuneista pelihimosta, seksuaalisista tarpeista, pakonomaisesta ostelusta, ahmimisesta tai pakonomaisesta syömisestä tai muista impulssikontrollin ongelmista aripipratsolihoidon aikana. On huomattava, että impulssikontrollin häiriöihin viittaavat oireet saattavat liittyä perustautiin; joissakin tapauksissa näiden oireiden on kuitenkin ilmoitettu lakanneen, kun lääkeannosta on pienennetty tai kun lääkevalmisteen käyttö on lopetettu. Impulssikontrollihäiriöistä saattaa aiheutua potilaalle ja muille ihmisille haittaa, jos niitä ei tunnisteta. Annoksen pienentämistä tai lääkevalmisteen käytön lopettamista on harkittava, jos potilaalle kehittyy impulssikontrollin häiriöihin viittaavia oireita (ks. kohta Haittavaikutukset).
Kaatumiset
Aripipratsoli voi aiheuttaa uneliaisuutta, asentohypotensiota sekä motorista ja sensorista epävakautta, jotka voivat johtaa kaatumisiin. Varovaisuutta on noudatettava hoidettaessa kohonneessa riskissä olevia potilaita, ja pienemmän aloitusannoksen käyttöä on harkittava (esim. iäkkäille tai heikkokuntoisille potilaille, ks. kohta Annostus ja antotapa).
Natrium
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Yhteisvaikutustutkimuksia ei ole tehty Abilify Maintena -valmisteella. Alla esitetyt tiedot on saatu suun kautta otettavalla aripipratsolilla tehdyistä tutkimuksista.
Aripipratsoli saattaa tehostaa eräiden antihypertensiivisten lääkevalmisteiden vaikutusta α1-adrenergisia reseptoreja salpaavan vaikutuksensa vuoksi.
Aripipratsolin primaaristen keskushermostovaikutusten vuoksi varovaisuutta on noudatettava, kun aripipratsolia käytetään yhdessä alkoholin tai muiden keskushermostoon vaikuttavien lääkevalmisteiden kanssa, jotka aiheuttavat päällekkäisiä haittavaikutuksia, kuten sedaatiota (ks. kohta Haittavaikutukset).
Varovaisuutta on noudatettava, jos aripipratsolia annetaan yhdessä QT-aikaan tai elektrolyyttitasapainoon haitallisesti vaikuttavien lääkevalmisteiden kanssa.
Muiden lääkevalmisteiden mahdollinen vaikutus aripipratsolihoitoon
Kinidiini ja muut voimakkaat CYP2D6:n estäjät
Terveillä tutkittavilla tehdyssä suun kautta otettavan aripipratsolin kliinisessä tutkimuksessa voimakas CYP2D6:n estäjä (kinidiini) suurensi aripipratsolin AUC-arvoa 107 %, mutta Cmax-arvo pysyi muuttumattomana. Aktiivisen metaboliitin, dehydroaripipratsolin, AUC-arvo pieneni 32 % ja Cmax-arvo 47 %. Muilla CYP2D6:n voimakkailla estäjillä, kuten fluoksetiinilla ja paroksetiinilla, voidaan odottaa olevan samanlaisia vaikutuksia, joten annosta on pienennettävä vastaavasti (ks. kohta Annostus ja antotapa).
Ketokonatsoli ja muut voimakkaat CYP3A4:n estäjät
Terveillä tutkittavilla tehdyssä suun kautta otettavan aripipratsolin kliinisessä tutkimuksessa voimakas CYP3A4:n estäjä (ketokonatsoli) suurensi aripipratsolin AUC-arvoa 63 % ja Cmax-arvoa 37 %. Dehydroaripipratsolin AUC-arvo suureni 77 % ja Cmax-arvo 43 %. Hitailla CYP2D6-metaboloijilla voimakkaiden CYP3A4:n estäjien samanaikainen käyttö voi johtaa suurempiin aripipratsolin pitoisuuksiin plasmassa kuin nopeilla CYP2D6-metaboloijilla.
Harkittaessa ketokonatsolin tai muiden voimakkaiden CYP3A4:n estäjien yhteiskäyttöä aripipratsolin kanssa hoidon mahdollisen hyödyn pitää olla suurempi kuin potilaalle mahdollisesti aiheutuvat riskit. Muilla voimakkailla CYP3A4:n estäjillä, kuten itrakonatsolilla ja HIV-proteaasin estäjillä, voidaan odottaa olevan samanlaisia vaikutuksia, joten annosta on pienennettävä vastaavasti (ks. kohta Annostus ja antotapa).
Kun CYP2D6:n tai CYP3A4:n estäjän käyttö lopetetaan, aripipratsoliannos on nostettava takaisin yhdistelmähoidon aloittamista edeltäneelle tasolle. Kun aripipratsolia annetaan samanaikaisesti heikkojen CYP3A4:n estäjien (esim. diltiatseemi) tai CYP2D6:n estäjien (esim. essitalopraami) kanssa, aripipratsolipitoisuuden voidaan odottaa nousevan jonkin verran plasmassa.
Karbamatsepiini ja muut CYP3A4:n induktorit
Annettaessa samanaikaisesti karbamatsepiinia, joka on voimakas CYP3A4:n induktori, ja suun kautta otettavaa aripipratsolia skitsofreniaa tai skitsoaffektiivista häiriötä sairastaville potilaille, Cmax-arvon geometrinen keskiarvo oli 68 % pienempi ja AUC-arvon geometrinen keskiarvo 73 % pienempi kuin annettaessa pelkkää suun kautta otettavaa aripipratsolia (30 mg). Vastaavasti dehydroaripipratsolin Cmax-arvon geometrinen keskiarvo oli 69 % pienempi ja AUC:n geometrinen keskiarvo 71 % pienempi samanaikaisen karbamatsepiinin annon jälkeen kuin annettaessa pelkkää suun kautta otettavaa aripipratsolia. Abilify Maintena 400 mg/300 mg -valmisteen ja muiden CYP3A4:n induktorien (kuten rifampisiini, rifabutiini, fenytoiini, fenobarbitaali, primidoni, efavirentsi, nevirapiini ja mäkikuisma) samanaikaisella annolla voidaan odottaa olevan samanlaisia vaikutuksia. CYP3A4:n induktorien samanaikaiskäyttöä Abilify Maintena 400 mg/300 mg -valmisteen kanssa pitää välttää, koska se aiheuttaa veren aripipratsolipitoisuuden vähenemistä, mahdollisesti alle tehokkaan pitoisuustason.
Serotoniinioireyhtymä
Serotoniinioireyhtymää on havaittu aripipratsolia käyttävillä potilailla. Tämän häiriön mahdollisia oireita ja löydöksiä voi ilmetä erityisesti käytettäessä samanaikaisesti muita serotonergisiä lääkevalmisteita, kuten serotoniinin takaisinoton estäjiä / serotoniinin ja noradrenaliinin takaisinoton estäjiä (SSRI-/SNRI-valmisteita), tai lääkevalmisteita, joiden tiedetään lisäävän aripipratsolipitoisuutta (ks. kohta Haittavaikutukset).
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi
Abilify Maintena -kerta-annoksen jälkeisen aripipratsolialtistuksen plasmassa odotetaan säilyvän enintään 34 viikon ajan (ks. kohta Farmakokinetiikka). Tämä sekä raskaaksi tulemisen ja imetyksen mahdollisuus on huomioitava, kun hoito aloitetaan naisille, jotka voivat tulla raskaaksi. Abilify Maintena -hoidon saa aloittaa raskaaksi tulemista suunnitteleville naisille vain, jos se on selvästi välttämätöntä.
Raskaus
Ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia aripipratsolin käytöstä raskaana oleville naisille. Synnynnäisiä epämuodostumia on raportoitu, mutta syy-yhteyttä aripipratsoliin ei ole voitu osoittaa. Eläinkokeissa ei voitu sulkea pois mahdollista lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Potilasta on kehotettava ottamaan yhteyttä lääkäriinsä, jos hän tulee raskaaksi tai suunnittelee tulevansa raskaaksi aripipratsolihoidon aikana.
Lääkärin täytyy lääkettä määrätessään olla tietoinen Abilify Maintena -valmisteen pitkävaikutteisista ominaisuuksista. Aripipratsolia on havaittu aikuispotilaiden plasmassa jopa 34 viikon jälkeen depotsuspension kerta-annoksen antamisesta.
Psykoosilääkkeille (myös aripipratsolille) kolmannen raskauskolmanneksen aikana altistuneilla vastasyntyneillä on ekstrapyramidaali- ja/tai lääkevieroitusoireiden riski. Oireiden vaikeusaste ja kesto synnytyksen jälkeen voi vaihdella. Näitä vastasyntyneillä esiintyviä oireita voivat olla agitaatio, hypertonia, hypotonia, vapina, uneliaisuus, hengitysvaikeus tai syömishäiriöt. Siksi vastasyntyneiden vointia pitää seurata huolellisesti (ks. kohta Haittavaikutukset).
Äidin altistuminen Abilify Maintena -valmisteelle ennen raskautta ja sen aikana saattaa aiheuttaa haittavaikutuksia vastasyntyneelle. Abilify Maintena -valmistetta ei pidä käyttää raskauden aikana, ellei se ole selvästi välttämätöntä.
Imetys
Aripipratsolia/metaboliitteja erittyy ihmisen rintamaitoon siinä määrin, että vaikutukset rintaruokittuun imeväiseen ovat todennäköisiä, jos Abilify Maintena -valmistetta annetaan imettäville naisille. Koska Abilify Maintena -kerta-annoksen odotetaan säilyvän plasmassa jopa 34 viikon ajan (ks. kohta Farmakokinetiikka), rintaruokittuun imeväiseen kohdistuvat riskit ovat mahdollisia, vaikka Abilify Maintena -valmistetta olisi annettu kauan ennen imettämistä. Potilaiden, jotka saavat Abilify Maintena -hoitoa parhaillaan tai ovat saaneet sitä viimeisten 34 viikon aikana, ei pidä imettää.
Hedelmällisyys
Aripipratsoli ei heikentänyt hedelmällisyyttä aripipratsolilla tehtyjen lisääntymistoksisuustutkimusten perusteella.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Aripipratsolilla on vähäinen tai kohtalainen vaikutus ajokykyyn ja koneiden käyttökykyyn, koska hermostoon ja näkökykyyn kohdistuvat vaikutukset, kuten sedaatio, uneliaisuus, pyörtyminen, näön hämärtyminen ja kahtena näkeminen, ovat mahdollisia (ks. kohta Haittavaikutukset).
Haittavaikutukset
Yhteenveto turvallisuusprofiilista
Yleisimmin havaitut haittavaikutukset, joita on todettu ≥ 5 %:lla potilaista kahdessa kaksoissokkoutetussa, pitkäkestoisessa Abilify Maintena 400 mg/300 mg -valmisteen tutkimuksessa, olivat painonnousu (9,0 %), akatisia (7,9 %), unettomuus (5,8 %) ja kipu injektiokohdassa (5,1 %).
Taulukoitu luettelo haittavaikutuksista
Aripipratsolihoitoon liittyvien haittavaikutusten esiintyvyys on taulukoitu alla. Taulukko perustuu kliinisten tutkimusten aikana ja/tai markkinoilletulon jälkeisen käytön myötä ilmoitettuihin haittavaikutuksiin.
Kaikki haittavaikutukset on lueteltu elinluokan ja esiintyvyyden mukaan: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/ 1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000) ja tuntematon (koska saatavissa oleva tieto ei riitä arviointiin). Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Haittavaikutukset, joiden esiintyvyys on ”tuntematon”, on raportoitu markkinoille tulon jälkeen.
| Yleinen | Melko harvinainen | Tuntematon | |
|---|---|---|---|
| Veri ja imukudos | Neutropenia Anemia Trombosytopenia Neutrofiilimäärän lasku Valkosolumäärän lasku | Leukopenia | |
| Immuunijärjestelmä | Yliherkkyys | Allerginen reaktio (esim. anafylaktinen reaktio, angioedeema mukaan lukien kielen turvotus, kieliedeema, kasvoedeema, kutina tai urtikaria) | |
| Umpieritys | Veren prolaktiiniarvon lasku Hyperprolaktinemia | Diabeettinen hyperosmolaarinen kooma Diabeettinen ketoasidoosi | |
| Aineenvaihdunta ja ravitsemus | Painonnousu Diabetes Painonlasku
| Hyperglykemia Hyperkolesterolemia Hyperinsulinemia Hyperlipidemia Hypertriglyseridemia Ruokahalun häiriö | Anoreksia Hyponatremia |
| Psyykkiset häiriöt | Agitaatio Ahdistuneisuus Rauhattomuus Unettomuus | Itsemurha-ajatukset Psykoottinen häiriö Hallusinaatio Harhaluulo Hyperseksuaalisuus Paniikkireaktio Masennus Mielialan ailahtelu Apatia Dysforia Unihäiriö Bruksismi Libidon heikkeneminen Mielialan muuttuminen | Itsemurhan toteuttaminen Itsemurhayritykset Pelihimo Impulssikontrollin häiriöt Ahmiminen Pakonomainen ostelu Poriomania Hermostuneisuus Aggressiivisuus |
| Hermosto | Ekstrapyramidaalioireet Akatisia Vapina Dyskinesia Sedaatio Uneliaisuus Huimaus Päänsärky
| Dystonia Tardiivi dyskinesia Parkinsonismi Liikehäiriö Psykomotorinen yliaktiivisuus Levottomat jalat -oireyhtymä Hammasratasjäykkyys Hypertonia Bradykinesia Kuolaaminen Makuhäiriö Hajuhäiriö | Maligni neurolepti-oireyhtymä Grand mal -kohtaus Serotoniini-oireyhtymä Puheen häiriöt |
| Silmät | Okulogyyrinen kriisi Näön hämärtyminen Silmäkipu Kahtena näkeminen Valonarkuus | ||
| Sydän | Kammiolisälyönnit Bradykardia Takykardia T-aallon madaltuminen EKG:ssa Poikkeava EKG EKG:n T-aallon inversio | Äkkikuolema Sydänpysähdys Kääntyvien kärkien takykardia Ventrikulaarinen arytmia QT-ajan piteneminen | |
| Verisuonisto | Hypertensio Ortostaattinen hypotensio Verenpaineen nousu | Pyörtyminen Laskimotromboembolia (myös keuhkoembolia ja syvä laskimotromboosi) | |
| Hengityselimet, rintakehä ja välikarsina | Yskä Nikotus | Orofaryngiaalinen spasmi Laryngospasmi Aspiraatiopneumonia | |
| Ruoansulatuselimistö | Suun kuivuminen | Gastroesofageaalinen refluksitauti Dyspepsia Oksentelu Ripuli Pahoinvointi Ylävatsakipu Vatsavaivat Ummetus Tiheä ulostamistarve Syljen liikaeritys | Pankreatiitti Dysfagia |
| Maksa ja sappi | Maksan toimintakokeiden poikkeavuudet Maksaentsyymin lisääntyminen Alaniiniamino-transferaasi-arvon nousu Gamma-glutamyyli-transferaasiarvon nousu Veren bilirubiiniarvon nousu Aspartaattiamino-transferaasiarvon nousu | Maksan vajaatoiminta Keltaisuus Hepatiitti Alkalisen fosfataasiarvon nousu | |
| Iho ja ihonalainen kudos | Alopekia Akne Ruusufinni Ekseema Ihon kovettuma | Ihottuma Valoherkkyys-reaktiot Runsas hikoilu Lääkkeeseen liittyvä yleisoireinen eosinofiilinen oireyhtymä (DRESS) | |
| Luusto, lihakset ja sidekudos | Muskuloskeletaalinen kankeus | Lihasjäykkyys Lihaskouristukset Lihasnykäykset Lihaskireys Myalgia Kipu raajoissa Nivelkipu Selkäkipu Vähentynyt nivelten liikelaajuus Niskajäykkyys Leukalukko | Rabdomyolyysi |
| Munuaiset ja virtsatiet | Munuaiskivet Glukosuria | Virtsaumpi, Virtsainkontinenssi | |
| Raskauteen, synnytykseen ja perinataalikauteen liittyvät haitat | Vastasyntyneen lääkeainevieroitusoireyhtymä (ks. kohta Raskaus ja imetys) | ||
| Sukupuolielimet ja rinnat | Erektiohäiriö | Maidonvuoto Gynekomastia Rintojen arkuus Vulvovaginaalinen kuivuus | Priapismi |
| Yleisoireet ja antopaikassa todettavat haitat | Kipu injektiokohdassa Injektiokohdan kovettuma Väsyneisyys | Kuume Voimattomuus Kävelyhäiriöt Epämukava tunne rinnassa Reaktio injektiokohdassa Punoitus injektiokohdassa Turvotus injektiokohdassa Epämukava tunne injektiokohdassa Injektiokohdan kutina Jano Hidasliikkeisyys | Lämmönsäätelyn häiriö (esim. hypotermia, kuume) Rintakipu Perifeerinen edeema |
| Tutkimukset | Veren kreatiinifosfokinaasiarvon nousu | Verensokerin nousu Verensokerin lasku Glykosyloituneen hemoglobiiniarvon nousu Vyötärönympäryksen kasvu Veren kolesteroliarvon lasku Veren triglyseridiarvon lasku | Verensokerin vaihtelut |
Valikoitujen haittavaikutusten kuvaus
Reaktiot injektiokohdassa
Kahden pitkäkestoisen tutkimuksen kontrolloitujen, kaksoissokkoutettujen vaiheiden aikana havaittiin reaktioita injektiokohdassa. Nämä olivat vaikeusasteeltaan yleensä lieviä tai kohtalaisia ja hävisivät ajan myötä. Injektiokohdan kipu (esiintymistiheys 5,1 %) alkoi mediaaniarvoisesti toisena injektion jälkeisenä vuorokautena ja sen keston mediaani oli 4 vuorokautta.
Avoimessa tutkimuksessa, jossa verrattiin olkavarren hartialihakseen tai pakaralihakseen annetun Abilify Maintena 400 mg/300 mg -valmisteen biologista hyötyosuutta, injektiokohtaan liittyviä reaktioita havaittiin hieman useammin olkavarren hartialihaksessa. Suurin osa reaktioista oli lieviä ja lievittyi myöhempien injektioiden myötä. Toistuvaa injektiokohdan kipua ilmeni useammin olkavarren hartialihaksessa verrattuna tutkimuksiin, joissa Abilify Maintena 400 mg/300 mg injisoitiin pakaralihakseen.
Neutropenia
Neutropenian esiintymistä ilmoitettiin Abilify Maintena 400 mg/300 mg -valmisteen kliinisessä tutkimusohjelmassa ja se alkoi tyypillisesti noin 16 vuorokauden kuluttua ensimmäisestä injektiosta. Neutropenian keston mediaani oli 18 vuorokautta.
Ekstrapyramidaalioireet
Vakaassa tilassa oleville skitsofreniaa sairastaville potilaille tehdyissä tutkimuksissa Abilify Maintena 400 mg/300 mg -hoitoon liittyi yleisemmin ekstrapyramidaalioireita (18,4 %) kuin suun kautta otettavaan aripipratsolihoitoon (11,7 %). Akatisia oli yleisin havaittu oire (8,2 %) ja se alkoi tyypillisesti noin 10 vuorokauden kuluttua ensimmäisestä injektiosta. Akatisian keston mediaani oli 56 vuorokautta. Tutkittavat, joille kehittyi akatisiaa, käyttivät tyypillisesti antikolinergista lääkehoitoa, lähinnä bentsatropiinimesilaattia ja triheksyfenidyyliä. Akatisian hoitoon käytettiin harvemmin propranololia ja bentsodiatsepiineja (klonatsepaami ja diatsepaami) ja vastaavia lääkeaineita. Seuraavaksi yleisin haittatapahtuma akatisian jälkeen oli parkinsonismi (esiintymistiheys 6,9 % Abilify Maintena 400 mg/300 mg –hoidossa; 4,15 % suun kautta otettavia 10 mg – 30 mg:n aripipratsolitabletteja käyttäneiden ryhmässä ja 3,0 % lumelääkettä saaneilla).
Dystonia
Luokkavaikutus: Dystonian oireita, pitkittyneitä poikkeavia lihasryhmien supistuksia, voi esiintyä niille alttiilla henkilöillä muutaman ensimmäisen hoitovuorokauden aikana. Dystonian oireita ovat niskalihasten spasmit, jotka joskus etenevät kurkun kireydeksi, nielemisvaikeudet, hengitysvaikeudet tai kielen esiintyöntyminen (protruusio). Vaikka näitä oireita voi esiintyä matalia annoksia käytettäessä, niitä esiintyy useammin ja vaikea-asteisempana käytettäessä suuria annoksia ensimmäisen polven psykoosilääkkeitä. Akuutin dystonian riski on suurempi miehillä ja nuoremmissa ikäryhmissä.
Paino
38 viikkoa kestäneen pitkäkestoisen tutkimuksen kaksoissokkoutetussa, aktiivikontrolloidussa vaiheessa (ks. kohta Farmakodynamiikka) lähtötason ja viimeisen käynnin välisen ≥ 7 %:n painonnousun esiintymistiheys oli 9,5 % Abilify Maintena 400 mg/300 mg -valmistetta käytettäessä ja 11,7 % suun kautta otettavia 10 mg – 30 mg:n aripipratsolitabletteja käytettäessä. Lähtötason ja viimeisen käynnin välisen ≥ 7 %:n painon laskun esiintymistiheys oli 10,2 % Abilify Maintena 400 mg/300 mg -valmistetta käytettäessä ja 4,5 % suun kautta otettavia 10 mg – 30 mg:n aripipratsolitabletteja käytettäessä. 52 viikkoa kestäneen pitkäkestoisen tutkimuksen kaksoissokkoutetussa, lumelääkekontrolloidussa vaiheessa (ks. kohta Farmakodynamiikka) lähtötason ja viimeisen käynnin välisen ≥ 7 %:n painonnousun esiintymistiheys oli 6,4 % Abilify Maintena 400 mg/300 mg -valmistetta käytettäessä ja 5,2 % lumelääkettä käytettäessä. Lähtötason ja viimeisen käynnin välisen ≥ 7 %:n painon laskun esiintymistiheys oli 6,4 % Abilify Maintena 400 mg/300 mg -valmistetta käytettäessä ja 6,7 % lumelääkettä käytettäessä. Kaksoissokkoutetun hoidon aikana kehonpainon muutoksen keskiarvo lähtötasosta viimeiselle käynnille oli −0,2 kg Abilify Maintena 400 mg/300 mg -valmistetta saaneilla ja −0,4 kg lumelääkettä saaneilla (p = 0,812).
Prolaktiini
Hyväksyttyjä käyttöaiheita koskevissa kliinisissä tutkimuksissa ja markkinoille tulon jälkeisissä tutkimuksissa aripipratsolin käyttöön havaittiin liittyvän seerumin prolaktiinipitoisuuden suurenemista ja pienenemistä lähtötilanteeseen verrattuna (Farmakodynamiikka).
Pelihimo ja muut impulssikontrollihäiriöt
Pelihimoa, hyperseksuaalisuutta, pakonomaista ostelua sekä ahmimista tai pakonomaista syömistä saattaa ilmetä potilailla, joita hoidetaan aripipratsolilla (katso kohta Varoitukset ja käyttöön liittyvät varotoimet).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 Fimea
Yliannostus
Aripipratsolin kliinisissä tutkimuksissa ei ilmoitettu yliannostukseen liittyvistä haittavaikutuksista. Varovaisuutta on noudatettava, jotta vältetään injisoimasta tätä lääkevalmistetta verisuoneen. Varman tai epäillyn tahattoman yliannostuksen/suonensisäisen annon jälkeen tarvitaan potilaan huolellista tarkkailua. Jos mahdollisesti vakava oire tai löydös kehittyy, seurannan lisäksi jatkuva EKG-monitorointi on välttämätöntä. Lääketieteellistä valvontaa ja seurantaa jatketaan potilaan toipumiseen asti.
Annoksen yllättävän vapautumisen (nk. dose dumping) simulaatio osoitti, että ennustettu aripipratsolin keskipitoisuuden huippu on 4 500 ng/ml, eli 9 kertaa terapeuttisen alueen yläraja. Dose dumping -tilanteessa aripipratsolipitoisuuksien ennustetaan nousevan nopeasti terapeuttisen ikkunan ylärajalle noin 3 vuorokaudessa. Seitsemänteen vuorokauteen mennessä aripipratsolin keskipitoisuudet laskevat niiden pitoisuuksien tasolle, joita tavataan lihakseen annetun depotannoksen jälkeen ilman dose dumping -ilmiötä. Yliannoksen todennäköisyys on pienempi parenteraalisia kuin peroraalisia valmisteita käytettäessä. Seuraavassa esitetään kuitenkin peroraalisen aripipratsolin yliannokseen liittyvät ohjeet.
Oireet ja löydökset
Kliinisissä tutkimuksissa ja markkinoilla olon aikana aikuispotilaat ovat ottaneet pelkkää aripipratsolia tahallaan tai vahingossa yliannoksena aina 1 260 mg:n annokseen (41 kertaa suurin suositeltu päivittäinen aripipratsoliannos) asti ilman kuolemantapauksia. Havaittuja lääketieteellisesti mahdollisesti merkittäviä oireita ja löydöksiä olivat letargia, verenpaineen nousu, uneliaisuus, takykardia, pahoinvointi, oksentelu ja ripuli. Lisäksi pelkän aripipratsolin vahingossa tapahtuneita yliannostuksia (195 mg:n annokseen asti) on kuvattu lapsilla ilman kuolemantapauksia. Näissä tapauksissa yliannostus aiheutti potentiaalisesti vakavia oireita ja löydöksiä, kuten uneliaisuutta, tilapäistä tajuttomuutta ja ekstrapyramidaalioireita.
Yliannostuksen hoito
Yliannostuksen hoidon on keskityttävä elintoimintoja tukeviin hoitotoimenpiteisiin, joihin kuuluvat hengitysteiden pitäminen avoimina, happihoito ja tekohengitys, sekä oireiden hoitoon. Mahdollinen useiden lääkevalmisteiden osallisuus on otettava huomioon. Sydämen ja verenkierron tarkkailu sekä jatkuva EKG-monitorointi mahdollisten rytmihäiriöiden havaitsemiseksi on aloitettava heti. Aripipratsolin yliannostuksen tai sen epäilyn yhteydessä huolellista valvontaa ja seurantaa on jatkettava potilaan toipumiseen asti.
Hemodialyysi
Hemodialyysin vaikutuksista aripipratsolin yliannostuksen hoidossa ei ole tutkimustietoa, mutta siitä ei todennäköisesti ole hyötyä, koska aripipratsoli sitoutuu voimakkaasti plasman proteiineihin.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: psykoosilääkkeet, muut psykoosilääkkeet, ATC- koodi: N05AX12
Vaikutusmekanismi
Aripipratsolin tehon skitsofrenian hoidossa on arveltu välittyvän yhdistetyn osittaisen dopamiini- D2- ja serotoniini-5HT1A-reseptoriagonismin ja serotoniini-5HT2A-reseptoriantagonismin kautta. Aripipratsolilla oli antagonistin ominaisuudet dopaminergisen hyperaktiivisuuden eläinkoemalleissa ja agonistin ominaisuudet dopaminergisen hypoaktiivisuuden osalta. Aripipratsolilla on voimakas kiinnittymistaipumus in vitro dopamiini-D2- ja -D3-, serotoniini-5HT1A- ja −5HT2A-reseptoreihin ja kohtalainen affiniteetti dopamiini-D4-, serotoniini-5HT2C- ja −5HT7-, alfa1-adrenergisiin ja histamiini-H1-reseptoreihin. Aripipratsolilla oli myös kohtalainen kiinnittymistaipumus serotoniinin takaisinottokohtaan, mutta ei mainittavaa affiniteettia kolinergisiin muskariinireseptoreihin. Yhteisvaikutukset muiden kuin dopamiini- ja serotoniinireseptorien alaryhmiin kuuluvien reseptorien kanssa saattavat selittää osan aripipratsolin muista kliinisistä vaikutuksista.
Kun terveille tutkittaville annettiin 0,5 mg – 30 mg aripipratsolia suun kautta kerran päivässä 2 viikon ajan, positroniemissiotomografiassa havaittiin, että 11C-raklopridin, D2/D3-reseptorin ligandin, sitoutuminen nucleus caudatukseen ja putameniin väheni annoksesta riippuvasti.
Kliininen teho ja turvallisuus
Skitsofrenian ylläpitohoito aikuisilla
Abilify Maintena 400 mg/300 mg
Abilify Maintena 400 mg/300 mg -valmisteen teho skitsofreniaa sairastavien potilaiden ylläpitohoidossa on todettu kahdessa satunnaistetussa kaksoissokkoutetussa pitkäkestoisessa tutkimuksessa.
Keskeisenä tutkimuksena oli 38 viikkoa kestänyt satunnaistettu, kaksoissokkoutettu, aktiivikontrolloitu tutkimus, joka oli suunniteltu havainnoimaan tämän lääkevalmisteen tehoa, turvallisuutta ja siedettävyyttä skitsofreniaa sairastavien aikuispotilaiden ylläpitohoidossa. Lääke annettiin kuukausittaisina injektioina ja vertailuhoito kerran vuorokaudessa suun kautta otettavina 10 mg – 30 mg:n aripipratsolitabletteina. Tutkimuksessa oli seulontavaihe ja 3 hoitovaihetta: muuntovaihe, suun kautta otettavan lääkkeen vakiinnuttamisvaihe ja kaksoissokkoutettu, aktiivikontrolloitu vaihe.
662 potilasta, jotka soveltuivat 38 viikon kaksoissokkoutettuun, aktiivikontrolloituun vaiheeseen, jaettiin satunnaisesti suhteessa 2:2:1 kolmeen kaksoissokkoutettuun hoitoryhmään: 1) Abilify Maintena 400 mg/300 mg, 2) suun kautta otettavan 10 mg – 30 mg:n aripipratsolin vakiinnuttaminen tai 3) pitkävaikutteinen 50 mg/25 mg aripipratsoli-injektio. Pitkävaikutteinen aripipratsoli-injektio annoksella 50 mg/25 mg otettiin mukaan aripipratsolin matalana annoksena vertailukelpoisuusasetelman (non-inferioriteetti) sensitiivisyyden testaamiseksi.
Ensisijainen tehon päätetapahtuma oli niiden potilaiden osuus, joilla ilmeni relapsi kaksoissokkoutetun, aktiivikontrolloidun vaiheen viikon 26 loppuun mennessä. Tämän analyysin tulokset osoittivat, että Abilify Maintena 400 mg/300 mg oli vertailukelpoinen suun kautta otettavien 10 mg – 30 mg:n aripipratsolitablettien kanssa.
Relapsin esiintyvyys viikon 26 loppuun mennessä oli 7,12 % Abilify Maintena 400 mg/300 mg -valmistetta käytettäessä ja 7,76 % suun kautta otettavia 10 mg – 30 mg:n aripipratsolitabletteja käytettäessä. Ero oli −0,64 %.
95 %:n luottamusväli arvioidulle viikon 26 loppuun mennessä relapsin saavien potilaiden suhteelliselle osuudelle oli (−5,26; 3,99). Ennalta määritelty vertailukelpoisuusmarginaali riskierolle (11,5 %) jäi havaitun 95 %:n luottamusvälin ulkopuolelle. Näin ollen Abilify Maintena 400 mg/300 mg on vertailukelpoinen (non-inferior) suun kautta otettavien 10 mg – 30 mg:n aripipratsolitablettien kanssa.
Arvioitu viikon 26 loppuun mennessä relapsin saavien potilaiden suhteellinen osuus oli 7,12 % Abilify Maintena 400 mg/300 mg -valmistetta käytettäessä, mikä on tilastollisesti merkitsevästi vähäisempi osuus kuin pitkävaikutteisia 50 mg/25 mg aripipratsoli-injektioita käytettäessä (21,80 %; p = 0,0006). Siten Abilify Maintena 400 mg/300 mg -valmisteen paremmuus pitkävaikutteiseen 50 mg/25 mg aripipratsoli-injektioon verrattuna oli osoitettavissa ja tutkimusasetelman validius varmistui.
Kuvassa 1 on esitetty Kaplan-Meierin käyrät satunnaistamisen ja relapsin välisestä ajasta Abilify Maintena 400 mg/300 mg -valmisteen, suun kautta otettavien 10 mg – 30 mg:n aripipratsolitablettien ja pitkävaikutteisten 50 mg/25 mg aripipratsoli-injektioiden osalta 38 viikkoa kestäneen kaksoissokkoutetun, aktiivikontrolloidun vaiheen aikana.
Kuva 1 Kaplan-Meierin käyrä: Aika psykoottisten oireiden vaikeutumiseen tai relapsiin
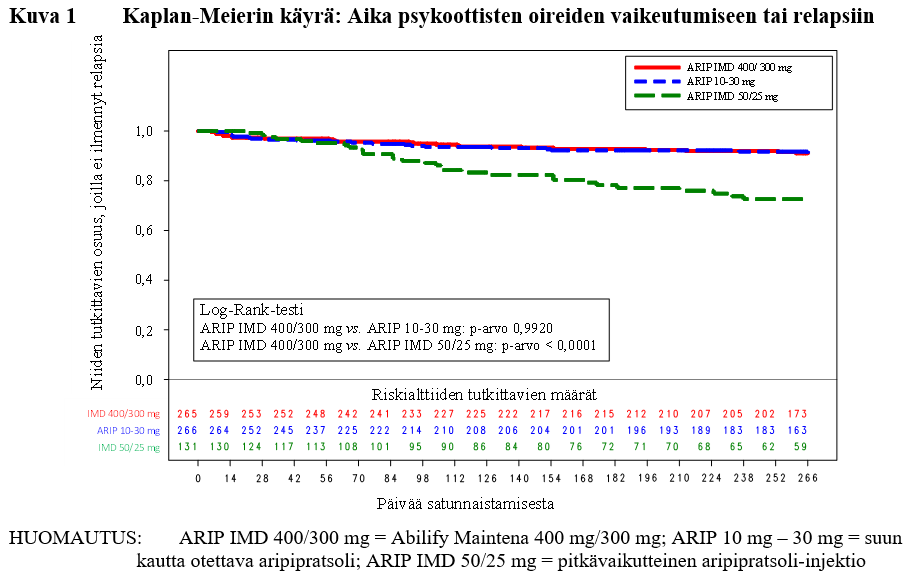
Lisäksi PANSS-asteikon (Positive and Negative Syndrome Scale) pistemäärän tulosten analyysi tukee Abilify Maintena 400 mg/300 mg -valmisteen vertailukelpoisuutta suun kautta otettavaan 10–30 mg:n aripipratsolin kanssa.
Taulukko 1 PANSS-kokonaispistemäärä – Muutos lähtötasosta viikkoon 38, LOCF- menetelmällä:
Satunnaistettu koe tehon tutkimiseena, b
| PANSS-kokonaispistemäärä – Muutos lähtötasosta viikkoon 38, LOCF-menetelmällä: Satunnaistettu koe tehon tutkimiseen a, b | |||
| Abilify Maintena 400 mg/300 mg (n = 263) | Suun kautta otettava aripipratsoli 10 mg – 30 mg/vrk (n = 266) | Pitkävaikutteinen aripipratsoli-injektio 50 mg/25 mg (n = 131) | |
| Lähtötason keskiarvo (SD) | 57,9 (12,94) | 56,6 (12,65) | 56,1 (12,59) |
| Muutoksen keskiarvo (SD) | -1,8 (10,49) | 0,7 (11,60) | 3,2 (14,45) |
| P-arvo | - | 0,0272 | 0,0002 |
a Pisteiden negatiivinen muutos osoittaa tilan paranemista.
b Mukaan otettiin vain potilaat, joilla oli sekä lähtötason havaintoarvo että vähintään yksi lähtötason jälkeinen havaintoarvo. P-arvot johdettiin vertailusta lähtötasoon nähden kovarianssianalyysissa, jossa hoito oli kiinteänä terminä ja lähtötaso kovariaattina.
Toinen tutkimus oli 52 viikkoa kestänyt satunnaistettu ja kaksoissokkoutettu hoidon lopettamistutkimus, jossa tutkittavat olivat yhdysvaltalaisia aikuispotilaita, joilla oli tutkimushetkellä skitsofreniadiagnoosi. Tutkimuksessa oli seulontavaihe ja 4 hoitovaihetta: muuntovaihe, suun kautta otettavan lääkkeen vakiinnuttamisvaihe, Abilify Maintena 400 mg/300 mg -valmisteen vakiinnuttamisvaihe ja kaksoissokkoutettu lumelääkekontrolloitu vaihe. Potilaat, joilla suun kautta otettavan lääkkeen vakiinnuttamisvaiheen edellytykset täyttyivät, jatkoivat yksöissokkoutetusti Abilify Maintena 400 mg/300 mg -valmisteen vakiinnuttamisvaiheessa vähintään 12 viikon ja korkeintaan 36 viikon ajan. Soveltuvat potilaat jaettiin satunnaisesti suhteessa 2:1 kaksoissokkoutettuun hoitovaiheeseen Abilify Maintena 400 mg/300 mg -valmisteella tai lumelääkkeellä.
Lopullisessa tehoa koskevassa analyysissa oli mukana 403 satunnaistettua potilasta ja 80 psykoosioireiden vaikeutumisen tai relapsin tapahtumaa. Lumelääkeryhmässä 39,6 %:lla potilaista oireet etenivät relapsiin asti, kun Abilify Maintena 400 mg/300 mg -ryhmässä relapsi ilmeni 10 %:lla potilaista. Siten lumelääkeryhmän potilailla oli 5,03-kertainen riski relapsiin.
Prolaktiini
38 viikkoa kestäneen tutkimuksen kaksoissokkoutetun aktiivikontrolloidun vaiheen aikana prolaktiinipitoisuus aleni keskimääräisesti lähtötasosta viimeiselle käynnille Abilify Maintena 400 mg/300 mg -valmistetta käytettäessä (−0,33 ng/ml). Suun kautta otettavia 10 mg – 30 mg:n aripipratsolitabletteja käytettäessä pitoisuus nousi keskimääräisesti (0,79 ng/ml; p < 0,01). Niiden Abilify Maintena 400 mg/300 mg -valmistetta saaneiden potilaiden osuus, joiden prolaktiinipitoisuus oli yli viitearvojen ylärajan missä tahansa arvioinnissa, oli 5,4 %. Suun kautta otettavia 10 mg – 30 mg:n aripipratsolitabletteja saaneiden potilaiden vastaava osuus oli 3,5 %.
Viitearvoista poikkeavia prolaktiinipitoisuuksia ilmaantui molemmissa hoitoryhmissä miespotilailla yleisemmin kuin naispotilailla.
52 viikkoa kestäneen tutkimuksen kaksoissokkoutetun lumelääkekontrolloidun vaiheen aikana prolaktiinipitoisuus aleni keskimääräisesti lähtötasosta viimeiselle käynnille Abilify Maintena 400 mg/300 mg ‑valmistetta käytettäessä (−0,38 ng/ml). Lumelääkettä käytettäessä pitoisuus nousi keskimääräisesti (1,67 ng/ml). Niiden Abilify Maintena 400 mg/300 mg -valmistetta saaneiden potilaiden osuus, joiden prolaktiinipitoisuus oli yli viitearvojen ylärajan missä tahansa arvioinnissa, oli 1,9 %. Lumelääkettä saaneiden potilaiden vastaava osuus oli 7,1 %.
Skitsofrenian akuuttivaiheen hoito aikuispotilailla
Abilify Maintena 400 mg/300 mg -valmisteen teho aikuispotilailla, joiden skitsofrenia paheni akuutisti, varmistettiin lyhytaikaisessa (12 viikon) tutkimuksessa, joka oli satunnaistettu, kaksoissokkoutettu ja lumelääkekontrolloitu (n = 339).
Ensisijainen päätetapahtuma (muutos PANSS-asteikon kokonaispistemäärässä lähtötasosta viikolle 10) osoitti, että Abilify Maintena 400 mg/300 mg (n = 167) oli tehokkaampi kuin lumelääke (n = 172).
PANSS-asteikon kokonaispistemäärän tavoin myös PANSS-asteikon positiivisten ja negatiivisten ala-asteikkojen pistemäärät paranivat (pienenivät) lähtötilanteesta ajan myötä.
Taulukko 2 PANSS-kokonaispistemäärä – muutos lähtötasosta viikolle 10: Satunnaistettu otos tehon tutkimiseen
PANSS-kokonaispistemäärä – muutos lähtötasosta viikolle 10: Satunnaistettu otos tehon tutkimiseen | ||
Abilify Maintena 400 mg/300 mg | Lumelääke
| |
| Lähtötason keskiarvo (SD) | 102,4 (11,4) n = 162 | 103,4 (11,1) n = 167 |
| Muutoksen LS-keskiarvo (SE) | -26,8 (1,6) n = 99 | -11,7 (1,6) n = 81 |
| P-arvo | < 0,0001 | |
| Hoitoerob (95 % CI) | -15,1 (-19,4, -10,8) | |
a Aineisto analysoitiin käyttämällä MMRM-menetelmää (toistomittausten sekamallia). Analyysiin otettiin mukaan vain tutkittavat, jotka oli satunnaistettu hoitoryhmään ja joille oli annettu vähintään yksi injektio ja tehty lähtötasoarviointi ja vähintään yksi tehon arviointi sen jälkeen.
b Ero (Abilify Maintena miinus lumelääke) pienimmän neliösumman keskiarvon muutoksena lähtötasoon nähden.
Abilify Maintena 400 mg/300 mg -hoidolla aikaansaatu oireiden paraneminen, joka näkyy CGI-S (Clinical Global Impressions Severity) -asteikon muutoksena lähtötasosta viikolle 10, oli myös tilastollisesti merkitsevää.
Henkilökohtaista ja sosiaalista toimintakykyä arvioitiin käyttämällä PSP-asteikkoa (Personal and Social Performance). PSP-asteikko on validoitu asteikko, jossa lääkäri arvioi potilaan henkilökohtaista ja sosiaalista toimintakykyä neljällä osa-alueella: sosiaalisesti hyödylliset toiminnot (esim. työ ja opiskelu), henkilökohtaiset ja sosiaaliset suhteet, itsestä huolehtiminen sekä häiritsevä ja aggressiivinen käyttäytyminen. Hoidossa oli tilastollisesti merkitsevä ero Abilify Maintena 400 mg/300 mg -valmisteen eduksi lumelääkkeeseen verrattuna viikolla 10 (+7,1, p < 0,0001, 95 prosentin luottamusväli: 4,1 ̶ 10,1 käytettäessä ANCOVA-mallia (LOCF)).
Turvallisuusprofiili oli Abilify Maintena 400 mg/300 mg -valmisteen tunnetun profiilin mukainen. Siinä oli kuitenkin eroja siihen verrattuna, mitä oli havaittu valmisteen ylläpitokäytössä skitsofrenian hoidossa. Lyhytaikaisessa (12 viikon) tutkimuksessa, joka oli satunnaistettu, kaksoissokkoutettu ja lumelääkekontrolloitu ja jossa potilaita hoidettiin Abilify Maintena 400 mg/300 mg -valmisteella, painonnousua ja akatisiaa esiintyi vähintään kaksinkertaisesti verrattuna niiden esiintymistiheyteen lumelääkkeen käytön yhteydessä. Vähintään 7 prosentin painonnousua lähtötilanteesta viimeiselle seurantakäynnille (viikko 12) esiintyi 21,5 prosentilla Abilify Maintena 400 mg/300 mg -valmisteella hoidettujen ryhmässä. Lumelääkeryhmässä vastaava luku oli 8,5 prosenttia. Yleisin havaittu ekstrapyramidaalioire oli akatisia (Abilify Maintena 400 mg/300 mg -ryhmässä 11,4 %:lla ja lumelääkeryhmässä 3,5 %:lla).
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Abilify Maintena -valmisteen käytöstä skitsofrenian hoidossa kaikissa pediatrisissa potilasryhmissä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Aripipratsolin imeytyminen systeemiseen verenkiertoon Abilify Maintena 400 mg/300 mg -valmisteen annon jälkeen on hidasta ja pitkäkestoista aripipratsolipartikkeleiden vähäisen liukoisuuden vuoksi. Abilify Maintena 400 mg/300 mg -valmisteen keskimääräinen imeytymisen puoliintumisaika on 28 vuorokautta. Lihakseen annetun pitkävaikutteisen lääkemuodon sisältämä aripipratsoli imeytyi täydellisesti verrattuna tavalliseen lihakseen annettavaan (välittömästi vaikuttavaan) lääkemuotoon. Pitkävaikutteisen lääkemuodon annoskorjatut Cmax-arvot olivat noin 5 % lihakseen annettavan tavallisen lääkemuodon Cmax-arvoista.
Kun Abilify Maintena 400 mg/300 mg -valmistetta annettiin kerta-annos olkavarren hartialihakseen tai pakaralihakseen, annon jälkeen imeytymisen määrä (AUC-arvo) oli samanlainen molempien injektiokohtien osalta. Imeytymisnopeus (Cmax-pitoisuus) oli kuitenkin suurempi olkavarren hartialihakseen annon jälkeen.
Useiden lihakseen annettujen annosten jälkeen aripipratsolin pitoisuus plasmassa suureni asteittain enimmäisplasmapitoisuuteen siten, että tmax-ajan mediaani oli seitsemän vuorokautta pakaralihaksen osalta ja neljä vuorokautta olkavarren hartialihaksen osalta.
Vakaan tilan pitoisuus saavutettiin tyypillisen tutkittavan kohdalla neljänteen annokseen mennessä molempien antokohtien osalta.
Kerran kuukaudessa annettujen 300 mg tai 400 mg Abilify Maintena -injektioiden jälkeen havaitaan aripipratsolin ja dehydroaripipratsolin pitoisuuksissa ja kokonaisaltistuksissa annosvasteista pienempiä nousuja.
Jakautuminen
Suun kautta annetulla aripipratsolilla tehtyjen tutkimusten tulosten perusteella aripipratsoli jakautuu laajasti koko kehoon. Havaittu jakautumistilavuus on 4,9 l/kg, mikä viittaa laajaan ekstravaskulaariseen jakautumiseen. Terapeuttisina pitoisuuksina yli 99 % aripipratsolista ja dehydroaripipratsolista sitoutuu seerumin proteiineihin, pääasiassa albumiiniin.
Biotransformaatio
Aripipratsoli metaboloituu suureksi osaksi maksassa, pääasiassa kolmea biotransformaatioreittiä pitkin: dehydrogenaation, hydroksylaation ja N-dealkylaation kautta. In vitro-tutkimusten perusteella CYP3A4- ja CYP2D6-entsyymit vastaavat aripipratsolin dehydrogenaatiosta ja hydroksylaatiosta, ja CYP3A4 katalysoi N-dealkylaation. Aripipratsoli on valmisteen vallitseva osa systeemisessä verenkierrossa. Aktiivisen metaboliitin, dehydro-aripipratsolin osuus plasmassa on noin 29,1 % – 32,5 % aripipratsolin kokonaisaltistuksesta toistuvien Abilify Maintena 400 mg/300 mg -annosten antamisen jälkeen.
Eliminaatio
Keskimääräinen aripipratsolin puoliintumisaika on 29,9 vuorokautta (300 mg:n annoksella) ja 46,5 vuorokautta (400 mg:n annoksella) toistuvien Abilify Maintena 400 mg/300 mg -annosten jälkeen, ja johtuu luultavasti imeytymisnopeuden rajoittamasta kinetiikasta. [14C]-merkityn aripipratsolin peroraalisen kerta-annoksen jälkeen noin 27 % annetusta radioaktiivisesta annoksesta erittyi virtsaan ja noin 60 % ulosteeseen. Alle 1 % aripipratsolista erittyi muuttumattomana virtsaan ja noin 18 % ulosteeseen.
Farmakokinetiikka erityisryhmissä
Hitaat CYP2D6-metaboloijat
Abilify Maintena 400 mg/300 mg -valmisteen populaatiofarmakokineettisen arvioinnin perusteella aripipratsolin kokonaispuhdistuma oli 3,71 l/h normaaleilla CYP2D6-metaboloijilla ja noin 1,88 l/h (suunnilleen 50 % vähäisempi) hitailla CYP2D6-metaboloijilla (ks. annossuositus kohdasta Annostus ja antotapa).
Iäkkäät potilaat
Suun kautta otetun aripipratsolin farmakokinetiikassa ei ollut eroja terveiden iäkkäiden ja nuorempien aikuisten tutkittavien välillä. Iällä ei ollut vaikutusta myöskään Abilify Maintena 400 mg/300 mg -valmistetta käyttäneiden skitsofreniaa sairastavien potilaiden populaatiofarmakokineettisessä analyysissä.
Sukupuoli
Suun kautta otetun aripipratsolin farmakokinetiikassa ei ollut eroja terveiden mies- ja naispuolisten tutkittavien välillä. Samalla lailla sukupuolella ei ollut kliinisesti merkittävää vaikutusta Abilify Maintena 400 mg/300 mg -valmistetta käyttäneiden skitsofreniaa sairastavien potilaiden kliinisistä tutkimuksista tehdyssä populaatiofarmakokineettisessä analyysissä.
Tupakointi
Suun kautta otetun aripipratsolin populaatiofarmakokineettisen analyysin perusteella tupakointi ei vaikuttanut kliinisesti merkittävästi aripipratsolin farmakokinetiikkaan.
Rotu
Aripipratsolin farmakokinetiikassa ei havaittu eri rotujen välisiä eroja populaatiofarmakokineettisessä arvioinnissa.
Munuaisten vajaatoiminta
Kerta-annostutkimuksessa, jossa annettiin aripipratsolia suun kautta, aripipratsolin ja dehydroaripipratsolin farmakokineettisten ominaisuuksien todettiin olevan samanlaiset vaikeaa munuaissairautta sairastavilla potilailla ja terveillä nuorilla tutkittavilla.
Maksan vajaatoiminta
Eriasteista maksakirroosia (Child-Pugh-luokka A, B tai C) sairastavien potilaiden kerta-annostutkimuksessa, jossa aripipratsolia annettiin suun kautta, maksan vajaatoiminnan ei havaittu vaikuttavan merkittävästi aripipratsolin eikä dehydroaripipratsolin farmakokinetiikkaan. Tutkimuksessa oli kuitenkin mukana vain 3 potilasta, joilla oli luokan C maksakirroosi. Tämä on liian pieni määrä, jotta sen perusteella voitaisiin tehdä johtopäätöksiä tämän potilasryhmän metaboloimiskyvystä.
Prekliiniset tiedot turvallisuudesta
Koe-eläimille injektiolla lihakseen annetun aripipratsolin toksikologiset ominaisuudet ovat yleisesti ottaen samanlaisia kuin suun kautta annettuna vastaavilla plasmapitoisuuksilla. Lihakseen annettuun injektioon liittyi kuitenkin injektiokohdan tulehdusreaktio, joka koostui granulomatoottisesta tulehduksesta, pesäkkeestä (kerääntynyt vaikuttava aine), soluinfiltraateista, edeemasta ja, apinoilla, fibroosista. Haittavaikutukset hävisivät vähitellen annostelun keskeyttämisen jälkeen.
Suun kautta annetun aripipratsolin farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, genotoksisuutta, karsinogeenisuutta sekä lisääntymis- ja kehitystoksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Suun kautta annetu aripipratsoli
Suun kautta annetun aripipratsolin toksikologisesti merkitseviä vaikutuksia havaittiin vain annos- tai altistustasoilla, jotka ylittivät ihmisen enimmäisannoksen tai -altistuksen, viitaten siihen, että vaikutukset olivat vähäisiä tai niillä ei ollut kliinistä merkitystä. Tutkimuksissa havaittiin annosriippuvaista lisämunuaiskuoreen kohdistuvia haittavaikutuksia rotilla 2 vuoden kuluttua pitoisuuksilla, jotka olivat 3–10-kertaisia verrattuna odotettavissa oleviin kliinisiin vakaan tilan pitoisuuksiin enimmäisannoksen jälkeen ja lisääntyneitä lisämunuaiskuoren adenoomia ja karsinoomia naarasrotilla pitoisuuksilla, jotka olivat 10-kertaa suurempia kuin kliinisessä altistuksessa odotettavissa olevat pitoisuudet enimmäisannoksen jälkeen vakaassa tilassa. Suurin altistustaso, joka ei aiheuttanut kasvaimia naarasrotille, oli 7-kertainen verrattuna kliiniseen altistukseen käytettäessä suositeltua annostusta.
Lisäksi apinoilla todettiin sappikivitautia, joka johtui aripipratsolin hydroksimetaboliittien sulfaattikonjugaattien saostumisesta sappeen toistuvien oraalisten annosten jälkeen annoksilla 25 mg/kg/vrk −125 mg/kg/vrk. Ko. annokset ovat 16−81-kertaisia verrattuna ihmiselle suositeltuun enimmäisannokseen kehon pinta-alaan suhteutettuna (mg/m2).
Aripipratsolin hydroksimetaboliittien sulfaattikonjugaattien pitoisuudet ihmisen sapessa enimmäisannoksella, 30 mg/vrk, olivat kuitenkin enintään 6 % apinoiden sapessa olevista pitoisuuksista 39 viikkoa kestäneessä tutkimuksessa. Sulfaattikonjugaattien pitoisuudet jäivät selvästi alle in vitro -liukoisuusrajan.
Nuorilla rotilla ja koirilla tehdyissä toistuvan annoksen tutkimuksissa aripipratsolin toksiset vaikutukset olivat vastaavia kuin aikuisilla eläimillä, eikä neurotoksisuutta tai kehitykseen vaikuttavia haittatapahtumia todettu.
Kattavien tavanomaisten genotoksisuuskokeiden tulosten perusteella aripipratsolin ei katsota olevan genotoksinen. Aripipratsoli ei heikentänyt hedelmällisyyttä lisääntymistoksisuustutkimuksissa.
Kehitystoksisuutta, kuten annoksesta riippuvaa luutumisen hidastumista sikiöillä ja mahdollisia teratogeenisia vaikutuksia todettiin rotilla pitoisuuksilla, jotka olivat matalammat kuin ihmisille suositetut terapeuttiset pitoisuudet, ja kaniineilla pitoisuuksilla, jotka olivat 3- ja 11-kertaa suurempia kuin kliiniset pitoisuudet enimmäisannoksen jälkeen vakaassa vaiheessa. Emoon kohdistuvaa toksisuutta esiintyi samoilla annostasoilla, jotka aiheuttivat kehitystoksisuutta.
Farmaseuttiset tiedot
Apuaineet
Kuiva-aine
Karmelloosinatrium
Mannitoli (E421)
Natriumdivetyfosfaattimonohydraatti (E339)
Natriumhydroksidi (E524)
Liuotin
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta
Abilify Maintena 400 mg/300 mg injektiokuiva-aine ja liuotin, depotsuspensiota varten
Suspensio injisoidaan välittömästi käyttökuntoon saattamisen jälkeen, mutta sitä voidaan säilyttää alle 25 °C:ssa maksimissaan 4 tuntia injektiopullossa.
Abilify Maintena 400 mg/300 mg injektiokuiva-aine ja liuotin, depotsuspensiota varten, esitäytetty ruisku
Suspensio injisoidaan välittömästi käyttökuntoon saattamisen jälkeen, mutta sitä voidaan säilyttää alle 25 °C:ssa maksimissaan 2 tuntia ruiskussa.
Käyttökuntoon saattamisen jälkeen
Abilify Maintena 400 mg injektiokuiva-aine ja liuotin, depotsuspensiota varten
Valmisteen on osoitettu säilyvän käytön aikana kemiallisesti ja fysikaalisesti stabiilina 4 tunnin ajan 25 °C:n lämpötilassa. Mikrobiologiselta kannalta valmiste on käytettävä heti, ellei pakkausta avata ja valmistetta saateta käyttökuntoon sellaisella menetelmällä, joka estää mikrobikontaminaation. Jos valmistetta ei käytetä välittömästi, säilytysajat ja käyttöolosuhteet ovat käyttäjän vastuulla. Älä säilytä käyttökuntoon saatettua suspensiota ruiskussa.
Abilify Maintena 400 mg injektiokuiva-aine ja liuotin, depotsuspensiota varten, esitäytetty ruisku
Jos injektiota ei anneta välittömästi käyttökuntoon saattamisen jälkeen, ruiskua voi säilyttää alle 25 °C:n lämpötilassa korkeintaan 2 tunnin ajan.
Säilytys
Ei saa jäätyä.
Abilify Maintena 400 mg injektiokuiva-aine ja liuotin, depotsuspensiota varten, esitäytetty ruisku
Säilytä esitäytettyä ruiskua ulkopakkauksessa valolta suojaamiseksi.
Käyttökuntoon saatetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
ABILIFY MAINTENA injektiokuiva-aine ja liuotin, depotsuspensiota varten
400 mg (L:ei) 1 pakkaus (400 mg + 2 ml) (288,59 €)
ABILIFY MAINTENA injektiokuiva-aine ja liuotin, depotsuspensiota varten, esitäytetty ruisku
400 mg (L:ei) 1 pakkaus (400 mg + 1,6 ml) (288,59 €)
PF-selosteen tieto
Abilify Maintena 400 mg injektiokuiva-aine ja liuotin, depotsuspensiota varten
Injektiopullo
Tyypin I lasinen injektiopullo, jossa on laminoitu kumitulppa ja joka on sinetöity alumiinikapselilla.
Liuos
2 ml Tyypin I lasinen injektiopullo, jossa on laminoitu kumitulppa ja joka on sinetöity alumiinikapselilla.
Kertapakkaus
Kertapakkaus sisältää yhden injektiopullon kuiva-ainetta, 2 ml injektiopullon liuotinta, yhden 3 ml:n luer-lukollisen ruiskun, jossa on esikiinnitettynä 38 mm:n 21 gaugen hypoderminen neulansuojuslaitteella varustettu turvaneula, yhden 3 ml:n luer-lukkopäällä varustetun kertakäyttöruiskun, yhden injektiopullon adapterin ja kolme hypodermista turvaneulaa: yhden 25 mm:n 23 gaugen, yhden 38 mm:n 22 gaugen ja yhden 51 mm:n 21 gaugen neulan.
Monipakkaus
3 kertapakkauksen yhdistelmäpakkaus
Abilify Maintena 400 mg injektiokuiva-aine ja liuotin, depotsuspensiota varten, esitäytetty ruisku
Kirkas lasinen esitäytetty ruisku (tyypin I lasia), jossa on harmaat klorobutyylitulpat (etummainen, keskimmäinen ja takimmainen stopperi), polypropyleenistä valmistettu etuosa, polypropyleenistä valmistettu sormikahva, mäntä ja silikonista valmistettu ruiskun korkki. Etummaisen stopperin ja keskimmäisen stopperin välinen etummainen kammio sisältää kuiva-aineen ja keskimmäisen stopperin ja takimmaisen stopperin välinen takimmainen kammio sisältää liuottimen.
Kertapakkaus
Kertapakkaus sisältää yhden esitäytetyn ruiskun ja kolme hypodermista turvaneulaa: yhden 25 mm:n 23 gaugen, yhden 38 mm:n 22 gaugen ja yhden 51 mm:n 21 gaugen neulan.
Monipakkaus
3 kertapakkauksen yhdistelmäpakkaus
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kuiva-aine: valkoinen tai luonnonvalkoinen
Liuotin: kirkas liuos
Käyttö- ja käsittelyohjeet
Abilify Maintena 400 mg injektiokuiva-aine ja liuotin, depotsuspensiota varten
Ravista injektiopulloa voimakkaasti vähintään 30 sekunnin ajan kunnes suspensio vaikuttaa tasaiselta. Jos injektiota ei anneta välittömästi käyttökuntoon saattamisen jälkeen, ravista injektiopulloa voimakkaasti vähintään 60 sekunnin ajan uudelleen suspendoimiseksi ennen injektion antamista.
Abilify Maintena 400 mg injektiokuiva-aine ja liuotin, depotsuspensiota varten, esitäytetty ruisku
Ravista ruiskua pystysuunnassa voimakkaasti 20 sekunnin ajan, kunnes lääke on tasaisen luonnonvalkoista, ja käytä se heti. Jos injektiota ei anneta välittömästi käyttökuntoon saattamisen jälkeen, ruiskua voidaan säilyttää alle 25 °C:n lämpötilassa korkeintaan 2 tunnin ajan. Jos käyttökuntoon saatettu injektio on ollut valmiina yli 15 minuutin ajan, ravista ruiskua voimakkaasti vähintään 20 sekunnin ajan suspension muodostamiseksi uudelleen ennen injektion antamista.
Anto pakaralihakseen
Valmisteen annossa pakaralihakseen suositellaan käytettäväksi 38 mm:n 22 gaugen hypodermista turvaneulaa. Ylipainoisille potilaille (painoindeksi yli 28 kg/m2) käytetään 51 mm:n 21 gaugen hypodermista turvaneulaa. Pakaralihakseen pistettävät injektiot on annettava vuorotellen eri pakaralihakseen.
Anto olkavarren hartialihakseen
Valmisteen annossa olkavarren hartialihakseen suositellaan käytettäväksi 25 mm:n 23 gaugen hypodermista turvaneulaa. Ylipainoisille potilaille käytetään 38 mm:n 22 gaugen hypodermista turvaneulaa. Olkavarren hartialihakseen pistettävät injektiot on annettava vuorotellen eri olkavarren hartialihakseen.
Kuiva-aine- ja liuotinpullot sekä esitäytetty ruisku ovat kertakäyttöisiä.
Hävitä injektiopullo, adapteri, ruisku, neulat, käyttämätön suspensio ja injektionesteisiin käytettävä vesi asianmukaisella tavalla.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Täydelliset Abilify Maintena 400 mg/300 mg -valmisteen käyttö- ja käsittelyohjeet löytyvät pakkausselosteesta (Ohjeita hoitohenkilökunnalle -kohdasta).
Korvattavuus
ABILIFY MAINTENA injektiokuiva-aine ja liuotin, depotsuspensiota varten
400 mg 1 pakkaus
ABILIFY MAINTENA injektiokuiva-aine ja liuotin, depotsuspensiota varten, esitäytetty ruisku
400 mg 1 pakkaus
- Ylempi erityiskorvaus (100 %). Vaikeat psykoosit ja muut vaikeat mielenterveyden häiriöt (112).
- Peruskorvaus (40 %).
ATC-koodi
N05AX12
Valmisteyhteenvedon muuttamispäivämäärä
25.03.2024
Yhteystiedot
Sveavägen 151
113 46 Stockholm
Sweden
+46 8 545 28660
www.otsuka.se
info@otsuka.se
