CASPOFUNGIN ORION kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos 50 mg, 70 mg
Vaikuttavat aineet ja niiden määrät
Yksi injektiopullo sisältää kaspofungiiniasetaattia, joka vastaa 50 mg:aa tai 70 mg:aa kaspofungiinia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet
Lääkemuoto
Kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos.
Kliiniset tiedot
Käyttöaiheet
- Invasiivisen kandidiaasin hoito aikuis- tai lapsipotilailla.
- Invasiivisen aspergilloosin hoito aikuis- tai lapsipotilailla silloin, kun amfoterisiini B:llä, amfoterisiini B:n lipidimuodoilla ja/tai itrakonatsolilla ei saada hoitovastetta tai kun potilas ei siedä näitä lääkkeitä. Hoitovasteen puuttumisen määritelmänä on infektion eteneminen tai se, ettei paranemista ole nähtävissä, kun aiemman tehokkaan sienilääkehoidon hoitoannoksia on annettu vähintään seitsemän päivän ajan.
- Oletetun sieni-infektion (kuten Candida tai Aspergillus) empiirinen hoito kuumeisilla neutropeenisilla aikuis- tai lapsipotilailla.
Ehto
Invasiivisten sieni-infektioiden hoitoon perehtyneen lääkärin tulisi aloittaa hoito.
Annostus ja antotapa
Kaspofungiinihoidon saa aloittaa vain lääkäri, joka on perehtynyt vakavien sieni-infektioiden hoitoon.
Annostus
Aikuispotilaat
Hoito aloitetaan ensimmäisenä päivänä yhdellä 70 mg:n kyllästysannoksella. Seuraavina päivinä annos on 50 mg/vrk. Yli 80 kg painaville potilaille suositellaan 70 mg:n kyllästysannoksen jälkeen 70 mg kaspofungiinia vuorokaudessa (ks. kohta Farmakokinetiikka). Annostuksen säätäminen ei ole tarpeen sukupuolen eikä rodun perusteella (ks. kohta Farmakokinetiikka).
Pediatriset potilaat (12 kuukauden – 17 vuoden ikäiset)
Annostus lapsipotilaille (ikä 12 kuukautta – 17 vuotta) perustuu kehon pinta-alaan (ks. ohjeet kohdasta Käyttö lapsipotilaiden hoidossa, Mostellerin1 kaava). Kaikissa käyttöaiheissa hoito aloitetaan ensimmäisenä päivänä yhdellä 70 mg/m2 kyllästysannoksella (todellinen annos ei saa olla yli 70 mg). Seuraavina päivinä annos on 50 mg/m2 (todellinen annos ei saa olla yli 70 mg/vrk). Jos annos 50 mg/m2/vrk on hyvin siedetty mutta kliininen vaste ei ole riittävä, vuorokausiannos voidaan nostaa tasolle 70 mg/m2 (todellinen vuorokausiannos ei saa olla yli 70 mg).
1 Mosteller RD: Simplified Calculation of Body Surface Area. N Engl J Med 1987 Oct 22;317(17):1098 (letter)
Kaspofungiinin turvallisuudesta ja tehosta ei ole tehty riittävästi kliinisiä tutkimuksia vastasyntyneiden ja alle 12 kuukauden ikäisten lasten hoidossa. Varovaisuutta on noudatettava hoidettaessa tämän ikäryhmän potilaita. Rajalliset tiedot viittaavat siihen, että vastasyntyneille ja imeväisille (alle 3 kuukauden ikäisille) voidaan harkita kaspofungiiniannostusta 25 mg/m2/vrk ja pikkulapsille (3–11 kuukauden ikäisille) annostusta 50 mg/m2/vrk (ks. kohta Farmakokinetiikka).
Hoidon kesto
Empiirisen hoidon keston on perustuttava potilaan kliiniseen vasteeseen. Hoitoa on jatkettava jopa 72 tunnin ajan neutropenian korjaantumisesta (ANC ≥ 500). Potilaita, joilla todetaan sieni-infektio, on hoidettava vähintään 14 vuorokautta ja hoitoa on jatkettava vähintään seitsemän vuorokautta sen jälkeen, kun sekä neutropenia että kliiniset oireet ovat korjautuneet.
Invasiivisen kandidiaasin hoidon keston on perustuttava potilaan kliiniseen ja mikrobiologiseen vasteeseen. Kun invasiivisen kandidiaasin löydökset ja oireet ovat hävinneet ja sieniviljelyt ovat negatiivisia, voidaan harkita siirtymistä suun kautta annettavaan sienilääkehoitoon. Sienilääkehoitoa on yleensä jatkettava vähintään 14 päivää viimeisen positiivisen viljelyn jälkeen.
Invasiivisen aspergilloosin hoidon kesto on tapauskohtainen ja määräytyy potilaan perustaudin vaikeuden, immunosupression korjaantumisen ja hoidon kliinisen vasteen mukaan. Yleensä hoitoa on jatkettava vähintään seitsemän päivää oireiden hävittyä.
Tiedot yli 4 viikkoa kestävien hoitojaksojen turvallisuudesta ovat vähäiset. Saatavilla olevat tiedot viittaavat kuitenkin siihen, että kaspofungiini on hyvin siedetty myös pidempikestoisessa hoidossa (jopa 162 vuorokautta aikuispotilailla ja 87 vuorokautta lapsipotilailla).
Erityisryhmät
Iäkkäät potilaat
Iäkkäillä potilailla (vähintään 65‑vuotiailla) pitoisuuskäyrän alle jäävä pinta-ala (AUC-arvo) on suurentunut noin 30 %. Annostuksen muuttaminen ei kuitenkaan ole tarpeen. Yli 65-vuotiaiden hoidosta on rajoitetusti hoitokokemusta (ks. kohta Farmakokinetiikka).
Munuaisten vajaatoiminta
Annostusta ei tarvitse muuttaa munuaisten vajaatoiminnan takia (ks. kohta Farmakokinetiikka).
Maksan vajaatoiminta
Aikuispotilaiden annostusta ei tarvitse muuttaa lievässä maksan vajaatoiminnassa (Child-Pugh-pistemäärä 5–6). Aikuispotilaille, joilla on keskivaikea maksan vajaatoiminta (Child-Pugh-pistemäärä 7–9), suositeltu kaspofungiiniannostus on farmakokineettisten tietojen perusteella 35 mg/vrk. Hoito tulee aloittaa 70 mg:n kyllästysannoksella ensimmäisenä päivänä. Kliinistä kokemusta ei ole valmisteen antamisesta aikuispotilaille, joilla on vaikea maksan vajaatoiminta (Child-Pugh-pistemäärä yli 9), eikä minkään asteista maksan vajaatoimintaa sairastavista lapsipotilaista (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Yhteiskäyttö metaboliaentsyymien induktoreiden kanssa
Alustavien tutkimustietojen perusteella 70 mg:n kyllästysannoksen jälkeen on harkittava kaspofungiinin vuorokausiannoksen suurentamista 70 mg:aan, silloin kun kaspofungiinia annetaan aikuispotilaille samanaikaisesti tiettyjen metaboliaentsyymien induktoreiden kanssa (ks. kohta Yhteisvaikutukset). Jos kaspofungiinia annetaan (12 kuukauden – 17 vuoden ikäisille) lapsipotilaille näiden samojen metaboliaentsyymien induktoreiden kanssa (ks. kohta Yhteisvaikutukset), on harkittava kaspofungiiniannostusta 70 mg/m2/vrk (todellinen vuorokausiannos ei saa olla yli 70 mg).
Antotapa
Käyttökuntoon saatettu ja laimennettu liuos annetaan laskimoon hitaana infuusiona, noin yhden tunnin aikana. Katso kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen saattamisesta käyttökuntoon.
Valmiste on saatavana sekä 70 mg:n että 50 mg:n injektiopulloissa.
Kaspofungiini annetaan yhtenä infuusiona kerran vuorokaudessa.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Anafylaksiaa on raportoitu kaspofungiinin antamisen aikana. Jos sitä ilmenee, kaspofungiinin anto on lopetettava ja annettava asianmukaista hoitoa. Mahdollisesti histamiinivälitteisiä haittavaikutuksia, mukaan lukien ihottumaa, kasvojen turvotusta, angioedeemaa, kutinaa, kuumotuksen tunnetta tai keuhkoputkien supistumista, on raportoitu, ja ne voivat vaatia kaspofungiinihoidon lopettamisen ja/tai tarkoituksenmukaisen hoidon aloittamisen.
Jotkut tiedot viittaavat siihen, että kaspofungiini ei tehoa harvinaisimpiin ei-Candida sieniin jaei-Aspergillus homesieniin. Kaspofungiinin tehoa näihin sienipatogeeneihin ei ole vahvistettu.
Kaspofungiinin käyttöä samanaikaisesti siklosporiinin kanssa on arvioitu terveillä aikuisilla ja aikuispotilailla. Joillakin terveillä aikuisilla, jotka saivat kaksi 3 mg:n/kg siklosporiiniannosta yhdessä kaspofungiinin kanssa, alaniiniaminotransferaasin (ALAT) ja aspartaattiaminotransferaasin (ASAT) arvot suurenivat ohimenevästi enintään kolminkertaisiksi normaaliarvojen ylärajaan verrattuina ja korjaantuivat, kun hoito lopetettiin. Vakavia maksahaittoja ei todettu retrospektiivisessä tutkimuksessa, jossa 40 potilasta sai markkinoilla olevaa kaspofungiinia ja siklosporiinia 1–290 päivää (mediaani 17,5 päivää). Nämä tiedot viittaavat siihen, että kaspofungiinia voidaan käyttää siklosporiinia saavalle potilaalle, kun hoidon mahdollinen hyöty on suurempi kuin siitä koituva mahdollinen riski. Maksaentsyymien tarkkaa seurantaa on harkittava, jos potilas saa samanaikaisesti kaspofungiinia ja siklosporiinia.
AUC-arvo suurenee aikuispotilailla lievässä maksan vajaatoiminnassa noin 20 % ja keskivaikeassa maksan vajaatoiminnassa noin 75 %. Keskivaikeassa maksan vajaatoiminnassa suositellaan aikuispotilaiden vuorokausiannoksen pienentämistä 35 mg:aan. Vaikeaa maksan vajaatoimintaa sairastavien aikuispotilaiden tai minkä tahansa asteista maksan vajaatoimintaa sairastavien pediatristen potilaiden hoidosta ei ole kliinistä kokemusta. Lääkealtistuksen odotetaan kuitenkin olevan suurempi kuin keskivaikeassa maksan vajaatoiminnassa, ja varovaisuutta on noudatettava kaspofungiinin käytössä tällaisille potilaille (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka).
Kaspofungiinia saaneilla terveillä tutkittavilla ja aikuis- ja pediatrisilla potilailla on todettu poikkeamia maksan toimintaa mittaavissa laboratoriokokeissa. Joillakin aikuis- ja pediatrisilla potilailla, joilla oli jokin vakava lääketieteellinen perussairaus ja jotka saivat kaspofungiinin lisäksi useita muita lääkkeitä samanaikaisesti, on raportoitu kliinisesti merkittäviä maksan toimintahäiriöitä, maksatulehdusta sekä maksan vajaatoimintaa. Syy-yhteyttä kaspofungiiniin ei ole osoitettu. Jos maksan toimintakokeissa ilmenee poikkeamia kaspofungiinihoidon aikana, on potilasta seurattava maksan toiminnan heikkenemisen varalta ja kaspofungiinihoidon jatkamisen hyöty–haitta-suhde on arvioitava uudelleen.
Stevens-Johnsonin oireyhtymää (SJS) ja toksista epidermaalista nekrolyysiä (TEN) on raportoitu kaspofungiinin markkinoille tulon jälkeen. Varovaisuutta on noudatettava potilailla, joilla on ollut aiemmin allergisia ihoreaktioita (ks. kohta Haittavaikutukset).
Apuaineet
Tämä lääkevalmiste sisältää alle 1 mmol (23 mg) natriumia per injektiopullo eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
In vitro ‑tutkimusten mukaan kaspofungiini ei inhiboi mitään sytokromi P450 ‑järjestelmän entsyymiä. Kliinisissä tutkimuksissa kaspofungiini ei indusoinut muiden aineiden CYP3A4‑välitteistä metaboliaa. Kaspofungiini ei ole P‑glykoproteiinin substraatti, ja se on heikko sytokromi P450 ‑entsyymien substraatti. Kaspofungiinilla on kuitenkin osoitettu olevan yhteisvaikutuksia muiden lääkevalmisteiden kanssa farmakologisissa ja kliinisissä tutkimuksissa (ks. seuraavassa esitetyt tiedot).
Kahdessa terveille aikuisille tehdyssä kliinisessä tutkimuksessa siklosporiini A (annostus 4 mg/kg x 1 tai 3 mg/kg x 2 12 tunnin välein) suurensi kaspofungiinin AUC-arvoa noin 35 %. AUC-arvojen suureneminen johtuu todennäköisesti kaspofungiinin vähentyneestä siirtymisestä maksaan. Kaspofungiini ei suurentanut siklosporiinin pitoisuutta plasmassa. Maksan ALAT- ja ASAT-arvot suurenivat ohimenevästi enintään kolminkertaisiksi normaalin ylärajaan verrattuina, kun kaspofungiinia annettiin samanaikaisesti siklosporiinin kanssa, ja arvot korjaantuivat, kun näiden lääkevalmisteiden käyttö lopetettiin. Vakavia maksahaittoja ei todettu retrospektiivisessä tutkimuksessa, jossa 40 potilasta sai markkinoilla olevaa kaspofungiinia ja siklosporiinia 1–290 vuorokauden ajan (keskimäärin 17,5 vuorokautta), (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Maksaentsyymien tarkkaa seurantaa on harkittava, jos potilas saa samanaikaisesti kaspofungiinia ja siklosporiinia.
Kaspofungiini pienensi takrolimuusin minimipitoisuuksia terveillä vapaaehtoisilla aikuisilla 26 %. Jos potilas saa näitä lääkeaineita samanaikaisesti, on ehdottomasti rutiininomaisesti seurattava veren takrolimuusipitoisuutta ja tarpeen mukaan muutettava takrolimuusin annostusta.
Terveille vapaaehtoisille aikuisille tehdyt kliiniset tutkimukset osoittavat, että itrakonatsoli, amfoterisiini B, mykofenolaatti, nelfinaviiri tai takrolimuusi eivät muuta kliinisesti merkityksellisesti kaspofungiinin farmakokinetiikkaa. Kaspofungiini ei vaikuttanut amfoterisiini B:n, itrakonatsolin, rifampisiinin eikä mykofenolaattimofetiilin farmakokinetiikkaan. Vaikka turvallisuustietoja on rajallisesti, vaikuttaa siltä, että erityiset varotoimet eivät ole tarpeen, kun kaspofungiinin kanssa käytetään samanaikaisesti amfoterisiini B:tä, itrakonatsolia, nelfinaviiria tai mykofenolaattimofetiilia.
Kun rifampisiinin ja kaspofungiinin antaminen terveille aikuisille aloitettiin samanaikaisesti, rifampisiini suurensi yhteisannon ensimmäisenä päivänä kaspofungiinin AUC-arvoa 60 % ja Ctrough‑arvoa 170 %. Annostelua jatkettaessa vuorokauden alin kaspofungiinipitoisuus väheni asteittain. Kahden viikon annostelun jälkeen rifampisiinilla oli enää vähäinen vaikutus kaspofungiinin AUC-arvoon, kun taas vuorokauden alimmat kaspofungiinipitoisuudet olivat 30 % alemmat kuin pelkkää kaspofungiinia saaneilla aikuisilla tutkittavilla. Tällainen interaktio saattaa johtua kuljetusproteiinien inhiboitumisesta alkuvaiheessa ja niiden myöhemmästä indusoitumisesta. Samankaltainen vaikutus on oletettavissa myös muilla lääkevalmisteilla, jotka indusoivat metaboliaentsyymeitä. Rajalliset tiedot populaatiofarmakokineettisistä tutkimuksista osoittavat, että kaspofungiinin samanaikainen käyttö induktorien eli efavirentsin, nevirapiinin, rifampisiinin, deksametasonin, fenytoiinin tai karbamatsepiinin kanssa saattaa pienentää kaspofungiinin AUC-arvoa. Jos kaspofungiinia annetaan samanaikaisesti metaboliaentsyymien induktoreiden kanssa, on harkittava aikuispotilaan kaspofungiinin vuorokausiannoksen suurentamista 70 mg:aan 70 mg:n kyllästysannoksen jälkeen (ks. kohta Annostus ja antotapa).
Kaikissa edellä kuvatuissa aikuispotilaille tehdyissä yhteisvaikutustutkimuksissa kaspofungiinia annettiin 50 tai 70 mg/vrk. Suuremmilla kaspofungiiniannoksilla ei ole tehty varsinaisia yhteisvaikutustutkimuksia muiden lääkevalmisteiden kanssa.
Pediatristen potilaiden farmakokineettisten tietojen regressioanalyysit viittaavat siihen, että samanaikaisesti kaspofungiinin kanssa annettu deksametasoni voi pienentää vuorokauden alinta kaspofungiinipitoisuutta kliinisesti merkittävästi. Tämä havainto saattaa olla osoitus siitä, että induktorit pienentävät kaspofungiinin pitoisuutta pediatrisilla potilailla samankaltaisesti kuin aikuispotilailla. Jos kaspofungiinia annetaan pediatrisille potilaille (12 kuukauden – 17 vuoden ikäisille) yhdessä puhdistuman induktoreiden, kuten rifampisiinin, efavirentsin, nevirapiinin, fenytoiinin, deksametasonin tai karbamatsepiinin kanssa, on harkittava kaspofungiiniannosta 70 mg/m2/vrk (todellinen vuorokausiannos ei saa olla yli 70 mg).
Raskaus ja imetys
Raskaus
Ei ole olemassa tietoja tai on vain vähän tietoja kaspofungiinin käytöstä raskaana oleville naisille. Kaspofungiinia ei pidä käyttää raskauden aikana, ellei se ole selvästi välttämätöntä. Eläinkokeissa on havaittu kehitystoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Eläintutkimuksissa kaspofungiinin on osoitettu läpäisevän istukan.
Imetys
Ei tiedetä, erittyykö kaspofungiini ihmisen rintamaitoon. Olemassa olevat farmakodynaamiset/toksikologiset tiedot koe-eläimistä ovat osoittaneet kaspofungiinin erittyvän rintamaitoon. Kaspofungiinihoitoa saavien naisten ei pidä imettää.
Hedelmällisyys
Uros- ja naarasrotilla tehdyissä tutkimuksissa kaspofungiinilla ei ollut vaikutusta hedelmällisyyteen (ks. kohta Prekliiniset tiedot turvallisuudesta). Kaspofungiinista ei ole olemassa kliinisiä tietoja, joiden perusteella voitaisiin arvioida sen vaikutusta hedelmällisyyteen.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Tutkimuksia valmisteen vaikutuksesta ajokykyyn tai koneidenkäyttökykyyn ei ole tehty.
Haittavaikutukset
Yliherkkyysreaktioita (anafylaksiaa ja mahdollisesti histamiinivälitteisiä haittavaikutuksia) on raportoitu (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Potilailla, joilla oli invasiivinen aspergilloosi, todettiin myös keuhkoedeemaa, aikuisen hengitysvaikeusoireyhtymää (ARDS) ja keuhkovarjostumia.
Aikuispotilaat
Kliinisissä tutkimuksissa 1 865 aikuista sai kerta-annoksen tai toistuvia annoksia kaspofungiinia: 564:lla oli kuumeinen neutropenia (empiirisen hoidon tutkimus), 382:lla invasiivinen kandidiaasi, 228:lla invasiivinen aspergilloosi, 297:llä paikallinen Candida-infektio, ja 394 oli osallistunut vaiheen I tutkimuksiin. Empiirisen hoidon tutkimukseen osallistuneet potilaat olivat saaneet kemoterapiaa syöpään tai heille oli tehty hematopoieettisten kantasolujen siirto (mukaan lukien 39 allogeenista siirtoa). Tutkimuksissa, joihin osallistuneilla potilailla oli diagnosoitu jokin Candida-infektio, suurimmalla osalla invasiivista Candida-infektiota sairastaneista oli jokin vakava perussairaus (esim. hematologinen tai muu maligniteetti, hiljattain tehty suuri leikkaus, HIV), joka vaati useiden lääkkeiden samanaikaista käyttöä. Monilla ei-vertailevaan Aspergillus-tutkimukseen osallistuneilla potilailla oli jokin sieni-infektiolle altistava vakava lääketieteellinen tila (esim. luuydinsiirre tai perifeerisen veren kantasolusiirre, hematologinen maligniteetti, kiinteä kasvain tai elinsiirre), joka vaati useiden lääkkeiden samanaikaista käyttöä.
Laskimotulehdus oli yleisesti ilmoitettu paikallinen pistoskohdan haittavaikutus kaikissa potilasryhmissä. Muita paikallisia reaktioita olivat punoitus, kipu/aristus, kutina, vuoto ja kirvely.
Kaikkien kaspofungiinia saaneiden aikuisten (yhteensä 1 780 aikuista) keskuudessa todetut kliiniset ja laboratoriotuloksissa ilmenneet poikkeavuudet olivat tyypillisesti lieviä ja johtivat harvoin hoidon keskeyttämiseen.
Seuraavia haittavaikutuksia on raportoitu:
MedDRA-järjestelmän elinluokka | Yleinen ≥ 1/100, < 1/10 | Melko harvinainen ≥ 1/1 000, < 1/100 | Tuntematon (koska saatavissa oleva tieto ei riitä arviointiin) |
Veri ja imukudos | Pienentynyt hemoglobiiniarvo, pienentynyt hematokriittiarvo, pienentynyt valkosolumäärä | Anemia, trombosytopenia, hyytymishäiriö, leukopenia, suurentunut eosinofiilimäärä, pienentynyt trombosyyttimäärä, suurentunut trombosyyttimäärä, pienentynyt lymfosyyttimäärä, suurentunut valkosolumäärä, pienentynyt neutrofiilimäärä | |
Aineenvaihdunta ja ravitsemus | Hypokalemia | Nesteylimäärä, hypomagnesemia, ruokahaluttomuus, elektrolyyttihäiriö, hyperglykemia, hypokalsemia, metabolinen asidoosi | |
Psyykkiset häiriöt | Ahdistuneisuus, ajan ja paikan tajun hämärtyminen, unettomuus | ||
Hermosto | Päänsärky | Heitehuimaus, makuhäiriö, tuntoharhat, uneliaisuus, vapina, heikentynyt tuntoaisti | |
Silmät | Silmänvalkuaisten keltaisuus, näön hämärtyminen, silmäluomien turvotus, lisääntynyt kyynelvuoto | ||
Sydän | Sydämentykytys, takykardia, rytmihäiriöt, eteisvärinä, kongestiivinen sydämen vajaatoiminta | ||
Verisuonisto | Laskimotulehdus | Tromboflebiitti, punehtuminen, kuumat aallot, hypertensio, hypotensio | |
Hengityselimet, rintakehä ja välikarsina | Hengenahdistus | Nenän tukkoisuus, nielun ja kurkunpään kipu, takypnea, bronkospasmi, yskä, yöllinen hengenahdistuskohtaus, hypoksia, rahinat, hengityksen vinkuna | |
Ruoansulatuselimistö | Pahoinvointi, ripuli, oksentelu | Vatsakipu, ylävatsakipu, suun kuivuminen, ruoansulatushäiriöt, mahavaivat, vatsan pingotus, askites, ummetus, nielemisvaikeudet, ilmavaivat | |
Maksa ja sappi | Suurentuneet maksa-arvot (alaniiniaminotransferaasi, aspartaattiaminotransferaasi, veren alkalinen fosfataasi, konjugoitunut bilirubiini, veren bilirubiini) | Kolestaasi, hepatomegalia, hyperbilirubinemia, keltaisuus, maksan toimintahäiriö, maksatoksisuus, maksasairaus, suurentunut gammlglutamyylitrans-feraasiarvo | |
Iho ja ihonalainen kudos | Ihottuma, kutina, punoitus, runsas hikoilu | Erythema multiforme, makulaarinen ihottuma, makulopapulaarinen ihottuma, kutiava ihottuma, nokkosihottuma, allerginen ihottuma, yleistynyt kutina, punoittava ihottuma, yleistynyt ihottuma, morbilliforminen ihottuma, iholeesio | Toksinen epidermaalinen nekrolyysi ja Stevens-Johnsonin oireyhtymä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) |
Luusto, lihakset ja sidekudos | Nivelkipu | Selkäkipu, raajakipu, luukipu, lihasheikkous, lihaskipu | |
Munuaiset ja virtsatiet | Munuaisten vajaatoiminta, akuutti munuaisten vajaatoiminta | ||
Yleisoireet ja antopaikassa todettavat haitat | Kuume, vilunväristykset, infuusiokohdan kutina | Kipu, katetrointikohdan kipu, väsymys, kylmän tunne, kuuman tunne, infuusiokohdan punoitus, infuusiokohdan kovettuma, infuusiokohdan kipu, infuusiokohdan turvotus, pistoskohdan laskimotulehdus, perifeerinen edeema, aristus, epämiellyttävä tunne rintakehässä, rintakipu, kasvojen turvotus, ruumiinlämmön muuttumisen tunne, kovettuma, infuusiokohdan ekstravasaatio, infuusiokohdan ärsytys, infuusiokohdan laskimotulehdus, infuusiokohdan ihottuma, infuusiokohdan nokkosihottuma, pistoskohdan punoitus, pistoskohdan edeema, pistoskohdan kipu, pistoskohdan turvotus, yleinen huonovointisuus, turvotus | |
Tutkimukset | Pienentynyt veren kaliumpitoisuus, pienentynyt veren albumiinipitoisuus | Suurentunut veren kreatiniinipitoisuus, punasoluja virtsassa, pienentynyt kokonaisproteiinimäärä, proteiinia virtsassa, pidentynyt protrombiiniaika, lyhentynyt protrombiiniaika, pienentynyt veren natriumpitoisuus, suurentunut veren natriumpitoisuus, pienentynyt veren kalsiumpitoisuus, suurentunut veren kalsiumpitoisuus, pienentynyt veren kloridipitoisuus, suurentunut veren glukoosipitoisuus, pienentynyt veren magnesiumpitoisuus, pienentynyt veren fosforipitoisuus, suurentunut veren fosforipitoisuus, suurentunut veren ureapitoisuus, pidentynyt aktivoitunut osittainen tromboplastiiniaika (APTT), pienentynyt veren bikarbonaattipitoisuus, suurentunut veren kloridipitoisuus, suurentunut veren kaliumpitoisuus, kohonnut verenpaine, pienentynyt veren virtsahappoarvo, verta virtsassa, poikkeavat hengitysäänet, pienentynyt hiilidioksidiarvo, immunosuppressiivisen lääkkeen suurentunut pitoisuus, suurentunut INR-arvo, lieriöitä virtsassa, valkosoluja virtsassa ja suurentunut virtsan pH-arvo |
Kaspofungiinia on tutkittu myös 150 mg:n vuorokausiannoksina (enintään 51 päivän ajan) 100 aikuispotilaalla (ks. kohta Farmakodynamiikka). Tutkimuksessa verrattiin kaspofungiiniannoksia 50 mg/vrk (1. päivänä annetun 70 mg:n kyllästysannoksen jälkeen) ja 150 mg/vrk invasiivisen kandidiaasin hoidossa. Tässä potilasryhmässä kaspofungiinin turvallisuus vaikutti olevan suurempaa annosta saaneilla potilailla yleisesti ottaen samankaltainen kuin 50 mg:n vuorokausiannoksia saaneilla potilailla. Vakavia lääkkeeseen liittyneitä haittavaikutuksia tai kaspofungiinihoidon keskeyttämisiä lääkkeeseen liittyneiden haittavaikutusten vuoksi ilmeni molemmissa hoitoryhmissä yhtä suurella osalla potilaista.
Pediatriset potilaat
Tiedot 5 kliinisestä tutkimuksesta, joihin osallistui 171 pediatrista potilasta, viittaavat siihen, ettei kliinisten haittavaikutusten esiintymistiheys (26,3 %; 95 %: luottamusväli (CI) −19,9; 33,6) ollut suurempi kuin kaspofungiinihoitoa saaneilla aikuisilla (43,1 %; 95 %:n luottamusväli (CI) −40,0; 46,2). Pediatristen potilaiden haittavaikutusprofiili on kuitenkin todennäköisesti erilainen kuin aikuispotilaiden. Kaspofungiinilla hoidetuilla pediatrisilla potilailla yleisimmin raportoidut lääkkeeseen liittyneet kliiniset haittavaikutukset olivat kuume (11,7 %), ihottuma (4,7 %) ja päänsärky (2,9 %).
Seuraavia haittavaikutuksia on raportoitu:
MedDRA-järjestelmän elinluokka | Hyvin yleinen≥ 1/10 | Yleinen ≥ 1/100, < 1/10 |
Veri ja imukudos | Suurentunut eosinofiilimäärä | |
Hermosto | Päänsärky | |
Sydän | Takykardia | |
Verisuonisto | Punehtuminen, hypotensio | |
Maksa ja sappi | Suurentuneet maksaentsyymiarvot (ASAT, ALAT) | |
Iho ja ihonalainen kudos | Ihottuma, kutina | |
Yleisoireet ja antopaikassa todettavat haitat | Kuume | Vilunväristykset, katetrointikohdan kipu |
Tutkimukset | Pienentynyt kaliumpitoisuus, hypomagnesemia, suurentunut verensokeripitoisuus, pienentynyt fosforipitoisuus ja suurentunut fosforipitoisuus |
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Kaspofungiinin tahatonta antoa aina annokseen 400 mg/vrk asti on raportoitu. Näissä tapauksissa ei ilmennyt kliinisesti merkittäviä haittavaikutuksia. Kaspofungiini ei poistu verestä dialyysissä.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Systeemiset sienilääkkeet, ATC-koodi: J02AX04
Vaikutusmekanismi
Kaspofungiiniasetaatti on puolisynteettinen lipopeptidiyhdiste (ekinokandiini), joka on syntetisoitu Glarea lozoyensis ‑sienen fermentaatiotuotteesta. Kaspofungiiniasetaatti estää beeta-(1,3)‑D‑glukaanin synteesiä. Beeta-(1,3‑D)‑glukaani on monien rihmasienten ja hiivojen soluseinämän välttämätön aineosa. Beeta-(1,3)‑D‑glukaania ei esiinny nisäkkäiden soluissa.
Kaspofungiinilla on osoitettu olevan fungisidinen vaikutus Candida-hiivasieniin. In vitro‑ ja in vivo ‑tutkimukset osoittavat, että Aspergilluksen altistuminen kaspofungiinille hajottaa ja tuhoaa sienirihmojen kärkiosat ja haarautumiskohdat eli solun kasvu- ja jakautumiskohdat.
Farmakodynaamiset vaikutukset
Kaspofungiini tehoaa in vitroAspergillus-lajeihin (Aspergillus fumigatus [N = 75], Aspergillus flavus [N = 111], Aspergillus niger [N = 31], Aspergillus nidulans [N = 8], Aspergillus terreus [N = 52] ja Aspergillus candidus [N = 3]). Kaspofungiini tehoaa in vitro myös Candida-lajeihin (Candida albicans [N = 1 032], Candida dubliniensis [N = 100], Candida glabrata [N = 151], Candida guilliermondii [N = 67], Candida kefyr [N = 62], Candida krusei [N = 147], Candida lipolytica [N = 20], Candida lusitaniae [N = 80], Candida parapsilosis [N = 215], Candida rugosa [N = 1] ja Candida tropicalis [N = 258]), mukaan lukien moniresistentit siirtomutaatioisolaatit ja isolaatit, joilla on hankinnainen tai sisäsyntyinen resistenssi flukonatsolia, amfoterisiini B:tä ja 5‑flusytosiinia vastaan. Herkkyysmääritys tehtiin CLSI:n (Clinical and Laboratory Standards Institute, aiemmin National Committee for Clinical Laboratory Standards [NCCLS]) modifioidulla M38‑A2-menetelmällä (Aspergillus-lajit) ja modifioidulla M27‑A3‑menetelmällä (Candida-lajit).
EUCAST on standardoinut hiivasienten herkkyysmääritysmenetelmiä.
Kaspofungiinille ei ole vielä määritetty EUCAST-raja-arvoja, koska kaspofungiinin MIC-arvoissa on ollut huomattavia vaihteluita eri laboratorioiden välillä. Raja-arvojen käytön sijasta Candida-isolaatit, jotka ovat herkkiä sekä anidulafungiinille että mikafungiinille, on katsottava herkiksi myös kaspofungiinille. Vastaavasti jos C. parapsilosis-isolaattien herkkyys anidulafungiinille ja mikafungiinille on alentunut, myös niiden herkkyyden kaspofungiinille voidaan katsoa olevan alentunut.
Resistenssimekanismi
Pienellä potilasjoukolla on tunnistettu hoidon aikana Candida-isolaatteja, joiden herkkyys kaspofungiinille on heikentynyt (kaspofungiinin MIC-arvoksi on raportoitu > 2 mg/l [MIC-arvo suurentunut 4–30‑kertaisesti] käytettäessä CLSI:n hyväksymiä standardoituja MIC-määritysmenetelmiä). Todettu resistenssimekanismi on FKS1 ja/tai FKS2 (C. glabrata) -geenimutaatio. Näihin tapauksiin on yhdistetty huono kliininen hoitovaste.
Aspergillus-lajeilla on todettu in vitro kaspofungiiniresistenssin kehittymistä. Kliininen kokemus kaspofungiinista on vähäistä, mutta kaspofungiiniresistenssiä on havaittu invasiivista aspergilloosia sairastaneilla potilailla. Resistenssimekanismia ei ole vahvistettu. Kaspofungiiniresistenssin ilmaantuvuus kliinisissä Aspergillus-isolaateissa on harvinainen. Kaspofungiiniresistenssiä Candida-lajeissa on havaittu, mutta sen ilmaantuvuus voi vaihdella lajien tai alueen mukaan.
Kliininen teho ja turvallisuus
Aikuispotilaiden invasiivinen kandidiaasi: Ensimmäisessä tutkimuksessa verrattiin kaspofungiinia ja amfoterisiini B:tä invasiivisen kandidiaasin hoidossa 239 potilaalla, joista 24:llä oli neutropenia. Yleisimmät diagnoosit olivat sepsis (kandidemia) (77 %, n = 186) ja Candida-peritoniitti (8 %, n = 19); tähän tutkimukseen ei otettu mukaan potilaita, joilla oli Candida-endokardiitti, -osteomyeliitti tai -meningiitti. Kaspofungiinia annettiin ensin 70 mg:n kyllästysannos ja sitten 50 mg kerran vuorokaudessa. Amfoterisiini B:tä annettiin 0,6–0,7 mg/kg/vrk potilaille, joilla ei ollut neutropeniaa, ja 0,7–1,0 mg/kg/vrk potilaille, joilla oli neutropenia. Suonensisäisen lääkityksen kesto oli keskimäärin 11,9 vuorokautta (vaihteluväli 1–28 vuorokautta). Suotuisaan vasteeseen vaadittiin sekä oireiden häviäminen että Candida-infektion paraneminen mikrobiologisten määritysten perusteella. Laskimoon annetun tutkimushoidon lopussa tehtiin vasteen primaarinen tehokkuusanalyysi (MITT-analyysi) 224:lle potilaalle: suotuisan hoitovasteen invasiivisessa kandidiaasissa saaneiden osuudet olivat toisiinsa verrattavat kaspofungiiniryhmässä (73 % [80/109]) ja amfoterisiini B ‑ryhmässä (62 % [71/115]) [ero 12,7 % (95,6 % CI: −0,7; 26,0)]. Laskimoon annetun tutkimushoidon lopussa kandidemiapotilaille tehdyssä primaarisessa tehokkuusanalyysissa (MITT-analyysi) suotuisan hoitovasteen saavuttaneiden osuudet olivat toisiinsa verrattavat kaspofungiiniryhmässä (72 % [66/92]) ja amfoterisiini B ‑ryhmässä (63 % [59/94]), [ero 10,0 % (95,0 % CI: −4,5; 24,5)]. Tiedot potilaista, joilla infektio oli muualla kuin veressä, olivat suppeampia. Neutropeenisista potilaista suotuisan vasteen saavutti 7/14 (50 %) kaspofungiiniryhmässä ja 4/10 (40 %) amfoterisiini B ‑ryhmässä. Empiiristä hoitoa koskeneen tutkimuksen tulokset tukevat näitä tietoja.
Toisessa tutkimuksessa invasiivista kandidiaasia sairastaneet potilaat saivat kaspofungiinia joko 50 mg/vrk (1. päivänä annetun 70 mg:n kyllästysannoksen jälkeen) tai 150 mg/vrk (ks. kohta Haittavaikutukset). Tässä tutkimuksessa kaspofungiiniannoksen anto kesti 2 tuntia (tavanomaisen 1 tunnin infuusion sijasta). Tutkimuksesta poissuljettiin potilaat, joilla epäiltiin Candida-endokardiittia, ‑meningiittiä tai ‑osteomyeliittiä. Koska kyseessä oli ensisijaishoitoa koskenut tutkimus, mukaan ei otettu myöskään potilaita, joihin aiemmat sienilääkkeet eivät olleet tehonneet. Myös neutropeenisia potilaita otettiin tähän tutkimukseen vain vähän (8,0 %). Tämän tutkimuksen toissijainen päätetapahtuma oli teho. Tehoa mittaavaan analyysiin otettiin mukaan potilaat, jotka täyttivät tutkimuksen sisäänottokriteerit ja saivat vähintään yhden kaspofungiiniannoksen tutkimushoitona. Kaspofungiinihoidon päättyessä suotuisan vasteen saavuttaneiden kokonaisosuus oli molemmissa hoitoryhmissä samaa luokkaa: 72 % (73/102) 50 mg:n kaspofungiiniryhmässä ja 78 % (74/95) 150 mg:n kaspofungiiniryhmässä (ero 6,3 % [95 % CI: −5,9; 18,4]).
Aikuispotilaiden invasiivinen aspergilloosi: Avoimeen ei-vertailevaan tutkimukseen, jossa arvioitiin kaspofungiinin turvallisuutta, siedettävyyttä ja tehoa, otettiin 69 invasiivista aspergilloosia sairastanutta aikuispotilasta (ikä 18–80 vuotta). Vaatimuksena oli, että joko hoitovastetta ei ollut saavutettu (tauti edennyt tai tila ei kohentunut muilla vähintään 7 päivän ajan annetuilla sienilääkehoidoilla) (84 % tutkimukseen otetuista potilaista) tai potilas ei ollut sietänyt muita tavanomaisia sienilääkehoitoja (16 % tutkimukseen otetuista potilaista). Useimmilla potilailla oli jokin perussairaus (hematologinen syöpä [N = 24], allogeeninen luuydinsiirre tai kantasolusiirre [N = 18], elinsiirre [N = 8], kiinteä kasvain [N = 3] tai jokin muu sairaus [N = 10]). Invasiivisen aspergilloosin diagnosoinnissa ja hoitovasteen määrittämisessä käytettiin Mycoses Study Group -työryhmän kriteereihin perustuvia tiukkoja määritelmiä; suotuisaan vasteeseen vaadittiin tilan kliinisesti merkitsevä paraneminen sekä röntgenkuvien että merkkien ja oireiden perusteella. Hoito kesti keskimäärin 33,7 päivää (vaihteluväli 1–162 päivää). Riippumattoman asiantuntijaryhmän arvion mukaan suotuisa hoitovaste saavutettiin 41 %:lla (26/63) ainakin yhden kaspofungiiniannoksen saaneista potilaista. Yli 7 päivän ajan kaspofungiinihoitoa saaneista potilaista suotuisa vaste saavutettiin 50 %:lla (26/52). Suotuisa vaste saavutettiin 36 %:lla (19/53) niistä potilaista, joilla aiemmat hoidot eivät olleet tuottaneet hoitovastetta, ja 70 %:lla (7/10) niistä potilaista, jotka eivät olleet sietäneet aiempia hoitoja. Vaikka tutkimukseen vaikeahoitoisina otetut 5 potilasta olivat aiemmin saaneet sienilääkehoitoa pienemmillä annoksilla kuin mitä invasiivisessa aspergilloosissa usein käytetään, suotuisa vaste kaspofungiinihoitoon oli näillä potilailla samaa luokkaa kuin muillakin vaikeahoitoisilla potilailla (2/5 vs. 17/48). Vaste saatiin 47 %:lla (21/45) niistä potilaista, joiden tauti oli keuhkoissa, ja 28 %:lla (5/18) niistä potilaista, joiden tauti oli muualla kuin keuhkoissa. Niistä 8 potilaasta, joiden keuhkoihin liittymätön tauti oli varmasti, todennäköisesti tai mahdollisesti edennyt myös keskushermostoon, suotuisa vaste saatiin 2:lla.
Empiirinen hoito kuumeisilla, neutropeenisilla aikuispotilailla: Kliiniseen tutkimukseen otettiin yhteensä 1 111 potilasta, joilla oli pitkäkestoinen kuume ja neutropenia. Potilaat saivat hoitona joko 50 mg kaspofungiinia kerran vuorokaudessa 70 mg:n kyllästysannoksen jälkeen tai 3,0 mg/kg/vrk liposomaalista amfoterisiini B:tä. Tutkimukseen soveltuneet potilaat olivat saaneet kemoterpiaa syöpään, tai heille oli tehty hematopoieettisten kantasolujen siirto, ja heillä oli neutropenia (< 500 solua/mm3 96 tunnin ajan) ja kuumetta (> 38,0 °C), joka ei ollut vastannut ≥ 96 tunnin parenteraaliseen antibakteeriseen hoitoon. Potilaita oli tarkoitus hoitaa 72 tuntiin saakka neutropenian korjaantumisesta, enintään 28 päivää. Hoitoa voitiin kuitenkin jatkaa pitempään, jos potilaalla todettiin tutkimuksissa sieni-infektio. Jos lääke oli hyvin siedetty, mutta potilaalla oli edelleen kuumetta ja hänen kliininen tilansa heikkeni 5 hoitopäivän jälkeen, tutkimuslääkkeen annostus voitiin suurentaa kaspofungiiniryhmässä 70 mg:aan/vrk (13,3 % hoidetuista potilaista) ja liposomaalisen amfoterisiini B:n ryhmässä 5,0 mg:aan/kg/vrk (14,3 % hoidetuista potilaista). Modifioituun primaariseen tehokkuusanalyysiin (Modified Intention-To-Treat, MITT-analyysi), jonka avulla arvioitiin suotuisan hoitovasteen saavuttaneiden potilaiden kokonaisosuuksia, otettiin 1 095 potilasta: kaspofungiini (33,9 %) oli yhtä tehokas kuin liposomaalinen amfoterisiini B (33,7 %) [ero 0,2 % (95,2 % CI: −5,6; 6,0)]. Suotuisaan kokonaishoitovasteeseen vaadittiin kaikkien seuraavien 5 ehdon täyttyminen: 1) lähtötilanteen sieni-infektion onnistunut hoito (kaspofungiini 51,9 % [14/27], liposomaalinen amfoterisiini B 25,9 % [7/27]), 2) sieni-infektio ei uusiutunut tutkimuslääkityksen aikana eikä 7 päivän kuluessa hoidon päättymisestä (kaspofungiini 94,8 % [527/556], liposomaalinen amfoterisiini B 95,5 % [515/539]), 3) potilas oli elossa 7 päivää tutkimuslääkityksen päättymisen jälkeen (kaspofungiini 92,6 % [515/556], liposomaalinen amfoterisiini B 89,2 % [481/539], 4) tutkimuslääkitystä ei lopetettu lääkkeeseen liittyneen toksisuuden tai hoidon tehottomuuden vuoksi (kaspofungiini 89,7 % [499/556], liposomaalinen amfoterisiini B 85,5 % [461/539]) ja 5) kuume hävisi neutropeniajakson aikana (kaspofungiini 41,2 % [229/556], liposomaalinen amfoterisiini B 41,4 % [223/539]). Lähtötilanteen Aspergillus-infektioissa hoitovaste saavutettiin 41,7 %:lla (5/12) kaspofungiiniryhmässä ja 8,3 %:lla (1/12) liposomaalisen amfoterisiini B:n ryhmässä. Lähtötilanteen Candida-infektioissa vastaavat luvut olivat 66,7 % (8/12) ja 41,7 % (5/12). Kaspofungiiniryhmässä ilmeni seuraavien epätavallisten hiiva‑ ja homesienten aiheuttamien infektioiden uusiutumisia: Trichosporon‑ (1), Fusarium‑ (1), Mucor‑ (1) ja Rhizopus-lajit (1).
Pediatriset potilaat
Kaspofungiinin turvallisuutta ja tehoa arvioitiin 3 kuukauden – 17 vuoden ikäisten pediatristen potilaiden hoidossa kahdessa prospektiivisessa kliinisessä monikeskustutkimuksessa. Tutkimusasetelma, diagnoosikriteerit ja tehon arviointikriteerit olivat samankaltaiset kuin vastaavissa aikuispotilaille tehdyissä tutkimuksissa (ks. kohta Farmakodynamiikka).
Ensimmäinen tutkimus oli satunnaistettu kaksoissokkotutkimus, johon otettiin mukaan 82 iältään 2–17-vuotiasta potilasta. Tässä tutkimuksessa verrattiin kaspofungiinia (1. päivänä 70 mg:n/m2 kyllästysannos [enintään 70 mg/vrk] ja sen jälkeen 50 mg/m2 laskimoon kerran vuorokaudessa) ja liposomaalista amfoterisiini B:tä (3 mg/kg/vrk laskimoon). Näitä lääkevalmisteita annettiin suhteessa 2:1 (56 sai kaspofungiinia, 26 liposomaalista amfoterisiini B:tä) empiirisenä hoitona pediatrisille potilaille, joilla oli pitkäkestoinen kuume ja neutropenia. MITT-analyysituloksiin perustuvat, riskitekijöiden mukaan korjatut konaisonnistumisprosentit olivat: kaspofungiini 46,6 % (26/56) ja liposomaalisen amfoterisiini B:n ryhmässä 32,2 % (8/25).
Toinen tutkimus oli avoin prospektiivinen ei-vertaileva tutkimus, jossa arvioitiin kaspofungiinin turvallisuutta ja tehoa invasiivista kandidiaasia, ruokatorven kandidiaasia ja invasiivista aspergilloosia sairastaneiden pediatristen potilaiden (6 kuukauden – 17 vuoden ikäisten) hoidossa (toisen linjan hoito eli salvage-hoito). Tutkimukseen otettiin 49 potilasta, jotka saivat ensimmäisenä päivänä 70 mg/m2 kaspofungiinia kyllästysannoksena (enintään 70 mg/vrk) ja sen jälkeen 50 mg/m2 laskimoon kerran vuorokaudessa. Näistä potilaista 48 otettiin mukaan MITT-analyysiin. Heistä 37:llä oli invasiivinen kandidiaasi, 10:llä invasiivinen aspergilloosi ja yhdellä ruokatorven kandidiaasi. MITT-analyysin mukaan kaspofungiinihoidon päättyessä suotuisa hoitovaste oli saavutettu käyttöaiheittain seuraavasti: 81 % (30/37) invasiivinen kandidiaasi, 50 % (5/10) invasiivinen aspergilloosi ja 100 % (1/1) ruokatorven kandidiaasi.
Kaksoissokkoutetussa, satunnaistetussa (2:1), vertailevassa tutkimuksessa kaspofungiinin (2 mg/kg/vrk infusoituna laskimoon kahden tunnin aikana) turvallisuutta, siedettävyyttä ja tehoa arvioitiin amfoterisiini B deoksikolaattiin (1 mg/kg/vrk) verrattuna vastasyntyneillä ja alle 3 kuukauden ikäisillä vauvoilla, joilla oli (bakteeriviljelmästä varmistettu) invasiivinen kandidaasi. Koska tutkimukseen saatiin mukaan potilaita huonosti, tutkimus keskeytettiin aikaisin ja satunnaistaminen tehtiin vain 51 potilaalle. Elossa olevien sieni-infektiosta parantuneiden potilaiden osuus 2 viikkoa hoidon päättymisen jälkeen oli kaspofungiiniryhmässä (71,0 %) samanlainen kuin amfoterisiini B deoksikolaattiryhmässä (68,8 %). Tämän tutkimuksen perusteella ei voida tehdä suosituksia annostuksesta vastasyntyneille ja vauvoille.
Farmakokinetiikka
Jakautuminen
Kaspofungiini sitoutuu suuressa määrin albumiiniin. Sitoutumattoman kaspofungiinin osuus plasmassa vaihtelee 3,5 %:sta terveillä tutkittavilla 7,6 %:iin invasiivista kandidiaasia sairastavilla potilailla. Jakautumisella on keskeinen asema kaspofungiinin farmakokinetiikassa plasmassa, ja se on nopeutta säätelevä tekijä sekä alfa- että beetavaiheessa. Kudoksiin jakautuminen oli huipussaan 1,5–2 päivän kuluttua annostelusta, jolloin 92 % annoksesta oli jakautunut kudoksiin. Todennäköisesti vain pieni osa kudoksiin siirtyneestä kaspofungiinista palautuu muuttumattomana plasmaan. Koska kaspofungiini siis eliminoituu ilman, että sen jakautuminen elimistöön olisi saavuttanut tasapainotilan, kaspofungiinin jakautumistilavuudesta on toistaiseksi mahdotonta esittää luotettavaa arviota.
Biotransformaatio
Kaspofungiini hajoaa itsestään avorenkaiseksi yhdisteeksi, minkä jälkeen se metaboloituu peptidihydrolyysin ja N‑asetylaation avulla. Kaspofungiinin hajotessa avorenkaiseksi yhdisteeksi muodostuu kaksi välituotetta, jotka muodostavat kovalentteja addukteja plasman proteiinien kanssa; tästä seuraa pysyvä sitoutuminen plasman proteiineihin pieninä pitoisuuksina.
In vitro ‑tutkimukset osoittavat, ettei kaspofungiini estä sytokromi P450 ‑entsyymejä 1A2, 2A6, 2C9, 2C19, 2D6 tai 3A4. Kliinisissä tutkimuksissa kaspofungiini ei indusoinut eikä estänyt muiden lääkevalmisteiden CYP3A4-välitteistä metaboliaa. Kaspofungiini ei ole P‑glykoproteiinin substraatti, ja se on heikko sytokromi P450 ‑entsyymien substraatti.
Eliminaatio
Kaspofungiini eliminoituu plasmasta hitaasti, ja puhdistuma on 10–12 ml/min. Laskimoon annetun 1 tunnin kertainfuusion jälkeen plasman kaspofungiinipitoisuus pienenee monivaiheisesti. Välittömästi infuusiota seuraava lyhyt alfavaihe etenee beetavaiheeseen, jonka puoliintumisaika on 9–11 tuntia. Lisäksi esiintyy gammavaihe, jonka puoliintumisaika on 45 tuntia.
Tärkein kaspofungiinin puhdistumaan plasmasta vaikuttava mekanismi on jakautuminen, ei niinkään erittyminen tai biotransformaatio.
Radioaktiivisesti leimatusta annoksesta noin 75 % erittyy 27 päivän kuluessa virtsaan (41 %) tai ulosteisiin (34 %). Kaspofungiini erittyy ja biotransformoituu vain vähän antoa seuraavien 30 tunnin aikana. Erittyminen on hidasta, ja radioaktiivisuuden terminaalinen puoliintumisaika oli 12–15 päivää. Pieni määrä kaspofungiinia (noin 1,4 % annoksesta) erittyy virtsaan muuttumattomana.
Kaspofungiinin farmakokinetiikka on kohtalaisen epälineaarista, ja kaspofungiini kertyy elimistöön lisääntyvässä määrin annoksen suuretessa. Toistuvassa annossa aika vakaan tilan saavuttamiseen riippuu annoksesta.
Erityisryhmät
Kaspofungiinialtistuksen suurenemista todettiin munuaisten vajaatoimintaa ja lievää maksan vajaatoimintaa sairastaneilla aikuispotilailla, naispuolisilla tutkittavilla ja iäkkäillä potilailla. Altistus suureni yleensä vain vähän, ei niin huomattavasti, että annostusta olisi tarvinnut muuttaa. Annostusta voidaan joutua muuttamaan aikuispotilaille, joilla on keskivaikea maksan vajaatoiminta tai jotka ovat painavia (ks. seuraavat kohdat).
Paino
Painon todettiin vaikuttavan kaspofungiinin farmakokinetiikkaan aikuisia kandidiaasipotilaita koskeneessa populaatiofarmakokineettisessä analyysissa. Plasman kaspofungiinipitoisuus pienenee ruumiinpainon noustessa. Keskimääräisen kaspofungiinialtistuksen ennustettiin olevan 80 kg painavalla aikuispotilaalla noin 23 % pienempi kuin 60 kg painavalla aikuispotilaalla (ks. kohta Annostus ja antotapa).
Maksan vajaatoiminta
Lievä maksan vajaatoiminta suurentaa aikuispotilaan AUC-arvoa noin 20 % ja keskivaikea maksan vajaatoiminta noin 75 %. Vaikeaa maksan vajaatoimintaa sairastavien aikuispotilaiden ja minkä tahansa asteista maksan vajaatoimintaa sairastavien pediatristen potilaiden hoidosta ei ole kliinistä kokemusta. Kun keskivaikeaa maksan vajaatoimintaa sairastaneiden aikuispotilaiden vuorokausiannos pienennettiin moniannostutkimuksessa 35 mg:aan, AUC-arvo oli samaa luokkaa kuin tavanomaista annostusta saaneilla aikuisilla tutkittavilla, joilla maksa toimii normaalisti (ks. kohta Annostus ja antotapa).
Munuaisten vajaatoiminta
70 mg:n kerta-annosta koskeneessa kliinisessä tutkimuksessa kaspofungiinin farmakokinetiikka oli samankaltaista lievää munuaisten vajaatoimintaa (kreatiniinipuhdistuma 50–80 ml/min) sairastaneilla aikuisilla tutkittavilla ja verrokeilla. Keskivaikea (kreatiniinipuhdistuma 31–49 ml/min), pitkälle edennyt (kreatiniinipuhdistuma 5–30 ml/min) ja loppuvaiheen (kreatiniinipuhdistuma < 10 ml/min ja dialyysiä vaativa) munuaisten vajaatoiminta suurensivat plasman kaspofungiinipitoisuutta kohtalaisesti kerta-annoksen antamisen jälkeen (AUC-arvon muutoksen vaihteluväli 30–49 %). Lievä tai pitkälle edennyt munuaisten vajaatoiminta ei kuitenkaan vaikuttanut kaspofungiinin pitoisuuteen merkitsevästi, kun invasiivista kandidiaasia, ruokatorven kandidiaasia tai invasiivista aspergilloosia sairastaneille aikuispotilaille annettiin toistuvasti kaspofungiinia 50 mg/vrk. Annostusta ei tarvitse muuttaa potilaalle, jolla on munuaisten vajaatoiminta. Kaspofungiini ei ole dialysoitavissa, joten lisäannoksia ei hemodialyysin jälkeen tarvita.
Sukupuoli
Plasman kaspofungiinipitoisuus oli naisilla keskimäärin 17–38 % suurempi kuin miehillä.
Iäkkäät potilaat
Iäkkäillä miespuolisilla tutkittavilla havaittiin AUC-arvon (28 %) ja C24h-arvon (32 %) vähäistä suurenemista nuoriin miespuolisiin tutkittaviin verrattuna. Vastaava ikään liittynyt vähäinen vaikutus todettiin empiiristä hoitoa saaneilla tai invasiivista kandidiaasia sairastaneilla iäkkäillä potilailla verrattuna heitä nuorempiin potilaisiin.
Rotu
Potilaiden farmakokineettiset tiedot osoittivat, ettei kaspofungiinin farmakokinetiikassa ole kliinisesti merkitseviä eroja valkoihoisten, mustaihoisten, latinalaisamerikkalaisten ja mestitsien välillä.
Pediatriset potilaat
Nuorilla (12–17‑vuotiailla), jotka saivat kaspofungiinia 50 mg/m2/vrk (enintään 70 mg/vrk), kaspofungiinin AUC0-24h plasmassa oli yleisesti samaa tasoa kuin aikuisilla, jotka saivat kaspofungiinia 50 mg/vrk. Kaikkien nuorten annos oli > 50 mg/vrk, ja itse asiassa 6 potilasta 8:sta sai enimmäisannosta 70 mg/vrk. Kaspofungiinin pitoisuus plasmassa oli näillä nuorilla pienempi kuin aikuisilla, joiden annostus oli 70 mg/vrk (yleisin annostus nuorille).
Lapsilla (2–11‑vuotiailla), jotka saivat kaspofungiinia 50 mg/m2/vrk (enintään 70 mg/vrk), kaspofungiinin AUC0-24h plasmassa oli toistuvan annon jälkeen samaa tasoa kuin aikuisilla, jotka saivat kaspofungiinia 50 mg/vrk.
Pikkulapsilla ja leikki-ikäisillä (12–23 kuukauden ikäisillä), jotka saivat kaspofungiinia 50 mg/m2/vrk (enintään 70 mg/vrk), kaspofungiinin AUC0-24h plasmassa oli toistuvan annon jälkeen samaa tasoa kuin aikuisilla, jotka saivat kaspofungiinia 50 mg/vrk, ja vanhemmilla lapsilla (2–11‑vuotiailla), joiden annostus oli 50 mg/m2/vrk.
Kaiken kaikkiaan valmisteen farmakokinetiikasta, tehosta ja turvallisuudesta 3–10 kuukauden ikäisten potilaiden hoidossa on saatavilla vain vähän tietoa. Farmakokineettiset tiedot yhdestä 10 kuukauden ikäisestä lapsesta, jonka annos oli 50 mg/m2/vrk, osoittivat, että AUC0-24h oli samaa tasoa kuin mitä on havaittu samaa annosta (50 mg/m2) saaneilla vanhemmilla lapsilla ja 50 mg:n annosta saaneilla aikuisilla. Sen sijaan yhdellä 6 kuukauden ikäisellä lapsella, jonka annos oli 50 mg/m2,AUC0-24h oli jonkin verran suurempi.
Vastasyntyneillä ja imeväisillä (alle 3 kuukauden ikäisillä), jotka saivat kaspofungiinia 25 mg/m2/vrk (vastaava keskimääräinen vuorokausiannos 2,1 mg/kg), kaspofungiinin huippupitoisuus (C1h) ja vuorokauden pienin kaspofungiinipitoisuus (C24h) olivat toistuvan annon jälkeen samaa tasoa kuin aikuisilla, jotka saivat kaspofungiinia 50 mg/vrk. Ensimmäisenä hoitopäivänä näiden vastasyntyneiden ja imeväisten C1h‑arvot olivat samaa tasoa ja C24h‑arvot hieman suurempia (36 %) kuin aikuisten vastaavat arvot. Vaihtelua kuitenkin ilmeni sekä C1h-arvossa (4. hoitopäivän geometrinen keskiarvo 11,73 mikrog/ml, vaihteluväli 2,63–22,05 mikrog/ml) että C24h‑arvossa (4. hoitopäivän geometrinen keskiarvo 3,55 mikrog/ml, vaihteluväli 0,13–7,17 mikrog/ml). Tässä tutkimuksessa ei tehty AUC0-24h‑mittauksia plasmanäytteiden niukkuuden vuoksi. On huomattava, että kaspofungiinin tehoa ja turvallisuutta ei ole tutkittu riittävästi prospektiivisissa kliinisissä tutkimuksissa vastasyntyneiden ja alle 3 kuukauden ikäisten imeväisten hoidossa.
Prekliiniset tiedot turvallisuudesta
Rotilla ja apinoilla tehdyissä toistuvan altistuksen aiheuttamaa toksisuutta koskeneissa tutkimuksissa, joissa enimmäisannos laskimoon oli 7–8 mg/kg, todettiin kummallakin eläinlajilla pistoskohdan reaktioita, rotilla merkkejä histamiinin vapautumisesta ja apinoilla viitteitä maksaan kohdistuneista haittavaikutuksista. Rotilla tehdyt kehitystoksisuustutkimukset osoittivat, että kaspofungiini pienentää sikiöpainoa ja lisää nikamien, rintalastan ja kalloluiden puutteellisen luutumisen ilmaantuvuutta annoksella 5 mg/kg. Näihin muutoksiin yhdistettiin emoon kohdistuneita haittavaikutuksia, kuten histamiinin vapautumisen merkkejä tiineillä rotilla. Myös kaulakylkiluiden ilmaantuvuuden lisääntymistä todettiin. Kaspofungiini oli negatiivinen in vitro -genotoksisuusmäärityksissä ja hiiren luuytimellä tehdyssä in vivo ‑kromosomitestissä. Pitkäaikaisia eläintutkimuksia kaspofungiinin karsinogeenisuuden arvioimiseksi ei ole tehty. Uros- ja naarasrotilla tehdyissä tutkimuksissa kaspofungiinilla ei ollut vaikutusta hedelmällisyyteen, kun annos oli enintään 5 mg/kg/vrk.
Farmaseuttiset tiedot
Apuaineet
Sakkaroosi
Mannitoli
Etikkahappo, väkevä
Natriumhydroksidi (pH:n säätöön)
Yhteensopimattomuudet
Lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa, lukuun ottamatta niitä, jotka mainitaan kohdassa Käyttö- ja käsittelyohjeet.
Kestoaika
Avaamattomat injektiopullot:
2 vuotta.
Käyttökuntoon saatettu konsentraatti:
Kun valmiste on saatettu käyttökuntoon injektionesteisiin käytettävällä vedellä, kemiallinen ja fysikaalinen säilyvyys käytön aikana on osoitettu 24 tuntiin saakka huoneenlämmössä ja 2 °C–8 °C:ssa. Mikrobiologisten syiden vuoksi tuote pitäisi käyttää heti. Jos sitä ei käytetä heti, käytönaikaiset säilytysaika ja -olosuhteet ennen käyttöä ovat käyttäjän vastuulla eivätkä normaalisti saa olla yli 24 tuntia 2 °C–8 °C:ssa, jollei valmistetta ole saatettu käyttökuntoon kontrolloiduissa ja validoiduissa aseptisissa olosuhteissa.
Potilaalle annettava laimennettu infuusioliuos:
Kun valmiste säilytetään 25 °C:ssa tai 2 °C–8 °C:ssa ja laimennetaan joko 9 mg/ml (0,9 %), 4,5 mg/ml (0,45 %) tai 2,25 mg/ml (0,225 %) natriumkloridi-injektionesteliuoksella tai Ringerin laktaattiliuoksella, kemiallinen ja fysikaalinen säilyvyys käytön aikana on osoitettu 48 tuntiin saakka.
Mikrobiologisten syiden vuoksi tuote pitäisi käyttää heti. Jos sitä ei käytetä heti, käytönaikaiset säilytysaika ja -olosuhteet ennen käyttöä ovat käyttäjän vastuulla, eivätkä normaalisti saa olla yli 24 tuntia 2 °C–8 °C:ssa, jollei valmistetta ole saatettu käyttökuntoon ja laimennettu kontrolloiduissa ja validoiduissa aseptisissa olosuhteissa.
Säilytys
Avaamattomat injektiopullot: Säilytä jääkaapissa (2 °C–8 °C).
Käyttökuntoon saatetun ja laimennetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
CASPOFUNGIN ORION kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos
50 mg (L:ei) 50 mg (662,78 €)
70 mg (L:ei) 70 mg (834,29 €)
PF-selosteen tieto
10 ml:n läpinäkyvä lasinen (tyyppi I) injektiopullo, jossa on harmaa bromobutyylikumitulppa ja alumiinivyöte, jossa on joko punainen (50 mg) tai oranssi (70 mg) muovinen repäisykorkki. Toimitetaan pakkauksessa, jossa on 1 injektiopullo.
Valmisteen kuvaus:
Valmiste on ennen käyttökuntoon saattamista valkoista tai lähes valkoista kylmäkuivattua jauhetta.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
KÄYTTÖOHJEET AIKUISPOTILAIDEN HOIDOSSA
Vaihe 1: Injektiopullojen saattaminen käyttökuntoon
Saata kuiva-aine käyttökuntoon ottamalla injektiopullo huoneenlämpöön ja lisäämällä siihen aseptisesti 10,5 ml injektionesteisiin käytettävää vettä. Pitoisuus käyttökuntoon saatetussa injektiopullossa on joko 5,2 mg/ml (50 mg:n injektiopullo) tai 7,2 mg/ml (70 mg:n injektiopullo).
Valkoinen tai lähes valkoinen tiivis kylmäkuivattu kuiva-aine liukenee täydellisesti. Sekoita varovasti, kunnes liuos on kirkasta. Käyttökuntoon saatettu liuos on tarkastettava näkyvien hiukkasten ja värinmuutosten varalta. Käyttökuntoon saatettua liuosta saa säilyttää enintään 24 tuntia enintään 25 °C:ssa (vähintään 2 °C–8 °C:ssa).
Vaihe 2: Käyttökuntoon saatetun Caspofungin Orion ‑liuoksen lisääminen potilaan infuusioliuokseen
Laimennin lopullista infuusioliuosta varten ovat natriumkloridi-injektionesteliuos (9 mg/ml, 4,5 mg/ml tai 2,25 mg/ml) tai Ringerin laktaattiliuos. Infuusioliuos valmistetaan lisäämällä oikea määrä (ks. seuraava taulukko) käyttökuntoon saatettua konsentraattia aseptisesti 250 ml:n infuusiopussiin tai ‑pulloon. Potilaalle voidaan tarvittaessa lääketieteellisistä syistä antaa määrältään tavanomaista pienempi, 100 ml:n infuusio, kun vuorokausiannos on 50 mg tai 35 mg. Tämä infuusioliuos on käytettävä 48 tunnin kuluessa, jos sitä on säilytetty enintään 25 °C:ssa (vähintään 2 °C–8 °C:ssa). Älä käytä, jos liuos on samea tai saostunut.
INFUUSIOLIUOKSEN VALMISTAMINEN AIKUISILLE
ANNOS* | Infuusiopussiin tai -pulloon siirrettävän käyttökuntoon saatetun Caspofungin Orion -liuoksen tilavuus | Tavanomainen infuusio (käyttökuntoon saatettu Caspofungin Orion lisätty 250 ml:aan), lopullinen pitoisuus | Tilavuudeltaan pienempi infuusio (käyttökuntoon saatettu Caspofungin Orion lisätty 100 ml:aan), lopullinen pitoisuus |
70 mg | 10 ml | 0,28 mg/ml | Ei suositella |
70 mg (kahdesta 50 mg:n injektiopullosta)** | 14 ml | 0,28 mg/ml | Ei suositella |
50 mg | 10 ml | 0,20 mg/ml | - |
50 mg pienemmässä tilavuudessa | 10 ml | - | 0,47 mg/ml |
35 mg keskivaikeassa maksan vajaatoiminnassa (yhdestä 50 mg:n injektiopullosta) | 7 ml | 0,14 mg/ml | - |
35 mg keskivaikeassa maksan vajaatoiminnassa (yhdestä 50 mg:n injektiopullosta) pienemmässä tilavuudessa | 7 ml | - | 0,34 mg/ml |
35 mg keskivaikeassa maksan vajaatoiminnassa (yhdestä 70 mg:n injektiopullosta) | 5 ml | 0,14 mg/ml | 0,34 mg/ml |
* Injektiopullon käyttökuntoon saattamiseen on käytettävä aina 10,5 ml injektionesteisiin käytettävää vettä.
** Jos saatavilla ei ole 70 mg:n injektiopulloa, 70 mg:n annos voidaan valmistaa kahdesta 50 mg:n injektiopullosta.
KÄYTTÖOHJEET PEDIATRISTEN POTILAIDEN HOIDOSSA
Pediatristen potilaiden kehon pinta-alan laskeminen annostusta varten
Laske ennen infuusioliuoksen valmistamista potilaan kehon pinta-ala seuraavalla kaavalla: (Mostellerin kaava):
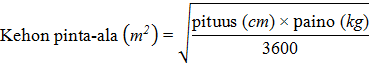
70 mg/m2‑infuusion valmistaminen yli 3 kuukauden ikäisille pediatrisille potilaille (käyttäen joko 50 mg:n tai 70 mg:n injektiopulloa)
-
Määritä pediatriselle potilaalle annettava todellinen kyllästysannos potilaan kehon pinta-alan (laskettu edellä olevalla kaavalla) ja seuraavan yhtälön perusteella: kehon pinta-ala (m2) x 70 mg/m2 = kyllästysannos
Ensimmäisenä päivänä annettava kyllästysannos ei saa olla yli 70 mg, olipa potilaan laskettu annos mikä tahansa. - Ota Caspofungin Orion ‑injektiopullo jääkaapista ja anna sen lämmetä huoneenlämpöön.
- Lisää injektiopulloon aseptisesti 10,5 ml injektionesteisiin käytettävää vettä.a Näin käyttökuntoon saatettua liuosta voidaan säilyttää enintään 24 tuntia enintään 25 °C:ssa (vähintään 2 °C–8 °C:ssa).b Lopullinen kaspofungiinipitoisuus on nyt joko 5,2 mg/ml (50 mg:n injektiopullo) tai 7,2 mg/ml (70 mg:n injektiopullo).
- Ota injektiopullosta laskettua kyllästysannosta (vaihe 1) vastaava määrä lääkevalmistetta. Siirrä tämä määrä (ml)c käyttökuntoon saatettua Caspofungin Orion ‑liuosta aseptisesti infuusiopussiin (tai -pulloon), jossa on 250 ml 9 mg/ml (0,9 %), 4,5 mg/ml (0,45 %) tai 2,25 mg/ml (0,225 %) natriumkloridi-injektioliuosta tai Ringerin laktaattiliuosta. Vaihtoehtoisesti sama määrä (ml)c käyttökuntoon saatettua Caspofungin Orion ‑liuosta voidaan lisätä pienempään määrään 9 mg/ml (0,9 %), 4,5 mg/ml (0,45 %) tai 2,25 mg/ml (0,225 %) natriumkloridi-injektioliuosta tai Ringerin laktaattiliuosta, kuitenkin niin, että lopullinen pitoisuus on enintään 0,5 mg/ml. Tämä infuusioliuos on käytettävä 48 tunnin kuluessa, jos sitä säilytetään enintään 25 °C:ssa (vähintään 2 °C–8 °C:ssa).
50 mg/m2‑infuusion valmistaminen yli 3 kuukauden ikäisille pediatrisille potilaille (käyttäen joko 50 mg:n tai 70 mg:n injektiopulloa)
-
Määritä pediatriselle potilaalle annettava todellinen ylläpitoannos potilaan kehon pinta-alan (laskettu edellä olevalla kaavalla) ja seuraavan yhtälön perusteella: kehon pinta-ala (m2) x 50 mg/m2 = ylläpitoannos/vrk
Ylläpitoannos ei saa olla yli 70 mg/vrk, olipa potilaan laskettu annos mikä tahansa. - Ota Caspofungin Orion ‑injektiopullo jääkaapista ja anna sen lämmetä huoneenlämpöön.
- Lisää injektiopulloon aseptisesti 10,5 ml injektionesteisiin käytettävää vettä.a Näin käyttökuntoon saatettua liuosta voidaan säilyttää enintään 24 tuntia enintään 25 °C:ssa (vähintään 2 °C–8 °C:ssa).b Lopullinen kaspofungiinipitoisuus on nyt joko 5,2 mg/ml (50 mg:n injektiopullo) tai 7,2 mg/ml (70 mg:n injektiopullo).
- Ota injektiopullosta laskettua ylläpitovuorokausiannosta (vaihe 1) vastaava määrä lääkevalmistetta. Siirrä tämä määrä (ml)c käyttökuntoon saatettua Caspofungin Orion ‑liuosta aseptisesti infuusiopussiin (tai ‑pulloon), jossa on 250 ml 9 mg/ml (0,9 %), 4,5 mg/ml (0,45 %) tai 2,25 mg/ml (0,225 %) natriumkloridi-injektioliuosta tai Ringerin laktaattiliuosta. Vaihtoehtoisesti sama määrä (ml)c käyttökuntoon saatettua Caspofungin Orion ‑liuosta voidaan lisätä pienempään määrään 9 mg/ml (0,9 %), 4,5 mg/ml (0,45 %) tai 2,25 mg/ml (0,225 %) natriumkloridi-injektioliuosta tai Ringerin laktaattiliuosta, kuitenkin niin, että lopullinen pitoisuus on enintään 0,5 mg/ml. Tämä infuusioliuos on käytettävä 48 tunnin kuluessa, jos sitä säilytetään enintään 25 °C:ssa (vähintään 2 °C–8 °C:ssa).
Liuoksen valmistusta koskevat huomautukset: | |
a. | Valkoinen tai lähes valkoinen kuiva-ainepaakku liukenee täydellisesti. Sekoita varovasti, kunnes liuos on kirkasta. |
b. | Tarkasta käyttökuntoon saatettu liuos näkyvien hiukkasten tai värinmuutosten varalta käyttökuntoon saattamisen aikana ja ennen infuusiota. Älä käytä, jos liuos on samea tai saostunut. |
c. | Caspofungin Orion ‑injektiopullosta saadaan koko etiketin mukainen annos (50 mg tai 70 mg), kun pullosta otetaan 10 ml. |
Korvattavuus
CASPOFUNGIN ORION kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos
50 mg 50 mg
70 mg 70 mg
- Ei korvausta.
ATC-koodi
J02AX04
Valmisteyhteenvedon muuttamispäivämäärä
17.11.2020
Yhteystiedot
 ORION OYJ ORION PHARMA
ORION OYJ ORION PHARMA Orionintie 1, PL 65
02101 Espoo
010 4261
www.orion.fi
etunimi.sukunimi@orionpharma.com
