NEXPLANON implantaatti 68 mg
Vaikuttavat aineet ja niiden määrät
Nexplanon on säteilyä läpäisemätön, biologisesti hajoamaton, pelkästään progestiinia sisältävä taipuisa implantaatti, joka on pakattu steriiliin kertakäyttöiseen asettimeen.
Yksi säteilyä läpäisemätön implantaatti sisältää 68 mg etonogestreelia, jonka vapautumisnopeus on noin 60–70 mikrog/vrk 5–6 ensimmäisen käyttöviikon ajan ja hidastuu siten, että se on ensimmäisen vuoden lopussa noin 35–45 mikrog/vrk, toisen vuoden lopussa noin 30–40 mikrog/vrk ja kolmannen vuoden lopussa noin 25–30 mikrog/vrk. Asetin on tarkoitettu käytettäväksi yhdellä kädellä ja se on suunniteltu helpottamaan implantaatin asettamista oikein ihon alle.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Implantaatti ihon alle.
Kliiniset tiedot
Käyttöaiheet
Raskauden ehkäisy.
Turvallisuus ja teho on osoitettu 18-40-vuotiailla naisilla.
Annostus ja antotapa
Annostus
Yksi implantaatti, joka voi olla paikoillaan kolmen vuoden ajan.
Pediatriset potilaat
Nexplanonin turvallisuutta ja tehoa alle 18-vuotiailla nuorilla ei ole tutkittu.
Antotapa
Raskauden mahdollisuus on suljettava pois ennen Nexplanonin asettamista.
| On erittäin suositeltavaa, että Nexplanon-implantaatin asettavat ja poistavat vain terveydenhuollon ammattilaiset, jotka ovat osallistuneet Nexplanon-asettimen käyttöä ja Nexplanon-implantaatin asetus- ja poistamistekniikkaa opastavaan koulutukseen. Heidän on tarvittaessa pyydettävä ohjausta ennen implantaatin asettamista tai poistamista. |
Ennen implantaatin asettamista lue huolellisesti sen asettamista ja poistamista koskevat ohjeet kohdasta Annostus ja antotapa Nexplanonin asettaminen ja kohdasta Annostus ja antotapa Nexplanonin poistaminen ja noudata näitä ohjeita.
| Implantaatin asettamista ja poistamista esittelevät videot ovat saatavissa osoitteesta www.nexplanonvideos.eu. Jos sinulla on kysyttävää, ota yhteyttä myyntiluvanhaltijan paikalliseen edustajaan, puh. +358 29 170 3520. |
Jos olet epävarma Nexplanonin turvallisen asettamisen ja/tai poistamisen vaiheista, älä tee toimenpidettä.
Miten Nexplanonia käytetään
Nexplanon on pitkävaikutteinen hormonaalinen ehkäisyväline. Ihon alle asetetaan yksi implantaatti, joka voi olla paikoillaan kolmen vuoden ajan. Implantaatti poistetaan viimeistään kolmen vuoden kuluttua sen asettamisesta. Käyttäjälle on kerrottava, että hänen pyynnöstään Nexplanon voidaan poistaa milloin tahansa. Painavammilla naisilla terveydenhuollon ammattilainen voi harkita implantaatin vaihtamista uuteen aikaisemmin (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Jos heti implantaatin poiston jälkeen asetetaan uusi implantaatti, ehkäisysuoja jatkuu. Jos nainen ei halua jatkaa Nexplanonin käyttöä, mutta haluaa ehkäisysuojan jatkuvan, hänelle on suositeltava toista ehkäisymenetelmää.
Nexplanon-pakkaus sisältää potilaalle annettavan kortin, johon merkitään implantaatin eränumero. Terveydenhuollon ammattilaisen tulisi kirjata korttiin implantaatin asettamispäivämäärä, kumpaan käteen implantaatti asetettiin sekä implantaatin suunniteltu poistopäivämäärä. Potilaita on ohjeistettava pitämään kortti tallessa ja näyttämään sitä kaikilla implantaattiin liittyvillä käynneillä. Potilaskortissa on myös ohjeet potilaalle tunnustella implantaattia aika ajoin varovasti sen sijainnin varmistamiseksi. Potilaita on ohjeistettava ottamaan mahdollisimman pian yhteyttä terveydenhuollon ammattilaiseen, jos implantaatti ei tunnu. Pakkaus sisältää myös terveydenhuollon ammattilaisten potilasarkistoja varten tarraetikettejä, joihin on painettu implantaatin eränumero. Jos sähköiset potilastiedot ovat käytössä, nämä tiedot tallennetaan niihin.
Nexplanon-implantaatin luotettava käyttö ja aikanaan tapahtuva poisto perustuvat siihen, että implantaatti asetetaan ihon alle oikein ja huolellisesti annettujen ohjeiden mukaisesti.
- Jos implantaattia ei aseteta ohjeiden mukaisesti eikä oikeana asettamisajankohtana, seurauksena saattaa olla tahaton raskaus (ks. kohta Annostus ja antotapa Nexplanonin asettaminen ja Nexplanonin asettamisajankohta).
- Jos implantaatti on asetettu syvemmälle kuin ihon alle, se ei ehkä ole palpoitavissa ja sen paikantaminen ja/tai poistaminen voi olla vaikeaa (ks. kohta Annostus ja antotapa Nexplanonin poistaminen ja kohta Varoitukset ja käyttöön liittyvät varotoimet).
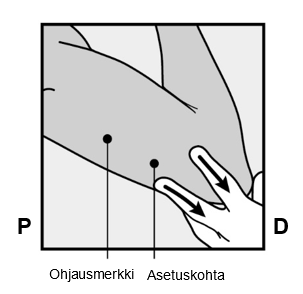
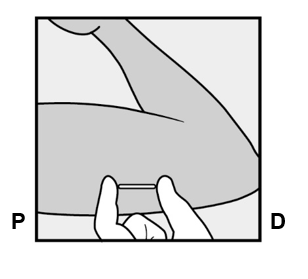
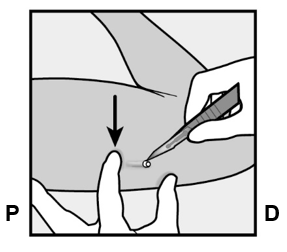
Nexplanon-implantaatti asetetaan AIVAN IHON ALLE ei-hallitsevan käden olkavarren sisäsivulle. Asetuskohta on kolmipäisen olkalihaksen (m.triceps) päällä noin 8–10 cm humeruksen mediaalisesta epikondyylistä (olkaluun koukistajalisäkkeestä) ja 3–5 cm hauislihaksen (m.biceps) ja kolmipäisen olkalihaksen (m.triceps) välisen uurteen alapuolella. Tällä sijainnilla vältetään kolmipäisen olkalihaksen ja hauislihaksen välisessä uurteessa ja sen ympärillä olevia suuria verisuonia ja hermoja (ks. kuvat 2a, 2b ja 2c).
Implantaatin sijainti on varmistettava palpoimalla se välittömästi asettamisen jälkeen. Jos implantaatti ei ole palpoitavissa tai sen paikallaan olo on epävarmaa, ks. kohta Annostus ja antotapa Nexplanonin asettaminen, kohta "Jos implantaatti ei tunnu palpoimalla asettamisen jälkeen".
Nexplanonin asettamisajankohta
TÄRKEÄÄ: Raskaus on suljettava pois ennen implantaatin asettamista.
Asettamisajankohta riippuu naisen aiemmin käyttämästä ehkäisystä seuraavasti:
Ei edeltävää hormonaalista ehkäisyä edellisen kuukauden aikana
Implantaatti asetetaan kuukautiskierron 1.–5. päivänä (1. päivä on kuukautisvuodon ensimmäinen päivä), vaikka vuoto ei olisi vielä loppunut.
Jos implantaatti asetetaan suositusten mukaisesti, lisäehkäisyä ei tarvita. Jos implantaatin suositellusta asettamisajankohdasta poiketaan, naista on kehotettava käyttämään ehkäisynä estemenetelmää, kunnes implantaatin asettamisesta on kulunut 7 päivää. Jos yhdyntä on jo tapahtunut, raskaus on suljettava pois.
Siirtyminen toisesta hormonaalisesta ehkäisymenetelmästä Nexplanon-implantaattiin
Kun siirrytään yhdistelmähormoniehkäisystä implantaattiin (yhdistelmäehkäisytabletit, emätinrengas tai ehkäisylaastari)
Implantaatti asetetaan mieluiten aiemmin käytössä olleen yhdistelmäehkäisytablettivalmisteen viimeisen vaikuttavaa ainetta sisältävän tabletin ottoa seuraavana päivänä tai emätinrenkaan tai ehkäisylaastarin poistopäivänä. Implantaatti on asetettava viimeistään aiemmin käytössä olleen yhdistelmähormoniehkäisyvalmisteen tavanomaista tabletti-, ehkäisyrengas- tai laastaritaukoa tai viimeisen lumetabletin ottamista seuraavana päivänä, jolloin uusi emätinrengas tai ehkäisylaastari pitäisi ottaa käyttöön tai seuraava tabletti pitäisi ottaa. Jotkut ehkäisymenetelmät (ehkäisylaastari, emätinrengas) eivät ole markkinoilla kaikissa EU-maissa.
Jos implantaatti asetetaan suositusten mukaisesti, lisäehkäisyä ei tarvita. Jos implantaatin suositellusta asettamisajankohdasta poiketaan, naista on kehotettava käyttämään ehkäisynä estemenetelmää, kunnes implantaatin asettamisesta on kulunut 7 päivää. Jos yhdyntä on jo tapahtunut, raskaus on suljettava pois.
Kun siirrytään pelkkää progestiinia sisältävistä valmisteista (esim. pelkkää progestiinia sisältävät ehkäisytabletit, injektiot, toinen implantaatti, progestiinia vapauttava kohdunsisäinen ehkäisin [IUS]) Nexplanoniin.
Koska pelkkää progestiinia sisältäviä valmisteita on useita erilaisia, implantaatti on asetettava seuraavasti:
- injektio: implantaatti asetetaan päivänä, jolloin seuraava injektio tulisi antaa
- pelkkää progestiinia sisältävät ehkäisytabletit: minipillereistä voidaan siirtyä Nexplanonin käyttöön minä kuukauden päivänä tahansa. Implantaatti asetetaan 24 tunnin kuluessa viimeisen tabletin ottamisen jälkeen.
- toinen implantaatti/kohdunsisäinen ehkäisin: implantaatti asetetaan sinä päivänä, jolloin aiempi implantaatti tai kohdunsisäinen ehkäisin poistetaan.
Jos implantaatti asetetaan suositusten mukaisesti, lisäehkäisyä ei tarvita. Jos implantaatin suositellusta asettamisajankohdasta poiketaan, naista on kehotettava käyttämään ehkäisynä estemenetelmää, kunnes implantaatin asettamisesta on kulunut 7 päivää. Jos yhdyntä on jo tapahtunut, raskaus on suljettava pois.
Abortin tai keskenmenon jälkeen
Implantaatti voidaan asettaa välittömästi abortin tai keskenmenon jälkeen.
- Ensimmäinen raskauskolmannes: Jos implantaatti asetetaan 5 päivän kuluessa, lisäehkäisyä ei tarvita.
- Toinen raskauskolmannes: Jos implantaatti asetetaan 21 päivän kuluessa, lisäehkäisyä ei tarvita.
Jos implantaatti asetetaan suositellun asettamisajankohdan jälkeen, naista on kehotettava käyttämään ehkäisynä estemenetelmää, kunnes implantaatin asettamisesta on kulunut 7 päivää. Jos yhdyntä on jo tapahtunut, raskaus on suljettava pois ennenimplantaatin asettamista.
Synnytyksen jälkeen
Implantaatti voidaan asettaa välittömästi synnytyksen jälkeen sekäimettäville että ei-imettäville naisille yksilöllisen hyöty-riskiarvion perusteella.
- Jos implantaatti asetetaan 21 päivän kuluessasynnytyksestä, lisäehkäisyä ei tarvita.
- Jos implantaatti asetetaan myöhemmin kuin 21 päivää synnytyksen jälkeen, naista on kehotettava käyttämään ehkäisynä estemenetelmää, kunnes implantaatin asettamisesta on kulunut 7 päivää. Jos yhdyntä on jo tapahtunut, raskaus on suljettava pois ennenimplantaatinasettamista.
Nexplanonin asettaminen
Nexplanonin luotettavuus ja myöhemmin tapahtuva poisto perustuvat implantaatin asettamiseen oikein ja huolellisesti annettujen ohjeiden mukaisesti ei-hallitsevan käden olkavarteen, aivan ihon alle. Sekä terveydenhuollon ammattilaisen että naisen on pystyttävä käsin tuntemaan naisen ihon alla oleva implantaatti sen asettamisen jälkeen.
Implantaatti tulee asettaa aivan ihon alle (subkutaanisesti) ei-hallitsevan käden olkavarren sisäsivulle.
- Jos implantaatti on asetettu syvemmälle kuin aivan ihon alle, se ei ehkä ole palpoitavissa ja sen paikantaminen ja/tai poistaminen saattaa olla vaikeaa (ks. kohta Annostus ja antotapaNexplanonin poistaminen ja kohta Varoitukset ja käyttöön liittyvät varotoimet).
- Mikäli Nexplanon asetetaan syvälle, saattaa tästä aiheutua hermo- tai verisuonivaurioita. Syvälle tai virheellisesti tapahtuneisiin asetuksiin on liittynyt parestesioita (hermovauriosta johtuen) ja implantaatin siirtymistä asetuskohdasta (lihakseen tai faskiaan tapahtuneesta asetuksesta johtuen) ja harvoissa tapauksissa intravaskulaarisia asetuksia.
Nexplanonin saa asettaa paikalleen vain toimenpiteeseen perehtynyt terveydenhuollon ammattilainen ja se tehdään aseptisissa olosuhteissa. Implantaatti voidaan asettaa paikalleen ainoastaan esitäytetyn asettimen avulla.
Asettaminen
Jotta voidaan varmistua siitä, että implantaatti on asetettu aivan ihon alle, terveydenhuollon ammattilaisen tulisi sijoittua niin, että hän näkee neulan liikkeen katsomalla asetinta sivulta eikä yläpuolelta. Sivusta katsomalla asetuspaikka ja neulan liike aivan ihon alla voidaan nähdä tarkasti.
Kuvissa esitetään vasemman olkavarren sisäsivu asetuskohdan havainnollistamiseksi.
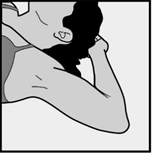
- Pyydä naista asettumaan selälleen makuulle tutkimuspöydälle ei-hallitsevan käden käsivarsi kyynärpäästä taivutettuna ja ulospäin kierrettynä siten, että kämmen on hänen päänsä alla (tai niin lähellä päätä kuin mahdollista) (Kuva 1).
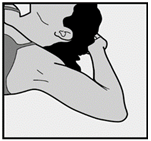
Kuva 1
- Etsi asetuskohta, joka on ei-hallitsevan käden olkavarren sisäsivulla. Asetuskohta on kolmipäisen olkalihaksen (m.triceps) päällä noin 8–10 cm humeruksen mediaalisesta epikondyylistä (olkaluun koukistajalisäkkeestä) ja 3–5 cm hauislihaksen (m.biceps) ja kolmipäisen olkalihaksen (m.triceps) välisen uurteen alapuolella (Kuvat 2a, 2b ja 2c). Tällä implantaatin asetuskohdalla on tarkoituksena välttää lihasten välisessä uurteessa ja sen ympärillä sijaitsevia suuria verisuonia ja hermoja. Jos implantaattia ei ole mahdollista asettaa tähän kohtaan (esim. naisilla, joilla on ohuet käsivarret), se tulee asettaa niin paljon uurteen alapuolelle kuin mahdollista.
- Tee merkintäkynällä kaksi merkkiä: merkitse ensin implantaatin asetuskohta ja sitten kohta, joka sijaitsee proksimaalisesti (kohti olkapäätä) 5 cm:n päässä ensimmäisestä merkistä (Kuva 2a ja 2b). Toinen merkki (ohjausmerkki) ohjaa myöhemmin implantaatin asetussuuntaa.
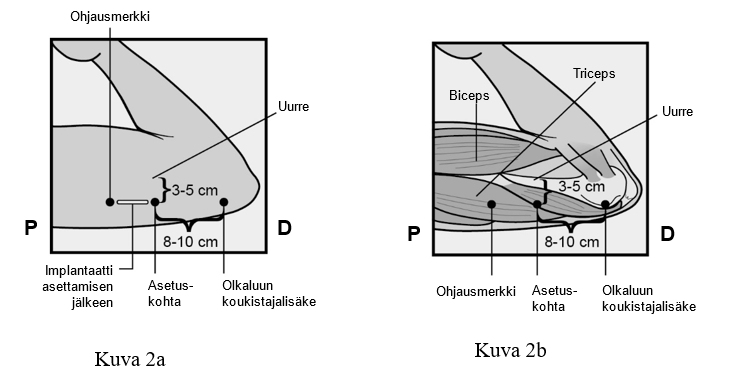
P proksimaalinen (kohti olkapäätä)
D distaalinen (kohti kyynärpäätä)
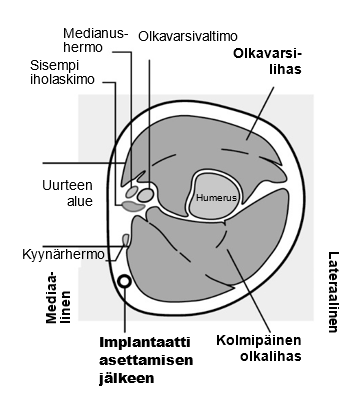
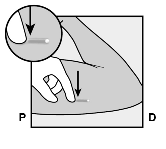
Kuva 2c
Läpileikkaus vasemman käsivarren yläosasta, kyynärpäästä katsottuna
Mediaalinen (käsivarren sisäpuoli)
Lateraalinen (käsivarren ulkopuoli)
- Merkitsemisen jälkeen varmista, että merkkien paikka on oikeassa kohdassa olkavarren sisäsivulla.
- Puhdista iho implantaatin asetuskohdasta ohjausmerkkiin saakka antiseptisellä liuoksella.
- Puuduta asetuskohta (esim. puudutussuihkeella tai injisoimalla 2 ml 1 % lidokaiinia ihon alle suunniteltua asetuslinjaa pitkin).
-
Poista implantaatin sisältävä steriili, kertakäyttöinen Nexplanon-asetin läpipainopakkauksesta. Tarkista ennen käyttöä silmämääräisesti, että pakkaus on ehjä eikä siinä ole vaurioita (kuten repeämiä tai reikiä). Älä käytä asetinta, jos pakkauksessa näkyy vaurioita, jotka voivat vaarantaa sen steriiliyden.
- Pitele asetinta sen karhennetusta kohdasta aivan neulan yläpuolelta. Poista läpinäkyvä suojakorkki liu’uttamalla korkkia vaakatasossa nuolen suuntaan neulasta poispäin (Kuva 3). Jos korkki ei irtoa helposti, asetinta ei saa käyttää. Sinun pitäisi nähdä valkoinen implantaatti katsomalla neulankärjen sisään. Älä kosketa lilanväristä painiketta ennen kuin olet asettanut neulan kokonaan ihon alle, koska painikkeen painaminen vetää neulan sisään ja vapauttaa ennenaikaisesti implantaatin asettimesta.
-
Jos lilanvärinen painike vapautuu ennenaikaisesti, aloita toimenpide alusta uudella asettimella.
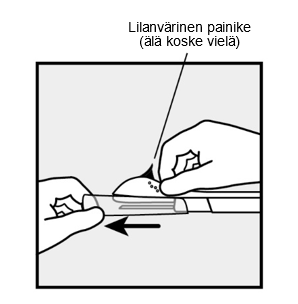
Kuva 3
- Venytä asetuskohtaa ympäröivää ihoa kohti kyynärpäätä vapaalla kädelläsi (Kuva 4).
Kuva 4
-
Implantaatti tulee asettaa aivan ihon alle (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Varmistaaksesi, että implantaatti asetetaan aivan ihon alle, sinun tulisi asettua siten, että näet neulan liikkeen katsomalla asetinta sivulta, ei sen yläpuolelta. Sivulta katsoessa voit selvästi nähdä asetuskohdan ja neulan liikkeen ihon alla (ks. Kuva 6).
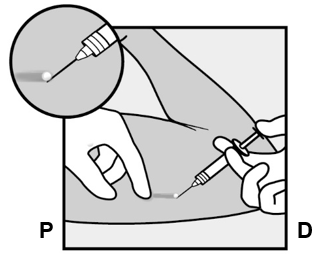
- Puhkaise iho neulankärjellä hieman alle 30 asteen kulmassa (Kuva 5a).
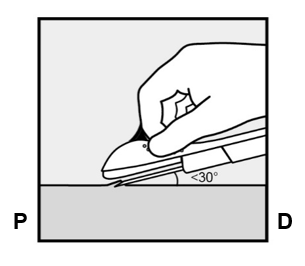
Kuva 5a
- Työnnä neulaa, kunnes sen viisto osa (kärjen vino avoin osa) on juuri ihon alla (ei yhtään pidemmälle) (Kuva 5b). Jos työnsit neulaa pidemmälle sen viiston osan yli, vedä sitä takaisinpäin, kunnes vain kärjen viisto osa on ihon alla.
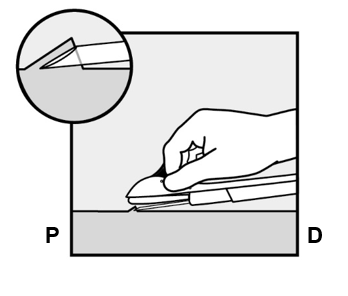
Kuva 5b
- Laske asetin lähes vaakasuoraan asentoon. Varmistaaksesi ihonalaisen asetuksen nosta ihoa neulalla ja liu’uta neula samalla koko pituudeltaan ihon alle (Kuva 6). Neulassa saattaa tuntua vähäistä vastusta, mutta älä käytä liiallista voimaa. Jos neulaa ei ole työnnetty koko pituudeltaan ihon alle, implantaatti ei asetu kunnolla paikalleen. Jos neulankärki puhkaisee ihon ennen kuin neula on työnnetty koko pituudeltaan ihon alle, neulaa tulee vetää taaksepäin ja se tulee asettaa uudelleen ihonalaiseen asentoon ennen kuin asetustoimenpide viedään loppuun.
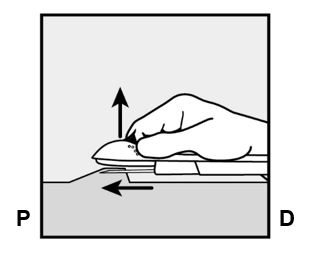
Kuva 6
- Pidä asetin samassa asennossa, kun neula on koko pituudeltaan ihon alla (Kuva 7). Voit tarvittaessa käyttää vapaata kättäsi pitämään asetinta paikallaan.
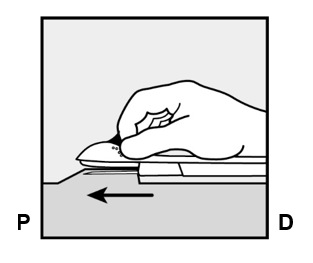
Kuva 7
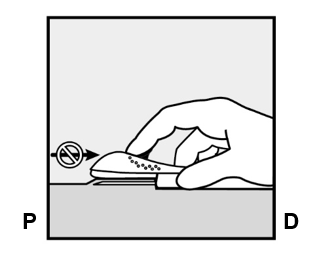
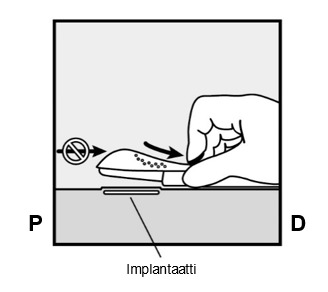
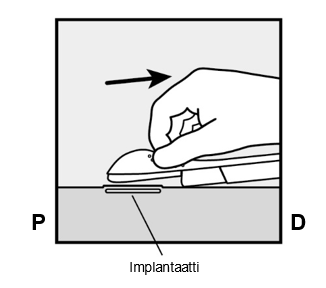
- Vapauta lilanvärinen painike painamalla sitä hiukan alaspäin (Kuva 8a). Vedä painike kokonaan taaksepäin kunnes se ei mene enää pidemmälle.
-
Älä liikuta (
 ) asetinta kun liikutat lilanväristä painiketta (Kuva 8b). Implantaatti on nyt lopullisessa sijaintipaikassaan ihon alla ja neula on lukittuna asettimen rungon sisään. Nyt voit poistaa asettimen (Kuva 8c).
) asetinta kun liikutat lilanväristä painiketta (Kuva 8b). Implantaatti on nyt lopullisessa sijaintipaikassaan ihon alla ja neula on lukittuna asettimen rungon sisään. Nyt voit poistaa asettimen (Kuva 8c).
Kuvat 8a, 8b ja 8c
Jos asetin ei pysy toimenpiteen aikana samassa asennossa tai jos et saa lilanväristä painiketta vedetyksi kokonaan taka-asentoon, implantaatti ei asetu oikein paikalleen ja voi jäädä osittain ihon ulkopuolelle.
Jos implantaatti jää osittain ihon ulkopuolelle, poista ihosta ulos työntyvä implantaatti kokonaan ja aseta uusi implantaatti samaan asetuskohtaan. Älä työnnä ulos työntyvää implantaattia takaisin ihon alle.
-
Kiinnitä asetuskohtaan pieni laastari.
- Tarkista aina välittömästi implantaatin asettamisen jälkeen käsin tunnustelemalla, että implantaatti on paikallaan potilaan olkavarressa. Käsin tunnustelemalla implantaatin molemmat päät voit varmistua, että 4 cm:n pituinen sauva on ihon alla (Kuva 9). Ks. alla kohta ”Jos implantaatti ei tunnu palpoimalla asettamisen jälkeen”.
Kuva 9
- Pyydä naista tunnustelemaan implantaattia.
- Kiinnitä asetuskohtaan steriili harsotaitos painesiteen kanssa mustelmien välttämiseksi. Nainen voi poistaa painesiteen 24 tunnin kuluttua ja implantaatin asetuskohdan peittävän laastarin 3–5 päivän kuluttua.
- Täytä potilaalle annettava kortti ja anna se hänelle mukaan. Kirjaa merkinnät myös tarraetiketteihin ja kiinnitä ne potilaan potilastietoihin. Jos käytössä on sähköiset potilastiedot, on tarraetiketin tiedot tallennettava niihin.
- Asetin on kertakäyttöinen ja se on hävitettävä asianmukaisesti paikallisten ongelmajätteistä annettujen ohjeiden mukaisesti.
Jos implantaatti ei tunnu palpoimalla asettamisen jälkeen:
Jos et tunne implantaattia palpoimalla tai et ole varma sen sijainnista, implantaattia ei ehkä ole asetettu tai se on asetettu syvälle:
- Tarkista asetin. Neulan on oltava vetäytyneenä täysin asettimen sisään, ja vain männän lilanvärisen kärjen tulisi olla näkyvissä.
- Varmista implantaatin paikallaanolo muiden menetelmien avulla. Implantaatin röntgenpositiivisen ominaisuuden vuoksi sopivia menetelmiä paikantamiseen ovat kaksiulotteinen röntgenkuva ja tietokonetomografia (TT-kuvaus). Ultraäänikuvausta, jossa käytetään korkeataajuuksista rivianturia (10 MHz tai korkeampi taajuus) tai magneettikuvausta (MRI-kuvaus) voidaan käyttää. Jos implantaattia ei löydy näillä kuvantamismenetelmillä, implantaatin paikallaanolo kehotetaan varmistamaan määrittämällä potilaan verinäytteestä veren etonogestreelipitoisuus. Ota tässä tapauksessa yhteyttä myyntiluvanhaltijan paikalliseen edustajaan, joka antaa ohjeet sopivasta menetelmästä.
- Naisen on käytettävä lisäksi jotakin ei-hormonaalista ehkäisymenetelmää niin kauan, kunnes implantaatin paikallaanolo on voitu varmistaa.
- Syvälle asetetut implantaatit tulee paikantaa ja poistaa mahdollisimman pian, jotta voidaan välttää niiden mahdollinen siirtyminen kauemmas kehossa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Nexplanonin poistaminen
Implantaatti poistetaan aseptiikkaa noudattaen ja sen saa poistaa vain terveydenhuollon ammattilainen, joka on perehtynyt implantaatin poistotekniikkaan. Jos et tunne implantaatin poistotekniikkaa, ota yhteyttä myyntiluvanhaltijan paikalliseen edustajaan lisätietojen saamiseksi.
Terveydenhuollon ammattilaisen on ennen poistotoimenpiteen aloittamista paikallistettava implantaatti.Vahvista implantaatin tarkka sijainti olkavarressa käsin tunnustellen.
Jos implantaatti ei ole käsin tunnusteltavissa, tarkista potilaalle annetusta kortista tai potilastiedoista, kummassa olkavarressa implantaatti sijaitsee. Jos implantaatti ei ole palpoitavissa, se saattaa sijaita syvällä tai on voinut siirtyä. Huomioi, että se saattaa sijaita lähellä verisuonia tai hermoja. Palpoitumattoman implantaatin saa poistaa vain terveydenhuollon ammattilainen, jolla on kokemusta syvällä olevien implantaattien poistamisesta ja joka on perehtynyt implantaatin paikallistamiseen ja käsivarren anatomiaan. Lisätietojen saamiseksi ota yhteyttä myyntiluvanhaltijan paikalliseen edustajaan.
Ks. alla kohta ”Implantaatin paikantaminen ja poistaminen, jos implantaatti ei tunnu palpoimalla”.
Palpoituvan implantaatin poistaminen
Kuvissa esitetään vasemman olkavarren sisäsivu poistokohdan havainnollistamiseksi.
- Pyydä naista asettumaan selälleen makuulle tutkimuspöydälle. Käsivarren tulee olla kyynärpäästä taivutettuna ja kämmenen hänen päänsä alla (tai niin lähellä päätä kuin mahdollista). (Ks. Kuva 10).
- Paikallista implantaatti käsin tunnustelemalla. Paina implantaatin olkapäätä lähinnä sijaitsevaa päätä alaspäin (Kuva 11) stabiloidaksesi sen paikalleen. Painamisesta pitäisi seurata implantaatin lähinnä kyynärpäätä sijaitsevan pään kohouma ihosta. Jos implantaatin pää ei näy kohoumana, sen poisto voi olla vaikeaa. Tällöin poisto tulisi tehdä sellaisen terveydenhuollon ammattilaisen toimesta, jolla on kokemusta syvemmällä olevien implantaattien poistosta. Tarkempien ohjeiden saamiseksi ota yhteyttä implantaatin myyntiluvanhaltijan paikalliseen edustajaan.
- Merkitse distaalipää (lähinnä kyynärpäätä sijaitseva pää) esimerkiksi merkintäkynällä.
- Puhdista suunniteltu viiltokohta antiseptisella aineella.
Kuva 10
Kuva 11
P proksimaalinen (kohti olkapäätä)
D distaalinen (kohti kyynärpäätä)
- Puuduta suunniteltu viiltokohta esim. 0,5–1 ml:lla 1 % lidokaiinia (Kuva 12). Varmista, että injisoit paikallispuuduteainetta implantaatin alle, jotta implantaatti pysyy ihon pinnan läheisyydessä. Paikallispuudutusaineen injisointi implantaatin päälle voi vaikeuttaa sen poistoa.
Kuva 12
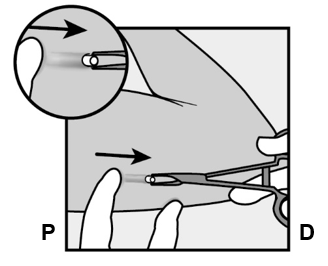
- Paina implantaatin olkapäätä lähinnä sijaitsevaa päätä alaspäin (Kuva 13) stabiloidaksesi sen paikalleen toimenpiteen ajaksi. Tee pitkittäinen (implantaatin suuntainen) 2 mm:n viilto kohti kyynärpäätä, aloittaen implantaatin kyynärpäätä lähinnä sijatsevasta päästä. Varo leikkaamasta implantaatin kärkeä.
Kuva 13
- Implantaatin kärjen pitäisi tulla näkyviin viillosta. Jos näin ei tapahdu, työnnä implantaattia varovasti kohti viiltoa, kunnes kärki näkyy. Ota implantaatista kiinni pihdeillä, jos mahdollista, ja poista implantaatti (Kuva 14). Tarvittaessa irrota varovasti implantaatin kärkeen kiinnittynyttä kudosta sen ympäriltä. Jos implantaatin kärki ei tule esiin, tee viilto kudostuppeen ja poista implantaatti pihtien avulla (Kuvat 15 ja 16).
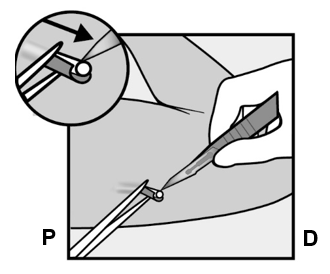
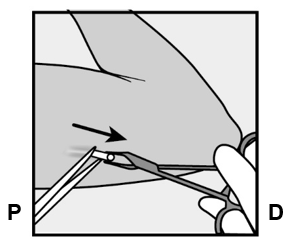
Kuvat 14, 15 ja 16
- Jos implantaatin kärki ei tule viillosta esiin, työnnä pihtejä (mieluiten kaarevat moskiittopihdit) viiltoon pinnallisesti (Kuva 17).
- Ota implantaatista kiinni varovasti ja siirrä pihdit toiseen käteesi (Kuva 18).
- Irrota toisilla pihdeillä varovasti kudosta implantaatin ympäriltä ja ota ote implantaatista (Kuva 19). Implantaatti voidaan nyt poistaa.
- Jos et saa otetta implantaatista, lopeta toimenpide ja lähetä potilas sellaiselle terveydenhuollon ammattilaiselle, jolla on kokemusta vaikeista poistoista, tai ota yhteyttä myyntiluvanhaltijan paikalliseen edustajaan.
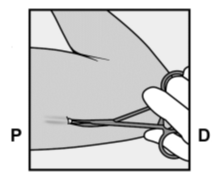
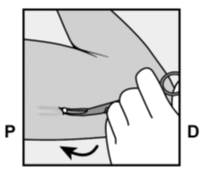
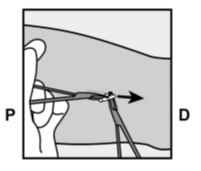
Kuvat 17, 18 ja 19
- Varmista, että koko 4 cm:n pituinen sauva on poistettu mittaamalla sen pituus. Rikkoutuneista implantaateista potilaan olkavarressa on raportoitu. Joissakin tapauksissa on raportoitu rikkoutuneen implantaatin poistamiseen liittyvistä vaikeuksista. Jos implantaatista saadaan pois vain osa (alle 4 cm), jäljelle jäänyt osa on poistettava edellä annettujen ohjeiden mukaisesti.
- Jos nainen haluaa edelleen käyttää Nexplanon-implantaattia, uusi implantaatti voidaan asettaa saman viillon kautta heti vanhan implantaatin poistamisen jälkeen, jos asetuskohta on oikea (ks. kohta Annostus ja antotapa Miten Nexplanon vaihdetaan).
- Kun implantaatti on poistettu, sulje viilto haavateipillä.
- Kiinnitä steriili harsotaitos painesiteen kanssa asettamiskohtaan mustelmien välttämiseksi. Paineside voidaan poistaa 24 tunnin kuluttua ja steriili haavateippi 3–5 päivän kuluttua.
Implantaatin paikantaminen ja poistaminen, jos implantaatti ei tunnu palpoimalla
Implantaatin on toisinaan raportoitu siirtyneen. Tavallisesti kyse on implantaatin vähäisestä liikkumisesta alkuperäiseltä paikaltaan (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet). Tämä saattaa hankaloittaa implantaatin paikantamista käsin tunnustelemalla. Syvälle asetettua tai paikaltaan siirtynyttä implantaattia ei ehkä voida tuntea käsin tunnustelemalla, ja sen vuoksi alla kuvattuja toimenpiteitä voidaan tarvita implantaatin paikantamiseen.
Jos implantaattia ei voida paikantaa tunnustelemalla, sen sijainti on aina varmistettava ennen poistoon ryhtymistä. Implantaatin röntgenpositiivisen ominaisuuden vuoksi sopivia menetelmiä paikantamiseen ovat kaksiulotteinen röntgenkuva ja tietokonetomografia (TT-kuvaus). Ultraäänikuvausta, jossa käytetään korkeataajuuksista rivianturia (10 MHz tai korkeampi taajuus) tai magneettikuvausta (MRI-kuvaus), voidaan käyttää. Kun implantaatti on paikannettu käsivarressa, se pitää poistaa sellaisen terveydenhuollon ammattilaisen toimesta, jolla on kokemusta syvemmällä olevien implantaattien poistosta ja joka tuntee hyvin käsivarren anatomian. Poistamisen yhteydessä on syytä harkita ultraääniohjauksen käyttöä.
Jos implantaattia ei pystytä paikantamaan olkavarresta perusteellisista yrityksistä huolimatta, rintakehän kuvantamista on harkittava, koska on raportoitu erittäin harvinaisia tapauksia, joissa implantaatti on siirtynyt keuhkoverisuonistoon. Jos implantaatti paikannetaan rintakehässä, voidaan poistamiseen tarvita kirurgisia -tai endovaskulaarisia toimenpiteitä; tällaisessa tapauksessa on konsultoitava rintakehän anatomian hyvin tuntevaa terveydenhuollon ammattilaista.
Jos näillä kuvantamismenetelmillä ei onnistuta paikantamaan implantaattia, sen paikallaanolo voidaan varmistaa määrittämällä potilaan verinäytteestä veren etonogestreelipitoisuus. Ota yhteys implantaatin myyntiluvanhaltijan paikalliseen edustajaan saadaksesi lisäohjeita.
Jos implantaatti liikkuu olkavarressa, poistamiseen voidaan tarvita pienehkö kirurginen toimenpide, jossa tehdään pidempi viilto tai kirurginen toimenpide leikkaussalissa. Syvälle asetettu implantaatti on poistettava varoen, jotta vältetään syvällä olkavarressa sijaitsevien hermojen ja verisuonten vauriot.
Palpoitumattomat ja syvälle asetetut implantaatit saa poistaa vain terveydenhuollon ammattilainen, joka tuntee hyvin käsivarren anatomian ja on perehtynyt syvemmällä olevien implantaattien poistoon.
Eksploratiiviseen kirurgiaan ei pidä ryhtyä, mikäli implantaatin tarkka sijainti ei ole tiedossa.
Ota yhteyttä implantaatin myyntiluvanhaltijan paikalliseen edustajaan saadaksesi lisäohjeita.
Miten Nexplanon vaihdetaan
Uusi implantaatti voidaan asettaa välittömästi aiemman implantaatin poistamisen jälkeen. Toimenpide on sama kuin kohdassa Annostus ja antotapa kuvattu implantaatin asettaminen ”Nexplanonin asettaminen”.
Uusi implantaatti voidaan asettaa samaan käsivarteen saman viillon kautta, josta aiempi implantaatti poistettiin, jos asetuskohta on oikea eli 8–10 cm humeruksen mediaalisesta epikondyylistä ja 3–5 cm hauislihaksen (m.biceps) ja kolmipäisen olkalihaksen (m.triceps) välisen uurteen alapuolella (ks. kohta Annostus ja antotapa Nexplanonin asettaminen). Jos uuden implantaatin asettamiseen käytetään samaa viiltoa, asetuskohta puudutetaan (esim. 2 ml:lla 1 % lidokaiinia) injisoimalla puudutusaine aivan ihon alle asetuskanavaa pitkin poistoviillosta aloittaen. Noudata tämän jälkeen ohjeita implantaatin asettamiseen.
Vasta-aiheet
- Aktiivinen laskimopuolen tromboembolinen häiriö.
- Todetut tai epäillyt maligniteetit, joihin sukupuolihormonit vaikuttavat.
- Parhaillaan esiintyvä tai aiemmin esiintynyt maksakasvain (hyvän- tai pahanlaatuinen).
- Maksasairaus, niin kauan kuin maksa-arvot eivät ole palautuneet normaaleiksi.
- Verinen emätinvuoto, jonka syytä ei ole selvitetty.
- Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Jos potilaalla on jokin alla mainituista tiloista tai riskitekijöistä, progestiinin käytön etuja on verrattava mahdollisiin riskeihin tapauskohtaisesti ja niistä on keskusteltava käyttäjän kanssa ennen kuin hän tekee päätöksen Nexplanonin käytöstä. Käyttäjää on neuvottava ottamaan yhteyttä terveydenhuollon ammattilaiseen, jos jokin näistä tiloista pahenee, uusiutuu tai jos uusia oireita ilmenee. Tällöin terveydenhuollon ammattilainen päättää, lopetetaanko Nexplanonin käyttö.
Rintasyöpä
Rintasyövän riski kasvaa yleisesti iän mukana. (Yhdistelmä)ehkäisytablettien käyttäjillä rintasyövän diagnosoimisen riski on hieman suurentunut. Suurentunut riski häviää vähitellen 10 vuoden kuluessa yhdistelmäehkäisymenetelmän käytön lopettamisen jälkeen eikä se riipu käytön kestosta, vaan käyttäjän iästä. Odotettavissa olevien tapausten määrän 10 000 naista kohti, jotka käyttävät yhdistelmäehkäisytabletteja (tai ovat lopettaneet käytön 10 vuoden sisällä), suhteessa ei-käyttäjiin saman ajanjakson aikana on arvioitu olevan eri ikäryhmissä: 4,5/4 (16–19-vuotiaat), 17,5/16 (20–24-vuotiaat), 48,7/44 (25–29-vuotiaat), 110/100 (30–34-vuotiaat), 180/160 (35–39-vuotiaat) ja 260/230 (40–44-vuotiaat). Pelkkää progestiinia sisältävien ehkäisymenetelmien käyttäjillä riski on mahdollisesti samaa suuruusluokkaa kuin yhdistelmäehkäisytabletteja käyttävillä. Näiden menetelmien kohdalla tätä ei ole kuitenkaan pitävästi osoitettu. Verrattuna riskiin sairastua rintasyöpään elinaikana on ehkäisytabletteihin liittyvä lisäriski pieni. Ehkäisytablettien käyttäjillä diagnosoidut rintasyöpätapaukset ovat ehkäisyä käyttämättömiin naisiin verrattuna yleensä kliinisesti varhaisemmassa vaiheessa. Havaittu riskin suureneminen ehkäisytablettien käyttäjillä voi johtua rintasyövän varhaisemmasta diagnoosista, ehkäisytablettien biologisista vaikutuksista tai molemmista.
Maksasairaus
Jos akuutteja tai kroonisia maksan toimintahäiriöitä esiintyy, käyttäjä tulee ohjata erikoislääkärin luo tutkimusta ja neuvontaa varten.
Tromboottiset tai muut verisuonitapahtumat
Epidemiologiset tutkimukset viittaavat siihen, että yhdistelmäehkäisytablettien (estrogeeni + progestiini) käyttö ja tromboembolisten laskimosairauksien (laskimotromboembolian, syvän laskimotromboosin ja keuhkoembolian) sekä tromboembolisten valtimosairauksien (valtimotromboembolian, sydäninfarktin ja iskeemisten aivohalvausten) suurentunut riski ovat yhteydessä toisiinsa. Näiden havaintojen kliinistä merkitystä ei tunneta, kun etonogestreeliä (desogestreelin biologisesti aktiivinen metaboliitti) käytetään pelkkää progestiinia sisältävänä ehkäisyvalmisteena ilman estrogeeniä.
Rajalliset epidemiologiset tiedot eivät osoita laskimo- tai valtimotromboembolian suurentunutta riskiä implantaattia käyttävillä naisilla. Valmisteen markkinoille tulon jälkeen on kuitenkin raportoitu laskimo- tai valtimotromboembolioita naisilla, jotka käyttivät etonogestreeliä sisältävää implantaattia. Tunnetut valtimo- ja laskimotukosten vaaraa suurentavat tekijät suositellaan arvioimaan.
Naisille, joilla on ollut tromboembolinen sairaus, tulee kertoa tilan uusiutumisen mahdollisuudesta. Implantaatti on poistettava tromboosin yhteydessä. Implantaatin poistoa on harkittava myös pitkäaikaisen leikkaukseen tai sairauteen liittyvän immobilisaation yhteydessä.
Kohonnut verenpaine
Nexplanonin käyttö on lopetettava, jos verenpaine kohoaa pysyvästi käytön aikana tai jos verenpaine kohoaa huomattavasti, eikä sitä saada hallintaan verenpainelääkityksellä.
Vaikutus hiilihydraattiaineenvaihduntaan
Progestiinia sisältävät ehkäisyvalmisteet voivat vaikuttaa perifeeriseen insuliiniresistenssiin ja glukoosinsietoon. Siksi diabeetikoita tulee seurata huolellisesti ensimmäisten Nexplanonin käyttökuukausien aikana.
Maksaläiskät
Maksaläiskiä saattaa esiintyä silloin tällöin, etenkin naisilla, joilla on ollut raskaudenaikaisia maksaläiskiä. Maksaläiskiin taipuvaisen käyttäjän tulee välttää auringonvaloa ja ultraviolettisäteilyä Nexplanonin käytön aikana.
Paino
Nexplanonin ehkäisyteho riippuu plasman etonogestreelipitoisuudesta. Pitoisuus plasmassa on kääntäen verrannollinen painoon, ja se laskee ajan myötä implantaatin asettamisen jälkeen. Kliinistä kokemusta Nexplanonin käytöstä painaville naisille kolmantena käyttövuotena on vähän. Siksi ei voida sulkea pois sitä, että ehkäisyteho näillä naisilla voi kolmantena käyttövuotena olla heikompi kuin normaalipainoisilla naisilla. Terveydenhuollon ammattilainen voi siksi harkita uuden implantaatin asettamista aikaisemmin painavammille naisille.
Komplikaatiot asettamisessa
Implantaatin liikkumisesta asettamispaikastaan käsivarressa on raportoitu. Tämä voi liittyä implantaatin liian syvään asettamiseen (ks. kohta Annostus ja antotapa, Nexplanonin asettaminen) tai se voi tapahtua ulkoisen voiman seurauksena (esim. implantaatin manipuloiminen tai kontaktiurheilu). Markkinoilletulon jälkeen on myös raportoitu tapauksia, joissa implantaatti on paikannettu käsivarren verisuonista ja keuhkoverisuonistosta, mikä voi johtua sen asettamisesta syvälle tai intravaskulaarisesti. Tapauksissa, joissa implantaatti on liikkunut asettamispaikastaan käsivarressa, implantaatin paikantaminen voi vaikeutua ja poistaminen saattaa vaatia pienehkön kirurgisen toimenpiteen, jossa tehdään pidempi poistoviilto, tai kirurgisen toimenpiteen leikkaussalissa. Tapauksissa, joissa implantaatti on liikkunut keuhkoverisuonistoon, voidaan tarvita endovaskulaarisia tai kirurgisia toimenpiteitä (ks. kohta Annostus ja antotapa, Nexplanonin poistaminen). Jos milloin tahansa implantaatti ei löydy tunnustelemalla, on se paikannettava ja implantaatin poistamista suositellaan heti, kun se on lääketieteellisesti tarkoituksenmukaista. Jos implantaattia ei poisteta, ehkäisyteho sekä progestiiniin liittyvät haittavaikutukset saattavat jatkua toivottua pidempään.
Implantaatti voi pyrkiä poistumaan elimistöstä erityisesti, jos sitä ei ole asetettu kohdassa Annostus ja antotapa, Nexplanonin asettaminen annettujen ohjeiden mukaisesti, tai paikallisen infektion seurauksena.
Munasarjakystat
Kaikkien matala-annoksisten hormonaalisten ehkäisyvalmisteiden käyttöön liittyy munarakkuloiden kypsymistä, ja joskus ne saattavat jatkaa kasvuaan suuremmiksi kuin normaalikierron aikana. Yleensä suurentuneet munarakkulat katoavat itsestään. Usein ne ovat oireettomia; joissakin tapauksissa ne saattavat aiheuttaa lieviä alavatsakipuja. Kirurgiset toimenpiteet ovat harvoin tarpeen.
Kohdunulkoiset raskaudet
Perinteiset pelkkää progestiinia sisältävät ehkäisyvalmisteet eivät suojaa kohdunulkoiselta raskaudelta yhtä hyvin kuin yhdistelmäehkäisytabletit. Tämä johtunee siitä, että näiden menetelmien käytön aikana esiintyy usein ovulaatioita. Siitä huolimatta, että Nexplanon estää ovulaation, on kohdunulkoisen raskauden mahdollisuus otettava huomioon amenorrean ja vatsakivun erotusdiagnostiikassa.
Psyykkiset häiriöt
Masentunut mieliala ja masennus ovat tunnettuja hormonaalisten ehkäisyvalmisteiden käyttöön liittyviä haittavaikutuksia (ks. kohta "Haittavaikutukset"). Masennus voi olla vakavaa, ja se on itsetuhoisen käyttäytymisen ja itsemurhan tunnettu riskitekijä. Naisia on kehotettava ottamaan yhteyttä lääkäriinsä, jos heillä esiintyy mielialan muutoksia ja masennuksen oireita, myös pian hoidon aloittamisen jälkeen.
Muut tilat
Seuraavia tiloja on havaittu sekä raskauden että sukupuolisteroidien käytön aikana, mutta niiden yhteydestä progestiinin käyttöön ei ole varmuutta: kolestaasiin liittyvä keltaisuus ja/tai kutina, sappikivimuodostus, porfyria, SLE, hemolyyttis-ureeminen oireyhtymä, Sydenhamin korea, herpes gestationis, otoskleroosiin liittyvä kuulon alenema ja (perinnöllinen) angioedeema.
Lääkärintarkastus/konsultaatio
Ennen Nexplanonin asettamista ensimmäistä kertaa tai uudelleen tauon jälkeen, käyttäjältä on selvitettävä täydelliset terveystiedot (sukuanamneesi mukaan lukien) ja raskaus on suljettava pois. Lisäksi on mitattava verenpaine ja potilas on tutkittava ottaen huomioon vasta-aiheet (ks. kohta Vasta-aiheet) ja varoitukset (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). On suositeltavaa, että kolmen kuukauden kuluttua Nexplanonin asettamisen jälkeen käyttäjä tulee tarkastuskäynnille. Tarkastuskäynnillä mitataan verenpaine ja naiselta tiedustellaan häntä mahdollisesti askarruttavista kysymyksistä tai vaivoista sekä onko hän kokenut haittavaikutuksia. Tulevien tarkastuskäyntien tiheys ja luonne sovitetaan yksilöllisesti ja kliinisen arvion mukaan. Implantaatti tulisi palpoida jokaisella tarkastuskäynnillä. Potilasta on ohjeistettava ottamaan tarkastuskäyntien välillä heti yhteyttä terveydenhuollon ammattilaiseen, jos implantaatti ei tunnu käsin tunnustelemalla.
Käyttäjälle on kerrottava, että Nexplanon ei suojaa HIV-tartunnalta (AIDS) eikä muilta sukupuolitaudeilta.
Tehon heikkeneminen muun samanaikaisen lääkityksen yhteydessä
Nexplanonin teho saattaa heiketä, jos samaan aikaan käytetään muuta lääkitystä, joka alentaa etonogestreelin pitoisuutta plasmassa (ks. kohta Yhteisvaikutukset).
Vuotoprofiilimuutokset
On todennäköistä, että naisilla esiintyy vuotoprofiilimuutoksia Nexplanonin käytön aikana. Näitä vuotoprofiilin muutoksia ei voi ennustaa etukäteen. Muutoksia voivat olla kuukautisten muuttuminen epäsäännöllisiksi (vuoto jää pois, vuotoa on harvemmin tai useammin tai jatkuvasti) tai muutos vuodon määrässä (vuodon määrä vähentynyt tai lisääntynyt) tai vuodon kestossa. Amenorreaa on raportoitu noin 1 naisella 5:stä ja vastaavasti 1 naisella 5:stä on raportoitu usein toistuvaa ja/tai pitkittynyttä vuotoa. Muutokset kuukautisvuodossa ensimmäisten 3 käyttökuukauden aikana antavat usein viitteen jatkokäytössä ilmenevistä vuotomuutoksista. Asianmukainen neuvonta ja vuotokalenterin käyttö saattavat parantaa kuukautisvuodon muutosten hyväksymistä. Kuukautisvuoto tulee arvioida tilanteen mukaan, ja tällöin voidaan myös tutkimuksen avulla sulkea pois gynekologisen sairauden tai raskauden mahdollisuus.
Rikkoutunut tai vääntynyt implantaatti in situ
Rikkoutuneesta tai vääntyneestä implantaatista potilaan käsivarressa on raportoitu. Tämä voi tapahtua ulkoiselle voimalle altistumisen seurauksena. Rikkoutuneen implantaatin palasen on myös raportoitu siirtyneen käsivarressa. Saatujen in vitro tietojen perusteella etonogestreelin vapautumisnopeus voi implantaatin rikkoutumisen tai vääntymisen johdosta hieman kasvaa. Tällä ei oleteta olevan kliinisesti merkitsevää vaikutusta.
Jos implantaatti rikkoutuu, se on kuitenkin poistettava, ja on tärkeää poistaa se kokonaan. Katsokohdasta Annostus ja antotapa,miten implantaatti (palpoituva tai palpoitumaton) poistetaan.
Yhteisvaikutukset
Huomautus: Mahdollisten yhteisvaikutusten selvittämiseksi on tutustuttava samanaikaisesti käytettävien lääkevalmisteiden valmisteyhteenvetoihin.
Muiden lääkkeiden vaikutukset Nexplanoniin
Yhteisvaikutuksia saattaa ilmetä maksan mikrosomaalisia entsyymejä indusoivien lääkkeiden kanssa, jotka voivat lisätä sukupuolihormonien puhdistumaa, mikä voi johtaa kuukautisvuotoihin ja/tai ehkäisytehon heikkenemiseen.
Hoito
Entsyymi-induktio voidaan havaita jo muutaman hoitopäivän jälkeen. Maksimaalinen entsyymi-induktio ilmenee yleensä muutaman viikon kuluessa. Lääkehoidon lopettamisen jälkeen entsyymi-induktion vaikutus voi kestää noin neljän viikon ajan.
Maksan entsyymejä indusoivia lääkkeitä tai kasvirohdosvalmisteita käyttäville naisille on kerrottava, että Nexplanonin teho saattaa heiketä. Implantaatin poistaminen ei ole tarpeen, mutta naisia on kehotettava käyttämään lisäksi muuta kuin hormonaalista ehkäisymenetelmää lääkkeiden yhteiskäytön ajan ja vielä 28 päivää sen päättymisestä maksimaalisen suojan aikaansaamiseksi.
Kirjallisuudessa on raportoitu seuraavia yhteisvaikutuksia (pääasiassa yhdistelmäehkäisyvalmisteilla, mutta joissain tapauksissa myös pelkkää progestiinia sisältävillä ehkäisyvalmisteilla, Nexplanon mukaan lukien):
Hormonaalisten ehkäisyvalmisteiden puhdistumaa lisääviä aineita (entsyymi-induktion aiheuttama yhdistelmäehkäisyvalmisteen tehon heikkeneminen) ovat mm.:
Barbituraatit, bosentaani, karbamatsepiini, fenytoiini, primidoni, rifampisiini ja HIV/HCV-lääkkeet kuten efavirentsi, bosepreviiri, nevirapiini sekä mahdollisesti myös felbamaatti, griseofulviini, okskarbatsepiini, topiramaatti ja mäkikuismaa (Hypericum perforatum) sisältävät kasvirohdosvalmisteet.
Aineet, joilla on vaihtelevia vaikutuksia hormonaalisten ehkäisyvalmisteiden puhdistumaan
Yhtäaikaisesti hormonaalisten ehkäisyvalmisteiden kanssa käytettynä monet HIV-proteaasin estäjiä ja ei-nukleosidirakenteisiä käänteiskopioijaentsyymin estäjiä sisältävät lääkeyhdistelmät, mukaan lukien HCV-estäjiä sisältävät yhdistelmät, voivat suurentaa tai pienentää progestiinien, myös etonogestreelin, pitoisuutta plasmassa. Näiden muutosten kokonaisvaikutus voi joissakin tapauksissa olla kliinisesti merkittävä.
Tämän vuoksi samanaikaisen HIV/HCV-lääkityksen valmisteyhteenveto pitää tarkastaa potentiaalisten yhteisvaikutusten varalta ja niiden suhteen annettujen lisäohjeiden osalta. Naisen, joka käyttää proteaasin estäjää tai ei-nukleosidirakenteista käänteiskopioijaentsyymin estäjää, tulee lisäksi käyttää lisäehkäisynä jotain estemenetelmää, jos yhteisvaikutuksen mahdollisuutta epäillään.
Aineet, jotka vähentävät hormonaalisten ehkäisyvalmisteiden puhdistumaa (entsyymi-inhibiittorit)
Voimakkaiden CYP3A4-entsyymi-inhibiittoreiden (esim. ketokonatsoli, itrakonatsoli, klaritromysiini) tai kohtalaisten CYP3A4-entsyymi-inhibiittoreiden (esim. flukonatsoli, diltiatseemi, erytromysiini) yhtäaikainen käyttö voi nostaa progestiinien, mukaan lukien etonogestreelin, pitoisuutta seerumissa.
Nexplanonin vaikutukset muihin lääkkeisiin
Hormonaaliset ehkäisyvalmisteet voivat vaikuttaa tiettyjen muiden vaikuttavien aineiden metaboliaan. Näin ollen pitoisuudet plasmassa ja kudoksissa saattavat joko suurentua (esim. siklosporiini) tai pienentyä (esim. lamotrigiini).
Laboratoriokokeet
Tiedot yhdistelmäehkäisytableteista ovat osoittaneet, että raskautta ehkäisevät steroidit saattavat vaikuttaa joihinkin laboratoriokokeiden tuloksiin; näitä ovat: maksan, kilpirauhasen, lisämunuaisen ja munuaisten toimintakokeiden biokemialliset parametrit, (kantaja)proteiinien pitoisuudet seerumissa, esim. kortikosteroideja sitova globuliini ja lipidi/lipoproteiinifraktiot, hiilihydraattimetabolian parametrit ja hyytymis- ja fibrinolyysiparametrit. Muutokset ovat yleensä normaalialueella. Ei tiedetä, kuinka laajasti tämä pätee myös pelkkää progestiinia sisältäviin ehkäisyvalmisteisiin.
Raskaus ja imetys
Raskaus
Nexplanonia ei ole tarkoitettu käytettäväksi raskauden aikana. Jos nainen tulee raskaaksi Nexplanonin käytön aikana, implantaatti pitää poistaa. Eläintutkimuksissa on todettu, että erittäin suuret progestiiniannokset voivat aiheuttaa naaraspuolisten sikiöiden maskulinisaatiota. Laajoissa epidemiologisissa tutkimuksissa ei ole todettu syntymävaurioiden riskin lisääntymistä lapsilla, joiden äidit ovat käyttäneet ehkäisytabletteja ennen raskaaksi tuloa, eikä teratogeenisiä vaikutuksia, kun ehkäisytabletteja on vahingossa käytetty raskauden aikana. Vaikka tämä pätee luultavasti kaikkiin ehkäisytabletteihin, ei ole selvää, päteekö se myös Nexplanoniin.
Etonogestreeliä ja desogestreeliä sisältävistä valmisteista (etonogestreeli on desogestreelin metaboliitti) kerätyt haittavaikutustiedot eivät myöskään viittaa lisääntyneeseen riskiin.
Imetys
Kliiniset tiedot viittaavat siihen, että Nexplanon ei vaikuta rintamaidon tuotantoon tai maidon laatuun (proteiini-, laktoosi- tai rasvapitoisuuksiin). Pieniä määriä etonogestreeliä erittyy kuitenkin rintamaitoon. Päivittäisen maidon kulutuksen ollessa keskimäärin 150 ml/kg lapsen saama keskimääräinen etonogestreeliannos on noin 27 ng/kg/vrk (laskettu kun etonogestreeliä vapautunut implantaatista kuukauden ajan). Tämä vastaa noin 2,2 % äidin saamasta painoon suhteutetusta vuorokausiannoksesta ja noin 0,2 % arvioidusta äidin saamasta absoluuttisesta annoksesta. Imetyksen jatkuessa maidon etonogestreelipitoisuus pienenee ajan myötä.
Rajallista pitkän ajan tutkimustietoa on 38 lapsesta, joiden äideille asetettiin implantaatti 4–8 viikon kuluessa synnytyksestä. Lapsia imetettiin keskimäärin 14 kuukauden ajan ja seurattiin aina 36 kuukauden ikään saakka. Seurattaessa kasvua sekä fyysistä ja psykomotorista kehitystä ei havaittu eroa verrattaessa rintaruokittuihin lapsiin, joiden äidit käyttivät kohdunsisäistä ehkäisintä (n=33). Tästä huolimatta lapsen kehitystä ja kasvua pitää seurata tarkoin. Saatavilla olevan tiedon perusteella Nexplanonia voidaan käyttää imetyksen aikana.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Farmakodynaamisen profiilin perusteella Nexplanonilla ei oleteta olevan vaikutusta ajokykyyn tai koneiden käyttökykyyn tai sen vaikutuksen oletetaan olevan vähäinen.
Haittavaikutukset
On todennäköistä, että naisilla esiintyy vuotoprofiilimuutoksia Nexplanonin käytön aikana. Näitä vuotoprofiilin muutoksia ei voi ennustaa etukäteen. Muutoksia voivat olla kuukautisten muuttuminen epäsäännöllisiksi (vuoto jää pois, vuotoa on harvemmin tai useammin tai jatkuvasti) tai muutos vuodon määrässä (vuodon määrä vähentynyt tai lisääntynyt) tai vuodon kestossa. Amenorreaa on raportoitu noin 1 naisella 5:stä ja vastaavasti 1 naisella 5:stä on raportoitu usein toistuvaa ja/tai pitkittynyttä vuotoa. Runsasta vuotoa on raportoitu ajoittain. Kliinisten tutkimusten mukaan vuotoprofiilimuutokset ovat yleisin syy Nexplanonin käytön keskeyttämiselle (11 %). Vuotoprofiili ensimmäisten 3 käyttökuukauden aikana antaa usein viitteitä tulevasta vuotoprofiilista implantaatin käytön aikana.
Seuraavassa taulukossa on lueteltu Nexplanonin käyttöön mahdollisesti liittyviä haittavaikutuksia, joita on raportoitu kliinisissä tutkimuksissa.
| MedDRA-termistön mukainen haittavaikutus1 | |||
| Elinjärjestelmä | Hyvin yleinen (≥ 1/10) | Yleinen (≥1/100, <1/10) | Melko harvinainen (≥ 1/1 000, <1/100) |
| Infektiot | Emätintulehdus | Nielutulehdus, nuha, virtsatietulehdus | |
| Immuunijärjestelmä | Yliherkkyys | ||
| Aineenvaihdunta ja ravitsemus | Lisääntynyt ruokahalu | ||
| Psyykkiset häiriöt | Mielialan labiliteetti, masentunut mieliala, hermostuneisuus, libidon heikentyminen | Ahdistuneisuus, unettomuus | |
| Hermosto | Päänsärky | Heitehuimaus | Migreeni, uneliaisuus |
| Verisuonisto | Kuumat aallot | ||
| Ruoansulatuselimistö | Vatsakipu, pahoinvointi, ilmavaivat | Oksentelu, ummetus, ripuli | |
| Iho ja ihonalainen kudos | Akne | Alopesia | Liikakarvoitus, ihottuma, kutina |
| Luusto, lihakset ja sidekudos | Selkäkipu, nivelkipu, lihaskipu, lihaksiin ja luustoon liittyvät kivut | ||
| Munuaiset ja virtsatiet | Dysuria | ||
| Sukuelimet ja rinnat | Rintojen aristus ja kipu, kuukautisten epäsäännöllisyys | Dysmenorrea, munasarjakystat | Emätinvuoto, ulkosynnytinten ja emättimen oireet, galaktorrea, rintojen koon suureneminen, sukuelinten kutina |
| Yleisoireet ja antopaikassa todettavat haitat | Kipu asetuskohdassa, asetuskohdan reaktiot, väsymys, influenssan kaltainen sairaus, kipu | Kuume, turvotus | |
| Tutkimukset | Painon nousu | Painon lasku | |
1 Taulukkoon on listattu tarkoituksenmukaisin MedDRA-termi (versio 10.1) kuvaamaan tiettyä haittavaikutusta. Taulukkoon ei ole listattu synonyymeja eikä näihin liittyviä tiloja, mutta nämä tulee myös huomioida.
Nexplanonin markkinoille tulon jälkeisen seurannan aikana on harvoin havaittu kliinisesti merkittävää verenpaineen nousua. Lisäksi on raportoitu idiopaattista intrakraniaalista hypertensiota. Seborreaa on myös raportoitu. Anafylaktisia reaktioita, urtikariaa, angioedeemaa, angioedeeman pahenemista ja/tai perinnöllisen angioedeeman pahenemista saattaa esiintyä.
Seuraavia haittavaikutuksia on ilmoitettu implantaatin asettamisen tai poistamisen yhteydessä:
Implantaatin asettaminen ja poistaminen voi aiheuttaa mustelmia, joissakin tapauksissa myös hematoomaa, lievää paikallista ärsytystä, kipua tai kutinaa.
Implantaatin asettaminen saattaa aiheuttaa vasovagaalisia reaktioita (kuten hypotensiota, heitehuimausta tai pyörtymisen).
Joskus implantaatin asetuskohdassa voi ilmetä fibroosia tai muodostua arpi tai asetuskohtaan voi kehittyä absessi. Parestesioita ja niiden kaltaisia tuntemuksia voi esiintyä. Nexplanonin ekspulsiota sekä paikoiltaan liikkumista, harvoin myös rintakehän seinämään on raportoitu. Harvoissa tapauksissa implantaatti on löytynyt verisuonistosta, mukaan lukien keuhkoverisuonisto. Jotkut tapaukset, joissa implantaatti löytyi keuhkoverisuonistosta, raportoitiin rintakipuna ja/tai hengityselinten häiriöinä (kuten hengenahdistus, yskä, veriyskä), muut raportoitiin oireettomina (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Jos ohjeita ei noudateta, (ks. kohta "Annostus ja antotapa"), implantaatin asettaminen saattaa tapahtua väärin, implantaatti saatetaan asettaa hankalaan kohtaan ja implantaatin poisto saattaa olla vaikeaa. Kirurginen toimenpide voi olla tarpeen implantaattia poistettaessa.
Harvoissa tapauksissa on raportoitu kohdun ulkopuolisia raskauksia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Naisilla, jotka käyttävät (yhdistelmä)ehkäisytabletteja, on raportoitu useita (vakavia) haittavaikutuksia. Näitä ovat laskimoiden tromboemboliset häiriöt, valtimoiden tromboemboliset häiriöt, hormoniriippuvaiset kasvaimet (esim. maksakasvaimet, rintasyöpä) sekä maksaläiskät. Näistä on kerrottu yksityiskohtaisemmin kohdassa Varoitukset ja käyttöön liittyvät varotoimet.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 Fimea
Yliannostus
Implantaatti on aina poistettava ennen uuden asettamista. Etonogestreelin yliannoksista ei ole saatavilla tietoa. Ehkäisyvalmisteiden yliannostukseen liittyviä vakavia vahingollisia vaikutuksia ei ole raportoitu.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Systeemisesti käytettävät hormonaaliset ehkäisyvalmisteet, progestageenit, ATC-koodi: G03AC08
Vaikutusmekanismi
Nexplanon-implantaatti on biologisesti hajoamaton, säteilyä läpäisemätön etonogestreeliä sisältävä ihon alle asetettava implantaatti, joka on pakattu steriiliin, kertakäyttöiseen asettimeen. Etonogestreeli on desogestreelin, ehkäisytableteissa yleisesti käytetyn progestiinin, biologisesti aktiivinen metaboliitti. Rakenteeltaan se on 19-nortestosteronin johdos ja sitoutuu herkästi kohde-elinten progesteronireseptoreihin. Etonogestreelin ehkäisyvaikutus perustuu ensisijaisesti ovulaation estoon. Ovulaatioita ei havaittu implantaatin kahden ensimmäisen käyttövuoden aikana, ja vain harvoin kolmannen vuoden aikana. Ovulaation eston lisäksi etonogestreeli aiheuttaa kohdunkaulan liman muutoksia, jolloin siittiöiden läpipääsy vaikeutuu.
Kliininen teho ja turvallisuus
Kliiniset tutkimukset tehtiin 18–40-vuotiailla naisilla. Vaikka suoraa vertailevaa tutkimusta ei tehty, ehkäisyteho osoittautui vähintään verrannolliseksi oraalisten yhdistelmäehkäisyvalmisteiden tehoon nähden. Kliinisissä tutkimuksissa ei havaittu yhtään raskautta 35 057 syklin aikana; Pearlin Indeksi on 0,00 (95 %:n luottamusraja 0,00 - 0,14). Kuitenkin on todettava, että käytännössä mikään menetelmä ei ole 100 %:n luotettava. Tehokas ehkäisysuoja saavutetaan mm. siksi, että Nexplanonin ehkäisyteho ei ole riippuvainen naisen omasta ehkäisymenetelmän säännöllisestä annostelusta. Etonogestreelin ehkäisyvaikutus ei jää pysyväksi, mikä ilmenee siten, että kuukautiskierto palaa nopeasti ennalleen implantaatin poiston jälkeen. Vaikka etonogestreeli estää ovulaatiota, munasarjojen toiminta ei kuitenkaan lamaudu täydellisesti. Keskimääräiset estradiolipitoisuudet pysyvät varhaista follikulaarivaiheen tasoa korkeampina. Kaksivuotisessa tutkimuksessa, jossa verrattiin luun tiheyttä 44 Nexplanonin käyttäjän ja 29 kuparikierukan käyttäjän kesken, ei havaittu haitallisia vaikutuksia luumassaan. Kliinisesti merkittäviä vaikutuksia rasva-aineenvaihduntaan ei havaittu. Progestiinia sisältävien ehkäisyvalmisteiden käyttö saattaa vaikuttaa insuliiniresistenssiin ja glukoositoleranssiin. Kliinisissä tutkimuksissa todettiin lisäksi, että Nexplanonin käyttäjillä on usein vähemmän kivuliaat kuukautiset (dysmenorrea).
Farmakokinetiikka
Imeytyminen
Implantaatin asettamisen jälkeen etonogestreeli imeytyy nopeasti verenkiertoon. Ovulaation estävä pitoisuus saavutetaan yhdessä päivässä. Huippupitoisuus seerumissa (472–1270 pg/ml) saavutetaan 1–13 päivässä. Etonogestreelin vapautumisnopeus implantaatista hidastuu ajan myötä. Tämän seurauksena pitoisuus seerumissa laskee nopeasti muutaman ensimmäisen kuukauden aikana. Ensimmäisen vuoden loppuun mennessä keskimääräinen seerumipitoisuus on noin 200 pg/ml (vaihteluväli 150–261 pg/ml), ja se laskee hitaasti tasolle 156 pg/ml (vaihteluväli 111–202 pg/ml) kolmannen vuoden loppuun mennessä. Seerumissa havaittujen pitoisuusvaihtelujen voidaan osittain katsoa johtuvan käyttäjien painoeroista.
Jakautuminen
Etonogestreeli sitoutuu seerumin proteiineihin 95,5–99-prosenttisesti, pääasiassa albumiiniin ja vähemmässä määrin SHBG:hen. Sentraalinen jakautumistilavuus on 27 litraa ja kokonaisjakautumistilavuus 220 litraa, eivätkä ne juurikaan muutu Nexplanonin käytön aikana.
Biotransformaatio
Etonogestreeli hydroksyloituu ja pelkistyy ja muodostuneet metaboliitit konjugoituvat sulfaateiksi ja glukuronideiksi. Eläintutkimukset osoittavat, että enterohepaattinen kierto ei luultavasti vaikuta etonogestreelin progestiinivaikutukseen.
Eliminaatio
Etonogestreelin laskimoon annon jälkeen eliminaation puoliintumisajan keskiarvo on noin 25 tuntia ja puhdistuma seerumista on noin 7,5 l/h. Sekä puhdistuma että eliminaation puoliintumisaika pysyvät samoina koko hoitojakson ajan. Etonogestreeli ja sen metaboliitit erittyvät joko vapaina steroideina tai konjugaatteina virtsaan ja ulosteisiin (suhde 1,5:1). Kun imettäville naisille asetetaan implantaatti, etonogestreeliä erittyy rintamaitoon ja maito/seerumisuhde on 0,44–0,50 ensimmäisten neljän kuukauden ajan. Imettävien äitien äidinmaidossa imeväiseen keskimäärin siirtyvä etonogestreelin määrä on noin 0,2 % äidin saamasta arvioidusta päivittäisestä absoluuttisesta annoksesta (2,2 % painoon suhteutettuna). Ajan kuluessa pitoisuudet pienenevät asteittain tilastollisesti merkitsevästi.
Prekliiniset tiedot turvallisuudesta
Toksikologisissa tutkimuksissa ei antotavasta riippumatta tullut esiin muita kuin etonogestreelin omilla hormonaalisilla ominaisuuksilla selittyviä vaikutuksia.
Farmaseuttiset tiedot
Apuaineet
Implantaatti
Ydin: etyleenivinyyliasetaattikopolymeeri (28 % vinyyliasetaattia, 43 mg)
bariumsulfaatti (15 mg)
magnesiumstearaatti (0,1 mg).
Kuori: etyleenivinyyliasetaattikopolymeeri (15 % vinyyliasetaattia, 15 mg).
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
5 vuotta.
Nexplanonia ei saa asettaa ulkopakkaukseen merkityn viimeisen käyttöpäivämäärän jälkeen.
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Säilytä alkuperäispakkauksessa.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
NEXPLANON implantaatti
68 mg (L:ei) 1 fol (kertakäyttöasetin) (149,93 €)
PF-selosteen tieto
Läpipainopakkaus sisältää yhden implantaatin (pituus 4 cm, läpimitta 2 mm), joka on pakattu ruostumattomasta teräksestä valmistettuun neulaan kertakäyttöisessä, steriilissä, käyttövalmiissa asettimessa. Implantaatin sisältävä asetin on pakattu läpinäkyvästä polyeteenitereftalaattiglykolista (PETG) valmistettuun pakkaukseen, joka on suljettu HDPE-muovikannella. Vahingoittumattoman ja avaamattoman läpipainopakkauksen sisältö on steriili.
Pakkauskoot: kotelo, jossa on 1 läpipainopakkaus tai 5 läpipainopakkausta.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Säteilyä läpäisemätön, biologisesti hajoamaton, valkoinen tai melkein valkoinen, pehmeä, joustava sauva, jonka pituus on 4 cm ja läpimitta 2 mm.
Käyttö- ja käsittelyohjeet
Ks. kohta Annostus ja antotapa.
Pakkauksessa oleva asetin on kertakäyttöinen.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
NEXPLANON implantaatti
68 mg 1 fol
- Ei korvausta.
ATC-koodi
G03AC08
Valmisteyhteenvedon muuttamispäivämäärä
15.07.2025
Yhteystiedot
 Organon Finland Oy
Organon Finland Oy Puolikkotie 8, 5. krs
02230 Espoo
Suomi
029 170 3520
dpoc.finland@organon.com
